Hypolipidemic Activity of Total Flavonoids from Sea Buckthorn Peel Residue in Vivo and in Vitro
-
摘要: 为探究沙棘果皮渣总黄酮的降血脂功效及抗氧化水平,采用体外和体内试验研究沙棘果皮渣总黄酮纯化物(TFSE)降血脂功能。通过体外试验测定TFSE的抗氧化活性,并模拟人体胃肠环境,考察TFSE对三种胆酸盐的结合能力,以此来评价其体外抗氧化及降血脂效果;通过高脂饲料诱导C57BL/6J小鼠建立高脂血症模型,灌胃TFSE进行干预,分别比较不同剂量的TFSE对C57BL/6J小鼠的体重、血清和肝脏的血脂水平、肝功能指标及肝脏的氧化指标,并对肝脏组织进行病理学的观察。体外试验结果表明,TFSE对DPPH、ABTS+自由基清除能力较强,其IC50值分别5.20、10.24 μg/mL,且具有较高的还原能力,说明其抗氧化活性好;与胆酸钠、甘氨胆酸钠、牛磺胆酸钠结合能力的IC50值分别为11.11、2.61、3.50 mg/mL,说明TFSE与胆酸盐的结合能力较强;体内动物实验结果表明,与模型组(HFD)相比,L-TFSE组和H-TFSE组能够抑制小鼠体重增加,显著降低(P<0.05)血清和肝脏中总胆固醇(TC)、三酰甘油(TG)和低密度脂蛋白胆固醇(LDL-C)水平,显著增加(P<0.05)高密度脂蛋白蛋白(HDL-C)水平及显著降低(P<0.05)小鼠血清中谷草转氨酶(AST)、谷丙转氨酶(ALT)、碱性磷酸酶(AKP)、乳酸脱氢酶(LDH)水平。同时,显著增加(P<0.05)小鼠肝脏中超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)水平,显著降低(P<0.05)丙二醛(MDA)含量。综上,TFSE可以改善高脂饮食对肝脏的病理损伤,并显现出良好的降血脂活性以及抗氧化活性,该研究可为提高新疆沙棘果皮渣产品的附加值提供一定的理论基础。Abstract: To investigate the hypolipidemic effects and antioxidant levels of total flavonoids from seabuckthorn fruit peel and residue, in vitro and in vivo experiments were conducted to examine the hypolipidemic functionality of the purified total flavonoids from seabuckthorn fruit peel and residue (TFSE). The antioxidant activity of TFSE was determined through in vitro experiments, and its binding capacity to three types of bile acids was investigated by simulating the human gastrointestinal environment. This was conducted to evaluate its antioxidant and hypolipidemic effects in vitro. In the in vivo experiment, a high-fat diet-induced hyperlipidemia model was established in C57BL/6J mice, and TFSE was administered orally to compare its effects on body weight, serum, hepatic lipid levels, liver function indicators, and oxidative indicators. Then, histopathological observations of the liver tissue were completed. The in vitro study showed that TFSE exhibited strong scavenging abilities against DPPH and ABTS+ radicals, with IC50 values of 5.20 and 10.24 μg/mL, respectively, thus indicating effective antioxidant activity. Moreover, TFSE showed strong binding capabilities with sodium cholate, glycocholate, and taurocholate, with IC50 values of 11.11, 2.61, and 3.50 mg/mL, respectively, thus highlighting its binding solid capacity with bile acids. Results of the mice experiments showed that, compared to the model group (HFD), the L-TFSE and H-TFSE groups showed inhibited body weight gain, whilst (P<0.05) total cholesterol (TC), triglycerides (TG), and low-density lipoprotein cholesterol (LDL-C) levels in serum and liver were significantly decreased. At the same time, significantly increased (P<0.05) high-density lipoprotein cholesterol (HDL-C) levels and significantly decreased (P<0.05) levels of aspartate aminotransferase (AST), alanine aminotransferase (ALT), alkaline phosphatase (AKP), and lactate dehydrogenase (LDH) in mice serum. Furthermore, TFSE significantly increased (P<0.05) the superoxide dismutase (SOD), glutathione peroxidase (GSH-Px), and catalase (CAT) levels in mice liver, and significantly decreased (P<0.05) the whilst malondialdehyde (MDA) content. In summary, TFSE would improve the hepatic pathological damage caused by a high-fat diet, showed effective lipid-lowering activity and antioxidant activity. This study would provide a theoretical basis for improving the added value of sea buckthorn peel residue products in Xinjiang.
-
沙棘(Hippophae rhamnoides L.,Sea Buckthorn)隶属胡颓子科沙棘属,是一种具有重要生态和经济价值的药食同源性植物[1]。其活性成分因具有来源天然、结构多样等优点,对高脂血症、心血管疾病等有良好的改善作用,受到人们的广泛青睐[2−3]。新疆沙棘资源丰富,因其得天独厚的地理与气候条件,其生物活性物质与其他产地的相比具有一定差异性[4]。目前,沙棘加工主要以果实精深加工为主,而作为副产物的沙棘果皮渣被当做饲料或丢弃,造成资源浪费[5]。为了增加沙棘资源的附加值,有必要对沙棘果皮渣中的天然活性成分进行开发利用。研究发现从果皮渣中获得的黄酮类化合物是天然活性成分的重要来源[6],裴轶琨[7]提取了沙棘果皮渣黄酮,其得率可达10.23 mg/g。黄酮作为一类广泛分布在自然界植物中的天然活性成分,具有降血脂、抗氧化、降血糖等多种生物功效[3]。
长期摄入高脂饮食(HFD)会导致脂质代谢紊乱,进而导致代谢综合征,如高脂血症、非酒精性脂肪肝(NAFLD)和心血管疾病(CVD)等慢性代谢性疾病[8]。其中,高脂血症是这些慢性疾病的主要危险因素之一,其特征在于体重增加和脂质参数变化[9],并且高脂血症的形成与氧化应激密切相关[10]。尽管高脂血症可以通过药物治疗,但长期服用会对肝肾产生一定毒副作用。因此,从植物资源中寻找预防和控制高脂血症的天然活性物质极其重要。研究表明,食用一些植物资源中的天然活性成分可以降低患高脂血症的风险[11]。而富含黄酮类化合物的饮食具有多种健康促进作用,改善由高脂肪饮食引起的脂质代谢紊乱[12]。胆汁酸盐作为胆固醇合成的前体物质,与黄酮类化合物结合后排出体外,从而促使肝脏中的胆固醇降解,合成更多的胆汁酸,促使血液中胆固醇流入肝脏,最终达到降血脂的目的[13]。李珊等[14]发现狭果茶藨子黄酮对胆酸盐均有结合能力,且纯化后的胆酸盐结合能力更强。王兆丹[15]研究发现菊花黄酮可显著改善高脂膳食诱导SD大鼠的血脂四项的水平,同时显著提高抗氧化酶的活性,并减轻高脂饮食引起的肝损伤,达到降脂作用,这为黄酮类化合物减轻高脂饮食诱导的高脂血症提供了一定的依据。目前国内外对于沙棘果皮渣的研究主要集中在饲料加工方面[16],缺乏对沙棘果皮渣中黄酮类化合物在生物活性方面的研究。
因此,为了进一步加强沙棘果皮渣综合利用,开发出具有降脂作用的功能性产品,实验就超声辅助提取与大孔树脂纯化得到的沙棘果皮渣总黄酮纯化物(TFSE)对体内外降血脂的影响开展研究。通过构建体外模型比较TFSE的抗氧化能力以及对胆酸盐的结合能力,并以C57BL/6J小鼠为研究对象,通过高脂饲料诱导建立高脂血症模型,探究TFSE对小鼠的血清、肝脏生化指标及组织病理学指标的影响,评价TFSE干预对高脂血症小鼠降血脂的作用,以期为新疆沙棘果皮渣实现高值化利用提供依据。
1. 材料与方法
1.1 材料与仪器
SPF级雄性C57BL/6J小鼠 40只,体重(18±2 g),购于湖南斯莱克景达实验动物有限公司,生产许可证号: SCXK(湘)2019-0004;高脂饲料 协同生物XT310(含蛋白质20%、碳水化合物40%、脂肪40%);普通饲料 江苏美迪森生物医药有限公司;沙棘果皮渣 新疆阿勒泰地区慧华生物科技有限公司提供;芦丁标准品(HPLC级别≥98%)、胆酸钠、甘氨胆酸钠(纯度>98%)、牛磺胆酸钠(纯度>97%) 上海麦克林生化科技有限公司;ABTS 纯度>98%,上海蓝季生物科技有限公司;DPPH 纯度>97%,上海如吉生物科技有限公司;胃蛋白酶 生物技术级,国药集团化学试剂有限公司;胰蛋白酶1:250(酶活>250.N.F.U/mg) 北京索莱宝科技有限公司;血脂康 北京北大维信生物科技有限公司;总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C)、谷草转氨酶(AST)、谷丙转氨酶(ALT)、碱性磷酸酶(ALP)、乳酸脱氢酶(LDH)、总超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-PX)、丙二醛(MDA)测定试剂盒 南京建成生物工程研究所;其他试剂均为国产分析纯。
UV-2700紫外分光光度计 日本岛津公司;KQ-250DE数控超声波清洗器 昆山市超声仪器有限公司;Y0062电子天平 赛多利斯科学仪器北京有限公司;STGL-18M离心机 上海卢湘仪离心机仪器有限公司;ALPHA2-4 LSCplus冷冻干燥机 德国Martin Christ公司;Bio-rad xMark酶标仪 美国伯乐公司;16×200 mm层析柱 瑞达恒辉;FE20 pH计 梅特勒-托利多仪器上海有限公司;BT100N蠕动泵 保定申辰泵业有限公司;BSZ-100自动部分收集器 上海嘉鹏科技有限公司;EasyScan 6数字切片扫描与应用系统 麦克奥迪实业集团有限公司。
1.2 实验方法
1.2.1 沙棘果皮渣总黄酮粗提物(TFCE)制备
参考本课题组前期研究所确定的最优提取工艺进行操作:将经过热风干燥(16 h,60 ℃)得到的沙棘果皮渣粉碎后过40目筛,精确称量150 g后加入体积分数59%的乙醇,经液料比40 mL/g,超声温度59 ℃,超声时间39 min条件下结合超声波辅助提取,合并两次提取液减压浓缩后蒸至浸膏状,得到TFCE。
沙棘果皮渣总黄酮含量(mg/g)=黄酮质量浓度×稀释倍数×提取液体积沙棘果皮渣质量 1.2.2 沙棘果皮渣总黄酮纯化物(TFSE)制备
将TFCE配制成2.2 mg/mL的样液,以1.0 mL/min流速上样至AB-8大孔树脂吸附饱和经水洗至无Molish反应后75%乙醇以1.5 mL/min流速洗脱120 mL,收集洗脱液,旋蒸至浸膏状,冷冻干燥即得TFSE(以芦丁计,此条件下的总黄酮纯度由纯化前9.78%提高到50.20%)。
1.2.3 抗氧化活性的测定
1.2.3.1 DPPH自由基清除能力
参考Brand-Williams等[17]的方法稍作修改。用无水乙醇配制成0.2 mmol/L DPPH工作液待用,向96孔板中加入浓度为5、10、20、40、80、160 μg/mL的TFSE样品和DPPH溶液各100 μL,以相同浓度的VC作为阳性比较,于517 nm处测定各反应吸光度。按如下公式计算DPPH自由基的清除率:
DPPH自由基清除率(%)=(1−A1−A2A0) 式中:A0为空白对照的吸光度;A1为样品的吸光度;A2为样品本底管的吸光度(用无水乙醇代替DPPH测得的对应浓度的吸光度)。
1.2.3.2 ABTS+自由基清除能力
参考Wang等[18]描述的方法稍作修改。向96孔板中加入40 μL浓度分别为5、10、20、40、80、160 μg/mL的TFSE样品和160 μL ABTS+储备液,以相同浓度的VC作为阳性对照,在避光条件下反应6 min后,测定其在734 nm处的吸光度,按如下公式计算ABTS+自由基的清除率:
ABTS+自由基清除率(%)=(1−A1−A2A0) 式中:A0为空白对照的吸光度;A1为样品的吸光度;A2为样品本底管的吸光度(用无水乙醇代替ABTS+测得的对应浓度的吸光度)。
1.2.3.3 总还原能力测定
参考Zhang等[19]方法稍作修改,移取1 mL浓度分别为5、10、20、40、80、160 μg/mL的TFSE样品,依次加入0.2 mol/L磷酸盐缓冲液(pH=6.6)2.5 mL和1%的六氰合铁酸钾溶液2.5 mL,50 ℃恒温水浴20 min,快速冷却后加入10%三氯乙酸2.5 mL,3000 r/min离心10 min,移取上清液2.5 mL,依次加入2.5 mL蒸馏水,0.1%三氯化铁溶液0.5 mL,振荡摇匀,避光静置10 min,用蒸馏水代替样品溶液作为空白对照,以同浓度的VC作为阳性对照,于700 nm处测定各反应吸光度。
1.2.4 体外结合胆酸盐能力的测定
1.2.4.1 胆酸盐标准曲线
根据康彤[20]的方法测定,得到甘氨胆酸标准曲线线性方程:y=1.9713x+0.0068,R2=0.999;牛磺胆酸钠的标准曲线线性方程:y=2.0002x+0.0058,R2=0.998;胆酸钠的标准曲线线性方程为:y=0.9362x+0.0039,R2=0.999。
1.2.4.2 样品测定
胆酸盐结合能力测定根据唐茹萌等[21]的方法稍作修改。通过“1.2.4.1”比色法测定甘氨胆酸钠和牛磺胆酸钠、胆酸钠吸光度,按如下公式计算胆酸盐的结合率:
胆酸盐结合率(%)=(1−C1−C2C0)×100 式中:C0为PBS代替样品测得吸光值(空白组);C1为样品组测得吸光值;C2为样品控制组测得吸光值。
1.2.5 动物分组、造模及给药
取40只SPF级C57BL/6J雄性小鼠7 d适应性喂养后,随机分为正常对照组(NC)、模型组(HFD)、阳性对照组(血脂康180 mg/kg·d,PC)、低剂量组(TFSE 160 mg/kg·d,L-TFSE)、高剂量组(TFSE 320 mg/kg·d,H-TFSE),每组8只,剂量参考文献[22]。正常对照组小鼠用普通饲料喂养,其余各组小鼠均用高脂饲料喂养30 d以制备高脂血症模型。随后进行后续30 d灌胃干预,正常对照组和模型组小鼠每天灌胃0.9%生理盐水,灌胃剂量为0.2 mL/20 g,同时观察小鼠进食情况,被毛光滑程度,反应快慢,活动度等行为表现。期间每6 d称重。本研究涉及的动物实验方案已经通过新疆农业大学实验动物福利伦理委员会审核批准,批准号为:2023026。
1.2.6 试验指标检测
1.2.6.1 血清参数的测定
采血前12 h小鼠禁食不禁水。眼球采血,并分离血清置于−80 ℃保存。按照试剂盒说明测定血清中的TC、TG、HDL-C、LDL-C、AST、ALT、AKP、LDH。
1.2.6.2 肝脏参数的测定
解剖分离肝脏,用生理盐水冲洗干净,一部分置于10%中性多聚甲醛中固定,另一部分以1:9冰浴无菌生理盐水进行匀浆,4 ℃,2500 r/min离心10 min,收集上清液,按照试剂盒说明测定肝匀浆中TC、TG、HDL-C、LDL-C、SOD、GSH-PX、CAT、MDA。
1.2.6.3 肝脏样本的病理观察
将多聚甲醛中固定的肝脏组织,经脱水与透明处理后用石蜡包埋进行切片,苏木精-伊红(HE)染色显微观察。
1.3 数据处理
数据采用SPSS 25.0统计软件进行处理,并采用OriginPro 2019b软件进行绘图;实验结果以“平均值±标准差”表示;多组间使用单因素方差分析(One-Way ANOVA)进行比较,两两比较使用LSD法,差异显著水平为P<0.05。
2. 结果与分析
2.1 沙棘果皮渣总黄酮的提取与纯化结果
用超声波辅助提取沙棘果皮渣总黄酮,提取液经旋转蒸发得到TFCE,经计算TFCE的含量为24.26±0.072 mg/g,其纯度为9.78%;AB-8大孔树脂纯化后,收集洗脱液旋转蒸发、冷冻干燥后得到TFSE,其纯度为50.20%,纯化后纯度提高了5.13倍。
2.2 抗氧化活性
2.2.1 DPPH自由基清除能力
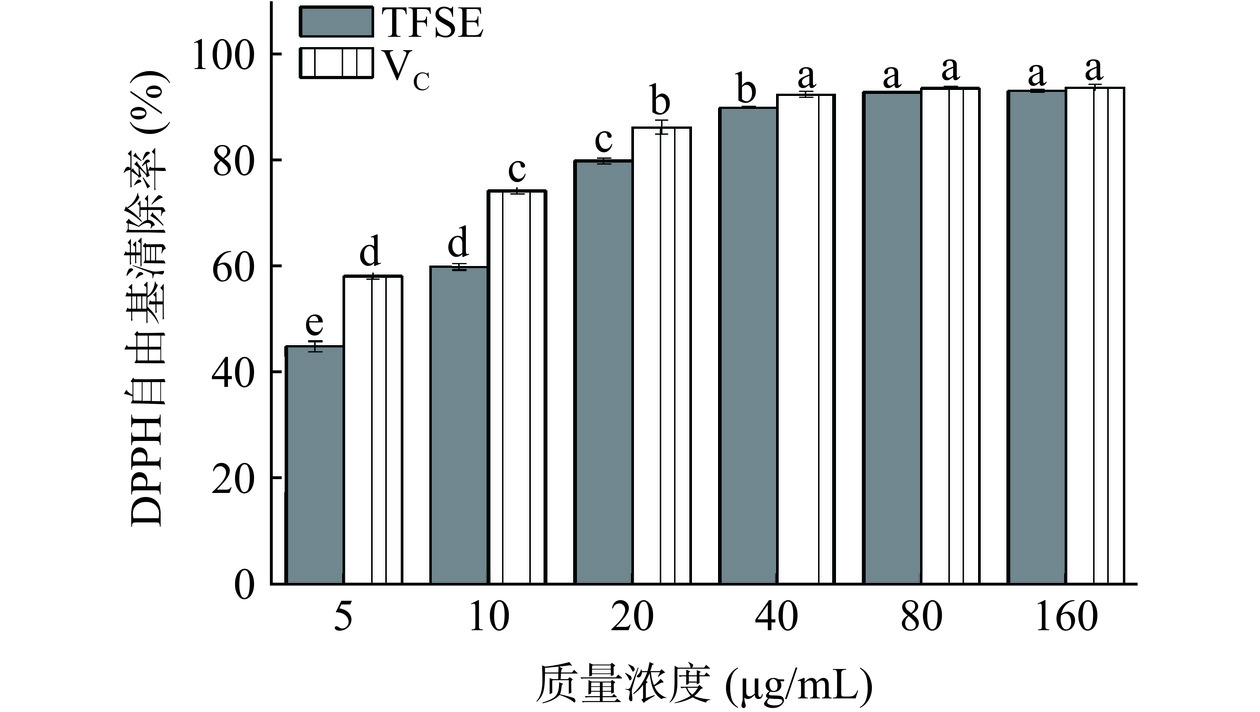
TFSE对DPPH自由基的清除能力见图1。TFSE和VC在5~40 μg/mL浓度范围内,浓度与清除率呈现显著的量效关系(P<0.05)。当浓度大于40 μg/mL时,TFSE和VC对DPPH自由基的清除率逐渐平缓(P>0.05),当浓度达到160 μg/mL时,二者的清除率分别达到92.74%±0.32%、93.35%±0.61%,其IC50值分别为5.204和2.114 μg/mL。上述结果优于焦岩[23]研究大果沙棘黄酮纯化物对DPPH自由基的清除效果,原因是沙棘品种的区别或者是不同部位中黄酮的种类与含量不同,表现出的抗氧化活性有所差异。
2.2.2 ABTS+自由基清除能力
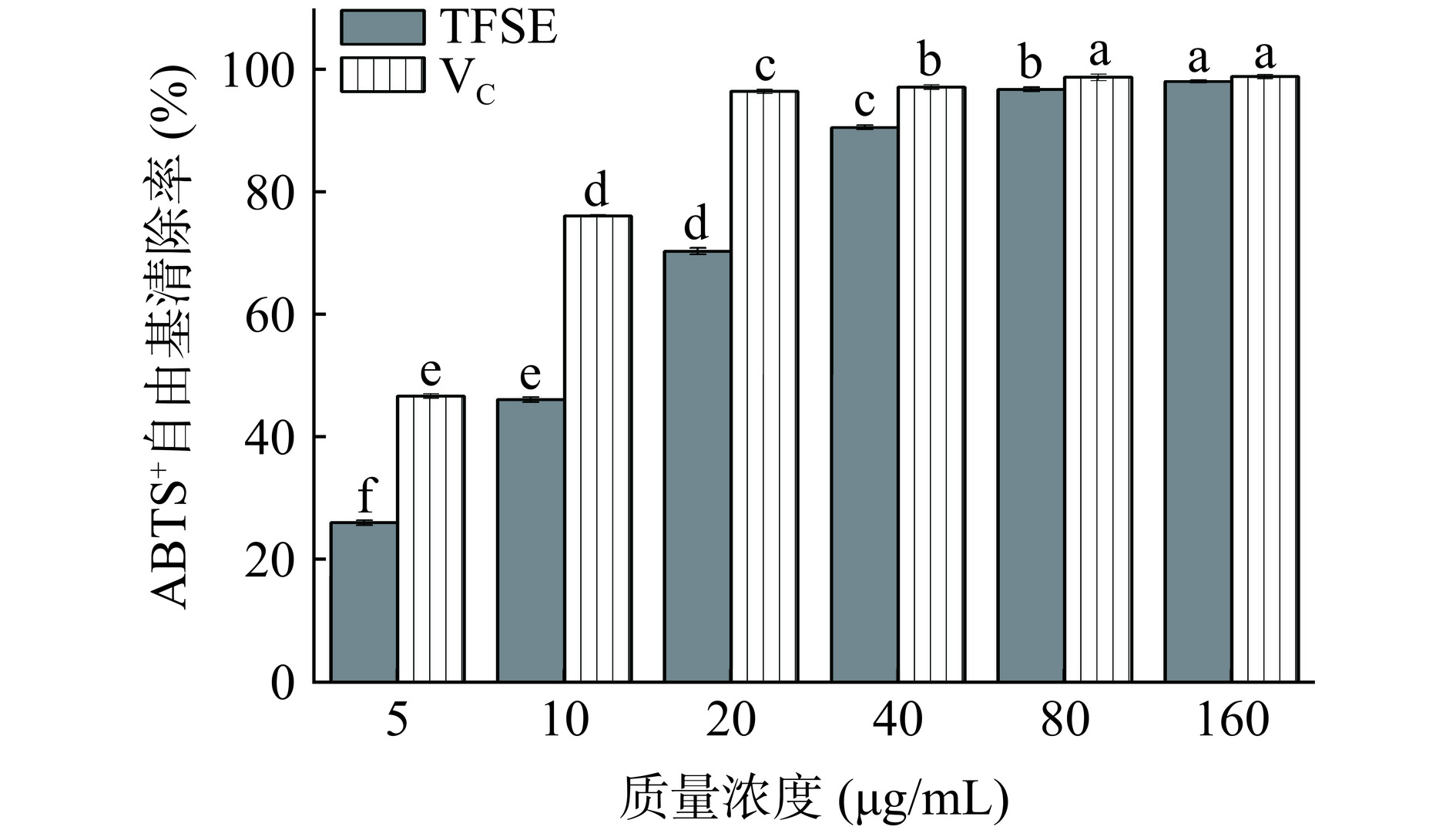
TFSE对ABTS+自由基的清除能力见图2。在5~80 μg/mL浓度范围内,TFSE和VC对ABTS+自由基的清除效果呈现显著的量效关系(P<0.05)。当浓度大于80 μg/mL时,VC对ABTS+自由基的清除效果无显著差异(P>0.05)。当浓度达到160 μg/mL时,TFSE和VC对ABTS+自由基的清除率均达到最大值,分别为98.153%±0.200%、98.961%±0.346%,其IC50分别为10.241、3.670 μg/mL。这与赵明慧[24]的结果相似,经AB-8型大孔树脂纯化后的沙棘黄酮对ABTS+自由基的清除能力显著增强。由此可见,TFSE具有良好的清除ABTS+自由基的能力。
2.2.3 还原力的测定
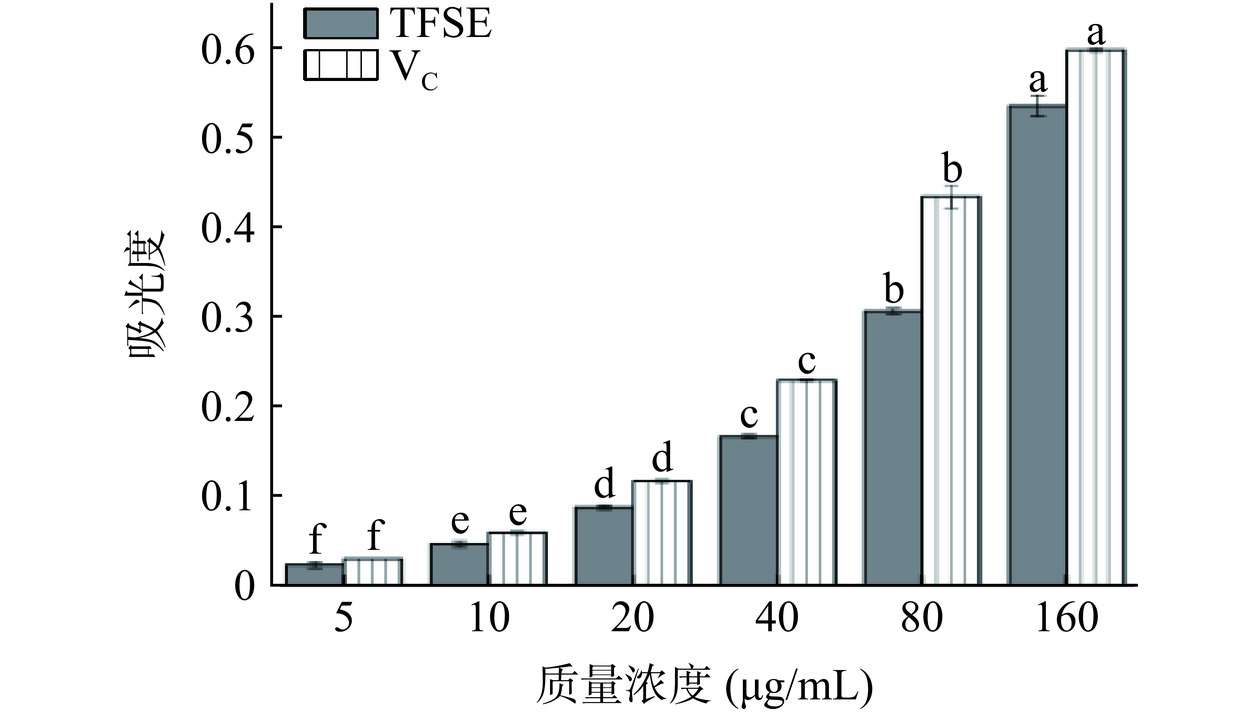
TFSE还原力的测定见图3。随着浓度的增加,TFSE和VC呈现量效关系(P<0.05)。当浓度为160 μg/mL时,均达到最大吸光度,其吸光度分别为0.53和0.59。这与Li等[25]的研究结果类似,经AB-8大孔树脂纯化后的林泽兰总黄酮的还原能力明显增强,表明TFSE具有较好的抗氧化能力。
2.3 胆酸盐能力结合研究
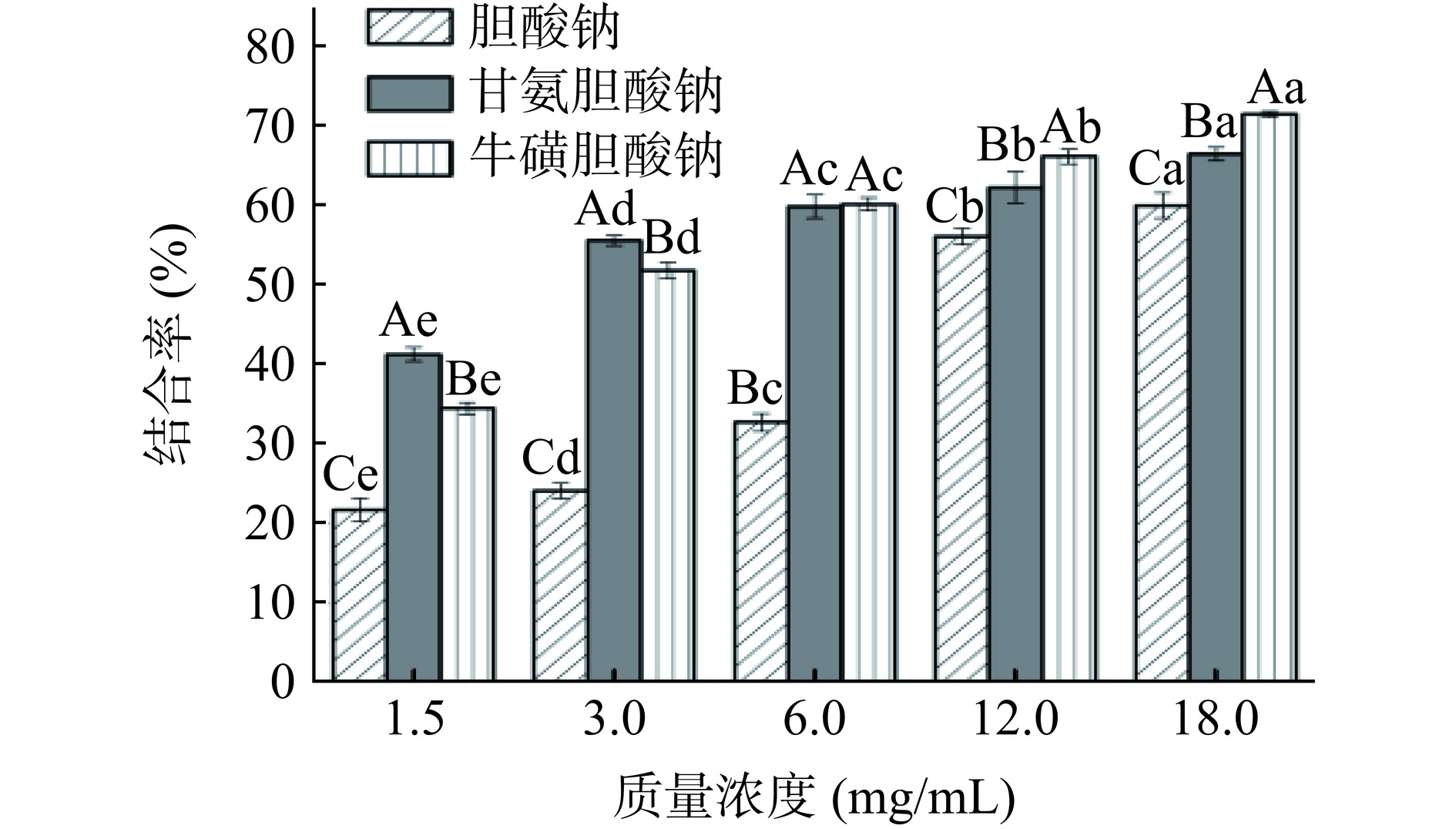
由图4可知,TFSE结合胆酸钠、甘氨胆酸钠和牛磺胆酸钠的能力与质量浓度呈正相关(P<0.05),当浓度在1.5~3 mg/mL时,TFSE对甘氨胆酸钠的结合率显著(P<0.05)高于胆酸钠和牛磺胆酸钠,且相互之间差异显著(P<0.05);当浓度为6 mg/mL时,TFSE对甘氨胆酸钠的结合率与牛磺胆酸钠的结合率差异不显著(P>0.05),但显著(P<0.05)高于胆酸钠。当浓度为18 mg/mL时,TFSE对胆酸钠、甘氨胆酸钠和牛磺胆酸钠的结合率达到最高分别为:59.88%±1.60%、66.36%±0.86%、71.35%±0.36%,其IC50分别为11.11、2.61、3.50 mg/mL。这一结论与芦宇等[26]的结果一致,经聚酰胺纯化后,红树莓籽黄酮对甘氨胆酸钠结合能力优于胆酸钠和牛磺胆酸钠。表明TFSE有较强的胆酸盐结合能力,可促使胆酸盐排出体外,降低其重吸收率,从而产生降血脂的功效。
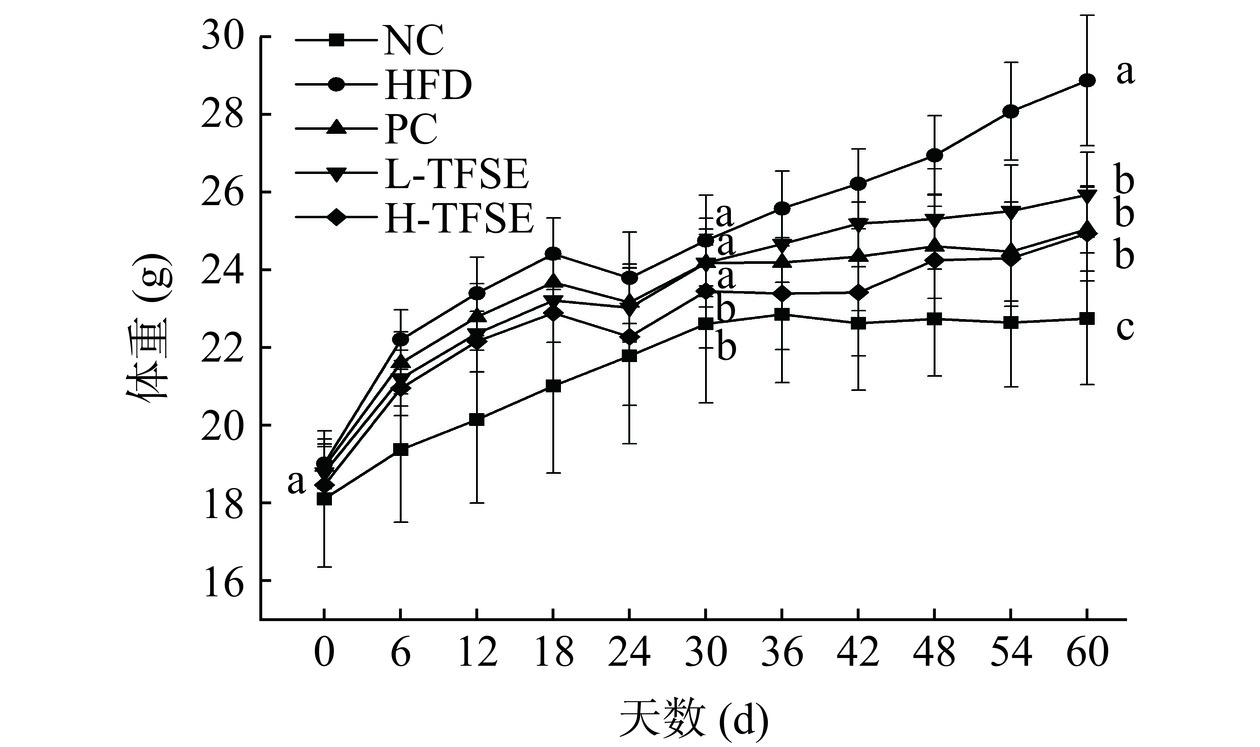
2.4 各组小鼠生长状态分析
由图5可知,在第1周普通饲料适应喂养期后,5组小鼠间体重差异不显著(P>0.05)。在60 d的试验期间,各组小鼠体重均有不同程度的增长,30 d后,HFD组小鼠体重显著高于NC组(P<0.05)。第60 d结束时,与NC组相比,HFD组小鼠的体重增加26.91%,仍显著高于NC组(P<0.05),说明饲喂高脂饲料可增加小鼠体重;相比HFD组,PC组、L-TFSE、H-TFSE组的小鼠体重显著降低(P<0.05),说明高脂饮食增加了小鼠体重,但随着不同剂量TFSE的干预,可以有效降低小鼠的体重。这些结果表明TFSE能一定程度上改善小鼠体重增加。
2.5 TFSE干预对高脂饮食小鼠血清血脂浓度的影响
脂质代谢异常通常会导致TC、TG、LDL-C水平的升高和HDL-C水平的降低,这些指标异常变化均会引发高脂血症的形成[27]。TFSE干预后对高血脂小鼠血清TC、TG、LDL-C和HDL-C浓度的影响如图6A~图6D所示,与NC组比较,HFD组小鼠血清中TC、TG、LDL-C浓度均显著升高(P<0.05);HDL-C浓度显著降低(P<0.05),表明小鼠高脂模型造模成功。与HFD组比较,经PC组、L-TFSE组、H-TFSE组干预后,小鼠血清中TC、TG、LDL-C浓度均显著降低(P<0.05),HDL-C含量均显著升高(P<0.05),上述结果表明TFSE能有效地调节小鼠血清血脂水平。
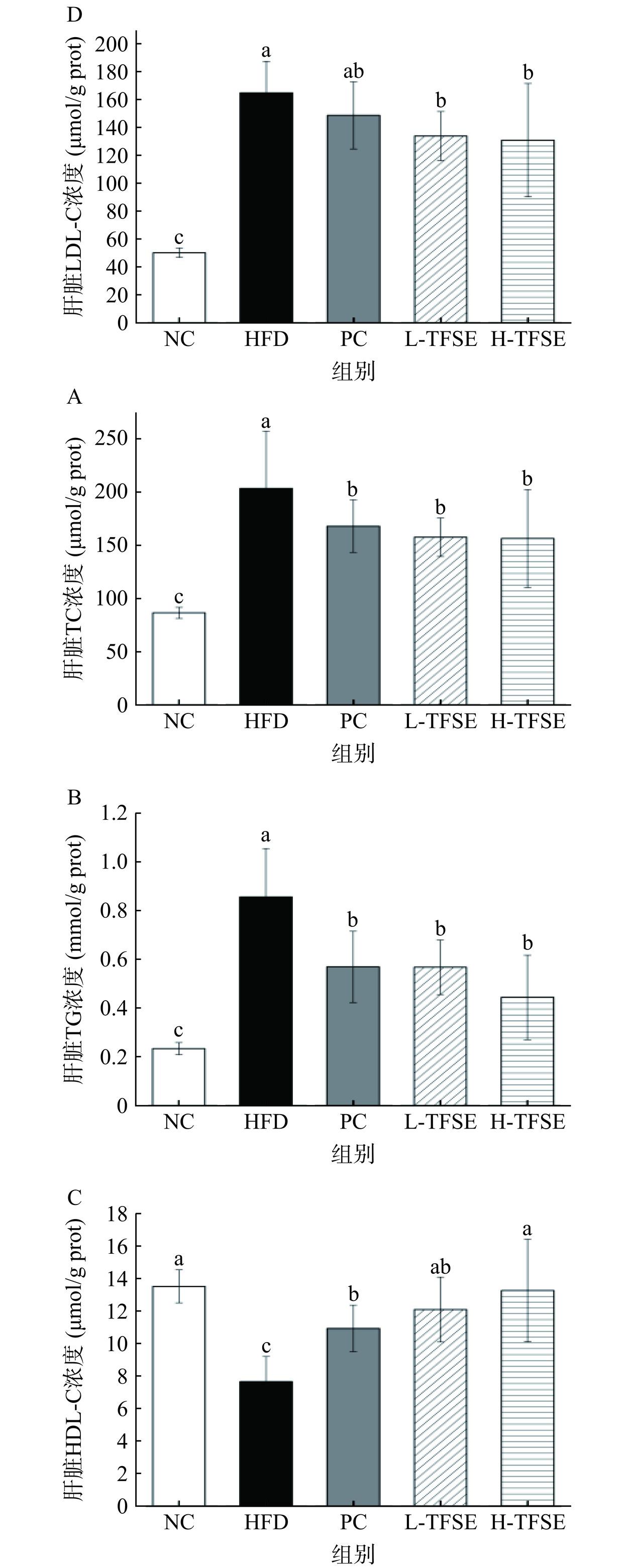
2.6 TFSE干预对高脂饮食小鼠肝脏血脂浓度的影响
肝脏为脂质合成和代谢的主要场所,而肝细胞内的脂质过度堆积会导致脂肪肝,引发一系列的炎症反应,最终导致不可逆性的肝损伤[28]。为了评估小鼠肝脏中的脂肪聚积情况,测定小鼠肝匀浆中TC、TG、LDL-C和HDL-C的浓度如图7A~图7D可知,与NC组相比,高脂饮食显著提高了HFD组小鼠肝脏TC、TG、LDL-C浓度(P<0.05),显著降低HDL-C浓度(P<0.05)。H-TFSE组干预后,小鼠肝脏中TC、TG、LDL-C浓度较HFD组下降最显著(P<0.05),其下降率分别为23.14%、47.98%、20.54%;同时HDL-C浓度显著(P<0.05)增加至73.14%,说明TFSE能改善高脂饮食引起的的肝脏脂质蓄积,一定程度上起到了保护肝脏的作用。
2.7 TFSE干预对高脂饮食小鼠肝功能指标的影响
AST、ALT、AKP和LDH是评估肝功能的重要生化指标,当肝脏组织损伤后,这些指标会大量释放入血,因此可以通过检测血清的AST、ALT、AKP和LDH活力高低来衡量肝脏损伤程度[27]。由图8A~图8D可知,与NC组相比,HFD组血清肝功能的4个指标均显著增加(P<0.05),说明高脂饮食对肝脏会造成一定程度的肝损伤。与HFD组相比,PC组、L-TFSE组和H-TFSE组的AST、ALT、AKP和LDH活力均显著降低(P<0.05),其中PC组与L-TFSE组显著降低AST与ALT的活力(P<0.05);PC组与H-TFSE组对AKP与LDH活力下降的效果较为明显(P<0.05),可以看出L-TFSE组和H-TFSE组效果与PC组效果相当。上述结果表明,TFSE在降血脂的同时,能有效地地改善肝功能,从而对肝脏起到保护作用。
2.8 TFSE干预对高脂饮食小鼠抗氧化指标的影响
研究表明,高脂饮食诱导引发的高脂血症会增加肝脏中炎症反应和脂质氧化应激反应,同时还会抑制内源性抗氧化酶系的活力,进一步加剧肝脏的损伤[29]。从图9A~图9D中可以看出,与NC组相比,HFD组血清中SOD、GSH-Px和CAT的活力依次显著降低(P<0.05),而MDA的活力则显著上升(P<0.05)。与HFD组相比,PC组、L-TFSE组、H-TFSE组干预后均能显著改善抗氧化酶的活力(P<0.05),L-TFSE组对SOD活力较HFD组提高了10.07%;H-TFSE组对GSH-PX、CAT活力较HFD组分别提高了23.08%、27.10%,对MDA含量的降低效果较好,为HFD组的18.05%。上述结果表明,TFSE可以增强体内抗氧化酶活力,从而抑制因高脂饮食引起的氧化应激。
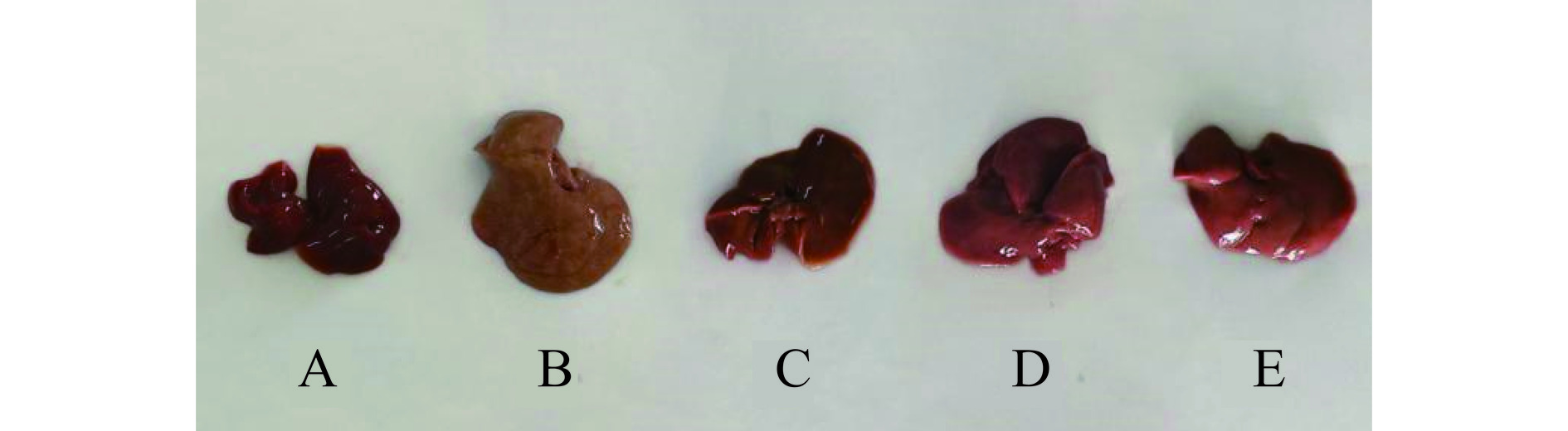
2.9 TFSE干预对高脂饮食小鼠肝脏的影响
TFSE对高血脂小鼠肝脏的外观形态观察如图10所示,NC组小鼠肝脏形态规则,体积适中,呈现鲜红色,且质地光滑具有一定弹性。与NC组相比,HFD组小鼠的肝脏肿大,有油腻感,呈现棕黄色,且切面出现花斑样并伴有一些细小的黄色斑点,质地柔软弹性较差。与HFD组相比,PC组、L-TFSE组以及H-TFSE组能够改善高血脂小鼠肝脏发黄与油腻感的情况,并减少肝脏表面的黄色斑点[30]。总的来看,TFSE各剂量组有助于改善高脂饮食诱导的高血症小鼠脂肪肝变性,其中H-TFSE和PC组改善小鼠肝脏的脂肪化的程度较为显著。
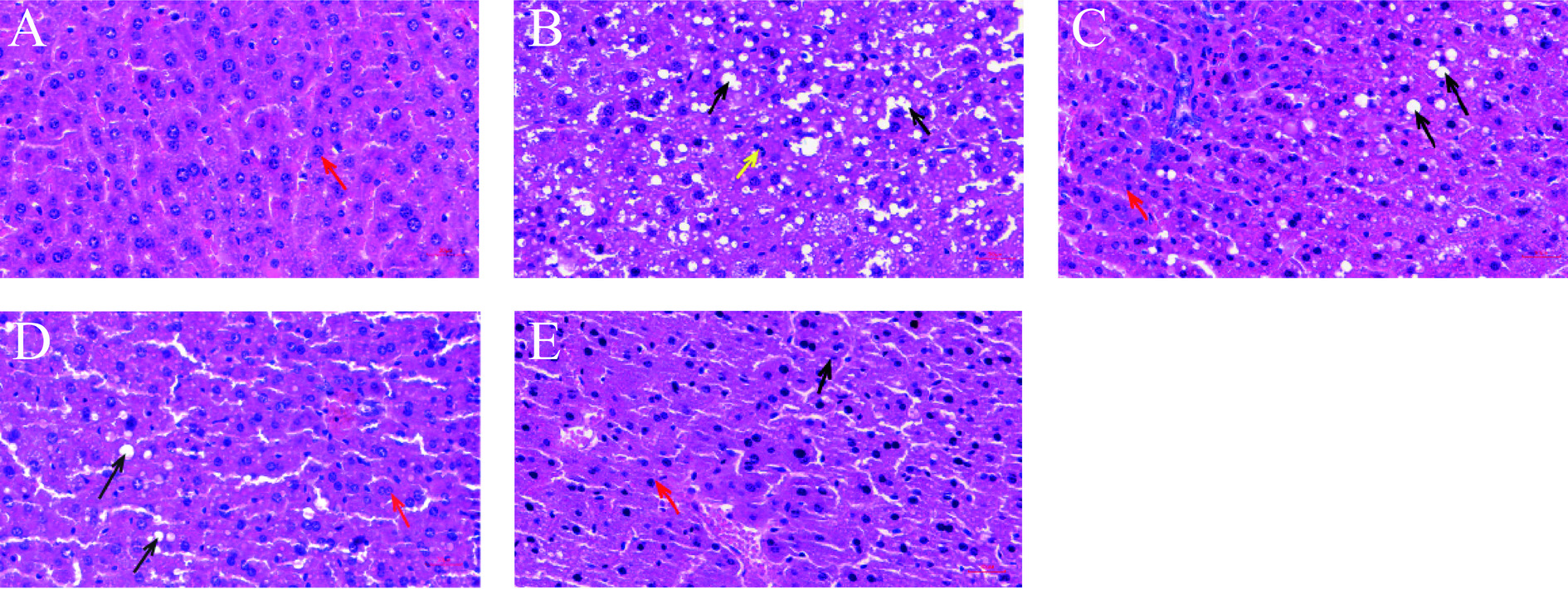
2.10 小鼠肝脏病理学观察
小鼠的肝脏组织经HE染色结果如图11所示,NC组肝索排列整齐有序,肝窦未见明显扩,肝细胞轮廓清晰,胞浆丰富,未观测到明显变性,如红色箭头所示,细胞内无脂滴出现(图11A)。HFD组肝结构重度异常,肝细胞广泛肿胀伴随弥散型脂肪变性,肝索排列紊乱,胞浆内可见大小不一圆形空泡,如黑色箭头所示,并且个别细胞核挤压偏移[31];肝窦中巨噬细胞数量有所增加,如黄色箭头所示(图11B)。通过阳性药物与TFSE各剂量的干预后这种现象有所改善,PC组肝结构轻度异常,部分肝细胞呈现轻度脂肪变性,细胞肿胀减轻且圆形脂肪空泡有所减少,黑色箭头所示,脂肪变性程度较HFD组明显减少,周围可见较为正常肝细胞,如红色箭头所示(图11C)。L-TFSE组呈现轻微的肝细胞脂肪变性,脂肪空泡有不同程度的改善,脂滴变少,形态较正常(图11D)。H-TFSE组肝基本正常,肝细胞排列较为有序,偶见脂肪空泡,如黑色箭头所示,与NC组相比差异不大,作用效果最佳(图11E)。
3. 讨论与结论
在正常情况下,机体脂质代谢处于动态平衡,当内源性脂质代谢紊乱或外源性脂质摄入过多(长期高脂饮食的摄入)引起血液中脂类成分明显异常,形成了高脂血症,而高脂血症被认为是冠心病和动脉粥样硬化的主要危险因素[15]。大量研究表明,降低TC和TG水平可以有效预防和治疗高脂血症[32]。LDL-C是TC最重要的转运蛋白,可将TC转运到组织中,但多余的LDL-C容易在动脉管壁中积聚和氧化,造成动脉粥样硬化[33]。相反,HDL-C可以通过“逆向胆固醇转运”途径将组织和血管中的TC运输到肝脏,并通过胆汁酸将其排出[34]。另外TG水平升高也会增加心血管疾病(CVD)的风险,但必须与低水平的HDL-C和高水平的TC、LDL-C相关联[27]。研究发现黄酮可以降低血清TC,从而降低CVD的风险。这是因为黄酮与胆酸盐结合抑制胆汁酸重吸收,减少机体对脂质的过量吸收[26],说明黄酮类化合物在调节机体脂质代谢方面具有显著的作用。本研究通过体外胆酸盐结合试验,发现TFSE有较强的胆酸盐结合能力,初步说明TFSE具有潜在的降血脂活性。通过高脂饲料诱导构建高血脂小鼠模型进行了体内试验,结果表明小鼠血清TC、TG、LDL-C水平显著升高(P<0.05),HDL-C水平显著降低(P<0.05)。TFSE干预除降低因高脂饮食增加的体重外(P<0.05),还改善了脂质代谢紊乱状况,血清中TC、TG和LDL-C的水平显著降低(P<0.05),HDL-C的水平显著增加(P<0.05),说明TFSE对高脂血症的防治与改善有重要作用。
脂质代谢对人体的生命活动是至关重要的,而肝脏在脂质代谢中起着关键作用,长期摄入高脂食物使得脂肪和胆固醇在肝细胞中过度积累,这种脂质代谢紊乱,会导致一系列健康问题,如高血脂、脂肪肝等[21]。因此,本文通过检测肝脏中血脂四项的水平,进一步评估机体肝脏脂质代谢情况。研究结果表明,高脂饮食显著增加HFD组小鼠肝脏TC、TG、LDL-C水平(P<0.05),显著降低了HDL-C水平,表明高脂饮食导致小鼠脂质代谢紊乱;经TFSE组干预后TC、TG和LDL-C的水平较HFD组显著降低(P<0.05),下降率分别为23.14%、47.98%、20.54%;HDL-C的水平显著增加(P<0.05),上升率为73.14%。由于脂肪主要在肝脏和脂肪组织中合成,当产生的脂质无法释放到血液中时,它们会以脂滴的形式积聚并沉积在肝组织中。血清转氨酶对肝细胞的损伤很敏感,ALT、AST、AKP和LDH作为肝损伤的生物标志物,它们主要存在于肝细胞中。肝细胞膜完整性一旦被破坏,其通透性增加,可导致这些酶从胞质中释放入血液[35]。这可能是HFD组小鼠血清AST、ALT、AKP和LDH活力均显著高于NC组的原因(P<0.05);通过组织病理学检查发现HFD组小鼠的肝组织损伤明显,表明高脂饮食导致小鼠脂质代谢紊乱和肝损伤。通过TFSE干预后时,这些酶的活力均显著降低(P<0.05),结果与肝组织病理学检查结果一致,TFSE可有效减少高脂血症小鼠肝组织细胞中脂滴的积聚,从而预防脂肪肝。上述结果表明TFSE有效的改善了高脂饮食导致的肝脏脂质聚积和肝脏损伤。
研究表明,抗氧化活性和降血脂之间有着密切的关系,并明确了活性氧自由基(reactive oxygen species,ROS)在高脂血症发展中的重要作用。当ROS增加或自由基清除酶活性降低,均会导致抗氧化系统的紊乱即氧化应激[10]。生物体内源性抗氧化酶如SOD、GSH-Px、CAT被认为是人体内重要的抗氧化酶。其中SOD主要通过减轻超氧阴离子自由基导致的脂质过氧化和细胞膜损伤来反映机体清除氧自由基的能力[10];GSH-PX是一种重要的催化H2O2分解酶,通过抑制ROS的活性,减少脂质过氧化,从而保护细胞膜结构和功能免受氧化损伤[36];CAT是通过催化H2O2分解与防止H2O2参与有害物质·OH的产生两种方式来增强机体抵抗自由基的能力[37];超氧阴离子自由基会攻击细胞膜中的多不饱和脂肪酸,进而产生脂质过氧化产物MDA。因此MDA被认为是脂质过氧化和氧化应激的重要标志物[29]。肝脏作为参与脂肪酸氧化的主要场所,是ROS损伤的潜在部位,当肝脏中脂质积聚过多,会导致ROS的过量产生[38]。评价肝脏抗氧化体系酶活力和脂质过氧化产物MDA含量可以反映机体的抗氧化能力。本研究结果证明高脂饮食使小鼠肝脏中SOD、GSH-PX、CAT活力均显著降低(P<0.05),MDA含量显著增加(P<0.05),说明高脂饮食会导致机体内自由基增加,引发脂质过氧化反应,降低机体的抗氧化能力。但通过TFSE干预后,小鼠肝脏中SOD、GSH-PX、CAT活力均显著增加(P<0.05),MDA含量显著降低(P<0.05),其中L-TFSE对SOD活力影响最强,H-TFSE对GSH-PX、CAT活力和MDA含量影响最强。此外,体外试验的结果显示,TFSE具有较好的抗氧化能力,能有效清除DPPH、ABTS+自由基并提高还原力。说明TFSE可减少高脂血症小鼠肝脏中的超氧化物阴离子,降低脂质过氧化物含量,并改善其氧化应激,提高机体抗氧化活性。
本文对TFSE的降血脂作用进行了深入探究。在体外模拟试验中,TFSE对DPPH、ABTS+自由基清除率的IC50值分别为5.204、10.241 μg/mL,当质量浓度为160 μg/mL时,总还原能力较好,其吸光值为0.531±0.012;TFSE对胆酸钠、甘氨胆酸钠和牛磺胆酸钠结合率的IC50分别为11.11、2.61、3.50 mg/mL。在体内动物试验中,TFSE干预后可有效抑制高脂饮食诱导的小鼠体重,显著降低(P<0.05)血清与肝脏中TC、TG和LDL-C水平,显著增加(P<0.05)HDL-C水平;同时,TFSE显著提高(P<0.05)SOD、GSH-Px、CAT水平,显著降低(P<0.05)AST、ALT、AKP、LDH水平及MDA含量,能够提高抗氧化能力并改善高脂饮食对肝脏的病理损伤,进一步验证了TFSE的降血脂效果。
综上所述,TFSE通过抗氧化、抑制胆酸盐重吸收、改善脂肪肝等途径在体内外均表现出降血脂作用,可作为潜在的降血脂活性物质来源,但是具体的降血脂作用机制还需要进一步的探讨。后期将从网络药理学、分子对接及分子生物学方面开展脂质代谢相关通路的研究,为进一步阐明沙棘果皮渣黄酮类化合物降脂作用提供理论基础,同时为提高沙棘类产品附加值和果皮渣副产物的深度开发利用提供参考。
-
-
[1] 王萌, 王子纯, 黄京美, 等. 沙棘黄酮类物质提取纯化及功能活性研究进展[J]. 食品工业科技,2023,44(2):487−496. [WANG M, WANG Z C, HUANG J M, et al. Research progress on extraction, purification and functional activity of sea buckthorn flavonoids[J]. Science and Technology of Food Industry,2023,44(2):487−496.] WANG M, WANG Z C, HUANG J M, et al. Research progress on extraction, purification and functional activity of sea buckthorn flavonoids[J]. Science and Technology of Food Industry, 2023, 44(2): 487−496.
[2] 王宁宁, 郑文惠, 张凯雪, 等. 沙棘的化学成分、药理作用研究进展及其质量标志物的预测分析[J]. 中国中药杂志,2021,46(21):5522−5532. [WANG N N, ZHENG W H, ZHANG K X, et al. Research progress on chemical constituents and pharmacological activities of sea buckthorn and predictive analysis on Q-marker[J]. China Journal of Chinese Materia Medica,2021,46(21):5522−5532.] WANG N N, ZHENG W H, ZHANG K X, et al. Research progress on chemical constituents and pharmacological activities of sea buckthorn and predictive analysis on Q-marker[J]. China Journal of Chinese Materia Medica, 2021, 46(21): 5522−5532.
[3] TU J Q, LIU H P, SUN N X, et al. Optimization of the steam explosion pretreatment effect on total flavonoids content and antioxidative activity of sea buckthom pomace by response surface methodology[J]. Molecules,2018,24(1):60. doi: 10.3390/molecules24010060
[4] 帕塔尔·尼牙孜. 沙棘果渣黄酮软胶囊产品开发研究[D]. 乌鲁木齐:新疆大学, 2016. [PATAER N Y Z. Study on development of producing flavones soft capsule from sea buckthorn residue[D]. Urumqi:Xinjiang university, 2016.] PATAER N Y Z. Study on development of producing flavones soft capsule from sea buckthorn residue[D]. Urumqi: Xinjiang university, 2016.
[5] SYTAOVÁ I, ORSAVOVÁ J, SNOPEK L, et al. Impact of phenolic compounds and vitamins C and E on antioxidant activity of sea buckthorn (Hippophaë rhamnoides L.) berries and leaves of diverse ripening times[J]. Food Chemistry, 2020, 310:125784.
[6] 张东生. 沙棘果皮渣黄酮提取及在粮油食品中应用研究[D]. 长春:长春工业大学, 2013. [ZHANG D S. Extraction of Hippophae Rhamnoides marc flavones and' applied research in cearal and oil food[D]. Changchun:Changchun University of Technology, 2013.] ZHANG D S. Extraction of Hippophae Rhamnoides marc flavones and' applied research in cearal and oil food[D]. Changchun: Changchun University of Technology, 2013.
[7] 裴轶琨. 响应面法优化高压脉冲电场提取沙棘果皮渣黄酮[J]. 中国酿造,2012,31(10):57−61. [PEI Y K. Extraction optimization of the total flavones of sea buckthorn marcwith high voltage pulsed electric field by response surface methodology[J]. China Brewing,2012,31(10):57−61.] doi: 10.3969/j.issn.0254-5071.2012.10.016 PEI Y K. Extraction optimization of the total flavones of sea buckthorn marcwith high voltage pulsed electric field by response surface methodology[J]. China Brewing, 2012, 31(10): 57−61. doi: 10.3969/j.issn.0254-5071.2012.10.016
[8] NAN G H, LIU L S, WU H L, et al. Transcriptomic and metabonomic profiling reveals the antihyperlipidemic effects of tartary buckwheat sprouts in high-fat-diet-fed mice[J]. Journal of Agricultural and Food Chemistry,2022,70(41):13302−13312. doi: 10.1021/acs.jafc.2c05382
[9] DUAN R Q, GUAN X, HUANG K, et al. Flavonoids from whole-grain oat alleviated high-fat diet-induced hyperlipidemia via regulating bile acid metabolism and gut microbiota in mice[J]. Journal of Agricultural and Food Chemistry,2021,69(27):7629−7640. doi: 10.1021/acs.jafc.1c01813
[10] SEYEDAN A, ALSHAWSH M A, ALSHAGGA M A, et al. Antiobesity and lipid lowering effects of Orthosiphon stamineus in high-fat diet-induced obese mice[J]. Planta Medica,2017,83(8):684−692.
[11] 马建林, 黄文杰. 他汀类药物相关不良反应的研究进展[J]. 中国医药,2019,14(7):1118−1120. [MA J L, HUANG W J. Research progress of statin-related adverse reactions[J]. China Medicine,2019,14(7):1118−1120.] doi: 10.3760/j.issn.1673-4777.2019.07.040 MA J L, HUANG W J. Research progress of statin-related adverse reactions[J]. China Medicine, 2019, 14(7): 1118−1120. doi: 10.3760/j.issn.1673-4777.2019.07.040
[12] 陈斌, 刘洁, 詹敏敏, 等. 黄酮类化合物与肠道菌群互作研究进展[J]. 中国食品学报,2022,22(6):369−381. [CHEN B, LIU J, ZHAN M M, et al. Research progress on the interaction between flavonoids and intestinal flora[J]. Journal of Chinese Institute of Food Science and Technology,2022,22(6):369−381.] CHEN B, LIU J, ZHAN M M, et al. Research progress on the interaction between flavonoids and intestinal flora[J]. Journal of Chinese Institute of Food Science and Technology, 2022, 22(6): 369−381.
[13] BAEBANA C, BOUCHER A C, BOYE J I. In vitro binding of bile salts by lentil flours, lentil protein concentrates and lentil protein hydrolysates[J]. Food Research International,2011,44(1):174−180. doi: 10.1016/j.foodres.2010.10.045
[14] 李珊, 刘耀耀, 刘哲, 等. 狭果茶藨子黄酮提取工艺优化及其体外降血脂活性[J]. 食品研究与开发,2021,42(3):73−79. [LI S, LIU Y Y, LIU Z, et al. Optimization of the extraction process of flavonoids from Ribes stenocarpum maxim. and its hypolipidemic activity in vitro[J]. Food Research and Development,2021,42(3):73−79.] doi: 10.12161/j.issn.1005-6521.2021.03.012 LI S, LIU Y Y, LIU Z, et al. Optimization of the extraction process of flavonoids from Ribes stenocarpum maxim. and its hypolipidemic activity in vitro[J]. Food Research and Development, 2021, 42(3): 73−79. doi: 10.12161/j.issn.1005-6521.2021.03.012
[15] 王兆丹. 菊花黄酮的提取、分析及其降血脂作用机制研究[D]. 南京:东南大学, 2022. [WANG Z D. Extraction and analysis of flavonoids from chrysanthemum and its mechanism of reducing blood lipid[D]. Nanjing:Southeast University, 2022.] WANG Z D. Extraction and analysis of flavonoids from chrysanthemum and its mechanism of reducing blood lipid[D]. Nanjing: Southeast University, 2022.
[16] HUSSAIN S, SHARMA M, BHAT R. Valorisation of sea buckthorn pomace by optimization of ultrasonic-assisted extraction of soluble dietary fibre using response surface methodology[J]. Foods,2021,10(6):1330. doi: 10.3390/foods10061330
[17] BRAND-WILLIAMS W, CUVELIER M E, BERSET C. Use of a free radical method to evaluate antioxidant activity[J]. LWT-Food Science and Technology,1995,28(1):25−30. doi: 10.1016/S0023-6438(95)80008-5
[18] WANG W, ZHANG X L, LIU Q L, et al. Study on extraction and antioxidant activity of flavonoids from Hemerocallis fulva (Daylily) Leaves[J]. Molecules,2022,27(9):2916. doi: 10.3390/molecules27092916
[19] ZHANG Y L, SHEN Y X, ZHU Y C, et al. Assessment of the correlations between reducing power, scavenging DPPH activity and anti-lipid-oxidation capability of phenolic antioxidants[J]. LWT-Food Science and Technology,2015,63(1):569−574. doi: 10.1016/j.lwt.2015.03.047
[20] 康彤. 甘草黄酮的提取, 纯化及活性研究[D]. 天津:天津科技大学, 2019. [KANG T. Extraction, purification and activity of flavonoids from Glycyrrhiza[D]. Tianjin:Tianjin University of Science and Technology, 2019.] KANG T. Extraction, purification and activity of flavonoids from Glycyrrhiza[D]. Tianjin: Tianjin University of Science and Technology, 2019.
[21] 唐茹萌, 焦文雅, 桑亚新, 等. 裙带菜多糖体外和体内降血脂活性[J]. 食品科学,2022,43(1):142−149. [TANG R M, JIAO W Y, SANG Y X, et al. In vitro and in vitro hypolipidemic effect of Undaria pinnatifida polysaccharide[J]. Food Science,2022,43(1):142−149.] doi: 10.7506/spkx1002-6630-20210108-087 TANG R M, JIAO W Y, SANG Y X, et al. In vitro and in vitro hypolipidemic effect of Undaria pinnatifida polysaccharide[J]. Food Science, 2022, 43(1): 142−149. doi: 10.7506/spkx1002-6630-20210108-087
[22] 兰卫. 洋甘菊总黄酮对高脂血症模型小鼠脂质代谢的影响及机制[J]. 中国药房,2021,32(22):2706−2712. [LAN W. Effects of total flavonoids from chamomile on lipid metabolism of hyperlipidemia model mice and its mechanism[J]. China Pharmacy,2021,32(22):2706−2712.] doi: 10.6039/j.issn.1001-0408.2021.22.04 LAN W. Effects of total flavonoids from chamomile on lipid metabolism of hyperlipidemia model mice and its mechanism[J]. China Pharmacy, 2021, 32(22): 2706−2712. doi: 10.6039/j.issn.1001-0408.2021.22.04
[23] 焦岩. 大果沙棘黄酮分离纯化及生物活性研究[D]. 哈尔滨:东北林业大学, 2010. [JIAO Y. Studies on separation, purification and bioactivity of flavonoids from sea buckthorn[D]. Harbin:Northeast Forestry University, 2010.] JIAO Y. Studies on separation, purification and bioactivity of flavonoids from sea buckthorn[D]. Harbin: Northeast Forestry University, 2010.
[24] 赵明慧. 沙棘黄酮的提取纯化工艺优化及应用研究[D]. 石河子:石河子大学, 2023. [ZHAO M H. Study on extraction and purification process optimization and application of sea buckthorn flavonoids[D]. Shihezi:Shihezi University, 2023.] ZHAO M H. Study on extraction and purification process optimization and application of sea buckthorn flavonoids[D]. Shihezi: Shihezi University, 2023.
[25] LI C, CHEN S L, SHA J, et al. Extraction and purification of total flavonoids from Eupatorium lindleyanum DC. and evaluation of their antioxidant and enzyme inhibitory activities[J]. Food Science and Nutrition,2021,9(5):2349−2363. doi: 10.1002/fsn3.1999
[26] 芦宇, 吕长鑫, 焦天慧, 等. 聚酰胺纯化红树莓籽黄酮及其结合胆酸盐能力评价[J]. 中国食品学报,2019,19(10):172−178. [LU Y, LÜ C X, JIAO T H, et al. Evaluation of the ability of polyamide to purify flavonoids from red raspberry seeds and to bind cholate[J]. Journal of Chinese Institute of Food Science and Technology,2019,19(10):172−178.] LU Y, LÜ C X, JIAO T H, et al. Evaluation of the ability of polyamide to purify flavonoids from red raspberry seeds and to bind cholate[J]. Journal of Chinese Institute of Food Science and Technology, 2019, 19(10): 172−178.
[27] 单科开, 王鸿飞, 许凤, 等. 苦菜黄酮对高脂血症小鼠血脂代谢及保肝作用[J]. 食品科学,2019,40(19):231−236. [SHAN K K, WANG H F, XU F, et al. Flavonoids from Sonchus oleraceus L. exert a hepatoprotective effect in hyperlipidemic mice by regulating blood lipid metabolism[J]. Food Science,2019,40(19):231−236.] doi: 10.7506/spkx1002-6630-20181010-087 SHAN K K, WANG H F, XU F, et al. Flavonoids from Sonchus oleraceus L. exert a hepatoprotective effect in hyperlipidemic mice by regulating blood lipid metabolism[J]. Food Science, 2019, 40(19): 231−236. doi: 10.7506/spkx1002-6630-20181010-087
[28] 杨红娟, 陈振东, 田旭东. 中医药治疗非酒精性脂肪性肝病相关信号通路的研究进展[J/OL]. 天然产物研究与开发, 2024, 36(1):175−185. DOI: 10.16333/j.1001-6880.2024.1.019. [YANG H J, CHEN Z D, TIAN X D. Research progress of signaling pathways associated with traditional Chinese medicine for the treatment of nonalcoholic fatty liver disease[J/OL]. Natural Product Research and Development, 2024, 36(1):175−185. doi:10.16333/j.1001-6880.2024.1.019.] YANG H J, CHEN Z D, TIAN X D. Research progress of signaling pathways associated with traditional Chinese medicine for the treatment of nonalcoholic fatty liver disease[J/OL]. Natural Product Research and Development, 2024, 36(1): 175−185. doi: 10.16333/j.1001-6880.2024.1.019.
[29] ZHANG S S, XU X L, CAO X, et al. The structural characteristics of dietary fibers from Tremella fuciformis and their hypolipidemic effects in mice[J]. Food Science and Human Wellness,2023,12(2):503−511. doi: 10.1016/j.fshw.2022.07.052
[30] 卢月, 胡永强, 夏雨弘, 等. 香灰菌发酵茶水提物对高血脂小鼠脂质代谢的影响[J]. 食品工业科技,2023,44(15):378−384. [LU Y, HU Y Q, XIA Y H, et al. Effects of aqueous extracts from Annulohypoxylon stygium fermented tea on lipid metabolism in hypolipidemic mice[J]. Science and Technology of Food Industry,2023,44(15):378−384.] LU Y, HU Y Q, XIA Y H, et al. Effects of aqueous extracts from Annulohypoxylon stygium fermented tea on lipid metabolism in hypolipidemic mice[J]. Science and Technology of Food Industry, 2023, 44(15): 378−384.
[31] DENG M, ZHANG S, DONG L H, et al. Shatianyu (Citrus grandis L. Osbeck) flavonoids and dietary fiber in combination are more effective than individually in alleviating high-fat-diet-induced hyperlipidemia in mice by altering gut microbiota[J]. Journal of Agricultural and Food Chemistry,2022,70(46):14654−14664. doi: 10.1021/acs.jafc.2c03797
[32] XIE Y D, LIU J P, SHI Y H, et al. The combination of sesamol and clofibric acid moieties leads to a novel potent hypolipidemic agent with antioxidant, anti-inflammatory and hepatoprotective activity[J]. Bioorganic & Medicinal Chemistry Letters,2021,15(44):128121.
[33] CHU L L, YANG L C, LIN L Z, et al. Chemical composition, antioxidant activities of polysaccharide from Pine needle (Pinus massoniana) and hypolipidemic effect in high-fat diet-induced mice[J]. International Journal of Biological Macromolecules:Structure, Function and Interactions,2019,15(125):445−452.
[34] ZENG H L, CHEN P L, CHANG Q, et al. Hypolipidemic effect of polysaccharides from Fortunella margarita (Lour.) Swingle in hyperlipidemic rats[J]. Food and Chemical Toxicology,2019,132:110663. doi: 10.1016/j.fct.2019.110663
[35] BOUHAMED S B H, CHAARI M, BELLASSOUED K, et al. Anti-yperlipidemic and antioxidant effects of feather protein hydrolysate in high-fat fed mice[J]. Engineering in Life Sciences,2018,12(5):158−239.
[36] 包晓玮, 韩海霞, 杜光明, 等. 甜菜红素对小鼠体内抗氧化及免疫调节的作用[J]. 食品科学,2019,40(17):196−201. [BAO X W, HAN H X, DU G M, et al. Antioxidant activity and immunomodulatory effect of betalain in mice[J]. Food Science,2019,40(17):196−201.] doi: 10.7506/spkx1002-6630-20180930-344 BAO X W, HAN H X, DU G M, et al. Antioxidant activity and immunomodulatory effect of betalain in mice[J]. Food Science, 2019, 40(17): 196−201. doi: 10.7506/spkx1002-6630-20180930-344
[37] JIANG N F, LI B X, WANG X Q, et al. The antioxidant and antihyperlipidemic activities of phosphorylated polysaccharide from Ulva pertusa[J]. International Journal of Biological Macromolecules:Structure, Function and Interactions,2020,15(145):1059−1065.
[38] GRATTAGLIANO I, PALMIERI V O, PORTINCASA P, et al. Oxidative stress-induced risk factors associated with the metabolic syndrome:a unifying hypothesis[J]. The Journal of Nutritional Biochemistry,2008,19(8):491−504. doi: 10.1016/j.jnutbio.2007.06.011





 下载:
下载:



 下载:
下载:
