Effects of Thermal Reaction Conditions on Dicarbonyl Compounds and Flavor Substances in Glucose-Alanine Sweet-flavored Maillard Reaction Model System
-
摘要: 目的:探究不同热反应条件(温度、pH、反应时间和底物摩尔比)对葡萄糖-丙氨酸模拟体系中3种重要二羰基化合物(Dicarbonylcompounds,DCs)同步生成规律及对应风味物质的影响。方法:采用邻苯二胺衍生结合HPLC同步测定了葡萄糖-丙氨酸体系中的乙二醛(Glyoxal,GO)、丙酮醛(Methylglyoxal,MGO)和3-脱氧葡萄糖醛酮(3-Deoxyglucosone,3-DG)的含量;采用SPME-GC-MS测定了体系中的5类重要风味化合物。结果:温度升高会促进DCs的生成;碱性条件不利于3-DG的生成但有利于GO和MGO的生成;增加还原糖比例有利于3-DG的生成,而增加氨基酸比例则有利于GO和MGO的生成。结论:在甜香型食品热加工过程中,需要重点关注体系中的MGO。调整加工工艺来控制DCs生成或向危害物转化时,需要重点考虑对酮类和吡嗪类风味物质的影响。Abstract: Objective: To investigate the effects of different thermal reaction conditions (temperature, pH, reaction time and substrate molar ratio) on the simultaneous generation pattern of 3 important dicarbonyl compounds (DCs) and the corresponding flavor substances in the glucose-alanine model system. Methods: The contents of glyoxal (GO), methylglyoxal (MGO) and 3-deoxyglucuronide (3-DG) in the glucose-alanine system were determined synchronously using o-phenylenediamine derivatization coupled with HPLC, and 5 types of important flavor compounds in the system were determined using SPME-GC-MS. Results: Increasing temperature promoted the production of DCs. Alkaline conditions were unfavorable to 3-DG but favorable to GO and MGO. Increasing the proportion of reducing sugars favored the production of 3-DG, while increasing the proportion of amino acids favored the production of GO and MGO. Conclusion: During the thermal processing of sweet and aromatic foods, the MGO in the system should be focused on. When adjusting the processing technology to control the generation of DCs or the conversion to hazardous substances, it was necessary to focus on the impact on ketone and pyrazine flavor substances.
-
Keywords:
- glucose /
- alanine /
- Maillard reaction /
- model system /
- dicarbonyl compounds /
- processing conditions /
- flavor substances
-
美拉德反应是一类在食品热加工过程中由还原糖和氨基酸、蛋白质等之间发生的非酶促羰氨反应。由于美拉德反应可赋予食品优良的感官特性(风味、色泽等),人们可利用美拉德反应制备各种美味的食物。在非酶促褐变的过程中,会生成醛类、酮类、呋喃类和吡嗪类等一系列复杂的风味化合物,对于不同氨基酸参与的反应体系,其特征风味也不同。例如,葡萄糖-半胱氨酸体系呈现鸡肉味;葡萄糖-甘氨酸体系会产生焦糖风味[1];葡萄糖-甲硫氨酸体系呈现煎炸后的马铃薯味[2]。而对于还原糖-丙氨酸体系,则会生成类似花果的甜香味,其主要风味物质是丙酮和5-茚醇[3]。因此,甜香型热反应香精的制备往往会使用丙氨酸。然而,美拉德反应在提高食品食用价值的同时,也会产生丙烯酰胺、晚期糖基化终末产物、4-甲基咪唑等一系列危害物[4]。
α-二羰基化合物(α-Dicarbonyl compounds,DCs)是一类在食品热处理或储存过程中产生的重要中间物质,其可通过美拉德反应[5]、焦糖化反应[6]或脂质过氧化反应[7]等途径生成。目前,在食品体系中已检测到十余种DCs,其中乙二醛(Glyoxal,GO)、丙酮醛(Methylglyoxal,MGO)和3-脱氧葡萄糖醛酮(3-Deoxyglucuronide,3-DG)是美拉德反应中产生的最重要的3种二羰基化合物中间体[8]。在美拉德反应过程中,DCs可与氨基酸残基或肽反应生成具有特征风味的吡嗪酮类化合物[9];环化的葡萄糖醛酮和GO或MGO均可相互作用生成呋喃酮[10],这在食品风味中发挥了重要的作用。与此同时,这些活性二羰基中间体也可向有害物质转变。GO和MGO可修饰赖氨酸,分别形成羧甲基赖氨酸和羧乙基赖氨酸[11−12],这两种晚期糖基化终末产物的摄入可增加人们罹患糖尿病等各种慢性疾病的风险[13−14];MGO可在氨的作用下直接生成或经过羟基丙酮转化为2-氨基丙醛,进一步脱水形成4-甲基咪唑[15]。4-甲基咪唑是一种潜在的致癌物,国际癌症研究机构(International Agency for Research on Cancer,IARC)已将其标记为2B类致癌物(可能对人类致癌)[4,16]。此外,这些高活性的DCs还是丙烯酰胺[17]、羟甲基糠醛[18]等其他危害物的关键中间体。
目前,已有国内外学者报道了还原糖-氨基酸美拉德反应模拟体系中DCs的测定方法[19]、生成规律[20−22]以及其向丙烯酰胺[23]、杂环胺[24]等危害物的转变,但加工条件对多种DCs同步生成规律的影响以及对风味物质的影响还研究较少。本文研究了葡萄糖-丙氨酸甜香型美拉德反应模拟体系中GO、MGO和3-DG在不同热反应条件(温度、pH、反应时间和底物摩尔比)下的同步生成规律,并测定了在同一条件下其中风味物质的含量。本研究可为食品热加工过程中基于阻断关键中间体的危害物抑制策略提供一些参考,也可为低危害物含量的热反应香精等热加工食品的制备提供理论依据。
1. 材料与方法
1.1 材料与仪器
葡萄糖、丙氨酸、十二水合磷酸氢二钠、二水合磷酸二氢钠、氢氧化钠、盐酸、邻苯二胺(化学纯) 分析纯,国药集团化学试剂有限公司;GO、MGO、3-DG、喹喔啉、2-甲基喹喔啉、2-(2,3,4-三羟基丁基)-喹喔啉 纯度≥98%,北京百灵威科技有限公司;甲酸、甲醇 色谱纯,美国Sigma-Aldrich公司。
Alliance 2695型高效液相色谱仪 美国Waters公司;HH-S型数显恒温油浴锅 常州国宇仪器公司;Smart-S2-30DH型超纯水机 南京易普易达公司;FE20 SevenEasy型pH计、PL2002型分析天平 瑞士Mettler Toledo公司。
1.2 实验方法
1.2.1 热反应条件对葡萄糖-丙氨酸模拟体系中DCs生成量的影响
1.2.1.1 温度对DCs生成量的影响
称取一定量的葡萄糖和丙氨酸加入磷酸盐缓冲溶液中,使其最终浓度均为0.2 mol/L,用1 mol/L的NaOH和1 mol/L的HCl调节到pH7,分别于80、90、100、110、120、130、140 ℃下反应120 min后立即置于冰水混合物中终止反应,收集反应液保存待测。每组样品做3个平行。
1.2.1.2 pH对DCs生成量的影响
称取一定量的葡萄糖和丙氨酸加入磷酸盐缓冲溶液中,使其最终浓度均为0.2 mol/L,用1 mol/L的NaOH和1 mol/L的HCl分别调节到pH5、6、7、8、9,于120 ℃下反应120 min后立即置于冰水混合物中终止反应,收集反应液保存待测。每组样品做3个平行。
1.2.1.3 反应时间对DCs生成量的影响
称取一定量的葡萄糖和丙氨酸加入磷酸盐缓冲溶液中,使其最终浓度均为0.2 mol/L,用1 mol/L的NaOH和1 mol/L的HCl调节到pH7,分别于120 ℃下反应10、20、30、60、90、120 min后立即置于冰水混合物中终止反应,收集反应液保存待测。每组样品做3个平行。
1.2.1.4 底物摩尔比对DCs生成量的影响
分别称取一定量的葡萄糖和丙氨酸加入磷酸盐缓冲溶液中,使葡萄糖和丙氨酸的物质的量之比分别为1:1,1:3和3:1,并确保其最终浓度之和为0.4 mol/L,用1 mol/L的NaOH和1 mol/L的HCl调节到pH7,分别于120 ℃下反应120 min后立即置于冰水混合物中终止反应,收集反应液保存待测。每组样品做3个平行。
1.2.2 葡萄糖-丙氨酸模拟体系中DCs的测定
1.2.2.1 DCs测定方法学考察
分别配制浓度为2 mmol/L的喹喔啉(GO的衍生物)、2-甲基喹喔啉(MGO的衍生物)和2-(2,3,4-三羟基丁基)-喹喔啉(3-DG的衍生物)标准贮备溶液,实验开始前分别稀释至0.005、0.01、0.05、0.1、0.2、0.5、1.0 mmol/L作为标准工作溶液,涡旋15 s使其充分均匀后过0.22 μm有机系针头式过滤器,HPLC进样检测并绘制标准曲线,根据标准曲线确定线性范围和决定系数(R2)。检测限(LOD)为峰高3倍于噪声时对应的浓度,定量限(LOQ)为峰高10倍于噪声时对应的浓度。
1.2.2.2 衍生前处理
实验开始前配制0.05 mol/L的邻苯二胺水溶液。用移液器吸取100 μL模拟体系反应液与200 μL邻苯二胺水溶液混合,涡旋30 s充分均匀,置于室温避光环境下衍生2 h,过0.22 μm有机系针头式过滤器,保存滤液待HPLC进样分析。
1.2.2.3 GO、MGO和3-DG的HPLC同步测定
色谱柱:Agilent LiChrospher C18柱(250 mm×4.6 mm,5 μm);柱温:40 ℃;紫外检测波长:320 nm;进样量:10 μL;流速:1 mL/min;流动相A:0.1%甲酸水溶液,流动相B:色谱甲醇,采用梯度洗脱方式,程序见表1。
表 1 梯度洗脱程序Table 1. Gradient elution program时间(min) A(%) B(%) 0 70 30 10 40 60 12 70 30 15 70 30 1.2.3 葡萄糖-丙氨酸模拟体系反应液中风味物质的测定
1.2.3.1 固相微萃取前处理
在20 mL顶空瓶中加入6 mL葡萄糖-丙氨酸模拟体系反应液,同时加入10 μL 2-辛醇(2 μg/mL)作为内标。将顶空瓶置于恒温磁力搅拌器上于50 ℃加热并搅拌,插入萃取头萃取富集45 min后拔出,置于GC-MS进样口中启动分析程序,解吸10 min后移出萃取头。
1.2.3.2 GC-MS分析
GC条件:色谱柱:采用DB-WAX(30 m×0.25 mm,0.25 μm)熔融石英毛细管柱;进样口温度:260 ℃;载气:He,流速:1.0 mL/min;不分流进样;升温程序:起始温度35 ℃保持5 min,然后以5 ℃/min的速率升温到230 ℃并保持7 min。
MS条件:电离方式:EI;离子源温度:220 ℃;电子能量:70 eV;接口温度:250 ℃;采集方式:全扫描模式,扫描范围:30.0~400.0 m/z。根据相对保留指数LRI与WILEY138数据库比对结果对风味化合物进行定性。
1.2.3.3 风味物质归类
将1.2.4.2中所检测到的关键风味物质按化合物类型分为醛类、酮类、呋喃类、呋喃酮类和吡嗪类,每一类的风味物质浓度即为该分类下所有风味化合物浓度的总和。
1.3 数据处理
试验数据采用平均值±相对标准偏差表示,使用Masslynx 4.1软件进行液相色谱图分析和峰面积积分计算。GC-MS数据使用Xcalibur软件在NIST08标准质谱库中匹配,未知化合物经计算机检索,同时与NIST谱库(107k Compounds)和Wiley谱库(320k Compounds, version 6.0)匹配。使用SPSS 17.0对数据之间的相关性进行分析。本文中的图片使用Origin 9.0和Excel 2010绘制。标准曲线和DCs含量的计算使用Excel 2010。
2. 结果与分析
2.1 方法学验证
3种DCs的线性范围、R2、LOD和LOQ如表2所示。3种化合物的R2均大于0.998,说明标准曲线的线性拟合度高,可用于准确计算含量。平行实验数值的RSD在2.04%~5.05%之间,表明本方法的精密度和重现性较好。以上方法学验证结果表明本实验的HPLC方法适合用于美拉德模拟体系反应液中DCs的同步测定。
表 2 3种DCs的HPLC分析方法学验证结果Table 2. Analytical characteristics results of HPLC analysis of three DCsDCs 线性范围
(mmol/L)R2 LOD
(×10−5 mmol/L)LOQ
(×10−5 mmol/L)RSD
(%)GO 0.0047~1.0102 0.9981 0.5044 3.1323 5.05 MGO 0.0049~1.0377 0.9985 2.8021 27.1086 3.84 3-DG 0.0050~1.0296 0.9991 1.1063 17.5623 2.04 2.2 温度对葡萄糖-丙氨酸模拟体系中DCs生成量和风味物质的影响
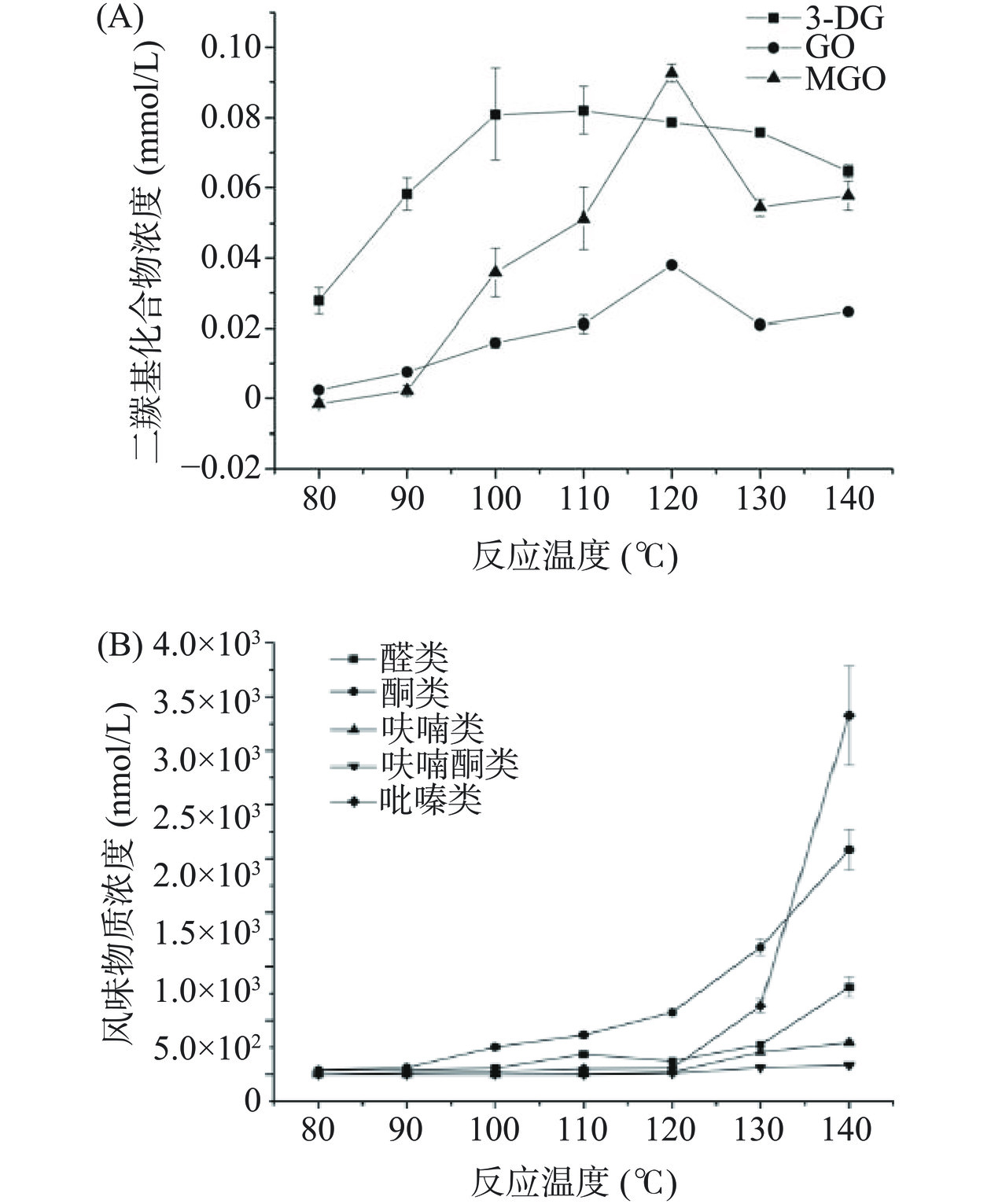
温度直接影响着化学反应速率,从而对中间产物和终产物的含量产生较大影响。图1(A)展示了温度对葡萄糖-丙氨酸模拟体系中DCs生成量的影响。可以看出,3种DCs的生成规律有明显差异。3-DG浓度在80~100 ℃内持续上升,高于100 ℃时生成速率明显降低,处于生成和降解的动态平衡,超过110 ℃时其含量开始缓慢下降。GO和MGO在80~90 ℃内的生成速率较低,高于90 ℃时,GO的生成速率几乎不变,但MGO的生成速率显著增加。120 ℃时,GO和MGO的生成量达到了最大值,分别为0.0350和0.0900 mmol/L。这说明,温度升高会促进3-DG、GO和MGO的生成,温度高于110 ℃时3-DG会加速降解,高于120 ℃时GO、MGO则被抑制。这可能是由于温度较高时,3-DG向乙酸的转化加速,造成其生成量表现减小[25]。
温度对葡萄糖-丙氨酸模拟体系中主要风味物质的影响如图1(B)所示。可以看出,反应体系中醛、酮、呋喃、呋喃酮和吡嗪5大类主要挥发性成分生成量在80~120 ℃的温度范围内增加缓慢,酮类物质的总量要高于其他几类物质的含量。当温度高于120 ℃时,醛类、酮类、吡嗪类物质的生成量开始显著(P<0.05)增加,其中吡嗪类物质的增速最为明显,140 ℃时其生成量达到3.3290 μg/L,而呋喃、呋喃酮类物质在温度高于120 ℃时呈缓慢增加趋势,在80~140 ℃的温度范围内的总体生成量较低。结果表明,温度的升高会促进主要风味物质的生成,美拉德反应速度的加快可能促进了DCs等中间体向挥发性风味物质的转化,但温度的升高对呋喃及呋喃酮类物质生成量的影响很低,这可能是由于温度升高时,促进了葡萄糖醛酮向还原酮以及脱氢还原酮类物质的转化,进一步促进还原酮类的逆羟醛缩合以及Strecker降解,抑制了呋喃及呋喃酮类物质的生成[26]。
2.3 pH对葡萄糖-丙氨酸模拟体系中DCs生成量和风味物质的影响
图2(A)展示了体系初始pH对葡萄糖-丙氨酸模拟体系中DCs生成量的影响。可以看到3-DG在酸性条件下(pH5~6)的生成速率很快,当体系pH逐渐增加时,其浓度开始逐渐降低,直到pH达到8时开始趋于稳定。GO和MGO的生成量随着pH的增加而缓慢增加,总体上在碱性条件下的生成速率高于酸性条件。结果表明,碱性条件不利于3-DG的生成,但对GO和MGO并没有明显的影响,反而会促进MGO和GO的生成。可能的原因是在较高的pH条件下Amadori产物2,3-烯醇化的程度增强,抑制了3-DG的生成,促进了GO和MGO的生成[27]。
体系初始pH对葡萄糖-丙氨酸模拟体系中主要风味物质的影响如图2(B)所示。醛、酮、呋喃、呋喃酮和吡嗪等5类风味物质的生成量随着pH的增加整体呈现增长趋势,其中酮类物质的生成量最大,增速较快。醛类物质在pH5~7的过程中的生成量出现了缓慢降低,而在pH高于7时会加速生成。当pH达到9时,各类化合物的生成量达到最大值。以上结果说明,pH的增加会促进酮类、呋喃类和吡嗪类物质的生成,中性条件不利于醛类物质的生成,而呋喃酮类物质在pH变化的过程中生成量并没有明显的变化。Yu等[28]对抗坏血酸-苏氨酸模拟体系的研究发现,pH在5~9.55范围内升高时,吡嗪类物质的总量也在一直增加,本研究与之结果一致。这可能是由于吡嗪类化合物形成的主要途径是由DCs与氨基酸之间的反应,而氨基酸活性受溶液pH影响[29],因此当体系pH上升时,氨基酸反应活性的增加导致吡嗪类化合物的持续累积。
2.4 反应时间对葡萄糖-丙氨酸模拟体系中DCs生成量和风味物质的影响
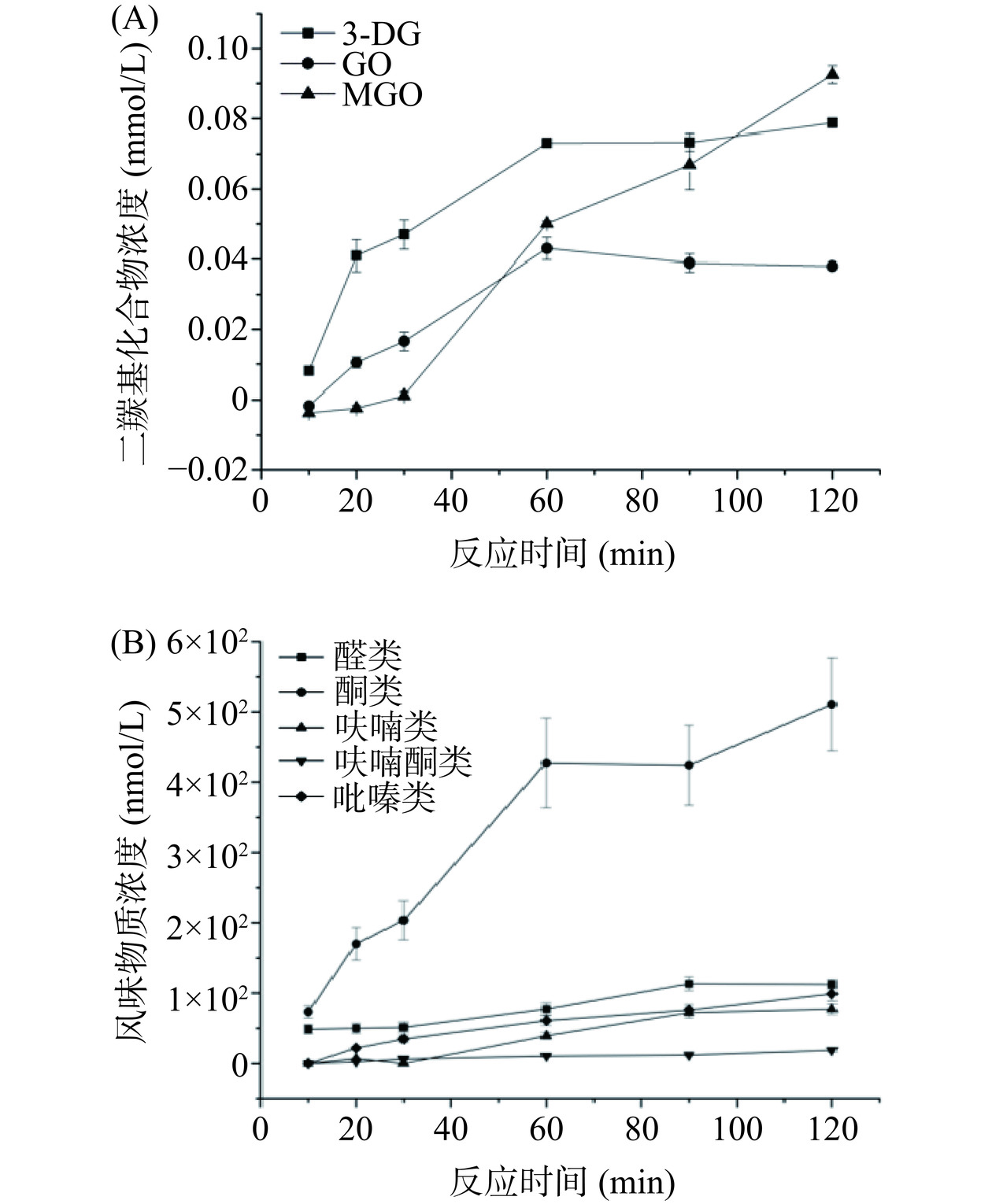
反应时间决定着底物向中间产物和终产物的转化程度。图3(A)展示了反应时间对葡萄糖-丙氨酸模拟体系中DCs生成量的影响。可见3-DG与MGO的生成量都随着反应时间的延长逐渐增加。在反应初始阶段3-DG的含量高于MGO,同时累积速率也更快,30 min后,MGO的生成速率开始高于3-DG。60 min时,3-DG的生成速率开始下降,其浓度开始趋于平衡,达到0.080 mmol/L左右;而MGO的生成速率仍然较快。120 min时,MGO含量达到0.093 mmol/L,为3种DCs中的最高。对于GO,在0~60 min内持续累积,在60 min达到最大值0.430 mmol/L,超过60 min时,其含量开始缓慢降低。上述结果表明,GO的含量比3-DG和MGO更快达到动态平衡。在美拉德反应过程中,GO来自于3-DG C2-C3链的裂解[30],当反应时间达到60 min时,GO与游离氨基发生Strecker降解的速度[31]开始增加,这可能导致了后续GO浓度的降低。
反应时间对葡萄糖-丙氨酸模拟体系中主要风味物质的影响如图3(B)所示。可以看出反应时间对酮类物质的影响明显高于其他4类风味物质,酮类随反应时间的积累较快,生成量也最高,而醛类、呋喃类、呋喃酮类和吡嗪类物质的累积则较为缓慢。反应时间达到120 min时,总挥发性酮类的生成量达到509.6 nmol/L,醛类生成量为113.3 nmol/L,吡嗪类生成量为98.23 nmol/L,呋喃类生成量为81.56 nmol/L,呋喃酮的生成量最低,仅为17.39 nmol/L,且其含量几乎不随时间变化。造成这些差异的可能原因是还原酮的逆羟醛缩合反应随着时间延长保持快速进行,造成酮类物质的迅速累积;而还原酮和脱氢还原酮主要向羟醛缩合及Strecker降解路径反应,造成由NH3参与的呋喃酮生成路径受到限制,导致呋喃酮的生成量很少[26]。
2.5 底物摩尔比对葡萄糖-丙氨酸模拟体系中DCs生成量和风味物质的影响
图4(A)展示了底物摩尔比对葡萄糖-丙氨酸模拟体系中DCs生成量的影响。随着葡萄糖在体系中比例的上升,3-DG的生成量也持续增加,在葡萄糖和丙氨酸摩尔比为3:1时生成量最高,为0.1020 mmol/L。MGO的生成量在摩尔比为1:3时达到最高,在1:1时达到最低。GO则在摩尔比为1:1时生成量达到最高,在3:1时达到最低。总体来看,MGO的生成量最高,GO的生成量最低。以上结果说明还原糖在体系中占比的增加会促进3-DG的生成,而氨基酸在体系中占比的增加则会促进GO和MGO的生成。这可能是由于氨基酸的含量较高时会抑制3-DG的降解[25],从而导致3-DG含量的增加,而3-DG裂解为GO和MGO途径的抑制也会同时减少GO和MGO的生成。
底物摩尔比对葡萄糖-丙氨酸模拟体系中主要风味物质的影响如图4(B)所示。从图中可以看出,酮类、吡嗪类物质的生成量随葡萄糖和丙氨酸摩尔比的上升而下降,醛类物质生成量在葡萄糖和丙氨酸摩尔比为1:1时达到最低。呋喃类物质在摩尔比为1:3和1:1时的生成量基本一致,而当体系中葡萄糖含量进一步上升时,呋喃类物质的生成量明显提升。呋喃酮类物质的生成量几乎不受底物摩尔比的影响。结果表明,葡萄糖-丙氨酸体系中还原糖比例的增加不利于吡嗪类、酮类的生成,但是有利于呋喃类物质的生成;还原糖和氨基酸比例接近时不利于醛类物质的生成。当体系中还原糖的比例提高时,由氨基酸参加的Strecker降解生成醛类以及吡嗪类物质的反应会有所减缓[32],导致它们的生成量表现出降低。Hollnagel等[33]的研究发现,同样反应120 min,当体系中存在甘氨酸时,葡萄糖的降解程度比不存在甘氨酸增加了20%,而呋喃类物质来自于糖类重排产物的环化反应,因此还原糖比例的增加可能会促进其生成[34]。
3. 结论
考察了4种热反应条件(温度、pH、反应时间和底物摩尔比)对葡萄糖-丙氨酸美拉德反应模拟体系中3种DCs(GO、MGO和3-DG)以及5类风味物质生成规律的影响。总体来看,在各种加工条件下,MGO的生成量基本均高于GO和3-DG,是3种DCs中最易生成的。因此,在依赖美拉德反应的食品热加工过程中,需要重点关注体系中的MGO含量,控制其向丙烯酰胺、晚期糖基化终末产物和4-甲基咪唑等危害物的转化。在5大类风味物质中,酮类和吡嗪类受加工条件的影响较大,因此,为了保持产品的风味和品质,在调整加工工艺来控制危害物中间体的过程中,需要重点考虑其对酮类和吡嗪类风味物质的影响。本研究可为美拉德反应体系中各种DCs的同步生成规律提供更全面的理解,并为香精等热加工食品制备过程中基于共有关键中间体的危害物减控和品质保证提供理论基础和实验依据。在甜香型食品实际体系中,DCs与风味物质的关联有待进一步研究。
-
表 1 梯度洗脱程序
Table 1 Gradient elution program
时间(min) A(%) B(%) 0 70 30 10 40 60 12 70 30 15 70 30 表 2 3种DCs的HPLC分析方法学验证结果
Table 2 Analytical characteristics results of HPLC analysis of three DCs
DCs 线性范围
(mmol/L)R2 LOD
(×10−5 mmol/L)LOQ
(×10−5 mmol/L)RSD
(%)GO 0.0047~1.0102 0.9981 0.5044 3.1323 5.05 MGO 0.0049~1.0377 0.9985 2.8021 27.1086 3.84 3-DG 0.0050~1.0296 0.9991 1.1063 17.5623 2.04 -
[1] 钱敏, 白卫东, 赵文红, 等. 不同氨基酸和糖对美拉德反应产物的影响[J]. 食品科学,2016,37(13):31−35. [QIAN M, BAI W D, ZHAO W H, et al. Effects of amino acids and reducing sugars on Maillard reaction products[J]. Food Science,2016,37(13):31−35.] doi: 10.7506/spkx1002-6630-201613006 QIAN M, BAI W D, ZHAO W H, et al. Effects of amino acids and reducing sugars on Maillard reaction products[J]. Food Science, 2016, 37(13): 31−35. doi: 10.7506/spkx1002-6630-201613006
[2] WONG K, AZIZ S, MOHAMED S. Sensory aroma from Maillard reaction of individual and combinations of amino acids with glucose in acidic conditions[J]. International Journal of Food Science and Technology,2008,43(9):1512−1519. doi: 10.1111/j.1365-2621.2006.01445.x
[3] 冯涛, 赵宇, 张治文, 等. L-阿拉伯糖与氨基酸美拉德反应挥发性风味物质分析[J]. 食品科学,2019,40(8):213−217. [FENG T, ZHAO Y, ZHANG Z W, et al. Analysis and formation mechanism of volatile flavor substances in Maillard reaction products from L-arabinose and amino acid[J]. Food Science,2019,40(8):213−217.] doi: 10.7506/spkx1002-6630-20180420-271 FENG T, ZHAO Y, ZHANG Z W, et al. Analysis and formation mechanism of volatile flavor substances in Maillard reaction products from L-arabinose and amino acid[J]. Food Science, 2019, 40(8): 213−217. doi: 10.7506/spkx1002-6630-20180420-271
[4] 王起帆, 何志勇, 王召君, 等. 热反应香精制备过程伴随危害物的形成规律与抑制途径研究进展[J]. 食品安全质量检测学报,2023,14(3):78−87. [WANG Q F, HE Z Y, WANG Z J, et al. Research progress on the formation and inhibition pathways of the harmful substances accompanying the preparation of thermal reaction flavorings[J]. Journal of Food Safety & Quality,2023,14(3):78−87.] doi: 10.3969/j.issn.2095-0381.2023.3.spaqzljcjs202303010 WANG Q F, HE Z Y, WANG Z J, et al. Research progress on the formation and inhibition pathways of the harmful substances accompanying the preparation of thermal reaction flavorings[J]. Journal of Food Safety & Quality, 2023, 14(3): 78−87. doi: 10.3969/j.issn.2095-0381.2023.3.spaqzljcjs202303010
[5] WEENEN H. Reactive intermediates and carbohydrate fragmentation in Maillard chemistry[J]. Food Chemistry,1998,62(4):393−401. doi: 10.1016/S0308-8146(98)00074-0
[6] MOTTRAM D, WEDZICHA B, DODSON A. Acrylamide is formed in the Maillard reaction[J]. Nature,2002,419(6906):448−449. doi: 10.1038/419448a
[7] WANG Y, HU H, MCCLEMENTS D, et al. pH and lipid unsaturation impact the formation of acrylamide and 5-hydroxymethylfurfural in model system at frying temperature[J]. Food Research International,2019,123:403−413. doi: 10.1016/j.foodres.2019.05.001
[8] AMOROSO A, MAGA G, DAGLIA M. Cytotoxicity of α-dicarbonyl compounds submitted to in vitro simulated digestion process[J]. Food Chemistry,2013,140(4):654−659. doi: 10.1016/j.foodchem.2012.10.063
[9] WANG Y, HO C. Flavour chemistry of methylglyoxal and glyoxal[J]. Chemical Society Reviews,2012,41(11):4140−4149. doi: 10.1039/c2cs35025d
[10] WANG Y, HO C. Formation of 2,5-dimethyl-4-hydroxy-3(2H)-furanone through methylglyoxal:A Maillard reaction intermediate[J]. Journal of Agricultural and Food Chemistry,2008,56(16):7405−7409. doi: 10.1021/jf8012025
[11] VAN NGUYEN C. Toxicity of the AGEs generated from the Maillard reaction:On the relationship of food-AGEs and biological-AGEs[J]. Molecular Nutrition & Food Research,2006,50(12):1140−1149.
[12] XUE C, SHI Z, HE Z, et al. Formation of three selected AGEs and their corresponding intermediates in aldose- and ketose-lysine systems[J]. eFood,2020,1(3):270−278. doi: 10.2991/efood.k.200508.001
[13] NIE C, LI Y, QIAN H, et al. Advanced glycation end products in food and their effects on intestinal tract[J]. Critical Reviews in Food Science and Nutrition,2022,62(11):3103−3115. doi: 10.1080/10408398.2020.1863904
[14] FOTHERINGHAM A, GALLO L, BORG D, et al. Advanced glycation end products (AGEs) and chronic kidney disease:does the modern diet AGE the kidney?[J]. Nutrients,2022,14(13):2675. doi: 10.3390/nu14132675
[15] MOON J, SHIBAMOTO T. Formation of carcinogenic 4(5)-methylimidazole in maillard reaction systems[J]. Journal of Agricultural and Food Chemistry,2011,59(2):615−618. doi: 10.1021/jf104098a
[16] AKBARI N, SHAFAROODI H, JAHANBAKHSH M, et al. 4-Methylimidazole, a carcinogenic component in food, amount, methods used for measurement:A systematic review[J]. Food Chemistry X,2023,18:100739. doi: 10.1016/j.fochx.2023.100739
[17] YE H, MIAO Y, ZHAO C, et al. Acrylamide and methylglyoxal formation in potato chips by microwaving and frying heating[J]. International Journal of Food Science and Technology,2011,46(9):1921−1926. doi: 10.1111/j.1365-2621.2011.02702.x
[18] 张泽宇, 曹雁平, 朱雨辰. 缓解食品中丙烯酰胺和5-羟甲基糠醛形成的研究进展[J]. 食品工业科技,2020,41(12):324−333. [ZHANG Z Y, CAO Y P, ZHU Y C, et al. Mitigation strategies on acrylamide and 5-hydroxymethylfurfural in foods[J]. Science and Technology of Food Industry,2020,41(12):324−333.] ZHANG Z Y, CAO Y P, ZHU Y C, et al. Mitigation strategies on acrylamide and 5-hydroxymethylfurfural in foods[J]. Science and Technology of Food Industry, 2020, 41(12): 324−333.
[19] CHEN X, KITTS D. Identification and quantification of α-dicarbonyl compounds produced in different sugar-amino acid Maillard reaction model systems[J]. Food Research International,2011,44(9):2775−2782. doi: 10.1016/j.foodres.2011.06.002
[20] PFEIFER Y, KROH L. Investigation of reactive α-dicarbonyl compounds generated from the Maillard reactions of L-methionine with reducing sugars via their stable quinoxaline derivatives[J]. Journal of Agricultural and Food Chemistry,2010,58(14):8293−8299. doi: 10.1021/jf1008988
[21] ZHANG L, SUN Y, PU D, et al. Kinetics of alpha-dicarbonyl compounds formation in glucose-glutamic acid model of Maillard reaction[J]. Food Science & Nutrition,2021,9(1):290−302.
[22] 卢永翎, 肖留榜, 夏秋琴, 等. 精氨酸—还原糖体系中1,2-二羰基化合物的形成和抑制研究[J]. 食品与机械,2018,34(10):1−7. [LU Y L, XIAO L B, XIA Q Q, et al. Study on the formation and elimination mechanism of 1,2-dicarbonyl compounds in arginine-reducing sugar system[J]. Food & Machinery,2018,34(10):1−7.] LU Y L, XIAO L B, XIA Q Q, et al. Study on the formation and elimination mechanism of 1,2-dicarbonyl compounds in arginine-reducing sugar system[J]. Food & Machinery, 2018, 34(10): 1−7.
[23] YUAN Y, ZHAO G, CHEN F, et al. Correlation of methylglyoxal with acrylamide formation in fructose/asparagine Maillard reaction model system[J]. Food Chemistry,2008,108(3):885−890. doi: 10.1016/j.foodchem.2007.11.054
[24] 史海鹏. 模拟体系中α-二羰基化合物参与的Harman和Norharman生成规律及机理研究[D]. 天津:天津科技大学, 2019. [SHI H P. Study on the formation law and mechanism of Harman and Norharman participated in α-dicarbonyl compounds in simulation system[D]. Tianjin:Tianjin University of Science and Technology, 2019.] SHI H P. Study on the formation law and mechanism of Harman and Norharman participated in α-dicarbonyl compounds in simulation system[D]. Tianjin: Tianjin University of Science and Technology, 2019.
[25] MARTINS S, VAN BOEKEL M. A kinetic model for the glucose/glycine Maillard reaction pathways[J]. Food Chemistry,2005,90(1-2):257−269. doi: 10.1016/j.foodchem.2004.04.006
[26] VAN BOEKEL M. Formation of flavour compounds in the Maillard reaction[J]. Biotechnology Advances,2006,24(2):230−233. doi: 10.1016/j.biotechadv.2005.11.004
[27] GAO Y, MIAO J, LAI K. Study on Maillard reaction mechanism by quantum chemistry calculation[J]. Journal of Molecular Modeling,2023,29(3):81. doi: 10.1007/s00894-023-05484-w
[28] YU A, ZHANG A. The effect of pH on the formation of aroma compounds produced by heating a model system containing L-ascorbic acid with L-threonine/L-serine[J]. Food Chemistry,2010,119(1):214−219. doi: 10.1016/j.foodchem.2009.06.026
[29] MEYNIER A, MOTTRAM D. The effect of pH on the formation of volatile compounds in meat-related model systems[J]. Food Chemistry,1995,52(4):361−366. doi: 10.1016/0308-8146(95)93282-V
[30] HOFMANN T. Quantitative studies on the role of browning precursors in the Maillard reaction of pentoses and hexoses with L-alanine[J]. European Food Research and Technology,1999,209(2):113−121. doi: 10.1007/s002170050468
[31] LIU M, YU J, ZHOU T, et al. Formation priority of pyrazines and 2-acetylthiazole dependent on the added cysteine and fragments of deoxyosones during the thermal process of the glycine-ribose amadori compound[J]. Journal of Agricultural and Food Chemistry,2022,70(37):11643−11651. doi: 10.1021/acs.jafc.2c04874
[32] JOUSSE F, JONGEN T, AGTEROF W, et al. Simplified kinetic scheme of flavor formation by the Maillard reaction[J]. Journal of Food Science,2002,67(7):2534−2542. doi: 10.1111/j.1365-2621.2002.tb08772.x
[33] HOLLNAGEL A, KROH L. Degradation of oligosaccharides in nonenzymatic browning by formation of α-dicarbonyl compounds via a “peeling off” mechanism[J]. Journal of Agricultural and Food Chemistry,2000,48(12):6219−6226. doi: 10.1021/jf9906127
[34] 杜卿卿, 彭增起, 任晓镤, 等. 110 ℃下木糖-半胱氨酸美拉德反应模型风味物质及杂环胺的形成[J]. 食品工业科技,2020,41(12):21−28. [DU Q Q, PENG Z Q, REN X P, et al. Development of flavor substances and heterocyclic amines by Maillard reaction models of xylose-cysteine at 110 ℃[J]. Science and Technology of Food Industry,2020,41(12):21−28.] DU Q Q, PENG Z Q, REN X P, et al. Development of flavor substances and heterocyclic amines by Maillard reaction models of xylose-cysteine at 110 ℃[J]. Science and Technology of Food Industry, 2020, 41(12): 21−28.





 下载:
下载:


 下载:
下载:
