Regulation of Calcium Absorption in Caco-2 Cells by Aspartic Acid, Glutamic Acid and Their Glycine Dipeptides
-
摘要: 为了探究天冬氨酸和谷氨酸及其甘氨酸二肽对钙离子吸收的影响机理,本文利用等温滴定量热技术、电化学、Caco-2细胞模型结合量子化学计算(密度泛函理论)对天冬氨酸和谷氨酸及其甘氨酸二肽与钙离子的相互作用进行了探究。结果表明,天冬氨酸和谷氨酸通过焓和熵驱动的放热反应与钙离子形成复合物,而其形成的二肽则是通过熵驱动的吸热反应与钙离子结合。此外,二肽比单独的氨基酸表现出更强的钙离子结合能力。量子化学计算表明,氨基酸/二肽中的羧基为钙离子的主要结合位点,在碱性条件下,会导致钙离子结合位点转移,氨基也可以参与钙离子结合。Caco-2细胞吸收实验表明,天冬氨酸和谷氨酸及其二肽均可促进钙的吸收,其中甘氨酸-谷氨酸二肽(Gly-Glu)的促进效果最好,促钙吸收率为1.33±0.115。此外,促钙吸收能力与钙离子结合能力之间没有明确的相关性,与其电子亲和力的关系更为密切。研究结果解释了天冬氨酸、谷氨酸及其甘氨酸二肽与钙之间的相互作用,为进一步开发钙补充剂提供科学依据。Abstract: In order to investigate the mechanism of aspartic acid, glutamic acid and their glycine dipeptides on calcium ion uptake, the isothermal titration calorimetry technique, electrochemistry, and Caco-2 cell model combined with quantum mechanical calculation (density functional theory) were used to investigate the interactions between aspartic acid and glutamic acid, as well as their glycine dipeptides. The results showed that aspartic acid and glutamic acid form complexes with calcium ions through exothermic reactions driven by enthalpy and entropy, while their dipeptides interacted with calcium ions by entropy-driven endothermic reactions. In addition, dipeptides exhibited stronger calcium binding capacity than the single amino acids. Quantum chemical calculations showed that the carboxyl groups in the amino acid/dipeptide were the main binding site of calcium ions, while under alkaline conditions, the amino group could also participate in calcium binding, leading to a calcium binding site shift. Caco-2 cell uptake experiments showed that aspartic acid, glutamic acid and their dipeptides could promote calcium absorption. Among them, Gly-Glu dipeptide had the best promotion effect, and the calcium absorption rate was 1.33±0.115. Furthermore, there was no clear correlation between the ability to promote calcium absorption and the ability to bind calcium ions. However, it was more closely related to its electron affinity. The results elucidated the interactions between aspartic acid, glutamic acid and their glycine dipeptides and calcium ions, providing scientific basis for further development of calcium supplements
-
Keywords:
- aspartic acid /
- glutamic acid /
- glycine /
- Caco-2 cell model /
- calcium absorption /
- quantum chemical calculations
-
钙是一种人体必需的矿物质元素,参与人体许多重要的生理功能,如肌肉、神经和心脏的正常运作,以及骨骼和牙齿的形成和维护[1]。为了维持人体正常的钙水平,摄入含有良好钙源的饮食(如乳制品和钙强化食品)非常重要[2]。然而缺钙引起的骨质疏松症却影响着全球数百万人,尤其是女性和老年人更容易患上骨质疏松症,而且风险会随着年龄的增长而增加[3−4]。在这种情况下,需要摄入钙补充剂来帮助人们满足对钙的需求[5]。
钙在肠道中的吸收主要通过两种途径:一种是依赖维生素D并需要能量的跨细胞途径;另一种是依赖于基于浓度梯度的被动扩散的细胞旁途径[6]。这两种途径的吸收都取决于肠道中的可溶性钙的浓度[7]。然而,可溶性钙的浓度很容易受到其他饮食因素的影响,例如磷酸盐和草酸盐,这些食物组分会与钙离子发生沉淀反应并抑制其吸收[8]。传统的钙补充剂如碳酸钙往往补钙效果不佳,因为它们更容易在肠道中沉淀,且临床研究表明,服用这些钙补充剂也会产生副作用[9−10],如对胃肠刺激性强,有引起结石的风险。近年来,研究表明食源性钙离子结合肽可有效促进钙吸收,而且不会引起不良反应[11]。另外,这些肽可以在人体内被迅速吸收,可开发成非常有前景的钙补充剂[12−13]。虽然近年来,针对钙离子结合肽的研究有了一定的进展,但是大部分集中于从各种食源性蛋白中鉴定钙离子结合肽[14−16],而对其钙离子结合机理、促钙吸收机理及其影响因素均未完全阐明。
此外,之前的研究表明相关蛋白质或者钙离子结合肽中的天冬氨酸和谷氨酸在与钙离子结合上发挥着主要作用[17]。因此,在本研究中,选择天冬氨酸、谷氨酸以及其形成的甘氨酸肽来研究与钙离子的相互作用以及对Caco-2细胞钙吸收能力的影响,并揭示其物化性质和促钙吸收率之间的相关性。本研究可为基于促钙吸收的肽设计提供有价值的信息。
1. 材料与方法
1.1 材料与仪器
甘氨酸-天冬氨酸二肽(Gly-Asp,纯度≥98%)、甘氨酸-谷氨酸二肽(Gly-Glu,纯度≥98%)、甘氨酸(纯度≥99%)、L-天冬氨酸(纯度≥98%)、L-谷氨酸(纯度≥99%)、甘氨酸钠盐水合物(纯度≥98%)、L-天冬氨酸钠盐一水合物(纯度≥99%)、L-谷氨酸单钠盐一水合物(纯度≥98%)、氯化钙六水合物(纯度≥98%) 默克Sigma-Aldrich公司;盐酸、氢氧化钠、三羟甲基氨基甲烷盐酸盐等(分析纯) 国药集团化学试剂有限公司;Caco-2细胞系 植物源功能食品北京市重点实验室保存细胞;胎牛血清、12孔Transwell细胞培养板 Corning公司;DMEM高糖培养基、DPBS缓冲液、HBSS缓冲液 北京索莱宝科技有限公司;0.25% EDTA胰蛋白酶(2500 mg/L) Thermo Fisher Scientific公司。
ME204型电子分析天平 梅特勒托利多科技(中国)有限公司;FE28型pH计 美国METTLER TOLEDO公司;Nano-ITC等温滴定量热仪 美国TA仪器公司;972124钙离子复合电极 上海仪电科学仪器股份有限公司;Millicell-ERS细胞电阻仪 默克Millipore公司。
1.2 实验方法
1.2.1 钙离子结合的热力学参数测定
氨基酸和甘氨酸二肽与钙离子结合的热力学参数测定参照之前的实验方法[18],采用带有金样品池的Nano-ITC进行等温滴定量热实验。在进行滴定前,所有样品通过脱气站脱气处理15 min。然后将氨基酸或甘氨酸二肽(0.01 mol/L,溶于0.1 mol/L pH为7.4的Tris-HCl缓冲液)注入样品池中,将氯化钙(0.1 mol/L,溶于0.1 mol/L pH为7.4的Tris-HCl缓冲液)吸入进样注射器。进样注射器以250 r/min的速度搅拌样品池中的溶液,以确保快速混合。在25 s内将2.5 μL钙注入样品池中,并留出一定时间间隔,以确保信号在两次注射之间返回到基线。然后通过将氯化钙滴定到缓冲液中进行对照实验,并将获得的信号从最终分析中减去。将所得数据通过NanoAnalyze进行分析拟合,获得其化学计量数(n)、结合常数(Ka)、熵变(ΔS)、焓变(ΔH)等热力学参数,此外,吉布斯自由能(ΔG)的计算方式如式(1):
ΔG=−RTlnKa=ΔH−TΔS (1) 1.2.2 钙离子活度测定
溶液中的钙离子活度使用钙离子选择性电极进行测定。测定前分别使用1.0×10−4、1.0×10−3以及1.0×10−2 mol/L的CaCl2标准水溶液在25 ℃下对复合钙离子选择性电极进行校准。钙离子活度aCa2+则可以根据校准溶液测量的电极电位(以mV为单位)与校准溶液的pCa= −logαCa2+之间所呈现的线性关系(能斯特方程)中计算得[19]。标准溶液中的钙离子活度αCa2+可根据活度与浓度之间的关系计算如式(2)所示:
αCa2+=[Ca2+]×γCa2+ (2) 式中,γCa2+是根据戴维斯方程计算的活度系数,如式(3)所示:
logγCa2+=−ADHz2×(√I1+√I−0.3I) (3) 式中,ADH是Debye-Hückel常数,在25 ℃时,ADH的数值为0.51;对于水溶液,z是钙离子的电荷,值为2;I是离子强度。离子强度计算如式(4)所示:
I=12∑Cz2 (4) 式中,C是离子浓度(mol/L),包括溶液中存在的所有离子浓度和调整pH所加入的NaOH。
1.2.3 量子力学-密度泛函理论计算
氨基酸与甘氨酸二肽与钙离子的结合位点以及结合后的最优构型通过密度泛函理论(DFT)计算进行研究。所有量子力学计算均使用Gaussian 16进行[20]。密度泛函理论采用Becke的三参数混合交换泛函以及Lee-Yang-Parr相关性(B3LYP)结合6-311G(d,p)基组进行几何优化和频率计算。溶剂效应则通过对可极化连续介质 (IEFPCM)模型应用积分方程形式来呈现。分析计算出的频率以确保优化的结构对应于势能超曲面上的局部最小值。
1.2.4 Caco-2细胞培养
将复苏后的Caco-2细胞接种于25 cm2透气细胞培养瓶中,加入5 mL含10%胎牛血清的DMEM培养基,置于37 ℃含5% CO2的细胞培养箱中培养24 h,待细胞贴壁后换液,用DPBS清洗细胞2~3遍并更换新鲜培养基。细胞生长至90%~100%融合状态时,加入含0.25% EDTA的胰蛋白酶1 mL消化4 min,待细胞开始大部分脱落时加入4 mL新鲜培养基终止消化,用移液枪反复吹打,使细胞呈现单个均匀分散状态后进行传代,传代比率1:5。
1.2.5 钙离子吸收实验
取对数生长期细胞(10~15代)接种在12孔Transwell细胞培养板中,接种密度为3×105~4×105/mL,上室加入0.5 mL细胞悬液,下室加入1.5 mL DMEM培养基(含10%胎牛血清,1%非必需氨基酸)。前7 d隔天换液,第8 d开始每天换液。使用Millicell-ERS细胞电阻仪测量培养在Transwell细胞培养板中的Caco-2单层细胞膜电阻值,根据公式计算细胞跨膜电阻值。当细胞跨膜电阻值高于500 Ω·cm2且相对稳定时,表明细胞已形成了致密的单层膜。吸弃旧培养基,用不含钙镁的HBSS缓冲液清洗Transwell上、下室2~3次,上室加入0.5 mL已过0.22 μm无菌滤膜的待吸收样品,下室加入1.5 mL HBSS缓冲液,置于培养箱中培养2 h后取出。从下室吸取溶液,采用电感耦合等离子发射光谱方法检测下室钙含量,并利用式(5)计算钙吸收率,式(6)计算促钙吸收率:
钙吸收率=c下室×V上室c总×V总 (5) 式中:c下室为下室钙浓度(mol/L);V下室为下室钙体积(L);c总为总钙浓度(mol/L);V总为总钙体积(L)。
促钙吸收率=样品钙吸收率氯化钙吸收率 (6) 1.3 数据处理
使用Gaussian 16进行量子化学计算,R 4.0进行主成分分析(PCA)和离子强度的迭代计算,所有数据均为3次重复的平均结果,以平均值±标准差来表示。
2. 结果与分析
2.1 氨基酸及其甘氨酸二肽结合钙离子的热力学研究
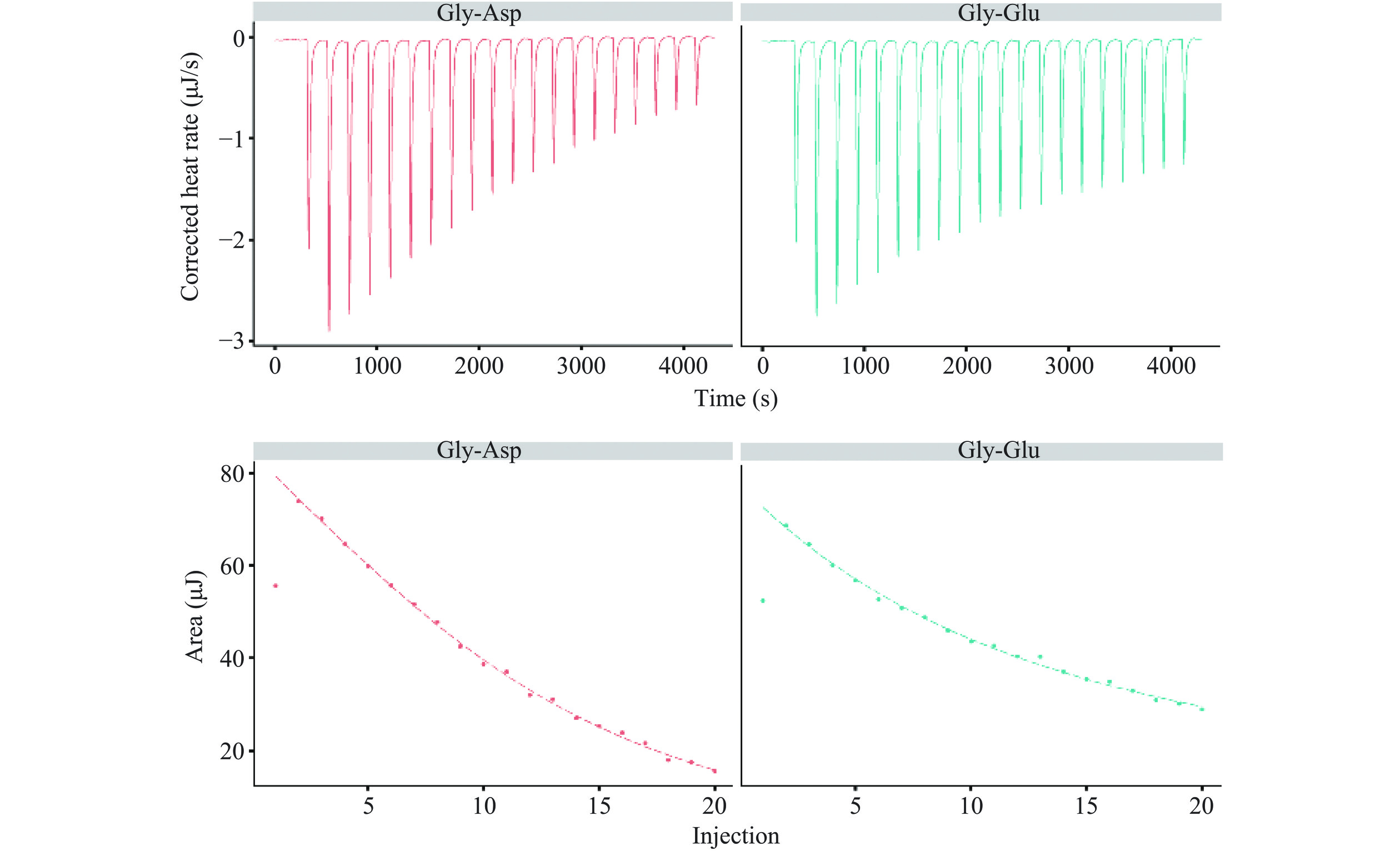
热力学可以研究热过程如何帮助化学系统达到平衡,以及在没有外部干预的情况下是否能实现真正的稳定[21−22],热力学参数可以更好的揭示氨基酸和肽与钙离子结合的过程。通过等温量热滴定仪对这一过程进行了测定(pH7.4,25 ℃),结果如图1和表1所示。由表1可知,氨基酸和二肽均可以和钙离子自发地(ΔG<0)形成复合物,但氨基酸与钙离子结合是焓驱动和熵驱动的放热反应(ΔH<0,ΔS>0),而甘氨酸二肽与钙离子结合则是熵驱动的吸热反应(ΔH>0,ΔS>0),这一结果与之前的研究结果相似[23−24]。通过对结合反应产生的热量进行积分(以甘氨酸二肽为例,如图1所示)并进行相应的拟合得到钙结合常数[25],结果如表1所示。通过拟合得到的热力学参数描述强结合反应时较为准确(Ka>1000 L/mol),而较小的焓变绝对值则表明氨基酸与甘氨酸二肽与钙离子属于弱结合,所以表1中得到的钙离子结合常数并不是非常准确,需进一步修正。
表 1 通过等温量热滴定测定的氨基酸及其甘氨酸二肽的钙离子结合热力学参数Table 1. Thermodynamic parameters of amino acids and their glycine dipeptides binding with calcium determined by isothermal titration calorimetry样品 Kd(mol/L) n ΔH(kJ/mol) Ka(L/mol) ΔS(J/mol·K) ΔG(kJ/mol) GlyNa (1.17±0.89)×10−3 0.36±0.05 −0.41±0.16 853 54.73 −16.73 AspNa (6.38±3.33)×10−4 0.1±0.15 −1.78±1.15 157 36.06 −12.53 GluNa (9.97±6.98)×10−3 0.1±0.21 −2.54±1.94 100 29.79 −11.42 Gly-Asp (3.99±3.88)×10−3 0.48±0.1 0.63±0.53 251 48.03 −13.7 Gly-Glu (1.3±0.62)×10−2 0.1±0.22 3.68±2.37 77 48.44 −10.76 注:Kd:解离常数;n:化学计量数;ΔH:结合焓;ΔS:结合熵;ΔG:吉布斯自由能;Ka:结合常数。 2.2 基于离子活度的钙离子结合常数计算
根据2.1结果,团队建立了通过溶液中钙离子活度来测定钙离子结合常数的方法。在水溶液中,氨基酸和甘氨酸二肽与钙离子的结合主要为1:1结合,用式(7)进行描述:
Ca2++L−⇌CaL+ (7) 式中,L−为氨基酸或者甘氨酸二肽;CaL+是形成的复合物。基于钙离子活度的钙离子结合常数可通过式(8)进行计算:
Ka=αCaL+αCa2+αL−=[CaL+]γCaL+αCa2+[L−]γL− (8) 式中,αCa2+为溶液中的钙离子活度(mol/L),可通过校准后的钙离子选择性电极直接测得,复合物浓度[CaL+]可以通过加入的总钙浓度cCa2+计算,如式(9)所示:
[CaL+]=cCa2+−[Ca2+]=cCa2+−αCa2+γCa2+ (9) 式中,cCa2+为总钙浓度(mol/L);[Ca2+]为游离钙浓度(mol/L)。式(8)中游离的配体浓度[L−]可以通过加入的氨基酸或甘氨酸二肽的总量cL−进行计算:
[L−]=cL−−[CaL+]=cL−cCa2++αCa2+γCa2+ (10) 式中,相应的离子活度系数γ可通过式(3)进行计算,对溶液中初始离子强度I进行如下估算:
I=12(cCa2+×4+cL−) (11) 基于计算得到初始的[Ca2+]、[L−]、[CaL+]等浓度后,可对溶液中的离子强度I重新进行如下更为精准的计算:
I=12([Ca2+]×4+[CaL+]+[L−]+cNa++cOH−) (12) 得到新的离子强度后,对式(3)、式(9)、式(10)、式(12)进行循环计算,直到根据式(12)得到的离子强度不再变化为止,最终可通过式(8)计算出基于钙离子活度的钙离子结合常数。通过此方法获得的钙离子结合常数如表2所示。相较于氨基酸,肽有着更高的钙离子结合能力,这一结果与之前的研究结果相一致[17,26]。天冬氨酸(103 L/mol)与钙离子的结合能力要高于谷氨酸(65 L/mol),其形成的甘氨酸二肽也表现出了同样的趋势。此外,团队对其钠盐的钙离子结合能力也进行了测定,结果表明它们在中性环境下的钙离子结合能力要普遍低于氨基酸形式。这是由于羧基的pKa不同导致,氨基酸在水溶液中的自然解离需要用NaOH调节来达到中性pH,之前的研究表明pH升高会增强氨基酸的钙离子的结合能力[27−30]。
表 2 钙离子和氨基酸及其钠盐和二肽在25 ℃水溶液体系中的热力学参数Table 2. Thermodynamic parameters in the Calcium–amino acid/dipeptide solution systems at 25℃样品 pH TCa2+(mol/L) TL−(mol/L) [Ca2+](mol/L) αCa2+ I γCa2+ L−(mol/L) [CaL+](mol/L) Ka(L/mol) Gly 7.2 0.001 0.01 0.00070 0.00055 0.0030 0.79 0.048 0.00030 9 Asp 7.4 0.001 0.01 0.00065 0.00041 0.012 0.64 0.0084 0.00035 103 Glu 7.2 0.001 0.01 0.00074 0.00048 0.012 0.64 0.0083 0.00026 65 AspNa 7.4 0.001 0.1 0.00045 0.00017 0.10 0.37 0.099 0.00055 34 GluNa 7.2 0.001 0.1 0.00048 0.00018 0.10 0.37 0.099 0.00052 29 Gly-Asp 7.6 0.001 0.01 0.00058 0.00038 0.011 0.65 0.0084 0.00042 132 Gly-Glu 7.1 0.001 0.01 0.00059 0.00038 0.012 0.64 0.0084 0.00041 128 注:TCa2+为总钙浓度;TL−为配体总浓度。 2.3 量子力学计算
除了钙离子结合常数外,揭示钙离子与肽的结合位点有助于更好的设计钙离子结合肽的序列[31]。因此,利用量子化学计算中的密度泛函理论(DFT/B3LYP/6-311G(d,p))对氨基酸和甘氨酸二肽与钙离子形成复合物的最优结构进行探究[26]。通过对复合物的所有构型进行优化,结合焓变值来确定最优结构,最终所得最优结构如图2所示,其中图2(a)为复合物中氨基酸/二肽中羧基去质子化和氨基质子化形式,图2(b)为复合物中氨基酸/二肽中羧基去质子化和氨基去质子化形式。从图2(a)中可知,在自然解离状态下,C端和侧链羧基为钙离子的主要结合位点,一般情况下C端羧基与钙离子形成二齿配位复合物,如果侧链羧基也参与钙离子的结合,则通过单齿配位的形式参与结合。而在碱性条件下(氨基和羧基去质子化,pH>pKa),如图2(b)所示,钙与氨基酸的结合位点发生明显转移,去质子化的氨基开始参与钙离子结合,这一结果与之前的量子化学计算结果相吻合[26,32]。此外,在甘氨酸二肽中,C端羧基仍然是钙离子结合的主要位点。结合位点的差异性可能是造成钙离子与其结合时热力学性质不同的原因之一。
此外,利用相同机组计算了氨基酸和甘氨酸二肽最优构型下的相关特性,并在表3(自然解离:氨基质子化和羧基去质子化)和表4(氨基和羧基去质子化,pH>pKa)中进行了总结,用于探究与钙离子结合和促钙吸收相关的物化特性。根据硬软路易斯酸碱(HSAB)理论,热力学上更倾向于“硬硬” “软软”的组合,因此该理论可用来预测金属-配体复合物的热力学稳定性[33−35]。钙作为一种路易斯硬酸,意味着它对电负性较高、体积较小的硬碱配体有偏好,与硬度较低的配体有较高的稳定性常数[36]。因此,利用式(13)~式(16)进行了计算:
表 3 配体在兼性离子形式下的DFT计算描述符Table 3. DFT-calculated parameters of ligands in zwitterionic forms样品 μ
(D)极化性
(a.u.)EHOMO
(eV)ELUMO
(eV)EGap
(eV)CP
(eV)化学硬度
(eV)化学软度
(eV)亲电性
(eV)IP
(eV)EA
(eV)Ethermal
(kcal/mol)ΔC
(cal/mol K)熵
(cal/mol K)电荷 ΔHbinding
(kJ/mol)Gly 12.08 42.49 −6.56 0.57 −7.12 2.99 3.56 0.14 1.74 1.26 6.56 −0.57 53.97 17.13 72.72 −93.36 Asp 16.04 78.32 −5.67 0.72 −6.39 2.47 3.19 0.16 1.56 0.95 5.66 −0.72 75.12 30.47 93.80 −170.48 Glu 17.70 93.18 −5.50 0.75 −6.25 2.38 3.12 0.16 1.54 0.90 5.50 −0.75 93.81 35.34 103.70 −186.52 Gly-Asp 30.66 119.64 −5.56 0.20 −5.77 2.68 2.88 0.17 1.53 1.25 5.56 −0.20 113.28 45.17 115.49 −180.23 Gly-Glu 41.63 133.99 −5.32 0.037 −5.36 2.64 2.68 0.19 1.51 1.30 5.32 −0.037 131.91 50.59 124.60 −200.37 注:μ为偶极矩;EHOMO为最高占据分子轨道能;ELUMO为最低未占分子轨道能;EGap为HOMO-LUMO能隙;IP为电离势;CP为化学势;EA为电子亲和力;Ethermal为热能;ΔC为热容量;ΔHbinding为钙结合焓;表4同。 表 4 配体在去质子化的形式下的DFT计算描述符Table 4. DFT-calculated parameters of ligands in deprotonated forms样品 μ
(D)极化性
(a.u.)EHOMO
(eV)ELUMO
(eV)EGap
(eV)CP
(eV)化学硬度
(eV)化学软度
(eV)亲电性
(eV)IP
(eV)EA
(eV)Ethermal
(kcal/mol)ΔC
(cal/mol K)熵
(cal/mol K)电荷 ΔHbinding
(kJ/mol)Gly 4.53 44.76 −5.29 1.75 −7.04 1.77 3.52 0.14 0.45 5.29 −1.75 45.11 17.14 73.52 1.66 −154.24 Asp 8.27 80.84 −5.22 1.77 −7.00 1.72 3.50 0.14 0.42 5.22 −1.77 66.51 30.08 94.46 1.49 −252.30 Glu 8.08 96.17 −5.24 1.45 −6.68 1.89 3.34 0.15 0.54 5.24 −1.45 84.89 35.12 103.88 1.48 −239.10 Gly-Asp 11.39 121.82 −5.32 0.83 −6.15 2.24 3.07 0.16 0.82 5.32 −0.83 104.09 45.29 118.84 1.47 −225.64 Gly-Glu 19.90 136.26 −5.27 0.79 −6.06 2.24 3.03 0.17 0.83 5.27 −0.79 122.71 50.66 125.43 1.45 −217.16 χ=−μ=−EHOMO+ELUMO2 (13) η=I+A2=−ELUMO−EHOMO2 (14) ω=χ22η (15) σ=12η (16) 式中:EHOMO为最高占据分子轨道能;ELUMO为最低未占分子轨道能;χ为电负性,表示吸引电子的能力;μ为化学势;I为电离势;A为电子亲和力;η为化学硬度;ω为亲电性指数;σ为化学软度;
从表3和表4可知,在两种形态下的氨基酸和甘氨酸二肽,具有相对较低硬度的配体具有较高钙离子结合能力,这一结果与硬软路易斯酸碱理论相一致。另外,通过Mulliken电荷分布分析可知,具有较强钙离子结合能力的配体与钙形成的复合物中的钙离子的Mulliken电荷相对较低。而ΔHbinding与表2中的钙离子结合常数没有表现出较高的相关性,这可能是由于天冬氨酸和谷氨酸及其形成的二肽与钙离子结合时涉及到多个功能基团,将溶液调节到中性环境后功能基团的不同形态分布较为复杂,虽然能看出一定的趋势,但有待进一步研究。而在氨基和羧基去质子化的形式下,通过密度泛函计算的天冬氨酸与钙离子的结合能力要强于谷氨酸,与表2中的结果一致,表明在碱性条件下,氨基在氨基酸和二肽与钙离子的结合中也起非常重要的作用。
2.4 氨基酸及其甘氨酸二肽促钙吸收的构效关系研究
为进一步探究氨基酸及其二肽对钙离子吸收率的影响,建立Caco-2细胞吸收模型测定其促钙吸收能力,结果如表5所示。
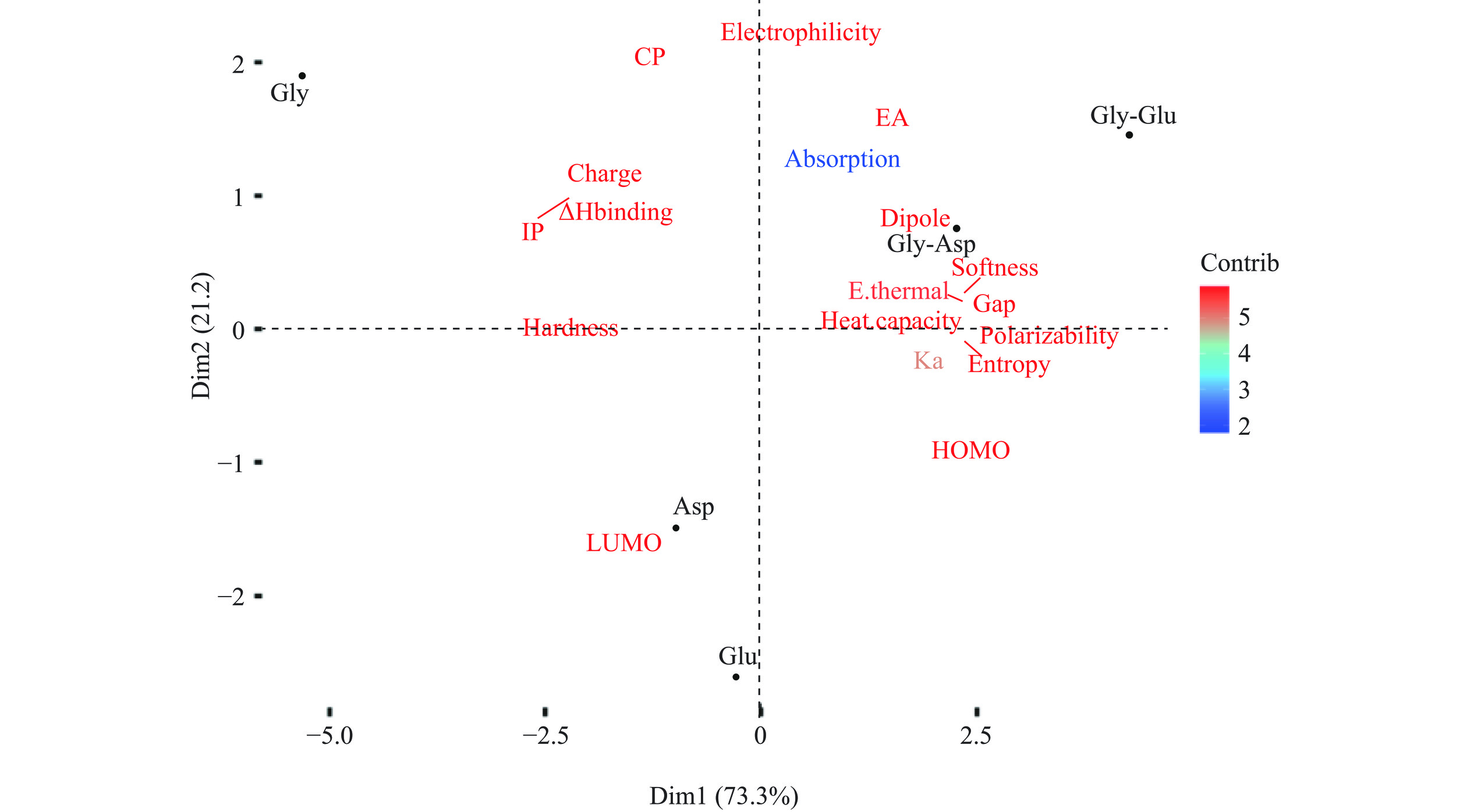
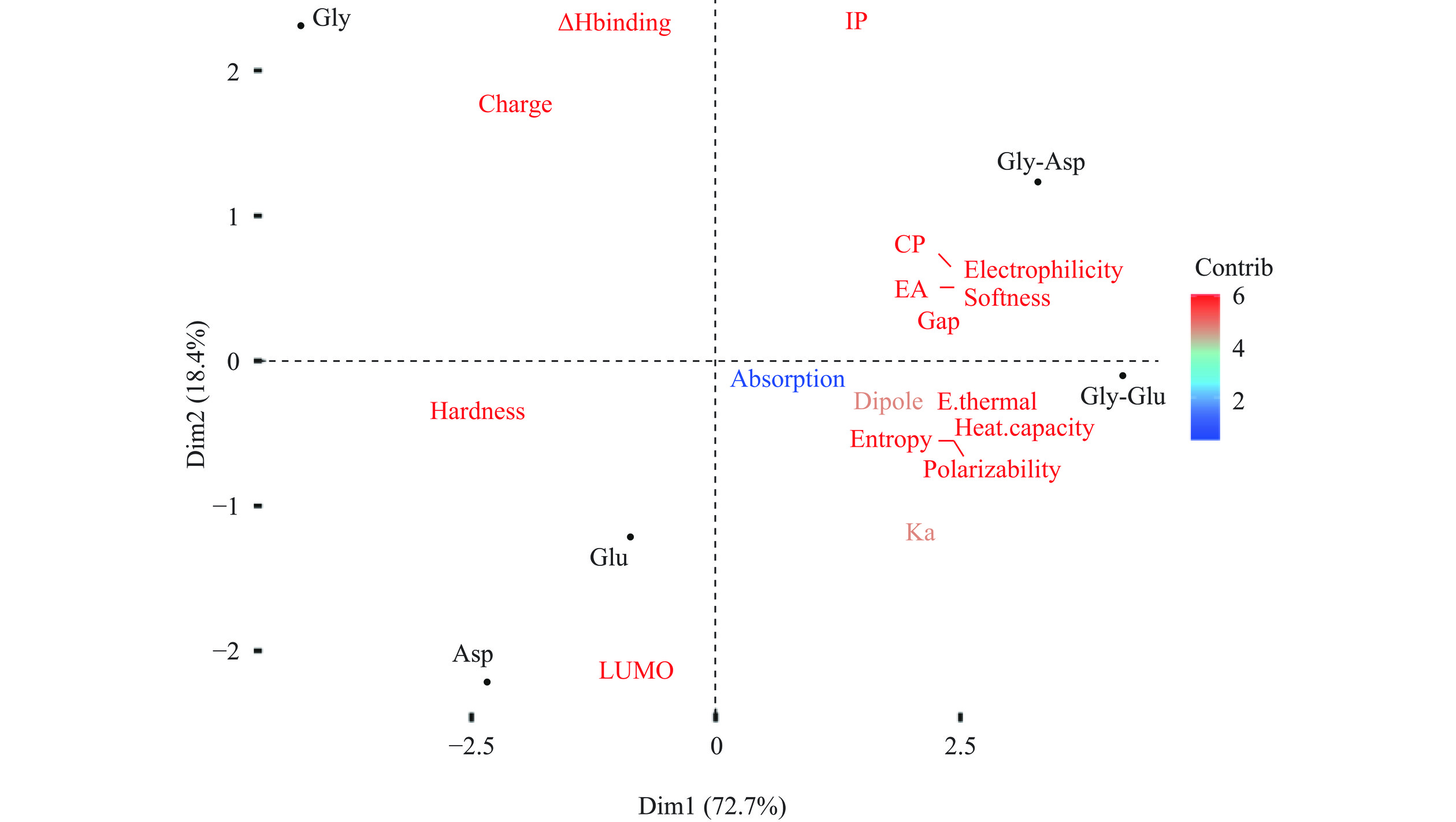
表 5 氨基酸和甘氨酸二肽的钙吸收率和相应的促钙吸收率(氯化钙为对照)和钙结合焓Table 5. Calcium absorption and corresponding calcium absorption promotion factor (CaCl2 as a control),and calcium-binding enthalpy样品 钙吸收率 促钙吸收率 Ka(L/mol) ΔHbinding-1(kJ/mol) ΔHbinding-2(kJ/mol) Gly 0.0175±0.001 1.19±0.080 9 −93.36 −154.24 Asp 0.0191±0.0003 1.30±0.027 103 −170.48 −252.3 Glu 0.0148±0.001 1.01±0.060 65 −186.52 −239.1 Gly-Asp 0.0171±0.001 1.16±0.086 132 −180.23 −225.64 Gly-Glu 0.0196±0.002 1.33±0.115 128 −200.37 −217.16 注:ΔHbinging-1为兼性离子形式下的钙结合焓;ΔHbinging-2为去质子化形式下的钙结合焓。 由表5可知,甘氨酸、天冬氨酸、谷氨酸及其二肽均有一定的促钙吸收作用。其中,甘氨酸-谷氨酸二肽表现出最高的促钙吸收能力,促钙吸收率为1.33,其次为天冬氨酸(1.30)和甘氨酸(1.19),而谷氨酸(1.01)表现出最低的促钙吸收率。有研究表明,与CaCl2相比(对照组),Glu-Tyr-Gly-Ca明显增加了钙转运且转移的钙量随着Glu-Tyr-Gly-Ca的剂量而增加[37]。对促钙吸收率和钙离子结合能力进行相关性分析,结果并没有表现出相关性,这一结果与之前磷酸化肽的研究结果相一致[11,38]。进一步对氨基酸和甘氨酸二肽的所有性质进行主成分分析,结果如图3所示。在自然解离状态下,氨基酸和二肽的特征具有明显区别,主成分1和主成分2总共解释了94.5%的性质变化,其中主成分1占73.3%,主成分2占21.2%。主成分1与化学硬度和结合焓变呈负相关,与钙离子结合常数和极化率呈正相关。主成分2与LUMO能量呈负相关,与亲电性呈正相关。结合常数的变化与极化率和熵变呈相关性,而促钙吸收率则与电子亲和性更相关。而针对碱性条件下的去质子化状态,如图4所示,虽然前2个主成分解释的总变量有所下降(91.1%),但结论与兼性离子状态的结论相似,且促钙吸收率与其他性质没有表现出一定的相关性。这可能是由于促钙吸收率本身对主成分分析的贡献率较低,而且在pH=7.4的中性条件下,兼性离子状态占主要比例。
![]() 图 3 氨基酸及其甘氨酸二肽在兼性离子形式下的主成分分析注:Electrophilicity为亲电性;CP为化学势;EA为电子亲和力;Absorption为钙吸收率;Charge为电荷;ΔHbinding为钙结合焓;IP为电离势;Dipole为偶极矩;Hardness为化学硬度;Softness为化学软度;E.thermal为热能;Gap为HOMO-LUMO能隙;Heat capacity为热容量;Polarizability为极化性;Entropy为熵;Ka为结合常数;HOMO为最高占据分子轨道能;LUMO为最低未占分子轨道能,图4同。Figure 3. Principal component analysis of amino acids/dipeptides in zwitterionic forms
图 3 氨基酸及其甘氨酸二肽在兼性离子形式下的主成分分析注:Electrophilicity为亲电性;CP为化学势;EA为电子亲和力;Absorption为钙吸收率;Charge为电荷;ΔHbinding为钙结合焓;IP为电离势;Dipole为偶极矩;Hardness为化学硬度;Softness为化学软度;E.thermal为热能;Gap为HOMO-LUMO能隙;Heat capacity为热容量;Polarizability为极化性;Entropy为熵;Ka为结合常数;HOMO为最高占据分子轨道能;LUMO为最低未占分子轨道能,图4同。Figure 3. Principal component analysis of amino acids/dipeptides in zwitterionic forms3. 结论
本文通过热力学、电化学、Caco-2细胞模型实验结合量子化学理论计算,揭示了天冬氨酸和谷氨酸及其形成的甘氨酸二肽影响钙吸收的机制。氨基酸与钙离子结合是通过焓驱动和熵驱动的放热反应,而肽则通过熵驱动的吸热反应自发地与钙离子结合形成复合物。相较于氨基酸,其形成的二肽与钙离子具有更强的钙离子结合能力(Gly-Asp 132 L/mol和Gly-Glu 128 L/mol)。氨基酸和肽主要通过羧基与钙离子结合,但是碱性条件下,氨基酸有明显的钙离子结合位点转移,氨基也参与钙离子结合。Caco-2细胞模型吸收实验表明所测定的氨基酸和甘氨酸二肽均有一定的促钙吸收能力,但促钙吸收能力与钙离子结合能力没有表现出相关性,与电子亲和性更为相关。实验结果可为钙补充剂的研发提供理论依据。未来应更有针对性地设计具有高促钙吸收能力的促钙吸收肽,更深入的研究其促钙吸收机制。
-
图 3 氨基酸及其甘氨酸二肽在兼性离子形式下的主成分分析
注:Electrophilicity为亲电性;CP为化学势;EA为电子亲和力;Absorption为钙吸收率;Charge为电荷;ΔHbinding为钙结合焓;IP为电离势;Dipole为偶极矩;Hardness为化学硬度;Softness为化学软度;E.thermal为热能;Gap为HOMO-LUMO能隙;Heat capacity为热容量;Polarizability为极化性;Entropy为熵;Ka为结合常数;HOMO为最高占据分子轨道能;LUMO为最低未占分子轨道能,图4同。
Figure 3. Principal component analysis of amino acids/dipeptides in zwitterionic forms
表 1 通过等温量热滴定测定的氨基酸及其甘氨酸二肽的钙离子结合热力学参数
Table 1 Thermodynamic parameters of amino acids and their glycine dipeptides binding with calcium determined by isothermal titration calorimetry
样品 Kd(mol/L) n ΔH(kJ/mol) Ka(L/mol) ΔS(J/mol·K) ΔG(kJ/mol) GlyNa (1.17±0.89)×10−3 0.36±0.05 −0.41±0.16 853 54.73 −16.73 AspNa (6.38±3.33)×10−4 0.1±0.15 −1.78±1.15 157 36.06 −12.53 GluNa (9.97±6.98)×10−3 0.1±0.21 −2.54±1.94 100 29.79 −11.42 Gly-Asp (3.99±3.88)×10−3 0.48±0.1 0.63±0.53 251 48.03 −13.7 Gly-Glu (1.3±0.62)×10−2 0.1±0.22 3.68±2.37 77 48.44 −10.76 注:Kd:解离常数;n:化学计量数;ΔH:结合焓;ΔS:结合熵;ΔG:吉布斯自由能;Ka:结合常数。 表 2 钙离子和氨基酸及其钠盐和二肽在25 ℃水溶液体系中的热力学参数
Table 2 Thermodynamic parameters in the Calcium–amino acid/dipeptide solution systems at 25℃
样品 pH TCa2+(mol/L) TL−(mol/L) [Ca2+](mol/L) αCa2+ I γCa2+ L−(mol/L) [CaL+](mol/L) Ka(L/mol) Gly 7.2 0.001 0.01 0.00070 0.00055 0.0030 0.79 0.048 0.00030 9 Asp 7.4 0.001 0.01 0.00065 0.00041 0.012 0.64 0.0084 0.00035 103 Glu 7.2 0.001 0.01 0.00074 0.00048 0.012 0.64 0.0083 0.00026 65 AspNa 7.4 0.001 0.1 0.00045 0.00017 0.10 0.37 0.099 0.00055 34 GluNa 7.2 0.001 0.1 0.00048 0.00018 0.10 0.37 0.099 0.00052 29 Gly-Asp 7.6 0.001 0.01 0.00058 0.00038 0.011 0.65 0.0084 0.00042 132 Gly-Glu 7.1 0.001 0.01 0.00059 0.00038 0.012 0.64 0.0084 0.00041 128 注:TCa2+为总钙浓度;TL−为配体总浓度。 表 3 配体在兼性离子形式下的DFT计算描述符
Table 3 DFT-calculated parameters of ligands in zwitterionic forms
样品 μ
(D)极化性
(a.u.)EHOMO
(eV)ELUMO
(eV)EGap
(eV)CP
(eV)化学硬度
(eV)化学软度
(eV)亲电性
(eV)IP
(eV)EA
(eV)Ethermal
(kcal/mol)ΔC
(cal/mol K)熵
(cal/mol K)电荷 ΔHbinding
(kJ/mol)Gly 12.08 42.49 −6.56 0.57 −7.12 2.99 3.56 0.14 1.74 1.26 6.56 −0.57 53.97 17.13 72.72 −93.36 Asp 16.04 78.32 −5.67 0.72 −6.39 2.47 3.19 0.16 1.56 0.95 5.66 −0.72 75.12 30.47 93.80 −170.48 Glu 17.70 93.18 −5.50 0.75 −6.25 2.38 3.12 0.16 1.54 0.90 5.50 −0.75 93.81 35.34 103.70 −186.52 Gly-Asp 30.66 119.64 −5.56 0.20 −5.77 2.68 2.88 0.17 1.53 1.25 5.56 −0.20 113.28 45.17 115.49 −180.23 Gly-Glu 41.63 133.99 −5.32 0.037 −5.36 2.64 2.68 0.19 1.51 1.30 5.32 −0.037 131.91 50.59 124.60 −200.37 注:μ为偶极矩;EHOMO为最高占据分子轨道能;ELUMO为最低未占分子轨道能;EGap为HOMO-LUMO能隙;IP为电离势;CP为化学势;EA为电子亲和力;Ethermal为热能;ΔC为热容量;ΔHbinding为钙结合焓;表4同。 表 4 配体在去质子化的形式下的DFT计算描述符
Table 4 DFT-calculated parameters of ligands in deprotonated forms
样品 μ
(D)极化性
(a.u.)EHOMO
(eV)ELUMO
(eV)EGap
(eV)CP
(eV)化学硬度
(eV)化学软度
(eV)亲电性
(eV)IP
(eV)EA
(eV)Ethermal
(kcal/mol)ΔC
(cal/mol K)熵
(cal/mol K)电荷 ΔHbinding
(kJ/mol)Gly 4.53 44.76 −5.29 1.75 −7.04 1.77 3.52 0.14 0.45 5.29 −1.75 45.11 17.14 73.52 1.66 −154.24 Asp 8.27 80.84 −5.22 1.77 −7.00 1.72 3.50 0.14 0.42 5.22 −1.77 66.51 30.08 94.46 1.49 −252.30 Glu 8.08 96.17 −5.24 1.45 −6.68 1.89 3.34 0.15 0.54 5.24 −1.45 84.89 35.12 103.88 1.48 −239.10 Gly-Asp 11.39 121.82 −5.32 0.83 −6.15 2.24 3.07 0.16 0.82 5.32 −0.83 104.09 45.29 118.84 1.47 −225.64 Gly-Glu 19.90 136.26 −5.27 0.79 −6.06 2.24 3.03 0.17 0.83 5.27 −0.79 122.71 50.66 125.43 1.45 −217.16 表 5 氨基酸和甘氨酸二肽的钙吸收率和相应的促钙吸收率(氯化钙为对照)和钙结合焓
Table 5 Calcium absorption and corresponding calcium absorption promotion factor (CaCl2 as a control),and calcium-binding enthalpy
样品 钙吸收率 促钙吸收率 Ka(L/mol) ΔHbinding-1(kJ/mol) ΔHbinding-2(kJ/mol) Gly 0.0175±0.001 1.19±0.080 9 −93.36 −154.24 Asp 0.0191±0.0003 1.30±0.027 103 −170.48 −252.3 Glu 0.0148±0.001 1.01±0.060 65 −186.52 −239.1 Gly-Asp 0.0171±0.001 1.16±0.086 132 −180.23 −225.64 Gly-Glu 0.0196±0.002 1.33±0.115 128 −200.37 −217.16 注:ΔHbinging-1为兼性离子形式下的钙结合焓;ΔHbinging-2为去质子化形式下的钙结合焓。 -
[1] MARTÍNEZ DE VICTORIA E. Calcium, essential for health[J]. Nutrición Hospitalaria,2016,33(4):26−31.
[2] MASOTTI F, CATTANEO S, STUKNYTĖ M, et al. Analytical advances in the determination of calcium in bovine milk, dairy products and milk-based infant formulas[J]. Trends in Food Science & Technology,2020,103:348−360.
[3] REID I R. Osteoporosis:evidence for vitamin D and calcium in older people[J]. Drug and Therapeutics Bulletin,2020,58(8):122−125. doi: 10.1136/dtb.2019.000063
[4] ALFARIS N A, ALKEHAYEZ N M, ALMUSHAWAH F I, et al. Vitamin D deficiency and associated risk factors in women from riyadh, saudi arabia[J]. Scientific Reports, 2019, 9(1):20371.
[5] STRAUB D A. Calcium supplementation in clinical practice:A review of forms, doses, and indications[J]. Nutrition in Clinical Practice,2007,22(3):286−296. doi: 10.1177/0115426507022003286
[6] PU F, CHEN N, XUE S H. Calcium intake, calcium homeostasis and health[J]. Food Science and Human Wellness,2016,5(1):8−16. doi: 10.1016/j.fshw.2016.01.001
[7] CIVITELLI R, ZIAMBARAS K, WARD W E. Calcium, magnesium, and vitamin D absorption; metabolim and deficiency[M]. Amsterdam:Encyclopedia of Gastroenterology (Second Edition), 2020:418−423.
[8] CORTE-REAL J, BOHN T. Interaction of divalent minerals with liposoluble nutrients and phytochemicals during digestion and influences on their bioavailability–a review[J]. Food Chemistry,2018,252:285−293. doi: 10.1016/j.foodchem.2018.01.113
[9] CORMICK G, BELIZÁN J M. Calcium intake and health[J]. Nutrients,2019,11(7):1606. doi: 10.3390/nu11071606
[10] ZHANG H, ZHAO L, SHEN Q, et al. Preparation of cattle bone collagen peptides-calcium chelate and its structural characterization and stability[J]. LWT,2021,144:111264. doi: 10.1016/j.lwt.2021.111264
[11] SUN N, WU H T, DU M, et al. Food protein-derived calcium chelating peptides:A review[J]. Trends in Food Science & Technology,2016,58:140−148.
[12] ZHANG M H, LIU K L. Calcium supplements and structure-activity relationship of peptide-calcium chelates:A review[J]. Food Science and Biotechnology,2022,31(9):1111−1122. doi: 10.1007/s10068-022-01128-6
[13] CAI X X, LIN J P, WANG S Y. Novel peptide with specific calcium-binding capacity fromSchizochytrium sp. protein hydrolysates and calcium bioavailability in Caco-2 Cells[J]. Marine Drugs,2016,15(1):3. doi: 10.3390/md15010003
[14] LIN Y L, CAI X X, WU X P, et al. Fabrication of snapper fish scales protein hydrolysate-calcium complex and the promotion in calcium cellular uptake[J]. Journal of Functional Foods,2020,65:103717. doi: 10.1016/j.jff.2019.103717
[15] LUO J Q, YAO X T, SOLADOYE O P, et al. Phosphorylation modification of collagen peptides from fish bone enhances their calcium-chelating and antioxidant activity[J]. LWT,2022,155:112978. doi: 10.1016/j.lwt.2021.112978
[16] SUN N, WANG Y X, BAO Z J, et al. Calcium binding to herring egg phosphopeptides:Binding characteristics, conformational structure and intermolecular forces[J]. Food Chemistry,2020,310:125867. doi: 10.1016/j.foodchem.2019.125867
[17] VAVRUSOVA M, SKIBSTED L H. Calcium binding to dipeptides of aspartate and glutamate in comparison with orthophosphoserine[J]. Journal of Agricultural and Food Chemistry,2013,61(22):5380−5384. doi: 10.1021/jf400741e
[18] TANG N, LIU J C, CHENG Y Q. Effects of zinc binding on the binding of epigallocatechin gallate (green tea) to bovine serum albumin and myoglobin[J]. Food Chemistry,2021,357:129750. doi: 10.1016/j.foodchem.2021.129750
[19] VAVRUSOVA M, GARCIA A C, DANIELSEN B P, et al. Spontaneous supersaturation of calcium citrate from simultaneous isothermal dissolution of sodium citrate and sparingly soluble calcium hydroxycarboxylates in water[J]. RSC Advances,2017,7(6):3078−3088. doi: 10.1039/C6RA25807G
[20] TANG N, SKIBSTED L H. Zinc Bioavailability from phytate-rich foods and zinc supplements. modeling the effects of food components with oxygen, nitrogen, and sulfur donor ligands[J]. Journal of Agricultural and Food Chemistry,2017,65(39):8727−8743. doi: 10.1021/acs.jafc.7b02998
[21] GLÖCKNER S, KLEBE G. Simultaneous determination of thermodynamic and kinetic data by isothermal titration calorimetry[J]. Biochimica et Biophysica Acta (BBA)-General Subjects,2021,1865(2):129772. doi: 10.1016/j.bbagen.2020.129772
[22] GHAI R, FALCONER R J, COLLINS B M. Applications of isothermal titration calorimetry in pure and applied research—survey of the literature from 2010[J]. Journal of Molecular Recognition:JMR, 2012, 25(1):32−52.
[23] DUDEV T. How theoretical evaluations can generate guidelines for designing/engineering metalloproteins with desired metal affinity and selectivity[J]. Molecules,2022,28:249. doi: 10.3390/molecules28010249
[24] LUO M N, XIAO J, SUN S W, et al. Deciphering calcium-binding behaviors of casein phosphopeptides by experimental approaches and molecular simulation[J]. Food & Function,2020,11:5284−5292.
[25] SI K, GONG T T, DING S Y, et al. Binding mechanism and bioavailability of a novel phosvitin phosphopeptide (Glu-Asp-Asp-pSer-pSer) calcium complex[J]. Food Chemistry,2023,404:134567. doi: 10.1016/j.foodchem.2022.134567
[26] TANG N, SKIBSTED L H. Calcium binding to amino acids and small glycine peptides in aqueous solution:toward peptide design for better calcium bioavailability[J]. Journal of Agricultural and Food Chemistry,2016,64(21):4376−4389. doi: 10.1021/acs.jafc.6b01534
[27] LIU X C, LIU J, SKIBSTED L H. Temperature effect on calcium binding to aspartate and glutamate[J]. Food Research International,2022,159:111625. doi: 10.1016/j.foodres.2022.111625
[28] SAJADI S A A. Metal ion-binding properties of L-glutamic acid and L-aspartic acid, a comparative investigation[J]. Natural Science,2010,02:85−90. doi: 10.4236/ns.2010.22013
[29] BRETTI C, CIGALA R M, GIUFFRÈ O, et al. Modeling solubility and acid-base properties of some polar side chain amino acids in NaCl and (CH3)4NCl aqueous solutions at different ionic strengths and temperatures[J]. Fluid Phase Equilibria,2018,459:51−64. doi: 10.1016/j.fluid.2017.11.030
[30] FOX S, BÜSCHING I, BARKLAGE W, et al. Coordination of biologically important alpha-amino acids to calcium (II) at high pH:insights from crystal structures of calcium alpha-aminocarboxylates[J]. Inorganic Chemistry,2007,46(3):818−824. doi: 10.1021/ic061838b
[31] JOSHUA A T, LEE C C, OPEOLU A J, et al. Metal-binding peptides and their potential to enhance the absorption and bioavailability of minerals[J]. Food Chemistry,2023,428:136678. doi: 10.1016/j.foodchem.2023.136678
[32] JIANG Y, LIU X C, DE ZAWADZKI A, et al. Binding of calcium to l-serine and o-phospho-l-serine as affected by temperature, pH and ionic strength under milk processing conditions[J]. International Dairy Journal,2021,112:104875. doi: 10.1016/j.idairyj.2020.104875
[33] PÉREZ P, CONTRERAS R, VELA A, et al. Relationship between the electronic chemical potential and proton transfer barriers[J]. Chemical Physics Letters,1997,269(5):419−427.
[34] CAMPODÓNICO P R, ANDRÉS J, AIZMAN A, et al. Proton transport catalysis in intramolecular rearrangements:A density functional theory study[J]. Chemical Physics Letters,2008,464(4):271−275.
[35] MIGLIORE A, POLIZZI N F, THERIEN M J, et al. Biochemistry and theory of proton-coupled electron transfer[J]. Chemical Reviews,2014,114(7):3381−3465. doi: 10.1021/cr4006654
[36] GEERLINGS P, DE PROFT F, LANGENAEKER W. Conceptual density functional theory[J]. Chemical Reviews,2003,103(5):1793−1874. doi: 10.1021/cr990029p
[37] QI L W, ZHANG H R, GUO Y J, et al. A novel calcium-binding peptide from bovine bone collagen hydrolysate and chelation mechanism and calcium absorption activity of peptide-calcium chelate[J]. Food Chemistry,2023,410:135387. doi: 10.1016/j.foodchem.2023.135387
[38] TENENBAUM M, DERACINOIS B, DUGARDIN C, et al. Identification, production and bioactivity of casein phosphopeptides–A review[J]. Food Research International,2022,157:111360. doi: 10.1016/j.foodres.2022.111360





 下载:
下载:

 下载:
下载:
