Multispectroscopic and Computational Study of the Interaction between α-Cembrenediol and Bovine Serum Albumin
-
摘要: α-西柏三烯二醇具有抗菌、抗肿瘤和神经保护等广泛生物活性,研究其与牛血清白蛋白(BSA)相互作用,有助于了解α-西柏三烯二醇在体内的转运、分布以及消除等信息。本研究通过紫外吸收光谱、荧光光谱、圆二色谱、分子对接模拟、分子动力学模拟等方法,在分子水平上研究了BSA与α-西柏三烯二醇在体外生理条件下的相互作用。结果表明,BSA与α-西柏三烯二醇发生了明显相互作用,且在293、303和310 K三个温度条件下,荧光淬灭常数KSV值和结合常数Kb值随着温度升高逐渐降低,α-西柏三烯二醇与BSA通过静态猝灭机制发生相互作用,三个不同温度下两者结合位点数n≈1,在BSA上只存在一个α-西柏三烯二醇的特异性结合位点;BSA与α-西柏三烯二醇的结合是自发进行的(ΔG<0),氢键和范德华力为主要驱动力(ΔH<0和ΔS<0);在Sudlow位点I处α-西柏三烯二醇与BSA发生结合;BSA与α-西柏三烯二醇结合导致其构象也会发生改变。本研究结果提供了α-西柏三烯二醇与BSA相互作用的基本信息,这将有助于进一步了解α-西柏三烯二醇的药代动力学特性。Abstract: α-Cembrenediol displays a diverse array of biological activities, encompassing antibacterial, antitumor, and neuroprotective effects. To comprehensively understand the in vivo transport, distribution, and elimination mechanisms associated with α-cembrenediol, its interaction with bovine serum albumin (BSA) was investigated. In this study, the interaction between α-cembrenediol and BSA was explored using various techniques, including UV absorption, steady-state fluorescence, circular dichroism spectrum, molecular docking, and molecular dynamics simulation. The results showed that there was a clear interaction between BSA and α-cembrenediol. Specifically, the KSV and Kb decreased with increasing temperature at 293, 303, and 310 K, indicating that α-cembrenediol interacted with BSA through a static quenching mechanism. Furthermore, the number of binding sites was approximately 1 at the three temperatures, suggesting the presence of a single specific binding site for α-cembrenediol on BSA. Moreover, the binding process occurred spontaneously (ΔG<0), primarily driven by hydrogen bonds and van der Waals forces (ΔH<0 and ΔS<0). α-Cembrenediol bound to the Sudlow site I of BSA. Binding of BSA to α-cembrenediol also caused its conformation to change. This study provides essential insights into the interaction between α-cembrenediol and BSA, contributing to a better understanding of the pharmacokinetic properties of the compound.
-
Keywords:
- α-cembrenediol /
- bovine serum albumin /
- interaction /
- fluorescence spectroscopy /
- molecular docking
-
α-西柏三烯二醇(α-2,7,11-cembratriene-4,6-diol,α-cembrenediol)是一种属于西柏烷型大环二萜类的天然化合物,它广泛存在于烟草、松属、大戟属等植物以及海洋生物中,其中在烟草中的含量最高[1−2]。研究发现,α-西柏三烯二醇具有抗肿瘤、抗菌和神经保护等多种生物活性。1985年,α-西柏三烯二醇首次被确认为抗肿瘤剂,并发现其能够抑制小鼠皮肤肿瘤的生长[3]。在体外实验中发现,α-西柏三烯二醇是一类新型c-Met抑制剂,可以降低不同乳腺癌细胞系中活化的VEGFR2水平,并且在小鼠体内减小MDA-MB-231肿瘤的大小[4−5]。α-西柏三烯二醇还可以通过p53-PUMA、PI3K-Akt和IL-1-NF-κB-IAP通路促进HepG2细胞的凋亡,抑制细胞增殖[6−7]。在抗菌方面,α-西柏三烯二醇表现出广谱抗微生物特性,研究表明α-西柏三烯二醇能够抑制金黄色葡萄球菌、巴氏芽孢杆菌等多种细菌以及白念珠菌等真菌的生长[8−10]。在神经保护方面,α-西柏三烯二醇通过与尼古丁乙酰胆碱受体发生相互作用,从而对有机磷中毒、脑缺血和帕金森病具有神经保护作用[11−12]。此外,α-西柏三烯二醇还具有较好的毒理安全性[13]。因此,α-西柏三烯二醇在食品、保健品和生物医药等领域具有较高的开发价值。
然而,目前关于它在机体内药物代谢相关的吸收、转运和释放等方面的认识仍然有限。血清白蛋白(SA)是一种在血液中具有重要转运功能的蛋白质。它能够与许多药物分子结合,并通过血浆将其运送到目标受体位点产生药效。同时,血清白蛋白还能与许多内源性和外源性化合物结合,发挥重要的储存和转运作用[14−15]。因此,研究血清白蛋白与α-西柏三烯二醇之间的相互作用,有助于进一步增进对α-西柏三烯二醇在体内运输和分布情况的理解,这对于揭示α-西柏三烯二醇的生理活性机制具有重要的意义。
牛血清白蛋白(BSA)是在体外研究药物与血清蛋白相互作用时常用的模式蛋白。本研究采用荧光光谱、紫外光谱、圆二色谱等多种光谱学技术,模拟生理条件下的实验环境,同时,结合分子动力学和分子对接等计算机模拟技术,详细研究α-西柏三烯二醇与BSA的结合过程,探究了两者之间的重要结合参数,如结合常数、热力学参数等,并观察BSA构象在结合前后的变化,以期进一步阐明α-西柏三烯二醇在血液中的结合与运输情况,为其在食品、保健品、新药组分等领域的设计和开发提供理论基础。
1. 材料与方法
1.1 材料与仪器
牛血清白蛋白 纯度≥98%,北京索莱宝科技有限公司;α-西柏三烯二醇 纯度≥97.5%,云南西力生物技术股份有限公司;华法林钠(纯度≥98%)、布洛芬(纯度≥98%)、甲醇(分析纯) 上海阿拉丁生化科技股份有限公司;PBS磷酸盐缓冲液 0.01 mol/L,pH7.4,上海源叶生物科技有限公司。
Hitachi-F4600荧光光谱仪、UH5300紫外分光光度计 日本日立公司;Jasco J-815圆二色谱仪 日本分光株式会社;T440塔式服务器 美国戴尔股份有限公司。
1.2 实验方法
1.2.1 样品准备
使用PBS缓冲液制备浓度为3 μmol/L的牛血清白蛋白(BSA)溶液(pH7.4,甲醇含量1%);用甲醇溶解α-西柏三烯二醇,并用PBS缓冲液稀释,配制浓度为3.0 mmol/L的α-西柏三烯二醇溶液(甲醇含量5%);分别用PBS缓冲液配制浓度为3.0 mmol/L的华法林钠和布洛芬溶液。
1.2.2 α-西柏三烯二醇与BSA相互作用的紫外光谱分析
在室温下,向比色杯中加入1 mL牛血清白蛋白溶液,并进行紫外吸收光谱检测,波长扫描范围为200~500 nm[16]。检测结束后,逐次向比色杯中加入1 μL α-西柏三烯二醇溶液(使药物作用浓度分别为0、3、6、9、12、15、18、21、24、27、30 μmol/L,后同),每次加入药品后,反应平衡5 min后分别检测,以相应浓度的α-西柏三烯二醇做参比溶液。
1.2.3 α-西柏三烯二醇与BSA相互作用的内源荧光光谱分析
向石英比色杯中加入3 mL BSA溶液,用荧光光谱仪检测其荧光光谱[17]。检测结束后,逐次向比色杯中加入3 μL α-西柏三烯二醇溶液,每次加入药品后,反应平衡5 min,然后分别检测反应体系的荧光光谱。在实验中,激发电压设置为400 V,激发狭缝和发射狭缝设置为5 nm。发射光谱激发波长λex分别设置为278和295 nm,扫描波长范围为300~400 nm,分别在293、303和310 K三个温度下进行检测。
根据278 nm激发内源光谱结果,采用Stern-Volmer方程计算猝灭常数:
F0F=1+Kqτ0[Q]=1+KSV[Q] (1) 式中,F0和F分别表示BSA和BSA-α-西柏三烯二醇反应体系的荧光强度。Kq、τ0、[Q]和KSV,分别代表猝灭速率常数、荧光寿命(生物大分子在激发态的τ0值为10−8 s)、α-西柏三烯二醇摩尔浓度和Stern-Volmer猝灭常数[18]。
采用Lineweaver-Burk双对数方程探究结合常数(Kb)和结合点位数(n):
log(F0−F)F=logKb+nlog[Q] (2) 式中,F0和F分别是BSA和BSA-α-西柏三烯二醇反应体系的荧光强度,[Q]为α-西柏三烯二醇的浓度[18]。
采用Van’t Hoff方程探究热力学参数:
lnKb=−ΔHRT+ΔSR (3) ΔG=ΔH−TΔS (4) 式中,ΔH为焓,ΔS为熵,ΔG为吉布斯自由能,Kb为结合常数,R为热力学常数,T为热力学温度[19] 。
1.2.4 α-西柏三烯二醇与BSA相互作用的同步荧光光谱和三维荧光光谱分析
样品处理同内源荧光光谱。同步荧光光谱波长扫描范围为250~350 nm,在310 K条件下,分别检测Δλ(Δλ=激发光波长−发射光波长)为15和60 nm时的光谱数据。三维荧光光谱实验发射光波长范围设置为200~500 nm,激发光波长范围设置为200~350 nm,扫描速度为12000 nm/min,检测温度为310 K。
1.2.5 α-西柏三烯二醇与BSA相互作用的圆二色谱分析
在室温条件下,使用1 mm光程的石英比色杯记录了远紫外圆二色谱。BSA样品浓度3 μmol/L,α-西柏三烯二醇处理终浓度分别为 0、3、9和15 μmol/L。实验中,固定扫描波长在200~250 nm,数据间隔为1 nm,激发光和发射光狭缝都设定为1 nm,并将扫描速度调整为50 nm/min。采用CDNN 2.1去卷积软件进行数据分析估算BSA反应体系的二级结构[20]。
1.2.6 α-西柏三烯二醇与BSA相互作用的荧光探针取代实验
α-西柏三烯二醇与BSA混合反应5 min后(终浓度Cα-西柏三烯二醇=CBSA=3 μmol/L),用微量进样器向反应体系依次加入荧光探针布洛芬溶液,使混合溶液中布洛芬的终浓度从0逐渐升高到30 μmol/L,每次混匀静置5 min后开始进行检测。检测参数同内源荧光光谱,激发波长为278 nm,温度为299 K。同种方法,以法华林为探针,重复以上实验。
采用Sudlow探针取代计算方法计算取代情况:
P(Probedisplacement)=F2F1 (5) 式中,P(Probedisplacement)代表取代情况,F1为不加布洛芬(法华林)时反应体系的荧光强度,F2为加入不同浓度布洛芬(法华林)后反应体系的荧光强度。
1.2.7 α-西柏三烯二醇与BSA相互作用的分子对接模拟实验
BSA晶体结构从RSCB数据库下载(PDB_ID:4F5S),α-西柏三烯二醇的三维结构从PubChem网站中下载(PubChem_ID: 6438508)。使用AutoDock Vina程序执行分子对接[21],根据对接结果,选择结合能量低和构象合理的对接结果进行下一步结合模式分析和分子动力学模拟。
1.2.8 α-西柏三烯二醇与BSA相互作用的分子动力学模拟实验
运用GROMACS 4.6.5软件,对BSA和BSA-α-西柏三烯二醇体系进行分子动力学模拟[22]。使用GROMACS 4.6.5自带的程序pdb2gmx产生BSA的拓扑结构文件,使用AmberTools15自带的程序antechamber和tleap产生α-西柏三烯二醇小分子拓扑文件,采用GAFF(general amber force field)力场,对反应体系进行20 ns的分子动力学模拟分析。
1.3 数据处理
所有光谱实验均设置3组重复,并扣除背景光谱信号,实验结果以平均值±标准差(¯x±s)表示。采用SAS 8.0软件对数据进行统计方差分析,采用Duncan程序进行差异显著性分析(P<0.05,差异显著),采用Origin 2018软件进行绘图。
2. 结果与分析
2.1 α-西柏三烯二醇与BSA相互作用的紫外吸收光谱
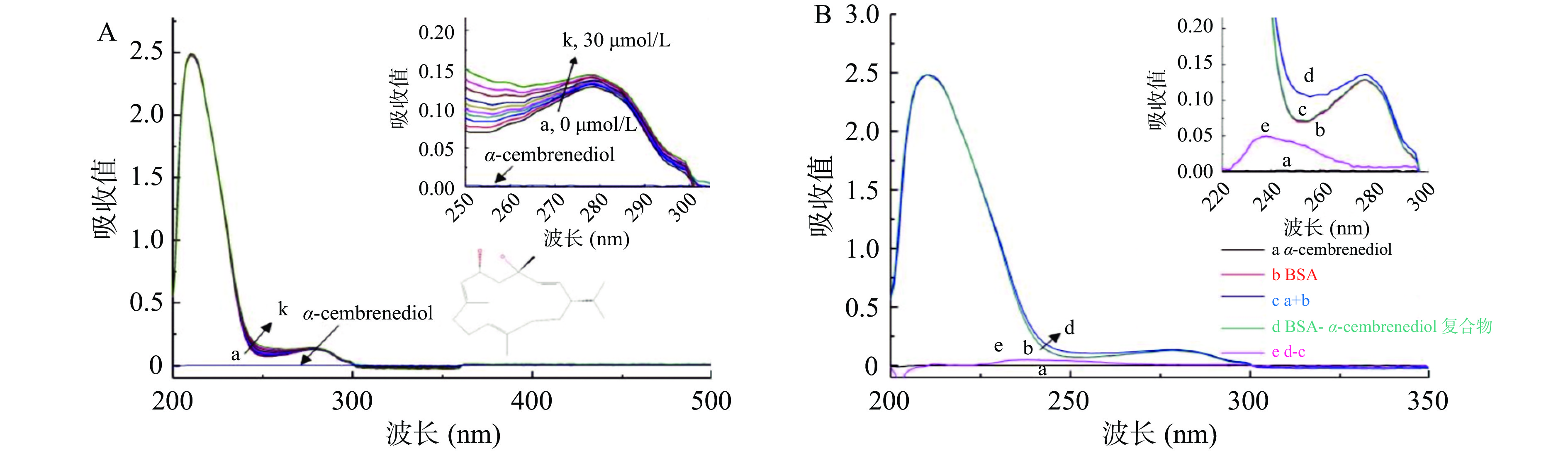
根据紫外光谱显示(图1),BSA在波长230 nm处出现强吸收峰,这是BSA骨架结构(α-螺旋)的典型特征,同时,在280 nm附近也有一个较弱的吸收峰,这是由芳香族氨基酸(色氨酸、酪氨酸和苯丙氨酸)引起的[23]。如图1A所示,随着α-西柏三烯二醇浓度的增加,BSA与α-西柏三烯二醇反应体系在280 nm处的吸收值呈规律性增加,并伴随轻微的蓝移现象,暗示α-西柏三烯二醇与BSA发生了相互作用,导致BSA芳香族残基周围的微环境由于络合作用而发生了改变[24]。如图1B所示,BSA-α-西柏三烯二醇反应体系(d)的吸收光谱明显不同于游离BSA(b)和α-西柏三烯二醇(a)的光谱总和(c),这进一步证实了静态配合物的形成。
2.2 α-西柏三烯二醇与BSA相互作用的荧光光谱
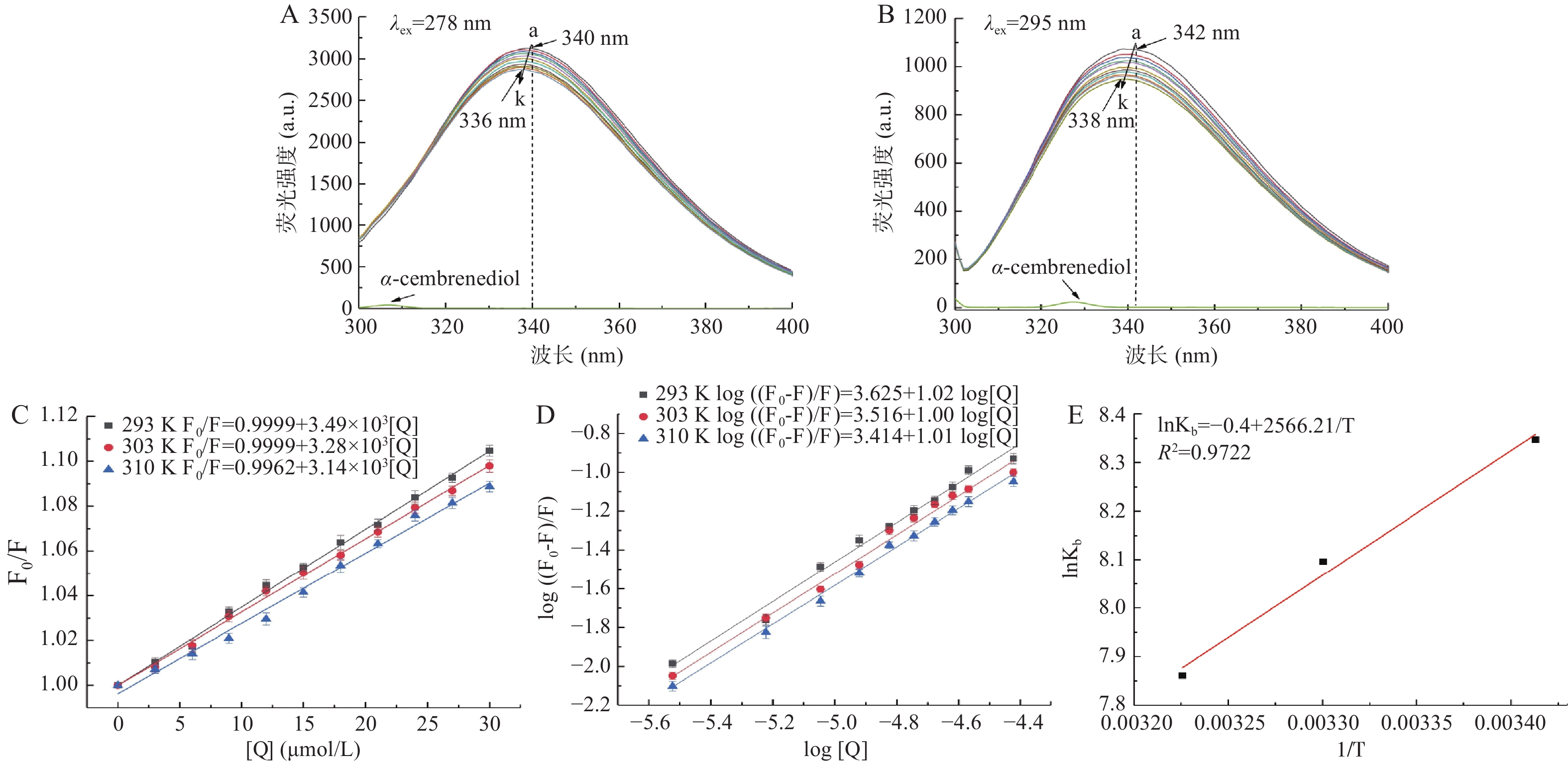
荧光光谱是研究受体-配体相互作用的常用方法,因其便捷性、高效性和灵敏性而被广泛应用。基于荧光光谱的结果,可以进一步确定受体和配体分子的结合模式和类型。当激发光λex=278和295 nm时,分别能特异性地反映BSA中色氨酸残基和酪氨酸残基荧光信号[17]。根据图2A的结果,当λex=278 nm时,在340 nm附近出现BSA的强荧光发射峰,随着α-西柏三烯二醇的加入和浓度的升高,BSA的荧光强度呈线性降低,并且最大发射峰的位置蓝移,从340 nm移动到了336 nm,表明α-西柏三烯二醇与BSA发生了相互作用,导致色氨酸残基的疏水性增加,进而引起色氨酸残基荧光信号发生猝灭。由图2B可知,当λex=295 nm时,实验现象与λex=278 nm时类似,随着α-西柏三烯二醇的加入和浓度的升高,BSA的荧光强度也呈线性降低,最大发射峰的位置蓝移,从342 nm了移动到338 nm,同样证明了α-西柏三烯二醇与BSA发生了相互作用,导致氨基酸残基微环境发生改变,荧光信号发生猝灭。综上,这些结果表明,α-西柏三烯二醇与BSA之间存在着较强的相互作用。
荧光猝灭的机制通常被分类为动态猝灭、静态猝灭或二者的组合。荧光猝灭常数是确定分子之间动态和静态猝灭的关键数据。对于静态猝灭,猝灭常数随着温度升高而减小,而对于动态猝灭,随着温度升高,分子碰撞加速,导致动态猝灭速率更快,猝灭常数增加。为了阐明α-西柏三烯二醇与BSA之间的复合物形成,采用Stern-Volmer方程(公式1)来研究其猝灭常数,如图2C和表1所示,随着温度的升高,α-西柏三烯二醇与BSA的猝灭常数(KSV)呈现逐渐降低的趋势,这符合荧光静态猝灭的典型特征[21],且在293、303和310 K温度条件下,Kq值分别为3.49×1011 、3.28×1011 和3.14×1011 L·mol−1·s−1,远高于最大扩散碰撞猝灭速率常数(2.0×1010 L·mol−1·s−1),进一步暗示α-西柏三烯二醇对BSA的荧光猝灭机制属于静态猝灭。
表 1 不同温度下α-西柏三烯二醇与BSA的Stern-Volmer方程及猝灭常数Table 1. Stern-volmer equation and quenching constants of α-cembrenediol and BSA at different temperaturesT(K) Stern-Volmer equation KSV(L·mol−1) Kq(L·mol−1·s−1) R2 293 F0/F=0.9999+3.49×103[Q] 3.49×103 3.49×1011 0.9974 303 F0/F=0.9999+3.28×103[Q] 3.28×103 3.28×1011 0.9979 310 F0/F=0.9962+3.14×103[Q] 3.14×103 3.14×1011 0.9914 为了计算BSA与α-西柏三烯二醇的结合常数(Kb)和结合点位数(n),采用了Lineweaver-Burk双对数方程(公式2)。如图2D和表2所示,在310 K温度条件下,α-西柏三烯二醇与BSA的结合常数(Kb)为2.59×103 L·mol−1,随着温度降低到303 K和293 K,结合常数(Kb)分别升高到3.28×103 和4.22×103 L·mol−1,这表明温度降低会增强α-西柏三烯二醇与BSA的结合程度,进一步证实两者之间的结合是静态结合[21]。此外,在这三个温度条件下,α-西柏三烯二醇与BSA结合位点数(n)均约等于1,这意味着α-西柏三烯二醇在BSA结构上只有一个独立的结合位点。
表 2 不同温度下BSA与α-西柏三烯二醇的结合位点数、结合常数以及热力学参数Table 2. Number of binding sites, binding constants and thermodynamic constants of α-cembrenediol with BSA at different temperaturesT(K) Kb(L·mol−1) n R ΔG
(kJ·mol−1)ΔH
(kJ·mol−1)ΔS
(J·mol−1·K−1)293 4.22×103 1.02 0.9877 −20.36 −21.34 −3.33 303 3.28×103 1.00 0.9886 −20.33 −21.34 −3.33 310 2.59×103 1.01 0.9947 −20.30 −21.34 −3.33 在热力学过程中,焓(ΔH)、熵(ΔS)和吉布斯自由能变化(ΔG)常被用于判断配体和蛋白质之间的结合模式和主要作用力。当ΔH>0和ΔS>0时,意味着疏水相互作用起主要作用,当 ΔH<0和ΔS>0时,静电力更重要,当ΔH<0和ΔS<0时,表明范德华力或氢键是配体与大分子之间的主要相互作用力[22]。为了确定α-西柏三烯二醇与BSA之间的主要驱动力,采用Van’t Hoff 方程(公式3和4)分别在293、303和310 K三种不同温度下测定了BSA与α-西柏三烯二醇相互作用的热力学参数,实验结果如图2E和表2所示,BSA与α-西柏三烯二醇相互作用的ΔG均为负数,表明两者的结合是一个自发过程,同时ΔH和ΔS均小于0,暗示范德华力或氢键是两者相互作用的主要驱动力。
2.3 α-西柏三烯二醇与BSA相互作用的同步荧光光谱
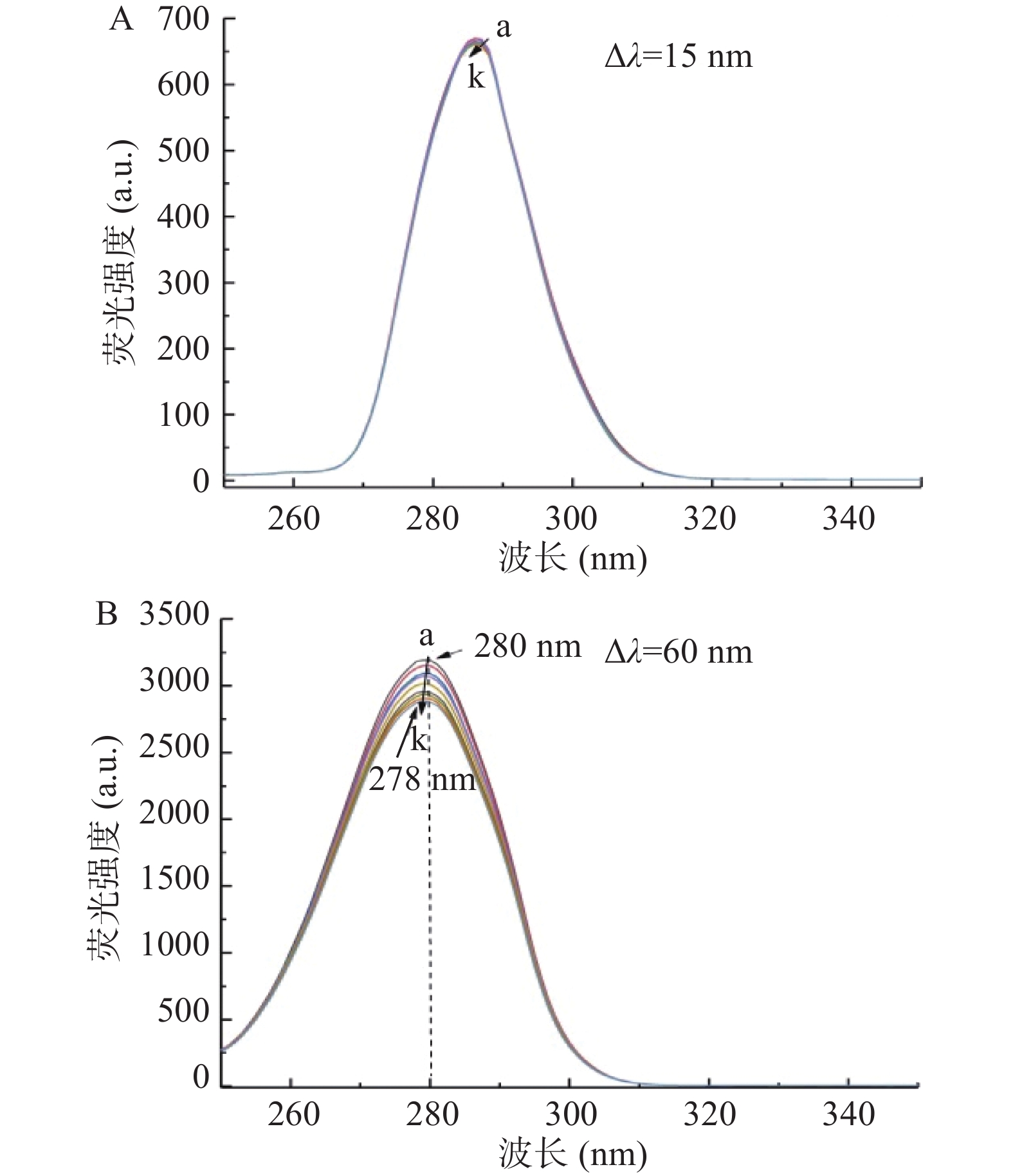
同步荧光光谱在Δλ=15和60 nm时,分别特异性地反映蛋白质中酪氨酸和色氨酸的微环境改变[24]。实验结果如图3A所示,在Δλ=15 nm时,随着α-西柏三烯二醇浓度的增加,BSA的荧光强度和最大发射峰位置没有发生明显变化,这表明,α-西柏三烯二醇与BSA的结合没有引起酪氨酸残基微环境发生明显变化。从图3B(Δλ=60 nm)可以看出,随着α-西柏三烯二醇浓度的增加,BSA的荧光强度明显降低,最大发射峰位置蓝移了2 nm,这表明BSA色氨酸残基所处的微环境都发生变化,疏水性增强,极性减弱。
2.4 α-西柏三烯二醇与BSA相互作用的三维荧光光谱
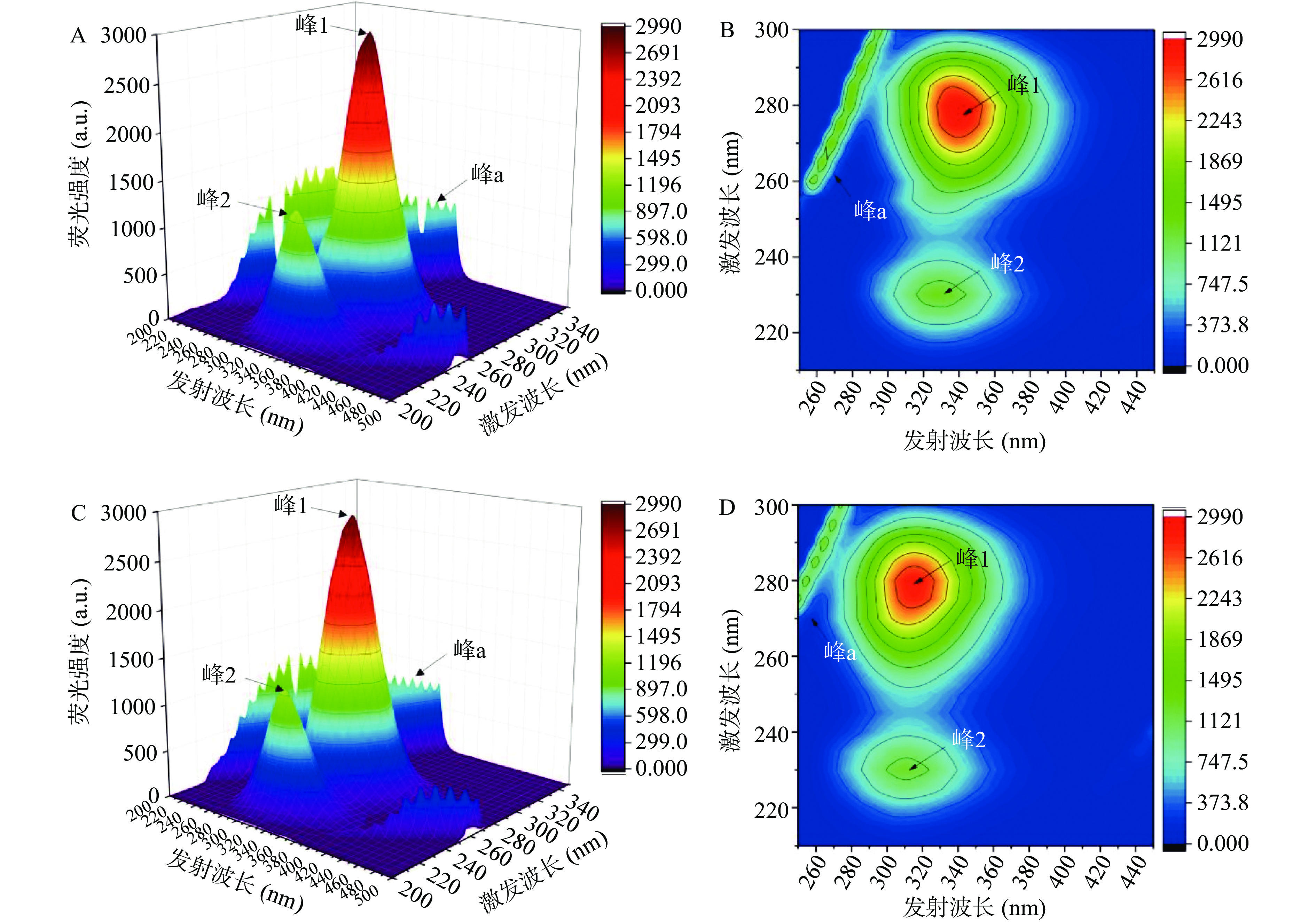
三维荧光光谱可以更全面地展示酪氨酸和色氨酸这些发色团的荧光信息,从而更具特征性地反映蛋白质结构的变化[25]。图4分别显示了单独的 BSA 和 BSA-α-西柏三烯二醇复合物的三维荧光等高线图和“鸟瞰”视图,描述性参数值列于表3中。峰a为瑞利散射峰(λex=λem),峰1(λex=280 nm,λem=340 nm)特征性地反映 BSA发色团的光谱行为,另一个强荧光峰2(λex=230 nm,λem=330 nm)则特征性地反映BSA多肽骨架结构的荧光。与游离的BSA相比,加入α-西柏三烯二醇后,BSA峰1和峰2的荧光强度明显减弱,且与荧光光谱结果一致,峰的位置发生了不同程度的蓝移,表明BSA-α-西柏三烯二醇复合物的形成,使得BSA分子的微环境发生了明显的变化。
表 3 α-西柏三烯二醇与BSA相互作用的三维荧光特性数据Table 3. Three-dimensional fluorescence characteristics data of the interaction between α-cembrenediol and BSA系统 峰1
(λex/λem)斯托克斯频移
(Δλ)=λem−λex荧光强度 峰2
(λex/λem)斯托克斯频移
(Δλ)=λem−λex荧光强度 BSA 280/340 60 2981 230/330 100 1313 BSA-α-西柏三烯二醇 280/315 35 2891 230/310 80 1262 2.5 α-西柏三烯二醇与BSA相互作用的圆二色谱
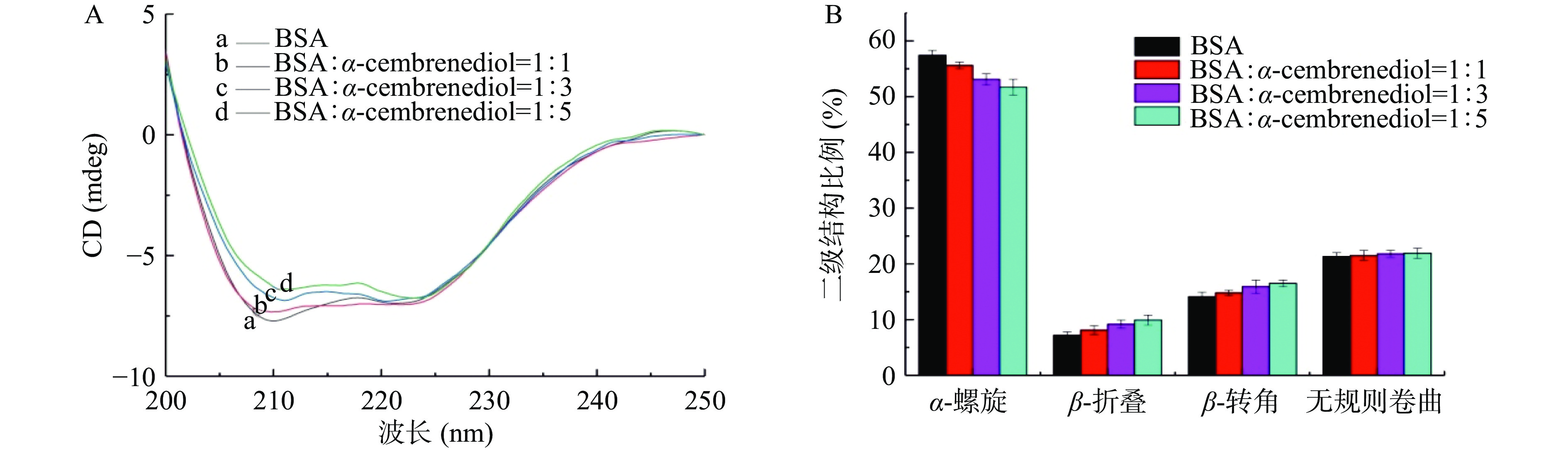
圆二色谱是一种常用的确定蛋白质二级结构的方法,为了监测BSA的构象变化,采用 Far-UV CD在远紫外区(200~250 nm)进行光谱检测。BSA的CD光谱在209和222 nm附近表现出两个强烈的负吸收带,这是由α-螺旋结构的肽键中的n → π*位移引起的[18]。如图5A所示,在将α-西柏三烯二醇加入到固定浓度的BSA溶液(3 μmol/L)之后,典型α-螺旋结构的两个特征峰的强度逐渐降低,并且在209 nm附近产生明显的红移,这表明随着α-西柏三烯二醇含量的增加,BSA分子的二级结构发生了变化,暗示它们之间存在相互作用。此外,BSA的二级结构的变化可能与疏水腔内芳香族残基周围的微环境扰动密切相关,这也进一步解释了BSA发生荧光猝灭的原因。经CDNN软件进行估算,如图5B所示,随着α-西柏三烯二醇从0升高到15 μmol/L,BSA的α-螺旋结构占比由初始的57.4%下降到51.7%,β-折叠结构由7.2%增加到9.9%,β-转角结构由14.1%增加到16.5%,无规则卷曲结构的含量基本保持不变。
2.6 α-西柏三烯二醇与BSA相互作用的荧光探针取代实验
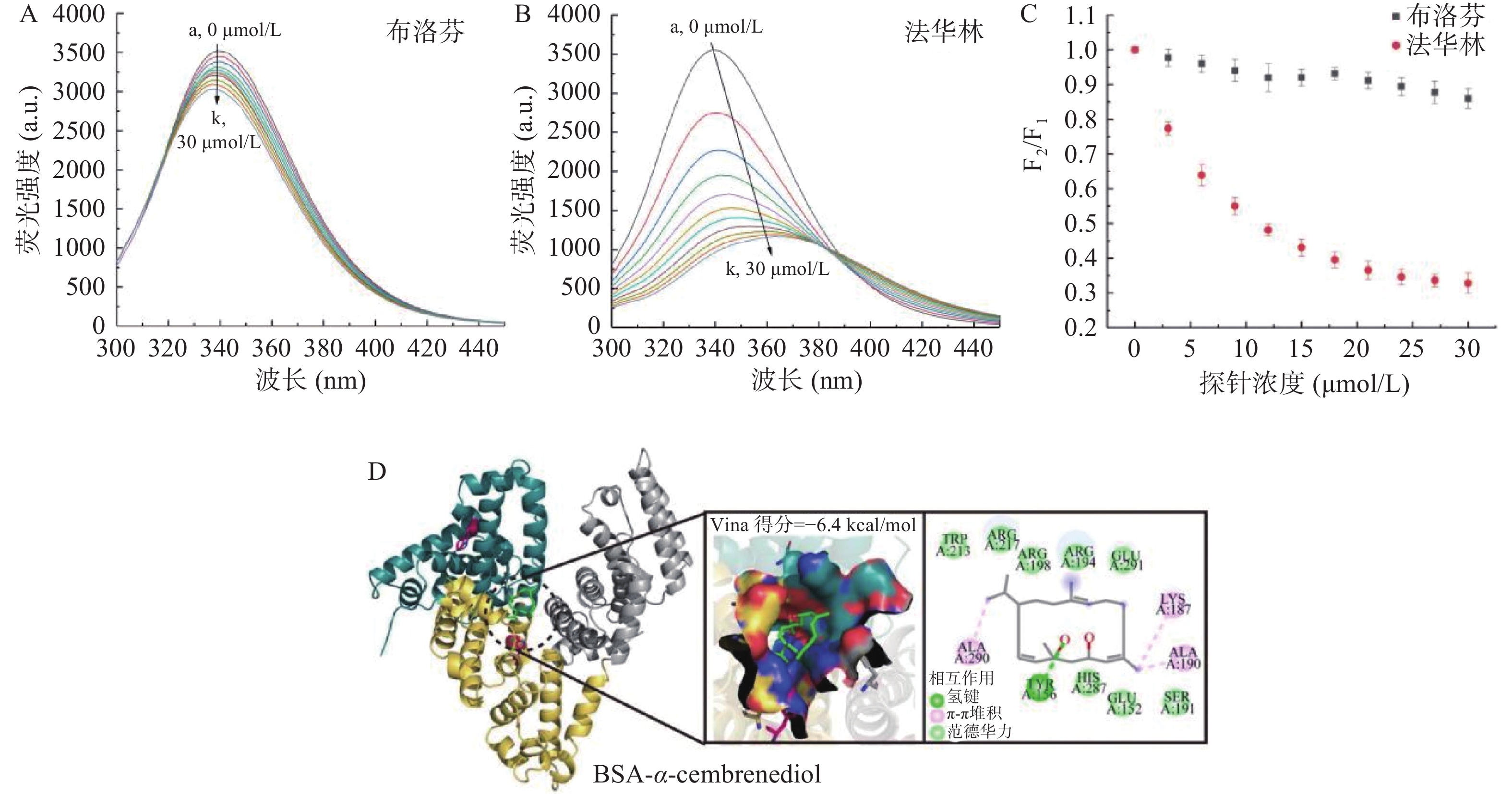
小分子配体主要结合在BSA的两个亚结构域上,例如法华林特异性地与BSA亚结构域ⅡA(Sudlow位点 I)结合,而布洛芬则特异性地与BSA亚结构域ⅢA(Sudlow位点 I)结合[26]。为了确定α-西柏三烯二醇在BSA上的结合位置,选择法华林和布洛芬作为荧光探针,对α-西柏三烯二醇是否被取代进行检测。根据式(5)进行计算,从图6A~C可以看出,荧光探针布洛芬对BSA和α-西柏三烯二醇复合物的荧光性质影响较小,表明布洛芬不能干扰BSA和α-西柏三烯二醇的结合。相反,当荧光探针法华林加入BSA-α-西柏三烯二醇反应体系时,荧光强度明显猝灭,且最大发射波长出现339至365 nm的红移,这表明了BSA和α-西柏三烯二醇复合物明显受到法华林探针的影响,这暗示在BSA上α-西柏三烯二醇与法华林具有相同的结合位点,即亚结构域ⅡA(Sudlow位点I)。
2.7 α-西柏三烯二醇与BSA相互作用的分子对接模拟
分子对接是一种用于分子相互作用分析的有效方法,可以提供关于α-西柏三烯二醇和BSA之间相互作用的更多信息。为了进一步了解α-西柏三烯二醇在牛血清白蛋白位点I和II的结合方式,在这两个位点上分别进行了分子对接模拟实验[19]。实验结果显示,α-西柏三烯二醇与BSA结合在位点I和II上获得的最低结合能分别为−6.4和−4.5 kcal/mol,这表明α-西柏三烯二醇对位点I的结合亲和力相对更高,这与荧光探针取代实验结果一致。此外,由荧光光谱计算的结合能为−21.34 kJ/mol(即−5.10 kcal/mol),这也与通过分子对接研究计算的结合能非常接近。由图6D可以看出,在位点I处,α-西柏三烯二醇由BSA残基形成的“口袋”包围,其中,以亲水性的氨基酸为主,主要有Glu152、Tyr156、Lys187、Ser191、Arg194、Arg198、Trp213、Arg217、Glu291、His287等,疏水性的氨基酸有Ala190、Ala290,此外,α-西柏三烯二醇还与Tyr156形成了H键,键距为2.3 Å,由此可见,这些离子和极性残基通过氢键和范德华力相互作用,在BSA-α-西柏三烯二醇复合物的稳定性中起主要作用,这也与荧光光谱热力学计算得出的结论一致。且Trp213残基与α-西柏三烯二醇产生了相互作用,这也进一步解释了色氨酸的荧光会发生明显猝灭的原因。
2.8 α-西柏三烯二醇与BSA相互作用的分子动力学模拟
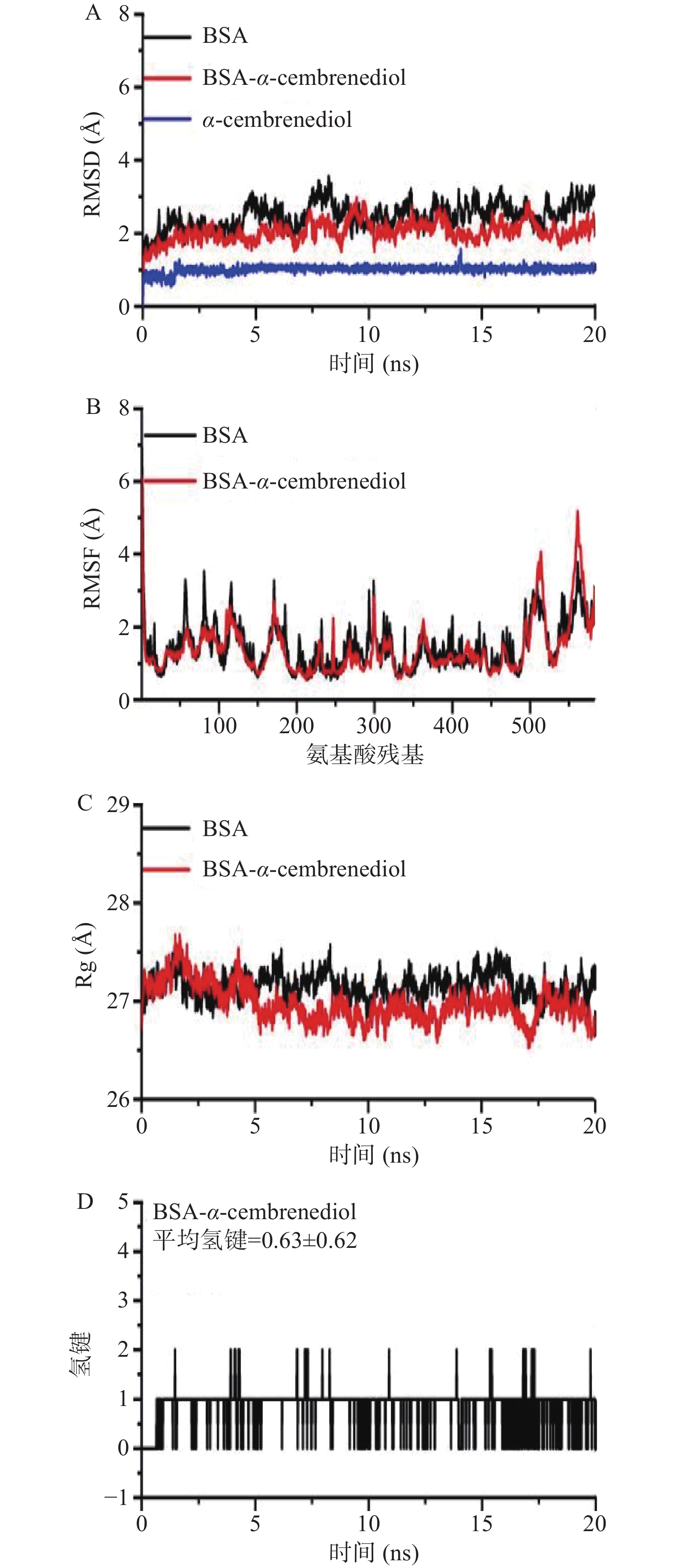
通过分子动力学模拟,可以更好地了解蛋白质和配体在生理状态下随时间变化的结合情况。通过BSA和BSA-α-西柏三烯二醇复合物的RMSD图,在20 ns模拟时间尺度下评估BSA和BSA-α-西柏三烯二醇复合物的刚性和稳定性[27],如图7A所示,0~5 ns时,BSA和BSA-α-西柏三烯二醇复合物的 RMSD值开始逐渐增加,在此之后,系统达到了平衡阶段,并围绕一个平均RMSD值振荡,直到模拟结束,这表明系统在整个模拟过程中是稳定的。值得注意的是,BSA-α-西柏三烯二醇复合物的RMSD值整体上明显小于单独BSA,表明α-西柏三烯二醇与BSA的结合使BSA二级构象发生改变,使其具有更高的刚性和稳定性。
均方根波动(RMSF)能够反映配体与蛋白受体结合的柔韧性[28]。BSA和BSA-α-西柏三烯二醇复合物的RMSF值如图7B所示,与BSA相比,均方根波动曲线显示BSA-α-西柏三烯二醇复合物的波动更低,在位点I处的Glu152、Tyr156、Lys187、Ser191、Arg194、Arg198、Trp213、Arg217、His28、Glu291等残基的RMSF值明显低于单独BSA,表明α-西柏三烯二醇可以稳定地结合到这些关键残基上,进一步证实α-西柏三烯二醇结合在BSA结合位点I。
配体与蛋白受体结合的紧凑情况可以通过回旋半径(Rg)反映[29]。从图7C可以看出,α-西柏三烯二醇结合到BSA后,Rg值略有下降,表明α-西柏三烯二醇结合BSA后导致BSA的构象变得更加紧凑,Rg和RMSD结果与圆二色谱实验结果一致,即α-西柏三烯二醇结合到BSA上导致蛋白质构象的改变,α螺旋含量降低。
氢键是配体与蛋白受体结合的主要作用力之一[30],图7D分析了α-西柏三烯二醇与BSA结合时氢键的变化,实验结果表明,BSA-α-西柏三烯二醇反应体系的氢键平均值为0.63,与对接模型1个氢键的结果十分接近,进一步证实氢键也是α-西柏三烯二醇与BSA的主要作用力之一。
3. 讨论与结论
本研究在模拟生理条件下,采用紫外光谱、荧光光谱、圆二色谱和计算机模拟技术,对α-西柏三烯二醇与牛血清白蛋白(BSA)的相互作用进行了深入探索。
紫外吸收光谱结果显示,α-西柏三烯二醇加入BSA溶液后,导致其吸收光谱发生明显变化,表明α-西柏三烯二醇与BSA之间存在着强烈的相互作用,引起BSA芳香族残基周围的微环境发生了改变。内源荧光光谱结果进一步显示,α-西柏三烯二醇与BSA结合,会导致BSA色氨酸残基和酪氨酸残基微环境疏水性增加,极性降低,从而引起荧光信号发生猝灭。为了判断两者结合的淬灭机制,进行了猝灭常数的计算,发现随着温度升高,两者结合的猝灭常数逐渐降低,表明α-西柏三烯二醇与BSA之间的荧光猝灭机制属于静态猝灭。为了评估两者之间的结合程度,进一步对其结合常数(Kb)和结合点位数(n)进行了计算,发现α-西柏三烯二醇在BSA结构上只有一个独立的结合位点,且随着温度升高,BSA与α-西柏三烯二醇的结合常数(Kb)逐渐降低,进一步证实了两者的结合方式为静态结合。为了判断两者静态结合的主要作用力,进行了热力学参数分析,发现范德华力以及氢键是两者相互作用的主要驱动力。
为了探究了α-西柏三烯二醇与BSA结合后对BSA结构的影响,进行了同步荧光光谱、三维荧光光谱、圆二色谱等研究,同步荧光光谱结果显示,α-西柏三烯二醇与BSA发生相互作用,引起了BSA氨基酸残基的微环境发生改变,色氨酸残基疏水性增强,极性减弱;三维荧光光谱结果显示,两者的结合导致BSA多肽骨架结构发生了变化;圆二色谱结果进一步表明,两者的结合导致BSA分子的α-螺旋结构占比降低,β-折叠结构和β-转角结构的含量增加。为了明确α-西柏三烯二醇在BSA上的具体结合位点,开展了荧光探针取代实验和分子对接模拟实验,荧光探针取代实验发现,布洛芬对BSA和α-西柏三烯二醇复合物的荧光性质影响较小,而法华林探针加入后,荧光强度明显猝灭,最大发射波长红移,表明BSA和α-西柏三烯二醇复合物受到法华林探针的影响,暗示在BSA上,α-西柏三烯二醇与法华林具有相同的结合位点,即亚结构域ⅡA(Sudlow位点 I),分子对接模拟实验结果显示,α-西柏三烯二醇与BSA结合在位点I和II上的最低结合能分别为−6.4和−4.5 kcal/mol,表明α-西柏三烯二醇对位点I的结合亲和力相对更高,进一步证实,α-西柏三烯二醇结合在BSA的结合位点I上。
为了了解α-西柏三烯二醇与BSA在生理状态下随时间变化的结合情况,开展了分子动力学模拟实验,结果显示,在模拟时间尺度下,BSA和BSA-α-西柏三烯二醇复合物的RMSD值(均方根偏离)逐渐增加并达到平衡状态,表明系统是稳定的。BSA-α-西柏三烯二醇复合物的RMSD值整体上小于单独的BSA,表明α-西柏三烯二醇的结合使BSA更具刚性和稳定性。此外,通过RMSF值(均方根波动)和Rg值(回旋半径)的分析,进一步证实了α-西柏三烯二醇结合在BSA的结合位点I上。
本研究通过探究α-西柏三烯二醇与BSA的结合过程,初步阐明了BSA与α-西柏三烯二醇相互作用的基本信息,加深了对基于血清白蛋白的体内α-西柏三烯二醇转运系统的认识,为促进α-西柏三烯二醇在食品、保健品以及医药产品的设计和开发提供必要的理论基础。
-
表 1 不同温度下α-西柏三烯二醇与BSA的Stern-Volmer方程及猝灭常数
Table 1 Stern-volmer equation and quenching constants of α-cembrenediol and BSA at different temperatures
T(K) Stern-Volmer equation KSV(L·mol−1) Kq(L·mol−1·s−1) R2 293 F0/F=0.9999+3.49×103[Q] 3.49×103 3.49×1011 0.9974 303 F0/F=0.9999+3.28×103[Q] 3.28×103 3.28×1011 0.9979 310 F0/F=0.9962+3.14×103[Q] 3.14×103 3.14×1011 0.9914 表 2 不同温度下BSA与α-西柏三烯二醇的结合位点数、结合常数以及热力学参数
Table 2 Number of binding sites, binding constants and thermodynamic constants of α-cembrenediol with BSA at different temperatures
T(K) Kb(L·mol−1) n R ΔG
(kJ·mol−1)ΔH
(kJ·mol−1)ΔS
(J·mol−1·K−1)293 4.22×103 1.02 0.9877 −20.36 −21.34 −3.33 303 3.28×103 1.00 0.9886 −20.33 −21.34 −3.33 310 2.59×103 1.01 0.9947 −20.30 −21.34 −3.33 表 3 α-西柏三烯二醇与BSA相互作用的三维荧光特性数据
Table 3 Three-dimensional fluorescence characteristics data of the interaction between α-cembrenediol and BSA
系统 峰1
(λex/λem)斯托克斯频移
(Δλ)=λem−λex荧光强度 峰2
(λex/λem)斯托克斯频移
(Δλ)=λem−λex荧光强度 BSA 280/340 60 2981 230/330 100 1313 BSA-α-西柏三烯二醇 280/315 35 2891 230/310 80 1262 -
[1] RODRIGUES I, MIGUEL M, MNIF W. A brief review on new naturally occurring cembranoid diterpene derivatives from the soft corals of the genera Sarcophyton, Sinularia, and Lobophytum since 2016[J]. Molecules,2019,24:781−813. doi: 10.3390/molecules24040781
[2] 鞠馥竹, 张洪博, 闫宁, 等. 烟草西柏三烯二醇含量的遗传分析[J]. 中国烟草科学,2021,42(1):1−6. [JU F Z, ZHANG H B, YAN N. Genetic analysis of cembratrien-diols content in tobacco[J]. Chinese Tobacco Science,2021,42(1):1−6.] JU F Z, ZHANG H B, YAN N. Genetic analysis of cembratrien-diols content in tobacco[J]. Chinese Tobacco Science, 2021, 42(1): 1−6.
[3] SAITO Y, TAKIZAWA H, KONISHI S, et al. Identification of cembratriene-4, 6-diol as antitumor-promoting agent from cigarette smoke condensate[J]. Carcinogenesis,1985,6:1189−1194. doi: 10.1093/carcin/6.8.1189
[4] HAILAT M M, EBRAHIM H Y, MOHYELDIN M M, et al. The tobacco cembranoid (1S, 2E, 4S, 7E, 11E)-2, 7, 11-cembratriene-4, 6-diol as a novel angiogenesis inhibitory lead for the control of breast malignancies[J]. Bioorg Med Chem,2017,25:3911−3921. doi: 10.1016/j.bmc.2017.05.028
[5] EBRAHIM H Y, MOHYELDIN M M, HAILAT M M, et al. (1S, 2E, 4S, 7E, 11E)-2, 7, 11-Cembratriene-4, 6-diol semisynthetic analogs as novel c-Met inhibitors for the control of c-Met-dependent breast malignancies[J]. Bioorg Med Chem,2016,24(22):5748−5761. doi: 10.1016/j.bmc.2016.09.032
[6] YUAN X L, MAO X X, DU Y M, et al. Anti-tumor activity of cembranoid-type diterpenes isolated from Nicotiana tabacum L[J]. Biomolecules,2019,9(2):45. doi: 10.3390/biom9020045
[7] 毛新新, 侯小东, 杜咏梅, 等. 烟草α-西柏三烯二醇的分离及抑制HepG2细胞活性研究[J]. 中国烟草科学,2017,38(3):80−85. [MAO X X, HOU X D, DU Y M, et al. Isolation and anti-HepG2 activity study of α-cembratriene-diol from tobacco[J]. Chinese Tobacco Science,2017,38(3):80−85.] MAO X X, HOU X D, DU Y M, et al. Isolation and anti-HepG2 activity study of α-cembratriene-diol from tobacco[J]. Chinese Tobacco Science, 2017, 38(3): 80−85.
[8] SHEN S M, LI W S, DING X, et al. Ximaoglaucumins A-F, new cembranoids with anti-inflammatory activities from the South China sea soft coral Sarcophyton glaucum[J]. Bioorg Med Chem, 2021, 38:11 639−11648.
[9] 刘雨露, 张建会, 付秋娟, 等. 烟草西柏三烯二醇稳定性及其抑菌活性研究[J]. 中国烟草科学,2020,41(6):82−87. [LIU Y L, ZHANG J H, FU Q J, et al. Study on the stability of tobacco cembratrien-diols and their antifungal activities[J]. Chinese Tobacco Science,2020,41(6):82−87.] LIU Y L, ZHANG J H, FU Q J, et al. Study on the stability of tobacco cembratrien-diols and their antifungal activities[J]. Chinese Tobacco Science, 2020, 41(6): 82−87.
[10] PENG C C, HUANG C A, AHMED A F, et al. Anti-inflammatory cembranoids from a Formosa soft coral Sarcophyton cherbonnieri[J]. Mar Drugs,2020,18(11):573−585. doi: 10.3390/md18110573
[11] SABEVA N, PAGÁN O R, FERRER-ACOSTA Y, et al. In vivo evaluation of the acute systemic toxicity of (1S, 2E, 4R, 6R, 7E, 11E)-cembratriene-4, 6-diol (4R) in Sprague Dawley rats[J]. Nutraceuticals (Basel),2022,2(2):60−70. doi: 10.3390/nutraceuticals2020005
[12] FERCHMIN P A, ANDINO M, REYES SALAMAN R, et al. 4R-cembranoid protects against diisopropylfluorophosphate-mediated neurodegeneration[J]. Neurotoxicology,2014,44:80−90. doi: 10.1016/j.neuro.2014.06.001
[13] 杨元鑫, 阮建成, 边腾飞, 等. 西柏三烯二醇分析、纯化及降解机理研究进展[J]. 高效化学工程学报,2022,1:1−8. [YANG Y X, RUAN J C, BIAN T F, et al. Research progress on analysis, purification and degradation mechanism of cembratriene-diols[J]. Journal of Chemical Engineering of Chinese Universities,2022,1:1−8.] YANG Y X, RUAN J C, BIAN T F, et al. Research progress on analysis, purification and degradation mechanism of cembratriene-diols[J]. Journal of Chemical Engineering of Chinese Universities, 2022, 1: 1−8.
[14] SAHA D, RAY D, KUMAR S, et al. Interaction of a bovine serum albumin (BSA) protein with mixed anionic-cationic surfactants and the resultant structure[J]. Soft Matter,2021,17(29):6972−6984. doi: 10.1039/D1SM00264C
[15] MADHUMITHA D, DHATHATHREYAN A. Interaction of myoglobin colloids with BSA in solution:Insights into complex formation and elastic compliance[J]. Int J Biol Macromol,2017,105(Pt1):1259−1268.
[16] ZKANG X, LI L, XU Z, et al. Investigation of the interaction of naringin palmitate with bovine serum albumin:Spectroscopic analysis and molecular docking[J]. PLoS One,2013,8(3):e59106. doi: 10.1371/journal.pone.0059106
[17] DEZHAMPANAH H, MOUSAZADEH M P A. Multi technique investigation on interaction between 5-(2-thiazolylazo)-2, 4, 6-triaminopyrimidine and HSA and BSA[J]. J Biomol Struct Dyn,2022,40(18):8143−8154. doi: 10.1080/07391102.2021.1906751
[18] SUDJARWO W A A, DOBLER M T, LIEBERZEIT P A. QCM-based assay designs for human serum albumin[J]. Anal Bioanal Chem,2022,414(1):731−741.
[19] WANG X, ZHANG G, YU D, et al. The interaction of folate-modified Bletilla striata polysaccharide-based micelle with bovine serum albumin[J]. Glycoconj J,2021,38(5):585−597. doi: 10.1007/s10719-021-10022-y
[20] DEZHAMPANAH H, MOHAMMADI A, MOUSAZADEH M P A. Investigation on intermolecular interaction of synthesized azo dyes with bovine serum albumin[J]. J Biomol Struct Dyn,2023,41(3):970−981. doi: 10.1080/07391102.2021.2015444
[21] BAI J, MA X, SUN X. Investigation on the interaction of food colorant Sudan III with bovine serum albumin using spectroscopic and molecular docking methods[J]. J Environ Sci Health A Tox Hazard Subst Environ Eng,2020,55(6):669−676. doi: 10.1080/10934529.2020.1729616
[22] ABEDANZADEH S , KARAMI K, RAHIMI M, et al. Potent cyclometallated Pd(II) antitumor complexes bearing α-amino acids:Synthesis, structural characterization, DNA/BSA binding, cytotoxicity and molecular dynamics simulation[J]. Dalton Trans,2020,49(42):14891−14907.
[23] NEHRU S, VEERALAKSHMI S, KALAISELVAM S, et al. Protein binding and antioxidant studies of diimine based emissive surfactant-ruthenium(II) complexes[J]. J Biomol Struct Dyn,2021,39(5):1535−1546. doi: 10.1080/07391102.2020.1733664
[24] PATEL R, MAURYA N, PARRAY M U D, et al. Esterase activity and conformational changes of bovine serum albumin toward interaction with mephedrone:Spectroscopic and computational studies[J]. J Mol Recognit,2018,31(11):e2734. doi: 10.1002/jmr.2734
[25] XI H, LI N, SHI Z, et al. A three-dimensional "turn-on" sensor array for simultaneous discrimination of multiple heavy metal ions based on bovine serum albumin hybridized fluorescent gold nanoclusters[J]. Anal Chim Acta,2022,1220:340023. doi: 10.1016/j.aca.2022.340023
[26] VINOD S M, MURUGAN S S, KRISHNAN A, et al. Complexity of the role of various site-specific and selective Sudlow binding site drugs in the energetics and stability of the acridinedione dye-bovine serum albumin complex:A molecular docking approach[J]. ACS Omega,2023,8(6):5634−5654. doi: 10.1021/acsomega.2c07111
[27] AHMED M F, MOLLA M R, SAHA M, et al. Aggregation behavior of cetyldimethylethylammonium bromide under the influence of bovine serum albumin in aqueous/electrolyte solutions at various temperatures and compositions:Conductivity and molecular dynamics study[J]. RSC Adv,2019,9(12):6556−6567. doi: 10.1039/C9RA00070D
[28] KHAN S, NAEEM A. Bovine serum albumin prevents human hemoglobin aggregation and retains its chaperone-like activity[J]. J Biomol Struct Dyn,2023,28:1−16.
[29] LYU S, WANG W. Spectroscopic methodologies and computational simulation studies on the characterization of the interaction between human serum albumin and astragalin[J]. J Biomol Struct Dyn,2021,39(8):2959−2970.
[30] ZHU G F, LYU S L, LIU Y, et al. Spectroscopic and computational studies on the binding interaction between gallic acid and Pin1[J]. Luminescence,2021,36:2014−2021. doi: 10.1002/bio.4138





 下载:
下载:
 下载:
下载:
