Ganoderma lucidum Polysaccharides Extraction by Choline Chloride/Lactic Acid/Guaiacol Ternary Deep Eutectic Solvent and Its Antioxidant Activities
-
摘要: 本研究采用氯化胆碱/乳酸/愈创木酚三元共熔溶剂(DES)来提取灵芝多糖(GLPs),优化DES溶剂提取灵芝多糖的工艺参数,采用傅里叶变换红外光谱(Fourier Transform Infrared Spectroscopy,FT-IR)和凝胶渗透色谱(Gel Permeation Chromatography,GPC)对GLPs结构进行了表征,并研究其体外抗氧化活性,最后,采用密度泛函理论初步研究了DES提取GLPs的分子机制。结果表明,在含水量为50%、提取温度为80 ℃、提取时间为1 h、料液质量体积比为1:30 g/mL的条件下,GLPs得率达9.20%±0.27%。FT-IR和GPC分析表明,4000~500 cm−1区域GLPs具有典型的多糖结构,GLPs的数均分子量为8057 Da,多分散系数为1.6。体外抗氧化活性测试显示,当GLPs质量浓度为5 mg/mL时,其总还原力为0.67±0.04。此外,GLPs对DPPH、OH和ABTS+自由基的清除能力的IC50值分别为2.366、6.179和2.440 mg/mL。密度泛函理论模拟分析表明,DES与葡萄糖之间的结合能为65.29 kcal/mol,远高于水与葡萄糖之间的结合能(20.38 kcal/mol),DES提取多糖是通过三重氢键相互作用来实现的。研究成果从分子水平上阐明了DES提取GLPs效果优于传统热水提取方法的内在机制。
-
关键词:
- 深共熔溶剂 /
- 氯化胆碱/乳酸/愈创木酚 /
- 灵芝多糖 /
- 抗氧化活性 /
- 密度泛函理论
Abstract: In this study, choline chloride/lactic acid/guaiacol ternary deep eutectic solvent (DES) was used to extract Ganoderma lucidum polysaccharides (GLPs). The operational parameters of GLPs extraction by DES were optimized, and the obtained GLPs structure was characterized by Fourier transform infrared spectrophotometer (FT-IR) and gel chromatography (GPC). Furthermore, the in vitro antioxidant activities of GLPs were investigated. In the end, density functional theory (DFT) was leveraged to gain preliminary insights into the molecular mechanism underpinning polysaccharide extraction facilitated by DES. Results unveiled that when the moisture content within DES was maintained at 50%, extraction was carried out at a temperature of 80 ℃ for 1 h, and the liquid-to-solid mass-volume ratio stood at 1:30 g/mL, the extraction yield of GLPs reached 9.20%±0.27%. FT-IR and GPC results showed that GLPs had typical polysaccharide structures in the 4000~500 cm−1 regions, and the number average mass weight (Mn) of GLPs was 8057 Da with the polydispersity index (PDI) of 1.6. In the context of in vitro antioxidant activity experiments, when GLPs content was 5 mg/mL, the total reducing power was measured at 0.67±0.04. Notably, the IC50 values for GLPs' scavenging capabilities against DPPH, OH, and ABTS+ free radicals were determined to be 2.366, 6.179, and 2.440 mg/mL, respectively. DES simulation analyses revealed a binding energy of 65.29 kcal/mol between DES and glucose, a substantially higher value compared to the binding energy observed between water and glucose (20.38 kcal/mol). The GLPs extraction by DES was facilitated through the pivotal role of triple hydrogen bond interactions. The findings in this study elucidated the intrinsic mechanism at molecular level that underscores the superior effectiveness of DES in comparison to traditional hot water extraction methods. -
灵芝(Ganoderma lucidum)是我国重要的药食两用真菌(图1),具有扶正固本、滋补强壮、延年益寿等功效[1]。其子实体中含有糖类、三萜类、甾醇类和氨基酸等活性成分,在免疫调节、降血脂和免疫性肝损伤等方面表现出良好的临床疗效[2]。其中,灵芝多糖(Ganoderma lucidum polysaccharides,GLPs)是灵芝的主要活性成分之一,具有抗氧化、增强免疫和治疗糖尿病等作用[3]。目前,灵芝多糖的提取技术主要包括热水浸提、碱提、酶解、微波和超声波辅助提取等方法[4],上述提取方法存在多糖得率低、提取过程不绿色等缺陷[5]。因此,开发一种新型的绿色高效提取技术,用于灵芝多糖的提取显得十分重要。
共熔溶剂(Deep eutectic solvent,DES)是由氢受体和氢供体按合适比例混合加热形成的液态绿色溶剂[6−7]。近年来,DES在多糖成分提取方面的应用逐渐受到人们的青睐。例如,Jing等[8]采用乙醇-氯化胆碱作为DES溶剂提取木耳多糖,与热水浸提法相比,木耳多糖的得率增加了18.68%。Lin等[9]选择氯化胆碱作为氢键受体,以乙二醇、乳酸、甘油和甲酸为氢键供体制备DES溶剂,然后用于百合多糖的提取,并与热水法进行比较。结果表明相同提取条件下,DES的多糖提取效率均高于热水提法。Nie等[10]利用氯化胆碱、1,2-丙二醇和水制备DES溶剂,通过超声辅助提取马尾藻多糖,在氯化胆碱和1,2-丙二醇摩尔比1:2、含水量30%、料液比1:30(g/mL)、提取温度70 ℃的条件下,马尾藻多糖的得率为11.31%。与热水法相比,在相同条件下所制备的DES溶剂也具有更强的脱蛋白和去除碳酸钙的能力。然而,三元低共熔溶剂提取灵芝多糖的研究及其提取多糖的分子机制,鲜有文献报道。
针对上述问题,本文制备了氯化胆碱/乳酸/愈创木酚三元DES溶剂,用于绿色提取GLPs,优化了DES提取多糖的工艺参数,对GLPs结构进行初步表征,同时研究了GLPs的体外抗氧化活性。最后,采用密度泛函理论揭示DES提取GLPs的分子机制,旨在为GLPs绿色高效提取提供技术支撑。
1. 材料与方法
1.1 材料与仪器
黑边灵芝 贵州望谟县食药用菌种植研发公司提供,该品种的生长地位于经度106°07´E、纬度25°03´N、海拔689.7 m、平均温度20~27 ºC,采摘地点位于贵州省黔西南布依族苗族自治州望谟县境内。将灵芝子实体清洗干净后,60 ℃烘干,粉碎后过40目筛,室温保存备用;葡聚糖标准品(相对分子质量为800、4400、9900、43500、124000、196000、401000 g/mol) Sigma公司;氯化胆碱、乳酸、愈创木酚、无水乙醇、丙酮、乙醚、硫酸、苯酚、葡萄糖、抗坏血酸、氯仿、正丁醇、三氯乙酸、氯化铁、硫酸亚铁、过氧化氢等均为分析纯 阿拉丁试剂公司;1,1-二苯基-2-三硝基苯肼(DPPH)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS) 北京博奥拓达科技有限公司。
UV-756CRT型紫外-可见分光光度计 上海佑仪仪器仪表有限公司;HH-ZK4型恒温水浴锅 北京星德仪器设备有限公司;RE-52型旋转蒸发仪 上海亚荣生化仪器有限公司;3K15 型台式高速冷冻离心机 北京五洲东方科技发展有限公司;VERTEX 70v傅立叶红外光谱 德国布鲁克仪器公司;GPC Waters 1515代垫凝胶渗透色谱仪 美国沃特世公司。
1.2 实验方法
1.2.1 三元共熔溶剂(DES)的制备
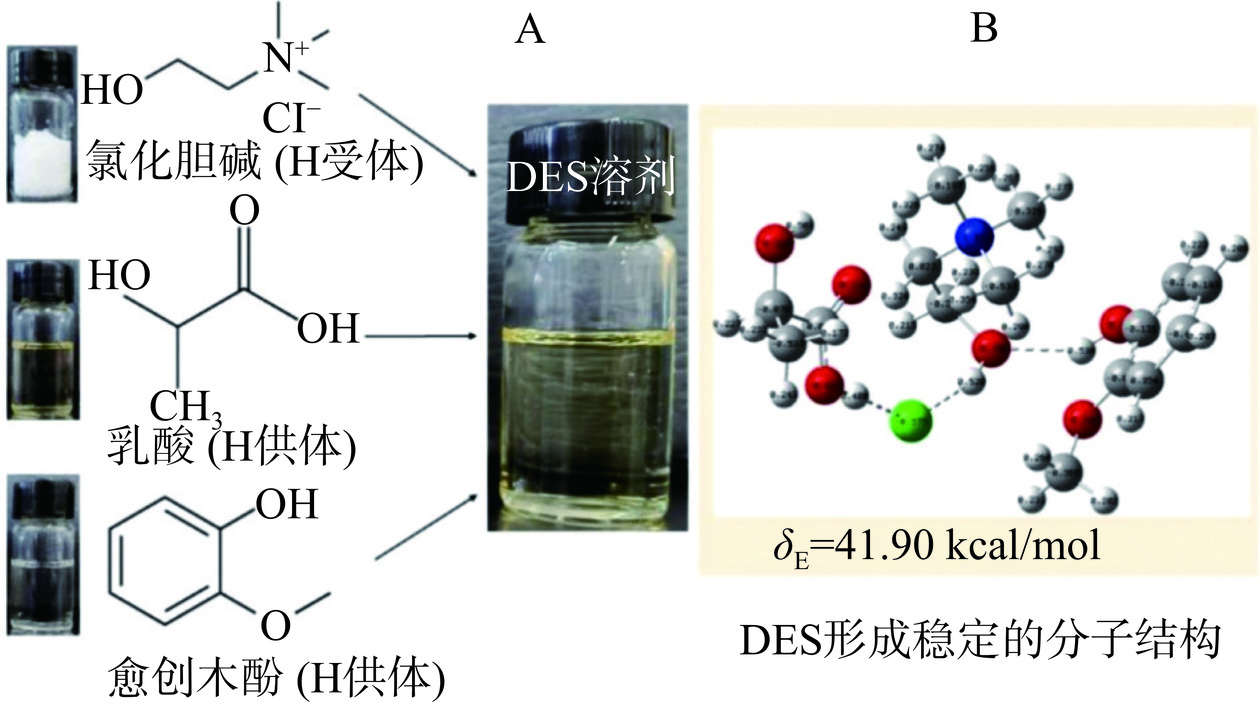
将氯化胆碱、乳酸和愈创木酚按摩尔比1:1:1混合,然后在80 ℃条件下进行水浴磁力搅拌30 min,直至形成清澈透明的溶液,即得到了DES溶剂。
1.2.2 DES溶剂提取灵芝多糖
1.2.2.1 提取工艺
称取2.00 g灵芝粉放于装有DES溶剂的250 mL圆底烧瓶中,在一定DES含水率、温度、提取时间和料液质量体积比下进行提取。提取结束后,5000 r/min离心15 min取上清。然后加入4倍体积的无水乙醇,在4 ℃下过夜醇沉。以5000 r/min转速离心15 min,得到多糖沉淀物。沉淀物经Sevag法[11]脱蛋白和活性炭脱色等工艺,然后进行无水乙醇二次沉淀。沉淀物依次用无水乙醇、丙酮、乙醚洗涤2~3次,最终得到纯化后的灵芝多糖。DES提取的灵芝多糖被标记为GLPs-D。采用苯酚-硫酸法[12]测量多糖浓度并计算得率,在紫外波长490 nm处测量吸光值,并分析各提取参数对多糖得率的影响。
1.2.2.2 单因素实验
研究了DES提取GLPs效率的四个主要因素的影响:DES含水率(10%、20%、30%、40%、50%)、温度(60、70、80、90 ℃)、提取时间(1、2、3、4 h)、料液质量体积比(1:15、1:20、1:25、1:30 g/mL)对提取效果的影响。考察某一个单因素的影响时,其它三个主要参数固定不变。比如,考察DES含水率的影响时,其它三个因素如提取时间1 h,提取温度80 ℃,料液比1:30 g/mL,含水率50%固定不变。
1.2.2.3 灵芝多糖浓度测定与得率的计算
葡萄糖标准曲线制备:采用苯酚-硫酸法测定总糖浓度,以吸光度为纵坐标,浓度为横坐标,绘制标准曲线方程y=1.3073x−0.0255(R2=0.9986),根据葡萄糖标准曲线计算提取液中多糖浓度。按式(2)计算灵芝多糖的得率:
多糖得率(%)=mM×100 (2) 式中:m为粗多糖质量(g);M为灵芝原料的质量(g)。
1.2.2.4 DES溶剂重复利用特性研究
按照1.2.2所述DES提取多糖方法,将醇沉离心得到的上清液真空干燥至体积不变,以回收DES,并用于下一批次实验。DES的回收率按式(1)计算。
DES回收率(%)=VaVb×100 (1) 式中:Va表示醇沉离心得到的上清液真空干燥至体积不变回收的DES的体积,mL;Vb表示DES提取前的原体积,mL。
1.2.3 热水法提取灵芝多糖
根据文献[13]方法,采用热水法在提取时间1 h、提取温度80 ℃、料液比1:30 g/mL条件下提取灵芝多糖,记为GLPs-W。
1.2.4 灵芝多糖傅立叶红外光谱分析和分子量的测定
采用VERTEX 70v傅立叶红外光谱分析了纯化灵芝多糖结构,采用为KBr压片法处理样品,扫描范围500~3500 cm−1。
采用Waters 1515凝胶渗透色谱(Gel Permeation Chromatography,GPC)测定灵芝多糖的分子量。GPC色谱条件:使用Waters Ultrahy drogel 250(7.8 mm×300 mm)凝胶柱和Waters Ultrahydrogel 2000(7.8 mm×300 mm)凝胶柱;流动相为0.1 mol/L NaNO3;体积流量为0.5 mL/min;柱温为35 ℃;进样量为50 μL;标样为已知相对分子质量的葡聚糖标准品,标准曲线为y=−0.4656x+12.436,相关系数R2=0.9951;检测器为Waters 1515示差折光检测器,检测器温度35 ℃。样品完全溶解后,过0.22 µm滤膜,然后进行GPC测试,采用Breeze2软件(Waters公司自带)进行数据采集与分析。
1.2.5 灵芝多糖体外抗氧化活性
1.2.5.1 总还原力的测定
参照文献[14],用吸光度评估灵芝多糖的总还原力。在波长700 nm处测定多糖溶液的吸光度,以去离子水为对照。用浓度为1.0~5.0 mg/mL的VC溶液作阳性对照。
1.2.5.2 DPPH自由基清除能力的测定
参照文献[15],测定灵芝多糖对DPPH自由基的清除能力。在波长517 nm处测定不同质量浓度灵芝多糖溶液的吸光度。为了比较,设立了空白组,用2 mL去离子水替代灵芝多糖溶液以消除背景干扰。同时,本底组用去离子水替代DPPH-乙醇溶液,以消除可能的反应干扰。以VC作阳性对照。根据式(3),计算灵芝多糖对DPPH自由基的清除率。
DPPH自由基清除率(%)=(1−Aa−AbA0)×100 (3) 式中:A0为空白组吸光度;Aa为测定组吸光度;Ab为测定管本底组吸光度。
1.2.5.3 OH自由基清除能力的测定
参照文献[16],测定灵芝多糖对OH自由基的清除能力。在波长510 nm处测定不同质量浓度灵芝多糖吸光度。设置了空白组对照组,用去离子水代替灵芝多糖溶液。以VC作为阳性对照。本底组用去离子水代替H2O2溶液,以消除可能的背景干扰。根据式(4),计算灵芝多糖对OH自由基的清除率:
OH自由基清除率(%)=(1−Aa−AbA0)×100 (4) 式中:A0为空白组吸光度;Aa为测定组吸光度;Ab为本底组吸光度。
1.2.5.4 ABTS+自由基清除能力的测定
参考文献[17],测定灵芝多糖对ABTS+自由基的清除率。在734 nm处测定灵芝多糖溶液吸光度。以去离子水作为空白对照。根据式(5),计算灵芝多糖对ABTS+自由基的清除率:
ABTS+自由基清除率(%)=(1−Aa−AbA0)×100 (5) 式中:A0为在734 nm波长下ABTS工作液用蒸馏水稀释至吸光度为0.700±0.02;Aa为测定组吸光度;Ab为空白组吸光度。
1.2.6 密度泛函理论分析DES提取灵芝多糖的分子机制
采用密度泛函理论(Density functional theory,DFT)研究了DES提取灵芝多糖的分子机制。DFT计算工作采用Gaussian 16软件在M06-2X/6-31+G(d)基组完成。首先对4种单体分子(氯化胆碱、愈创木酚、乳酸和葡萄糖)进行优化分析原子Mulliken电荷量和分子静电势差异,然后通过分析计算DES与葡萄糖结合能,优化DES与葡萄糖相互作用结合氢键数量与键长,找出最稳定的几何构型。同时,利用DFT软件计算水和葡萄糖之间结合能大小及水和葡萄糖相互作用结合氢键数量与键长,从分子水平上揭示DES提取多糖优于传统水提法的内在机制。
1.3 数据处理
本实验均重复试验三次,数据结果以平均值±标准差(Mean±SD)表示,采用GraphPad Prism 8软件进行数据处理并绘制作图。
2. 结果与分析
2.1 三元低共熔溶剂(DES)的特性分析
如图2A所示,所制备的DES溶剂为清澈透明的溶液,表现出高度稳定性,室温放置不会出现分层或沉淀现象。在该溶液中,氯化胆碱作为氢受体,而乳酸和愈创木酚则为氢供体,它们之间通过氢键相互作用形成了稳定的分子结构(图2B),结合自由能为41.90 kcal/mol。
2.2 DES溶剂提取灵芝多糖(GLPs)
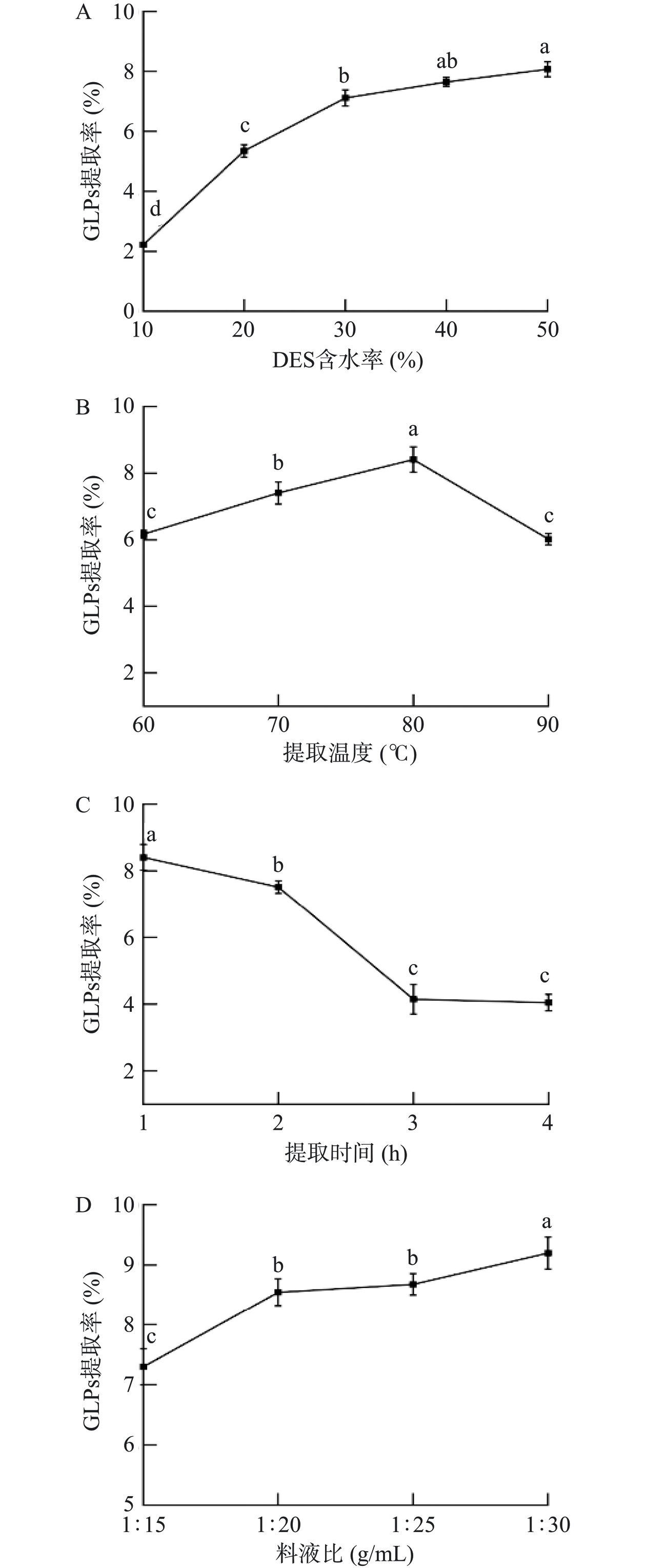
由图3A可知,随着DES含水率增加,GLPs得率增加,特别是当DES含水率为50%时,多糖的得率最大,达到8.08%±0.25%,这可能是由于随着含水率的增大使得DES与GLPs之间的氢键作用力逐渐增强导致的[18]。
如图3B所示,随着温度的升高,GLPs得率先增加后下降。当温度超过80 ℃,GLPs得率开始下降,可能是因为高温导致GLPs发生降解[19]。此外,温度对DES的黏度、极性和物料的溶解度都会造成影响。
如图3C所示,随着提取时间的延长,DLPs得率呈现降低趋势,提取时间为1 h时得率最高。这是因为长时间处于高温下使GLPs发生了降解损失[20],从而导致得率下降。
如图3D所示,料液比在1:15至1:30时,随着DES溶剂量的增加,GLPs得率也增加,特别是在料液质量体积比为1:30时,GLPs的得率达到最高,为9.20%±0.27%。
综上所述, DES法提取灵芝多糖的最优工艺参数为:含水率为50%、提取温度为80 ℃、提取时间为1 h、料液质量体积比为 1:30 g/mL。在此条件下,GLPs得率达到9.20%±0.27%。
2.3 DES提取GLPs的重复利用及与水提法的比较分析
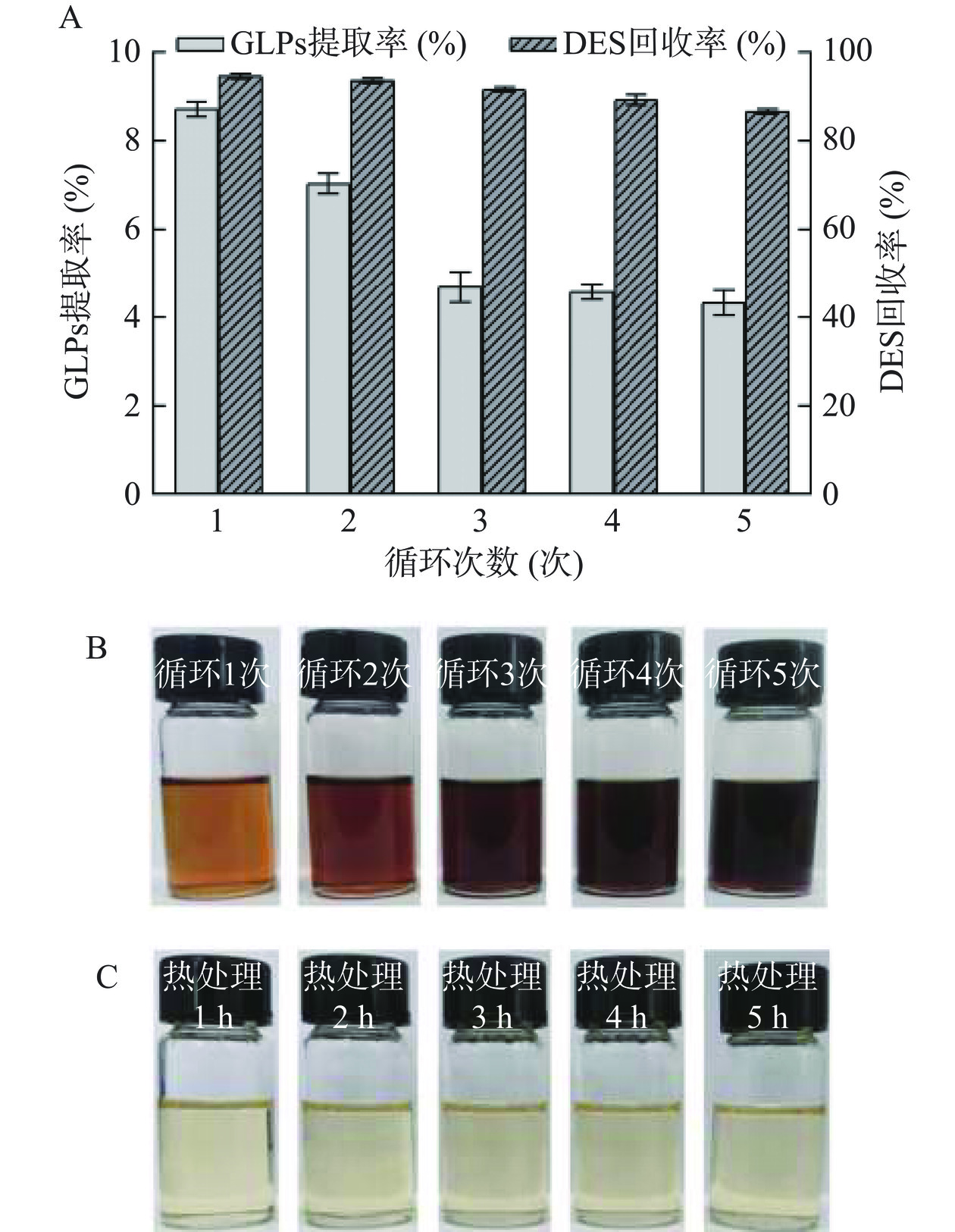
在上述DES提取GLPs的最佳条件下,考察了DES重复利用次数对GLPs得率的影响,结果见图4。
从图4A可以看出,DES重复利用5批次,GLPs得率仍维持在4.50%。尽管随着DES重复利用批次的增加,GLPs得率由最初的8%下降到第5批次的4.5%,但回收率仍维持88%。随着重复利用次数增加,DES溶剂颜色逐渐加深(图4B),同时影响了DES对多糖的溶解能力,从而阻碍了GLPs的溶出。为了进行比较分析,通过对DES进行了80 ℃连续热处理1~5 h,并观察其颜色变化。结果显示,DES溶剂连续热处理5 h,本身颜色基本没有发生变化,表现出较好的稳定性(图4C)。
在提取时间1 h、提取温度80 ℃和料液质量体积比1:30的相同条件下,进一步比较了含水率50%的DES提取法和热水提取法对GLPs得率和含量的影响,结果见表1。含水量50%的DES提取灵芝多糖得率(9.20%±0.27%)是热水法(2.14%±0.08%)的4.3倍。此外,含水率50%的DES提取液中多糖含量也较高。通过观察多糖醇沉样品图片,可以清晰地看到,经过无水乙醇沉淀,DES提取液中的多糖明显沉淀;而水提液中多糖沉淀量较少。这些结果表明,含水率50%的DES提取法灵芝多糖优于热水提取法,多糖得率更高。
表 1 DES提取法和热水提取法对GLPs得率的影响Table 1. Effects of DES and hot water extraction methods on the yield of GLPs提取方法 提取溶剂含水率(%) GLPs得率(%) GLPs纯度(µg/mL) 样品图片 DES提取法(GLPs-D) 50 9.20±0.27 92.46±0.49 
热水提取法(GLPs-W) 100 2.14±0.08 21.30±0.30 
2.4 GLPs的傅立叶红外结构分析与分子量测定
采用傅立叶红外光谱对提取的粗多糖结构进行了分析,结果如图5所示。
灵芝多糖样品在4000~500 cm−1区域表现出了多糖类物质的一般特征,并有特征吸收峰,这些特征峰可以提供关于多糖结构的重要信息,对于多糖的性质和应用研究具有重要意义。例如,3419 cm−1强宽谱带归属于糖类-OH的伸缩振动吸收峰。2921 cm−1吸收峰归属于糖类结构中甲基或亚甲基的C-H伸缩振动峰。1159~1428 cm−1附近的吸收峰归属于C-H的弯曲振动峰,与C-H的伸缩振动构成了糖环的特征吸收[17]。1616 cm−1附近的吸收峰是C=O的伸缩振动峰,同时与吸收的水相关,说明多糖对水有较强的亲和力[21]。925~1159 cm−1的吸收峰为吡喃糖环的伸缩振动峰。860 cm−1的吸收峰归属于β类型的糖苷键[22]。
表2列举了DES提取法和水提法对灵芝多糖分子量的影响。结果表明,DES溶剂提取的灵芝多糖分子量小于热水提取法。这一结果与文献报道类似。Kang等[23]通过超声辅助提取和热水法提取灵芝多糖分别分离出4种均质多糖。超声辅助提取法多糖分子量分别为1349、110、68和7 kDa,均小于热水法提取所得多糖分子量(它们分别为1932、916、105和8 kDa)。但是,不同提取方法获得灵芝多糖的分子量也不一样,Wen等[24]采用热水提法获得了3种纯化的灵芝多糖,它们分子量分别为82、5和4 kDa。Ren等[25]也报道了灵芝多糖的分子量,分布从2 kDa到800 kDa不等。文献[26]报道灵芝多糖的分子量最高为3750 kDa。导致这一差异的原因可能与多糖提取和纯化方法,以及灵芝原料来源不同等多种因素有关。多分散系数结果显示,GLPs-D的多分散系数(1.6)小于GLPs-W(2.0)。多分散系数越大,表明多糖分子量分布越宽。不同分子量多糖的抗氧化活性实验发现,多糖分子量越小和多分散系数越低,其水溶性和抗氧化活性就越高[27]。
表 2 DES提取法和热水提取法对灵芝多糖分子量的影响Table 2. Effects of DES and hot water extraction methods on GLPs molecular weight灵芝多糖 数均分子
量(Mn)重均分子
量(Mw)质均分子
量(Mz)Z均分子
量(Mz)多分散系数
(Mz/Mw)GLPs-D 8057 10150 16509 35410 1.6 GLPs-W 8605 12379 24710 51214 2.0 2.5 GLPs的体外抗氧化活性
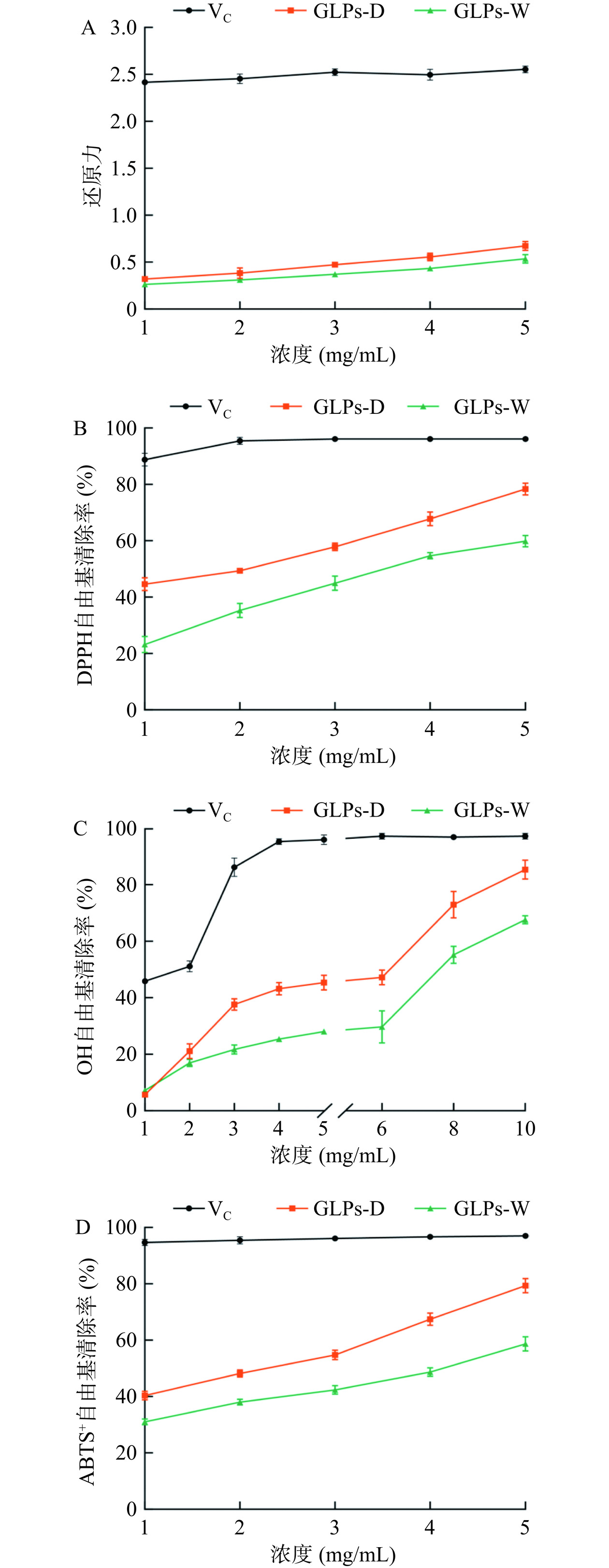
在相同浓度的VC溶液作为阳性对照组的条件下,比较了DES提取法和水提取法所得的灵芝多糖(GLPs)的体外抗氧化活性,结果见图6。
还原力是评价天然产物抗氧化能力的重要指标。溶液的吸光度越大,其还原力越强[10]。由图6A可知,随着GLPs质量浓度的增加,吸光度和还原力增强,GLPs-D的吸光度高于GLPs-W,但低于同等质量浓度的VC还原力。Zhang等[28]研究了金针菇多糖的还原力,在质量浓度为5 mg/mL时,多糖吸光度低于0.2,也低于灵芝多糖溶液。由此可知,GLPs具有较强的还原力。
图6B显示GLPs对DPPH自由基清除能力呈剂量依赖性。质量浓度为5.0 mg/mL时,GLPs-D对DPPH自由基清除率达78.35%±2.11%,高于GLPs-W,但低于VC。研究表明,GLPs-D清除DPPH自由基的IC50值为2.366 mg/mL。与魏伟等[29]研究黄精多糖的DPPH自由基清除能力相比,在质量浓度1 mg/mL时,其清除率为34.14%,低于GLPs-D在相同质量浓度的清除率(36.0%)。此外,李亚辉等[30]研究芦荟多糖的DPPH自由基清除率,在质量浓度25 mg/mL时,其清除率为75%,低于本实验10 mg/mL质量浓度GLPs-D的清除率。
图6C表示GLPs对OH自由基清除能力。由于OH自由基会造成严重氧化损伤,通过测OH自由基清除能力来评估GLPs的抗氧化活性[31]。图6C显示随着GLPs质量浓度增加,其OH自由基清除能力增强,呈现剂量依赖性。GLPs-D清除OH自由基的IC50值为6.179 mg/mL。质量浓度为6 mg/mL时,GLPs-D的OH自由基清除率为47.21%±2.61%,与VC在1 mg/mL时的清除率相当,表明GLPs具有较强的OH自由基清除能力。
ABTS+自由基清除作用也可以用于评估天然产物的抗氧化能力[32−33]。图6D显示GLPs对ABTS+的清除率随浓度升高而增加。质量浓度为5 mg/mL时,GLPs-D对ABTS+自由基的清除率为78.29%±4.73%,高于GLPs-W,但是低于VC。GLPs-D清除ABTS+自由基的IC50值为2.440 mg/mL,表明GLPs-D对ABTS+自由基有较好的清除效果。
综上所述,DES提取的灵芝多糖(GLPs-D)表现出优异性能的体外抗氧化活性,其还原力较高,其对DPPH、OH和ABTS+自由基的清除能力均较强,说明GLPs-D具有潜在的抗氧化应用价值。
2.6 DES提取灵芝多糖的分子机制分析
灵芝多糖是一种杂多糖,单糖成分主要为葡萄糖,占比达83.75%~90.6%[34−35]。因此,本实验以葡萄糖作为灵芝多糖模拟物,采用DFT计算对比DES与葡萄糖及水与葡萄糖之间的结合能和键长大小,以期从分子层面上解释DES和传统水提法提取多糖差异,结果见图7。
由图7可知,DES与葡萄糖之间的结合能为65.29 kcal/mol,远高于水与葡萄糖之间的结合能(20.38 kcal/mol),表明DES溶解葡萄糖的能力高于纯水,可能是DES与葡萄糖结合后,形成三重氢键(见绿色箭头,键长分别为2.109、1.890和2.048 Å),增加了对葡萄糖的溶解能力。水与葡萄糖结合后,只形成二重氢键(见绿色箭头,键长分别为1.845和1.836 Å),因此,水溶解葡萄糖能力比DES要低。研究表明,氢键在DES形成及其溶质化方面起着非常重要的作用[36]。从结合能大小、分子相互作用氢键数量与键长等数据,可以看出DES具有良好葡萄糖溶解特性,为阐明DES提取多糖的分子机制奠定了理论基础。
3. 结论
研究表明,氯化胆碱/乳酸/愈创木酚三元DES提取灵芝多糖效率优于传统水提取法。FT-IR确认了DES提取的灵芝多糖结构,GPC分析了灵芝多糖的分子量和多分散系数,其值均小于水提取法,说明DES提取法得到了更加一致性和分子量更小的多糖产物。通过单因素实验优化了DES提取灵芝多糖工艺参数,在DES含水量50%、提取温度80 ℃、提取时间1 h、料液质量体积比1:30 g/mL的条件下,灵芝多糖得率为9.20%±0.27%,比水浸提法提高了4.3倍。此外,DES可以重复利用5批次,多糖得率仍维持4.89%,DES回收率为88%。这表明DES提取法不仅提取效率高,而且还可重复使用。DES提取的灵芝多糖表现出较强的体外抗氧化活性,包括总还原力、DPPH、OH和ABTS+自由基清除能力,呈现出一定的剂量依赖性,有望在天然抗氧化剂方面发挥重要作用。DFT模拟分析表明,DES提取灵芝多糖的分子机制是通过三重氢键相互作用来实现的,DES与葡萄糖之间的结合能远高于水与葡萄糖的结合能。本文研究成果为理解DES提取法的优势提供了重要线索,并为进一步优化DES提取工艺和开发更多具有抗氧化活性的多糖提供了指导。
-
表 1 DES提取法和热水提取法对GLPs得率的影响
Table 1 Effects of DES and hot water extraction methods on the yield of GLPs
提取方法 提取溶剂含水率(%) GLPs得率(%) GLPs纯度(µg/mL) 样品图片 DES提取法(GLPs-D) 50 9.20±0.27 92.46±0.49 
热水提取法(GLPs-W) 100 2.14±0.08 21.30±0.30 
表 2 DES提取法和热水提取法对灵芝多糖分子量的影响
Table 2 Effects of DES and hot water extraction methods on GLPs molecular weight
灵芝多糖 数均分子
量(Mn)重均分子
量(Mw)质均分子
量(Mz)Z均分子
量(Mz)多分散系数
(Mz/Mw)GLPs-D 8057 10150 16509 35410 1.6 GLPs-W 8605 12379 24710 51214 2.0 -
[1] 钟涛, 张国新, 周迪夷, 等. 灵芝多糖对糖尿病肾病小鼠肾小管上皮细胞间充质转化的抑制作用[J]. 中国医药导报,2020,17(6):9−12. [ZHONG T, ZHANG G X, ZHOU D Y, et al. Inhibitory effect of Ganoderma lucidum polysaccharide on renal tubular endothelial-to-mesenchymaltransition of diabetic nephropathy mice[J]. China Medical Herald,2020,17(6):9−12.] ZHONG T, ZHANG G X, ZHOU D Y, et al. Inhibitory effect of Ganoderma lucidum polysaccharide on renal tubular endothelial-to-mesenchymaltransition of diabetic nephropathy mice[J]. China Medical Herald, 2020, 17(6): 9−12.
[2] ZHAO C, FAN J J, LIU Y Y, et al. Hepatoprotective activity of Ganoderma lucidum triterpenoids in alcohol-induced liver injury in mice, an iTRAQ-based proteomic analysis[J]. Food Chemistry,2019,271:148−156. doi: 10.1016/j.foodchem.2018.07.115
[3] LI M Y, YU L L, ZHAI Q X, et al. Combined Ganoderma lucidum polysaccharide and ciprofloxacin therapy alleviates Salmonella enterica infection, protects the intestinal barrier, and regulates gut microbiota[J]. Food & Function,2023,14:6896−6913.
[4] WANG W L, TAN J Q, NIMA L M, et al. Polysaccharides from fungi:a review on their extraction, purification, structural features, and biological activities[J]. Food Chemistry:X,2022,15:100414.
[5] 宁娜, 韩建军, 杨广安, 等. 灵芝多糖提取工艺研究进展[J]. 山东化工,2020,49(20):63. [NING N, HAN J, YANG G, et al. Research progress on extraction technology of polysaccharides from Ganoderma lucidum[J]. Shandong Chemical Industry,2020,49(20):63.] doi: 10.3969/j.issn.1008-021X.2020.20.025 NING N, HAN J, YANG G, et al. Research progress on extraction technology of polysaccharides from Ganoderma lucidum[J]. Shandong Chemical Industry, 2020, 49(20): 63. doi: 10.3969/j.issn.1008-021X.2020.20.025
[6] 王冬梅, 刘云. 低共熔溶剂(DES)分级分离木质纤维素组分新技术[J]. 北京化工大学学报(自然科学版),2018,45(6):40−47. [WANG D M, LIU Y. Fractionation of lignocellulose with deep eutectic solvent[J]. Journal of Beijing University of Chemical Technology (Natural Science Edition),2018,45(6):40−47.] WANG D M, LIU Y. Fractionation of lignocellulose with deep eutectic solvent[J]. Journal of Beijing University of Chemical Technology (Natural Science Edition), 2018, 45(6): 40−47.
[7] 郭振. 糖类化合物在离子液体和低共熔溶剂中的溶解性能研究[D]. 北京:北京化工大学, 2016. [GUO Z. Carbohydrate compounds dissolved in ionic liquids and deep eutectic solvent performance study[D]. Beijing:Beijing University of Chemical Technology, 2016.] GUO Z. Carbohydrate compounds dissolved in ionic liquids and deep eutectic solvent performance study[D]. Beijing: Beijing University of Chemical Technology, 2016.
[8] JING Y, JIANG Y Z, HUI N T, et al. Effect of deep eutectic solvent extraction on Auricularia auricula polysaccharide solubilization and antioxidant potential[J]. Sustainable Chemistry and Pharmacy,2023,34:101166. doi: 10.1016/j.scp.2023.101166
[9] LIN C, YANG Y Y, RONG R Z, et al. The extraction of phenolic acids and polysaccharides from Lilium lancifolium Thunb. using a deep eutectic solvent[J]. Analytical Methods:Advancing Methods and Applications,2021,13(10):1226−1231.
[10] NIE J G, CHEN D T, LU Y B. Deep eutectic solvents based ultrasonic extraction of polysaccharides from edible brown seaweed Sargassum horneri[J]. Journal of Marine Science and Engineering,2020,8(6):440. doi: 10.3390/jmse8060440
[11] ZHANG H L, CUI S H, ZHA X Q, et al. Jellyfish skin polysaccharides:extraction and inhibitory activity on macrophage derived foam cell formation[J]. Carbohydrate Polymers,2014,106:393−402. doi: 10.1016/j.carbpol.2014.01.041
[12] DUBOIS, M, GILLES, K, HAMILTON, J, et al. Colorimetric method for determination of sugars and related substances[J]. Analytical Chemistry,1956,28(3):350−356. doi: 10.1021/ac60111a017
[13] 教小磐, 刘云. 甜茶叶多糖的表征、体外抗氧化活性与体内毒性[J]. 食品科学,2020,41(15):201−207. [JIAO X P, LIU Y. Characterization, antioxidant activity in vitro and toxicity in vivo of polysaccharides from Rubus suavissimus S. Lee leaves[J]. Food Science,2020,41(15):201−207.] doi: 10.7506/spkx1002-6630-20190511-114 JIAO X P, LIU Y. Characterization, antioxidant activity in vitro and toxicity in vivo of polysaccharides from Rubus suavissimus S. Lee leaves[J]. Food Science, 2020, 41(15): 201−207. doi: 10.7506/spkx1002-6630-20190511-114
[14] LU X, ZHAO Y, SUN Y, et al. Characterization of polysaccharides from green tea of Huangshan Maofeng with antioxidant and hepatoprotective effects[J]. Food Chemistry,2013,141(4):3415−3423. doi: 10.1016/j.foodchem.2013.06.058
[15] 杨新河, 黄明军, 马蔚, 等. 不同黑茶多糖的组成分析及其抗氧化活性[J]. 食品工业科技,2017,38(20):16−20. [YANG X H, HUAN M J, MA W, et al. Composition and antioxidant activity of polysaccharides of different dark tea[J]. Science and Technology of Food Industry,2017,38(20):16−20.] YANG X H, HUAN M J, MA W, et al. Composition and antioxidant activity of polysaccharides of different dark tea[J]. Science and Technology of Food Industry, 2017, 38(20): 16−20.
[16] BI H T, GAO T T, LI Z H, et al. Structural elucidation and antioxidant activity of a water-soluble polysaccharide from the fruit bodies of Bulgaria inquinans (Fries)[J]. Food Chemistry,2013,138(2/3):1470−1475.
[17] XU Y, JIANG H, SUN C, et al. Antioxidant and hepatoprotective effects of purified Rhodiola rosea polysaccharides[J]. International Journal of Biological Macromolecules,2018,117:167−178. doi: 10.1016/j.ijbiomac.2018.05.168
[18] CAI C, WANG Y, YU W, et al. Temperature-responsive deep eutectic solvents as green and recyclable media for the efficient extraction of polysaccharides from Ganoderma lucidum[J]. Journal of Cleaner Production,2020,274:123047. doi: 10.1016/j.jclepro.2020.123047
[19] LU X, LI N, QIAO X, et al. Effects of thermal treatment on polysaccharide degradation during black garlic processing[J]. LWT - Food Science and Technology,2018,95:223−229. doi: 10.1016/j.lwt.2018.04.059
[20] 张锦钰. 低共熔溶剂提取淮山多糖及其结构、生物活性研究[D]. 长沙:湖南农业大学, 2020. [ZHANG J Y. Study on structure and bioactivity of Polysaccharides extracted from Chinese Yam using deep eutectic solvents[D]. Changsha:Hunan Agricultural University, 2020.] ZHANG J Y. Study on structure and bioactivity of Polysaccharides extracted from Chinese Yam using deep eutectic solvents[D]. Changsha: Hunan Agricultural University, 2020.
[21] 宋林珍, 朱丽云, 高永生, 等. 茶多糖的结构特征与降血糖活性[J]. 食品科学,2018,39(19):162−168. [SONG L Z, ZHU L Y, GAO Y S, et al. Structural characteristics and hypoglycemic activity of Polysaccharides from Green Tea Leaves[J]. Food Science,2018,39(19):162−168.] doi: 10.7506/spkx1002-6630-201819025 SONG L Z, ZHU L Y, GAO Y S, et al. Structural characteristics and hypoglycemic activity of Polysaccharides from Green Tea Leaves[J]. Food Science, 2018, 39(19): 162−168. doi: 10.7506/spkx1002-6630-201819025
[22] WANG D, ZHAO Y, SUN Y, et al. Protective effects of Ziyang tea polysaccharides on CCl4-induced oxidative liver damage in mice[J]. Food Chemistry,2014,143:371−378. doi: 10.1016/j.foodchem.2013.08.005
[23] KANG Q Z, CHEN S S, LI S F, et al. Comparison on characterization and antioxidant activity of polysaccharides from Ganoderma lucidum by ultrasound and conventional extraction[J]. International Journal of Biological Macromolecules,2018,124:1137−1144.
[24] WEN L R, SHENG Z L, WANG J P, et al. Structure of water-soluble polysaccharides in spore of Ganoderma lucidum and their anti-inflammatory activity[J]. Food Chemistry,2022,373:131374. doi: 10.1016/j.foodchem.2021.131374
[25] REN L, ZHANG J, ZHANG T H. Immunomodulatory activities of polysaccharides from Ganoderma on immune effector cells[J]. Food Chemistry,2021,340:127933. doi: 10.1016/j.foodchem.2020.127933
[26] LU J H, HE R J, SUN P L, et al. Molecular mechanisms of bioactive polysaccharides from Ganoderma lucidum (Lingzhi), a review[J]. International Journal of Biological Macromolecules,2020,150:765−774. doi: 10.1016/j.ijbiomac.2020.02.035
[27] 何喜珍. 不同分子量大豆多糖的制备、表征和抗氧化研究[D]. 上海:华东师范大学, 2016. [HE X Z. Preparation, characterization and antioxidation study of different molecular weight of Soluble Soybean Polysaccharides[D]. Shanghai:East China Normal University, 2016.] HE X Z. Preparation, characterization and antioxidation study of different molecular weight of Soluble Soybean Polysaccharides[D]. Shanghai: East China Normal University, 2016.
[28] ZHANG Z F, LÜ G Y, HE W Q, et al. Effects of extraction methods on the antioxidant activities of polysaccharides obtained from Flammulina velutipes[J]. Carbohydrate Polymers,2013,98(2):1524−1531. doi: 10.1016/j.carbpol.2013.07.052
[29] 魏炜, 李彦伟, 刘凤霞, 等. 响应面法优化超高压提取黄精多糖工艺[J]. 精细化工,2019,36(5):875−881. [WEI W, LI Y W, LIU F X, et al. Optimization of ultrahigh pressure extraction of Polysaccharides from Polygonatum cyrtonema Hua by response surface methodology[J]. Fine Chemicals,2019,36(5):875−881.] WEI W, LI Y W, LIU F X, et al. Optimization of ultrahigh pressure extraction of Polysaccharides from Polygonatum cyrtonema Hua by response surface methodology[J]. Fine Chemicals, 2019, 36(5): 875−881.
[30] 李亚辉, 马艳弘, 黄开红, 等. 响应面法优化复合酶提取芦荟多糖工艺及其抗氧化活性分析[J]. 食品科学,2014,35(18):63−68. [LI Y H, MA Y H, HUANG K H, et al. Response surface methodology for optimisation of complex enzyme extraction process of Aloe vera polysaccharide and its antioxidant activity analysis[J]. Food Science,2014,35(18):63−68.] doi: 10.7506/spkx1002-6630-201418012 LI Y H, MA Y H, HUANG K H, et al. Response surface methodology for optimisation of complex enzyme extraction process of Aloe vera polysaccharide and its antioxidant activity analysis[J]. Food Science, 2014, 35(18): 63−68. doi: 10.7506/spkx1002-6630-201418012
[31] 徐静珠, 吴彩娥, 应瑞峰, 等. 青钱柳叶多糖不同组分体外降血糖及抗氧化活性研究[J]. 南京林业大学学报(自然科学版),2017,41(4):6−12. [XU J Z, WU C E. YING R F, et al. Hypoglycemic and antioxidant activity of various polysaccharides from Cyclocarya paliurus leaves in vitro[J]. Journal of Nanjing Forestry University (Natural Sciences Edition),2017,41(4):6−12.] doi: 10.3969/j.issn.1000-2006.201610064 XU J Z, WU C E. YING R F, et al. Hypoglycemic and antioxidant activity of various polysaccharides from Cyclocarya paliurus leaves in vitro[J]. Journal of Nanjing Forestry University (Natural Sciences Edition), 2017, 41(4): 6−12. doi: 10.3969/j.issn.1000-2006.201610064
[32] 梁惠, 史艳财, 熊忠臣, 等. 不同冲泡条件下的槐米茶茶汤对ABTS阳离子自由基的清除作用[J]. 广西科学院学报,2023,39(1):108−118. [LIANG H, SHI Y C, XIONG Z C, et al. Scavenging effect of Sophora japonica tea soup on ABTS cationic free radical under different brewing conditions[J]. Journal of Guangxi Academy of Sciences,2023,39(1):108−118.] LIANG H, SHI Y C, XIONG Z C, et al. Scavenging effect of Sophora japonica tea soup on ABTS cationic free radical under different brewing conditions[J]. Journal of Guangxi Academy of Sciences, 2023, 39(1): 108−118.
[33] 朱帅, 黄梦玲, 吴倩倩, 等. 蛋黄卵磷脂的结构、提取、功能与脂质体研究进展[J]. 粮油食品科技,2020,28(3):18−25. [ZHU S, HUANG M L, WU Q Q, et al. State-of-the-art of egg yolk lecithin:Molecular structure, extraction strategies, bio-activities and liposome application[J]. Science and Technology of Cereals, Oils and Foods,2020,28(3):18−25] ZHU S, HUANG M L, WU Q Q, et al. State-of-the-art of egg yolk lecithin: Molecular structure, extraction strategies, bio-activities and liposome application[J]. Science and Technology of Cereals, Oils and Foods, 2020, 28(3): 18−25
[34] SUI X C, GUO Q B, XIA Y M, et al. Structure features of the intracellular polysaccharide from Ganoderma lucidum and the irrelative immune-anticancer activities of GLPs[J]. Bioactive Carbohydrates and Dietary Fiber,2016,8(2):43−50. doi: 10.1016/j.bcdf.2016.11.001
[35] LI J, GU F F, CAI C, et al. Purification, structural characterization, and immunomodulatory activity of the polysaccharides from Ganoderma lucidum[J]. International Journal of Biological Macromolecules,2020,143:806−813. doi: 10.1016/j.ijbiomac.2019.09.141
[36] SANTRA M, KUNZRU D, RABARI D. A stability analysis of choline chloride:Urea deep eutectic solvent using density functional theory[J]. Computational and Theoretical Chemistry,2022,1217:113921. doi: 10.1016/j.comptc.2022.113921






 下载:
下载:


 下载:
下载:
