Isolation, Identification and Fermentation Characterization of Leuconostoc pseudomesenteroides HL64-1 Producing D-Lactic Acid with High Optical Purity
-
摘要: 从自然界中筛选分离产酸菌是获得高光学纯度乳酸生产菌株有效的途径之一。从腐烂果实中分离获得一株产高光学纯度D-乳酸菌株HL64-1,经形态学、16S rDNA序列分析、序列相似性Blast比对分析鉴定为假肠膜明串珠菌(Leuconostoc pseudomesenteroides)。在基础发酵培养基中摇瓶发酵24 h,产D-乳酸的量达到62.18 g/L,产酸速率达2.59 g/(L·h),光学纯度达99.90%(ee);在5 L发酵罐中放大培养,通过补加碳源,发酵72 h,D-乳酸产量达到78.74 g/L,平均产酸速率达1.09 g/(L·h)。该菌株可以有效利用农业副产物花生饼粉和棉籽粉作为替代氮源以降低发酵原料成本。该菌还可利用木糖产生D-乳酸,且葡萄糖能显著提高木糖的利用效率,极具工业应用前景。Abstract: Isolation and identification of acid-producing bacteria from environmental samples is still one of important and effective approaches to obtain strains producing lactic acid with high optical purity. In this study, an isolate strain named HL64-1, producing D-lactic acid with high optical purity, was isolated from rotten fruit. And HL64-1 was characterized as Leuconostoc pseudomesenteroides based on morphology, 16S rDNA sequence analysis and sequence similarity Blast analysis. After fermentation for 24 h, 62.18 g/L D-lactic acid was produced with an optical purity of 99.90%(ee) in basic fermentation culture. The acid production rate was 2.59 g/(L·h). Scale-up fermentation of L. pseudomesenteroides HL64-1 in 5-L fermenter for 72 h produced 78.74 g/L D-lactic acid by replenishment of carbon sources, and the average acid production rate was 1.09 g/(L·h). Moreover, L. pseudomesenteroides HL64-1 was found to be capable of using effectively cheap raw materials, such as agricultural by-products peanut cake meal and cottonseed meal, as alternative nitrogen sources, leading a reduction of fermentation cost. In addition, L. pseudomesenteroides HL64-1 could metabolize xylose into D-lactic acid. Co-fermentation of glucose and xylose mixtures showed that glucose significantly enhanced the utilization efficiency of xylose, making L. pseudomesenteroides HL64-1 to be a promising strain for pure D-lactic acid industrial production.
-
Keywords:
- D-lactic acid producing bacteria /
- separation /
- high optical purity /
- fermentation /
- xylose
-
D-乳酸(D-lactic acid,D-LA)作为多种手性化合物的合成前体,广泛应用于农药、医药和化工等领域[1−3]。随着高光学纯度的D-乳酸在聚乳酸(polylactic acid,PLA)材料领域中的开发和应用,全球D-乳酸的需求量急剧增加[4−7]。目前细菌发酵生产D-乳酸主要存在产品光学纯度偏低,难以达到生产聚合级乳酸标准,以及对发酵原料要求较高、产量较低,导致发酵成本居高不下等问题,远不能满足市场及聚乳酸行业的需要[8−11]。细菌发酵生产乳酸主要采用葡萄糖、蔗糖、酵母粉、蛋白粉为原料,原料来源较为单一,制约了产业的发展[12−14]。我国豆饼粉、花生饼粉、玉米粉等农副产品和秸秆等木质纤维素生物质资源丰富,但综合利用率较低,可作为乳酸发酵生产的替代碳氮源[15−16]。目前对微生物利用农副产品和木质纤维素生物质发酵生成D-乳酸的研究较少,且产量和光学纯度均较低。邵莲月[17]利用德氏乳杆菌保加利亚亚种CICC21101,以玉米秸杆酶解液为碳源,D-乳酸产量达45.23 g/L;孙家夺等[18]利用芽孢乳杆菌YBS1-5,以玉米芯酶解液和棉籽粉为原料发酵生产D-乳酸,产量达111.8 g/L,光学纯度为98%以上;李媛等[19]以花生粕为唯一氮源,采用芽孢乳杆菌CADS通过分批补料方式进行发酵生产,D-乳酸产量达118.2 g/L,光学纯度达99.0%以上。通过基因改造在获得高光学纯度D-乳酸生产菌上取得了较大的进展,由于菌种的遗传稳定性和对营养和发酵条件要求较高,在工业上的应用受到限制[20−23]。针对D-乳酸生产中存在的能利用木糖的菌种稀缺,且产物光学纯度普遍较低,筛选和构建产高光学纯度和有效利用木糖的生产菌株是D-乳酸行业发展首要解决的问题。
自然界中拥有丰富的乳酸菌种资源,本研究旨在从富含产酸菌的样品中筛选分离能利用木糖和产高光学纯度D-乳酸的野生型菌株,建立一套快速筛选高光学纯度的乳酸生产菌的方法,结合能有效利用廉价农业副产物为替代氮源,以降低原料成本,为D-乳酸生产提供潜在的菌种来源和低成本的发酵工艺。
1. 材料与方法
1.1 材料与仪器
假肠膜明串珠菌HL64-1 由本研究室从江西省安义县凤凰山桃园的腐烂果实中分离获得;350 mL和2.5 L厌氧产气袋、15 cm×30 cm和2.5 L培养袋 日本三菱株式会社;DL-乳酸钠标准品 美国SIGMA公司;轻质碳酸钙 广西西陇化工有限公司;酸性蛋白酶(食品级,10万u/g) 无锡市雪梅酶制剂科技有限公司;葡萄糖、木糖、酵母粉、蛋白胨、琼脂粉等试剂 生工生物工程(上海)股份有限公司;棉籽粉、玉米浆粉 北京奥博星生物技术有限责任公司;花生饼粉、玉米粉、高温豆饼粉 江苏百思佳生物科技有限公司;Ezup柱式细菌基因组DNA抽提试剂盒 生工生物工程(上海)股份有限公司;其他试剂均为分析纯或化学纯。
BX43相差生物显微镜 美国OLYMPUS公司;D30分光光度计 德国EPPENDORF股份公司;Arktik多功能PCR仪 Thermo赛默飞世尔科技有限公司;e2695高压液相色谱仪、2414示差检测器、2489紫外检测器 美国Waters公司;Practum 224-ICN分析天平 德国Sartorius公司;H1650-W高速离心机 湖南湘仪离心机仪器有限公司;ZWY-2102C恒温培养振荡器 上海智城分析仪器制造有限公司;SPX-250B-Z生化培养箱 上海博迅仪器有限公司;SW-CJ-1CU洁净工作台 苏州安泰空气设备有限公司;5 L全自动发酵罐 上海保兴生物技术有限公司。
1.2 实验方法
1.2.1 培养基的制备
MRS培养基(g/L):葡萄糖10,酵母粉10,蛋白胨5,KH2PO4 0.25,K2HPO4 0.25,MgSO4·7H2O 0.4,MnSO4·5H2O 0.02,FeSO4·7H2O 0.02,NaCl 0.02,pH6.8。
产酸分离培养基(g/L):在MRS液体培养基中加入CaCO3 5,琼脂粉18。
木糖产酸分离培养基(g/L):采用木糖取代葡萄糖,即木糖10,其余同产酸分离培养基。
种子培养基(g/L):在MRS液体培养基中加入CaCO3 5。
基础发酵培养基(g/L):葡萄糖120,酵母粉5,蛋白胨5,KH2PO4 0.25,K2HPO4 0.25,MgSO4·7H2O 0.4,MnSO4·5H2O 0.02,NaCl 0.02,CaCO3 55。
木糖利用及混合碳源发酵培养基(g/L):葡萄糖0~50,木糖10~40,酵母粉5,蛋白胨5,KH2PO4 0.25,K2HPO4 0.25,MgSO4·7H2O 0.4,MnSO4·5H2O 0.02,NaCl 0.02,CaCO3 30。具体碳源配比:a.葡萄糖20+木糖10,b.葡萄糖20+木糖20,c.葡萄糖20+木糖30,d.葡萄糖20+木糖40,e.葡萄糖30+木糖20,f.葡萄糖40+木糖20,g.葡萄糖50+木糖20。
氮源试验发酵培养基(g/L):葡萄糖120,氮源水解液100 mL,KH2PO4 0.25,K2HPO4 0.25,MgSO4·7H2O 0.4,MnSO4·5H2O 0.02,NaCl 0.02,CaCO3 55。
氮源水解液制备方法:分别称取a.酵母粉5.0 g+棉籽粉5.0 g,b.酵母粉5.0 g+花生饼粉5.0 g,c.酵母粉5.0 g+玉米粉5.0 g,d.酵母粉5.0 g+高温豆饼粉5.0 g,e.花生饼粉10.0 g,f.高温豆饼粉10.0 g,g.玉米浆粉10.0 g,分别加入H2O 100 mL,用1 mol/L HCl调节pH至3.0±0.2,加入酸性蛋白酶0.10 g,置50 ℃水浴水解22 h,水解结束后用1 mol/L NaOH调节pH至6.6±0.2。
1.2.2 菌体的分离与纯化
取约1.0 g样品加入至5 mL的MRS液体培养基中,置37 ℃厌氧静置培养48 h,富集厌氧菌。将产酸分离培养基倒入ф9 cm无菌平皿中,取0.1 mL菌液进行梯度稀释,涂布于平皿中,于37 ℃厌氧静置培养48 h后进行观察,挑选有透明圈的单菌落进行划线纯化,连续纯化3次后,接种于MRS斜面培养基中,同样条件下厌氧培养48~72 h,置4 ℃冰箱保存。
1.2.3 摇瓶发酵筛选高光学纯度D-乳酸生产菌株
平皿分离的产酸菌株通过摇瓶发酵初步筛选高光学纯度D-乳酸生产菌株。将保存的斜面菌株分别用2 mL的生理盐水洗脱,全部菌液接入装有30 mL种子培养液的三角瓶中,置于装有350 mL厌氧产气袋的培养袋,密封后固定在摇床中,于37 ℃、150 r/min厌氧培养15 h。种子液按7.5%(v/v)的接种量接种至100 mL发酵液中,摇瓶发酵厌氧培养方式同种子液,于37 ℃、180 r/min厌氧培养48 h,取样分析乳酸产量及光学纯度,筛选D型乳酸生产菌株进行菌种鉴定和进一步发酵试验。
1.2.4 D-乳酸生产菌株的鉴定
1.2.4.1 形态学观察
将菌株涂布于产酸分离培养基中37 ℃、厌氧培养48 h后,观察菌落形态,同时进行革兰氏染色,于BX43相差生物显微镜100×油镜下观察菌体形态。
1.2.4.2 菌株16S rDNA序列扩增与分析
采用试剂盒法提取待测菌株DNA,提取步骤参考细菌基因组DNA提取试剂盒说明书。以正向引物7F(5’-CAGAGTTTGATCCTGGCT-3’)和反向引物1540R(5’-AGGAGGTGATCCAGCCGCA-3’)扩增16S rDNA。PCR反应条件:94 ℃预变性 4 min,94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸1 min,30个循环;72 ℃末端延伸10 min。PCR产物经琼脂糖凝胶电泳,在生工生物工程(上海)股份有限公司完成测序及全基因序列分析。
系统进化树的构建和分析:将测序获得16S rDNA序列在NCBI核酸数据库中进行BLAST搜索比对,结果采用MEGA8.0中的邻接法(Neighbor-Joining tree)进行系统树的构建,并用Bootstrap对进化树进行1000次可信度分析。
1.2.5 菌株发酵性能研究
1.2.5.1 生长曲线的测定
将待测菌株按5%(v/v)接种量接种于MRS培养液中,于37 ℃、150 r/min厌氧培养24 h,每隔2 h取样,用分光光度计测定波长600 nm处的OD值。
1.2.5.2 菌株生长最适pH测定
将MRS培养液的初始pH用1 mol/L HCl或1 mol/L NaOH分别调节为4.2、4.5、4.8、5.1、5.4、5.7、6.0、6.3、6.7、7.0、7.3和7.6,灭菌后备用,将已培养好的待测菌株按5%(v/v)接种量分别接种于上述MRS培养液中,于37 ℃、150 r/min厌氧培养15 h,用分光光度计测定波长600 nm处的OD值。
1.2.5.3 菌株生长及发酵最适温度测定
将待测菌株按5%(v/v)接种量接种于MRS培养液中,分别置于25、27、29、31、33、35、37、39、41、43和45 ℃,150 r/min厌氧培养15 h,用分光光度计测定波长600 nm处的OD值。在上述温度下按1.2.3的摇瓶发酵方法于180 r/min厌氧培养24 h,取样测定发酵液中乳酸产量。
1.2.5.4 木糖混合碳源和不同氮源摇瓶发酵产酸试验
斜面菌株用2 mL的生理盐水洗脱,全部菌液接入装有30 mL种子培养液的三角瓶中,种子液于37 ℃、150 r/min厌氧培养15 h,按7.5%(v/v)的接种量分别接种于不同浓度的木糖及混合碳源发酵培养液中,以及不同的氮源的摇瓶发酵培养液中,不同碳、氮源组成及氮源制备方法见(1.2.1),于39 ℃、180 r/min厌氧发酵培养48 h,发酵结束后取样测定乳酸、乙酸、木糖和葡萄糖含量,以及光学纯度。
1.2.5.5 5 L发酵罐厌氧发酵
将活化的产酸菌液按6%(v/v)的接种量接种至3.0 L种子培养液中,通入99%的无菌N2,通气量0.05 vvm,于37 ℃、150 r/min厌氧培养10 h,以7.5%(v/v)的接种量接种至葡萄糖初始浓度为120 g/L的3.0 L发酵培养液中,通入99%的无菌N2,于39 ℃、200 r/min厌氧培养72 h,用30%~33%的无菌CaCO3溶液控制发酵液pH在5.5~6.8之间,每12 h取样测定乳酸、葡萄糖含量和光学纯度。
1.2.6 检测方法
1.2.6.1 乳酸、乙酸和葡萄糖含量测定
采用改良的高效液相色谱法对产物乳酸、乙酸和葡萄糖浓度进行分析[24]。发酵液于10000 r/min离心10 min;取上清液,稀释,用0.22 μm聚醚水性滤膜过滤,备用。色谱条件:示差检测器,色谱柱TOSOH Tskgel OApak-P+OApak-A(300 mm×7.8 mm,5 μm);柱温:30 ℃;进样量:10 μL;流速:1.0 mL/min;流动相:0.75 mmol/L H2SO4;根据标准校正曲线计算发酵液中乳酸、乙酸和葡萄糖含量。
1.2.6.2 乳酸光学纯度测定
采用改良的高效液相色谱法进行光学纯度的分析[24]。将发酵液中乳酸含量稀释至0.1%左右,采用高效液相色谱仪进行分析。色谱条件:紫外检测器,波长265 nm,色谱柱 SUMICHIRAL OA-5000(4.6φ×150 mm);柱温:40 ℃;进样量:5 μL;流速:1.0 mL/min;流动相:1 mmol/L CuSO4。根据面积归一法计算乳酸L体或D体含量。
D体光学纯度(%ee)=SD−SLSL+SD×100 L体光学纯度(%ee)=SL−SDSL+SD×100 式中:SL为L体峰面积;SD为D体峰面积。
1.2.6.3 木糖含量测定
采用高压液相色谱HPLC分析(外标定量法)[25]:RID示差折射检测器,色谱柱SHIMADZU-GL Sciences Inertil NH2(300 mm×7.8 mm,5 μm),柱温35 ℃,流速1.2 mL/min,流动相75%乙腈溶液,进样量10 μL。
1.3 数据处理
本研究每个样品设置三个生物学重复,采用Excel 2010进行数据处理和作图,并利用数据分析软件SPSS 26分析相关实验数据,利用MEGA 8.0中的邻接法(NJ)构建系统发育进化树。
2. 结果与分析
2.1 高光学纯度D-乳酸生产菌的筛选及鉴定
2.1.1 D-乳酸生产菌的分离筛选
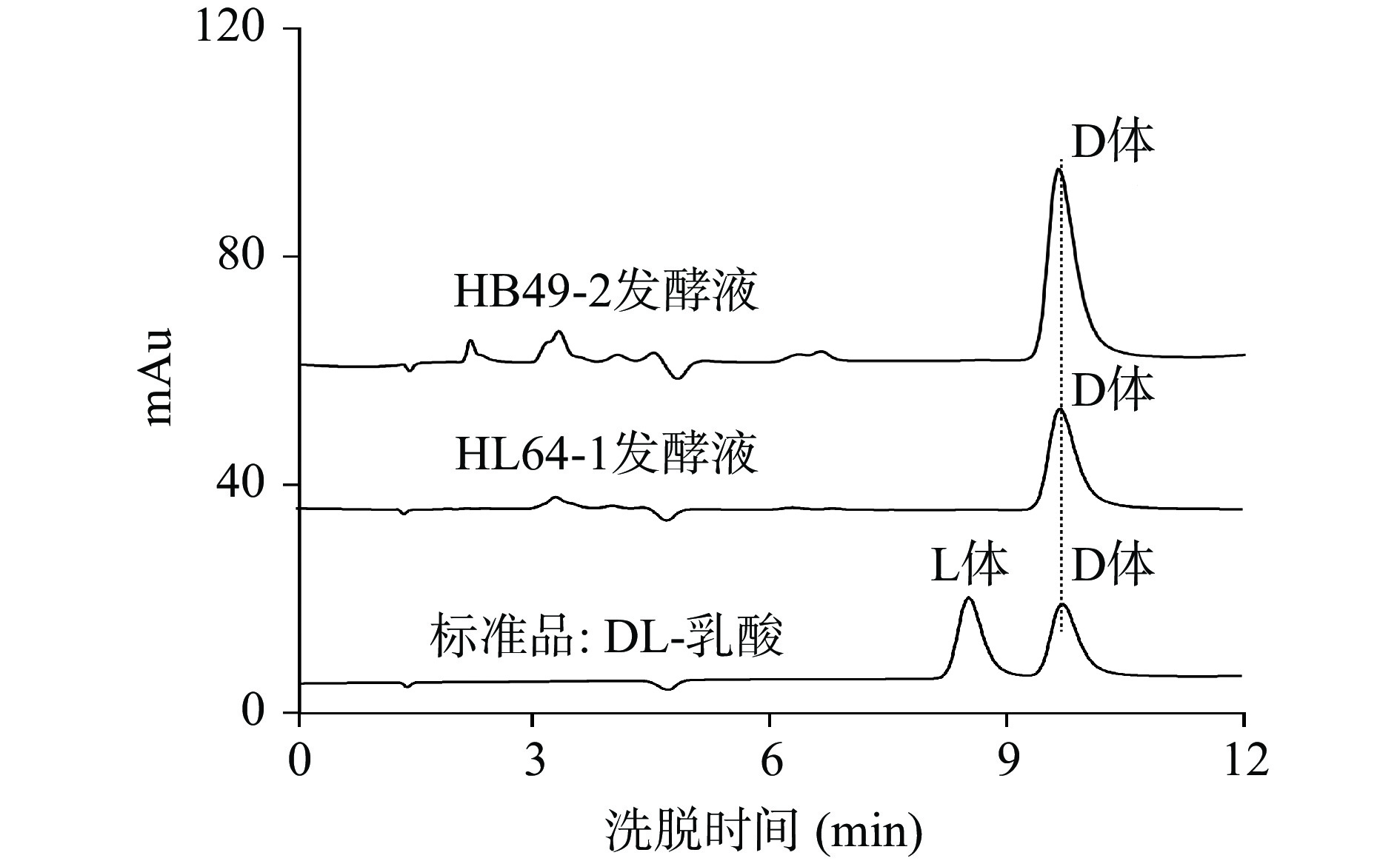
为分离到目标菌株,从不同地区、不同果园及腌渍的酸菜中采集样品。主要采集地区有江西省安义县凤凰山桃园,九江葡萄园种植基地,南丰县蜜桔种植基地,赣州信丰县裕和脐橙种植基地,福建莆田、龙岩地区的龙眼、荔枝种植基地。采集样品有不同品种的腐烂果实、种植园土壤、果树皮及果胶及各种酸菜水等,这些样品含有丰富的糖类等有机质,比较适合乳酸菌的生长。将采集的100多份样品通过产酸平皿筛选产酸菌,挑选出产酸快、透明圈较大的菌株进行分离纯化,共获得66株产酸菌株,通过摇瓶发酵对产乳酸能力和光学纯度的初步分析,获得2株产高光学纯度D-乳酸菌株(HB49-2和HL64-1),2株产高光学纯度L-乳酸菌株(HA7-5和HJ57),其光学纯度均达99.80%(ee)以上;另外有55株为产DL-乳酸菌株,其它7株产酸菌的发酵液中未能检测到乳酸。表1为产高光学纯度乳酸菌株和部分高产DL-乳酸菌株的初筛结果,菌株HL64-1和HB49-2为高光学纯度D-乳酸生产菌,发酵48 h乳酸产量分别达到60.39和42.85 g/L,D-乳酸光学纯度分别为99.90%(ee)和100%(ee),图1为菌株HL64-1和HB49-2发酵液中乳酸的光学纯度色谱图。
表 1 部分乳酸生产菌的初筛结果Table 1. Preliminary screening results of some lactic acid producing bacteria菌株编号 乳酸产量(g/L) 光学纯度(%ee) 菌株来源 L体 D体 BL4-4 93.58 54.42 45.58 桃园土壤 HA7-5 48.69 100.00 0.00 桃树树皮 HB45-2 96.38 52.23 47.77 酸菜水 HB49-2 42.85 0.00 100.00 桃园苔鲜 HJ57 34.13 99.88 0.08 葡萄园落果 HL64-1 60.39 0.10 99.90 桃园落果 HL66 98.46 73.33 26.67 桃树果胶 HL75-2 77.82 12.66 87.34 橙园落果 HL87-1 102.11 48.97 51.03 龙眼落果 HH103 104.21 49.55 50.45 荔枝园土壤 HH107-2 92.74 91.74 8.26 荔枝落果 2.1.2 D-乳酸生产菌形态学鉴定
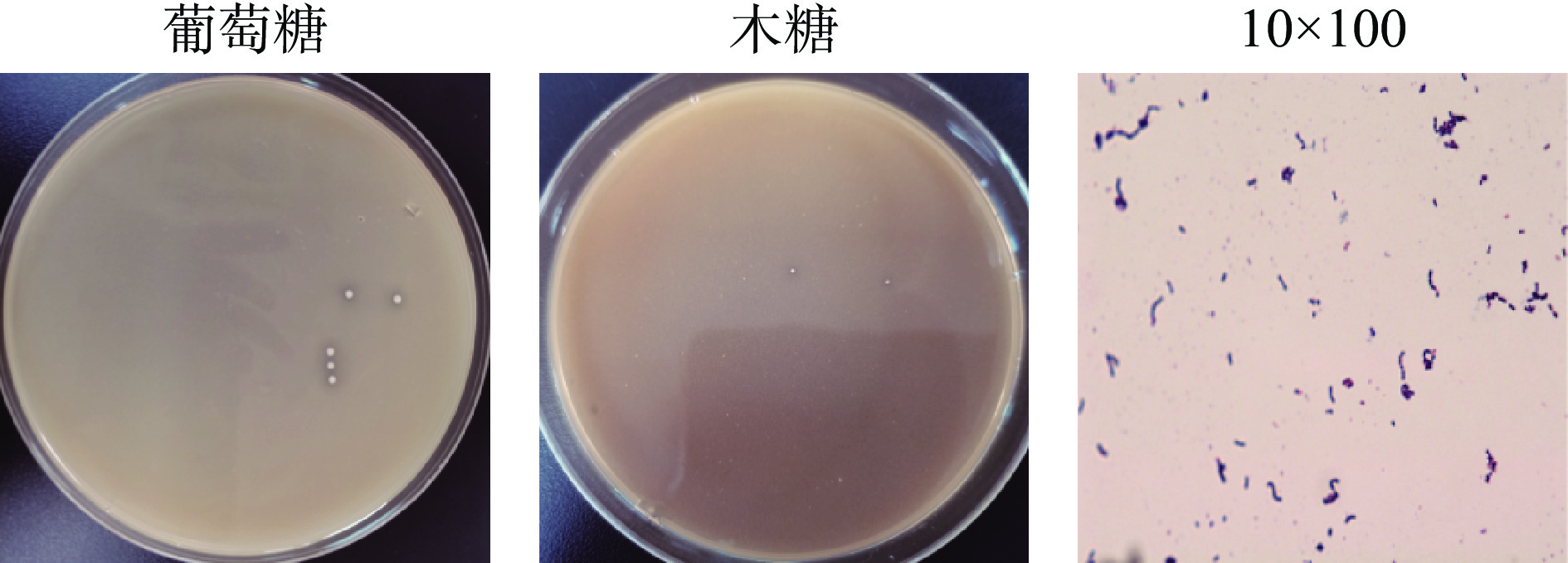
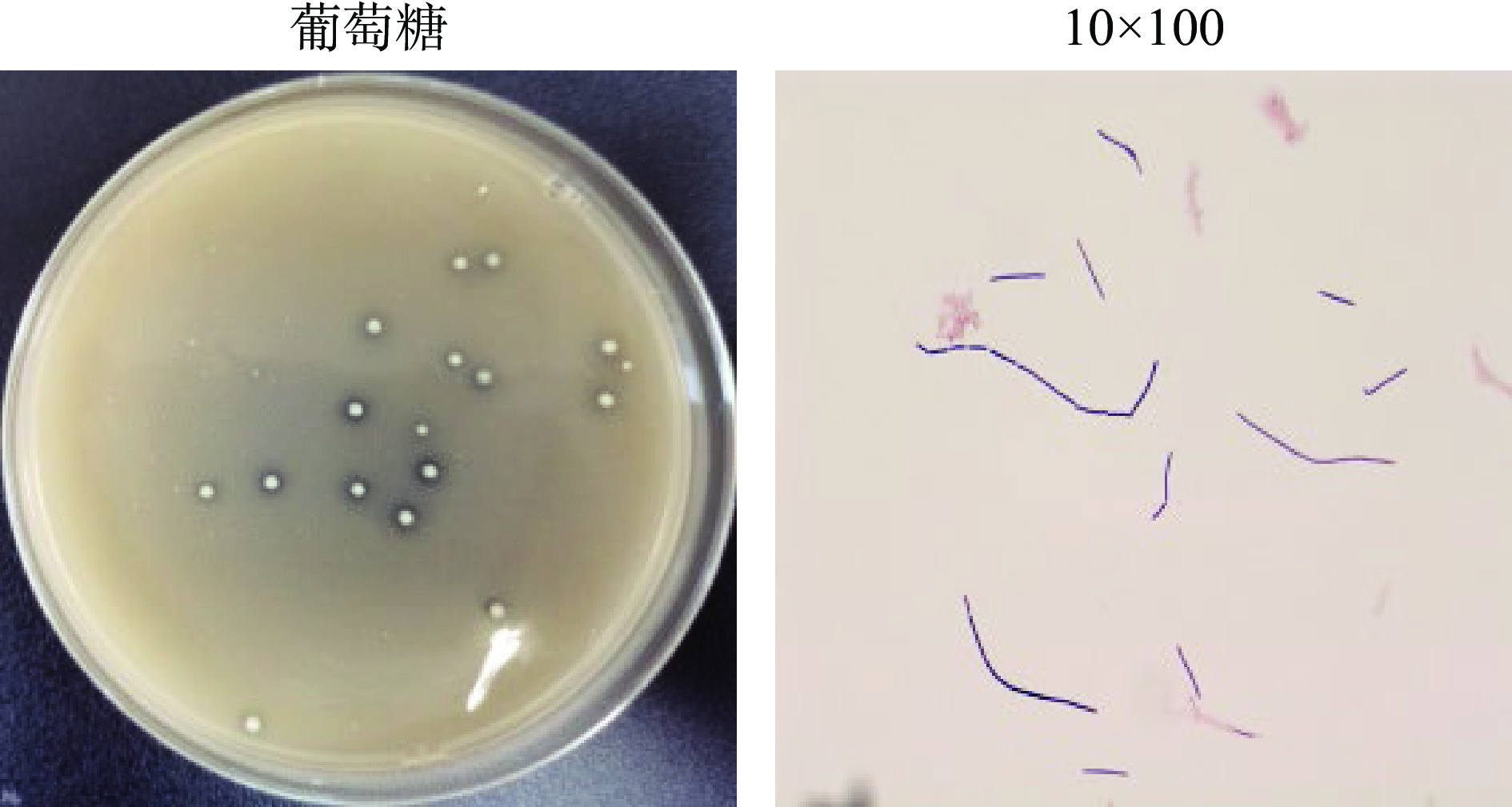
对分离获得的2株产高光学纯度D-乳酸菌株HB49-2和HL64-1的菌落形态和细胞形态进行了观察。这两种菌的菌落特征和菌体细胞形态描述见表2。菌株HL64-1还能在以木糖为唯一碳源的培养基中生长,表明该菌有利用木糖的产酸能力。图2为菌株HL64-1在产酸分离培养基、木糖产酸分离培养基中的菌落形态及细胞形态,与以葡萄糖为碳源的培养基相比,在培养相同时间内,菌株HL64-1在以木糖为唯一碳源的培养基上生长菌落较小,产酸圈亦较小;图3为菌株HB49-2在产酸分离培养基的菌落形态及细胞形态。
表 2 菌落及菌体细胞的形态特征Table 2. Morphological characteristics of colonies and cells菌株编号 菌落特征 菌体细胞形态 HB49-2 圆形、乳白色、表面光滑隆起、
边缘整齐单个体呈长杆状或呈链状 HL64-1 呈不透明的灰白色、表面光滑
扁平、边缘整齐椭圆形、有些成对或
成串排列2.1.3 菌株HL64-1和HB49-2的16S rDNA序列分析
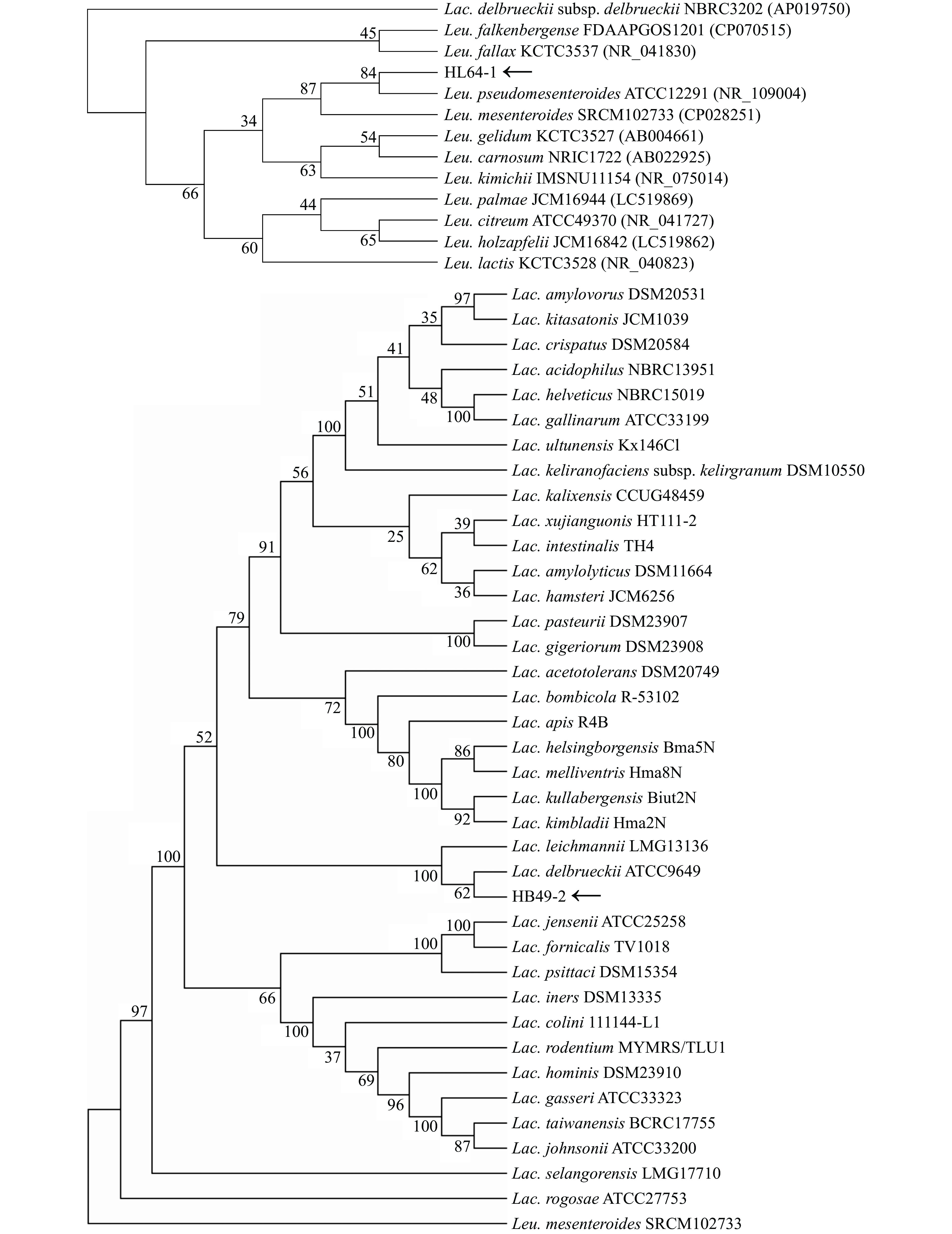
为了进一步鉴定菌株HL64-1和HB49-2,对其16S rDNA序列分别进行了测定。BLASTn比对结果显示菌株HL64-1与模式株Leuconostoc pseudomesenteroides ATCC12291(NR_109004)同源性为100%。菌株HB49-2与模式株Lacbacillus delbrueckii ATCC9649同源性为99.8%,此外,利用MEGA 8.0中的邻接法(NJ)构建了菌株的系统发育进化树(图4)。确定HL64-1属于假肠膜明串珠菌,命名为假肠膜明串珠菌HL64-1,HB49-2属于德氏乳杆菌,命名为德氏乳杆菌HB49-2。
自然界中能产乳酸的微生物很多,但大多数乳酸菌只产生DL-乳酸,产高光学纯度L-或D-乳酸的乳酸菌极少。目前已知的D-乳酸发酵生产中采用的生产菌株主要有德氏乳杆菌(Lac .delbrueckii)、保加利亚乳杆菌(Lac. bulgaricus)、棒状乳杆菌(Lac. coryniformis)和左旋乳酸芽孢杆菌(Bac. laevolacticus)等。并且D-乳酸生产菌的发酵菌种远不如L-乳酸发酵菌种具有种属多样性[26],通常野生菌株D-乳酸产量和光学纯度均较低,Tanaka等[27]利用Lac. delbrueckii IFO3202发酵生产D-乳酸,发酵36 h,D-乳酸最高产量达28 g/L,光学纯度达97.5%。通过诱变技术可有效提高产量,但对光学纯度的提高十分有限,于培星[28]利用钴60γ-射线辐照凝结芽孢杆菌JD-063D,D-乳酸产量由出发菌株的61 g/L提高至95 g/L,光学纯度从97.8%增加至98.7%。本研究从自然界中获得了两株光学纯度高于99.8%(ee)的D型野生菌株HL64-1和HB49-2。通过形态学和16S rDNA鉴定,确定了HL64-1属于Leuconostoc pseudomesenteroides,菌株HB49-2为Lactobacillus delbrueckii,德氏乳杆菌作为主要的D-乳酸生产菌株之一,国内外学者已进行了大量的研究,并已获得了较高的产量,产量通常达到85 g/L以上[29−31]。目前还未见到假肠膜明串珠菌产高光学纯度D-乳酸的报道,由于菌株HL64-1具有产酸速率快、D-乳酸光学纯度高的特点,且能在以木糖为唯一碳源的培养基中生长和产酸,为以纤维质为原料发酵生产D-乳酸提供了更多菌种选择,有望通过改良培养基组成和优化发酵工艺条件等,进一步提高产量和降低发酵成本。
2.2 菌株HL64-1发酵性能的初步研究
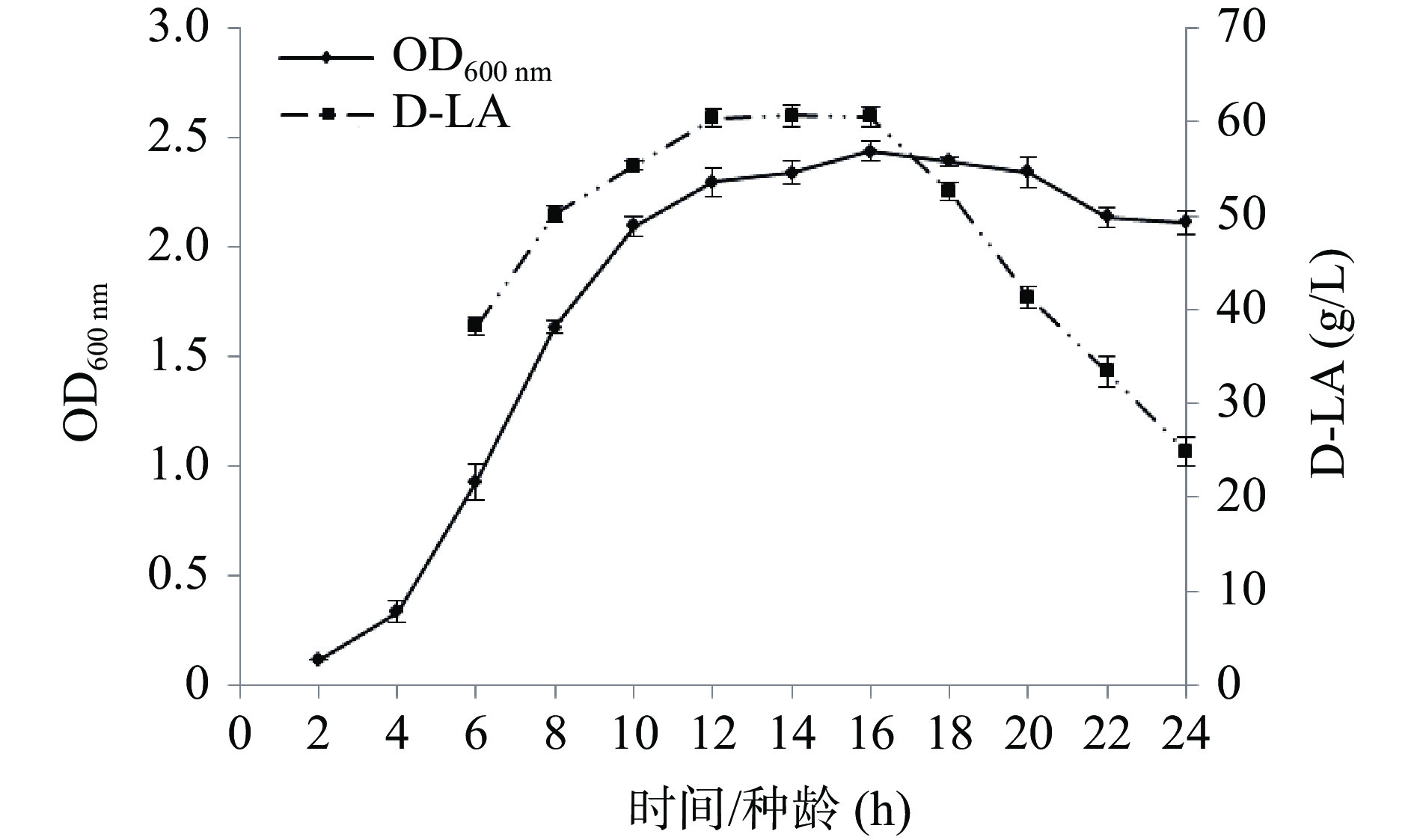
2.2.1 菌株HL64-1的生长曲线和种龄对D-乳酸产量的影响
从图5中可看出,菌株HL64-1在6 h左右进入对数生长期,10~12 h进入稳定生长期,在16 h吸光值达到最高值后,之后菌体浓度开始略有下降,至22 h吸光值下降明显。通过接种不同种龄的菌体进行摇瓶发酵,随着种龄的增长,D-乳酸产量明显增加,种龄在12~16 h时产量相差不大,达60.0 g/L左右,当种龄达到18 h后,产酸量明显下降,这可能与菌体衰老自溶,胞内酶释放和活性降低有关,因此选择培养14~16 h作为最适种龄进行发酵。
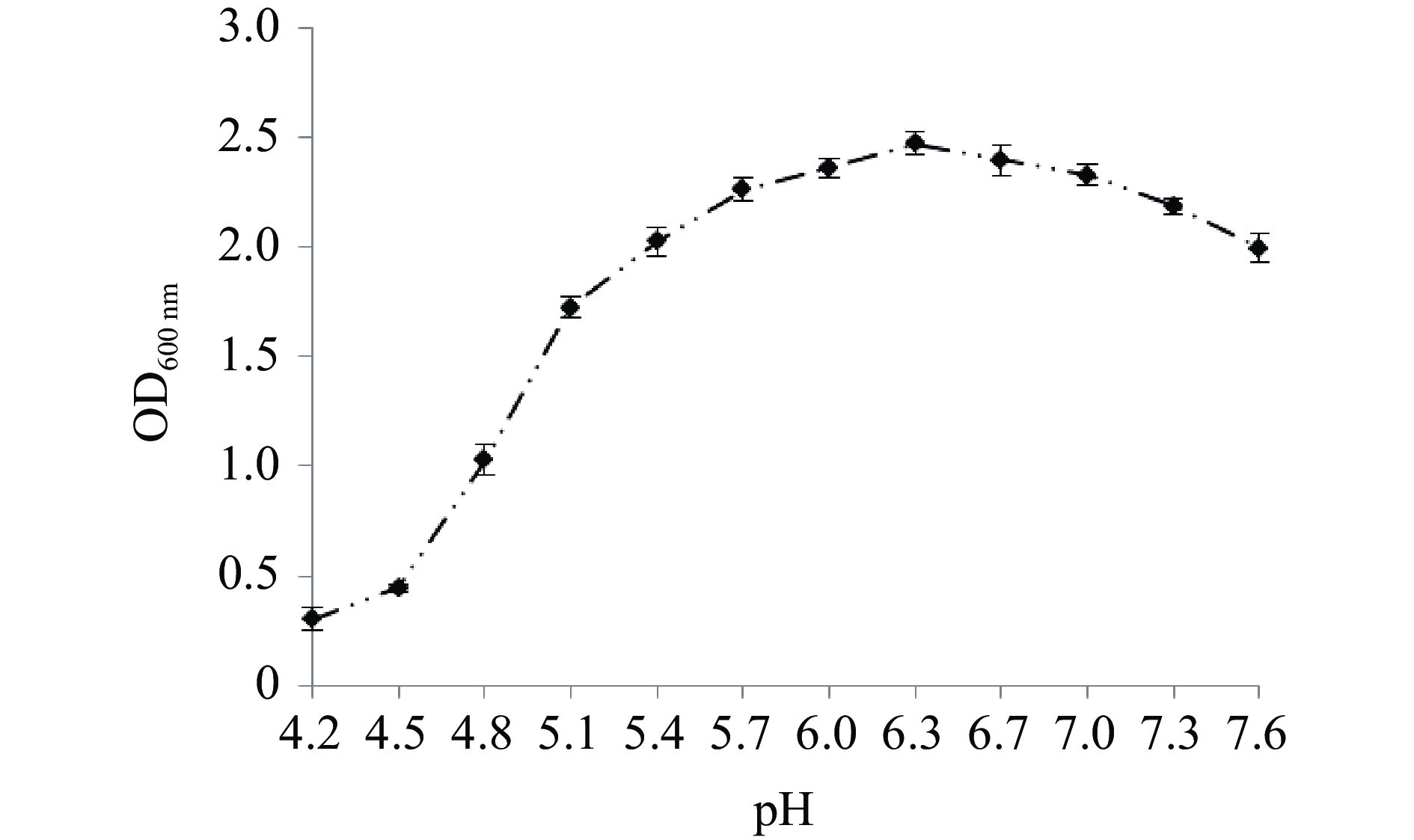
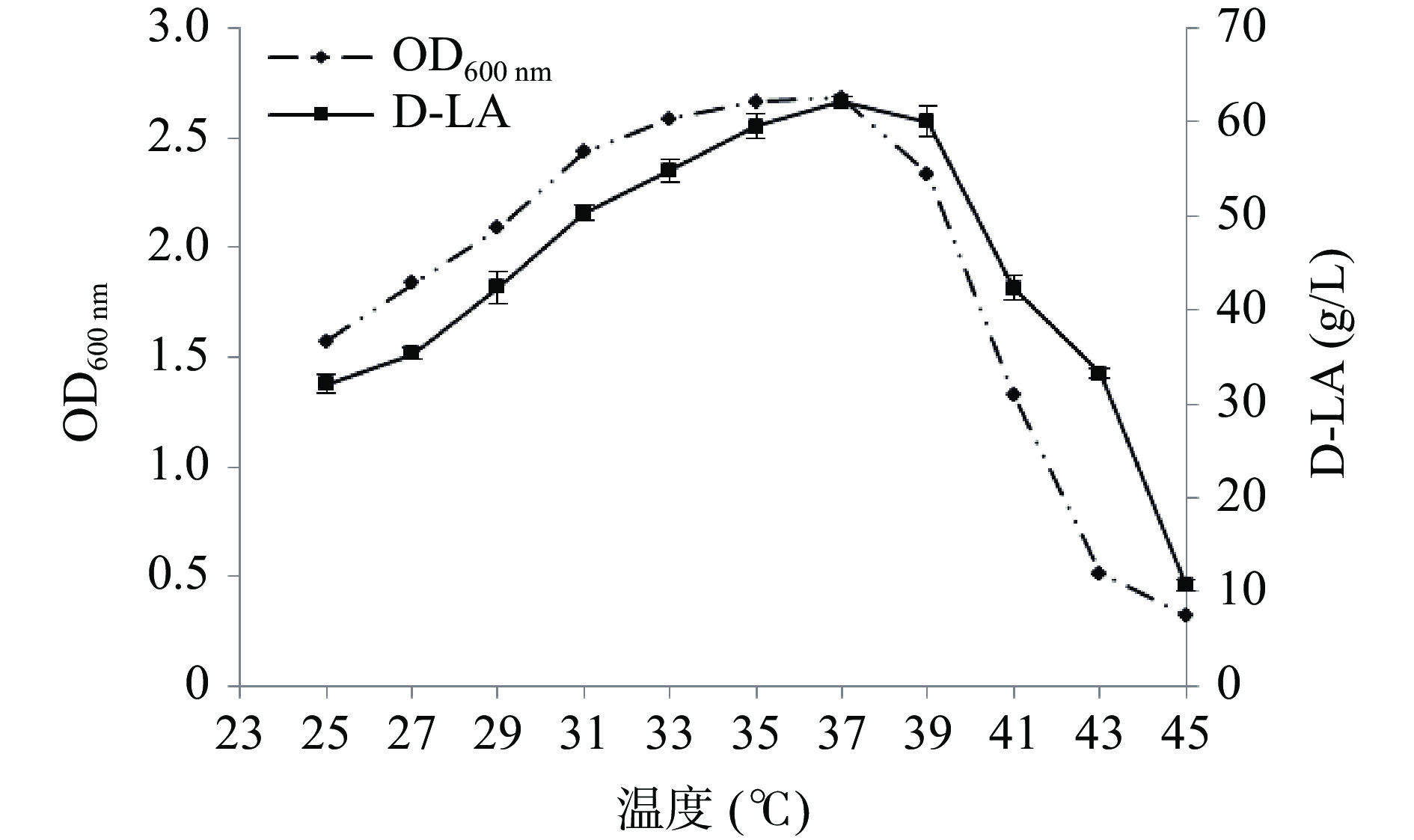
2.2.2 温度和pH对菌体生长和D-乳酸产量的影响
菌株在不同初始pH的MRS培养液中于37 ℃厌氧静置培养15 h后测定吸光值,在初始pH5.7~7.0时,菌体生长良好,在pH6.3时吸光值最高,表明该菌较适宜的pH生长条件为6.0~6.7(图6)。图7为在不同温度条件下菌体生长及摇瓶发酵24 h的产酸结果,随着温度的提高,菌体浓度和产酸能力随之增加,在37 ℃时菌体浓度达到最高,在37 ℃摇瓶厌氧发酵24 h,乳酸产量达到最高,为62.18 g/L,产酸速率达2.59 g/(L·h),进一步提高培养温度菌体浓度急剧下降,当温度高于39 ℃时,产酸能力亦明显下降,这可能是在较低的温度条件下,菌体生长缓慢,酶活活性低,而过高的温度也可导致一些酶失活和菌体快速衰老而影响产物合成,因此最适的发酵温度为37 ℃。
2.2.3 5 L发酵罐产酸放大试验
5 L罐的发酵试验分两组进行,初始葡萄糖(Glu)浓度均为120 g/L,其中一组每24 h补加20 g/L葡萄糖液,对照组不补加糖液,结果见图8。发酵24 h,D-乳酸含量均达62.00 g/L以上,此时葡萄糖已基本耗尽,在2.50 g/L以下;试验组补加葡萄糖后,D-乳酸产量有所增加,随着发酵时间的延长,产量增长速率减缓,葡萄糖消耗速率亦减缓,这可能与随着发酵时间的增加,菌体代谢能力下降有关。试验组发酵72 h,D-乳酸产量达78.74 g/L,平均产酸速率为1.09 g/(L·h);而未补加葡萄糖液的对照组,其发酵周期为24 h,D-乳酸产量为62.33 g/L,平均产酸速率达2.58 g/(L·h),D-乳酸光学纯度均在99.80%(ee)以上。
2.2.4 不同氮源对产酸的影响
为降低发酵原料成本,选用不同的农副产品为氮源取代或部分替代基础发酵培养基中的酵母粉和蛋白胨。1#是以基础发酵培养基的对照组(酵母粉5.0 g/L+蛋白胨5.0 g/L),2#~8#为试验组,不同配比氮源用酸性蛋白酶进行水解,使其更易于被菌体利用。除氮源外,其余发酵液组分与基础发酵培养基相同,将培养好的种子液以7.5%(v/v)接种量接种至100 mL含有不同氮源的发酵培养基中,于39 ℃、180 r/min摇床厌氧发酵48 h。结果见表3。
表 3 菌株HL64-1在不同氮源中的D-乳酸产量和光学纯度Table 3. D-Lactic acid production and optic purity of strain HL64-1 in different nitrogen sources编号 氮源水解液 D-LA(g/L) 光学纯度(%ee) 1 酵母粉5.0 g/L+蛋白胨5.0 g/L 61.18±2.38a 99.95±0.02a 2 酵母粉5.0 g/L+棉籽粉5.0 g/L 55.27±1.94b 99.94±0.03a 3 酵母粉5.0 g/L+花生饼粉5.0 g/L 57.38±1.06ab 99.94±0.04a 4 酵母粉5.0 g/L+玉米粉5.0 g/L 33.45±2.33d 99.87±0.11a 5 酵母粉5.0 g/L+高温豆饼粉5.0 g/L 40.24±1.82c 99.95±0.01a 6 花生饼粉10.0 g/L 31.54±1.45d 99.97±0.02a 7 高温豆饼粉10.0 g/L 20.32±0.87e 99.92±0.05a 8 玉米浆粉10.0 g/L 14.86±3.33f 99.85±0.09a 注:表中同列数据后的不同小写字母表示数据间具有显著性差异(P<0.05)。 结果表明:试验组酵母粉5.0 g/L+花生饼粉5.0 g/L和酵母粉5.0 g/L+棉籽粉5.0 g/L产酸量与对照组接近,表明花生饼粉和棉籽粉水解液可取代蛋白胨发酵生产乳酸,D-乳酸产量和产酸速率仅略低于以蛋白胨为氮源的对照组。采用酵母粉+农副产品作为复合氮源,不仅能够较好地降低乳酸发酵成本,而且可以有效利用农副产品的资源。相比上述情况,分别采用花生饼粉10.0 g/L、高温豆饼粉10.0 g/L和玉米浆粉10.0 g/L作为唯一氮源时,菌体生长速率和产酸量均较低,表明在混合氮源中添加酵母粉有利于产量的增加。采用不同氮源组合进行发酵,对产物的光学纯度没有显著影响。
2.2.5 菌株HL64-1利用木糖及复合碳源产酸试验
基于菌株HL64-1在以木糖(木糖含量10 g/L)为唯一碳源的MRS产酸筛选培养基中能够生长并产生透明圈,将培养好的种子液以7.5%(v/v)的接种量分别接种至以木糖和葡萄糖不同配比的发酵培养液中,于39 ℃、180 r/min摇床厌氧发酵48 h。碳源配比和结果见表4。
表 4 菌株HL64-1在木糖和不同配比的复合碳源中对D-乳酸产量的影响Table 4. Effects of strain HL64-1 on D-lactic acid production in xylose and composite carbon sources with different proportions碳源配比 D-LA(g/L) 乙酸(g/L) 葡萄糖(g/L) 木糖(g/L) 光学纯度(%ee) 葡萄糖(g/L) 木糖(g/L) 0 10 4.11±0.33g 2.27±0.42cd – 5.14±0.52ef 99.85±0.11a 0 20 4.79±0.24g 2.75±0.27bcd – 13.94±0.14b 99.90±0.07a 0 30 5.58±0.39g 2.92±0.36bc – 22.64±0.31a 99.86±0.05a 20 10 15.13±0.72f 2.14±0.22d – 3.77±1.17f 99.95±0.03a 20 20 18.22±0.32e 2.22±0.37cd – 10.56±0.63c 99.91±0.01a 20 30 23.77±1.16c 2.43±0.18cd – 15.47±1.85b 99.84±0.04a 20 40 27.42±0.85b 3.92±0.21a 0.15±0.06c 20.77±1.03a 99.94±0.04a 30 20 21.59±1.34cd 3.17±0.57b 0.84±0.29b 10.38±0.94c 99.94±0.01a 40 20 29.48±1.78b 2.90±0.38bc 1.21±0.35ab 8.24±1.04d 99.91±0.10a 50 20 32.17±0.83a 2.88±0.43bc 1.57±0.47a 7.05±0.66de 99.95±0.03a 注:表中同列数据后的不同小写字母表示数据间具有显著性差异(P<0.05),“–”表示未检出。 结果表明,在以木糖为唯一碳源时,随着木糖浓度提高,产酸量略有提高,如发酵24 h,D-乳酸含量就分别达4.07、4.74和5.58 g/L,并伴有少量副产物乙酸产生,乙酸浓度为2.27~2.92 g/L之间,发酵至48 h,D-乳酸含量基本没有增加,乙酸含量亦无明显变化,表明菌株在发酵初期对木糖利用速率较快,延长发酵时间并不能进一步利用木糖,最终残余木糖含量分别为5.14、13.94和22.64 g/L,D-乳酸光学纯度均为99.80%(ee)以上。在葡萄糖浓度为20 g/L时,增加木糖浓度,D-乳酸产量亦明显增加,且发酵液中木糖残留量比相同浓度的以木糖为唯一碳源时明显下降,表明采用混合碳源发酵有利于木糖的利用。在同一木糖浓度下,逐步提高葡萄糖浓度至50 g/L时,D-乳酸产量亦随着葡萄糖浓度增加而有所提高,发酵液中木糖残留量亦有所下降,亦表明了葡萄糖能有效促进菌株对木糖的利用。以木糖为碳源发酵均会产生一定量的副产物乙酸,其浓度大都在2.0~4.0 g/L之间,而以葡萄糖为唯一碳源发酵液中副产物乙酸浓度通常≤1.0 g/L,这可能与该菌利用木糖的代谢途径有关,需进一步进行深入研究。目前还鲜有细菌利用木糖生产D-乳酸的报道,亦未见假肠膜明串珠菌利用木糖生产D-乳酸的报道。传统的D-乳酸生产工艺主要采用以淀粉质原料进行发酵生产,这不仅消耗了粮食资源,而且还使乳酸的生产成本居高不下。我国秸秆、甘蔗渣、玉米芯等富含纤维素类物质的农业废料相当丰富,但这些资源未被合理利用造成了巨大的浪费和环境污染,菌株HL64-1能有效利用木糖生产D-乳酸,为微生物利用木质纤维素类物质生产乳酸提供了方法和菌种来源。
3. 结论
自然界中有丰富的产乳酸菌株资源,鉴于国内外用于生产高光学纯度D-乳酸生产菌种资源的稀缺,从自然界获得目标菌株是一种有效途径。本研究从腐烂果实中筛选分离出一株具有产高光学纯度D-乳酸生产菌株HL64-1,其D-乳酸光学纯度达到99.80%(ee)以上,经16S rDNA鉴定为假肠膜明串株菌(Leuconostoc pseudomesenteroides)。与其它D-乳酸生产菌株相比,菌株HL64-1虽然在乳酸产量上还较低,但在D-乳酸光学纯度和产酸速率上具有极大的优势,以葡萄糖为碳源其发酵周期仅24 h,产酸速度达2.59 g/(L·h),在发酵过程中通过补料可进一步提高乳酸产量至78.74 g/L。此外,该菌还能利用有效利用木糖,为开发利用木质纤维素资源发酵生产D-乳酸提供了菌株来源。通过综合利用廉价的农副产品如玉米浆、棉籽粉作为替代氮源,不仅有利于农副产品的资源利用,还可大幅降低原料成本。
-
表 1 部分乳酸生产菌的初筛结果
Table 1 Preliminary screening results of some lactic acid producing bacteria
菌株编号 乳酸产量(g/L) 光学纯度(%ee) 菌株来源 L体 D体 BL4-4 93.58 54.42 45.58 桃园土壤 HA7-5 48.69 100.00 0.00 桃树树皮 HB45-2 96.38 52.23 47.77 酸菜水 HB49-2 42.85 0.00 100.00 桃园苔鲜 HJ57 34.13 99.88 0.08 葡萄园落果 HL64-1 60.39 0.10 99.90 桃园落果 HL66 98.46 73.33 26.67 桃树果胶 HL75-2 77.82 12.66 87.34 橙园落果 HL87-1 102.11 48.97 51.03 龙眼落果 HH103 104.21 49.55 50.45 荔枝园土壤 HH107-2 92.74 91.74 8.26 荔枝落果 表 2 菌落及菌体细胞的形态特征
Table 2 Morphological characteristics of colonies and cells
菌株编号 菌落特征 菌体细胞形态 HB49-2 圆形、乳白色、表面光滑隆起、
边缘整齐单个体呈长杆状或呈链状 HL64-1 呈不透明的灰白色、表面光滑
扁平、边缘整齐椭圆形、有些成对或
成串排列表 3 菌株HL64-1在不同氮源中的D-乳酸产量和光学纯度
Table 3 D-Lactic acid production and optic purity of strain HL64-1 in different nitrogen sources
编号 氮源水解液 D-LA(g/L) 光学纯度(%ee) 1 酵母粉5.0 g/L+蛋白胨5.0 g/L 61.18±2.38a 99.95±0.02a 2 酵母粉5.0 g/L+棉籽粉5.0 g/L 55.27±1.94b 99.94±0.03a 3 酵母粉5.0 g/L+花生饼粉5.0 g/L 57.38±1.06ab 99.94±0.04a 4 酵母粉5.0 g/L+玉米粉5.0 g/L 33.45±2.33d 99.87±0.11a 5 酵母粉5.0 g/L+高温豆饼粉5.0 g/L 40.24±1.82c 99.95±0.01a 6 花生饼粉10.0 g/L 31.54±1.45d 99.97±0.02a 7 高温豆饼粉10.0 g/L 20.32±0.87e 99.92±0.05a 8 玉米浆粉10.0 g/L 14.86±3.33f 99.85±0.09a 注:表中同列数据后的不同小写字母表示数据间具有显著性差异(P<0.05)。 表 4 菌株HL64-1在木糖和不同配比的复合碳源中对D-乳酸产量的影响
Table 4 Effects of strain HL64-1 on D-lactic acid production in xylose and composite carbon sources with different proportions
碳源配比 D-LA(g/L) 乙酸(g/L) 葡萄糖(g/L) 木糖(g/L) 光学纯度(%ee) 葡萄糖(g/L) 木糖(g/L) 0 10 4.11±0.33g 2.27±0.42cd – 5.14±0.52ef 99.85±0.11a 0 20 4.79±0.24g 2.75±0.27bcd – 13.94±0.14b 99.90±0.07a 0 30 5.58±0.39g 2.92±0.36bc – 22.64±0.31a 99.86±0.05a 20 10 15.13±0.72f 2.14±0.22d – 3.77±1.17f 99.95±0.03a 20 20 18.22±0.32e 2.22±0.37cd – 10.56±0.63c 99.91±0.01a 20 30 23.77±1.16c 2.43±0.18cd – 15.47±1.85b 99.84±0.04a 20 40 27.42±0.85b 3.92±0.21a 0.15±0.06c 20.77±1.03a 99.94±0.04a 30 20 21.59±1.34cd 3.17±0.57b 0.84±0.29b 10.38±0.94c 99.94±0.01a 40 20 29.48±1.78b 2.90±0.38bc 1.21±0.35ab 8.24±1.04d 99.91±0.10a 50 20 32.17±0.83a 2.88±0.43bc 1.57±0.47a 7.05±0.66de 99.95±0.03a 注:表中同列数据后的不同小写字母表示数据间具有显著性差异(P<0.05),“–”表示未检出。 -
[1] 李晓姝, 高大成, 王领民, 等. 发酵法制备D-乳酸研究进展[J]. 当代化工,2017,46(8):1659−1662. [LI X S, GAO D C, WANG L M, et al. Research progress in preparation of D-lactic acid by fermentation[J]. Contemporary Chemical Industry,2017,46(8):1659−1662.] LI X S, GAO D C, WANG L M, et al. Research progress in preparation of D-lactic acid by fermentation[J]. Contemporary Chemical Industry, 2017, 46(8): 1659−1662.
[2] 刘娟, 王刚, 张明磊, 等. D-乳酸产生菌的研究进展[J]. 微生物学杂志,2016,36(1):96−99. [LIU J, WANG G, ZHANG M L, et al. The research progress of D-lactic acid fermentation bacterial strains[J]. Journal of Microbiology,2016,36(1):96−99.] LIU J, WANG G, ZHANG M L, et al. The research progress of D-lactic acid fermentation bacterial strains[J]. Journal of Microbiology, 2016, 36(1): 96−99.
[3] ERNESTA A, EGLE V, PAULIUS M, et al. Bioproduction of L- and D-lactic aicd:Advances and trends in microbial strain application and engineering[J]. Critical Reviews in Biotechnology,2021,42(3):11−19.
[4] 甄光明. 乳酸及聚乳酸的工业发展及市场前景[J]. 生物产业技术,2015(1):42−52. [ZHEN G M. Industrial development and market prospect of lactic acid and polylactic acid[J]. Bioindustrial Technology,2015(1):42−52.] ZHEN G M. Industrial development and market prospect of lactic acid and polylactic acid[J]. Bioindustrial Technology, 2015(1): 42−52.
[5] ZHAO Z G, TANG D H, JIA S K, et al. Favorable formation of stereocomplex crystals in long-chain branched poly(L-lactic acid)/poly(D-lactic acid) blends:Impacts of melt effect and molecular chain structure[J]. Journal of Materials Science,2021,56(10):6514−6530. doi: 10.1007/s10853-020-05703-2
[6] 赵璐. 生物可降解材料聚乳酸的制备及应用[J]. 辽宁化工,2017,46(8):834−837. [ZHAO L. Synthesis and application of biodegradable material-polylactic acid[J]. Liaoning Chemical Industry,2017,46(8):834−837.] ZHAO L. Synthesis and application of biodegradable material-polylactic acid[J]. Liaoning Chemical Industry, 2017, 46(8): 834−837.
[7] 汪晓鹏, 连钦, 李文磊, 等. 绿色生物降解塑料聚乳酸的研究进展[J]. 西部皮革,2021,43(7):8−10. [WANG X P, LIAN Q, LI W L, et al. Research progress of green biodegradable plastic polylactic acid[J]. Western Leather,2021,43(7):8−10.] WANG X P, LIAN Q, LI W L, et al. Research progress of green biodegradable plastic polylactic acid[J]. Western Leather, 2021, 43(7): 8−10.
[8] 韩文静, 梁颖超, 陶进, 等. 产D-乳酸的德氏乳杆菌保加利亚亚种发酵工艺研究[J]. 安徽农业科学,2018,46(7):4−5,9. [HAN W J, LIANG Y C, TAO J, et al. Production technology of D-lactic acid from Lactobacillus delbrueckii subsp. Bulgaricus[J]. Journal of Anhui Agriculture Science,2018,46(7):4−5,9.] HAN W J, LIANG Y C, TAO J, et al. Production technology of D-lactic acid from Lactobacillus delbrueckii subsp. Bulgaricus[J]. Journal of Anhui Agriculture Science, 2018, 46(7): 4−5,9.
[9] PRASIRTSAK B, THITIPRASERT B, TOLIENG V, et al. D-lactic acid fermentation performance and the enzyme activity of a novel bacterium Terrilactibacillus laevilacticus SK5-6[J]. Annals of Microbiology,2019,69(13):1537−1546. doi: 10.1007/s13213-019-01538-8
[10] DUSSELIER M, VAN WOUWE P, DEWAELE A, et al. Lactic acid as a platform chemical in the biobased economy:The role of chemocatalysis[J]. Energy & Environmental Science,2013,6(5):1415−1442.
[11] KLOTZ S, KAUFMANN N, KUENZ A, et al. Biotechnological production of enantiomerically pure D-lactic acid[J]. Applied Microbiology and Biotechnology,2016,100(22):9423−9437. doi: 10.1007/s00253-016-7843-7
[12] COELHO L F, BOLNER D L, CBISTIAN J, et al. D-lactic acid production by Leuconostoc mesenteroides B512:Using different carbon and nitrogen sources[J]. Applied Biochemistry and Biotechnology,2011,164(7):1160−1171. doi: 10.1007/s12010-011-9202-6
[13] ALICJA M, ANNA C R, SYLWIA G, et al. Study on the use of starch biomass as a carbon source in D-lactate fermentation[J]. Przemysl Chemicany,2020,99(1):99−102.
[14] 于波, 曾艳, 姜旭, 等. 聚合级L-乳酸的非粮生物质发酵研究进展[J]. 生物工程学报,2013,29(4):411−421. [YU B, ZENG Y, JIANG X, et al. Trends in polymer-grade L-lactic acid fermentation by non-food biomass[J]. Chinese Journal of Biotechnology,2013,29(4):411−421.] YU B, ZENG Y, JIANG X, et al. Trends in polymer-grade L-lactic acid fermentation by non-food biomass[J]. Chinese Journal of Biotechnology, 2013, 29(4): 411−421.
[15] 陈明星. 木质纤维素生产高手性纯度D-乳酸以及合成D-丙交酯的研究[D]. 上海:华东理工大学, 2022. [CHEN M X. Study on the production of high chiral purity of D-lactic acid and synthesis of cyclic D-lactide from lignocellulose[D]. Shanghai:East China University of Science and Technology, 2022.] CHEN M X. Study on the production of high chiral purity of D-lactic acid and synthesis of cyclic D-lactide from lignocellulose[D]. Shanghai: East China University of Science and Technology, 2022.
[16] MARIA A, ROLAND S, KERSTIN M, et al. Recent advances in D-lactic acid production from renewable resources:Case studies on agro-industrial waste streams[J]. Food and Biotechnology,2019,57(3):293−304. doi: 10.17113/ftb.57.03.19.6023
[17] 邵莲月. 玉米秸杆NaOH-Urea预处理及发酵生产D-乳酸初步研究[D]. 长春:吉林农业大学, 2021. [SAO L Y. A preliminary study on pretreatment of corn stover via NaOH-Urea and fermentation production of D-lactic acid[D]. Changchun:Jilin Agriculture University, 2021.] SAO L Y. A preliminary study on pretreatment of corn stover via NaOH-Urea and fermentation production of D-lactic acid[D]. Changchun: Jilin Agriculture University, 2021.
[18] 孙家夺, 吴斌, 何冰芳. 利用农业废弃物生产D-乳酸[J]. 生物加工过程,2019,17(2):202−206. [SUN J D, WU B, HE B F. Production of D-lactic acid from agricultural wastes by Sporolactobacillus sp. YBS1-5[J]. Chinese Journal of Bioprocess Engineering,2019,17(2):202−206.] SUN J D, WU B, HE B F. Production of D-lactic acid from agricultural wastes by Sporolactobacillus sp. YBS1-5[J]. Chinese Journal of Bioprocess Engineering, 2019, 17(2): 202−206.
[19] 李媛, 徐书景, 张庆, 等. 采用钠盐调酸发酵生产D-乳酸的工艺研究[J]. 河北师范大学学报/自然科学版,2014,38(8):296−300. [LI Y, XU S J, ZHANG Q, et al. Production of D-lactic acid using sodium hydroxide as neutralizing agent[J]. Journal of Hebei Normal University/Natural Science Edition,2014,38(8):296−300.] LI Y, XU S J, ZHANG Q, et al. Production of D-lactic acid using sodium hydroxide as neutralizing agent[J]. Journal of Hebei Normal University/Natural Science Edition, 2014, 38(8): 296−300.
[20] 黄玉堃. 代谢工程改造热带假丝酵母生产D-乳酸[D]. 无锡:江南大学, 2021. [HUANG Y X. Metabolic engineering of Candida tropicalis to produce D-lactic acid[D]. Wuxi:Jiangnan University, 2021.] HUANG Y X. Metabolic engineering of Candida tropicalis to produce D-lactic acid[D]. Wuxi: Jiangnan University, 2021.
[21] 周丽. 高产高纯D-乳酸的E. coli代谢工程菌的构建[D]. 无锡:江南大学, 2012. [ZHOU L. Construction of metabolically engineered E. coli producing higher titer of pure D-lactate[D]. Wuxi:Jiangnan University, 2012.] ZHOU L. Construction of metabolically engineered E. coli producing higher titer of pure D-lactate[D]. Wuxi: Jiangnan University, 2012.
[22] 郑璐, 柏中中, 许婷婷, 等. D-乳酸高产菌菊糖芽胞乳杆菌Y2-8磷酸果糖激酶基因在大肠杆菌中的克隆和表达[J]. 生物加工过程,2014,12(4):37−42. [ZHENG L, BAI Z Z, XU T T, et al. Cloning and expression of phosphofructokinase gene from Sporolactobacillus inulinus in Escherichia coli[J]. Chinese Journal of Bioprocess Engineering,2014,12(4):37−42.] ZHENG L, BAI Z Z, XU T T, et al. Cloning and expression of phosphofructokinase gene from Sporolactobacillus inulinus in Escherichia coli[J]. Chinese Journal of Bioprocess Engineering, 2014, 12(4): 37−42.
[23] WARASIRIN S, KITTAPONG S T, AKARAPHOL W, et al. D-lactic acid production from sugarcane bagasse by genetically engineered Saccharomyces cerevisiae[J]. Journal of Fungi,2022,8(8):816−818. doi: 10.3390/jof8080816
[24] 张媛, 王小艳, 陈博, 等. 基因工程改造植物乳杆菌生产光学纯度D-乳酸[J]. 当代化工,2019,48(4):674−678. [ZHANG Y, WANG X Y, CHEN B, et al. Genetically engineered Lactobacillus plantarum production of optical pure D-lactic acid[J]. Contemporary Chemical Industry,2019,48(4):674−678.] ZHANG Y, WANG X Y, CHEN B, et al. Genetically engineered Lactobacillus plantarum production of optical pure D-lactic acid[J]. Contemporary Chemical Industry, 2019, 48(4): 674−678.
[25] 梁莹. 玉米秸杆稀硫酸预处理工艺研究[D]. 天津:天津大学, 2007. [LIANG Y. Study of dilute sulfuric acid pretreatment of corn stover[D]. Tianjin:Tianjin University, 2007.] LIANG Y. Study of dilute sulfuric acid pretreatment of corn stover[D]. Tianjin: Tianjin University, 2007.
[26] 许婷婷, 柏中中, 何冰芳. D-乳酸制备研究进展[J]. 化工进展,2009,28(6):991−996. [XU T T, BAI Z Z, HE B F. Advances in the preparation of D-lactic acid[J]. Chemical Industry and Engineering Progress,2009,28(6):991−996.] XU T T, BAI Z Z, HE B F. Advances in the preparation of D-lactic acid[J]. Chemical Industry and Engineering Progress, 2009, 28(6): 991−996.
[27] TANKA T, MASAHIRO H, SUGURU T, et al. Production of D-lactic acid from defatted rice bran by simultaneous saccharification and fermentation[J]. Bioresource Technology,2006,97:211−217. doi: 10.1016/j.biortech.2005.02.025
[28] 于培星. 高产D-乳酸生产菌株的选育[J]. 食品与生物技术学报,2010,29(5):796−800. [YU P X. D-lactic acid production of high-yielding strains of breeding[J]. Journal of Food Science and Biotechnology,2010,29(5):796−800.] YU P X. D-lactic acid production of high-yielding strains of breeding[J]. Journal of Food Science and Biotechnology, 2010, 29(5): 796−800.
[29] TSAHIRO Y, KANEKO W, SUN Y, et al. Continuous D-lactic acid production by a novel thermotolerant Lactobacillus delbrueckii subsp lactis QU 41[J]. Applied Microbiology and Biotechnology,2011,89(6):1741−1750. doi: 10.1007/s00253-010-3011-7
[30] TORRE I, LADERO M, SANTOS V E. Production of D-lactic acid by L. delbrueckii growing on orange peel waste hydrolysates and mode monosaccharide solutions:Effects of pH and temperature on process kinetics[J]. Biomass Conversion and Biorefinery,2019,9(3):565−575. doi: 10.1007/s13399-019-00396-3
[31] 梁少雄. 德氏乳杆菌高效发酵D-乳酸过程的代谢调控机制研究[D]. 天津:天津大学, 2018. [LIANG S X. Metabolic and regulatory mechanism in the process of D-lactic acid overproduction by Lactobacillus delbrueckii[D]. Tianjin:Tianjin University, 2018.] LIANG S X. Metabolic and regulatory mechanism in the process of D-lactic acid overproduction by Lactobacillus delbrueckii[D]. Tianjin: Tianjin University, 2018.





 下载:
下载:

 下载:
下载:
