Extraction of Collagen and Preparation and Characterization of Nanofibers
-
摘要: 为提高羊皮中胶原蛋白的提取率和利用率,采用酸酶复合法提取羊皮胶原蛋白,再利用静电纺技术制备胶原基纳米纤维。以羊皮胶原蛋白提取率为评价指标,考察料液比、乙酸浓度、胃蛋白酶浓度和酶解时间四个因素对羊皮胶原蛋白提取效果的影响,确定单因素最优水平;在此基础上,采用正交试验设计对羊皮胶原蛋白提取的工艺条件进行优化,并通过紫外光谱扫描、红外光谱扫描、SDS-PAGE图谱和扫描电镜等生化技术探讨酶解过程对胶原蛋白结构性质的影响;然后将胶原蛋白和聚乳酸复合静电纺丝,制备得到胶原基纳米纤维。结果表明,酸酶复合法提取羊皮胶原蛋白最佳工艺为:料液比1:25 g/mL、乙酸浓度1.2 mol/L、胃蛋白酶用量1.0%、酶解时间72 h,在此条件下羊皮胶原蛋白提取率为38.42%±0.49%;紫外光谱扫描显示羊皮胶原蛋白于230 nm附近出现最大紫外吸收峰;红外光谱扫描、SDS-PAGE图谱分析表明羊皮胶原蛋白主要有α1、α2、β三种亚基成分组成,属于Ⅰ型胶原蛋白,且胶原蛋白的空间结构保留完整;扫描电镜直观表明了羊皮胶原蛋白的纤维网络结构保留较完整;静电纺丝得到的胶原基纳米纤维直径为418.02±183.77 nm,拉伸强度为3.616±0.386 MPa,断裂伸长率为8.69%±1.95%,物理性能优良,有做细胞支架的潜力。本研究为提高羊皮和羊皮胶原蛋白的高值化利用提供了一定的理论基础,也为胶原基纳米医用纤维产品开发提供理论支撑。Abstract: In order to improve the extraction rate and utilization rate of collagen in sheepskin, sheepskin collagen was extracted by acid enzyme compounding method, and collagen-based nanofibers were prepared by electrospinning technology. Taking the extraction rate of sheepskin collagen as the evaluation index, the effects of four factors, namely material-liquid ratio, acetic acid concentration, pepsin concentration and enzymatic hydrolysis time, on the extraction effect of sheepskin collagen were investigated, and the optimal level of single factors were determined. On this basis, the process conditions of sheepskin collagen extraction were optimized by orthogonal experimental design. The effects of enzymatic hydrolysis on the structural properties of collagen were explored by biochemical techniques such as ultraviolet spectrum scanning, infrared spectrum scanning, SDS-PAGE mapping and scanning electron microscopy. Collagen and polylactic acid were then compounded and electrospun to obtain collagen-based nanofibers. The results showed that the best process for extracting sheepskin collagen by acid enzyme compounding method was as follows: Material-liquid ratio of 1:25 g/mL, acetic acid concentration of 1.2 mol/L, pepsin dosage of 1.0%, enzymatic hydrolysis time of 72 h. Under these conditions, the extraction rate of sheepskin collagen was 38.42%±0.49%. Ultraviolet spectroscopy showed that sheepskin collagen had a maximum UV absorption peak around 230 nm. Infrared spectrum scanning and SDS-PAGE map analysis showed that sheepskin collagen was mainly composed of α1, α2 and β three subunit components, which belonged to type I collagen, and the spatial structure of collagen was intact. Scanning electron microscopy showed that the fiber network structure of sheepskin collagen was relatively intact. The collagen-based nanofibers obtained by electrospinning had a diameter of 418.02±183.77 nm, a tensile strength of 3.616±0.386 MPa, and an elongation at break of 8.69%±1.95%, which had excellent physical properties and the potential to be used as a cell scaffold. This study would provide a theoretical basis for improving the high-value utilization of sheepskin and sheepskin collagen, and also provide theoretical support for the development of collagen-based nanomedical fiber products.
-
Keywords:
- collagen /
- electrospinning /
- blending modification /
- medical materials /
- bracket
-
胶原蛋白,简称胶原,是一种生物大分子,常见的胶原蛋白类型有Ⅰ型、Ⅱ型、Ⅲ型,其中Ⅰ型胶原蛋白主要存在于动物皮、韧带、眼角膜、骨骼和肌腱中,约占全部胶原蛋白含量的90%;II型胶原蛋白主要存在于软骨中;III型胶原蛋白主要存在内脏中[1-2]。我国是畜牧业大国,动物皮产量日益增加,而这些动物皮多用于食品、医疗、皮革、服装等领域,在品质、价值方面仍处于弱势[3-5],毛皮利用率低,在生皮加工中会造成大量的浪费和污染。动物皮是制取动物胶原蛋白的主要载体,目前研究主要是从猪皮、牛皮、鱼皮中水解得到动物胶原蛋白,但以羊皮为研究对象的报告很少。我国羊皮资源丰富,每年生产上亿张羊皮,而羊皮主要成分是角蛋白、胶原蛋白、弹性蛋白,古书记载羊皮蛋白外敷具有治疗跌打肿痛的作用,现代研究表明羊皮胶原蛋白具有透气、保暖、吸湿的特点,对关节炎和风湿病人具有较好的疗效[6]。胶原蛋白的提取方法较多,有酶法、酸法、盐法、碱法、热水法[7-8],其中盐法用于胶原蛋白的分离纯化;碱法会使胶原蛋白变性成有毒物质;热水法容易导致胶原蛋白变性,常用于明胶的制备。酸法和酶法较为常用,因此本文利用酸酶复合法提取羊皮胶原蛋白。
纳米纤维是指纤维直径小于1 μm的纤维,因其具备尺寸效应和表/界面效应而广泛应用于生物医用、食品包装、吸附过滤、传感等领域[9]。纳米纤维可通过拉伸、模板合成、自组装、静电纺、相分离等方法制得,静电纺丝法相较于其他方法具有成本低廉、生产设备简单、工艺可控等优点,是近年来发展起来的一种加工技术[10]。随着科技的发展,静电纺丝用原料也趋向多元化,如天然高聚物(纤维素、蛋白质、多糖等)、合成高聚物(聚乙烯醇、聚己内酯、聚乳酸等),其中胶原蛋白作为动物蛋白的一种,是天然的生物大分子材料,而且具有良好的生物相容性、低免疫原性、可降解性,在止血、药物缓释载体、组织工程支架等方面有广泛应用[11-12]。静电纺胶原蛋白纳米纤维兼具纳米纤维的结构特征和胶原蛋白的化学特征,比表面积大、孔隙率高、生物相容性好、含有大量的活性基团、可模拟细胞外基质[13],是理想的生物医用材料。但由于胶原蛋白力学性能较弱,致使其在纺丝和应用中受到限制,因此需要将胶原蛋白改性[14-15]。已知聚乳酸天然可再生、易降解、成纤性好,同时具有良好的抗菌性和力学性[16-17],本文采用物理共混改性,将胶原蛋白和聚乳酸复合纺丝提高胶原纤维力学性能。相较于化学改性,共混改性无毒无污染,细胞亲和性好。
近年来,国内外通过提取动物胶原蛋白,再利用静电纺丝法制备复合材料应用到生物医学领域成为热点。本研究采用酸酶复合法提取羊皮中的胶原蛋白,并进行工艺优化和蛋白表征,然后将胶原蛋白与聚乳酸溶于六氟异丙醇中进行静电纺丝,以期制备出纤维形貌均一、成纤效果好的纳米纤维膜,旨在提供具有一定力学性能和生物活性的医用纳米纤维材料,为进一步的细胞试验和胶原蛋白医用产品开发提供支撑。
1. 材料与方法
1.1 材料与仪器
干羊皮 食品级,齐齐哈尔皮革厂;透析袋(Mw=14000) 浙江博时医疗器械有限公司;胃蛋白酶(1200 U/g)、四甲基乙二胺、β-巯基乙醇 分析纯,上海蓝季科技发展有限公司;氯化钠、异丙醇、丙三醇、三氯乙酸 化学纯,天津市光复科技发展有限公司;甲醇、乙醇 分析纯,天津市天力化学试剂有限公司;十二烷基磺酸钠、丙烯酰胺、N-N双丙烯酰胺、三羟甲基氨基甲烷 电泳级,上海阿拉丁生化科技有限公司;碳酸钠、过硫酸铵、乙酸 化学纯,天津市凯通化学试剂有限公司;溴酚蓝、考马斯亮蓝R-250 电泳级,上海创赛科技有限公司;甘氨酸、蛋白marker 电泳级,上海生物生工工程股份有限公司;聚乳酸、六氟异丙醇 分析纯,上海麦克林生化科技有限公司。
DF-Ⅱ集热式磁力加热搅拌器 江苏荣华公司;BS223S电子天平 北京赛多利斯公司;TDL40B离心机 上海安亭公司;PB-10 pH计 北京赛多利斯公司;LGJ-12冷冻干燥机 北京松源华兴公司;Lamda35紫外分光光度计 美国PE公司;Spectrum红外光谱仪 美国PE公司;DYCZ-24DM电泳仪 北京六一公司;FSP-T高压静电纺丝机 天津云帆公司;S-3400扫描电镜 日本日立公司;TH-8100万能材料试验机 济南普创机电有限公司;325-301测厚计 江都市天发试验机械厂;JY-82C视频接触角测定仪 承德鼎盛试验机检测设备有限公司。
1.2 实验方法
1.2.1 羊皮预处理
称取一定质量的干羊皮,浸入浓度为12%的氯化钠溶液中,4 h后取出以除去杂质,用蒸馏水冲洗3次,滤干后浸入脱脂剂(6%碳酸钠/8%异丙醇混合溶液1:1)中,24 h后取出以除去杂蛋白和脂肪[18],用蒸馏水重复洗3次,自然通风晾干后称重为W1,待用,试验温度4 ℃。
1.2.2 羊皮胶原蛋白的提取
已知哺乳类动物胶原蛋白变性温度和胃蛋白酶的最适温度为36~37 ℃[19],本文选择36 ℃作为酶解温度。把预处理过的干羊皮按照料液比1:25 g/mL加入蒸馏水,然后加入乙酸至1.2 mol/L(反应体系中乙酸的浓度)和1.0%的胃蛋白酶(相对于干羊皮重)溶解羊皮[20],在36 ℃条件下磁力搅拌72 h,过滤之后离心(离心机转速为3000 r/min,离心时间30 min,离心温度4 ℃),收集上清液以除去不溶性物质;将上清液装入的透析袋中,密封并放入大烧杯中,加入蒸馏水,磁力搅拌加速透析,在4 ℃下透析3 d,每隔6 h换一次蒸馏水,最后得到较为透明的乳白色溶液;把胶原蛋白溶液依次装入培养皿中,用保鲜膜包裹并扎眼透气,在冰箱中预冷冻12 h后,快速转移到冷冻干燥机中冷冻干燥(预冷冻温度为−18 ℃,冷冻干燥温度为−60 ℃),48 h后取出称重为W2,得到乳白色的海绵状羊皮胶原蛋白[21-22]。胶原蛋白的提取率R按如下公式计算:
R(%)=W2W1×100 式中:R为羊皮胶原蛋白提取率(%);W1为预处理后干羊皮质量(g);W2为冷冻干燥后提取的羊皮胶原蛋白质量(g)。
1.2.3 单因素实验设计
1.2.3.1 料液比对羊皮胶原蛋白提取率的影响
设置乙酸浓度为1.1 mol/L、胃蛋白酶浓度为1.0%、提取时间为72 h,研究不同料液比(1:10、1:15、1:20、1:25、1:30、1:35 g/mL)对羊皮胶原蛋白制备效果的影响。
1.2.3.2 乙酸浓度对羊皮胶原蛋白提取率的影响
设置料液比为1:25 g/mL、胃蛋白酶浓度为1.0%、提取时间为72 h,研究不同乙酸浓度(0.5、0.7、0.9、1.1、1.3、1.5 mol/L)对羊皮胶原蛋白制备效果的影响。
1.2.3.3 胃蛋白酶浓度对羊皮胶原蛋白提取率的影响
设置料液比为1:25 g/mL、乙酸浓度为1.1 mol/L、提取时间为72 h,研究不同胃蛋白酶浓度(0.4%、0.6%、0.8%、1.0%、1.2%、1.4%)对羊皮胶原蛋白制备效果的影响。
1.2.3.4 提取时间对羊皮胶原蛋白提取率的影响
设置料液比为1:25、乙酸浓度为1.1 mol/L、胃蛋白酶浓度为1.0%,研究不同提取时间(24、36、48、60、72、84 h)对羊皮胶原蛋白制备效果的影响。
1.2.4 正交试验设计
基于单因素实验,选择以料液比(A)、乙酸浓度(B)、胃蛋白酶浓度(C)、提取时间(D)作为正交试验因素,以羊皮胶原蛋白提取率为参考指标,设计四因素四水平正交试验进行分析,正交试验设计见表1。
表 1 正交试验因素水平设计Table 1. Factor level design of orthogonal test水平 A料液比(g/mL) B乙酸浓度(mol/L) C胃蛋白酶浓度(%) D提取时间(h) 1 1:21 0.9 0.8 60 2 1:23 1.0 0.9 66 3 1:25 1.1 1.0 72 4 1:27 1.2 1.1 78 1.2.5 胶原蛋白的检测与表征
1.2.5.1 UV检测
称取一定量的胶原蛋白,用0.5 mol/L乙酸溶液溶解,配成浓度为1 mg/mL的胶原蛋白溶液;另取同样乙酸溶液作对照。紫外分光光度计扫描测定[23],波长范围为200~330 nm。
1.2.5.2 FT-IR检测
取适量冻干胶原蛋白,KBr压片,放入红外光谱仪中检测。扫描范围400~4000 cm−1,分辨率4 cm−1,扫描速度0.2 cm/s。
1.2.5.3 SDS-PAGE检测
利用SDS-PAGE分析蛋白样品,采用5%浓缩胶和12%的分离胶体系进行电泳分离,用0.5 mol/L乙酸配置样品质量浓度为1 mg/mL胶原蛋白溶液,上样量12 μL。采用直流恒压电源进行电泳(浓缩胶电压80 V,分离胶电压120 V)。电泳分离后,用马斯亮蓝R-250染色胶体4 h,并用甲醇-乙酸脱色液脱色2~3次至背景颜色为无色,最后便可以分析分离条带的分子量[24]。
1.2.5.4 SEM检测
取冷冻干燥后的胶原蛋白样品固定于载物片上,真空喷金,置于扫描电镜观察胶原蛋白样品的表面形态结构,电压20 kV,放大200倍。
1.2.6 静电纺胶原蛋白/聚乳酸纳米纤维
静电纺丝装置主要由高压电源、注射器、不锈钢针头和接收屏组成。将一定量的羊皮胶原蛋白和聚乳酸溶于六氟异丙醇中,然后将混合溶液磁力搅拌3 h,搅拌温度为20 ℃,转速为300 r/min,得到所需纺丝溶液。将纺丝液置于微注射泵上的10 mL注射器中,电纺获得胶原基纳米纤维膜[25-26]。静电纺丝工艺参照王彦珍等[27]做的电纺试验,本试验设置为胶原与聚乳酸质量比为2:8、溶质质量分数为10%、纺丝电压为15 kV、纺丝速度为1 mL/h、纺丝距离为15 cm,纺丝针头为21 G。
1.2.7 胶原蛋白/聚乳酸纳米纤维膜的检测与表征
1.2.7.1 SEM检测
从铝箔纸上取下小块纳米纤维膜固定于载物片上,真空喷金,置于扫描电镜观察胶原蛋白样品的表面形态结构,电压20 kV,放大2000倍。然后使用Image Pro Plus 6.0直径分析软件测量纳米纤维的直径,从而得到纤维直径分布图。
1.2.7.2 机械性能检测
取长85 mm、宽15 mm的纳米纤维膜样品,用测厚计测量其厚度,测量十次,取平均值,然后利用万能材料试验机测量其力学性能[28]。
1.2.7.3 接触角检测
取长40 mm、宽20 mm的纳米纤维膜,用接触角测定仪测量其接触角,观察其疏水性[29]。
1.3 数据处理
所有试验均重复进行三次,结果表示为平均值±标准偏差的形式。采用Excel 2010、SPSS 27和Minitab 19软件对数据进行试验设计和统计分析,用Image Pro Plus 6.0软件测量直径,用Origin 2018软件进行绘图。
2. 结果与分析
2.1 单因素实验结果
2.1.1 料液比的选择
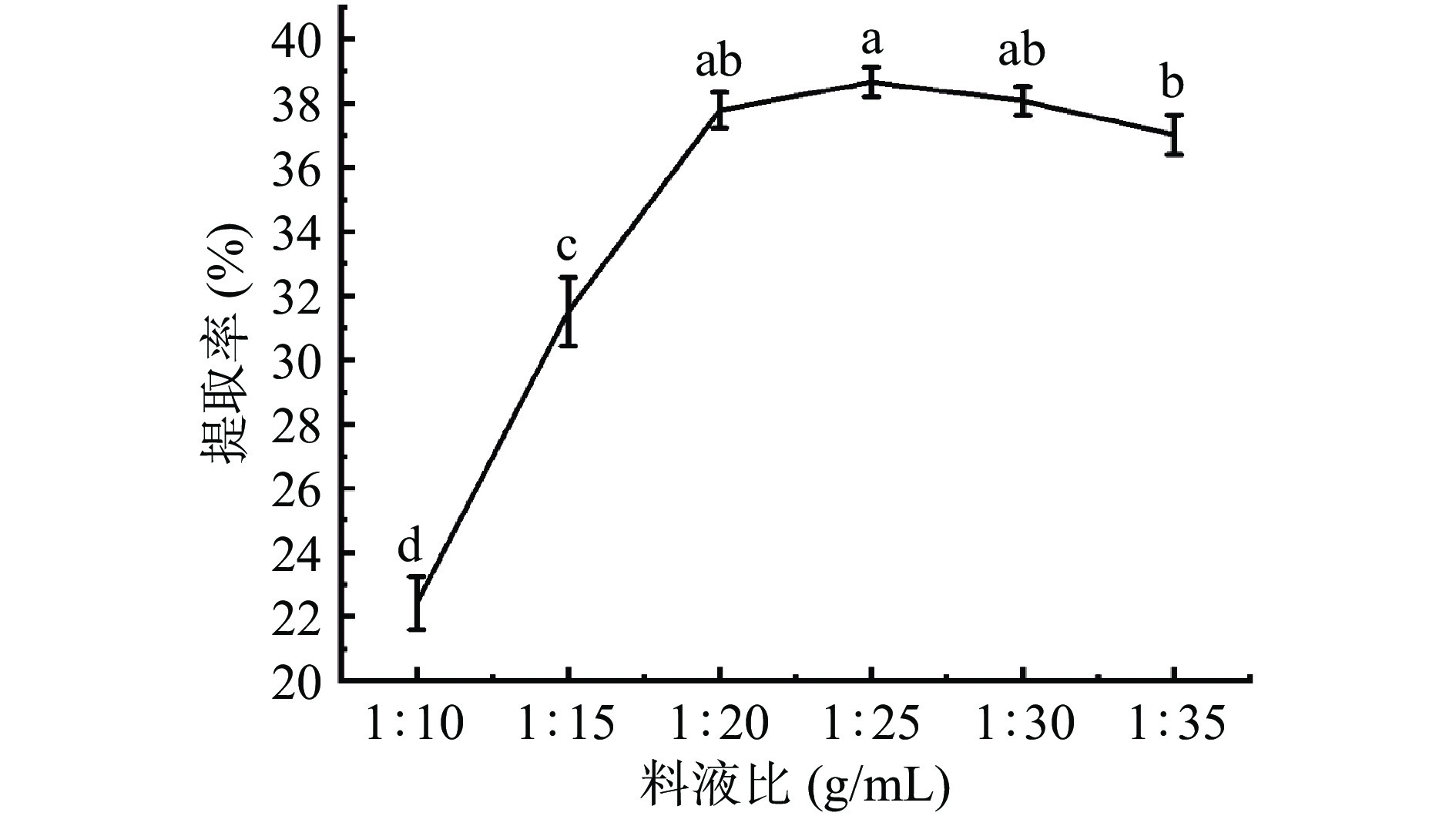
由图1结果可知,料液比从1:10至1:25 g/mL,羊皮胶原蛋白提取率呈现上升趋势。当料液比为1:25 g/mL时,胶原蛋白提取率为38.4%。料液比从1:25至1:35 g/mL,胶原蛋白提取效果反而下降。这表明当添加蒸馏水过少时,酶分子不能与底物充分接触,导致蛋白酶活性无法发挥,造成胶原蛋白提取不完全。而过多添加蒸馏水使酶分子扩散范围变大,降低蛋白酶与底物接触效率会影响胶原蛋白提取率[30]。因此综合效益与成本,料液比定为1:25 g/mL最为适宜。
2.1.2 乙酸浓度的选择
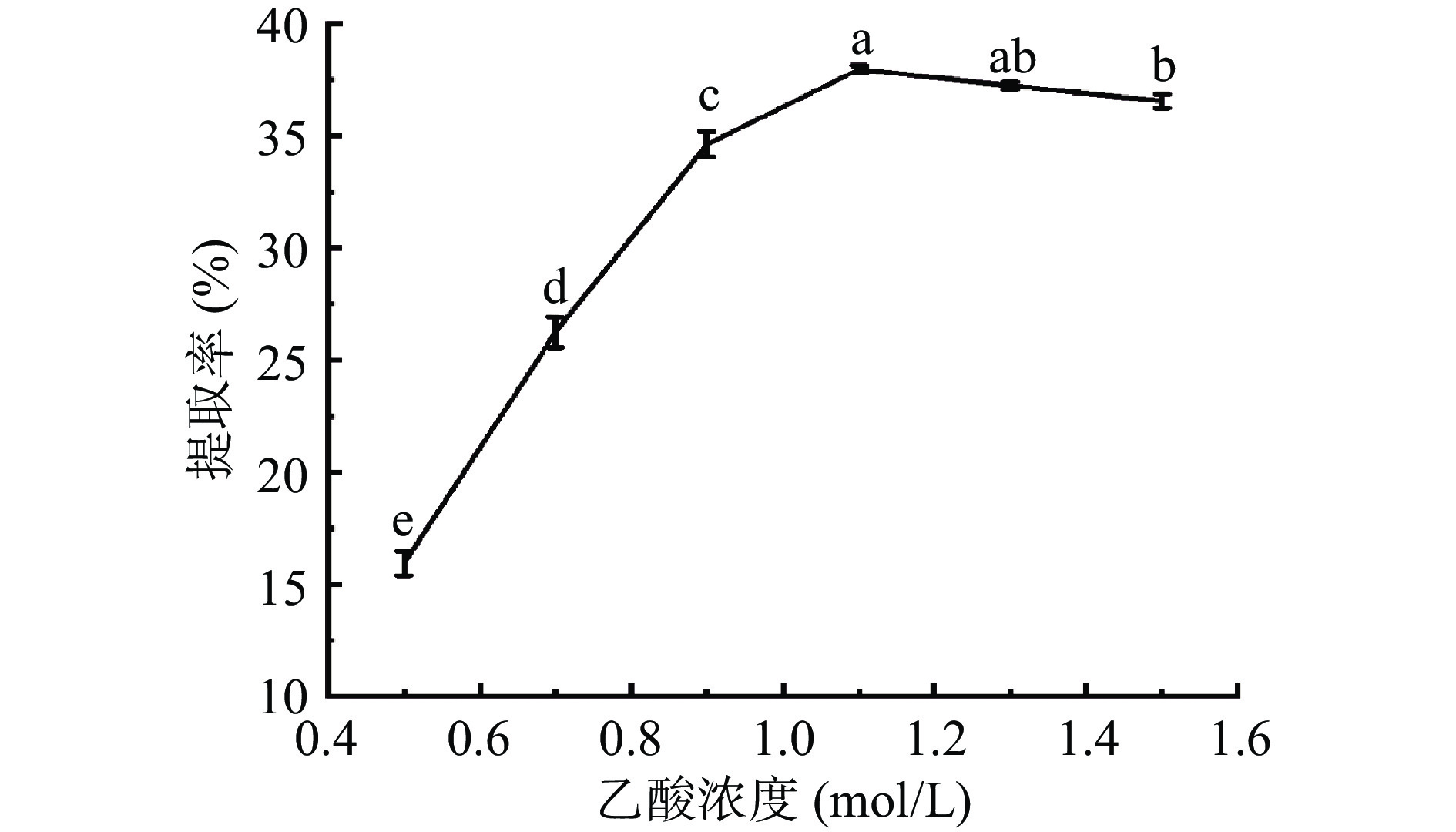
由图2结果可知,乙酸浓度从0.5至1.1 mol/L,羊皮胶原蛋白提取率呈现上升趋势。当乙酸浓度为1.1 mol/L时,胶原蛋白提取率为37.96%。乙酸浓度从1.1至1.5 mol/L,胶原蛋白提取效果反而下降。这表明当添加乙酸过少时,乙酸不能与胃蛋白酶和底物充分接触,导致蛋白酶活性无法发挥,造成胶原提取不完全。而过多添加乙酸既破坏胶原蛋白的结构,又抑制酶的活性,影响胶原蛋白提取率[31]。因此综合来看乙酸浓度定为1.1 mol/L最为适宜。
2.1.3 胃蛋白酶用量的选择
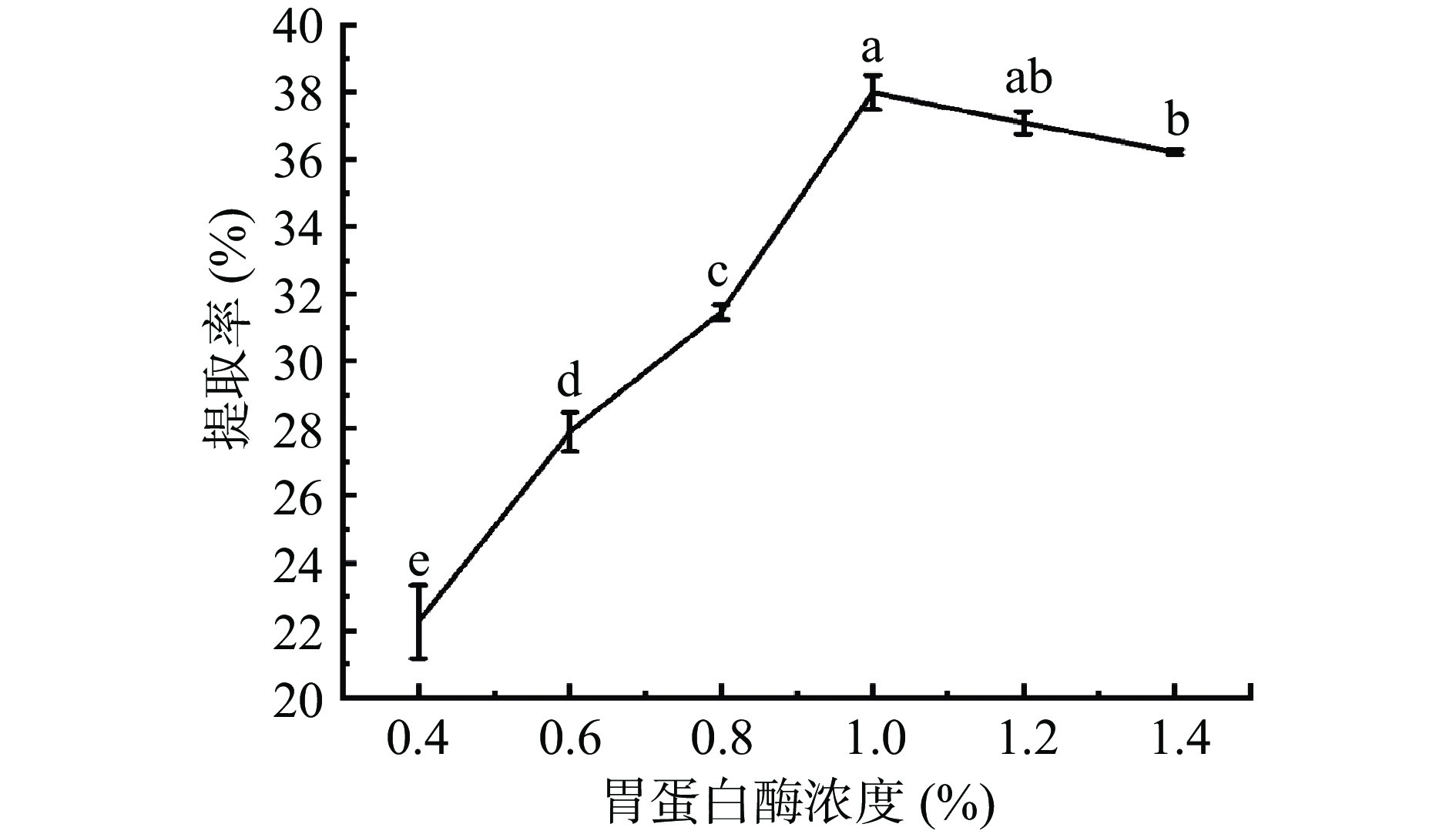
由图3结果可知,随着胃蛋白酶用量的增加,羊皮胶原蛋白提取率呈先上升后下降的趋势。当胃蛋白酶用量为1.0%时,酶分子控制底物反应,胶原蛋白提取率最高,胶原蛋白提取率为37.99%;而随着酶用量增大,酶分子之间接触面增大互相影响,降低酶分子对底物反应效率,导致胶原蛋白提取率降低。甘文梅等[32]研究酶水解提取牛骨胶原蛋白时,也得到酶用量的增加导致提取率呈先升后降。因此,胃蛋白酶用量1.0%最为适宜。
2.1.4 提取时间的选择
由图4结果可知,随着胃蛋白酶水解时间的加长,羊皮胶原蛋白提取率呈先急升后缓降的趋势。这是由于在刚开始阶段,水解时间过短,仅部分酶分子与底物反应,提取效果不佳。在酶水解时间为72 h时,胃蛋白酶与底物酶解反应充分,羊皮胶原蛋白提取率达最高值38.23%。随着提取时间继续延长,胶原蛋白的提取进入稳定期[32],长时间胶原结构会遭到破坏,生成小分子多肽,因此最佳提取时间为72 h。
2.2 正交试验结果
基于单因素实验,选择以料液比(A)、乙酸浓度(B)、胃蛋白酶浓度(C)、提取时间(D)作为正交试验因素,以羊皮胶原蛋白提取率为参考指标,设计四因素四水平正交试验进行分析,正交试验结果见表2、表3。
表 2 正交试验结果Table 2. Result of orthogonal test实验号 A B C D 提取率(%) 1 1 1 1 1 33.47 2 1 2 2 2 36.16 3 1 3 3 3 38.06 4 1 4 4 4 37.36 5 2 1 2 3 35.91 6 2 2 1 4 35.52 7 2 3 4 1 35.48 8 2 4 3 2 38.02 9 3 1 3 4 37.63 10 3 2 4 3 37.46 11 3 3 1 2 36.42 12 3 4 2 1 35.46 13 4 1 4 2 37.14 14 4 2 3 1 36.74 15 4 3 2 4 36.53 16 4 4 1 3 36.42 K1 145.05 144.15 141.83 141.15 K2 144.93 145.88 144.06 147.74 K3 146.97 146.49 150.45 147.85 K4 146.83 147.26 147.44 147.04 k1 36.26 36.04 35.46 35.29 k2 36.23 36.47 36.02 36.94 k3 36.74 36.62 37.61 36.96 k4 36.71 36.82 36.86 36.76 R 0.51 0.78 2.15 1.67 最优方案 A3 B4 C3 D3 表 3 正交试验方差分析Table 3. Analysis of variance for orthogonal tests来源 自由度 Adj SS Adj MS F值 P值 A 3 0.8835 0.29451 4.94 0.111 B 3 1.399 0.46632 7.83 0.063 C 3 10.6024 3.53412 59.31 0.004 D 3 7.712 2.57067 43.14 0.006 误差 3 0.1788 0.05959 合计 15 20.7756 如表2、表3结果所示,在使用酸酶复合法提取羊皮胶原蛋白的过程中,四个变量因素对羊皮胶原蛋白提取率的影响程度依次为:胃蛋白酶浓度(C)>提取时间(D)>乙酸浓度(B)>料液比(A),其中胃蛋白酶浓度和提取时间对羊皮胶原蛋白提取率影响显著(P<0.05)。得到酸酶复合法提取羊皮胶原蛋白的最佳工艺条件为A3B4C3D3,即料液比1:25 g/mL、乙酸浓度1.2 mol/L、胃蛋白酶浓度1.0%、提取时间72 h,与单因素实验结果相近。然后在最优水平条件下进行三次平行试验,得到的羊皮胶原蛋白提取率为38.42%±0.49%。
2.3 羊皮胶原蛋白的测试与分析
2.3.1 UV测试分析
图5为胶原蛋白紫外吸收光谱图,由图可知最大吸收峰在238 nm附近。胶原蛋白大分子链结构中含有−C=O,−COOH,−NH2等显色基团,这些基团的n→π*跃迁在230 nm处形成吸收峰[23,33]。观察280 nm附近,三者并没有明显的吸收峰,说明芳香族氨基酸的含量较少,提取的胶原蛋白纯度高。总的来说,在238 nm附近有一个最大吸收峰,符合胶原蛋白的特性。
2.3.2 FT-IR测试分析
图6为胶原蛋白傅里叶变换红外谱图。在3300.01 cm−1处,胶原蛋白中存在一个特征吸收峰,为酰胺A带,这是因为氨基中的N-H伸缩振动和羧基中的O-H伸缩振动,是胶原蛋白的特征峰[34];在2924.18 cm−1处,胶原蛋白中存在一个特征吸收峰,为酰胺B带,这是因为C-H伸缩振动;在1638.11 cm−1处,胶原中存在一个特征吸收峰,为酰胺Ⅰ带,这是因为C=O的伸缩振动[35],与胶原蛋白的二级结构有关,由此表明胶原蛋白的结构没有被破坏;在1543.63 cm−1处,胶原蛋白中有一个特征吸收峰,为酰胺Ⅱ带,这是由于胶原蛋白结构中的N-H弯曲振动和C-H弯曲振动;在1237.99 cm−1处,胶原蛋白中有一个特征吸收峰,为酰胺Ⅲ带,这是因为C-N伸缩振动[36],在1451.90~1237.99 cm−1附近的吸收峰表明提取胶原的三螺旋结构是完整的。总的来说,红外谱图证明了本试验提取的胶原蛋白为I型胶原蛋白。
2.3.3 SDS-PAGE测试分析
图7是用酸酶复合法提取的羊皮胶原蛋白SDS-PAGE谱图,进行三组重复试验。由图7可知,所提取的胶原蛋白具有α、β链,其中在分子质量为110 kDa附近有两条链,分别是α1和α2链[24];在分子质量为200 kDa附近,存在一条比较宽的β链,是两条α链的二聚体;图中α2链以下没有明显的电泳带,说明提取的胶原蛋白几乎没有降解为小分子多肽。结合紫外和红外分析表明,利用该工艺提取的胶原蛋白结构完整,所得到的胶原蛋白符合Ⅰ型胶原蛋白的特征。
2.3.4 SEM测试分析
冻干的羊皮胶原蛋白外貌呈乳白色,类似絮状海绵,触感细腻柔软,富有弹性。图8为提取的胶原蛋白微观结构图,从图8中可以看出羊皮胶原蛋白表面具有明显的纤维网状结构,层次分明,具有孔隙,同时网状纤维间距均匀,说明胶原蛋白是由网状结构的胶原纤维组成,结构稳定,分布均匀。
2.4 胶原蛋白/聚乳酸纳米纤维的测试与分析
2.4.1 SEM测试分析
使用Image Pro Plus 6.0直径分析软件,随机选取100根单纤维测量其直径[37],然后绘制胶原蛋白纳米纤维直径分布图,如图9所示。纤维直径大多分布在300~500 nm之间,直径分布较均匀,计算得到纤维平均直径为418.02±183.77 nm。已知动物细胞的平均直径为3000 nm,胶原基纳米纤维直径比细胞小数倍,具有作为细胞支架的潜力。目前利用胶原蛋白与其他材料混合进行静电纺丝获得的胶原膜纤维直径大小不一,吴国良等[38]在胶原蛋白中加入聚已内酯进行静电纺丝,制备成纳米纤维膜的纤维平均直径为750±390 nm;王佳冕[39]将林蛙皮胶原蛋白和聚乳酸复合,静电纺得到的纤维膜平均直径为593±98 nm;肖世维等[40]将不同浓度的胶原蛋白和聚乙烯醇共混,制备纺丝溶液,得到的纤维直径约为300 nm;本试验得到的胶原基纳米纤维直径分布较为均匀,纤维直径也较小。
2.4.2 机械性能测试分析
测量纳米纤维膜的拉伸强度和断裂伸长率,试验得出,在一定范围内,膜的拉伸强度和断裂伸长率随着膜厚度的增加而增加。如表4所示,当膜的厚度为0.121±0.008 mm时,其拉伸强度和断裂伸长率分别为3.616±0.386 MPa和8.69%±1.95%。陈腊梅等[41]利用胶原蛋白和聚己内酯,静电纺丝得到复合纳米纤维膜,纤维膜拉伸强度为1.27±0.18 MPa;陈卫英等[42]测量厚度为0.11 mm的胶原基纳米纤维膜的拉伸强度为6.19±0.82 MPa;本试验得到的胶原基纳米纤维膜相较于上述两种力学性能良好,分析其原因主要是因为胶原纤维直径分布均匀,层次分明,交错排列形成网状结构[43]。
表 4 力学性能结果分析Table 4. Analysis of mechanical property results厚度(mm) 拉伸强度(MPa) 断裂伸长率(%) 0.121±0.008 3.616±0.386 8.69±1.95 2.4.3 接触角测试分析
接触角大于90°,材料疏水;接触角小于90°,材料亲水。已知聚乳酸疏水[44],而胶原蛋白亲水,通过水滴接触角测试仪器在复合纳米纤维膜的表面滴加一滴水滴,两秒之后纪录其形态和接触角。如图10所示,接触角平均值为119.68°±1.63°,表明胶原蛋白复合聚乳酸纳米纤维膜是疏水的,但由于胶原蛋白和纳米孔隙的双重作用,随着时间推移纤维膜开始吸水,后期水滴会被完全吸收,表明纤维膜能够模拟细胞外基质[43],可以作为细胞依附增殖的支架材料。
3. 结论
以羊皮边角料为原料,采用酸酶复合法提取羊皮胶原蛋白。通过单因素实验和正交试验优化羊皮胶原蛋白提取工艺,得到最佳提取工艺条件:料液比为1:25 g/mL、乙酸浓度为1.2 mol/L、胃蛋白酶浓度为1.0%、提取时间为72 h,得到的羊皮胶原蛋白提取率为38.42%±0.49%。经过紫外谱图、红外谱图、SDS-PAGE、SEM表征分析表明提取的胶原蛋白为Ⅰ型胶原蛋白,结构较为完整。总的来说实现了羊皮和羊皮胶原蛋白的重复利用,提取工艺和提取率较好。
将制备的羊皮胶原蛋白和聚乳酸溶于六氟异丙醇溶剂中制备纺丝液,静电纺丝得到纳米纤维膜的平均纤维直径为418.02±183.77 nm,而且具有良好的力学性能,纳米纤维膜虽然前期表现疏水性但后期变得亲水,有作为生物医用材料和细胞支架的潜力。静电纺胶原蛋白复合聚乳酸纳米纤维结合了两者的优点,亦具有纳米纤维的优良特性,研究为进一步的细胞学试验提供了试验材料,也将为胶原蛋白基纳米医用纤维产品开发提供支撑。但是胶原基纳米纤维大多处于实验室阶段,本文也缺乏抗菌试验与细胞毒性试验,后期需要继续深入研究。
-
表 1 正交试验因素水平设计
Table 1 Factor level design of orthogonal test
水平 A料液比(g/mL) B乙酸浓度(mol/L) C胃蛋白酶浓度(%) D提取时间(h) 1 1:21 0.9 0.8 60 2 1:23 1.0 0.9 66 3 1:25 1.1 1.0 72 4 1:27 1.2 1.1 78 表 2 正交试验结果
Table 2 Result of orthogonal test
实验号 A B C D 提取率(%) 1 1 1 1 1 33.47 2 1 2 2 2 36.16 3 1 3 3 3 38.06 4 1 4 4 4 37.36 5 2 1 2 3 35.91 6 2 2 1 4 35.52 7 2 3 4 1 35.48 8 2 4 3 2 38.02 9 3 1 3 4 37.63 10 3 2 4 3 37.46 11 3 3 1 2 36.42 12 3 4 2 1 35.46 13 4 1 4 2 37.14 14 4 2 3 1 36.74 15 4 3 2 4 36.53 16 4 4 1 3 36.42 K1 145.05 144.15 141.83 141.15 K2 144.93 145.88 144.06 147.74 K3 146.97 146.49 150.45 147.85 K4 146.83 147.26 147.44 147.04 k1 36.26 36.04 35.46 35.29 k2 36.23 36.47 36.02 36.94 k3 36.74 36.62 37.61 36.96 k4 36.71 36.82 36.86 36.76 R 0.51 0.78 2.15 1.67 最优方案 A3 B4 C3 D3 表 3 正交试验方差分析
Table 3 Analysis of variance for orthogonal tests
来源 自由度 Adj SS Adj MS F值 P值 A 3 0.8835 0.29451 4.94 0.111 B 3 1.399 0.46632 7.83 0.063 C 3 10.6024 3.53412 59.31 0.004 D 3 7.712 2.57067 43.14 0.006 误差 3 0.1788 0.05959 合计 15 20.7756 表 4 力学性能结果分析
Table 4 Analysis of mechanical property results
厚度(mm) 拉伸强度(MPa) 断裂伸长率(%) 0.121±0.008 3.616±0.386 8.69±1.95 -
[1] 周丹, 沈艳琴, 武海良, 等. 胶原蛋白的应用研究现状[J]. 合成纤维,2022,51(8):5−8. [ZHOU D, SHEN Y Q, WU H L, et al. Application and research status of collagen[J]. Synthetic Fibers,2022,51(8):5−8. ZHOU D, SHEN Y Q, WU H L, et al. Application and research status of collagen[J]. Synthetic Fibers, 2022, 51(8): 5-8.
[2] ZHANG M, ZHAO D, ZHU S R, et al. Overheating induced structural changes of type I collagen and impaired the protein digestibility[J]. Food Research International,2020,134(6):1−9.
[3] 郑少东, 崔国廉, 胡杨, 等. 动物皮在创伤修复及止血材料中的应用[J]. 中国皮革,2014,43(1):42−45. [ZHENG S D, CUI G L, HU Y, et al. Application of animal skin in wound repair and hemostatic materials[J]. China Leather,2014,43(1):42−45. ZHENG S D, CUI G L, HU Y, et al. Application of animal skin in wound repair and hemostatic materials[J]. China Leather, 2014, 43(1): 42-45.
[4] 金月华, 曹佳雷, 孙霞, 等. 我国皮革服装行业的质量状况及改进策略[J]. 北京皮革,2020(6):16−20. [JIN Y H, CAO J L, SUN X, et al. Quality status and improvement strategy of leather garment industry in China[J]. Beijing Leather,2020(6):16−20. JIN Y H, CAO J L, SUN X, et al. Quality status and improvement strategy of leather garment industry in China[J]. Beijing Leather, 2020(6): 16-20.
[5] 任蕙铭, 李明娟. 黑龙江省畜牧产品营销现状及创新方式的思考[J]. 黑龙江畜牧兽医,2020,602(14):29−31. [REN H M, LI M J. Thinking on the marketing status and innovation methods of animal husbandry products in Heilongjiang Province[J]. Heilongjiang Animal Husbandry and Veterinary Medicine,2020,602(14):29−31. REN H M, LI M J. Thinking on the marketing status and innovation methods of animal husbandry products in Heilongjiang Province[J]. Heilongjiang Animal Husbandry and Veterinary Medicine, 2020, 602(14): 29-31.
[6] 高金龙. 山羊皮中胶原蛋白的提取及理化特性研究[D]. 呼和浩特: 内蒙古农业大学, 2010. GAO J L. Extraction and physicochemical properties of collagen in goat skin[D]. Hohhot: Inner Mongolia Agricultural University, 2010.
[7] SAFIYA N, CASPARUS J R, MARK C L, et al. Collagen extraction from various waste bovine hide sources[J]. Waste and Biomass Valorization,2020,11(11):5687−5698. doi: 10.1007/s12649-019-00843-2
[8] JAFARI H, LISTA A, SIEKAPEN M M, et al. Fish collagen: Extraction, characterization, and applications for biomaterials engineering[J]. Polymers,2020,12(10):2230−3340. doi: 10.3390/polym12102230
[9] JIA A B, LI M, KANG L Z, et al. Fabrication and comprehensive characterization of biomimetic extracellular matrix electrospun scaffold for vascular tissue engineering applications[J]. Journal of Materials Science,2019,54(15):10871−10883. doi: 10.1007/s10853-019-03667-6
[10] BEHESHTKHOO N, KOUHBANANI M, DEHGHANI F, et al. Fabrication and properties of collagen and polyurethane polymeric nanofibers using electrospinning technique for tissue engineering applications[J]. Journal of Environmental Treatment Techniques,2019,7(4):802−807.
[11] KIM D, LEE M, YANG J, et al. Dual skin-whitening and anti-wrinkle function of low-molecular-weight fish collagen[J]. Journal of Medicinal Food,2022,25(2):192−204. doi: 10.1089/jmf.2021.K.0124
[12] CHATTERJEE N, SUKUMARAN H, DARA P, et al. Nano-encapsulation of curcumin in fish collagen grafted succinyl chitosan hydrogel accelerates wound healing process in experimental rats[J]. Food Hydrocolloids for Health,2022,52(2):1−8.
[13] MALLICK M, ARE R, BABU A. An overview of collagen/bioceramic and synthetic collagen for bone tissue engineering[J]. Materialia,2022,131(1):391−492.
[14] 黄艳萍, 但年华, 但卫华. 静电纺丝制备胶原基复合纳米医用纤维的研究进展[J]. 材料导报,2019,33(19):3322−3327. [HUANG Y P, DAN N H, DAN W H. Research progress on preparation of collagen-based composite nanomedical fibers by electrospinning[J]. Materials Reports,2019,33(19):3322−3327. HUANG Y P, DAN N H, DAN W H. Research progress on preparation of collagen-based composite nanomedical fibers by electrospinning [J]. Materials Reports, 2019, 33(19): 3322-3327.
[15] SHEIK H, FARNA Z, HORRAM K, et al. Preparation, characterization, and surface modification of polycaprolactone-based nanofibrous scaffold by grafting with collagen for skin tissue engineering[J]. Regenerative Engineering and Translational Medicine,2022,8(4):545−562. doi: 10.1007/s40883-022-00254-1
[16] WANG F, ZHOU M, JIA Q. Evaluation of dynamic mechanical and cytotoxic properties of electrospun poly (lactic acid)/cellulose nanocrystalline composite membranes[J]. Journal of Physics: Conference Series,2021,1759(1):31−41.
[17] 张鹏. 聚乳酸电纺纳米纤维结构性能研究与应用拓展[D]. 南昌: 东华理工大学, 2015. ZHANG P. Research and application development of structural properties of polylactic acid electrospun nanofiber[D]. Nanchang: East China University of Technology, 2015.
[18] 林琳, 牛一帆, 史振霞, 等. 猪皮中胶原蛋白的提取[J]. 廊坊师范学院学报(自然科学版),2020,20(1):58−61. [LIN L, NIU Y F, SHI Z X, et al. Extraction of collagen from pig skin[J]. Journal of Langfang Normal University (Natural Science Edition),2020,20(1):58−61. LIN L, NIU Y F, SHI Z X, et al. Extraction of collagen from pig skin[J]. Journal of Langfang Normal University (Natural Science Edition), 2020, 20(1): 58-61.
[19] 周瑞, 陈舜胜. 鱼皮胶原蛋白提取方法研究及其在食品中的应用[J]. 上海农业学报,2021,37(1):129−135. [ZHOU R, CHEN S S. Research on extraction method of fish skin collagen and its application in food[J]. Shanghai Journal of Agricultural Sciences,2021,37(1):129−135. ZHOU R, CHEN S S. Research on extraction method of fish skin collagen and its application in food[J]. Shanghai Journal of Agricultural Sciences, 2021, 37(1): 129-135.
[20] 王杉杉. 牦牛皮胶原蛋白的提取及其活性肽的制备[D]. 绵阳: 西南科技大学, 2018. WANG S S. Extraction of yak hide collagen and preparation of its active peptides[D]. Mianyang: Southwest University of Science and Technology, 2018.
[21] 王彦珍, 宋秘钊, 王娟, 等. 聚乙烯醇羊皮水解物复合纳米纤维制备与表征[J]. 棉纺织技术,2021,49(9):11−14. [WANG Y Z, SONG M Z, WANG J, et al. Preparation and characterization of polyvinyl alcohol sheepskin hydrolysate composite nanofibers[J]. Cotton Textile Technology,2021,49(9):11−14. WANG Y Z, SONG M Z, WANG J, et al. Preparation and characterization of polyvinyl alcohol sheepskin hydrolysate composite nanofibers[J]. Cotton Textile Technology, 2021, 49(9): 11-14.
[22] 黄可承, 宫萱, 唐嘉诚, 等. 水产品副产物胶原蛋白制备方法及应用[J]. 精细化工,2022,39(9):1757−1766. [HUANG K C, GONG X, TANG J C, et al. Preparation method and application of aquatic product by-product collagen[J]. Fine Chemicals,2022,39(9):1757−1766. HUANG K C, GONG X, TANG J C, et al. Preparation method and application of aquatic product by-product collagen[J]. Fine Chemicals, 2022, 39(9): 1757-1766.
[23] 张晓亮. 兔皮胶原蛋白的提取及抗菌敷料的制备[D]. 天津: 天津工业大学, 2020. ZHANG X L. Extraction of rabbit skin collagen and preparation of antibacterial dressing[D]. Tianjin: Tianjin Polytechnic University, 2020.
[24] 任戈一, 马雪莲, 潘丽, 等. 不同提取工艺下牛骨胶原蛋白的结构特性[J]. 食品工业科技,2022,43(14):27−33. [REN G Y, MA X L, PAN L, et al. Structural characteristics of bovine bone collagen under different extraction processes[J]. Science and Technology of Food Industry,2022,43(14):27−33. REN G Y, MA X L, PAN L, et al. Structural characteristics of bovine bone collagen under different extraction processes[J]. Science and Technology of Food Industry, 2022, 43(14): 27-33.
[25] MONTALBANO G, TOMASINA C, FIORILLI S, et al. Biomimetic scaffolds obtained by electrospinning of collagen-based materials: Strategies to hinder the protein denaturation[J]. Materials,2021,14(16):4360−4370. doi: 10.3390/ma14164360
[26] IFFA A F, PRIHARTINI W, Muhammad A, et al. Poly-L-lactic acid (PLLA)-chitosan-collagen electrospun tube for vascular graft application[J]. Journal of Functional Biomaterials,2018,9(2):32−34. doi: 10.3390/jfb9020032
[27] 王彦珍, 宋秘钊, 王娟, 等. 羊皮水解蛋白/聚乙烯醇纳米纤维静电纺丝影响因素[J]. 毛纺科技,2021,49(10):6−10. [WANG Y Z, SONG M Z, WANG J, et al. Influencing factors of electrospinning of parchment hydrolyzed protein/polyvinyl alcohol nanofibers[J]. Wool Spinning Science and Technology,2021,49(10):6−10. WANG Y Z, SONG M Z, WANG J, et al. Influencing factors of electrospinning of parchment hydrolyzed protein/polyvinyl alcohol nanofibers[J]. Wool Spinning Science and Technology, 2021, 49(10): 6-10.
[28] 李萍, 张慧君, 郭浩, 等. 糖基化改性玉米醇溶蛋白膜的性能及硬胶囊体外释放分析[J]. 农业工程学报,2021,37(14):302−309. [LI P, ZHANG H J, GUO H, et al. Performance of glycosylated modified zein membrane and in vitro release analysis of hard capsules[J]. Transactions of the Chinese Society of Agricultural Engineering,2021,37(14):302−309. LI P, ZHANG H J, GUO H, et al. Performance of glycosylated modified zein membrane and in vitro release analysis of hard capsules[J]. Transactions of the Chinese Society of Agricultural Engineering, 2021, 37(14): 302-309.
[29] 陈曼, 何明, 郭妍婷, 等. 静电纺丝蛋白纳米纤维膜的改性研究进展[J]. 化工新型材料,2017,45(7):21−23. [CHEN M, HE M, GUO Y T, et al. Research progress on modification of electrospinning protein nanofiber membranes[J]. New Chemical Materials,2017,45(7):21−23. CHEN M, HE M, GUO Y T, et al. Research progress on modification of electrospinning protein nanofiber membranes[J]. New Chemical Materials, 2017, 45(7): 21-23.
[30] 单钱艺, 沈岳明, 张明兴, 等. 正交试验优化超声波-复合酶水解法提取中华鳖油的工艺[J]. 食品工业科技,2022,43(22):256−264. [SHAN Q Y, SHEN Y M, ZHANG M X, et al. Orthogonal test to optimize the process of extracting Chinese turtle oil by ultrasonic-complex enzymatic hydrolysis[J]. Science and Technology of Food Industry,2022,43(22):256−264. SHAN Q Y, SHEN Y M, ZHANG M X, et al. Orthogonal test to optimize the process of extracting Chinese turtle oil by ultrasonic-complex enzymatic hydrolysis[J]. Science and Technology of Food Industry, 2022, 43(22): 256-264.
[31] 杨璇. 基于超声酸酶法和模拟肠消化制备鱼皮胶原蛋白肽及肽钙螯合物研究[D]. 镇江: 江苏大学, 2020. YANG X. Preparation of fish skin collagen peptide and peptide calcium chelate based on ultrasonic acid enzyme method and simulated intestinal digestion[D]. Zhenjiang: Jiangsu University, 2020.
[32] 甘文梅, 张炜, 田格, 等. 响应面法优化牦牛骨胶原蛋白的提取工艺研究[J]. 化学研究与应用,2020,32(9):1535−1540. [GAN W M, ZHANG W, TIAN G, et al. Study on optimization of yak bone collagen extraction process by response surface method[J]. Chemical Research and Application,2020,32(9):1535−1540. GAN W M, ZHANG W, TIAN G, et al. Study on optimization of yak bone collagen extraction process by response surface method[J]. Chemical Research and Application, 2020, 32(9): 1535-1540.
[33] JOSUE J V, EDUARDO S M. Collagen and elastin scaffold by electrospinning for skin tissue engineering applications[J]. Journal of Materials Research,2019,34(16):2819−2827. doi: 10.1557/jmr.2019.233
[34] 程国清. 静电纺载药胶原蛋白纳米纤维膜的制备及性能研究[D]. 天津: 天津工业大学, 2017. CHENG G Q. Study on the preparation and properties of electrospun-loaded collagen nanofiber membranes[D]. Tianjin: Tianjin Polytechnic University, 2017.
[35] BAKIR G, GIROUARD B E, WIENS R, et al. Orientation matters: polarization dependent IR spectroscopy of collagen from intact tendon down to the single fibril level[J]. Molecules,2020,25(18):4285−4295. doi: 10.3390/molecules25184285
[36] LUO X S, GUO Z Z, HE P, et al. Study on structure, mechanical property and cell cytocompatibility of electrospun collagen nanofibers crosslinked by common agents[J]. International Journal of Biological Macromolecules,2018,113:476−486. doi: 10.1016/j.ijbiomac.2018.01.179
[37] RANI C, SAFIRA A, SURYADININGRAT M, et al. Characterization of tilapia collagen-loaded chitosan nanofibers synthesized by electrospinning method for wound dressing[J]. IOP Conference Series:Earth and Environmental Science,2022,1036(1):1−12.
[38] 吴国良, 任天斌, 曹春红, 等. 静电纺丝法制备PLCL/明胶与PLCL/胶原引导骨组织再生膜及其结构、性能与细胞学[J]. 材料导报,2010,24(S1):385−388. [WU G L, REN T B, CAO C H, et al. Preparation of PLCL/gelatin and PLCL/collagen-guided bone tissue regeneration membranes by electrospinning method, as well as their structure, properties and cytology[J]. Materials Reports,2010,24(S1):385−388. WU G L, REN T B, CAO C H, et al. Preparation of PLCL/gelatin and PLCL/collagen-guided bone tissue regeneration membranes by electrospinning method, as well as their structure, properties and cytology[J]. Materials Reports, 2010, 24(S1): 385-388.
[39] 王佳冕. 静电纺林蛙皮胶原蛋白/PLLA纳米纤维膜及性能研究[D]. 长春: 吉林大学, 2015. WANG J M. Study on collagen/PLLA nanofiber membrane and its properties in electrospun forest frog skin[D]. Changchun: Jilin University, 2015.
[40] 肖世维, 但年华, 马文杰, 等. 胶原-聚乙烯醇共混纤维的电纺工艺条件探索[J]. 材料导报,2015,29(6):49−53,75. [XIAO S W, DAN N H, MA W J, et al. Exploration of electrospinning process conditions of collagen-polyvinyl alcohol blended fibers[J]. Materials Reports,2015,29(6):49−53,75. XIAO S W, DAN N H, MA W J, et al. Exploration of electrospinning process conditions of collagen-polyvinyl alcohol blended fibers[J]. Materials Reports, 2015, 29(6): 49-53, 75.
[41] 陈腊梅, 曹婕, 叶霖, 等. 同轴静电纺丝法制备具有核-壳纤维结构的多功能敷料[J]. 高等学校化学学报,2016,37(3):600−606. [CHEN L M, CAO J, YE LL, et al. Preparation of multifunctional dressings with core-shell fiber structure by coaxial electrospinning[J]. Chemical Journal of Chinese Universities,2016,37(3):600−606. CHEN L M, CAO J, YE LL, et al. Preparation of multifunctional dressings with core-shell fiber structure by coaxial electrospinning [J]. Chemical Journal of Chinese Universities, 2016, 37(3): 600-606.
[42] 陈卫英, 陈真勇, 杨在君, 等. 胶原-乙酸混合溶液静电纺丝可纺性及电纺胶原膜力学特性评估[J]. 材料导报,2021,35(S2):516−519. [CHEN W Y, CHEN Z Y, YANG Z J, et al. Evaluation of electrospinning spinnability and mechanical properties of electrospun collagen film of collagen-acetic acid mixed solution[J]. Materials Reports,2021,35(S2):516−519. CHEN W Y, CHEN Z Y, YANG Z J, et al. Evaluation of electrospinning spinnability and mechanical properties of electrospun collagen film of collagen-acetic acid mixed solution[J]. Materials Reports, 2021, 35(S2): 516-519.
[43] 雒永超. 胶原基纳米复合功能材料的制备及生物学评价研究[D]. 天津: 河北工业大学, 2018. LUO Y C. Preparation and biological evaluation of collagen-based nanocomposite functional materials[D]. Tianjin: Hebei University of Technology, 2018.
[44] 莫志超. 聚乳酸血管支架的载药及其生物相容性评价[D]. 青岛: 青岛科技大学, 2016. MO Z C. Drug loading and biocompatibility evaluation of polylactic acid vascular stents[D]. Qingdao: Qingdao University of Science and Technology, 2016.





 下载:
下载:







 下载:
下载:
