Physicochemical Characterization and in Vivo Hypolipidemic Effect of Chitosan-Coated Nuciferine Liposomes
-
摘要: 目的:制备壳聚糖包覆荷叶碱脂质体(chitosan-coated nuciferine liposomes,CS-LP)并研究其体内降脂作用。方法:用薄膜分散法和pH梯度法制备壳聚糖包覆荷叶碱脂质体,对其粒径、电位分布、包封率、微观形态和体外释放曲线进行测定,并探究其对肥胖小鼠的降脂作用。结果:制得的CS-LP为均匀球体结构,粒径大小为253.54±4.25 nm,Zeta电位为32.50±3.44 mV,包封率达83.46%。相比荷叶碱脂质体(nuciferine liposomes,LP),外加壳聚糖涂层可以提高其在模拟消化液中的稳定性。与高脂饮食组相比,CS-LP灌胃11周后,小鼠体重和脂肪组织重量分别显著降低了12.91%和41.03%(P<0.05),血清甘油三酯和低密度脂蛋白胆固醇质量浓度分别显著降低了32.40%和14.49%(P<0.05),血脂水平趋向正常,脂肪细胞体积减小。高通量测序显示,CS-LP显著提高了小鼠肠道菌群的多样性(P<0.05)。在门水平上,小鼠肠道菌群厚壁菌门相对丰度下降,杆菌门相对丰度显著上升,弯曲杆菌门和厚壁菌门的比值与拟杆菌门相对丰度显著降低(P<0.05)。结论:壳聚糖包覆荷叶碱脂质体包封率高,缓释性好,可以有效改善高脂饮食导致的小鼠肥胖和肠道菌群紊乱,在降脂配方食品开发中具有广阔的应用前景。Abstract: Objective: Chitosan-coated nuciferine liposomes (CS-LP) were prepared and their hypolipidemic effects in vivo were investigated. Methods: The CS-LP were prepared by thin film dispersion and pH gradient methods, and their particle size and potential distribution, encapsulation rate, microscopic morphology and in vitro release curves were determined, and their hypolipidemic effects on obese mice were investigated. Results: The CS-LP was produced in a homogeneous spherical structure with a particle size of 253.54±4.25 nm, a zeta potential of 32.50±3.44 mV. The encapsulation rate of CS-LP was 83.46%. Compared with nuciferine liposomes (LP), the stability of CS-LP in the simulated digestive solution was improved after adding the chitosan. Compared with the high-fat group, mice gavaged with CS-LP for 11 weeks showed a 12.91% and 41.03% significant reduction in body weight and adipose tissue weight, respectively (P<0.05), a 32.40% and 14.49% significant reduction in serum triglyceride and LDL cholesterol mass concentrations, respectively (P<0.05), and a normalization of lipid levels and a reduction in adipocyte volume. High-throughput sequencing analysis showed that CS-LP significantly increased the diversity of intestinal flora in mice (P<0.05). At the phylum level, the relative abundance of the thick-walled phylum and the relative abundance of the bacillus phylum increased significantly, and the ratio of the campylobacter and thick-walled phylum to the relative abundance of the mimic phylum also significantly decreased (P<0.05). Conclusion: The chitosan-coated nuciferine liposomes with high encapsulation rate and slow release could effectively improve obesity and intestinal flora disorders in mice caused by high-fat diet, and express the broad application prospects in the development of lipid-lowering formulations.
-
Keywords:
- nuciferine /
- liposomes /
- lipid lowering effect /
- lipid metabolism /
- intestinal flora
-
客座主编寄语:天然资源中的生物活性物质如多酚、黄酮、类胡萝卜素、维生素、植物甾醇和功能油脂等具有溶解性差、易聚集沉淀、易氧化分解的特点;易受加工条件或人体胃肠pH条件的影响而失活,生物利用度低。以多糖、蛋白质和脂质等为材料制备的脂质体、大分子胶束、纳米脂质颗粒、纤维素纳米晶以及淀粉纳米材料等,具有比表面积大、表面活性高、荷载能力强等特点,在减少食品添加剂和乳化剂的用量,改善食品颜色和质地、提升食品口感、增加营养素的生物利用度等方面具有显著优势。
荷叶是一种有价值的中草药,其活性成分主要为生物碱和黄酮类化合物,荷叶碱(nuciferine,NUC)是荷叶中提取的阿朴啡型生物碱,易溶于酸性溶液,不易溶于中性和碱性溶液[1]。荷叶碱具有降脂、抗炎、抗肿瘤和抗心血管疾病等多种生物活性[2-5]。研究发现,荷叶碱可以通过激活AMPK通路改善胰岛素抵抗脂肪细胞中的葡萄糖和脂质代谢[6],改善肝脂肪变形并减少脂肪细胞的大小[7]。荷叶碱对肠道菌群有显著地调节作用,荷叶碱可以促进肥胖小鼠肠道益生菌双歧杆菌等的生长,抑制致病菌脱硫弧菌属等的繁殖[8]。但荷叶碱在生物体内半衰期短、消化速率快、生物利用率低,限制了其在食品工业上的进一步应用[9-11]。因此,为克服上述不足,亟待寻求新方法和新技术提升荷叶碱的稳定性和生物利用度。
脂质体是人工脂质囊泡,通过脂质水合形成送载体,以产生稳定的磷脂双分子层。脂质体具有亲水性、疏水性和双亲性[12],但由于其脂类成分的氧化水解,可能致使脂质体相互黏附融合,从而导致包封组分的泄露[13]。针对上述问题,相比修饰脂质体膜成分,对其表面进行修饰是更经济有效的方法[14]。壳聚糖是一种酸性条件下带正电荷的天然阳离子多糖,具有生物相容性和生物降解性,广泛应用于食品体系。壳聚糖与带负电的脂质体表面相互作用,可改善囊泡的黏着性能、减少泄露[15]。因此本研究采用薄膜分散法和pH梯度法制备壳聚糖包覆荷叶碱脂质体(chitosan-coated nuciferine liposomes,CS-LP),测定其粒径、电位和包封率,考察其体外释放特性,并进一步探究CS-LP对高脂饮食(high fat diet,HFD)小鼠肥胖的调控作用,以期为提升荷叶碱的生物利用度和高效开发荷叶食药同源资源提供科学依据。
1. 材料与方法
1.1 材料与仪器
32只SPF级C57BL/6小鼠(雄性6周龄,平均体重22±2 g) 购自济南朋悦动物繁殖有限公司,动物生产许可证号:SCXK(鲁)2019-0003,动物实验按照美国国立卫生研究所《实验动物护理和使用指南》进行,经中国海洋大学食品科学与工程学院实验动物伦理委员会批准;荷叶碱(98%纯度) 信阳市沐凡生物科技有限公司;大豆卵磷脂、胆固醇、Tween-20、壳聚糖、4%多聚甲醛、Axy Prep DNA凝胶回收试剂盒、猪胃黏膜胃蛋白酶(酶活性≥400 U/mg)、猪胰腺胰酶(4×USP) 北京索莱宝科技有限公司;正常组小鼠普通饲料、实验组小鼠60%高脂饲料 江苏省协同医药生物工程有限责任公司;奥利司他 重庆华森制药股份有限公司;总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-c)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-c)试剂盒 中国南京建成生物研究所;无水乙醇、柠檬酸、柠檬酸钠 国药集团化学试剂有限公司;其他化学试剂均为国产分析纯。
AB135-S天平 瑞士梅特勒公司;Laborota 4000旋转蒸发仪 德国海道尔夫公司;AH110B高压均质机 ATS工业系统有限公司;CU-600电热恒温水浴锅 上海福玛实验设备有限公司;LSJB120电动搅拌器 常州励岸宝科技有限公司;GL-21M高速冷冻离心机 湖南湘仪实验室仪器开发有限公司;FDU-1200冷冻干燥机 上海爱郎仪器有限公司;Synergy H4酶标仪 美国Bio-Tek公司;JEM-F200光学显微镜 日本电子株式会社;UV-2550紫外可见分光光度计 日本岛津公司;Nano-zs90粒度分析仪 英国马尔文仪器公司;JEM-2100透射电镜 日本株式会社公司;THZ-312振荡培养箱 上海精宏实验设备有限公司;Mini Gel 2D电泳仪 美国伯乐公司;NicoletiS10傅里叶红外光谱仪 美国赛默飞公司;M0104 pH计 瑞士梅特勒托利多公司。
1.2 实验方法
1.2.1 CS-LP的制备
采用薄膜分散法和pH梯度法制备脂质体[16]。准确称量0.9 g大豆卵磷脂、0.1 g胆固醇、0.2 g吐温-20溶于无水乙醇中,充分溶解后,60 ℃条件下旋转蒸发仪减压蒸发,待无水乙醇完全蒸发圆底烧瓶底部形成薄膜后,加入含0.2 g荷叶碱(9 mg/mL)的柠檬酸盐缓冲液(0.1 mol/L、pH3.0),缓慢水化至完全洗脱,再经由高压均质机在45 MPa条件循环均质15 min,调节外部pH为7后,滴加0.5%壳聚糖搅拌室温孵育1 h。冷冻干燥得到壳聚糖包覆荷叶碱脂质体粉末制剂。
1.2.2 包封率的测定
采用紫外分光光度计法测定包封率[17],具体为取2 mL CS-LP加入2 mL甲醇,常温超声30 min,功率设定为240 W,8000 r/min离心30 min,取上清待用。取2 mL CS-LP于10 kDa超滤离心管中,4000 r/min离心40 min,取外管液体待用。在270 nm处测定吸光值,计算荷叶碱脂质体包埋率。
E(%)=(1−c1/c2)×100 式中:E表示壳聚糖包覆荷叶碱脂质体包封率,%;
c1 表示根据吸光度值计算出的未包埋荷叶碱质量浓度,mg/mL;c2 表示根据吸光度值计算出的总荷叶碱质量浓度,mg/mL。1.2.3 粒径、多分散性指数(polydispersity index,PDI)和表面电荷的测定
样品稀释适当比例,放入粒径与电位测定皿内,25 ℃条件下,使用动态光散射(dynamic light scattering,DLS)测定平均粒径和PDI。使用相同的系统测量脂质体的表面电荷。
1.2.4 形态观察
脂质体稀释适当倍数,样品滴加到碳膜涂覆的铜网上,静置片刻。滴加质量分数2%的磷钨酸溶液染色。在200 kV条件下用透射电镜观察微观形貌。
1.2.5 红外光谱分析
新鲜制备脂质体冷冻干燥成固态。空载脂质体(empty liposomes,E-LP)、荷叶碱脂质体和壳聚糖包覆荷叶碱脂质体与溴化钾(KBr)混合,压成均匀的薄片,于4000~400 cm−1波长下扫描64次。
1.2.6 体外释放曲线测定
脂质体模拟胃肠消化稳定性采用Tai等[15]的方法,并进行适当修改。将20 mL样品加入20 mL模拟胃液(Simulated gastric fluid,SGF,含2 mg/mL NaCl,3.2 mg/mL胃蛋白酶,pH1.2)中,于37 ℃孵育2 h,每15 min取出部分样品分析。在SGF中消化后,将样品pH调节至6.8~7.0。将20 mL消化物加入20 mL模拟肠液(simulated intestinal fluid,SIF,含6.8 mg/mL K2HPO4,0.2 mg/mL胆汁盐,8.8 mg/mL NaCl,3.2 mg/mL胰酶,pH7.4)中,于37 ℃孵育2 h,每15 min取出部分样品分析粒径变化和释放率。
R(%)=(E0−En)/E0×100 式中:R表示壳聚糖包覆荷叶碱脂质体胃肠道模拟的体外释放率,%;E0表示初始壳聚糖包覆荷叶碱脂质体的包封率,%;En表示第n次取出壳聚糖包覆荷叶碱脂质体的包封率,%。
1.2.7 动物模型建立及分组
实验动物适应性饲养1周后,随机分为正常组(ND组)、高脂组(HFD组)、壳聚糖包覆荷叶碱脂质体组(CS-LP组)和奥利司他阳性对照组(PC组),每组8只。ND组每日喂养普通饲料,其余组喂养高脂饲料。ND组和HFD组每天给予5 mL/kg生理盐水灌胃,CS-LP组每天灌胃120 mg/kg的CS-LP(将2000 mg CS-LP溶于10 mL超纯水,按照5 mL/kg进行灌胃),PC组每天灌胃60 mg/kg的奥利司他(将1000 mg奥利司他溶于10 mL超纯水,按照5 mL/kg进行灌胃)。小鼠饲养11周后处死,取样,冷冻后备用。
1.2.8 体重、脏器指标测定
实验以灌胃第1 d为第0周,持续11周。每周记录小鼠体重。解剖小鼠后,取出附睾脂肪、肝脏、肾脏称重记录。
1.2.9 血清生化分析
小鼠灌胃期结束后,眼眶取血静置半小时后离心,4 ℃,4000 r/min离心15 min取上层血清。小鼠血清中TC、TG、HDL-c、LDL-c含量采用试剂盒进行检测,测定方法严格按照试剂盒进行。
1.2.10 脂肪组织病理学分析
处死小鼠,取小鼠附睾脂肪组织置于4%多聚甲醛中固定,采用HE染色,光学显微镜下分析各组小鼠脂肪组织结构变化。
1.2.11 小鼠肠道内容物的菌群分析
使用FastDNA®Spin Kit for Soil提取小鼠粪便中细菌的总DNA,通过1%琼脂糖凝胶电泳检查DNA完整性。对V3–V4高变区338F(5’-ACTCCTACGGGAGGCAGCAG-3’)和806R(5’-GGACTACHVGGGTWTCTAAT-3’)进行16S扩增。每个样本3个重复,将同一样本的PCR产物混合后用2%琼脂糖凝胶电泳检测,使用Axy Prep DNA凝胶回收试剂盒(AXYGEN,USA)切胶回收PCR产物,将PCR产物用QuantiFluor™-ST蓝色荧光定量系统(Promega,USA)进行检测定量。并在MiSeq平台(Illumina,CA,USA)上进行配对末端测序。在通过UPARSE软件进行开放参考操作分类单元(OTU)挑选和通过Silva 16S rRNA数据库进行分类之前,通过FLASH软件对原始序列读数进行质量过滤和合并。
1.3 数据处理
所有数据结果均采用平均值±标准差表示。采用SPSS 26.0对数据进行统计学处理,多组间比较采用单因素方差分析(ANOVA),以P<0.05为差异具有统计学意义。
2. 结果与分析
2.1 CS-LP的粒径、电位和包封率
空载脂质体、荷叶碱脂质体和壳聚糖包覆荷叶碱脂质体的粒径、电位和包封率如表1所示。空载脂质体的粒径为127.50±1.57 nm,Zeta电位为−13.4±2.37 mV,荷叶碱脂质体相比空载脂质体粒径显著增大(P<0.05),原因可能与荷叶碱成功封装至脂质体内部导致复合体粒径增加有关[18]。壳聚糖包覆荷叶碱脂质体的粒径进一步增加,分别比空载脂质体和荷叶碱脂质体增加了98.85%和13.48%,同时其Zeta电位增加,粒子更加稳定,其原因可能与壳聚糖自身氨基通过静电吸附作用与磷脂相作用有关[19]。壳聚糖包覆后,脂质体对荷叶碱的包封率提高了11.14%,原因可能是壳聚糖对于脂质体膜表面孔隙的涂覆作用,抑制了内容物的泄露[20]。
表 1 不同脂质体的粒径、电位和包封率Table 1. The particle size, zeta potential and encapsulation rate of different liposomes脂质体 粒径(nm) Zeta电位(mV) 包封率(%) 空载脂质体 127.50±1.57c −13.43±2.37b 荷叶碱脂质体 223.43±2.15b −15.32±1.68b 72.32±3.08b 壳聚糖包覆荷叶碱脂质体 253.54±4.25a 32.50±3.44a 83.46±2.07a 注:同列不同字母表示差异显著(P<0.05)。 2.2 CS-LP的形态观察
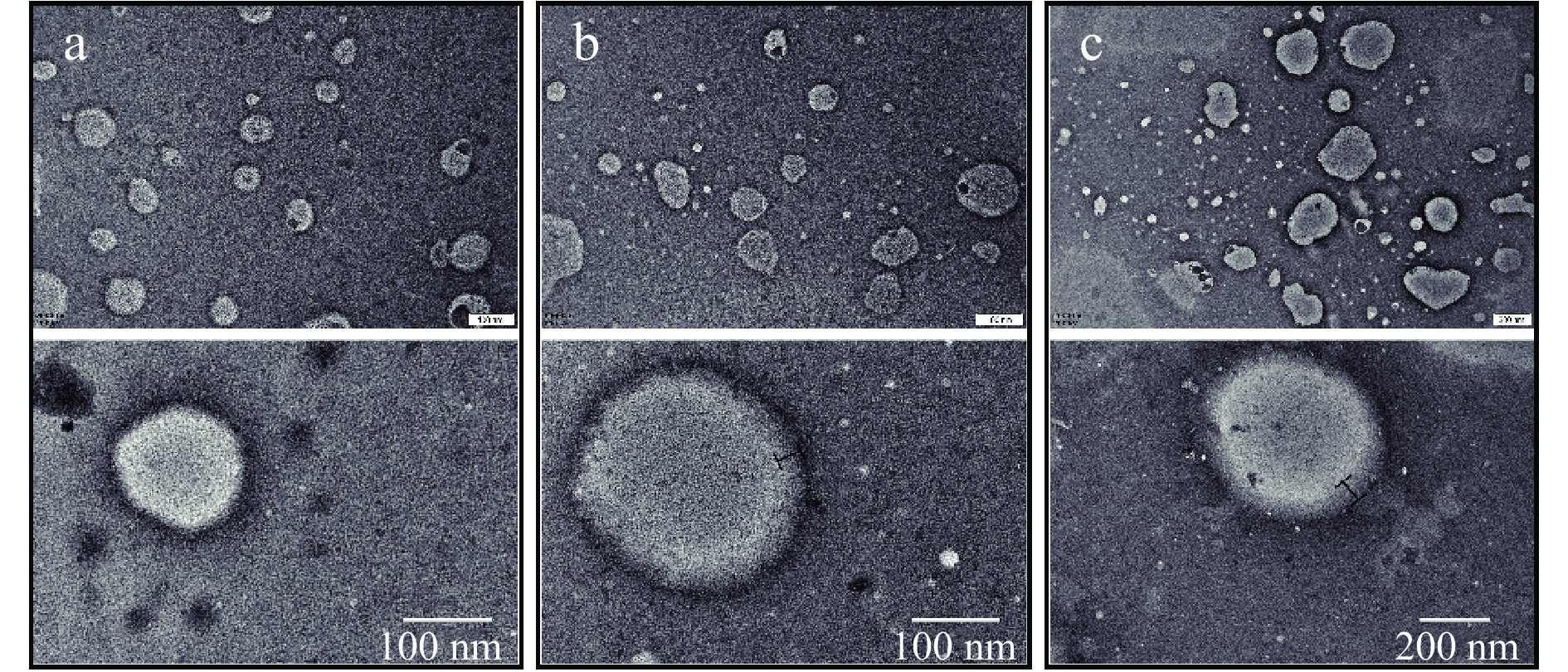
空载脂质体、荷叶碱脂质体和壳聚糖包覆荷叶碱脂质体的透射电镜图如图1所示。在相同100 nm标尺视野下,三种脂质体均为具有囊泡结构的球体,无明显聚集融合现象。荷叶碱封装后脂质体粒径增大,电镜形态结果与表1结果一致。壳聚糖的包覆作用使得脂质体的外膜层数和厚度增加,进一步证明壳聚糖吸附在脂质体表面,使其粒径增加。
2.3 CS-LP的红外光谱分析
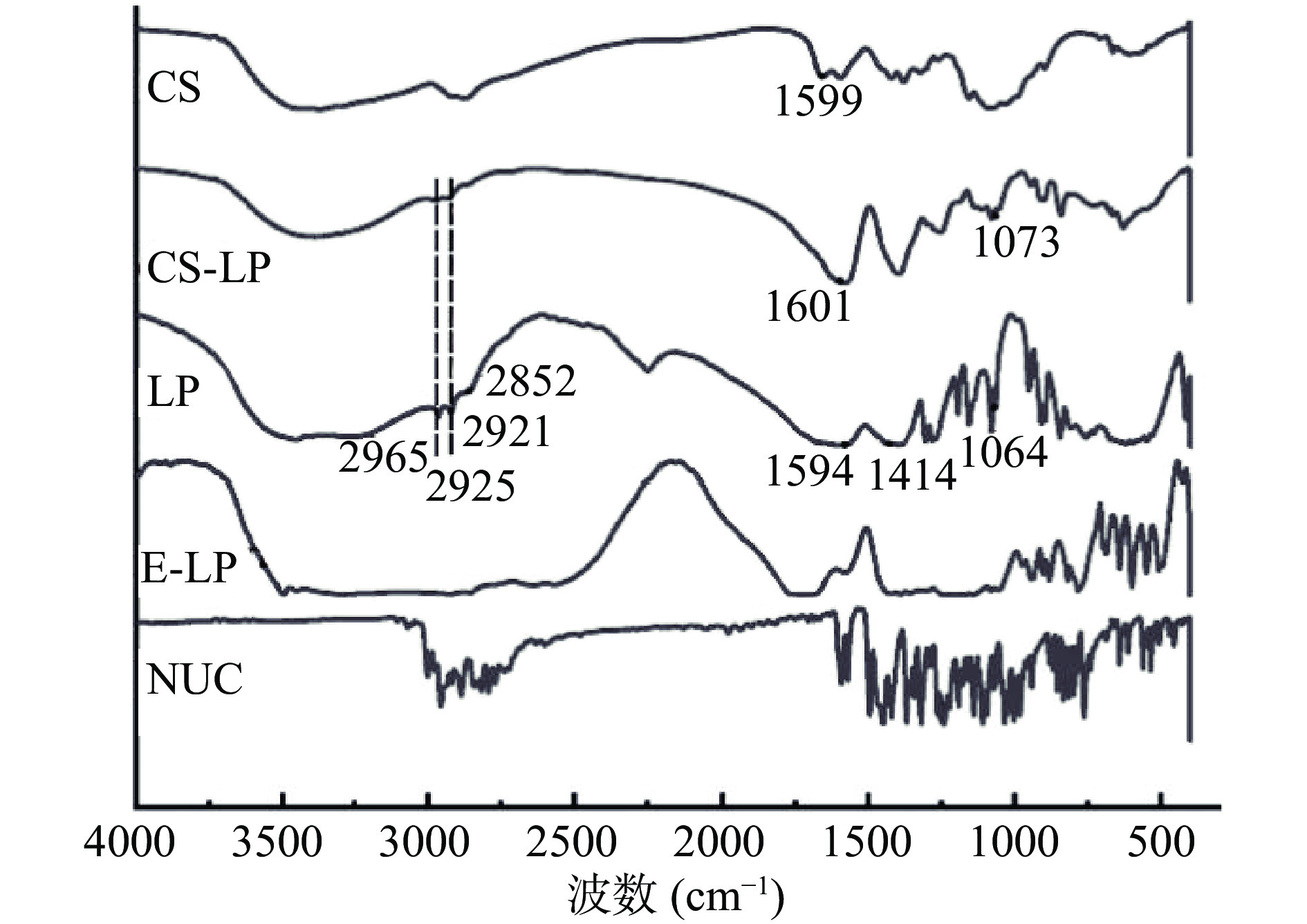
红外光谱分析结果如图2所示。荷叶碱脂质体CH2中C-H键的对称(2852
cm−1 )和反对称(2921cm−1 )伸缩振动可以反映有序无序状态的信息(即酰基链的柔韧性),这是囊泡的主要特征谱带。荷叶碱1450~1600cm−1 范围内的苯环框架振动特征吸收峰在荷叶碱脂质体中消失,表明脂质体成功包埋荷叶碱。脂质体中2925和2965cm−1 分别为内部疏水性CH2的非对称和对称振动吸收峰,包覆后峰未发生明显偏移,表明壳聚糖修饰于脂质体表面,未对脂质体内部结构产生影响。PO2− 在无包被脂质体中在1064cm−1 处的对称拉伸在CS-LP中转移到1073cm−1 处,壳聚糖中1599cm−1 是氨基(N-H)的弯曲振动峰,在包覆脂质体中此峰消失。表明壳聚糖通过静电相互作用修饰在脂质体表面[21]。2.4 CS-LP的体外释放特性
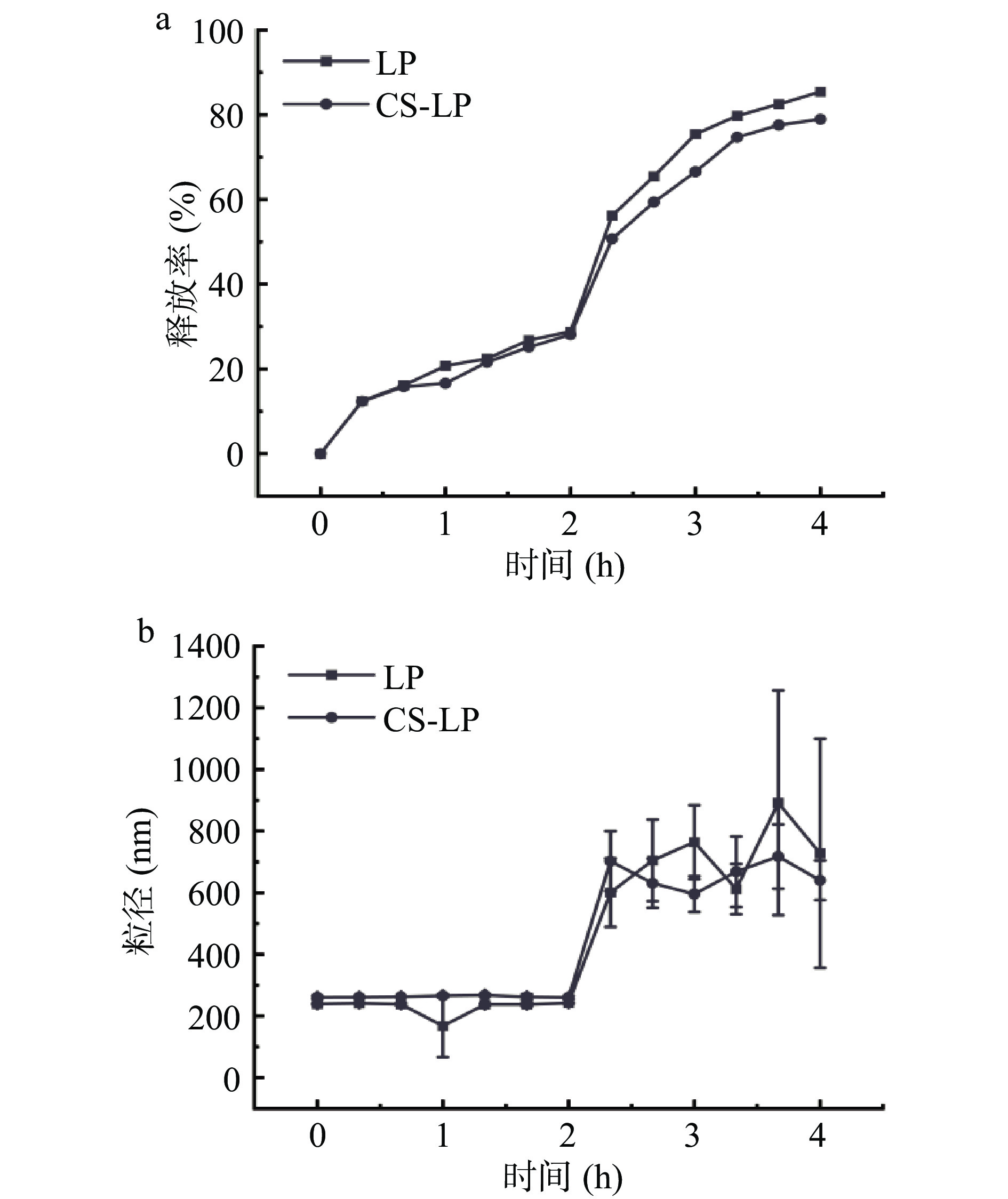
荷叶碱脂质体和壳聚糖包覆荷叶碱脂质体体外释放结果见图3。在SGF中消化阶段,CS和CS-LP粒径变化不明显。粒径变化主要出现在SIF消化阶段,两种脂质体粒径均呈现先上升后下降的趋势。这可能归因于胰酶对磷脂的水解以及胆盐与脂质体成分的相互作用[22]。脂质体的释放于消化过程中持续进行,在SIF中消化加速。消化4 h时,LP消化释放率为85.40%,CS-LP为78.93%,表明壳聚糖修饰可减缓荷叶碱的释放,这与Wang等[23]的研究结果相一致:Wang等[23]的研究证明,胆盐有助于胰酶接近脂质体表面并促进脂肪分解,并与磷脂、甘油酯和脂肪酸形成混合胶束,使得脂质体在胃肠道消化中出现粒径先增大后减小的现象。
2.5 CS-LP对小鼠体重和内脏器脂肪堆积的影响
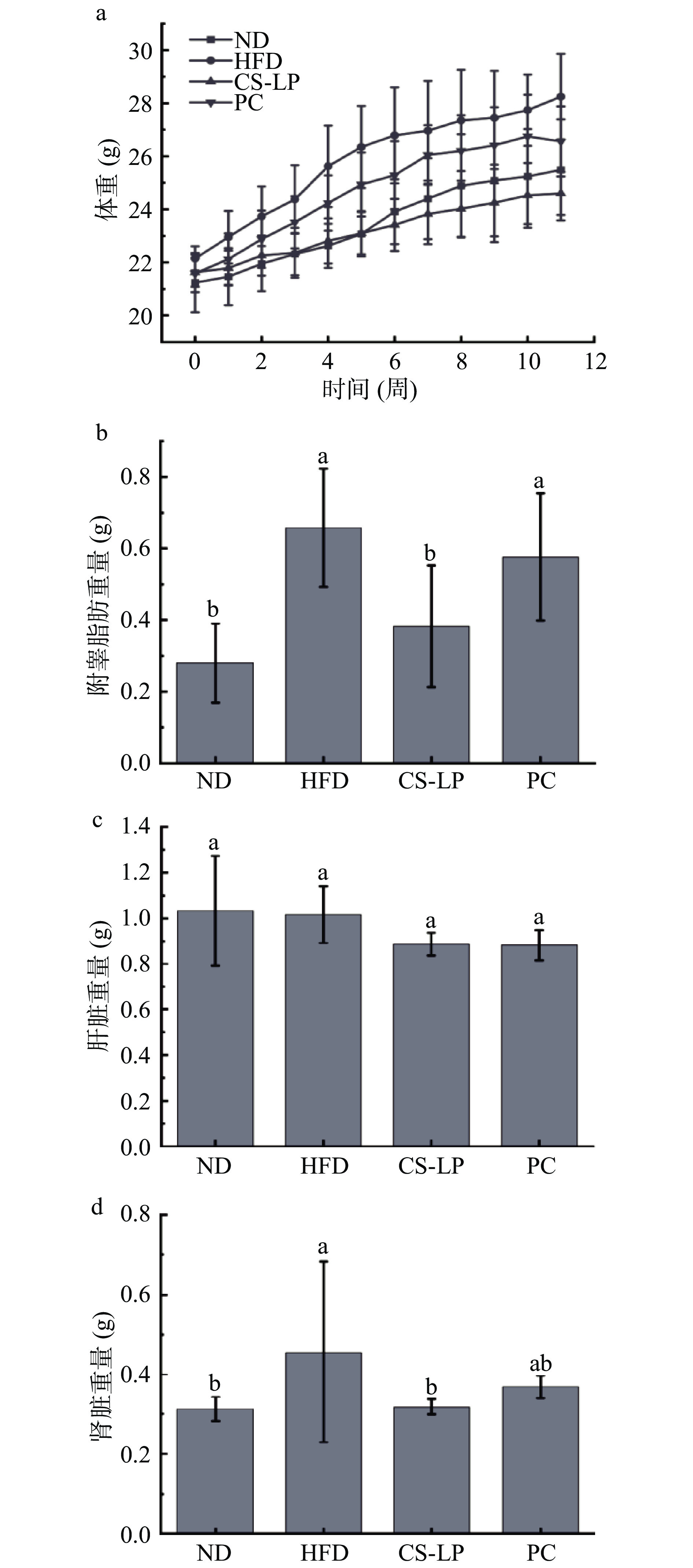
小鼠饲养11周的体重和内脏脂肪堆积如图4所示。在第0周时,4组小鼠具有相似的初始体重,与ND组相比,HFD组体重增长迅速,11周结束后,HFD组小鼠平均体重为28.24±1.61 g,比ND组增加了10.83%。通过PC和CS-LP干预可有效降低高脂饮食造成的小鼠肥胖和体重增加,11周结束后,CS-LP组小鼠平均体重比HFD组降低了12.91%(图4a),脂肪组织重量降低了41.03%,其效果优于PC(奥利司他)组。HFD组的附睾脂肪和肾脏重量显著高于ND组(P<0.05),经过11周CS-LP和奥利司他灌胃,CS-LP组附睾脂肪重量显著低于HFD组(P<0.005)(图4b、图4c和图4d),表明灌胃120 mg/kg/d CS-LP可以有效减轻由于高脂饮食带来的体重和附睾脂肪的增加,其效果与灌胃60 mg/kg/d的奥利司他效果相当。
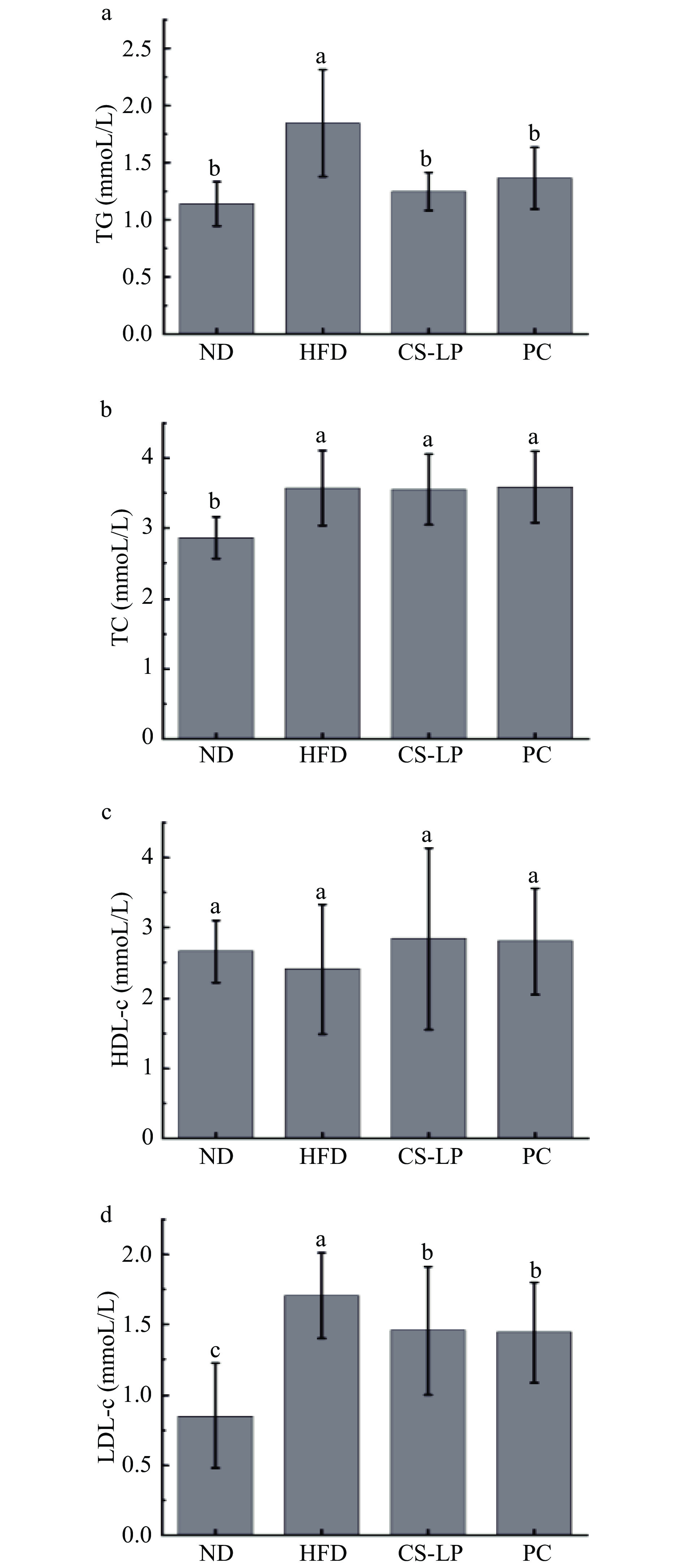
2.6 CS-LP对小鼠血脂水平的影响
CS-LP对小鼠血脂水平的影响如图5所示。与ND组相比,11周的高脂饮食喂养会导致小鼠TG、TC、LDL-c水平显著增加(P<0.05)。通过灌胃CS-LP可以减轻由于高脂饮食引起的TG、LDL-c显著升高(P<0.05)。虽然HFD组和CS-LP组TC含量相当,通过分析LDL-c的水平可以看出CS-LP能够通过改变血清中不同种类胆固醇的含量以此达到降脂的效果。常见的脂质代谢异常通常表现为TG和LDL-c含量升高[24-25],脂肪组织中的炎症状态对脂质代谢有显著影响,表现为TG和活化脂质的积累[26],而体脂和血浆异常升高是心血管疾病的重要危险因素[27]。
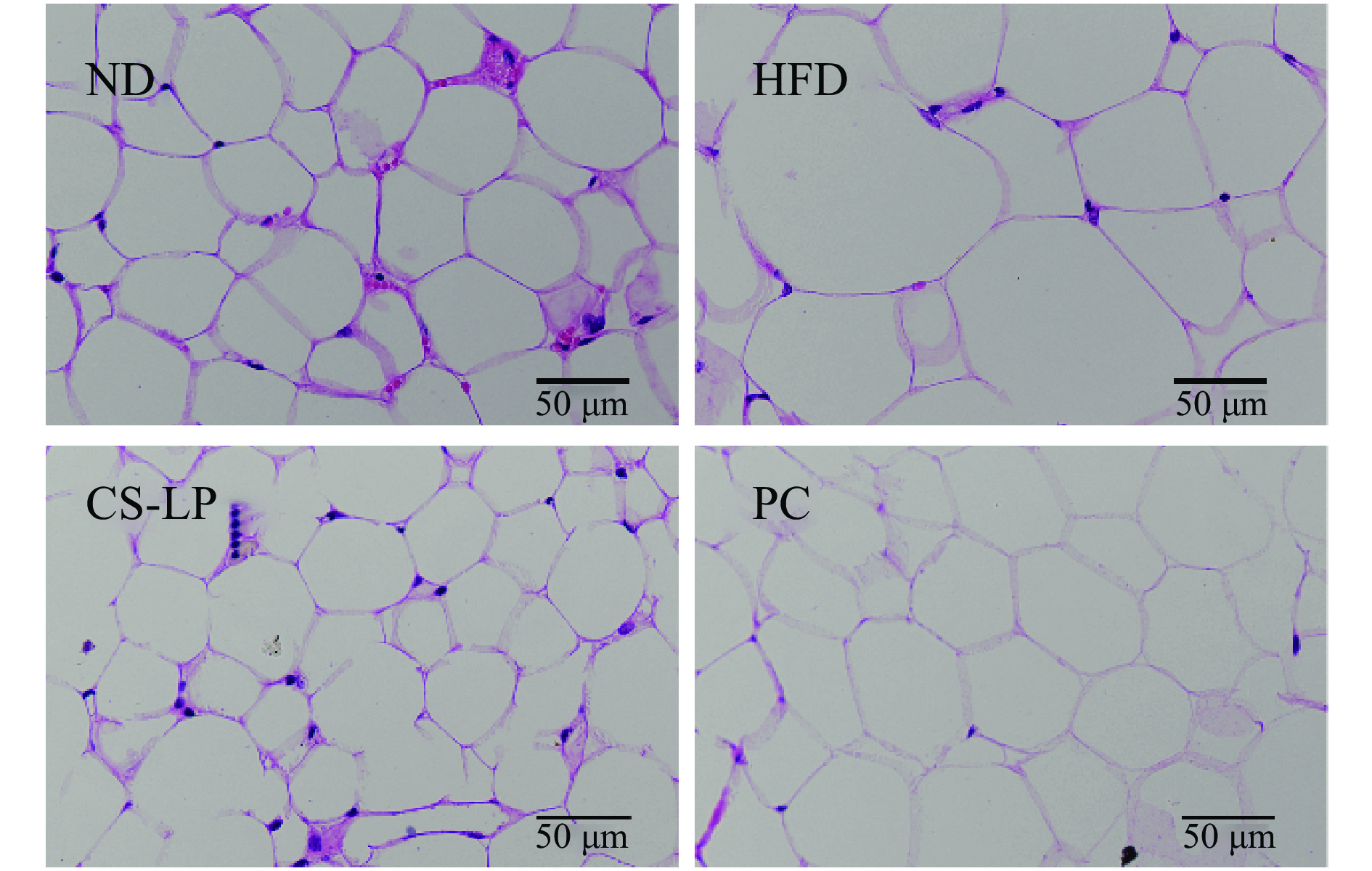
2.7 CS-LP对小鼠脂肪组织的影响
小鼠附睾脂肪组织切片如图6所示。在相同显微镜视野下,HFD组与ND组相比,脂肪细胞数量减少,体积增大,CS-LP组和PC组脂肪细胞体积均要小于HFD组。表明给予小鼠CS-LP灌胃可减小其附睾脂肪细胞体积。这一结果也与图4中附睾脂肪的重量相一致。
2.8 CS-LP对小鼠肠道菌群的影响
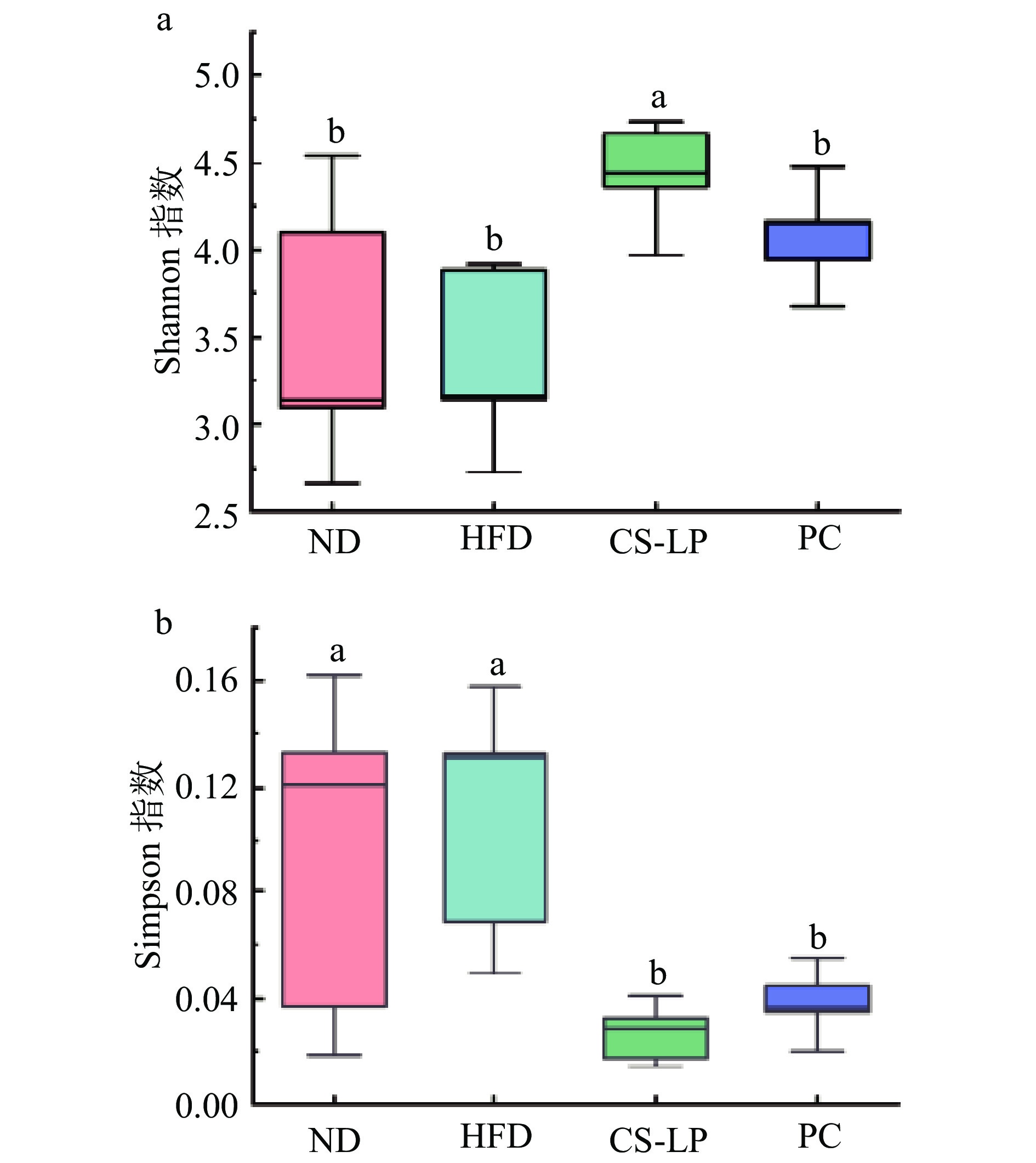
2.8.1 CS-LP对小鼠肠道微生物群落多样性的影响
肠道微生物群是宿主代谢的中枢调节剂,包括能量稳态、葡萄糖代谢和脂质代谢[28]。膳食组成是肠道微生物群代谢输出的核心,饮食影响肠道微生物群组成,从而影响其代谢潜力和对宿主的影响[29]。肠道微生物群已被证明在喂食高脂肪或低脂肪的小鼠饮食之间以及不同来源的饮食之间有所不同[30]。微生物群落的丰富度和多样性可以通过Alpha多样性反映。常用来反映群落多样性的指数有Shannon指数和Simpson指数,Shannon指数值越大,说明群落多样性越高;Simpson指数值越大,说明群落多样性越低[31]。由图7可知,与ND组相比,HFD组Shannon指数下降,Simpson指数上升,但差异不显著(P>0.05),CS-LP组、PC组与HFD组相比,其Shannon指数均上升,Simpson指数均下降,且CS-LP组差异显著(P<0.05)。表明,CS-LP和奥利司他处理能够抑制高脂饮食诱导的小鼠肠道菌群多样性的降低,增强菌群多样性。
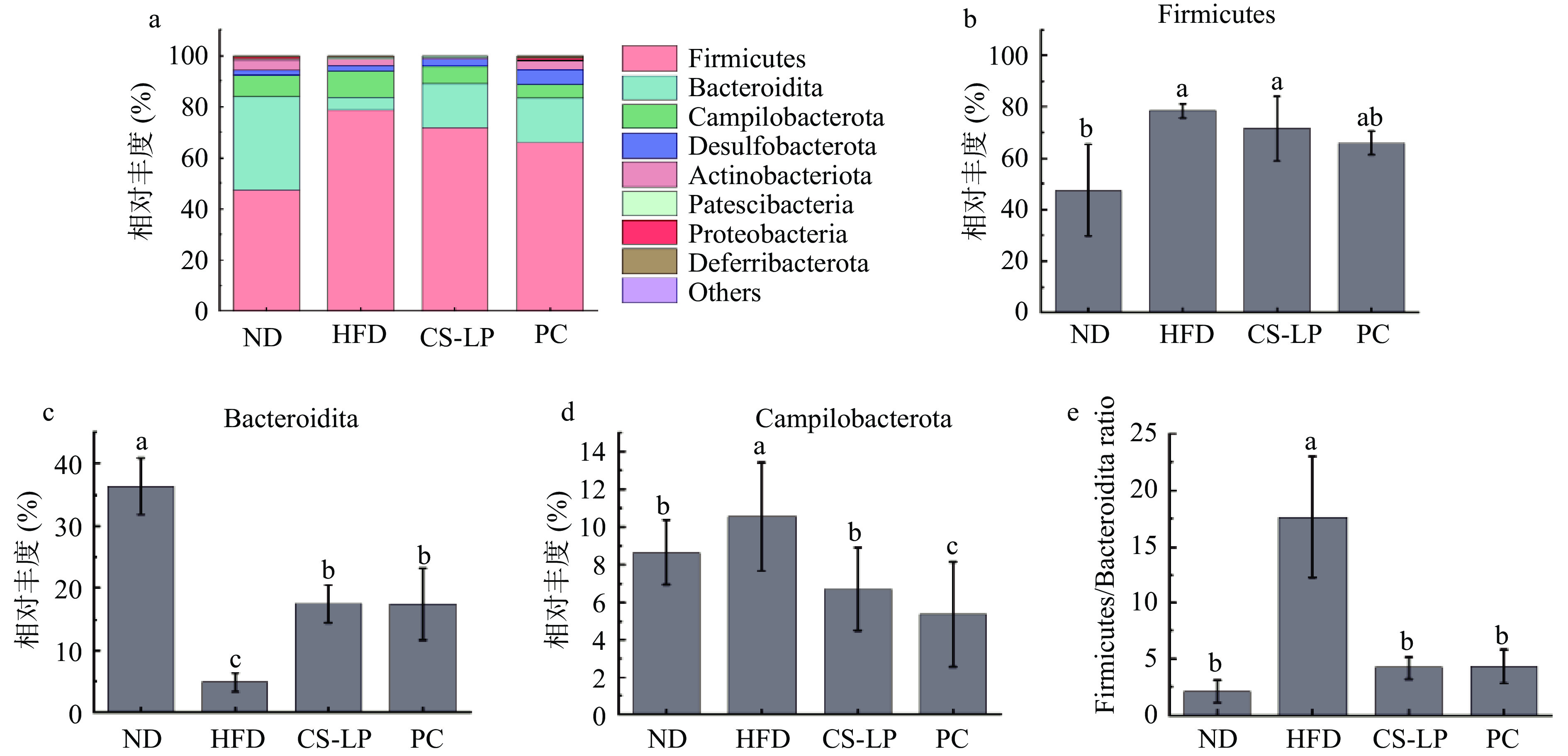
2.8.2 CS-LP对小鼠肠道菌群结构门水平上的影响
CS-LP对小鼠肠道菌群门水平的调节作用如图8所示,各组肠道菌群主要由厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidita)、弯曲杆菌门(Campilobacterota)和脱铁杆菌门(Desulfobacterota)组成。ND组中厚壁菌门、拟杆菌门和弯曲杆菌门的相对丰度分别是47.45%、36.34%、8.65%,厚壁菌门与拟杆菌门相对丰度的比值为1.31。与ND组相比,HFD组厚壁菌门、弯曲杆菌门以及厚壁菌门与拟杆菌门相对丰度的比值分别显著上升至78.47%、10.57%、17.56(P<0.05),拟杆菌门显著下降至4.93%(P<0.05)。灌胃CS-LP后,厚壁菌门相对丰度下降至72.54%,拟杆菌门相对丰度显著上升至17.47%(P<0.05),弯曲杆菌门和厚壁菌门与拟杆菌门相对丰度的比值分别显著下降至6.70%、4.19(P<0.05)。PC组厚壁菌门相对丰度下降至65.92%,拟杆菌门相对丰度显著升高至17.34%(P<0.05),弯曲杆菌门和厚壁菌门与拟杆菌门相对丰度的比值分别显著降低至5.35%、4.26(P<0.05)。结果表明,经过CS-LP诱导,小鼠肠道菌群主要门类相对丰度发生显著变化。CS-LP可以使拟杆菌门、弯曲杆菌门和厚壁菌门与拟杆菌门相对丰度的比值恢复到ND组水平。据报道,肥胖可能与两种占主导地位的细菌门有关:厚壁菌门和拟杆菌门。表现为厚壁菌门与拟杆菌门相对丰度的比值上升,说明肥胖小鼠微生物群从饮食中收集能量的能力更强[32]。相较于HFD组CS-LP干预组拟杆菌门相对丰度显著上升,弯曲杆菌门和厚壁菌门与拟杆菌门相对丰度的比值显著下降(P<0.05)。
2.8.3 CS-LP对小鼠肠道菌群结构属水平上的影响
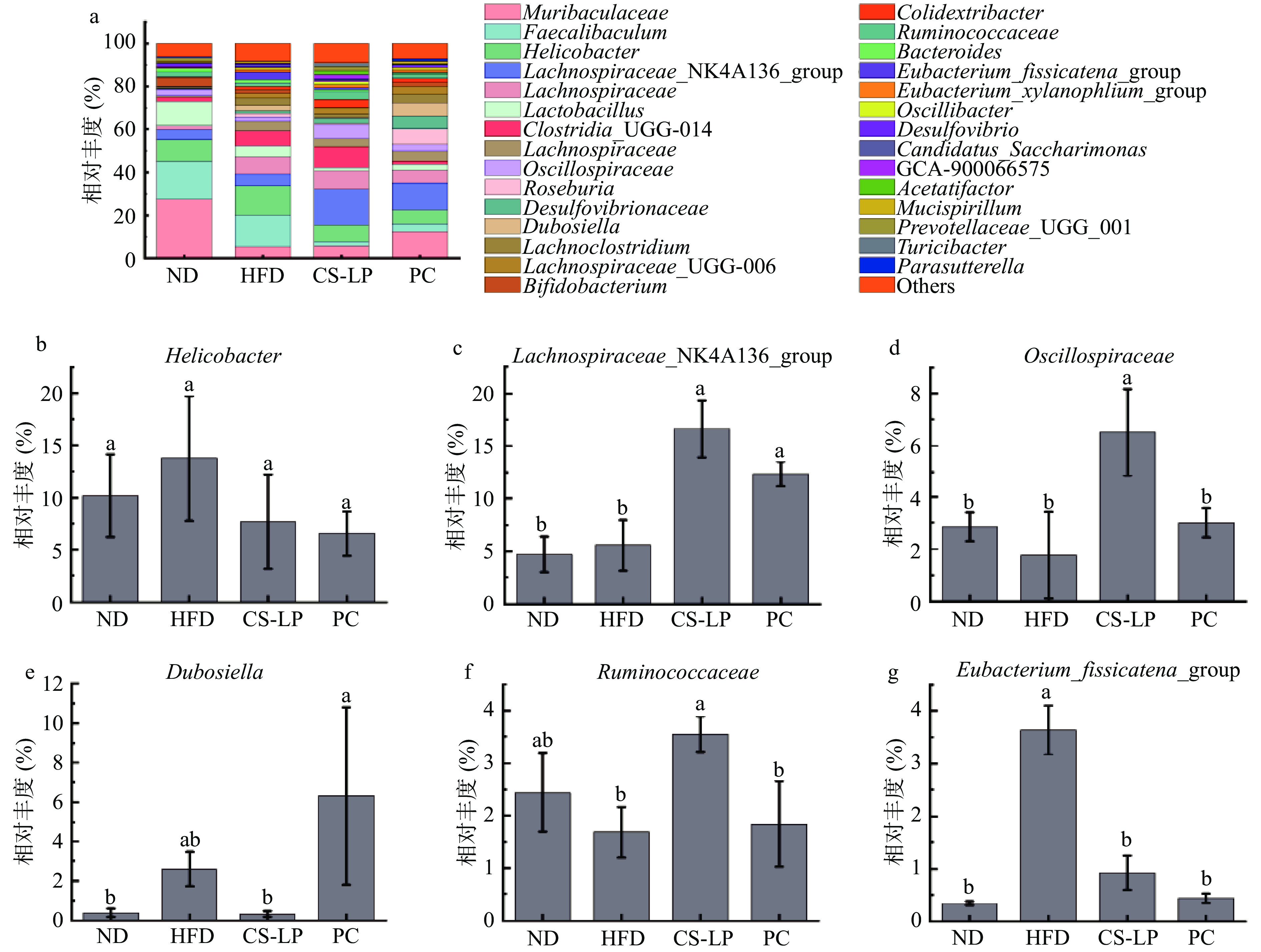
为了探究CS-LP对小鼠肠道菌群属水平的调节作用,对属水平上主要菌群的相对丰度进行统计分析。属水平上的聚类柱状图和主要菌群相对丰度如图9所示,各组肠道菌群主要由Muribaculaceae、Faecalibaculum、Helicobacter、Lachnospiraceae_NK4A136_group、Lachnospiraceae等组成。与ND组相比,HFD组肠道菌群中Helicobacter、Lachnospiraceae_NK4A136_group、Dubosiella的相对丰度上升,分别为13.73%、5.57%、2.62%。Eubacterium_fissicatena_group的相对丰度显著上升(P<0.05)为3.63%,Oscillospiraccae的相对丰度下降为6.50%,Ruminococcaceae的相对丰度下降为1.69%。灌胃CS-LP后,相较于HFD组,Helicobacter、Dubosiella的相对丰度下降,分别为7.68%、0.33%,Lachnospiraceae_NK4A136_group、Oscillospiraccae、Ruminococcaceae的相对丰度显著上升(P<0.05),分别为16.64%、6.50%、3.54%,Eubacterium_fissicatena_group的相对丰度显著下降至0.92%。PC组相较于HFD组Lachnospiraceae_NK4A136_group的相对丰度显著上升为12.34%,Eubacterium_fissicatena_group的相对丰度显著下降为0.44%。结果表明,经过CS-LP诱导,小鼠肠道菌群主要属类相对丰度发生显著变化(P<0.05)。CS-LP干预相较于HFD组Lachnospiraceae_NK4A136_group、Oscillospiraccae、Ruminococcaceae的相对丰度显著上升,Dubosiella、Eubacterium_fissicatena_group的相对丰度下降。能够将植物多糖发酵产生短链脂肪酸的菌群:Lachnospiraceae_NK4A136_group、Ruminococcaceae,在预防肥胖和胰岛素抵抗方面发挥积极作用。Li等[33]的研究中指出Eubacterium_fissicatena_group菌群丰度的降低可以恢复肠道生态平衡。
3. 结论
本研究采用薄膜分散法和pH梯度法制备的壳聚糖包覆荷叶碱脂质体包埋效果好,包埋率高,可达83.46%。透射电镜观察外观平滑,无明显融合现象,且大小相对均一。壳聚糖的包覆可延缓荷叶碱脂质体活性物质释放。壳聚糖包覆荷叶碱脂质体显著抑制高脂饮食小鼠体重增加,改善小鼠血脂异常,缓解小鼠脂肪组织的增长和积累,并能有效改善高脂饮食引起的小鼠肠道菌群紊乱。本研究证实壳聚糖包覆荷叶碱脂质体在预防肥胖和调节肠道菌群方面可以起到良好调控作用,有助于改善高脂饮食诱导的肥胖,在降脂配方食品开发领域具有广阔的应用前景。
-
表 1 不同脂质体的粒径、电位和包封率
Table 1 The particle size, zeta potential and encapsulation rate of different liposomes
脂质体 粒径(nm) Zeta电位(mV) 包封率(%) 空载脂质体 127.50±1.57c −13.43±2.37b 荷叶碱脂质体 223.43±2.15b −15.32±1.68b 72.32±3.08b 壳聚糖包覆荷叶碱脂质体 253.54±4.25a 32.50±3.44a 83.46±2.07a 注:同列不同字母表示差异显著(P<0.05)。 -
[1] ZHENG H, HAN L, SHI W, et al. Research advances in lotus leaf as chinese dietary herbal medicine[J]. The American Journal of Chinese Medicine,2022,50(6):1423−1445. doi: 10.1142/S0192415X22500616
[2] YU Y, LU J, SUN L, et al. Akkermansia muciniphila: A potential novel mechanism of nuciferine to improve hyperlipidemia[J]. Biomedicine & Pharmacotherapy,2021:133.
[3] ZHANG L N, GAO J H, TANG P, et al. Nuciferine inhibits LPS-induced inflammatory response in BV2 cells by activating PPAR-gamma[J]. International Immunopharmacology,2018,63:9−13. doi: 10.1016/j.intimp.2018.07.015
[4] QI Q, LI R, LI H Y, et al. Identification of the anti-tumor activity and mechanisms of nuciferine through a network pharmacology approach[J]. Acta Pharmacologica Sinica,2016,37(7):963−972. doi: 10.1038/aps.2016.53
[5] CHEN H W, YANG M Y, HUNG T W, et al. Nelumbo nucifera leaves extract attenuate the pathological progression of diabetic nephropathy in high-fat diet-fed and streptozotocin-induced diabetic rats[J]. Journal of Food and Drug Analysis,2019,27(3):736−748. doi: 10.1016/j.jfda.2018.12.009
[6] MA C, LI G, HE Y, et al. Pronuciferine and nuciferine inhibit lipogenesis in 3T3-L1 adipocytes by activating the AMPK signaling pathway[J]. Life Sciences,2015,136:120−125. doi: 10.1016/j.lfs.2015.07.001
[7] XU H, LU X, GUO X, et al. Distinct AMPK-mediated FAS/HSL pathway is implicated in the alleviating effect of nuciferine on obesity and hepatic steatosis in hfd-fed mice[J]. Nutrients,2022,14(9):25−46.
[8] PAN S Z. Study on effect of alkaloid salt from lotus leaf on preventing of diet-induced obesity and modulation of gut microbiota in mice [D]. Zhejiang: Zhejiang University, 2019.
[9] WANG Y X, LIU B, SHI R B, et al. Determination of nuciferine in Beagle dog by RP-HPLC and research on its pharmacokinetics[J]. Chinese Journal of Pharmaceutical Analysis,2008,28(9):1418−1421.
[10] WANG F G, CAO J, HOU X Q, et al. Pharmacokinetics, tissue distribution, bioavailability, and excretion of nuciferine, an alkaloid from lotus, in rats by LC/MS/MS[J]. Drug Development and Industrial Pharmacy,2018,44(9):1557−1562. doi: 10.1080/03639045.2018.1483399
[11] XIE Y L, WANG Y Y, TAN Y X, et al. Study on absolute bioavailability of nuciferine in rats[J]. Journal of Guangdong Pharmaceutical University,2010,26(01):17−19.
[12] COLLIER M A, BACHELDER E M, AINSLIE K M. Electrosprayed myocet-like liposomes: An alternative to traditional liposome production[J]. Pharmaceutical Research,2017,34(2):419−426. doi: 10.1007/s11095-016-2072-4
[13] SEBAALY C, HAYDAR S, GREIGE-GERGES H. Eugenol encapsulation into conventional liposomes and chitosan-coated liposomes: A comparative study[J]. Journal of Drug Delivery Science and Technology,2022:67.
[14] HE H S, LU Y, QI J P, et al. Adapting liposomes for oral drug delivery[J]. Acta Pharmaceutica Sinica B,2019,9(1):36−48. doi: 10.1016/j.apsb.2018.06.005
[15] TAI K D, RAPPOLT M, MAO L K, et al. The stabilization and release performances of curcumin-loaded liposomes coated by high and low molecular weight chitosan[J]. Food Hydrocolloids,2020:99.
[16] TIAN M, HAN J, YE A, et al. Structural characterization and biological fate of lactoferrin-loaded liposomes during simulated infant digestion[J]. Journal of the Science of Food and Agriculture,2019,99(6):2677−2684. doi: 10.1002/jsfa.9435
[17] WANG W, TAN X M. Study on the determination of total alkaloid content of lotus leaves[J]. Journal of Chinese Medicinal Materials,2004(1):50−51.
[18] BONECHI C, TAMASI G, DONATI A, et al. Physicochemical characterization of hyaluronic acid and chitosan liposome coatings[J]. Applied Sciences-Basel, 2021, 11(24).
[19] EFIMOVA A A, MULASHKIN F D, RUDENSKAYA G N, et al. Biodegradable electrostatic complexes of chitosan cationic microparticles and anionic liposomes[J]. Polymer Science, Series B,2018,60(1):84−90. doi: 10.1134/S1560090418010037
[20] MANCONI M, MANCA M L, VALENTI D, et al. Chitosan and hyaluronan coated liposomes for pulmonary administration of curcumin[J]. International Journal of Pharmaceutics,2017,525(1):203−210. doi: 10.1016/j.ijpharm.2017.04.044
[21] KHOERUNNISA F, NURHAYATI M, DARA F, et al. Physicochemical properties of tpp-crosslinked chitosan nanoparticles as potential antibacterial agents[J]. Fibers and Polymers,2021,22(11):2954−2964. doi: 10.1007/s12221-021-0397-z
[22] LIU W L, HOU Y Y, JIN Y Y, et al. Research progress on liposomes: Application in food, digestion behavior and absorption mechanism[J]. Trends in Food Science & Technology,2020,104:177−189.
[23] WANG Y, ZHANG W, REIMER B, et al. The effect of feedback on attitudes toward cellular phone use while driving: A comparison between novice and experienced drivers[J]. Traffic Injury Prevention,2010,11(5):471−477. doi: 10.1080/15389588.2010.495761
[24] CHO Y A, KIM J. Effect of probiotics on blood lipid concentrations a meta-analysis of randomized controlled trials[J]. Medicine,2015,94(43):6371−6384.
[25] BACKHED F, MANCHESTER J K, SEMENKOVICH C F, et al. Mechanisms underlying the resistance to diet-induced obesity in germ-free mice[J]. Proceedings of the National Academy of Sciences of the United States of America,2007,104(3):979−984. doi: 10.1073/pnas.0605374104
[26] CURAT C A, MIRANVILLE A, SENGENÈS C, et al. From blood monocytes to adipose tissue-resident macrophages: Induction of diapedesis by human mature adipocytes[J]. Diabetes,2004,53(5):1285−1292. doi: 10.2337/diabetes.53.5.1285
[27] BALLANTYNE C M, OLSSON A G, COOK T J, et al. Influence of low high-density lipoprotein cholesterol and elevated triglyceride on coronary heart disease events and response to simvastatin therapy in 4S[J]. Circulation,2001,104(25):3046−3051. doi: 10.1161/hc5001.100624
[28] SMITH B J, MILLER R A, SCHMIDT T M. Muribaculaceae genomes assembled from metagenomes suggest genetic drivers of differential response to acarbose treatment in mice[J]. Msphere,2021,6(6):78−92.
[29] SCHOELER M, CAESAR R. Dietary lipids, gut microbiota and lipid metabolism[J]. Reviews in Endocrine and Metabolic Disorders,2019,20(4):461−472. doi: 10.1007/s11154-019-09512-0
[30] JUST S, MONDOT S, ECKER J, et al. The gut microbiota drives the impact of bile acids and fat source in diet on mouse metabolism[J]. Microbiome,2018,6(1):134. doi: 10.1186/s40168-018-0510-8
[31] GAO X, JIA R, XIE L, et al. A study of the correlation between obesity and intestinal flora in school-age children[J]. Scientific Reports,2018,8(1):14511. doi: 10.1038/s41598-018-32730-6
[32] TURNBAUGH P J, LEY R E, MAHOWALD M A, et al. An obesity-associated gut microbiome with increased capacity for energy harvest[J]. Nature,2006,444(7122):1027−1031. doi: 10.1038/nature05414
[33] LI Y, LI N, LIU J, et al. Gegen qinlian decoction alleviates experimental colitis and concurrent lung inflammation by inhibiting the recruitment of inflammatory myeloid cells and restoring microbial balance[J]. J Inflamm Res,2022,15:1273−1291. doi: 10.2147/JIR.S352706









 下载:
下载:








 下载:
下载:
