Recent Advance on the Structure-Activity Relationship in Antioxidant Peptides of Fish
-
摘要: 氧化反应不仅与许多慢性疾病相关,同时亦是食品酸败的诱因之一,能够降低食品营养价值并缩短货架期。近年来,具有抗氧化活性的肽氨基酸组成、排列顺序及空间构象已被广泛报道。随着相关研究的不断深入,肽的构效关系已逐步成为阐明其抗氧化机制的核心问题。当前研究中,从陆地动物中分离的抗氧化肽,其抗氧化作用机制已基本明晰。然而,针对蛋白质含量的更高的鱼类资源,其抗氧化肽的构效关系研究甚少。因此,本文基于抗氧化肽电子转移清除自由基、氢原子转移清除自由基和螯合促氧化金属离子的作用机制,对鱼类源抗氧化肽的一级结构和二级结构对活性产生的重要影响进行综述。重点分析含硫氨基酸、芳香族氨基酸、部分疏水性氨基酸和部分中性氨基酸、酸性氨基酸和碱性氨基酸对抗氧化活性的影响,以期指导抗氧化肽相关食品的研发,深度拓展抗氧化肽产品的消费市场。Abstract: Oxidation reaction in food is related to chronic diseases and rancidity, shortening the nutritional value and shelf life of products. In recent advances, the amino acid, sort order and spatial conformation of the antioxidant peptides is wildly reported. The structure-function relationship of antioxidant peptides has become the main factors on the determination of the antioxidant mechanisms. However, compared with the significant antioxidant effect of the peptides from land animals, such structure-function relationship of the antioxidant peptides in the fish, which is rich in proteins, is seldom reported. Therefore, antioxidant mechanisms of the peptides from fish, such as scavenging the intracellular reactive oxygen species in vivo, scavenging the free radicals in vitro and chelating the pro-oxidant metal ions is summarized in this review. The structure-function relationship between the primary structure and secondary structure on the antioxidant activity of fish peptides is provided. Moreover, the effects of non-polar amino acids, polar uncharged amino acids, polar positively charged amino acids and polar negatively charged amino acids are further reviewed. The review would provide a guide for the application of antioxidant peptides, and expand the food market for such products.
-
Keywords:
- fish /
- enzymolysis /
- antioxidant peptides /
- structure-effect relationship /
- effect mechanism
-
活性氧(reactive oxygen species,ROS)在有氧生物的新陈代谢和呼吸过程中自然产生[1],当自由基产生过多或产生后没有被完全清除时,它们可以攻击附近的分子,使其失去电子,缺少电子的分子会攻击其他分子,造成氧化损伤[2]。目前,天然或合成抗氧化肽[3-5]可以作为外源性抗氧化剂维持体内或油脂的氧化还原平衡、预防和治疗疾病。因它们比酶类抗氧化剂结构简单,更稳定,不会产生危险的免疫反应,从而备受青睐[6]。
利用自然资源筛选和获得具有明确结构的抗氧化效用的肽产品正在成为食品和医疗行业的动力。2021年我国鱼类总产量超过3561万吨,占水产品总产量的1/2以上[7],鱼类加工过程中产生了约占鱼体50%~70%的副产物[8],包括:头、皮肤、骨骼、鳞片、鳍和内脏等[9]。鱼蛋白是一种极佳的抗氧化肽来源,与微藻、鸡蛋、大豆等原料蛋白相比,鱼类蛋白富含Arg、Lys和Gly,从鱼的不同部位制备的水解液可以作为必需氨基酸的良好来源,且其容易被人体吸收[10]。因此,与其他蛋白资源相比,鱼蛋白具有不同的氨基酸的种类和水平[10],这为制备出不同结构的抗氧化肽带来更多的可能性。
近年来,针对抗氧化肽制备、分离纯化和鉴定序列方面的研究较多,当前研究人员主要通过酶解或发酵[11]生产,并且可以与超声波[12]、微波[13]、高压脉冲电场[14]和超临界水萃取[14]等预处理技术结合,以获得更高的产量和投入更低的成本。当前关于抗氧化肽活性位点、结构特征与功能方面有一定的显示报道,但其构效关系与作用机制仍处于探索阶段。一直以来,氨基酸类型和序列被认为是决定肽的抗氧化性能的重要因素[15]。蛋白质中存在的20种氨基酸可以与自由基反应,表1罗列了近年来的鱼类抗氧化肽的作用机制,说明了氨基酸的结构特性与抗氧化能力的关系。此外,抗氧化肽的相互作用和二级结构影响抗氧化肽活性的高低,协同作用能增强整体抗氧化肽的活性,拮抗作用会减弱整体抗氧化肽的作用[16]。不论是一级结构的相互作用[17],还是混合肽之间的相互作用,都会影响肽作为抗氧化剂的能力强弱[16]。水解及预处理手段会使有序结构和无序结构二者发生转换,结果是造成了肽的二级结构含量与肽的活性成正相关或负相关。
表 1 抗氧化肽的作用机制Table 1. Action mechanism of antioxidant peptides氨基酸 结构特性 肽序列 抗氧化能力 蛋白来源 Cys(C) Cys侧链的-SH提供氢原子与自由基直接作用,Cys因具有共振结构而能维持抗氧化的稳定性 DCGY和NYDEY HRSA 罗非鱼[24] HRDRLCVVQ ORAC、ABTS 鲈鱼[22] Met(M) Met结构的S原子可以提供电子从而被氧化成Met亚砜,Met因具有共振结构而能维持抗氧化的稳定性 GGGAGMLLK ORAC、ABTS 鲈鱼[22] PMRGGGGYHY ORAC 合成肽[41] His(H) His的咪唑环提供氢原子,以电子共轭的方式稳定自身结构,从而阻断自由基链式反应 ATSHH DRSA 沙鱼[53] TAGHPGTH ORAC 鲮鱼[54] NHRYDR和GNRGFACRHA DRSA、HRSA 马鲭鱼和黄鱼[3] Asp(D)和Lys(L) Asp的羧基O原子、Lys的羧基O原子和它的氨基N原子 KGDPGLSPGK 金属离子螯合 太平洋鳕鱼[64] Arg(R) Arg的侧链能提供氢原子与ABTS自由基发生反应 GLFGPR
和GATGPQGPLGPRABTS 鲈鱼[55] Arg能通过其带电残基与金属离子相互作用,并使金属离子的氧化活性失活 FLGSFL和YEYSR ABTS和FICP 鲷鱼[56] Arg位于靠近N末端第三个位置,GDRGEESGPA在所有肽中具有最强的抗氧化活性 GDRGEESGPA、NHRYDR和GNRGFACRHA DRSA 鲟鱼[57] His(H)、Lys(L)和Arg(R) His、Lys和Arg提供的电荷吸引力、氢键、碳氢键、烷基键和π烷基键有助于VIFFVTMGTPR与Keap1结合,
阻断Nrf2信号通路VIFFVTMGTPR SOD、GSH含量提高,MDA含量降低 黑线鳕鱼[58] Glu(E) Glu的侧链可以提供一个氢原子作为还原剂,猝灭未配对电子和自由基,其可带电性也能中和启动子
金属离子的活性VPR、IEPH、LEEEE、IEEEQ ORAC 赤魟[60] Glu去除H2O2过程中,序列中的Glu通过
产生氧化型GSH来提供
抗氧化活性VE DRSA 扁舵鲣[43] Glu(E)和Asp(D) Glu通过其侧链的带电基团排斥带有负电荷的自由基 WMFDW和EMGPA DRSA、SRSA、HRSA和还原力 鲣鱼[62] Glu(E)和His(H) Glu的羧基、His的羧基和氨基 EPAH 金属离子螯合 扁舵鲣[67] Asn(N)和Asp(D) Asp和Asn使肽具有优秀的金属离子螯合能力 PGMLGGSPPGLLGGSPP DRSA和FICP 黑鱼[78] Glu(E)/Gln(Q)或
Asp(D)/Asn(N)C末端旁边第二个氨基酸位置是Glu/Gln或Asp/Asn,能更有效地中断氧化链式反应 LVPVAVF、ISTSLPV、MYPGIGDR和ADLVHVQ DRSA 鲢鱼[63] Glu(E)、Asp(D)、Lys(L)和Arg(R) Glu和Asp的羧基,以及Lys和Arg的氨基 DGPSGPKGDR
GETGLFICP 罗非鱼[70] Phe(F) Phe通过电子的共振或离域来稳定各种形式的ROS,将其转化为更稳定的苯氧基 FLNEFLHV DRSA、ABTS 鲑鱼[29] Phe的芳香环可以与羟基自由基反应,生成m-Tyr和o-Tyr WDR和PYFNK DRSA、ABTS、HRSA 路氏双髻鲨[92−93] Tyr(Y) Tyr的抗氧化活性可能与酚基作为氢供体的特殊能力有关 PYSFK、GFGPEL和VGRP DRSA、ABTS、HRSA 草鱼[34] EGL和YGDEY HRSA 罗非鱼[32] Tyr增加了与脂类相互作用的可能,并通过质子捐赠清除脂类衍生的自由基 WGDAGGYY 自由基清除能力和抑制亚油酸自氧化活性 金枪鱼[94] Trp(W) Trp将吲哚基团中的质子捐赠给缺电子的自由基,保持自由基稳定 WAFAPA ABTS 古氏魟[16] Leu(L)和Val(V) Leu和Val的侧链烯丙基氢含有丰富且活性高的氢原子,易与自由基反应 ACFL 抑制多不饱和脂肪酸氧化 马鲭鱼[4] Pro(P) Pro的吡咯环可以增加肽的柔韧性,并且由于其具有较低的电离势,可以猝灭单线态氧 GAGGP DRSA 扁舵鲣[43] Val(V)和Pro(C) 疏水基团可以促进肽与疏水自由基物种的接触 VSSK DRSA 金枪鱼[95] Phe、Trp、Val、Lys、Met、Pro、Leu和His FWKVV和FMPLH HRSA、DRSA、SRSA 鮸[49] 疏水性氨基酸 DLVKVEA DRSA 黑鳗鱼[96] Thr(T) Thr的羟基基团可以提供氢原子 PGGTM DRSA和ORAC 黑鲨鱼[97] ILGATIDNSK DRSA和ABTS 圆鲟[47] TVA ABTS 水牛与牛乳酪[39] Ser(S) Ser的羟基参与了肽的抗氧化过程 WCTSVS 防止DNA损伤和抑制脂质过氧化 印度鱿鱼[48] Gly(G) Gly侧链上的单个氢原子可以充当质子供体,
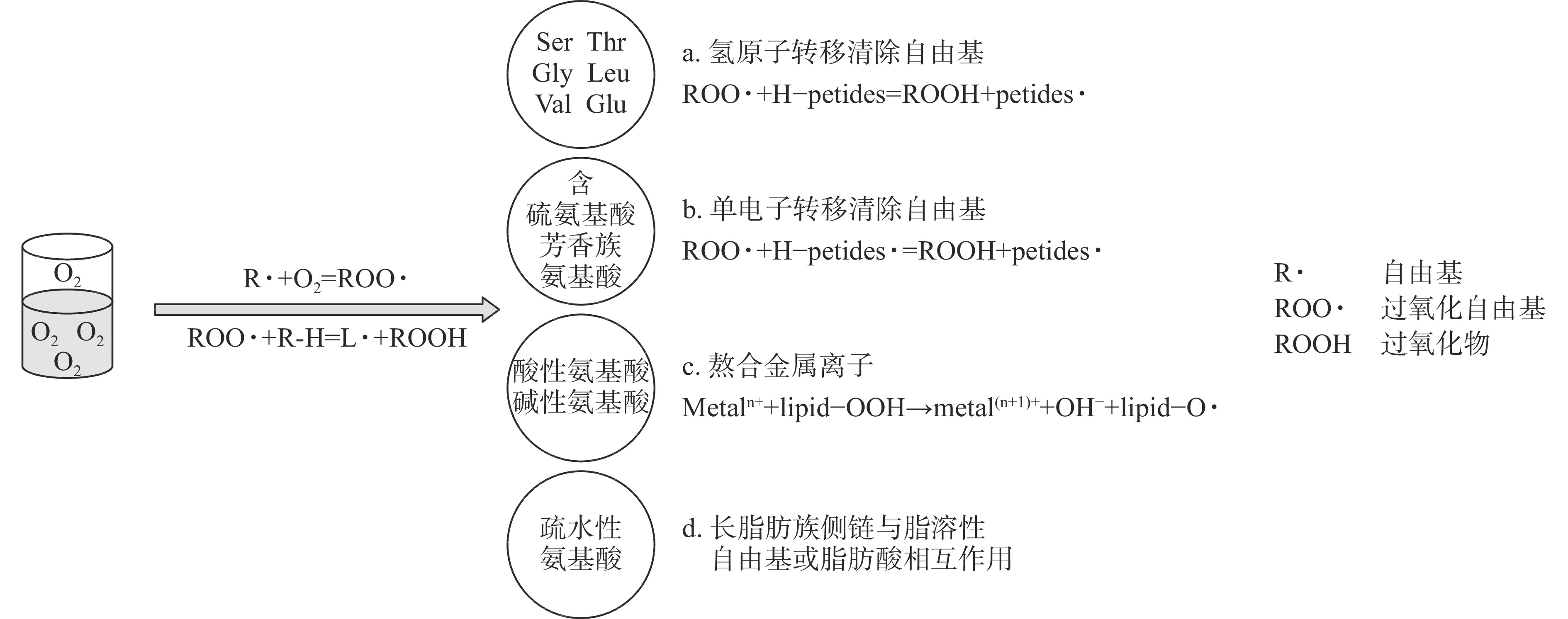
并中和活性自由基IYG DRSA、HRSA和SRSA和还原力 带鱼[42] 因没有一种单一的检测方法能反映抗氧化肽所有的作用机制,其机理包括通过清除自由基、抑制脂质氧化和螯合金属离子、提高氧化防御蛋白和酶的表达等[18]。抗氧化过程中,肽的特殊基团贡献电子与ROS反应,或者由氨基酸提供氢原子,致使氢原子的位置和峰值发生变化,最终清除自由基[11,19-20]。图1反映了各个氨基酸的抗氧化机制,含硫氨基酸和疏水性氨基酸的抗氧化机制都包括a、b和d,芳香族氨基酸的抗氧化机制包括a和b,部分中性氨基酸的抗氧化机制包括a,碱性氨基酸包括a、b和c,酸性氨基酸包括a和c。本文综述了国内外鱼类及其副产物蛋白抗氧化肽的结构对自由基和金属离子的影响,重点梳理总结了抗氧化肽的关键作用位点和官能团对其作用机制的影响,以期对体外合成高活性抗氧化肽指出新的发展方向和提高副产物利用价值。
1. 一级结构与清除自由基能力的关系
1.1 含硫氨基酸
Met和Cys是侧链拥有巯基(sulfhydryl group,-SH)的氨基酸,-SH的暴露可以增强肽清除自由基的能力[21]。Met是一种高度疏水的氨基酸,其抗氧化机制既包括图1中的b和d途径。鲈鱼蛋白肽GGGAGMLLK(Gly-Gly-Gly-Ala-Gly-Met-Leu-Leu-Lys)序列中的Met结构的S原子可以提供电子从而被氧化成Met亚砜[22],Met因具有共振结构而能维持抗氧化的稳定性[22]。安康鱼肌肉蛋白肽LMGQW(Leu-Met-Gly-Gln-Trp)的氧自由基吸收能力(Oxygen radi-cal absorbance ability,ORAC)都高于GSH,序列中的Met是抗氧化肽具备高活性的关键结构[23]。Cys的抗氧化机制包括a和b途径。罗非鱼骨肽DCGY(Asp-Cys-Gly-Tyr)和NYDEY(Asn-Tyr-Asp-Glu-Tyr)对羟基自由基清除活性(hydroxy radical scavenging activity,HRSA)的IC50分别为27.6、38.4 μg/mL,肽DCGY序列中的Cys侧链的-SH提供氢原子与自由基直接作用,使肽DCGY具有更小的IC50值[24]。从鲈鱼肌肉蛋白中鉴定得到的HRDRLCVVQ(His-Arg-Asp-Arg-Leu-Cys-Val-Val-Gln)中Cys具有的-SH能提供活跃的氢原子与自由基直接反应,Cys因具有共振结构而能维持抗氧化的稳定性[22]。此外,三肽CQV(Cys-Gln-Val)、QCV(Gln-Cys-Val)、QVC(Gln-Val-Cys)和QCA(Gln-Cys-Ala)在清除羟基自由基的实验中,Cys的抗氧化机制是通过-SH键的断裂完成的,侧链的-SH失去电子和氢原子后,消灭了自由基[25]。蓝圆鲹肌肉蛋白肽HDHPVC(His-Asp-His-Pro-Val-Cys)和HEKVC(His-Glu-Lys-Val-Cys)的DPPH自由基清除能力(DPPH radical scavenging activity,DRSA)和还原力超过天然抗氧化剂VC和GSH,肽的抗氧化活性与序列中亲水氨基酸Cys和His有关[26]。
1.2 芳香族氨基酸
Phe、Tyr和Trp能通过其芳香环、酚羟基或吲哚基团赋予肽抗氧化活性,它们的作用机制是图1中的b途径,利用单电子转移去除自由基[25],而Tyr的作用机制还包括a途径。Phe的结构中含有芳香环和酚羟基,它可以通过电子的共振或离域来稳定各种形式的ROS,将其转化为更稳定的苯氧基,抑制自由基介导的过氧化链式反应的传播[27-28]。鲑鱼胸鳍蛋白肽FLNEFLHV(Phe-Leu-Asn-Glu-Phe-Leu-His-Val)具有较好的DRSA、ABTS(ABTS radicals scavenging activity,ABTS)自由基清除活性和还原力,肽序列中的Phe作为抗氧化活性位点使肽产生抗氧化效果[29]。Tyr在结构上与p-香豆酸相似,p-香豆酸是一种芳香环上存在一个羟基且具有强抗氧化活性的酚类化合物[30]。肽链中Tyr的抗氧化机制是其酚羟基能作为氢供体清除自由基,而且Tyr也对目标疏水蛋白有很强亲和力[31]。尼罗罗非鱼皮肽YGDEY(Tyr-Gly-Asp-Glu-Tyr)具有较强HRSA活性,序列中的活性位点是因为C端和N端存在的Tyr[32]。从鲤鱼皮肤蛋白中提取得到的肽AY(Ala-Tyr)具有较好的亚铁离子螯合能力(ferrous ion chelating capacity,FICP)、还原力和DRSA,经过体外消化后具有强稳定性,C端Tyr的存在增强了自由基的清除活性[33]。草鱼皮蛋白肽有PYSFK(Pro-Tyr-Ser-Phe-Lys)、GFGPEL(Gly-Phe-Gly-Pro-Glu-Leu)和VGRP(Val-Gly-Arg-Pro),其中PYSFK具有最强的DRSA和ABTS自由基清除能力,这归功于肽序列的芳香族氨基酸Tyr的酚羟基发挥作用,而肽序列中不含芳香族氨基酸的VGRP的抗氧化能力最弱[34]。Trp是一种侧链有吲哚基团的非极性芳香族氨基酸[35],吲哚基比过氧自由基更稳定,寿命更长,因此任何逆反应或自由基介导的过氧连锁反应的传播都会受到抑制[36]。Trp将吲哚基团中的质子捐赠给缺电子的自由基,从而保持自由基稳定,提高肽的自由基清除活性[36]。古氏魟蛋白肽WAFAPA(Trp-Ala-Phe-Ala-Pro-Ala)比GSH有更强的抗氧化活性,其中Trp发挥了重要作用[16]。
1.3 部分疏水性氨基酸
疏水性氨基酸包括Leu、Val、Gly、Pro、Met、Phe、Trp、Ala和Ile,疏水性氨基酸有利于提升肽在水油介质中的溶解度[16],增加对脂溶性自由基或多不饱和脂肪酸的可及性和相互作用[37-38],促进质子向脂质衍生的自由基的递送过程,抑制氧化损伤的产生[36]。如图1的作用机制d所示,含有Leu和Ala的肽的抗氧化能力归因于它的长脂族侧链[35],能够与易感脂肪酸的酰基链发生相互作用,马鲭鱼内脏肽ACFL(Ala-Cys-Phe-Leu)含有Leu和Ala,其抑制多不饱和脂肪酸的能力高于天然抗氧化剂α-生育酚[4]。此外,Leu和Val的侧链烯丙基氢含有丰富且活性高的氢原子,容易与自由基反应[39],因此,Leu和Val符合图1中a和b抗氧化机制。大黄鱼鱼鳞肽QRPPEPR(Gln-Arg-Pro-Pro-Glu-Pro-Arg)、EKVWKYCD(Glu-Lys-Val-Trp-Lys-Tyr-Cys-Asp)和VGLPGLSGPVG(Val-Gly-Leu-Pro-Gly-Leu-Ser-Gly-Pro-Val-Gly),它们的DRSA清除率分别为55.1%、55.1%和59.1%,肽序列中含有两个Val的VGLPGLSGPVG对DPPH自由基的清除效果最好[40]。
Gly和Pro通过其特殊结构赋予肽抗氧化活性,而且Gly和Pro能影响肽的二级构象[40-41],进而影响功能活性。Gly的抗氧化机制是图1中的a途径,氨基酸作为供氢体,通过转移氢原子清除自由基。Gly侧链由一个氢原子组成,为肽的主链提供高度灵活性,因而改变肽的空间结构。Wu等[41]发现随着合成肽序列PMRGGGGYHY(Pro-Met-Arg-Gly-Gly-Gly-Gly-Tyr-His-Tyr)中Gly的减少,肽键形成的分子内氢键的数量越少,抗氧化肽更多的活性位点暴露出来,ORAC逐渐增强。带鱼肌肉蛋白肽IYG(Ile-Tyr-Gly)之所以具有较高的自由基清除能力、还原能力和亚油酸模型体系中的抑制脂质过氧化能力,是因为Gly侧链上的单个氢原子可以充当质子供体,中和活性自由基,而且其肽链短的优势更容易让肽的活性位点接触到靶点,有助于肽发挥生物活性[42]。Pro可以诱导二级结构弯曲,增加氨基酸发挥作用的可用性[40]。Pro的作用机制是图1中的b途径,利用单电子转移去除自由基。扁舵鲣蛋白肽GAGGP(Gly-Ala-Gly-Gly-Pro)具有较好的DRSA活性[43],序列中的Pro有一个富含电子的吡咯烷酮环,由于其较低的电离势,可以增加肽链的灵活性,也可以淬灭单线态氧[43-44],从路氏双髻鲨软骨蛋白中提取得到含有Pro的肽GPE(Gly-Pro-Glu)在亚油酸模型体系中表现出类似于抗氧化剂BHT的脂质过氧化抑制活性,其芳香侧链在抗氧化反应中充当电子给体[45]。
1.4 部分中性氨基酸
如图1的a途径所示,Asn、Gln、Thr和Ser可以作为氢供体,通过提供氢原子阻碍抗氧化反应。在中性pH环境下,Asn和Gln可以提供氢原子,进而吸引带有正电荷的自由基来增加肽的抗氧化活性[20]。Thr和Ser都可以作为氢供体来中和自由基。黑鲨鱼皮中鉴定得到的含有Thr的五肽PGGTM(Pro-Gly-Gly-Thr-Met)被报道具有强DRSA和ORAC[46]。在圆鲟蛋白中鉴定得到的所有肽中,肽序列中Thr使肽ILGATIDNSK(Ile-Leu-Gly-Ala-Thr-Ile-Asp-Asn-Ser-Lys)具有最强的DRSA和ABTS自由基清除能力[47]。印度鱿鱼寡肽WCTSVS(Trp-Cys-Thr-Ser-Val-Ser)Ser的羟基参与了该肽的抗氧化活性,防止DNA损伤和抑制脂质过氧化[48]。而且,一同分离出的寡肽SVNVPLY(Ser-Val-Asn-Val-Pro-Leu-Tyr)被报道其还原力显著高于YRIVPL(Tyr-Arg-Ile-Val-Pro-Leu)的原因是前者的N端存在Ser[30]。
1.5 碱性氨基酸
His、Lys和Arg是抗氧化肽序列中常见的碱性氨基酸。His的作用机制包括图1中的a、b和c途径[25]。His的咪唑基团和Arg的侧链能提供氢原子与自由基反应,使肽发挥抗氧化作用。His的咪唑基团是抗氧化肽的重要活性位点[28],因为它可以作为氢供体和脂质过氧自由基陷阱[49]。同时His可以通过给电子将自由基转化为稳定分子,同时通过共振结构保持自身的稳定性[50]。而且咪唑的氧化产物是咪唑啉酮,咪唑啉酮也具有抗氧化活性[51]。Chen等[52]发现,采用D-His取代抗氧化肽PHH(Pro-His-His)中的L-His会导致其活性下降,推测这与咪唑环的位置、方向和其供电子能力有关。沙鱼肌肉蛋白肽ATSHH(Ala-Thr-Ser-His-His)序列中含有两个His,在1 mg/mL的浓度下,寡肽对DPPH自由基的清除能力高达90%以上,这归因于His咪唑基团的供质子能力[53]。鲮鱼皮蛋白肽TAGHPGTH(Thr-Ala-Gly-His-Pro-Gly-Thr-His)具有ORAC活性,序列中His的咪唑环提供氢原子,以电子共轭的方式稳定自身结构,从而阻断自由基链式反应[54]。Lys的抗氧化机制如图1中的c途径所示,带正电荷的碱性氨基酸与带相反电荷的金属离子结合,阻碍氧化链式反应的进行。Arg的抗氧化机制包括图1中的a和c途径。Arg的侧链能提供氢原子与ABTS自由基发生反应,海鲈鱼皮肽GLFGPR(Gly-Leu-Phe-Gly-Pro-Arg)和GATGPQGPLGPR(Gly-Ala-Thr-Gly-Pro-Gln-Gly-Pro-Leu-Gly-Pro-Arg)具有较强的抗氧化能力,两个肽的C末端包含的Arg赋予肽抗氧化能力[55]。鲷鱼鱼糜肽FLGSFL(Phe-Leu-Gly-Ser-Phe-Leu)和YEYSR(Tyr-Glu-Tyr-Ser-Arg)具有较强的ABTS自由基清除能力和FICP,这是因为序列中的Arg能通过其带电残基与金属离子相互作用,并使金属离子失去氧化活性[56]。鲟鱼皮蛋白肽GDRGEESGPA(Gly-Asp-Arg-Gly-Glu-Glu-Ser-Gly-Pro-Ala)是鉴定中获得的所有肽中具有最强的DRSA活性的肽[57],Arg在肽序列中的存在和位置决定了肽的抗氧化活性,当Arg位于靠近N末端的第三个位置时具有较好抗氧化活性[3],而其他肽具有较低DRSA活性的原因是序列中缺乏Arg。除了图1中的抗氧化机制外,His、Lys和Arg也具有细胞内抗氧化能力,董丽莎等[58]采用分子对接发现黑线鳕鱼皮中鉴定的肽VIFFVTMGTPR(Val-Ile-Phe-Phe-Val-Thr-Met-Gly-Thr-Pro-Arg)与Keap1蛋白结合最稳定,序列中的His、Lys和Arg所提供的电荷吸引力、氢键、碳氢键、烷基键和π烷基键有助于二者紧密结合,阻断核转录因子(NF-E2-related factor 2,Nrf2)信号通路,实现对人表皮角质形成细胞(HaCaT)的抗氧化保护效应。
1.6 酸性氨基酸
酸性氨基酸包括Glu和Asp,其抗氧化机制如图1的a和c途径所示,Glu和Asp既能清除自由基,还能螯合金属离子,减弱金属离子的促氧化作用,抵抗脂质氧化[20]。Glu的侧链还可以提供一个氢原子作为还原剂,猝灭自由基[59]。赤魟软骨蛋白肽VPR(Val-Pro-Arg)、IEPH(Ile-Glu-Pro-His)、LEEEE(Leu-Glu-Glu-Glu-Glu)和IEEEQ(Ile-Glu-Glu-Glu-Gln)具有强自由基清除能力,序列中的Glu是肽的主要活性位点[60]。甲鲶鱼水解液的ORAC值与蓝莓、苹果和橙子等水果的ORAC值相似,从中鉴定的多个肽序列都存在IEE(Ile-Glu-Glu)或IEEE(Ile-Glu-Glu-Glu)序列,IEE重复序列是高抗氧化活性的部分原因[61]。扁舵鲣蛋白肽VE(Val-Glu),在去除H2O2过程中,序列中的Glu通过产生氧化型谷胱甘肽(glutathione,GSH)来提供抗氧化活性[43]。鲣鱼鱼头蛋白肽WMFDW(Trp-Met-Phe-Asp-Trp)和EMGPA(Glu-Met-Gly-Pro-Ala),肽序列的Asp和Glu在清除羟基自由基的过程中起着关键作用[62]。鲢鱼肌肉蛋白肽MYPGIGDR(Met-Tyr-Pro-Gly-Ile-Gly-Asp-Arg)和ADLVHVQ(Ala-Asp-Leu-Val-His-Val-Gln)都具有较强DRSA,C末端旁边第二个氨基酸位置是Glu或Asp能更有效地对中断氧化链式反应,减少有害ROS的产生,有助于增强肽的自由基清除活性和还原能力[63]。
2. 一级结构与金属离子螯合能力的关系
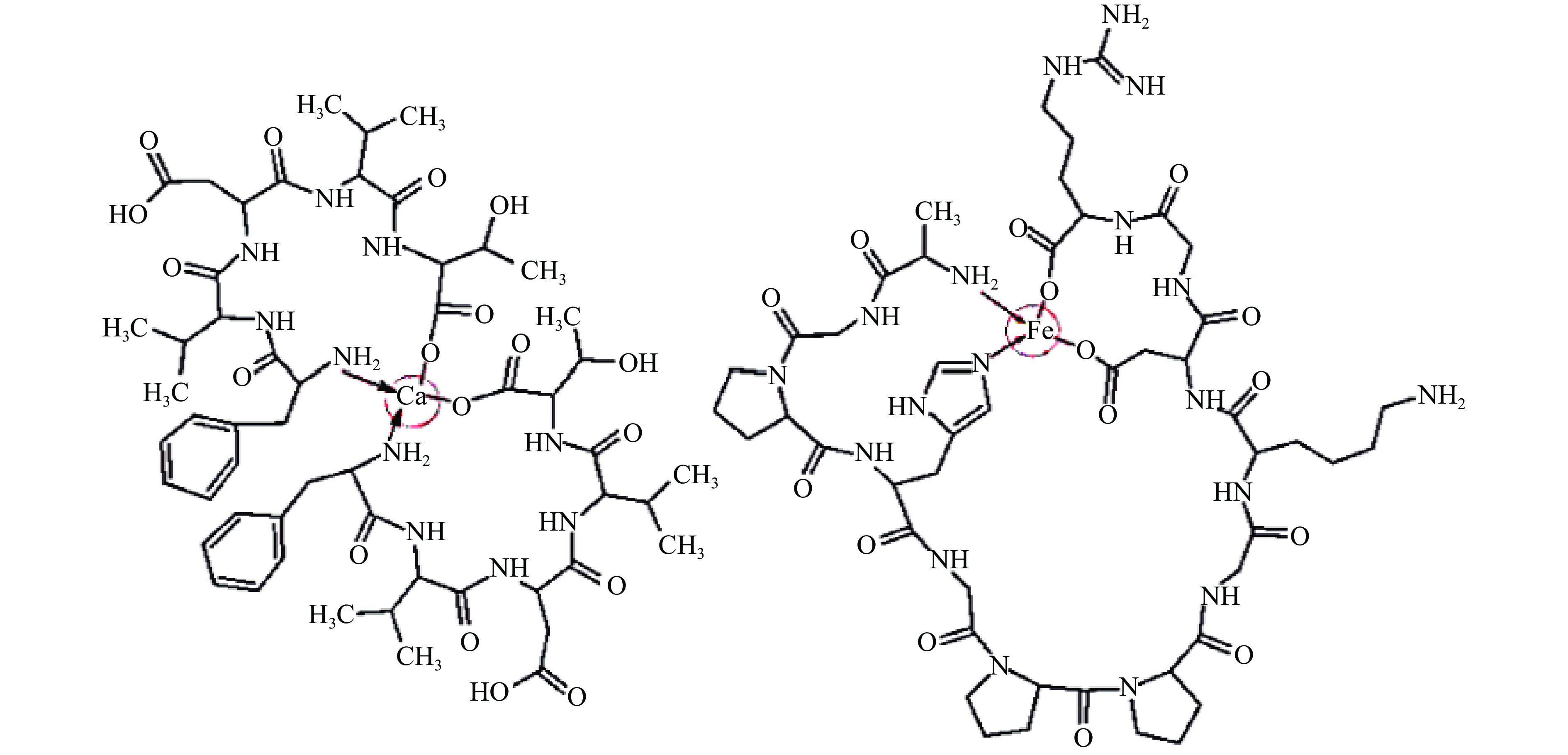
鱼类抗氧化肽容易与Ca2+、Fe2+和Zn2+等金属离子通过配位共价结合或者吸附结合[3,64-66]。金属离子与酸性氨基酸的羧基基团形成离子键,与碱性氨基酸的氨基基团形成配位键[60]。Zhang等[64]从水解太平洋鳕鱼骨中得到与Ca2+结合的KGDPGLSPGK(Lys-Gly-Asp-Pro-Gly-Leu-Ser-Pro-Gly-Lys),通过分子对接技术发现螯合作用的特异性结合位点是Asp-3的羧基O原子、Lys-10的羧基O原子、Lys-10的氨基N原子。Chen等[67]已从扁舵鲣蛋白肽EPAH(Glu-Pro-Ala-His),其Ca2+螯合位点是Glu的羧基、His的羧基和氨基。如图2所示,WALTERS等分别从小麦和太平洋鳕鱼中得到的五肽FVDVT(Phe-Val-Asp-Val-Thr)和十二肽AGPHGPPGKDGR(Ala-Gly-Pro-His-Gly-Pro-Pro-Gly-Lys-Asp-Gly-Arg),其主链上的N端的氨基、C端的羧酸、肽键的C=O基团和His的亚胺基团参与了肽与金属离子的螯合[68]。当前所鉴定的亚铁离子螯合肽的结合位点主要与亲水性氨基酸(Arg、Asn、Asp、Cys、Gln、Glu、His、Lys、Ser、Thr和Tyr)有关[69]。Lin等[70]从罗非鱼皮胰蛋白酶水解液中分离出的4个肽GPAGPAGEK(Gly-Pro-Ala-Gly-Pro-Ala-Gly-Glu-Lys)、DGPSGPKGDR (Asp-Gly-Pro-Ser-Gly-Pro-Lys-Gly-Asp-Arg)、GLPGPSGEEGKR(Gly-Leu-Pro-Gly-Pro-Ser-Gly-Glu-Glu-Gly-Lys-Arg)和DGPSGPKGDRGETGL(Asp-Gly-Pro-Ser-Gly-Pro-Lys-Gly-Asp-Arg-Gly-Glu-Thr-Gly-Leu)都具有FICP,Fe2+主要与肽序列中Glu和Asp的羧基,以及Lys和Arg的氨基结合。Sampath等[3]从马鲭鱼和黄鱼中分别鉴定得到肽NHRYDR(Asn-His-Arg-Tyr-Asp-Arg)和GNRGFACRHA(Gly-Asn-Arg-Gly-Phe-Ala-Cys-Arg-His-Ala)具有同天然抗氧化剂EDTA活性相当的FICP,而且NHRYDR在亚油酸体系中的抗氧化能力超过天然抗氧化剂a-生育酚,两个肽的抗氧化活性主要是其序列中His的贡献。Mendis等[71]从巨型乌贼中鉴定的肽FDSGPAGVL(Phe-Asp-Ser-Gly-Pro-Ala-Gly-Val-Leu)和NEPLQAGQPGQPGR(Asn-Gly-Pro-Leu-Gln-Ala-Gly-Gln-Pro-Gly-Glu-Arg)没有金属离子螯合能力,这似乎是肽序列中缺少His的缘故。郭洪辉等[65]利用紫外光谱发现河豚皮寡肽与Zn2+的结合位点是C=O和N-C-O。此外,位于N端的Pro弯曲肽的二级结构的特点能增强肽作为金属离子螯合剂的能力[72],而且富含Pro的肽因为具有空间位阻,能抵抗消化,增强肽作为金属离子螯合剂的稳定性[73]。
氨基酸侧链的基团与金属离子螯合活性有关,带正电的碱性氨基酸侧链上的羧基失去氧原子与金属离子形成络合物[60],带负电的酸性氨基酸侧链上的氨基失去氮原子,氮原子未共享的电子对与金属离子结合,酸性氨基酸螯合Fe2+的还原方式与抗坏血酸类似[61],生成具有三齿结构的稳定铁螯合物[73]。碱性氨基酸的羧基、Asp的游离γ-羧基和Glu的游离δ-羧基与金属离子结合[73],His的咪唑环、Cys的巯基、Trp的吲哚基和Thr的羟基[1]以及Ser的羟基[74]可以提供额外的金属离子结合位点。
3. 二级结构与抗氧化活性的关系
肽的二级结构包括α-螺旋、β-折叠、β-转角、无规卷曲。来源于β-乳球蛋白的多肽WYSLAMAASDI(Trp-Tyr-Ser-Leu-Ala-Met-Ala-Ala-Ser-Asp-Ile)的ORAC活性比抗氧化剂BHA强,而且相对应的等摩尔游离氨基酸的混合物具有更高活性,而寡肽YVEEL(Tyr-Val-Glu-Glu-Leu)却正好相反,其氨基酸混合物的ORAC比寡肽低2倍[75]。这说明肽键或者肽链的空间结构既可能降低也可能提高多肽的抗氧化活性。
3.1 α-螺旋结构
α-螺旋主要通过羰基氧(-CO)和氨基氢(NH-)两种基团之间的分子内氢键形成,氨基酸越多的肽更容易形成α-螺旋结构[28]。α-螺旋结构区域具有较高的两亲性,有助于肽在界面发挥抗氧化作用[76]。α-螺旋在肽的抗氧化能力中发挥着关键作用,鲑鱼皮水解液具有较好的自由基清除能力,采用红外光谱分析其二级结构,其中α-螺旋含量占比最高,无规卷曲含量占比最低,水解液的ABTS、HRSA和超氧自由基清除活性(superoxide anion radical scavenging capacity,SRSA)分别为1.86、1.65和2.72 mg/mL[77]。也有研究结果表现出α-螺旋比例越低,肽具有的抗氧化能力更强。由拉普光谱测定金线鲷肌肉水解物的二级结构,α-螺旋占比最大,为47.88%,无规卷曲占比最小,为10.3%。经200 W超声波处理后,α-螺旋比例降低至0.78%,无规卷曲含量增加至12.33%,酶解产物的DRSA的IC50值降低,说明抗氧化活性增加[12]。
3.2 β-折叠和β-转角结构
β-折叠通过多肽链之间维持稳定性的链间氢键形成,有序结构α-螺旋和β-折叠主要位于蛋白质内部位置,β-转角结构由弱氢键结构产生[12]。肽的抗氧化活性与三维结构特征β-转角的贡献有关,黑鱼消化液中分离出的四个肽具有的β-转角结构的占总多肽二级结构的75%,其中鉴定出的肽PGMLGGSPPGLLGGSPP的DRSA活性与GSH相当,肽SDGSNIHFPN的FICP活性与EDTA相当[78]。东方鲀鱼皮和市售鱼皮肽的二级结构主要以β-折叠为主,两种肽再经消化酶水解后,β-折叠和无规卷曲含量降低,α-螺旋和β-转角含量增加,其中市售鱼皮肽的DRSA清除率由7.89%增加到28.77%,而东方鲀鱼皮肽的DRSA清除率减弱,东方鲀鱼皮经过消化,α-螺旋含量的增加造成了其DRSA清除率和总还原能力降低[79]。此外,Yang等[80]认为较高的β-折叠含量和较低的α-螺旋可能与肽的抗氧化活性有一定的相关性。
3.3 无规线圈结构
无规线圈由未折叠构象产生,它与肽链的灵活度有关[12]。关于无规线圈的含量与二级结构的关系不成正比或反比关系,比例高的无规卷曲能使肽的结构更加松散,暴露更多的活性位点,有利于和自由基结合[81]。有序结构向无序结构转变能使肽抗氧化活性增强[82],从三文鱼骨中提取的低聚肽粉具有较强ABTS和还原力,使用紫外光谱和圆二色谱分析其二级结构,α-螺旋和平行式β-折叠含量两类结构占比最小,无规卷曲含量占比最大。经过高压脉冲电场处理后的松仁蛋白肽Ac-QWFCT(Ac表示N端乙酰化Gln),其无规线圈含量与抗氧化活性成相反趋势[83]。当肽的无规卷曲含量为32.5%时,其具有最佳的抗氧化活性。王莹等[84]利用红外光谱、核磁共振光谱、Zeta电位和圆二色谱分析高压脉冲电场处理的寡肽KWFH(Lys-Trp-Phe-His),发现KWFH的羧酸羰基的C=O和苯环的氢质子发生变化,电位改变使二级结构变得更加无序,DRSA清除率较PEF处理前增强了13.92%。
4. 一级结构与肽的相互作用
4.1 氨基酸之间的相互作用
氨基酸或序列的增加或缺失可以增强肽的抗氧化活性,也可以削弱肽的抗氧化活性,这与抗氧化肽的分子量、肽键和氢键有关[85]。Gopinatth等[17]从金枪鱼骨干蛋白中提取出肽APTBP,将其任意一端替换Trp使肽的ABTS活性提高63.1%,而肽的两端都替换Trp后,ABTS活性降低10.3%。肽序列中氨基酸之间的协同效应在其抗氧化活性中发挥重要作用。通过自由基转移反应,被氧化的氨基酸可以将自由基损伤交换到邻近的氨基酸,使反应产物更稳定[86]。Liu等[87]认为肽链中Tyr的酚羟基的活性影响整体的抗氧化性能,当Tyr处于DD(Asp-Asp)或DQ(Gln-Asp)之间时抗氧化活性会增加,因为DD或DQ中的氨基酸侧链的羧酸基团的亲电性削弱了酚羟基的氧电子云密度,还增强了供应和释放氢质子的能力。同样,Bamdad等[86]认为五肽QPYPQ中的P和Y的交替序列对稳定自由基有积极作用。Najafian等[88]在罗马鱼(L. plantarum)水解液中鉴定了与之有相同结构基序PYP(Pro-Tyr-Pro)的肽AIPPHPYP(Ala-Ile-Pro-Pro-His-Pro-Tyr-Pro),此肽的DRSA、ABTS和还原力的IC50分别为1.38、0.873和0.456 mg/mL。因此,肽序列中的氨基酸存在的相互作用对肽的活性有一定影响,其影响程度还有待进一步研究。
4.2 肽之间的相互作用
单个肽与混合肽的抗氧化活性不同,古氏魟蛋白肽WAFAPA(Trp-Ala-Phe-Ala-Pro-Ala)和MYPGLA(Met-Tyr-Pro-Gly-Leu-Ala)清除ABTS自由基的实验值大于计算的理论值,两个肽之间潜在的协同作用能帮助它们在功能性食品中发挥更好的抗氧化作用[16]。同样,在半鳍鳀鱼肽NKVKGELD、EMSAGLHE和WRKKDPLND中,尽管单个肽NKVKGELD的DRSA活性很弱,但它与其他两个肽分别组合后的抗氧化活性增强[89]。金线鱼鱼糜多肽FLGSFLYEYSR的ABTS自由基清除率为2.448 mmol/L Trolox,与一同分离出的其他肽组合后,混合物的抗氧化能力降至1.962 mmol/L Trolox[56]。Halim等[90]在实验中发现,10000 Da的鳗鱼蛋白超滤液的DRSA活性超过了3000和5000 Da超滤液,尽管许多研究人员认为超滤液的分子量与其抗氧化活性成负相关[91],但多个肽的相互作用说明分子量不是唯一影响混合肽抗氧化活性的因素。
5. 结论
抗氧化肽的活性归因于其立体空间结构,一级结构中氨基酸基团、酸碱性、亲疏水性、相互作用和二级结构对抗氧化肽活性产生重要影响。His、Arg、Lys、Glu和Asp作为极性带电氨基酸可以吸引带有异性电荷的自由基和金属离子,赋予肽抗氧化能力。含硫氨基酸的巯基,芳香族氨基酸的苯环、酚羟基、吲哚基团,部分疏水性氨基酸的长脂肪族侧链,部分中性氨基酸的羟基,酸性氨基酸和碱性氨基酸的羧基这些官能团都对抗氧化肽的活性有显著影响。具体来说,Gly,Asp、Glu、Leu、Val、Cys、Ser、Thr、Arg、Tyr和Glu清除自由基的作用机制是提供氢原子。Ile、Leu、Ala、Lys、Val和Met等疏水性氨基酸的抗氧化作用机制主要是清除脂类自由基和增强水油界面的溶解度,延缓脂质氧化。Met、Tyr、Trp、His、Phe、Pro和Trp的作用机制是通过提供电子稳定自由基。
酶法水解破坏了鱼类肌肉和副产物蛋白的构造,活性部位暴露与整体抗氧化活性增强有关。多种因素如蛋白酶、酶解条件、酶解方式和辅助酶解手段被认为是控制复杂酶解过程的关键,由于蛋白酶对原料蛋白的可及性和切割肽键的特异性,导致获得的抗氧化肽的结构有差异。根据各种蛋白酶的酶切位点,掌握肽的构效关系可以预测合适的蛋白酶水解蛋白质释放出具有强活性抗氧化肽的可能性,可以提高鱼类副产物利用价值和打破抗氧化肽工厂化生产壁垒。
鱼类抗氧化肽的结构鉴定不仅局限于鉴定氨基酸序列和二级结构,还应深入开发新型鉴定结构的方法。阐明肽与其抗氧化活性的构效关系,能够降低成本和增加经济效益。此外,未来探究多肽链的氨基酸增加、减少、替换等修饰处理,以及探究氨基酸序列、位置、组成和侧链糖基化程度对抗氧化活性的影响,有助于为抗氧化肽的应用提供理论基础,指导新型抗氧化肽开发市场。此外,利用生物信息学技术和同源建模方法对肽的氨基酸序列进行分析,能够更好地了解其构效关系。研发表征抗氧化肽在细胞中构效关系的相应工具,有助于进一步剖析肽的抗氧化机制,指导抗氧化肽的定制化设计。
-
表 1 抗氧化肽的作用机制
Table 1 Action mechanism of antioxidant peptides
氨基酸 结构特性 肽序列 抗氧化能力 蛋白来源 Cys(C) Cys侧链的-SH提供氢原子与自由基直接作用,Cys因具有共振结构而能维持抗氧化的稳定性 DCGY和NYDEY HRSA 罗非鱼[24] HRDRLCVVQ ORAC、ABTS 鲈鱼[22] Met(M) Met结构的S原子可以提供电子从而被氧化成Met亚砜,Met因具有共振结构而能维持抗氧化的稳定性 GGGAGMLLK ORAC、ABTS 鲈鱼[22] PMRGGGGYHY ORAC 合成肽[41] His(H) His的咪唑环提供氢原子,以电子共轭的方式稳定自身结构,从而阻断自由基链式反应 ATSHH DRSA 沙鱼[53] TAGHPGTH ORAC 鲮鱼[54] NHRYDR和GNRGFACRHA DRSA、HRSA 马鲭鱼和黄鱼[3] Asp(D)和Lys(L) Asp的羧基O原子、Lys的羧基O原子和它的氨基N原子 KGDPGLSPGK 金属离子螯合 太平洋鳕鱼[64] Arg(R) Arg的侧链能提供氢原子与ABTS自由基发生反应 GLFGPR
和GATGPQGPLGPRABTS 鲈鱼[55] Arg能通过其带电残基与金属离子相互作用,并使金属离子的氧化活性失活 FLGSFL和YEYSR ABTS和FICP 鲷鱼[56] Arg位于靠近N末端第三个位置,GDRGEESGPA在所有肽中具有最强的抗氧化活性 GDRGEESGPA、NHRYDR和GNRGFACRHA DRSA 鲟鱼[57] His(H)、Lys(L)和Arg(R) His、Lys和Arg提供的电荷吸引力、氢键、碳氢键、烷基键和π烷基键有助于VIFFVTMGTPR与Keap1结合,
阻断Nrf2信号通路VIFFVTMGTPR SOD、GSH含量提高,MDA含量降低 黑线鳕鱼[58] Glu(E) Glu的侧链可以提供一个氢原子作为还原剂,猝灭未配对电子和自由基,其可带电性也能中和启动子
金属离子的活性VPR、IEPH、LEEEE、IEEEQ ORAC 赤魟[60] Glu去除H2O2过程中,序列中的Glu通过
产生氧化型GSH来提供
抗氧化活性VE DRSA 扁舵鲣[43] Glu(E)和Asp(D) Glu通过其侧链的带电基团排斥带有负电荷的自由基 WMFDW和EMGPA DRSA、SRSA、HRSA和还原力 鲣鱼[62] Glu(E)和His(H) Glu的羧基、His的羧基和氨基 EPAH 金属离子螯合 扁舵鲣[67] Asn(N)和Asp(D) Asp和Asn使肽具有优秀的金属离子螯合能力 PGMLGGSPPGLLGGSPP DRSA和FICP 黑鱼[78] Glu(E)/Gln(Q)或
Asp(D)/Asn(N)C末端旁边第二个氨基酸位置是Glu/Gln或Asp/Asn,能更有效地中断氧化链式反应 LVPVAVF、ISTSLPV、MYPGIGDR和ADLVHVQ DRSA 鲢鱼[63] Glu(E)、Asp(D)、Lys(L)和Arg(R) Glu和Asp的羧基,以及Lys和Arg的氨基 DGPSGPKGDR
GETGLFICP 罗非鱼[70] Phe(F) Phe通过电子的共振或离域来稳定各种形式的ROS,将其转化为更稳定的苯氧基 FLNEFLHV DRSA、ABTS 鲑鱼[29] Phe的芳香环可以与羟基自由基反应,生成m-Tyr和o-Tyr WDR和PYFNK DRSA、ABTS、HRSA 路氏双髻鲨[92−93] Tyr(Y) Tyr的抗氧化活性可能与酚基作为氢供体的特殊能力有关 PYSFK、GFGPEL和VGRP DRSA、ABTS、HRSA 草鱼[34] EGL和YGDEY HRSA 罗非鱼[32] Tyr增加了与脂类相互作用的可能,并通过质子捐赠清除脂类衍生的自由基 WGDAGGYY 自由基清除能力和抑制亚油酸自氧化活性 金枪鱼[94] Trp(W) Trp将吲哚基团中的质子捐赠给缺电子的自由基,保持自由基稳定 WAFAPA ABTS 古氏魟[16] Leu(L)和Val(V) Leu和Val的侧链烯丙基氢含有丰富且活性高的氢原子,易与自由基反应 ACFL 抑制多不饱和脂肪酸氧化 马鲭鱼[4] Pro(P) Pro的吡咯环可以增加肽的柔韧性,并且由于其具有较低的电离势,可以猝灭单线态氧 GAGGP DRSA 扁舵鲣[43] Val(V)和Pro(C) 疏水基团可以促进肽与疏水自由基物种的接触 VSSK DRSA 金枪鱼[95] Phe、Trp、Val、Lys、Met、Pro、Leu和His FWKVV和FMPLH HRSA、DRSA、SRSA 鮸[49] 疏水性氨基酸 DLVKVEA DRSA 黑鳗鱼[96] Thr(T) Thr的羟基基团可以提供氢原子 PGGTM DRSA和ORAC 黑鲨鱼[97] ILGATIDNSK DRSA和ABTS 圆鲟[47] TVA ABTS 水牛与牛乳酪[39] Ser(S) Ser的羟基参与了肽的抗氧化过程 WCTSVS 防止DNA损伤和抑制脂质过氧化 印度鱿鱼[48] Gly(G) Gly侧链上的单个氢原子可以充当质子供体,
并中和活性自由基IYG DRSA、HRSA和SRSA和还原力 带鱼[42] -
[1] 张红玉, 李会珍, 张天伟, 等. 抗氧化肽作用机制研究进展[J]. 食品安全质量检测学报,2022,13(12):3981−3988. [ZHANG H Y, LI H Z, ZHANG T W, et al. Research progress on the mechanism of antioxidant peptides[J]. Journal of Food Safety & Quality,2022,13(12):3981−3988. ZHANG H Y, LI H Z, ZHANG T W, et al. Research progress on the mechanism of antioxidant peptides[J]. Journal of Food Safety & Quality, 2022, 13(12): 3981-3988.
[2] WOJTUNIK-KULESZA K A, ONISZCZUK A, ONISZCZUK T, et al. The influence of common free radicals and antioxidants on development of Alzheimer's Disease[J]. Biomedicine & Pharmacotherapy,2016,78:39−49.
[3] SAMPATH KUMAR N S, NAZEER R A, JAIGANESH R. Purification and identification of antioxidant peptides from the skin protein hydrolysate of two marine fishes, horse mackerel (Magalaspis cordyla) and croaker (Otolithes ruber)[J]. Amino Acids,2012,42(5):1641−1649. doi: 10.1007/s00726-011-0858-6
[4] SAMPATH KUMAR N S, NAZEER R A, JAIGANESH R. Purification and biochemical characterization of antioxidant peptide from horse mackerel (Magalaspis cordyla) viscera protein[J]. Peptides,2011,32(7):1496−1501. doi: 10.1016/j.peptides.2011.05.020
[5] MA Y, WU Y, LI L. Relationship between primary structure or spatial conformation and functional activity of antioxidant peptides from Pinctada fucata[J]. Food Chemistry,2018,264:108−117. doi: 10.1016/j.foodchem.2018.05.006
[6] LÓPEZ-GARCÍA G, DUBLAN-GARCÍA O, ARIZMENDI-COTERO D, et al. Antioxidant and antimicrobial peptides derived from food proteins[J]. Molecules,2022,27(4):1343. doi: 10.3390/molecules27041343
[7] 王丹, 吴反修, 宋丹丹, 等. 2022中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2022. WANG D, WU B X, SONG D D, et al. 2022 China fisheries statistical yearbook[M]. Beijing: China Agricultural Publishing House, 2022.
[8] 蔡路昀, 马帅, 张宾, 等. 鱼类加工副产物的研究进展及应用前景[J]. 食品与发酵科技,2016,52(5):108−113. [CAI L Y, MA S, ZHANG B, et al. Recent advances and application prospects in the study of by-product of fish processing[J]. Food and Fermentation Science & Technology,2016,52(5):108−113. CAI L Y, MA S, ZHANG B, et al. Recent advances and application prospects in the study of by-product of fish processing[J]. Food and Fermentation Science & Technology, 2016, 52(5): 108-113.
[9] NGO D, VO T, NGO D, et al. Biological activities and potential health benefits of bioactive peptides derived from marine organisms[J]. International Journal of Biological Macromolecules,2012,51(4):378−383. doi: 10.1016/j.ijbiomac.2012.06.001
[10] CHEN Y, CHEN J, CHEN J, et al. Recent advances in seafood bioactive peptides and their potential for managing osteoporosis[J]. Critical Reviews in Food Science and Nutrition,2022,62(5):1187−1203. doi: 10.1080/10408398.2020.1836606
[11] ASHAOLU T J. Antioxidative peptides derived from plants for human nutrition: Their production, mechanisms and applications[J]. European Food Research & Technology,2020,246(5):853−865.
[12] LI Z, WANG J, ZHENG B, et al. Impact of combined ultrasound-microwave treatment on structural and functional properties of golden threadfin bream (Nemipterus virgatus) myofibrillar proteins and hydrolysates[J]. Ultrasonics Sonochemistry,2020,65:105063. doi: 10.1016/j.ultsonch.2020.105063
[13] 康永锋, 康俊霞, 吴文惠, 等. 超声波、微波对鲑鱼肽结构及抗氧化性的影响[J]. 食品工业科技,2013,34(5):66−71. [KANG Y F, KANG J X, WU W H, et al. Study on the effect and structure of ultrasonic and microwave on the antioxidant peptides from salmon[J]. Science and Technology of Food Industry,2013,34(5):66−71. KANG Y F, KANG J X, WU W H, et al. Study on the effect and structure of ultrasonic and microwave on the antioxidant peptides from salmon[J]. Science and Technology of Food Industry, 2013, 34(5): 66-71.
[14] XING L, WANG Z, HAO Y, et al. Marine products as a promising resource of bioactive peptides: Update of extraction strategies and their physiological regulatory effects[J]. Journal of Agricultural and Food Chemistry,2022,70(10):3081−3095. doi: 10.1021/acs.jafc.1c07868
[15] ZHANG Y, HE S, BONNEIL E, et al. Generation of antioxidative peptides from Atlantic sea cucumber using alcalase versus trypsin:In vitro activity, de novo sequencing, and in silico docking for in vivo function prediction[J]. Food Chemistry,2020,306:125581. doi: 10.1016/j.foodchem.2019.125581
[16] WONG F C, XIAO J, ONG M G, et al. Identification and characterization of antioxidant peptides from hydrolysate of blue-spotted stingray and their stability against thermal, pH and simulated gastrointestinal digestion treatments[J]. Food Chemistry,2019,271:614−622. doi: 10.1016/j.foodchem.2018.07.206
[17] GOPINATTH V, BALLINGER E, KWON J. Probing the structure-activity relationship of an antioxidant tuna-backbone derived peptide[J]. Current Developments in Nutrition,2020,4:398.
[18] 韦绪芹, 张建华, 占文婷, 等. 海洋生物源抗氧化活性肽的制备和构效关系[J]. 安徽农业科学,2015,43(25):15−20. [WEI X Q, ZHANG J H, ZHAN W T, et al. Preparation of marine antioxidant peptides and their structure-activity relationship[J]. Journal of Anhui Agricultural Sciences,2015,43(25):15−20. WEI X Q, ZHANG J H, ZHAN W T, et al. Preparation of marine antioxidant peptides and their structure-activity relationship[J]. Journal of Anhui Agricultural Sciences, 2015, 43(25): 15-20.
[19] WU D, SUN N, DING J, et al. Evaluation and structure-activity relationship analysis of antioxidant shrimp peptides[J]. Food Function,2019,10(9):5605−5615. doi: 10.1039/C9FO01280J
[20] 頡宇, 张柏林, 石天玉, 等. 抗氧化肽延缓油脂氧化作用机制研究进展[J]. 中国油脂,2021,46(12):50−55. [JIE Y, ZHANG B L, SHI T Y, et al. Progress on action mechanism of antioxidant peptides delaying lipid oxidation[J]. China Oils and Fats,2021,46(12):50−55. JIE Y, ZHANG B L, SHI T Y, et al. Progress on action mechanism of antioxidant peptides delaying lipid oxidation[J]. China Oils and Fats, 2021, 46(12): 50-55.
[21] ELIAS R J, KELLERBY S S, DECKER E A. Antioxidant activity of proteins and peptides[J]. Critical Reviews in Food Science and Nutrition,2008,48(5):430−441. doi: 10.1080/10408390701425615
[22] 赵翊君, 郑淋, 蔡勇建, 等. 鲈鱼(Lateolabrax japonicus)蛋白抗氧化肽的酶解制备及结构鉴定[J]. 现代食品科技,2018,34(6):168−173. [ZHAO Y J, ZHENG L, CAI Y J, et al. Enzymatic preparation and structural identification of antioxidant peptides from bass protein[J]. Modern Food Science and Technology,2018,34(6):168−173. ZHAO Y J, ZHENG L, CAI Y J, et al. Enzymatic preparation and structural identification of antioxidant peptides from bass protein[J]. Modern Food Science and Technology, 2018, 34(6): 168-173.
[23] CHI C, WANG B, DENG Y, et al. Isolation and characterization of three antioxidant pentapeptides from protein hydrolysate of monkfish (Lophius litulon) muscle[J]. Food Research International,2014,55:222−228. doi: 10.1016/j.foodres.2013.11.018
[24] FAN J, HE J, ZHUANG Y, et al. Purification and identification of antioxidant peptides from enzymatic hydrolysates of tilapia (Oreochromis niloticus) frame protein[J]. Molecules,2012,17(11):12836−12850. doi: 10.3390/molecules171112836
[25] ESFANDI R, WALTERS M E, TSOPMO A. Antioxidant properties and potential mechanisms of hydrolyzed proteins and peptides from cereals[J]. Heliyon,2019,5(4):e1538.
[26] JIANG H, TONG T, SUN J, et al. Purification and characterization of antioxidative peptides from round scad (Decapterus maruadsi) muscle protein hydrolysate[J]. Food Chemistry,2014,154:158−163. doi: 10.1016/j.foodchem.2013.12.074
[27] ROBLET C, AMIOT J, LAVIGNE C, et al. Screening ofin vitro bioactivities of a soy protein hydrolysate separated by hollow fiber and spiral-wound ultrafiltration membranes[J]. Food Research International,2012,46(1):237−249. doi: 10.1016/j.foodres.2011.11.014
[28] WU R, WU C, LIU D, et al. Antioxidant and anti-freezing peptides from salmon collagen hydrolysate prepared by bacterial extracellular protease[J]. Food Chemistry,2018,248:346−352. doi: 10.1016/j.foodchem.2017.12.035
[29] AHN C, KIM J, JE J. Purification and antioxidant properties of octapeptide from salmon byproduct protein hydrolysate by gastrointestinal digestion[J]. Food Chemistry,2014,147:78−83. doi: 10.1016/j.foodchem.2013.09.136
[30] BAMDAD F, AHMED S, CHEN L. Specifically designed peptide structures effectively suppressed oxidative reactions in chemical and cellular systems[J]. Journal of Functional Foods,2015,18:35−46. doi: 10.1016/j.jff.2015.06.055
[31] XIAO Z, LIANG P, CHEN J, et al. A peptide YGDEY from tilapia gelatin hydrolysates inhibits UVB-mediated skin photoaging by regulating MMP-1 and MMP-9 expression in HaCaT cells[J]. Photochem Photobiol,2019,95(6):1424−1432. doi: 10.1111/php.13135
[32] ZHANG Y, DUAN X, ZHUANG Y. Purification and characterization of novel antioxidant peptides from enzymatic hydrolysates of tilapia (Oreochromis niloticus) skin gelatin[J]. Peptides,2012,38(1):13−21. doi: 10.1016/j.peptides.2012.08.014
[33] TKACZEWSKA J, BUKOWSKI M, MAK P. Identification of antioxidant peptides in enzymatic hydrolysates of carp (Cyprinus carpio) skin gelatin[J]. Molecules,2019,24(1):97.
[34] CAI L, WU X, ZHANG Y, et al. Purification and characterization of three antioxidant peptides from protein hydrolysate of grass carp (Ctenopharyngodon idella) skin[J]. Journal of functional foods,2015,16:234−242. doi: 10.1016/j.jff.2015.04.042
[35] TANG X, HE Z, DAI Y, et al. Peptide fractionation and free radical scavenging activity of zein hydrolysate[J]. Journal of Agricultural and Food Chemistry,2010,58(1):587−593. doi: 10.1021/jf9028656
[36] SABEENA F K, ANDERSEN L L, OTTE J, et al. Antioxidant activity of cod (Gadus morhua) protein hydrolysates: Fractionation and characterisation of peptide fractions[J]. Food Chemistry,2016,204:409−419. doi: 10.1016/j.foodchem.2016.02.145
[37] AGRAWAL H, JOSHI R, GUPTA M. Purification, identification and characterization of two novel antioxidant peptides from finger millet (Eleusine coracana) protein hydrolysate[J]. Food Research International,2019,120:697−707. doi: 10.1016/j.foodres.2018.11.028
[38] JI Z, FENG R, MAO J. Separation and identification of antioxidant peptides from foxtail millet (Setaria italica) prolamins enzymatic hydrolysate[J]. Cereal Chemistry,2019,96(6):981−993. doi: 10.1002/cche.10202
[39] SHAZLY A B, HE Z, EL-AZIZ M A, et al. Fractionation and identification of novel antioxidant peptides from buffalo and bovine casein hydrolysates[J]. Food Chemistry,2017,232:753−762. doi: 10.1016/j.foodchem.2017.04.071
[40] CHEN W, HONG Y, JIA Z, et al. Purification and identification of antioxidant peptides from hydrolysates of large yellow croaker (Pseudosciaena crocea) scales[J]. Transactions of the ASABE,2020,63(2):289−294. doi: 10.13031/trans.13693
[41] WU R, HUANG J, HUAN R, et al. New insights into the structure-activity relationships of antioxidative peptide PMRGGGGYHY[J]. Food Chemistry,2021,337:127678. doi: 10.1016/j.foodchem.2020.127678
[42] YANG X, ZHANG L, DING D, et al. Preparation, identification, and activity evaluation of eight antioxidant peptides from protein hydrolysate of hairtail (Trichiurus japonicas) muscle[J]. Marine Drugs, 2019, 17(1): 23.
[43] 瞿瑜杉, 吉宏武, 宋文奎, 等. 扁舵鲣抗氧化肽分离纯化及结构鉴定[J]. 广东海洋大学学报,2022,42(1):113−119. [QU Y S, JI H W, SONG W K, et al. Isolation, purification and structural identification of antioxidant peptides from Auxis thazard[J]. Journal of Guangdong Ocean University,2022,42(1):113−119. QU Y S, JI H W, SONG W K, et al. Isolation, purification and structural identification of antioxidant peptides from Auxis thazard [J]. Journal of Guangdong Ocean University, 2022, 42(1): 113-119.
[44] PAN X, ZHAO Y, HU F, et al. Preparation and identification of antioxidant peptides from protein hydrolysate of skate ( Raja porosa) cartilage[J]. Journal of Functional Foods,2016,25:220−230. doi: 10.1016/j.jff.2016.06.008
[45] LI X, CHI C, LI L, et al. Purification and identification of antioxidant peptides from protein hydrolysate of scalloped hammerhead (Sphyrna lewini) cartilage[J]. Marine Drugs,2017,15(3):61. doi: 10.3390/md15030061
[46] 颜阿娜, 陈声漾, 陈旭, 等. 一种新型抗氧化五肽的纯化、鉴定与表征[J]. 食品科学,2019,40(10):43−49. [YAN A N, CHEN S Y, CHEN X, et al. Purication, identication and characterization of a novel antioxidant pentapeptide[J]. Food Science,2019,40(10):43−49. YAN A N, CHEN S Y, CHEN X, et al. Purication, identication and characterization of a novel antioxidant pentapeptide[J]. Food Science, 2019, 40(10): 43-49.
[47] CHEN H, WANG S, ZHOU A, et al. A novel antioxidant peptide purified from defatted round scad (Decapterus maruadsi) protein hydrolysate extends lifespan in Caenorhabditis elegans[J]. Journal of Functional Foods,2020,68:103907. doi: 10.1016/j.jff.2020.103907
[48] SUDHAKAR S, NAZEER R A. Structural characterization of an Indian squid antioxidant peptide and its protective effect against cellular reactive oxygen species[J]. Journal of Functional Foods,2015,14:502−512. doi: 10.1016/j.jff.2015.02.028
[49] HE Y, PAN X, CHI C, et al. Ten new pentapeptides from protein hydrolysate of miiuy croaker (Miichthys miiuy) muscle: Preparation, identification, and antioxidant activity evaluation[J]. LWT,2019,105:1−8. doi: 10.1016/j.lwt.2019.01.054
[50] SARMADI B H, ISMAIL A. Antioxidative peptides from food proteins: A review[J]. Peptides,2010,31(10):1949−1956. doi: 10.1016/j.peptides.2010.06.020
[51] 郑淋. 抗氧化肽的构效关系及定向制备的研究[D]. 广州: 华南理工大学, 2015. ZHENG L. Study on the structure-activity relationship and targeted preparation of antioxidant peptides[D]. Guangzhou: South China University of Technology, 2015.
[52] CHEN H, MURAMOTO K, YAMAUCHI F, et al. Antioxidant activity of designed peptides based on the antioxidative peptide isolated from digests of a soybean protein[J]. Journal of Agricultural and Food Chemistry,1996,44(9):2619−2623. doi: 10.1021/jf950833m
[53] JANG H L, LICEAGA A M, YOON K Y. Purification, characterisation and stability of an antioxidant peptide derived from sandfish(Arctoscopus japonicus ) protein hydrolysates[J]. Journal of Functional Foods,2016,20:433−442. doi: 10.1016/j.jff.2015.11.020
[54] 武翠玲, 吴日帮, 刘丹, 等. 鲮鱼皮胶原肽的制备及其抗氧化活性的检测[J]. 生物工程学报,2016,32(12):1727−1734. [WU C L, WU R B, LIU D, et al. Preparation and antioxidant activity detection of collagen peptide from Cirrhinus molitorella skin[J]. Chinese Journal of Biotechnology,2016,32(12):1727−1734. WU C L, WU R B, LIU D, et al. Preparation and antioxidant activity detection of collagen peptide from Cirrhinus molitorella skin[J]. Chinese Journal of Biotechnology, 2016, 32(12): 1727-1734.
[55] SAE-LEAW T, KARNJANAPRATUM S, O'CALLAGHAN Y C, et al. Purification and identification of antioxidant peptides from gelatin hydrolysate of seabass skin[J]. Journal of Food Biochemistry,2017,41(3):e12350. doi: 10.1111/jfbc.12350
[56] WIRIYAPHAN C, CHITSOMBOON B, ROYTRAKUL S, et al. Isolation and identification of antioxidative peptides from hydrolysate of threadfin bream surimi processing byproduct[J]. Journal of Functional Foods,2013,5(4):1654−1664. doi: 10.1016/j.jff.2013.07.009
[57] GUI M, GAO L, RAO L, et al. Bioactive peptides identified from enzymatic hydrolysates of sturgeon skin[J]. Journal of the Science of Food and Agriculture,2022,102(5):1948−1957. doi: 10.1002/jsfa.11532
[58] 董丽莎, 李妍妍, 张红燕, 等. 黑线鳕鱼皮胶原蛋白胰蛋白酶酶解多肽对UVB诱导HaCaT光损伤的抑制作用[J]. 食品科学,2018,39(10):185−192. [DONG L S, LI Y Y, ZHANG H Y, et al. Inhibitory effects of peptides derived from tryptic hydrolysate of skin collagen from Melanogrammus aeglefinus on UVB-induced photodamage in HaCaT cells[J]. Journal of Nuclear Agricultural Sciences,2018,39(10):185−192. DONG L S, LI Y Y, ZHANG H Y, et al. Inhibitory effects of peptides derived from tryptic hydrolysate of skin collagen from Melanogrammus aeglefinus on UVB-induced photodamage in HaCaT cells[J]. Journal of Nuclear Agricultural Sciences, 2018, 39(10): 185-192.
[59] NGUYEN V, QIAN Z, LEE B, et al. Fucoxanthin derivatives from Sargassum siliquastrum inhibit matrix metalloproteinases by suppressing NF-κB and MAPKs in human fibrosarcoma cells[J]. ALGAE,2014,29(4):355−366. doi: 10.4490/algae.2014.29.4.355
[60] PAN X, WANG Y, LI L, et al. Four antioxidant peptides from protein hydrolysate of red stingray (Dasyatis akajei) cartilages: Isolation, identification, and in vitro activity evaluation[J]. Marine Drugs,2019,17(5):263. doi: 10.3390/md17050263
[61] GUO Y, MICHAEL N, FONSECA MADRIGAL J, et al. Protein hydrolysate from Pterygoplichthys disjunctivus, armoured catfish, with high antioxidant activity[J]. Molecules,2019,24(8):1628. doi: 10.3390/molecules24081628
[62] ZHANG L, ZHAO G, ZHAO Y, et al. Identification and active evaluation of antioxidant peptides from protein hydrolysates of skipjack tuna (Katsuwonus pelamis) head[J]. Antioxidants,2019,8(8):318. doi: 10.3390/antiox8080318
[63] WANG K, HAN L, HONG H, et al. Purification and identification of novel antioxidant peptides from silver carp muscle hydrolysate after simulated gastrointestinal digestion and transepithelial transport[J]. Food Chemistry,2021,342:128275. doi: 10.1016/j.foodchem.2020.128275
[64] ZHANG K, LI J, HOU H, et al. Purification and characterization of a novel calcium-biding decapeptide from Pacific cod (Gadus Macrocephalus) bone: Molecular properties and calcium chelating modes[J]. Journal of Functional Foods,2019,52:670−679. doi: 10.1016/j.jff.2018.11.042
[65] 郭洪辉, 张怡评, 洪专, 等. 河豚鱼皮胶原寡肽螯合锌的体内体外抗氧化活性研究[J]. 食品工业科技,2021,42(5):66−71. [GUO H H, ZHANG Y P, HONG Z, et al. Industry, study on in vivo and in vitro antioxidant activity of collagen oligopeptide chelated zinc from puffer skin[J]. Science and Technology of Food,2021,42(5):66−71. GUO H H, ZHANG Y P, HONG Z, et al. Industry, study on in vivo and in vitro antioxidant activity of collagen oligopeptide chelated zinc from puffer skin [J]. Science and Technology of Food, 2021, 42(5): 66-71.
[66] 遆光慧, 布冠好. 多肽螯合金属离子产物的研究进展[J]. 食品安全质量检测学报,2022,13(5):1575−1581. [TI G H, BU G H. Research progress of peptide chelating metal ion products[J]. Journal of Food Safety & Quality,2022,13(5):1575−1581. TI G H, BU G H. Research progress of peptide chelating metal ion products[J]. Journal of Food Safety & Quality, 2022, 13(5): 1575-1581.
[67] CHEN M, JI H, ZHANG Z, et al. A novel calcium-chelating peptide purified from Auxis thazard protien hydrolysate and its binding properties with calcium[J]. Journal of Functional Foods,2019,60:103447. doi: 10.1016/j.jff.2019.103447
[68] WALTERS M E, ESFANDI R, TSOPMO A. Potential of food hydrolyzed proteins and peptides to chelate iron or calcium and enhance their absorption[J]. Foods,2018,7(10):172. doi: 10.3390/foods7100172
[69] WU W, YANG Y, SUN N, et al. Food protein-derived iron-chelating peptides: The binding mode and promotive effects of iron bioavailability[J]. Food Research International,2020,131:108976. doi: 10.1016/j.foodres.2020.108976
[70] LIN S, HU X, LI L, et al. Preparation, purification and identification of iron-chelating peptides derived from tilapia (Oreochromis niloticus) skin collagen and characterization of the peptide-iron complexes[J]. Food Science & Technology,2021,149:111796.
[71] MENDIS E, RAJAPAKSE N, BYUN H, et al. Investigation of jumbo squid (Dosidicus gigas) skin gelatin peptides for their in vitro antioxidant effects[J]. Life Sciences,2005,77(17):2166−2178. doi: 10.1016/j.lfs.2005.03.016
[72] BUDSEEKOAD S, YUPANQUI C T, SIRINUPONG N, et al. Structural and functional characterization of calcium and iron-binding peptides from mung bean protein hydrolysate[J]. Journal of Functional Foods,2018,49:333−341. doi: 10.1016/j.jff.2018.07.041
[73] STORCKSDIECK S, BONSMANN G, HURRELL R F. Iron-binding properties, amino acid composition, and structure of muscle tissue peptides from in vitro digestion of different meat sources[J]. Journal of Food Science,2007,72(1):S19−S29. doi: 10.1111/j.1750-3841.2006.00229.x
[74] MUHR L, PONTVIANNE S, SELMECZI K, et al. Chromatographic separation simulation of metal-chelating peptides from surface plasmon resonance binding parameters[J]. Journal of Separation Science,2020,43(11):2031−2041. doi: 10.1002/jssc.201900882
[75] HERNÁNDEZ-LEDESMA B, DÁVALOS A, BARTOLOMÉ B, et al. Preparation of antioxidant enzymatic hydrolysates from α-lactalbumin and β-lactoglobulin. Identification of active peptides by HPLC-MS/MS[J]. Journal of Agricultural and Food Chemistry,2005,53(3):588−593. doi: 10.1021/jf048626m
[76] 贺晓丽, 秦松, 李文军, 等. 海洋生物功能肽构效关系研究进展[J]. 海洋科学,2020,44(12):144−152. [HE X L, QIN S, LI W J, et al. Research progress on structure-activity relationship of marine biological functional peptides[J]. Marine Sciences,2020,44(12):144−152. HE X L, QIN S, LI W J, et al. Research progress on structure-activity relationship of marine biological functional peptides[J]. Marine Sciences, 2020, 44(12): 144-152.
[77] ZHANG X, DAI Z, ZHANG Y, et al. Structural characteristics and stability of salmon skin protein hydrolysates obtained with different proteases[J]. LWT,2022,153:112460. doi: 10.1016/j.lwt.2021.112460
[78] ZHANG J, LI M, ZHANG G, et al. Identification of novel antioxidant peptides from snakehead (Channa argus) soup generated during gastrointestinal digestion and insights into the anti-oxidation mechanisms[J]. Food Chemistry,2021,337:127921. doi: 10.1016/j.foodchem.2020.127921
[79] 曹振海, 乐彩虹, 陶宁萍, 等. 体外模拟消化对暗纹东方鲀鱼皮胶原蛋白肽结构特征及抗氧化活性的影响[J]. 食品与发酵工业,2021,47(23):61−69. [CAO Z H, LE C H, TAO N P, et al. Effects of structural characteristics and antioxidant activity of collagen bioactive peptides from Takifugu obscurus skin during simulated gastrointestinal digestion[J]. Food and Fermentation Industries,2021,47(23):61−69. CAO Z H, LE C H, TAO N P, et al. Effects of structural characteristics and antioxidant activity of collagen bioactive peptides from Takifugu obscurus skin during simulated gastrointestinal digestion[J]. Food and Fermentation Industries, 2021, 47(23): 61-69.
[80] YANG R, WANG J, LIN S, et al. In vitro antioxidant activities of the novel pentapeptides Ser-His-Glu-Cys-Asn and Leu-Pro-Phe-Ala-Met and the relationship between activity and peptide secondary structure[J]. Journal of the Science of Food and Agriculture,2017,97(6):1945−1952. doi: 10.1002/jsfa.8000
[81] MA C, SUN N, ZHANG S, et al. A new dual-peptide strategy for enhancing antioxidant activity and exploring the enhancement mechanism[J]. Food & Function,2019,1(11):7533−7543.
[82] 冯晓文, 赵晓涵, 潘骁琦, 等. 体外模拟消化对海洋鱼骨胶原低聚肽结构和抗氧化活性的影响[J]. 食品与发酵工业,2022,48(5):173−179. [FENG X W, ZHAO X H, PAN X Q, et al. The effect of simulated digestionin vitro on structure and antioxidant activity of marine fish bone collagen oligopeptides[J]. Food and Fermentation Industries,2022,48(5):173−179. FENG X W, ZHAO X H, PAN X Q, et al. The effect of simulated digestion in vitro on structure and antioxidant activity of marine fish bone collagen oligopeptides[J]. Food and Fermentation Industries, 2022, 48(5): 173-179.
[83] YANG R, LI X, LIN S, et al. Identification of novel peptides from 3 to 10 kDa pine nut (Pinus koraiensis) meal protein, with an exploration of the relationship between their antioxidant activities and secondary structure[J]. Food Chemistry,2017,219:311−320. doi: 10.1016/j.foodchem.2016.09.163
[84] 王莹, 邢杰, 李幸芳, 等. 基于FTIR和1H-NMR方法分析高压脉冲电场技术对抗氧化肽KWFH的结构影响[J]. 食品科学,2017,38(1):116−120. [WANG Y, XING J, LI X F, et al. Using FTIR and 1H-NMR to explore the structure of antioxidant peptide KWFH treated by pulsed electric field(PEF)[J]. Food Science,2017,38(1):116−120. WANG Y, XING J, LI X F, et al. Using FTIR and 1H-NMR to Explore the Structure of Antioxidant Peptide KWFH Treated by Pulsed Electric Field(PEF)[J]. Food Science, 2017, 38(1): 116-120.
[85] NGO D, QIAN Z, RYU B, et al. In vitro antioxidant activity of a peptide isolated from Nile tilapia (Oreochromis niloticus) scale gelatin in free radical-mediated oxidative systems[J]. Journal of Functional Foods,2010,2(2):107−117. doi: 10.1016/j.jff.2010.02.001
[86] BAMDAD F, CHEN L. Antioxidant capacities of fractionated barley hordein hydrolysates in relation to peptide structures[J]. Molecular Nutrition & Food Research,2013,57(3):493−503.
[87] LIU H, LIANG J, XIAO G, et al. Active sites of peptides Asp-Asp-Asp-Tyr and Asp-Tyr-Asp-Asp protect against cellular oxidative stress[J]. Food Chemistry,2022,366:130626. doi: 10.1016/j.foodchem.2021.130626
[88] NAJAFIAN L, BABJI A S. Fractionation and identification of novel antioxidant peptides from fermented fish (pekasam)[J]. Journal of Food Measurement and Characterization,2018,12(3):2174−2183. doi: 10.1007/s11694-018-9833-1
[89] SONG R, WEI R, RUAN G, et al. Isolation and identification of antioxidative peptides from peptic hydrolysates of half-fin anchovy (Setipinna taty)[J]. LWT-Food Science and Technology,2015,60(1):221−229. doi: 10.1016/j.lwt.2014.06.043
[90] HALIM N R A, AZLAN A, YUSOF H M, et al. Antioxidant and anticancer activities of enzymatic eel (Monopterus sp) protein hydrolysate as influenced by different molecular weight[J]. Biocatalysis and Agricultural Biotechnology,2018,16:10−16. doi: 10.1016/j.bcab.2018.06.006
[91] CHI C, WANG B, HU F, et al. Purification and identification of three novel antioxidant peptides from protein hydrolysate of bluefin leatherjacket (Navodon septentrionalis) skin[J]. Food Research International,2015,73:124−129. doi: 10.1016/j.foodres.2014.08.038
[92] ZHAO W, LUO Q, PAN X, et al. Preparation, identification, and activity evaluation of ten antioxidant peptides from protein hydrolysate of swim bladders of miiuy croaker (Miichthys miiuy)[J]. Journal of Functional Foods,2018,47:503−511. doi: 10.1016/j.jff.2018.06.014
[93] WANG B, LI Z, CHI C, et al. Preparation and evaluation of antioxidant peptides from ethanol-soluble proteins hydrolysate of Sphyrna lewini muscle[J]. Peptides,2012,36(2):240−250. doi: 10.1016/j.peptides.2012.05.013
[94] SAIDI S, SAOUDI M, BEN A R. Valorisation of tuna processing waste biomass: Isolation, purification and characterisation of four novel antioxidant peptides from tuna by-product hydrolysate[J]. Environmental Science and Pollution Research,2018,25(18):17383−17392. doi: 10.1007/s11356-018-1809-5
[95] 王锐, 张迪雅, 李晔, 等. 金枪鱼暗色肉酶解优势肽鉴定及其体外抗氧化和血管紧张素转换酶抑制活性分析[J]. 食品科学,2020,41(23):91−99. [WANG R, ZHANG D Y, LI Y, et al. Identification of dominant peptides from hydrolyzed tuna dark muscle and their antioxidant and angiotensin-converting enzyme inhibitory activities[J]. Food Science,2020,41(23):91−99. WANG R, ZHANG D Y, LI Y, et al. Identification of dominant peptides from hydrolyzed tuna dark muscle and their antioxidant and angiotensin-converting enzyme inhibitory activities[J]. Food Science, 2020, 41(23): 91-99.
[96] LEE J K, BYUN H. Characterization of antioxidative peptide purified from black eelpout (Lycodes diapterus) hydrolysate[J]. Fisheries and Aquatic Sciences,2019,22:22. doi: 10.1186/s41240-019-0137-0
[97] YANG Q, CAI X, YAN A, et al. A specific antioxidant peptide: Its properties in controlling oxidation and possible action mechanism[J]. Food Chemistry,2020,327:126984. doi: 10.1016/j.foodchem.2020.126984





 下载:
下载:
 下载:
下载:
