Screening of Fermented Strains in Handmade Yogurt in Aksu Region of Xinjiang and Its Fermentation Performance
-
摘要: 具有良好发酵性能的乳酸菌菌株是制备发酵剂的关键因素,而发酵剂是发酵乳品质的决定因素之一,因此,筛选优良发酵性能的菌株对于制备发酵剂至关重要。本研究从新疆阿克苏的三份手工酸奶样品中分离出四株经传代接种后,仍能明显凝乳且性能稳定的菌株,经16S rRNA基因测序结合形态生理鉴定为2株干酪乳杆菌(Lactobacillus casei)q8-1与q28-2,1株副干酪乳杆菌(Lactobacillus paracasei)R22-2和1株乳酸片球菌(Pediococcus acidilactici)q4-1。对分离出的这四株菌与实验室前期筛选出具有凝乳稳定性的戊糖片球菌(Pediococcus pentosaceus)K5-2,保加利亚乳杆菌(Lactobacillus bulgaricus)7-1,嗜热链球菌(Streptococcus thermophilus)A-2在乳品中单菌的生长能力、产酸性能、后酸化性能、贮藏过程中的活菌数、感官评定、质构性能以及产香能力进行测定。结果表明,Lactobacillus bulgaricus 7-1发酵性能最佳,其凝乳时间与达到发酵终点时间分别为8与9.5 h,具有高产酸能力与弱的后酸化能力,后熟1 d酸度达97.6 °T,在 4 ℃贮藏20 d后,酸度变化幅度<20 °T,活菌数维持在1×106 CFU/mL 之上;单菌发酵乳的组织状态良好、风味较佳,质构特性良好,硬度、黏稠度、内聚性、黏度指数分别为(60.26±0.11)g,(1209.37±0.62)g·s,(−11.81±0.04)g,(−5.37±0.04)g·s;产香能力突出,后熟1 d后其单菌发酵乳中乙醛和双乙酰含量分别为14.48、1.23 mg/L;Streptococcus thermophilus A-2、Pediococcus pentosaceus K5-2发酵性能较好,满足发酵剂的基本要求。综合研究结果表明Lactobacillus bulgaricus 7-1、Streptococcus thermophilus A-2、Pediococcus pentosaceus K5-2展现出良好的酸乳发酵能力,是具备作为制作酸奶发酵剂的优良菌株。Abstract: The Lactobacillus strains with excellent fermentation performance play a crucial role in the preparation of starter cultures, which has a significant impact on the quality of fermented dairy products. Therefore, to select the Lactobacillus strains with high fermentation performance is essential for the preparation of starter cultures. In this study, four Lactobacillus strains with high stability of milk-clotting after the 10th passage were derived from three samples of Aksu handmade yogurt (a sort of Xinjiang specialty). By means of 16S rRNA sequencing and morphophysiological identification, q8-1 and q28-2 were identified as Lactobacillus casei, R22-2 was identified as Lactobacillus paracasei, and q4-1 was identified as Pediococcus acidilactici. Meanwhile, some other bacteria with the stability of milk-clotting that had been previously selected in the lab including K5-2 (Pediococcus pentosaceus), 7-1 (Lactobacillus bulgaricus) and A-2 (Streptococcus thermophilus) were juxtaposed with these four Lactobacillus strains for performance assessment. In this assessment, a measurement was performed to determine their single-strain growth ability, acid production performance, post-acidification performance, viable cell count (VCC) during storage in diary products, sensory analysis results, texture properties and aroma-producing ability. Results showed that, the Lactobacillus bulgaricus 7-1 had the best fermentation performance with coagulation time and fermentation end times of 8 and 9.5 hours, respectively. It had a high acid yield but a weak capacity for post-acidification. After 1 day of post-ripening, the acidity was 97.6 °T. After 20 days of storage at 4 ℃, the acidity did not vary by more than 20 °T, and the number of viable bacteria remained above 1×106 CFU/mL. Good texture characterized the fermented milk. The firmness, consistency, cohesiveness and index of viscosity were (60.26±0.11) g, (1209.37±0.62) g·s, (−11.81±0.04) g, (−5.37±0.04) g·s, respectively. In the fermented milk, the concentrations of acetaldehyde and diacetyl were 14.48 and 1.23 mg/L, respectively. Good fermentation performance was demonstrated by Streptococcus thermophilus A-2, and Pediococcus pentosaceus K5-2, which also met the fundamental parameters of starter culture. Results showed that Lactobacillus bulgaricus 7-1, Streptococcus thermophilus A-2, and Pediococcus pentosaceus K5-2 had good yoghurt fermentation abilities and could be employed as yoghurt starter cultures.
-
Keywords:
- lactic acid bacteria /
- yogurt /
- screening /
- fermentation characteristics /
- acid-producing capacity /
- texture
-
乳酸菌(Lactic Acid Bacteria,LAB)是一类发酵糖类生成产物为乳酸的耐酸、无芽孢的杆状或者球状革兰氏阳性细菌[1]。数千年来在自然选择与进化作用下,不同地理环境等因素造就了乳酸菌的多样性[2-4]。世界各地均具有地域特色的手工发酵食品,意大利传统奶酪中乳酸菌菌株以Lactobacillus plantarum、Lactobacillus paracasei为主[5];青藏高原5个生态区的传统发酵牦牛奶中,乳酸菌菌株以Lactobacillus delbrueckii、Streptococcus salivarius和Stretpococcus thermophilus为主[6];新疆地区西南部的传统酸牛乳中分离纯化的乳酸菌菌株以Enterococcus faecium为主[7];内蒙古自治区传统发酵乳制品嚼克中分离纯化的乳酸菌菌种以Lactococcus lactis为主[8]。目前世界上许多科研机构成立了微生物菌种库,大型乳制品和发酵剂企业也通过收集区域性的乳酸菌资源,开发了优势乳酸菌和发酵剂,如Lactobacillus rhamnosus GG (LGG), Lactobacillus casei strain Shirota (LcS)[9],是知名度较高的益生菌品牌。
我国新疆聚居着众多的少数民族,依赖于其独特的地理、环境、气候条件,畜牧养殖业多样、丰富的原奶为牧民手工加工各种乳制品提供了充足的原料,孕育了多样的乳酸菌资源,是筛选优良菌种的宝贵资源库。特别是新疆地区生活着世代游牧的民族群体,保留着自制酸乳的习惯,手工酸乳具有鲜明的地域特色和独特的风味[10],通常采用简单消毒后的牛奶加入天然发酵剂(保留的酸乳)在适当温度下发酵10~12 h制作而成[11]。由于自然发酵的酸乳其质量与安全难以控制,从酸乳中筛选出性状优良的乳酸菌发酵剂对新疆地区乳品行业的发展很有必要。
乳酸菌发酵牛奶生产酸乳的过程中发生了许多变化,如酸度降低,质构特性升高,代谢物的产生等[12-13],对反映这些变化的指标进行测定,是筛选良好发酵性能的乳酸菌的关键。因此本研究从新疆阿克苏地区采集手工乳制品,分离野生乳酸菌菌株,测定其在乳品中单菌的生长能力、产酸性能、感官评定、后酸化性能、贮藏过程中的活菌数、质构性能以及产香能力,从而研究乳酸菌的发酵性能,为开发优良的酸乳发酵剂菌株奠定基础。
1. 材料与方法
1.1 材料与仪器
三份手工酸奶制品 采自新疆阿克苏;3株菌株:戊糖片球菌(Pediococcus pentosaceus)K5-2、保加利亚乳杆菌(Lactobacillus bulgaricus)7-1、嗜热链球菌(Streptococcus thermophilus)A-2 自新疆阿克苏地区手工酸奶制品分离出;伊利脱脂乳粉 蛋白质含量50% 市售;无水乙醇(AR) 天津市致远化学试剂厂;琼脂糖(AR) 美国BBI公司;氢氧化钠(AR) 天津市福晨化学试剂厂;琼脂(AR) 鹏程生物技术有限公司;甘油(AR) 天津市化学试剂三厂;10×TaqE Buffer(BR) TAKARA 公司;其余试剂 均为国产分析纯;MRS培养基:蛋白胨 10.0 g,牛肉浸粉 10.0 g,酵母提取物 5 g,柠檬酸二铵 2.0 g,乙酸钠 5.0 g,葡萄糖 20.0 g,K2HPO4 2.0 g;MgSO4·7H2O 0.58 g,MnSO4·4H2O 0.25 g,吐温80 1000 µL,每1 L;M17培养基:大豆蛋白胨5 g、蛋白胨2.5 g、酪蛋白胨2.5 g、酵母提取物2.5 g、牛肉浸粉5 g、乳糖5 g、抗坏血酸钠0.5 g、β-甘油磷酸钠19 g、硫酸镁0.25 g,每1 L 天津市光复精细化工研究所,北京奥博星生物技术有限责任公司,天津市巴斯夫化学试剂厂。
BS224S型万分之一天平 美国Mettler Toledo 公司;Fresco 21型高速冷冻离心机 Thermo公司;LAC-5040S型全自动高压灭菌锅 韩国LabTech公司;BC d-265F型冷藏冷冻箱 荣事达集团;Labcycler PCR扩增仪 (德国)圣欧/SensoQuest公司;Power Pac Universal水平电泳仪、Gel dOC XR凝胶成像系统、SUBCELL GT(20 cm×25 cm)电泳槽 美国BioRad 公司;85-2型精密磁力搅拌器 金坛市恒丰仪器厂;dG520型厌氧培养箱 英国dWS公司;B250型智能数显恒温油水浴锅 上海予卓仪器有限公司;SPX智能生化培养箱 宁波市江南仪器厂;TA.XTPlus质构仪 英国SMS公司;LAB DANCER S25型旋涡振荡器 IKA 公司;CX21型光学显微镜 Olympus公司;MiniBea dbeater-16 16珠磨式组织研磨器 美国Biospec公司;UVmini-1240型紫外分光光度计 日本岛津公司。
1.2 实验方法
1.2.1 乳酸菌的分离纯化
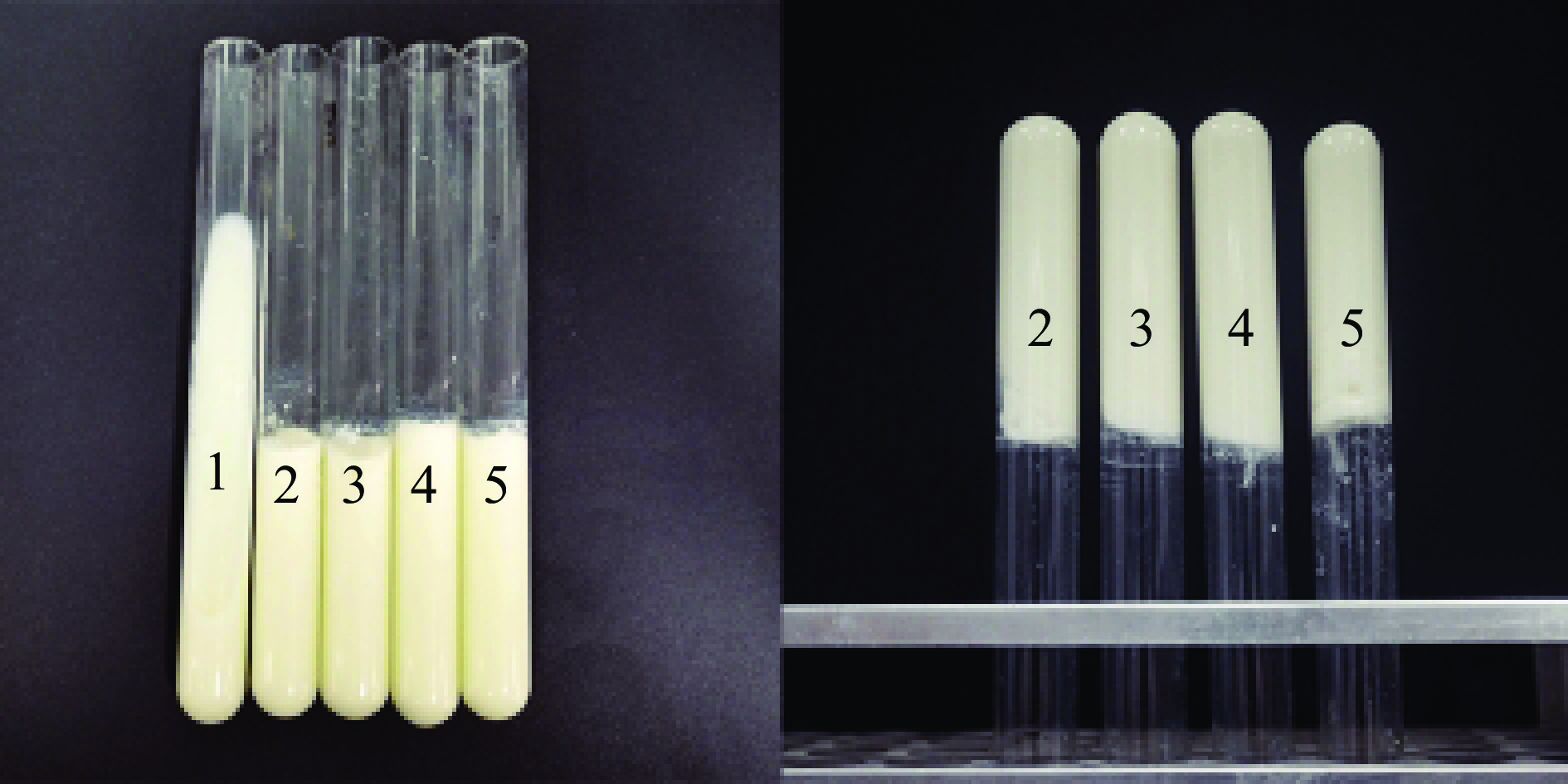
MRS培养基常用于乳酸杆菌的分离,M17培养基可用于乳球菌的分离[14]。使用无菌生理盐水对样品进行梯度稀释,吸取10−5、10−6、10−7稀释液100 µL,用涂布棒在MRS琼脂平板、M17琼脂平板进行涂布,在37 ℃恒温厌氧环境中培养48 h。在每个平板上挑取不同菌落形态的菌落进行3次转接划线后,进行革兰氏染色以及镜检,从而使乳酸菌初步分离纯化,将得到的纯菌株进行凝乳遗传稳定性实验,测定方法参考崔琴[15],活化菌株后,将乳酸菌接种至灭菌脱脂乳中,观察凝乳色泽,组织状态,乳清析出情况等,筛选凝乳状态稳定和传代培养后性能稳定的菌株。
1.2.2 16S rRNA基因的测序分析
对菌株进行16S rRNA基因进行测序分析,确定菌株的种属。使用玻璃珠法提取DNA,并使用通用扩增引物27F (5'-AGA GTT TGA TCC TGG CTC AG-3')和1492R(5'-TAC CTT GTT ACG ACT T-3')对DNA进行基因扩增。扩增条件参考张亚川[16]的条件。对PCR扩增产物进行琼脂糖凝胶电泳检测并送往苏州金唯智生物科技有限公司测序。在NCBI数据库中使用BLAST分析所测基因序列的序列同源性,并使用MEGA v.7.0建立乳酸菌系统发育树。
1.2.3 发酵菌种的筛选
测定分离出的四株乳酸菌与实验室前期从新疆阿克苏地区手工酸奶中筛选出具有凝乳稳定性的戊糖片球菌(Pediococcus pentosaceus)K5-2,保加利亚乳杆菌(Lactobacillus bulgaricus)7-1,嗜热链球菌(Streptococcus thermophilus)A-2的发酵性能。
1.2.3.1 菌株生长规律
将菌株按接种量3%转接至MRS培养基中,并在37 ℃恒温箱中培养。32 h内每隔2 h取菌液测OD600,并根据测得的OD600值绘制生长曲线,观察菌株的生长规律。
1.2.3.2 凝乳时间、发酵终点及酸度的测定
活化菌株后,使用生理盐水洗涤并重新悬浮,按3%的接种量转接至脱脂乳中,混合均匀后在37 ℃下恒温发酵,发现凝乳后立即记录各菌株的凝乳时间,待达到发酵终点(视pH达4.5为发酵终点)时记录时间,并在4 ℃下冷藏1 d,取后熟1 d后的样品测定酸度,酸度测定方法参考GB 5009.239-2016[17]。取10.0 g后熟1 d后发酵乳混匀样品,加入20 mL蒸馏水,混合均匀,加入2 mL 0.5%的酚酞指示剂,用0.1 mol/L的标准氢氧化钠溶液在45 s内滴定至粉红色,且30 s颜色不消退,并记录实验消耗氢氧化钠的体积以及发酵乳的质量。计算公式如下:
式中:X1表示试样的酸度,吉尔涅尔度(°T);C1表示氢氧化钠浓度,mol/L;V1表示滴定时所消耗氢氧化钠标准溶液的体积,mL;V0表示空白实验所消耗氢氧化钠标准溶液的体积,单位为mL;100表示100 g试样;M1表示试样的质量,g;0.1表示酸度理论定义氢氧化钠的摩尔浓度,mol/L。
1.2.3.3 菌株产酸能力的测定
将2株干酪乳杆菌(Lactobacillus casei)q8-1与q28-2,1株副干酪乳杆菌(Lactobacillus paracasei)R22-2和1株乳酸片球菌(Pediococcus acidilactici)q4-1,1株戊糖片球菌(Pediococcus pentosaceus)K5-2,1株保加利亚乳杆菌(Lactobacillus bulgaricus)7-1,1株嗜热链球菌(Streptococcus thermophilus)A-2活化后,使用生理盐水在8000 r/min条件下离心洗涤5 min并重悬,按3%的接种量转接至脱脂乳中,37 ℃发酵培养。每隔2 h取样,测定可滴定酸,测定方法见发酵酸度的测定,并绘制产酸曲线。
1.2.3.4 冷藏期间发酵乳酸度的变化
分别取凝乳后在4 ℃条件下冷藏保存1、5、10、15、20 d的发酵乳样品测定其可滴定酸,测定方法见1.2.3.2发酵酸度的测定,并绘制产酸曲线。
1.2.3.5 冷藏期间发酵乳中活菌数的测定
将在4 ℃条件下冷藏保存1、5、10、15、20 d发酵乳样品分别系列梯度稀释,用平板计数法测其活菌数,并绘制活菌数随时间变化的曲线图。
1.2.3.6 发酵乳的感官评价
组织10名培训后的食品专业学生对单菌发酵乳样品的感官特性进行评定,感官评定标准及方法参考文献[18-19],具体评价标准见表1。
表 1 感官评定标准Table 1. Sensory evaluation standards项目 分值(分) 标准 色泽 2.5 色泽均匀,整体呈微黄色(1.7~2.5) 色泽稍不均匀,整体颜色较浅或过深(0.9~1.6) 色泽黯淡无光(0~0.8) 组织状态 2.5 表面平整,质地光滑细腻且不分层,有少量乳清析出(1.7~2.5) 表面较平整,质地不分层,有少量乳清析出(0.9~1.6) 表面凹凸,质地松散,有大量乳清析出(0~0.8) 气味 2.5 发酵乳特有气味(1.7~2.5) 发酵乳特有气味较淡(0.9~1.6) 有异味(0~0.8) 滋味 2.5 发酵乳滋味明显(1.7~2.5) 发酵乳滋味一般(0.9~1.6) 无发酵乳滋味(0~0.8) 口感 2.5 口感润滑,酸度适中(1.7~2.5) 口感润滑,酸度过酸(0.9~1.6) 口感粗糙,颗粒感明显(0~0.8) 1.2.3.7 发酵乳质构特性测定
评价发酵乳质构特性的重要指标有硬度、粘稠度和内聚性[20],可通过质构分析仪测定。制备好的样品在4 ℃条件下后熟 24 h,使用质构仪测定酸乳样品的硬度、粘稠度、内聚性、粘度指数。测定条件:选用A/BE探头,压力盘直径:45 mm。设置参数:测试前速度2.00 mm/s,测试中速度1.00 mm/s,测试后速度2.00 mm/s,测试深度30.00 mm,感应力:Auto(Force)-2 g。
1.2.3.8 菌株产香能力的测定
取后熟1 d发酵乳测定乙醛和双乙酰的含量。测定方法参照万金敏[21]的方法进行测定。
a.乙醛含量的测定:取适量样品与等体积的TCA(16%)混合均匀,在3500 r/min条件下离心10 min,取上清液25 mL与5 mL NaHSO3溶液(1%)混匀,在黑暗环境中放置1 h,后加入1 mL淀粉溶液(1%),使用0.1 mol/L的碘液滴定至近无色,再使用0.01 mol/L的碘液进行滴定,直至出现淡蓝色且30 s不褪色。加 20 mL 1mol/L 的NaHCO3溶液,振荡混匀后再用浓度为0.01 mol/L的碘液进行滴定直到再次出现淡蓝色,记录消耗碘液的体积,同时做空白实验。乙醛含量计算公式如下:
式中:V2表示空白对照滴定消耗I2标准溶液的体积,mL;V1表示样品滴定消耗I2标准溶液的体积,mL;C表示I2标准溶液的浓度,mL;25表示称取乙醛样品的重量,mL;0.022表示乙醛化学反应基本单位,g。
b.双乙酰含量的测定:双乙酰标准曲线的绘制:取15 µL双乙酰溶于无菌水中,定容至500 mL。分别取双乙酰标准溶液0.0、2.0、4.0、6.0、8.0、10.0 mL各加入2支试管中,使用无菌水补足至10 mL。向不同浓度的6 支试管中加的邻苯二胺溶液(1%)0.5 mL,另外6 支试管不加邻苯二胺溶液,混匀后在黑暗环境中放置30 min,加入4.0 mol/L浓盐酸进行终止反应(加入邻苯二胺的试管加2.0 mL,不加入邻苯二胺的试管加 2.5 mL),混匀后以不加入邻苯二胺的试管为空白对照,使用紫外分光光度计于335 nm波长下测定OD值。以双乙酰浓度为横坐标,OD值为纵坐标绘制标准曲线。根据标准曲线回归方程y=0.1095x+0.0614,R2=0.9997,计算双乙酰含量。
双乙酰含量的测定:取适量样品与等体积的TCA(16%)混合均匀,在3500 r/min条件下离心10 min,取上清液20 mL,等体积加入两个试管中,一管加入邻苯二胺溶液(1%) 0.5 mL,另一管不加,震荡均匀后放置在黑暗环境中 30 min,加入 4.0 mol/L的浓盐酸溶液终止反应(加入邻苯二胺的试管加2.0 mL,不加入邻苯二胺的试管加 2.5 mL),以不加入邻苯二胺的试管为空白对照,测定在波长335 nm下的OD值。
1.3 数据处理
每个指标平行测定三次以上,利用Excel 2021和Spss 26软件对实验数据进行处理,结果表示为平均值±标准偏差。使用 Origin 2021 绘制图表并对结果进行分析。在NCBI数据库中使用BLAST分析所测基因序列的序列同源性,并使用MEGA v.7.0建立乳酸菌系统发育树。
2. 结果与分析
2.1 乳酸菌的分离
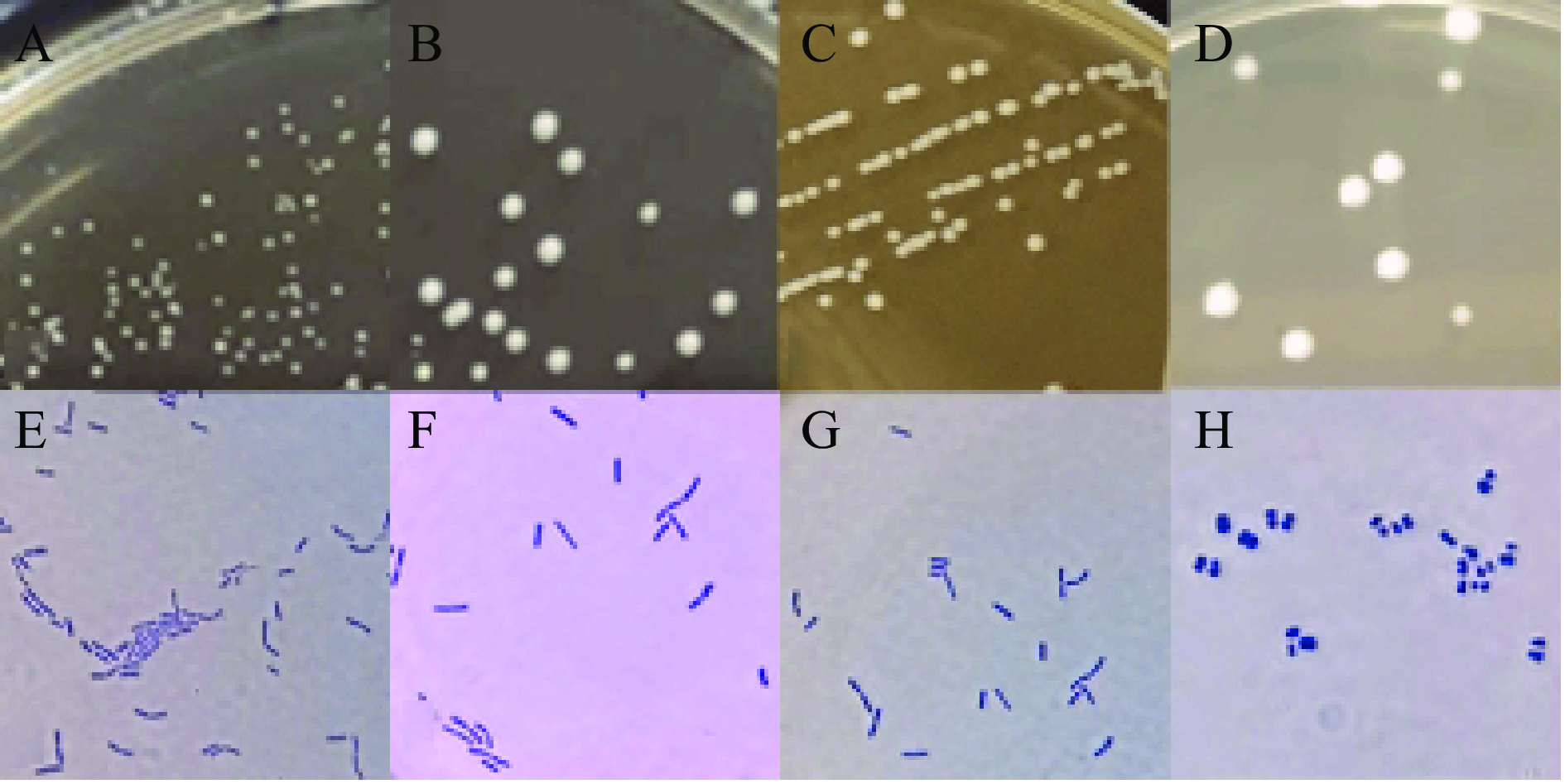
以3个酸奶样品为分离源,利用传统分离方法共分离出53株培养物,通过对菌落形态,镜检,革兰氏染色确定29株疑似菌株,其中具有凝乳遗传稳定性的菌株4株,4株菌的表型特征、显微镜检图片以及凝乳状态的比较如图1、表2和图2所示。
表 2 菌落形态以及菌株形态特征Table 2. Colony morphology and morphological characteristics of strains菌株编号 菌落形态 表面状态 颜色 菌株形态 革兰氏染色 q8-1 圆形扁平 粗糙 白色 杆状 阳性 q28-2 圆形隆起 光滑 乳白色 杆状 阳性 R22-2 圆形隆起 光滑 乳白色 杆状 阳性 q4-1 圆形隆起 粗糙 乳白色 球状 阳性 2.2 乳酸菌的鉴定
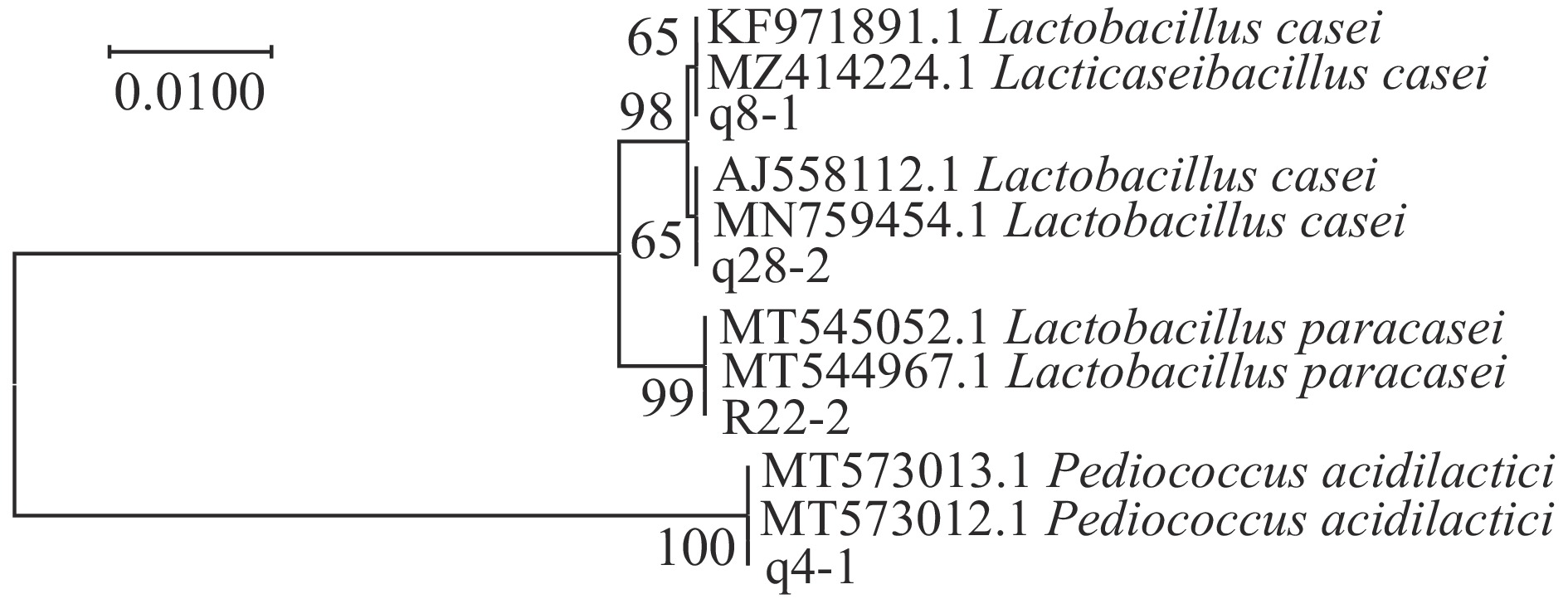
16S rRNA是原核生物中的一种rRNA,可利用恒定区序列设计引物扩增16S rRNA,再利用不同菌株间可变区序列不同进行区分[22],由此建立系统发育树可确定微生物在进化中位置。在NCBI数据库中使用BLAST比对4株菌的16S rRNA基因序列,选取相似性较高的菌株序列构建系统发育树见图3。由该图可知,q8-1、q28-2、R22-2、q4-1分别与Lactobacillus casei、Lactobacillus casei、Lactobacillus paracasei、Pediococcus acidilactici 亲缘关系最近。
2.3 发酵性能测定
2.3.1 菌株生长特性测定
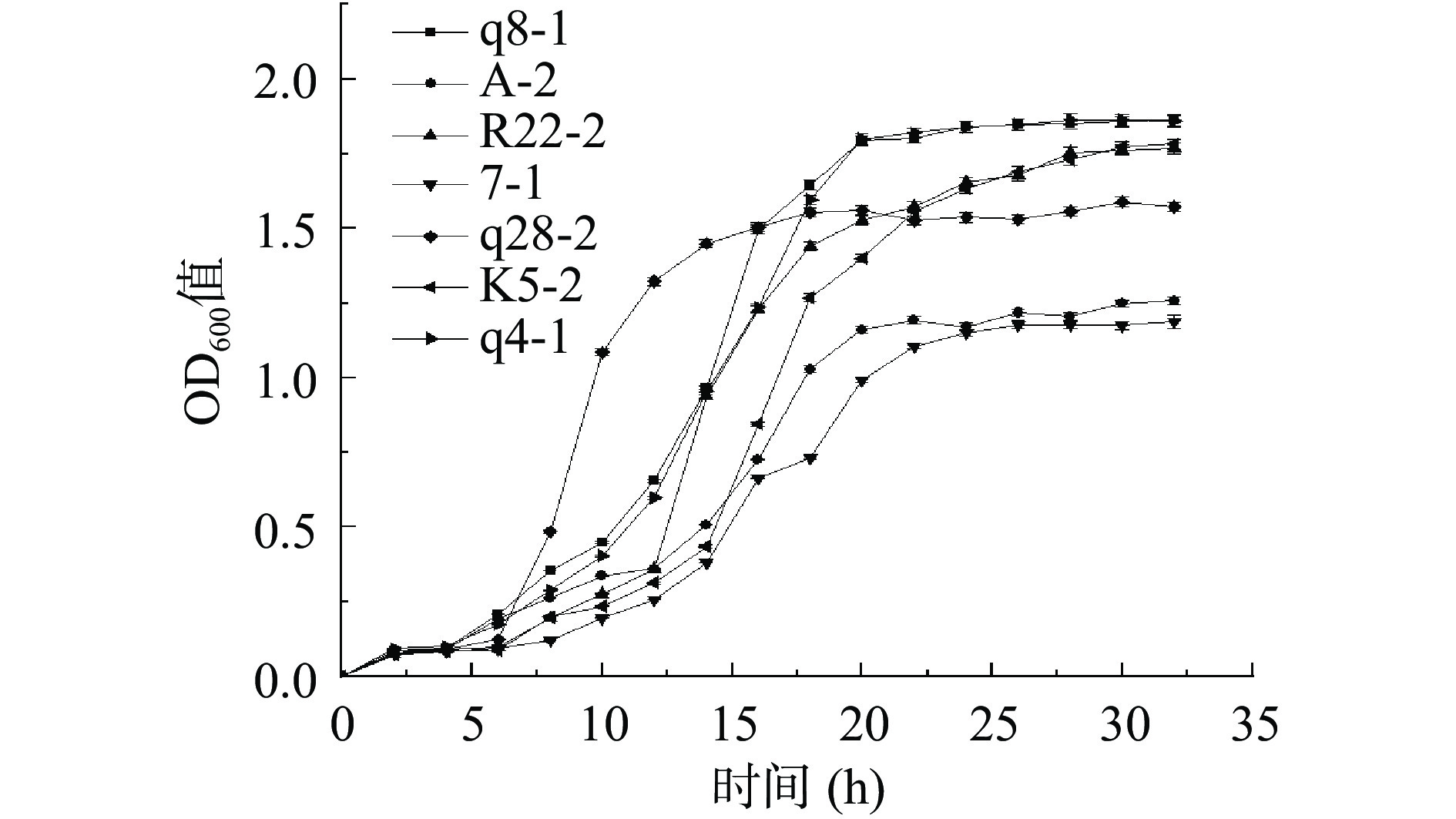
当OD值达到最大时为菌株的最佳收获期[23]。由图4可以看出,所有菌株培养6 h后均进入对数期,菌株q28-2在16 h最先进入稳定期,K5-2与R22-2在24 h左右最后进入稳定期,最终菌株7-1与A-2 OD600值在1.2左右,其余菌株OD600值均大于1.5,表明菌株生长状态良好,可推断得出菌株的最佳收获时间是16~24 h。
2.3.2 凝乳时间、发酵终点及酸度的测定
菌株凝乳时间和达到发酵终点的时间短,可作为发酵剂乳酸菌(SLAB)用于生产中,缩短生产时间;菌株凝乳时间和达到发酵终点的时间长,可考虑其对发酵乳制品风味的作用,作为非发酵剂乳酸菌(NSLAB)用于生产中[24]。由表3可以看出,除q4-1与q28-2外,其他菌株凝乳时间均在8~12 h,展现出良好的凝乳能力。菌株7-1在9.5 h达到发酵终点,展示了良好的发酵产酸能力,菌株q8-1、A-2、K5-2达到发酵终点时间在11~14 h 之间,能力尚可,菌株R22-2、q28-2、q4-1达到发酵终点的时间均大于15 h,时间过长,发酵凝乳能力较差。
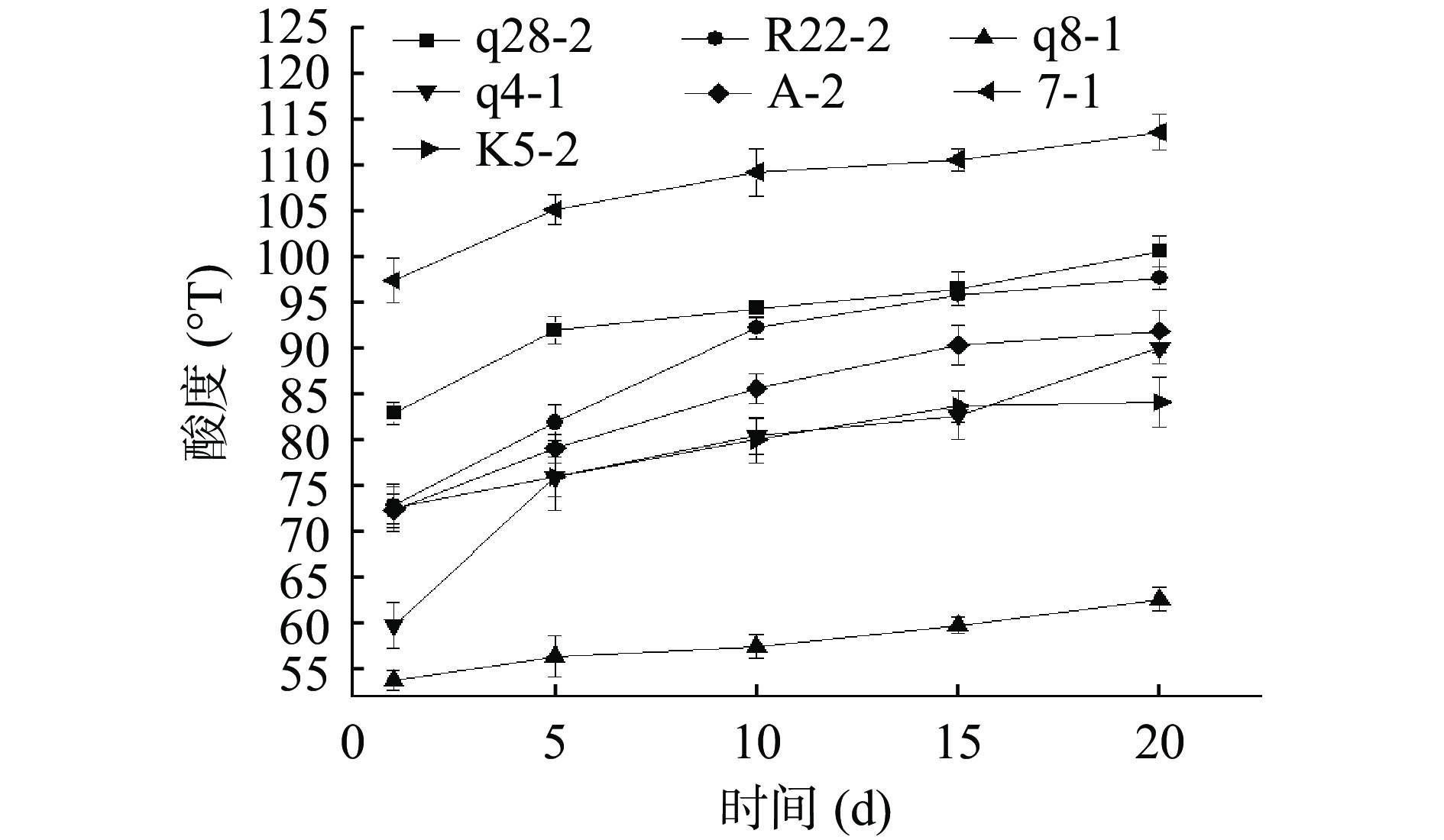
表 3 筛选菌株的凝乳时间、发酵终点及单菌发酵乳后熟1 d的酸度结果Table 3. Coagulation time, fermentation endpoint of selected strains and acidity of single strain fermented milk ripening for 1 d菌株 凝乳时间(h) 发酵终点(h) 酸度(°T) q28-2 16 17.5 73.2 q8-1 10 11.5 83.2 R22-2 12 15.5 54.2 q4-1 15 19 60.2 A-2 10 13.5 72.6 7-1 8 9.5 97.6 K5-2 9 12 72.92 7株菌制备的发酵乳4 ℃冷藏24 h后的酸度见表3,它们均在54~110 °T之间,《食品安全国家标准 发酵乳》中规定发酵乳酸度应大于70 °T,虽然菌株q4-1和R22-2发酵的发酵乳酸度低于70 °T,但是发酵剂为多菌株复配,如果其对质构、风味等特性起积极作用,可与产酸能力强的菌株进行复配,从而弥补凝乳时间长、酸度低的弊端[25]。
2.3.3 菌株产酸性能测定
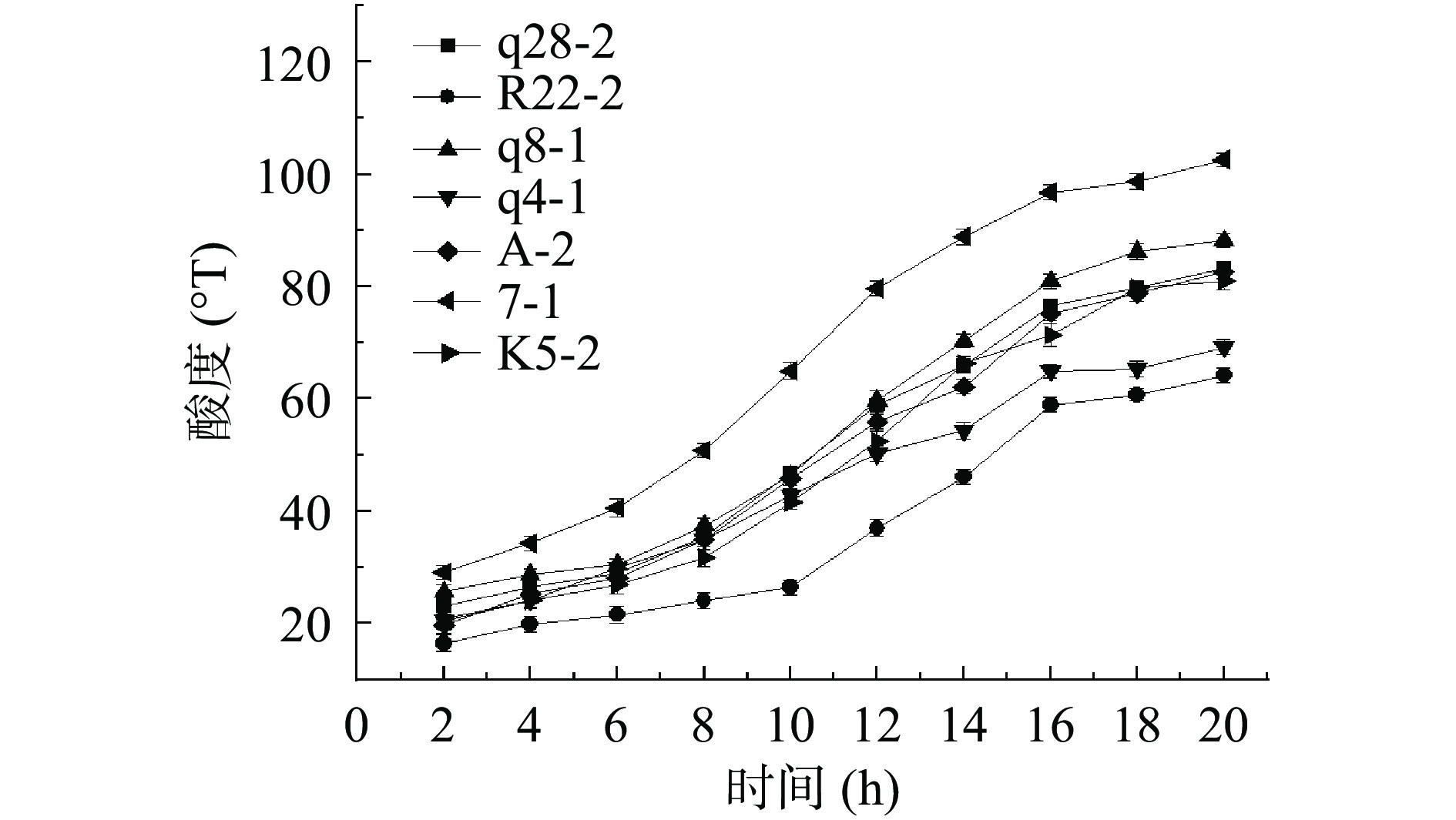
产酸能力高的菌株发酵时间短[26],并且产酸的快慢对酸乳的风味、质构和质量有重要影响。由图5可以看出除菌株R22-2在第10 h酸度才开始迅速增加以外,所有菌株在6 h前酸度增长缓慢,6~16 h产酸速率增快,酸度迅速增长,16 h后酸度增长趋于稳定。菌株7-1在20 h内酸度由29.1 °T上升到102.68 °T,酸度增加73.58 °T,产酸最快;菌株A-2、q8-1、q28-2、K5-2次之,在20 h内酸度分别增加了62.9、62.5、60.2、60.02 °T;菌株q4-1、R22-2产酸速率较慢,在20 h内酸度仅分别增加48.7、47.7 °T,在生产中易造成产品污染,不利于节省成本,不适宜作为发酵剂乳酸菌投入使用。
2.3.4 菌株的后酸化能力
后酸化指发酵乳正常发酵结束后,乳酸菌利用残存的乳糖发酵产酸使发酵乳pH继续下降[27~28],导致发酵乳在贮藏过程中过酸从而使乳清析出,影响发酵乳的感官风味,从而降低消费者的感官喜好度,也会缩短产品的贮藏期[29]。由图6可以看出7株菌的酸度均呈上升趋势,菌株7-1、q8-1、q28-2、K5-2、A-2冷藏过程中酸度变化不大,冷藏过程中酸度变化<20 °T,后酸化能力较弱,可赋予酸乳冷藏过程中较好的稳定性;菌株R22-2酸度仅增加8.8 °T但最终酸度低于65 °T,菌株q4-1酸度增加了30.1 °T,两者保藏过程中有大量乳清析出。
2.3.5 冷藏期间单菌发酵乳活菌数变化
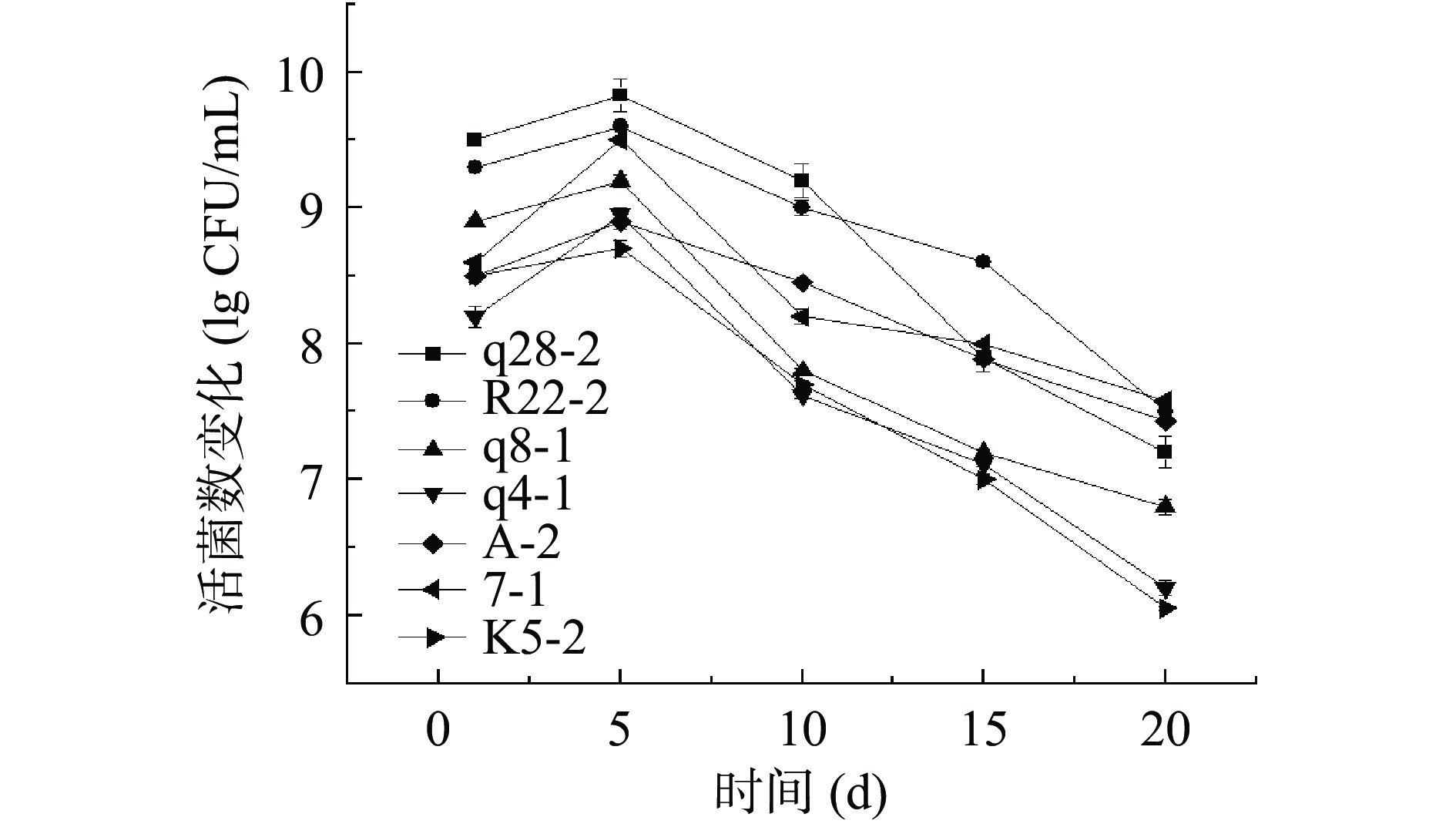
据《食品安全国家标准 发酵乳》相关要求规定,发酵乳中的活菌数必须高于1×106 CFU/mL,并有研究表明发酵乳的活菌数高于1×106 CFU/mL才有发挥益生功能[30]。因此菌株在酸乳保藏过程活性乳酸菌数也是选育发酵剂的一个重要依据。不同菌株制得的发酵乳在保藏过程中的活菌含量变化情况见图7,后熟1 d时,所有菌株活菌数含量均高于108 CFU/mL,在1~5 d内,随时间的延长活菌数增加,表明菌株在贮藏前期仍具有较好的活力,仍能利用残存乳糖生长繁殖;第5 d以后,随贮藏时间的延长,活菌数降低,与贮藏过程中酸度过高和低温抑制乳酸菌生长繁殖有关[31]。贾庆超等[32]发现,乳酸菌在贮藏早期数量增多,第5 d后数量逐渐减少,与本实验结果一致。冷藏20 d后,7株乳酸菌所制得发酵乳最终活菌数在1×106 CFU/mL以上,符合相关指标要求。
2.3.6 单菌发酵乳的感官评定
感官评价是评价酸乳品质的重要指标之一,可反映消费者的喜好和酸乳的受欢迎情况[33]。由表4可知,7株菌株制成的酸乳色泽较好,其色泽整体均匀且呈乳白或微黄色,其中菌株7-1色泽最佳;菌株7-1,q8-1,q28-2,K5-2,A-2表面光滑平整,表面无凹凸不平和裂缝的状态出现,质地细腻并无乳清析出,菌株q8-1,R22-2乳清析出较多;7株菌株均具有酸牛乳特有的气味且无异味,菌株A-2所制酸乳气味最佳;菌株q28-2,7-1,A-2,K5-2制成酸乳滋味明显,无苦涩味或其他异样滋味;在口感方面,菌株R22-2一般,有弱微的颗粒感。综合感官评定结果发现,菌株7-1感官评价总分最高,其余菌株感官评价总分均具有较好的质量品质。
表 4 感官评定结果Table 4. Sensory assessment results菌株 感官评价 色泽 组织状态 气味 滋味 口感 感官评价总分 q28-2 2.23 1.90 1.97 2.13 1.92 10.15 q8-1 2.11 2.30 1.99 1.63 1.77 9.80 R22-2 1.88 1.53 1.75 1.65 1.69 8.50 q4-1 2.14 1.63 1.71 1.65 1.73 8.86 A-2 1.99 1.75 2.15 1.87 1.74 9.50 7-1 2.31 2.39 2.02 2.04 2.26 11.02 K5-2 1.97 1.89 1.73 1.85 2.04 9.38 2.3.7 单菌发酵酸乳质构特性
通过比较各酸乳样品的硬度、黏稠度、内聚性、黏度指数对酸乳的质构特性进行评估,量化比较各物性指标的差异,由表5可知,不同菌株制备的发酵乳在后熟24 h的质构存在差异(P<0.05),其中以硬度、黏稠度、黏度指数受发酵菌株影响较大。发酵乳的硬度是其凝胶结构的特征,硬度大有利于储存和运输,菌株A-2发酵乳在硬度方面突出。7-1黏稠度显著高于其余菌株(P<0.05),黏稠度较高,说明流变特性相对较好[34],胞外多糖(EPS)是发酵乳的重要产黏物质,黏度高可能与胞外多糖的产生有关[35-36],有研究表明,发酵乳黏稠度高可降低乳饮料离心沉淀率,适合生产乳酸菌饮料[37-38]。黏度指数反映发酵乳受温度变化的影响程度[39],7-1黏度指数显著高于其余菌株(P<0.05),则其黏稠度受温度的影响越小。菌株K5-2、q28-2、q4-1、R22-2硬度、稠度以及粘度指数较低,所发酵乳品的质构特性较差。综合比较得出,菌株7-1所制的酸乳质构特性最佳,菌株A-2其次。
表 5 单菌发酵酸乳质构特性Table 5. Texture characteristics of monobacterial fermentation acid milk样品 硬度(g) 黏稠度(g·s) 内聚性(g) 黏度指数(g·s) q4-1 27.68±0.44g 480.48±0.59f −16.21±0.14b −80.50±0.14cd 7-1 60.26±0.11b 1209.37±0.62a −11.81±0.04a −5.37±0.04a A-2 65.14±0.38a 878.69±0.68d −13.67±0.11ab −19.18±015b q28-2 36.50±0.25e 707.28±0.68e −13.20±0.21ab −76.86±0.57c K5-2 30.55±0.24f 452.97±0.76g −15.55±0.11b −17.67±0.41b q8-1 52.33±0.19c 1141.80±0.22b −13.09±0.58ab −18.29±0.44b R22-2 48.76±0.14d 1028.36±0.68c −13.71±0.17ab −87.40±0.74d 注:同列不同字母表示组间差异显著(P<0.05)。 2.3.8 菌株的产香能力
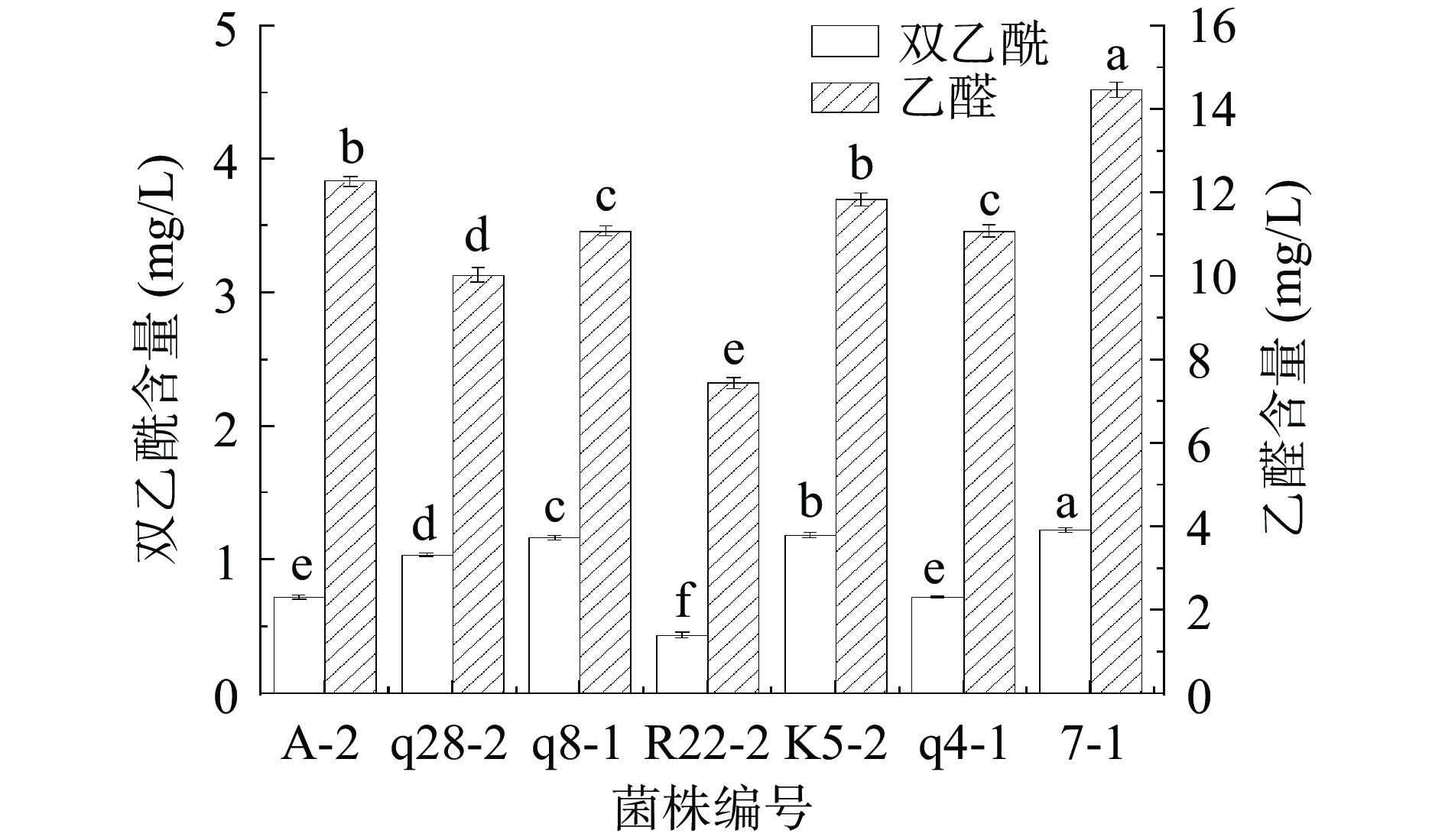
阈值较低的醛类、酮类等对发酵乳风味贡献较大[40],乙醛和双乙酰被认为是发酵乳风味的主要来源[41],可通过测定发酵乳中乙醛和双乙酰的含量对菌株产香能力进行测定。乙醛可为发酵乳提供水果香和奶油香,对发酵乳的风味有巨大作用[42],图8表明,各菌株产乙醛能力7-1>A-2>K5-2>q8-1>q4-1>q28-2>R22-2,有关研究表明,在一定浓度内乙醛含量越高,酸奶的风味越浓[43]。双乙酰可为发酵乳提供奶油香与类似坚果仁的风味[44],各菌株产双乙酰能力7-1>K5-2>q8-1>q28-2>A-2>q4-1>R22-2。一般认为乙醛:双乙酰大于3:1时,发酵乳的风味更好[45],由图8可知,各菌株发酵乳中乙醛:双乙酰均大于3:1。结果表明,7-1单菌发酵乳中乙醛和双乙酰含量均为最高,乙醛和双乙酰含量分别为14.48 、1.23 mg/L,菌株K5-2其次,乙醛和双乙酰含量分别为11.84、1.18 mg/L,产香能力优于其余菌株。
3. 结论
从新疆阿克苏地区采集的手工酸乳中纯化分离出29株疑似乳酸菌,其中4株菌具有稳定凝乳性能,经鉴定菌株q8-1、q28-2、R22-2、q4-1分别为Lactobacillus casei、Lactobacillus casei、Lactobacillus paracasei、Pediococcus acidilactici。本实验对分离出的4株菌株与实验室保藏的3株菌株的凝乳时间、发酵终点、产酸能力、后酸化能力、冷藏期间活菌数、感官特性、质构特性和产香能力进行分析检测,结果表明,菌株q28-2、R22-2、q4-1、q8-1凝乳时间和达到发酵终点的时间过长且质构特性与产香能力差,不满足生产要求。菌株7-1的各个发酵性能指标均为最佳,菌株A-2具有较好的质构特性,K5-2产香能力较为突出。综合各发酵性能指标结果,菌株7-1、A-2、K5-2的凝乳时间和达到发酵终点时间短且具有高产酸能力及弱的后酸化,单菌发酵乳的组织状态良好、风味较佳,且在4 ℃冷藏 20 d后,活菌数维持在1×106 CFU/mL之上,质构特性和产香能力突出,展现出较好的单菌发酵能力,符合优良发酵菌株的基本特征,为后续发酵剂的复配提供了理论依据。
-
表 1 感官评定标准
Table 1 Sensory evaluation standards
项目 分值(分) 标准 色泽 2.5 色泽均匀,整体呈微黄色(1.7~2.5) 色泽稍不均匀,整体颜色较浅或过深(0.9~1.6) 色泽黯淡无光(0~0.8) 组织状态 2.5 表面平整,质地光滑细腻且不分层,有少量乳清析出(1.7~2.5) 表面较平整,质地不分层,有少量乳清析出(0.9~1.6) 表面凹凸,质地松散,有大量乳清析出(0~0.8) 气味 2.5 发酵乳特有气味(1.7~2.5) 发酵乳特有气味较淡(0.9~1.6) 有异味(0~0.8) 滋味 2.5 发酵乳滋味明显(1.7~2.5) 发酵乳滋味一般(0.9~1.6) 无发酵乳滋味(0~0.8) 口感 2.5 口感润滑,酸度适中(1.7~2.5) 口感润滑,酸度过酸(0.9~1.6) 口感粗糙,颗粒感明显(0~0.8) 表 2 菌落形态以及菌株形态特征
Table 2 Colony morphology and morphological characteristics of strains
菌株编号 菌落形态 表面状态 颜色 菌株形态 革兰氏染色 q8-1 圆形扁平 粗糙 白色 杆状 阳性 q28-2 圆形隆起 光滑 乳白色 杆状 阳性 R22-2 圆形隆起 光滑 乳白色 杆状 阳性 q4-1 圆形隆起 粗糙 乳白色 球状 阳性 表 3 筛选菌株的凝乳时间、发酵终点及单菌发酵乳后熟1 d的酸度结果
Table 3 Coagulation time, fermentation endpoint of selected strains and acidity of single strain fermented milk ripening for 1 d
菌株 凝乳时间(h) 发酵终点(h) 酸度(°T) q28-2 16 17.5 73.2 q8-1 10 11.5 83.2 R22-2 12 15.5 54.2 q4-1 15 19 60.2 A-2 10 13.5 72.6 7-1 8 9.5 97.6 K5-2 9 12 72.92 表 4 感官评定结果
Table 4 Sensory assessment results
菌株 感官评价 色泽 组织状态 气味 滋味 口感 感官评价总分 q28-2 2.23 1.90 1.97 2.13 1.92 10.15 q8-1 2.11 2.30 1.99 1.63 1.77 9.80 R22-2 1.88 1.53 1.75 1.65 1.69 8.50 q4-1 2.14 1.63 1.71 1.65 1.73 8.86 A-2 1.99 1.75 2.15 1.87 1.74 9.50 7-1 2.31 2.39 2.02 2.04 2.26 11.02 K5-2 1.97 1.89 1.73 1.85 2.04 9.38 表 5 单菌发酵酸乳质构特性
Table 5 Texture characteristics of monobacterial fermentation acid milk
样品 硬度(g) 黏稠度(g·s) 内聚性(g) 黏度指数(g·s) q4-1 27.68±0.44g 480.48±0.59f −16.21±0.14b −80.50±0.14cd 7-1 60.26±0.11b 1209.37±0.62a −11.81±0.04a −5.37±0.04a A-2 65.14±0.38a 878.69±0.68d −13.67±0.11ab −19.18±015b q28-2 36.50±0.25e 707.28±0.68e −13.20±0.21ab −76.86±0.57c K5-2 30.55±0.24f 452.97±0.76g −15.55±0.11b −17.67±0.41b q8-1 52.33±0.19c 1141.80±0.22b −13.09±0.58ab −18.29±0.44b R22-2 48.76±0.14d 1028.36±0.68c −13.71±0.17ab −87.40±0.74d 注:同列不同字母表示组间差异显著(P<0.05)。 -
[1] MAHATO S, SHAHANI A K. Identifying the diversity of dominant labs from fermented dairy products dahi and yoghurt in eastern region of nepal[J]. Journal of Food Science and Technology Nepal,2019(11):60−64.
[2] LOZUPONE C, KNIGHT R. Unifrac: A new phylogenetic method for comparing microbial communities[J]. Applied and Environmental Microbiology,2005,71(12):8228−8235. doi: 10.1128/AEM.71.12.8228-8235.2005
[3] ELISA G, AGAPI I D, FOTEINI P, et al. Characterization of indigenous lactic acid bacteria in cow milk of the maltese islands: A geographical and seasonal assessment[J]. Microorganisms,2020,8(6):812. doi: 10.3390/microorganisms8060812
[4] YU Zhongjie, PENG Chuantao, KWOK Laiyu, et al. The bacterial diversity of spontaneously fermented dairy products collected in northeast asia[J]. Foods,2021,10(10):2321. doi: 10.3390/foods10102321
[5] PAOLA D, VALENTINA A, KALLIOPI R, et al. Microbial dynamics of Castelmagno PDO, a traditional Italian cheese, with a focus on lactic acid bacteria ecology[J]. International Journal of Food Microbiology,2007,122(3):302−311.
[6] DING Zitong, MI Jiandui, ZHOU Jianwei, et al. Characterization of the microbial community compositions and diversities in the traditional fermented yak milk from different ecotopes on the Qinghai-Tibetan plateau[J]. LWT,2022,156:113027. doi: 10.1016/j.lwt.2021.113027
[7] 杨行. 新疆传统酸奶乳酸菌分离鉴定及在驴乳酸奶研制中的应用[D]. 喀什: 喀什大学, 2020. YANG Hang. Isolation and identification of lactic acid bacteria from Xinjiang traditional yoghurt and its application in the development of donkey lactic acid milk[D]. kashgar: Kashgar University, 2020.
[8] FAN Hui, HUO Rui, ZHAO Jingna, et al. Microbial diversity analysis of jiaoke from Xilingol, Inner Mongolia[J]. Journal of Dairy Science,2020,103(7):5893−5905. doi: 10.3168/jds.2019-17583
[9] 许女, 王佳丽, 陈旭峰, 等. 优良乳酸菌的筛选、鉴定及在酸奶中的应用[J]. 中国食品学报,2019,19(2):98−107. [XU Nu, WANG Jiali, CHEN Xufeng, et al. Screening, identification and application of excellent lactic acid bacteria in yogurt[J]. Chinese Journal of Food Science,2019,19(2):98−107. doi: 10.16429/j.1009-7848.2019.02.013 XU Nu, WANG Jiali, CHEN Xufeng, et al. Screening, identification and application of excellent lactic acid bacteria in yogurt[J]. Chinese Journal of Food Science, 2019, 19(2): 98-107. doi: 10.16429/j.1009-7848.2019.02.013
[10] 陈欢. 新疆哈萨克族传统奶酪中乳酸菌发酵剂的筛选及对奶酪风味影响的研究[D]. 石河子: 石河子大学, 2019. CHEN Huan. Screening of lactic acid bacteria starter in traditional Kazakh cheese in Xinjiang and its influence on cheese flavor[D]. Shihezi: Shihezi University, 2019.
[11] 西热娜依·阿布力克木. 南疆传统发酵酸奶微生物多样性及其乳酸菌生物被膜的研究[D]. 乌鲁木齐: 新疆师范大学, 2017. SIRENAYI A. Study on the microbial diversity of traditional fermented yogurt in southern Xinjiang and its lactic acid bacteria biofilm[D]. Urumchi: Xinjiang Normal University, 2017.
[12] WANG JiCheng, LI ChangKun, XUE JianGang, et al. Fermentation characteristics and angiotensin I-converting enzyme–inhibitory activity of Lactobacillus helveticus isolate H9 in cow milk, soy milk, and mare milk[J]. Journal of Dairy Science,2015,98(6):3655−3664. doi: 10.3168/jds.2015-9336
[13] WANG JiCheng, GUO Zhuang, ZHANG Qing, et al. Effect of probiotic Lactobacillus casei Zhang on fermentation characteristics of set yogurt[J]. International Journal of Dairy Technology,2010,63(1):105−112. doi: 10.1111/j.1471-0307.2009.00556.x
[14] 郭兴华, 凌代文. 乳酸细菌现代研究实验技术[M]. 北京: 科学出版社, 2013. GUO XingHua, Ling DaiWen. Modern research and experimental techniques for lactic acid bacteria[M]. Beijing: Science Press, 2013.
[15] 崔琴. 甘南牧区发酵牦牛酸乳中优良乳酸菌的筛选及发酵性能的研究[D]. 兰州: 甘肃农业大学, 2010. CUI Qin. Screening of excellent lactic acid bacteria in fermented yak yogurt in Gannan pastoral area and study on fermentation performance[D]. Lanzhou: Gansu Agricultural University, 2010.
[16] 张亚川. 伊犁地区乳品中优良发酵菌株的筛选及其发酵性能的研究[D]. 石河子: 石河子大学, 2019. ZHANG Yachuan. Screening of excellent fermented strains in dairy products in Ili region and study on their fermentation properties[D]. Shihezi: Shihezi University, 2019.
[17] 中华人民共和国国家卫生和计划生育委员会. GB 5009.239-2016, 食品安全国家标准 食品酸度的测定[S]. 北京: 中国标准出版社, 2016. National Health and Family Planning Commission of the People's Republic of China. GB 5009.239-2016, National standards for food safety Determination of food acidity[S]. Beijing: China Standards Press, 2016.
[18] 中华人民共和国卫生部. GB 19302-2010, 食品安全国家标准 发酵乳[S]. 北京: 中国标准出版社, 2010. Ministry of Health of the People's Republic of China. GB 19302-2010, National standards for food safety. Fermented milk[S]. Beijing: China Standards Press, 2010.
[19] 李丹丹. 西藏传统牦牛乳制品中抗氧化乳酸菌的筛选及发酵性能研究[D]. 拉萨: 西藏大学, 2020. LI Dandan. Screening and fermentation performance of antioxidant lactic acid bacteria in traditional Yak dairy products in Tibet[D]. Lhasa: Tibet University, 2020.
[20] DU Huaxin, YANG Huaigu, WANG Xuping, et al. Effects of mulberry pomace on physicochemical and textural properties of stirred-type flavored yogurt[J]. Journal of Dairy Science,2021,104(12):12403−12414. doi: 10.3168/jds.2020-20037
[21] 万金敏. 西藏传统发酵乳制品中优良乳酸菌的筛选及发酵性能研究[D]. 咸阳: 西北农林科技大学, 2017. WAN Jinmin. Screening and fermentation properties of excellent lactic acid bacteria in traditional fermented dairy products in Tibet[D]. Xianyang: Northwest A & F University, 2017.
[22] 焦振泉, 刘秀梅. 16s rRNA序列同源性分析与细菌系统分类鉴定[J]. 国外医学(卫生学分册),1998(1):14−18. [JIAO Zhenquan, LIU Xiumei. 16s rRNA sequence homology analysis and bacterial systematic classification identification[J]. Foreign medicine (Health Credits Book),1998(1):14−18. JIAO Zhenquan , LIU Xiumei. 16s rRNA sequence homology analysis and bacterial systematic classification identification[J]. Foreign medicine(Health Credits Book), 1998(1): 14-18.
[23] 张敏. 甘肃牧区传统发酵牦牛乳中乳酸菌的分离鉴定及优良菌株的筛选[D]. 兰州: 甘肃农业大学, 2011. ZHANG Ming. Isolation and identification of lactic acid bacteria in traditional fermented yak milk in pastoral area of Gansu Province and screening of excellent strains[D]. Lanzhou: Gansu Agricultural University, 2010.
[24] GRUJOVIĆ M Ž, MLADENOVIĆ K G, SEMEDOLEMSADDEK T, et al. Advantages and disadvantages of non-starter lactic acid bacteria from traditional fermented foods: Potential use as starters or probiotics[J]. Comprehensive Reviews in Food Science and Food Safety,2022,21(2):1537−1567. doi: 10.1111/1541-4337.12897
[25] 蔡静静, 张亚川, 李谞, 等. 新疆伊犁地区乳制品中乳酸菌发酵和益生特性及其复合发酵方案优化[J]. 食品科学,2020,41(18):172−179. [CAI Jinjin, ZHANG Yachuan, LI Xu, et al. Fermentation and prebiotic characteristics of lactic acid bacteria in dairy products in Ili region of Xinjiang and optimization of their compound fermentation schemes[J]. Food Science,2020,41(18):172−179. doi: 10.7506/spkx1002-6630-20190724-320 CAI Jinjin, ZHANG Yachuan, LI Xu, et al. Fermentation and prebiotic characteristics of lactic acid bacteria in dairy products in Ili region of Xinjiang and optimization of their compound fermentation schemes[J]. Food Science, 2020, 41(18): 172-179. doi: 10.7506/spkx1002-6630-20190724-320
[26] 赵瑞香, 王大红, 牛生洋, 等. 嗜酸乳杆菌发酵乳增酵因子的研究[J]. 食品科学,2005,26(9):126−128. [ZHAO Ruixiang, WANG Dahong, NIU Shengyang, et al. Study of fermented milk fermentation factors of acidophilus acidophilus[J]. Food Science,2005,26(9):126−128. doi: 10.3321/j.issn:1002-6630.2005.09.030 ZHAO Ruixiang, WANG Dahong, NIU Shengyang, et al. Study of fermented milk fermentation factors of acidophilus acidophilus[J]. Food Science, 2005, 26(9): 126-128. doi: 10.3321/j.issn:1002-6630.2005.09.030
[27] PORNPAN J, RUUD V, APINYA A, et al. Isolation and characterization of acid-sensitive Lactobacillus plantarum with application as starter culture for Nham production[J]. Food Microbiology,2010,27(6):741−748. doi: 10.1016/j.fm.2010.03.014
[28] SHAH N P. Probiotic bacteria: selective enumeration and survival in dairy foods[J]. Journal of Dairy Science,2000,83(4):894−907. doi: 10.3168/jds.S0022-0302(00)74953-8
[29] DESHWAL G K, TIWARI S, KUMAR A, et al. Review on factors affecting and control of post-acidification in yoghurt and related products[J]. Trends in Food Science & Technology,2021,109:499−512.
[30] MIJAN M A, CHOI K H, KWAK H S. Physicochemical, microbial, and sensory properties of nanopowdered eggshell-supplemented yogurt during storage[J]. Journal of Dairy Science,2014,97(6):3273−3280. doi: 10.3168/jds.2013-7367
[31] 杨博, 柏吉, 靳亚梅, 等. 新疆地区驴乳源优良乳酸菌发酵剂的筛选及菌株益生特性[J]. 食品科学,2022,43(2):224−232. [YANG Bo, BAI Ji, JIN Yamei, et al. Screening of excellent lactic acid bacteria starter from donkey milk source in Xinjiang and prebiotic characteristics of strains[J]. Food Science,2022,43(2):224−232. doi: 10.7506/spkx1002-6630-20201209-104 YANG Bo, BAI Ji, JIN Yamei, et al. Screening of excellent lactic acid bacteria starter from donkey milk source in Xinjiang and prebiotic characteristics of strains[J]. Food Science, 2022, 43(2): 224-232. doi: 10.7506/spkx1002-6630-20201209-104
[32] 贾庆超, 孔欣欣. 市售酸奶在贮藏过程中品质的变化[J]. 中国乳品工业,2020,48(6):26−30. [JIA Qingchao, KONG Xinxin. Changes in the quality of commercially available yogurt during storage[J]. China's dairy industry,2020,48(6):26−30. doi: 10.19827/j.issn1001-2230.2020.06.006 JIA Qingchao, KONG Xinxin. Changes in the quality of commercially available yogurt during storage[J]. China's dairy industry, 2020, 48(6): 26-30. doi: 10.19827/j.issn1001-2230.2020.06.006
[33] 王磊. 酸乳用乳酸菌的筛选与应用研究[D]. 扬州: 扬州大学, 2021. WANG Lei. Screening and application research of lactic acid bacteria for yogurt[D]. Yangzhou: Yangzhou University, 2021.
[34] 李子叶. 不同酸奶发酵剂的发酵性能及其产品功能活性的研究[D]. 哈尔滨: 东北农业大学, 2019. LI Ziye. Study on the fermentation properties of different yogurt starters and the functional activity of their products[D]. Haerbin: Northeast Agricultural University, 2019.
[35] SHIRANI K, FALAH F, VASIEE A, er al. Effects of incorporation of Echinops setifer extract on quality, functionality, and viability of strains in probiotic yogurt[J]. Journal of Food Measurement and Characterization,2022,16(4):1−9.
[36] TIWARI S, KAVITAKE D, DEVI P B, et al. Bacterial exopolysaccharides for improvement of technological, functional and rheological properties of yoghurt[J]. International Journal of Biological Macromolecules,2021,183:1585−1595. doi: 10.1016/j.ijbiomac.2021.05.140
[37] 陆延, 邵晓园, 李高聪, 等. 发酵粘度对发酵发酵乳饮料稳定性的影响[J]. 中国乳品工业,2019,47(7):52−55. [LU Yan, SHAO Xiaoyuan, LI Gaocong, et al. Effect of fermentation viscosity on the stability of fermented fermented milk beverages[J]. Chinese Dairy Industry,2019,47(7):52−55. LU Yan, SHAO Xiaoyuan, LI Gaocong, et al. Effect of fermentation viscosity on the stability of fermented fermented milk beverages[J]. Chinese Dairy Industry, 2019, 47(7): 52-55.
[38] KONG Xiao, XIAO Ziqun, DU Mengdi, et al. Physicochemical, textural, and sensorial properties of soy yogurt as affected by addition of low acyl gellan gum[J]. Gels,2022,8(7):453. doi: 10.3390/gels8070453
[39] QI Xinyang, LIU Dasong, YUAN Jiajie, et al. Effects of heating temperatures and pH of skim milk fortified with milk protein concentrate on the texture and microstructure of high-protein yoghurts[J]. International Dairy Journal,2022,131:105395. doi: 10.1016/j.idairyj.2022.105395
[40] CHEN C, ZHAO Shanshan, HAO Guangfei, et al. Role of lactic acid bacteria on the yogurt flavour: A review[J]. International Journal of Food Properties,2017,20:S316−S330. doi: 10.1080/10942912.2017.1295988
[41] TIAN Huaixiang, YU Benjie, YU Haiyan, CHEN Chen. Evaluation of the synergistic olfactory effects of diacetyl, acetaldehyde, and acetoin in a yogurt matrix using odor threshold, aroma intensity, and electronic nose analyses[J]. Journal of Dairy Science,2020,103(9):7957−7967. doi: 10.3168/jds.2019-17495
[42] GEZGINC Y, TOPCAL F, COMERTPAY S, et al. Quantitative analysis of the lactic acid and acetaldehyde produced by Streptococcus thermophilus and Lactobacillus bulgaricus strains isolated from traditional Turkish yogurts using HPLC[J]. Journal of Dairy Science,2015,98(3):1426−1434.
[43] 刘宁宁, 郭红敏, 葛春美, 等. 酸奶中乙醛和双乙酰含量对其风味的影响[J]. 中国食品添剂,2012(s1):269−273. [LIU Ningning, KUO Hongmin, GE Chunmei, et al. Effect of acetaldehyde and diacetyl content in yogurt on its flavor[J]. Chinese Food Additives,2012(s1):269−273. LIU Ningning, KUO Hongmin, GE Chunmei, et al. Effect of acetaldehyde and diacetyl content in yogurt on its flavor[J]. Chinese food additives, 2012(s1): 269-273.
[44] LIU Chen, YANG Ping, WANG Haili, et al. Identification of odor compounds and odor-active compounds of yogurt using DHS, SPME, SAFE, and SBSE/GC-O-MS[J]. LWT,2022,154:112689. doi: 10.1016/j.lwt.2021.112689
[45] 巩小芬. 开菲尔粒中优质乳酸菌、酵母菌的分离鉴定与开菲尔复合发酵剂的研制[D]. 镇江: 江苏大学, 2018. GONG Xiaofen. Isolation and identification of high-quality lactic acid bacteria and yeast in kefir grains and development of kefir compound starter[D]. Zhenjiang: Jiangsu University, 2018.





 下载:
下载:
 下载:
下载:
