Optimization of Preparation Process of Collagen from Takifugu Obscurus Skin and Its Functional Properties
-
摘要: 暗纹东方鲀鱼皮胶原蛋白含量丰富,为增加其附加值,对鱼皮胶原蛋白进行制取和功能特性研究。实验以暗纹东方鲀鱼皮为研究对象,探究胃蛋白酶加酶量、酶解时间、辅助超声功率和超声时间对胶原蛋白提取率的影响;采用葡聚糖凝胶柱层析法对提取、盐析除杂的胶原蛋白进行进一步纯化,探究纯化的胶原蛋白对酪氨酸酶及透明酸酶的抑制活性。结果表明,胃蛋白酶加酶量4.2%、酶解时间38 h、超声功率320 W,超声时间9 min,胶原蛋白提取率最高71.6%±2.7%;在浓度为0.8 mg/mL,pH为5.5时,暗纹东方鲀鱼皮胶原蛋白酪氨酸酶抑制率为85%,透明质酸酶的抑制效果高达90%,其效果优于市售鱼皮胶原蛋白,具有更广泛的应用价值。Abstract: The skin of Takifugu obscurus is high in collagen. There is a growing trend to study the preparation method and functional properties of fish skin collagen due to the additive values. This research aimed to optimize the collagen extraction processing from the skin of dark-striped pufferfish including the effects of pepsin enzyme addition, enzymatic hydrolysis time, ultrasonic power and ultrasonic time. The dextran gel column chromatography method was used to separate and identify the extracted and salt-desorized collagen. The inhibitory activity of extracted collagen on tyrosinase and hyaluronase was studied. Results showed that, the best extraction rate of collagen was 71.6%±2.7% at pepsin 4.2%, enzymatic hydrolysis time 38 h, ultrasonic power 320 W, and the ultrasonic time 9 mins. The inhibition rate of tyrosinase and hyaluronidase was 85% and 90% respectively, at concentration of Takifugu obscurus skin collagen was 0.8 mg/mL and the pH was 5.5, which performed better than the commercial fish skin collagen. This study indicated that the skin collagen of Takifugu obscurus had the great potential in whitening and anti-inflammatory application, which could be further applied in the field of cosmetics.
-
Keywords:
- Takifugu obscurus /
- collagen /
- extraction /
- purification /
- tyrosinase /
- hyaluronidase
-
中国是世界渔业大国,2011~2020年我国河豚的海水养殖产量总体高于淡水产量,但近三年的海水养殖产量逐渐减少,淡水养殖产量整体呈现上升的趋势,2021年我国淡水养殖河豚产量为14559 t,其中主要是暗纹东方鲀[1]。人们对于河豚的研究主要集中于其自身毒素[2],而忽略其他价值。暗纹东方鲀作为目前主要养殖的河豚品种之一,在加工鱼片、鱼丸、鱼饺等过程中会产生大量的加工副产物,其鱼皮胶原蛋白约占粗蛋白总量的70%,是制备胶原蛋白的良好原料[3-4],近年来被广泛关注。
胶原蛋白是一种生物大分子,也是天然的生物资源,具有极强的生物相容性、可塑性、抗菌性,广泛应用于食品、化妆品、材料工程及医疗美容等领域[5]。胶原蛋白的三条左手螺旋的肽链相互缠绕形成右手超螺旋结构[5],使其具有异于普通蛋白质的功能,但在提取过程中易出现不同程度的变性,影响对其功能及应用的进一步研究。张建忠等[6]采用酶法提取得到了较高纯度的草鱼皮胶原蛋白。周瑞等[7]比较了热水法、酸法和胃蛋白酶法等提取方法,结果表明胃蛋白酶法提取率最高。王晴等[8]比较了酸法和酶法提取的胶原特性,结果表明酶溶性胶原蛋白的功能特性优于酸溶性胶原蛋白。Jridi等[9]发现加酶量对墨鱼胶原蛋白分子量及生物学特性有一定的影响。超声辅助法有广泛应用前景,其具有低毒性、高效性和温和性,能最大限度的保存胶原蛋白的三螺旋结构。严秋萍等[10-11]利用超声辅助柠檬酸法提取,得到了结构完整、纯度较高的齐口裂腹鱼骨胶原蛋白。
暗纹东方鲀鱼皮胶原蛋白含量丰富,是良好的胶原蛋白的来源,结合近年来胶原蛋白提取方法的研究进展,本文采用胃蛋白酶结合超声辅助方法制取胶原蛋白;采用葡聚糖凝胶柱层析对胶原蛋白进一步纯化,同时探究纯化的胶原蛋白对酪氨酸酶及透明酸酶的抑制活性,从而探索以河豚鱼皮中制取高纯度胶原蛋白的方法,研究其美白和抗炎性能及其应用于高附加值领域的可行性,为拓展其应用领域提供理论依据。
1. 材料与方法
1.1 材料与仪器
冷冻暗纹东方鲀鱼皮(鱼皮长23.17±0.50 cm,宽15.85±0.91 cm,重32.85±3.43 g,背部呈白色,周围呈黄色) 购买于江苏中洋生态鱼类股份有限公司;酪氨酸酶(1000 U/mg)、透明质酸酶(300 U/mg)、鱼皮胶原蛋白(采用羟脯氨酸含量测定初步估算胶原蛋白的纯度近94.51%)、4-羟基-α-吡咯甲酸(羟脯氨酸,色谱级)标准品 购于上海麦克林生化科技有限公司;冰乙酸、正丙醇、氯胺T、对二氨基苯甲醛、异丙醇等 均为分析纯;胃蛋白酶(酶活力(U/g)≥1200.0)为生化试剂 购于国药集团化学试剂有限公司;浓硫酸、高氯酸 为分析纯,购于上海柯灵斯试剂有限公司。
DHG-9140A电热鼓风干燥箱 上海慧泰仪器制造有限公司;UV-2200紫外分光光度计 美国Unico公司;HWS-24电热恒温水浴锅 上海一恒科学仪器有限公司;HD-3紫外检测仪、BT-100恒流泵、BS-100A自动部分收集器 上海沪西仪器分析厂;高效液相色谱仪Agilent1260 安捷伦科技有限公司。
1.2 实验方法
1.2.1 样品预处理
将暗纹东方鲀鱼皮解冻后洗净,切成体积大小约为0.5 cm3的块状,装于自封袋中密封,置于−40 ℃冰箱中保存待用。
1.2.2 基本营养成分测定
水分含量测定:参照GB 5009.3-2016,直接干燥法;灰分含量测定:参照GB 5009.4-2016,高温灼烧法;蛋白质含量测定:参照GB 5009.5-2016,凯氏定氮法;脂肪含量测定:参照GB 5009.6-2016,索氏抽提法。
1.2.3 胶原蛋白含量测定
参照GB/T 9695.23-2008《肉与肉制品 羟脯氨酸含量测定》,测定暗纹东方鲀鱼皮中羟脯氨酸的含量,乘以鱼类通用的羟脯氨酸与胶原蛋白换算系数11.1[12],可得两种河豚鱼皮胶原蛋白的含量。在560 nm处测定不同浓度羟脯氨酸的吸光度,并绘制出标准曲线图。得到的羟脯氨酸标准样品的线性回归方程为y=0.2018x+0.0095,r2为0.9997,表明羟脯氨酸标准曲线的相关性好。
1.2.4 胶原蛋白提取工艺
1.2.4.1 前处理
参考 Arumugam 等[13]方法并略作修改。取出切好的暗纹东方鲀鱼皮加入预冷去离子水洗净,加入4倍体积0.5 mol/L NaCl溶液浸泡12 h,5000 r/min离心10 min,留沉淀;加入25倍体积0.1 mol/L NaOH溶液浸泡72 h,去除鱼皮中非胶原物质及色素,12000 r/min离心30 min,将沉淀用去离子水洗至上清液为中性。
1.2.4.2 提取
参考张建忠等[6]的方法并进行改动,胃蛋白酶的加入可以使胶原蛋白非螺旋区域的端肽进行切除,得到主体三螺旋结构,实验室前期研究结果表明在室温20 ℃条件下提取胶原蛋白的空间结构并未被破坏,因此提取温度选用20 ℃。在上述沉淀中加入冰乙酸溶液和胃蛋白酶,以适宜的超声条件辅助酶解,12000 r/min离心30 min,弃沉淀,上清液中加入NaCl使其浓度为0.9 mol/L,搅拌30 min,静置3 h,12000 r/min离心20 min,弃上清液,沉淀加入适量0.5 mol/L冰乙酸溶解,置于0.02 mol/L Na2HPO4溶液(pH7.2)中透析24 h使胃蛋白酶失活(鞣酸溶液检测胃蛋白酶残留),12000 r/min离心40 min,留沉淀,0.5 mol/L冰乙酸复溶,置于0.1 mol/L冰乙酸中透析24 h,蒸馏水透析48 h,得到暗纹东方鲀鱼皮胶原蛋白粗提液,冻干后备用。
1.2.5 胶原蛋白提取率测定
羟脯氨酸是胶原蛋白特有的氨基酸,在其他蛋白质中很少见[14],通过测定暗纹东方鲀鱼皮酶解液中羟脯氨酸的含量,乘以相应的系数,可以计算出提取液中胶原蛋白的含量。
暗纹东方鲀鱼皮胶原蛋白的提取率(%)=提取液中胶原蛋白的含量河豚鱼皮中胶原蛋白的含量×100 1.2.6 单因素实验
1.2.6.1 加酶量对酶解反应的影响
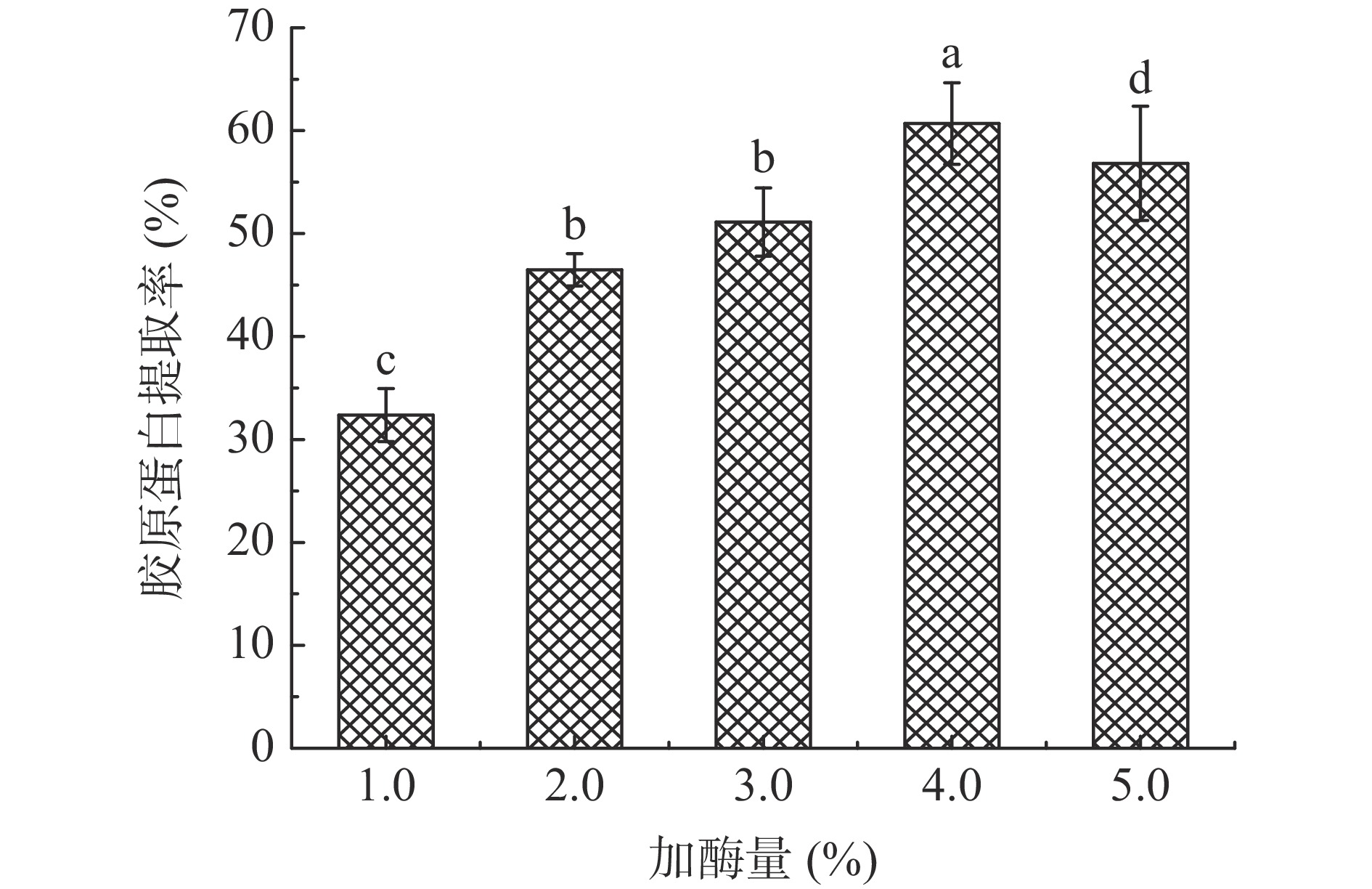
考察酶解过程中胃蛋白酶不同加酶量(相对鱼皮质量的百分比:1.0%、2.0%、3.0%、4.0%、5.0%)对暗纹东方鲀鱼皮胶原蛋白提取率的影响,固定酶解时间36 h、超声时间10 min、超声功率320 W进行提取。
1.2.6.2 酶解时间对酶解反应的影响
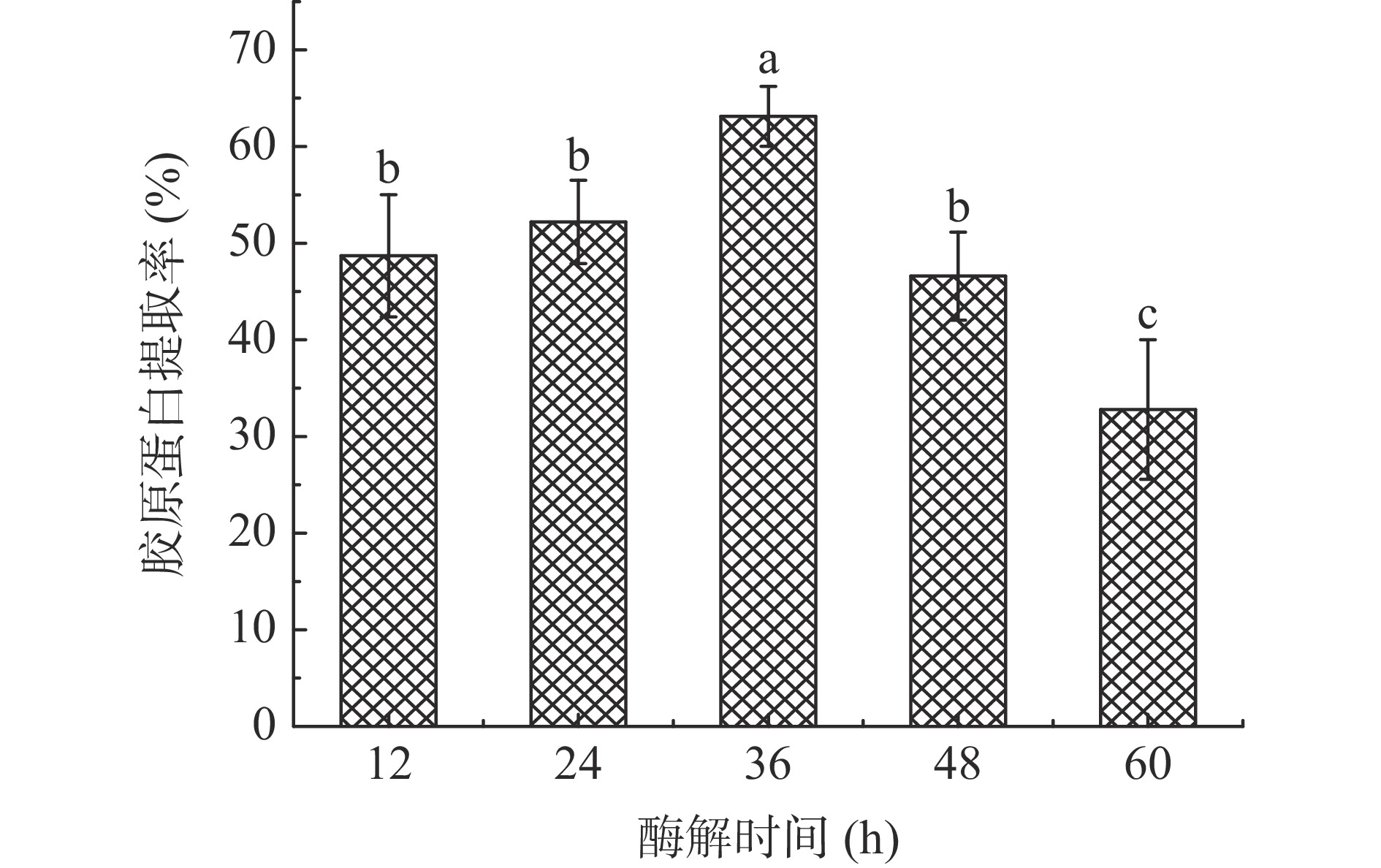
考察酶解过程中不同酶解时间(12、24 、36、48、60 h)对暗纹东方鲀鱼皮胶原蛋白提取率的影响,固定加酶量4.0%、酶解时间36 h、超声时间10 min的条件下进行提取。
1.2.6.3 超声功率对酶解反应的影响
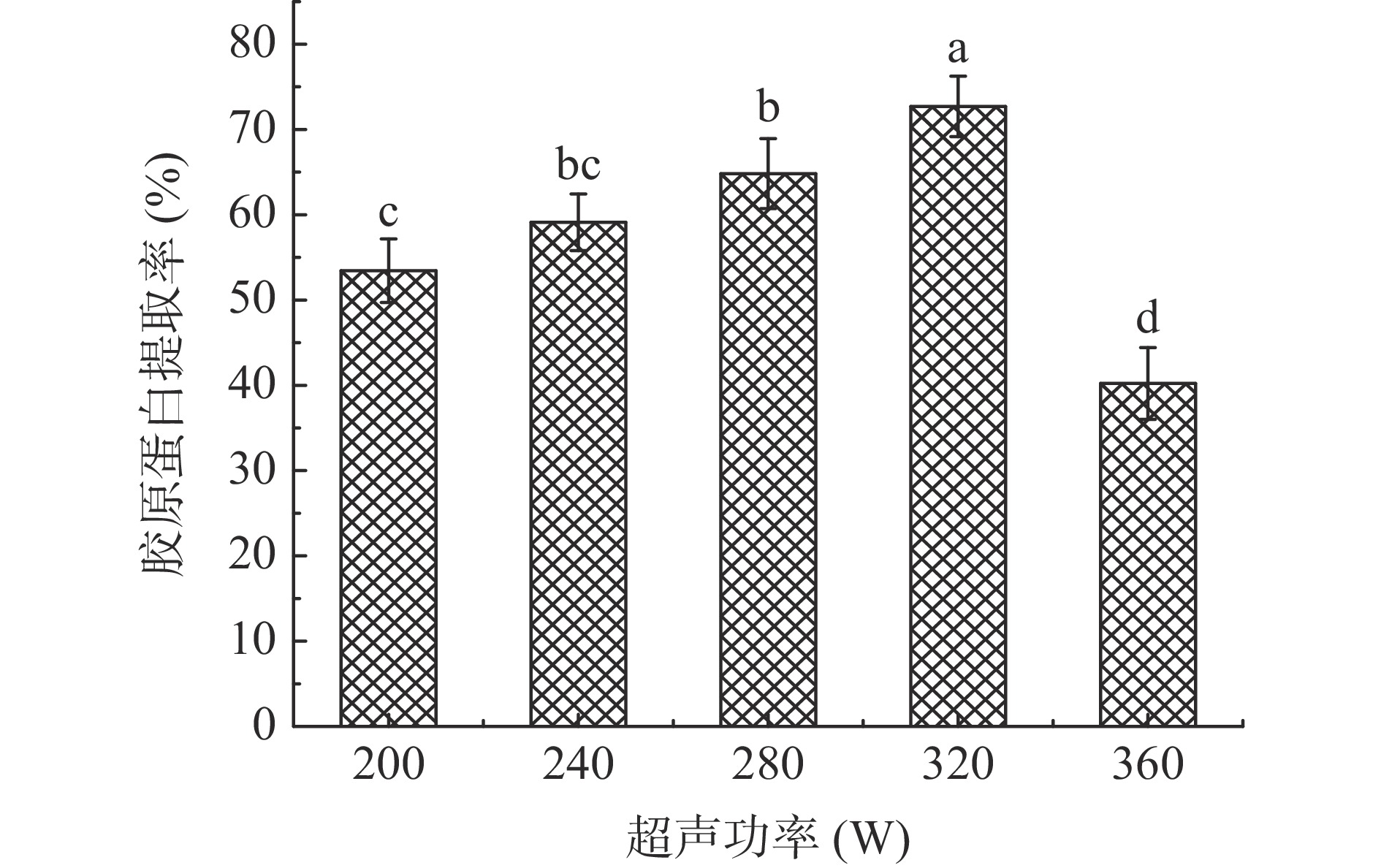
考察酶解过程中不同超声功率(200、240、280、320、360 W)对暗纹东方鲀鱼皮胶原蛋白提取率的影响,固定加酶量4.0%、酶解时间36 h、超声时间10 min进行提取。
1.2.6.4 超声时间对酶解反应的影响
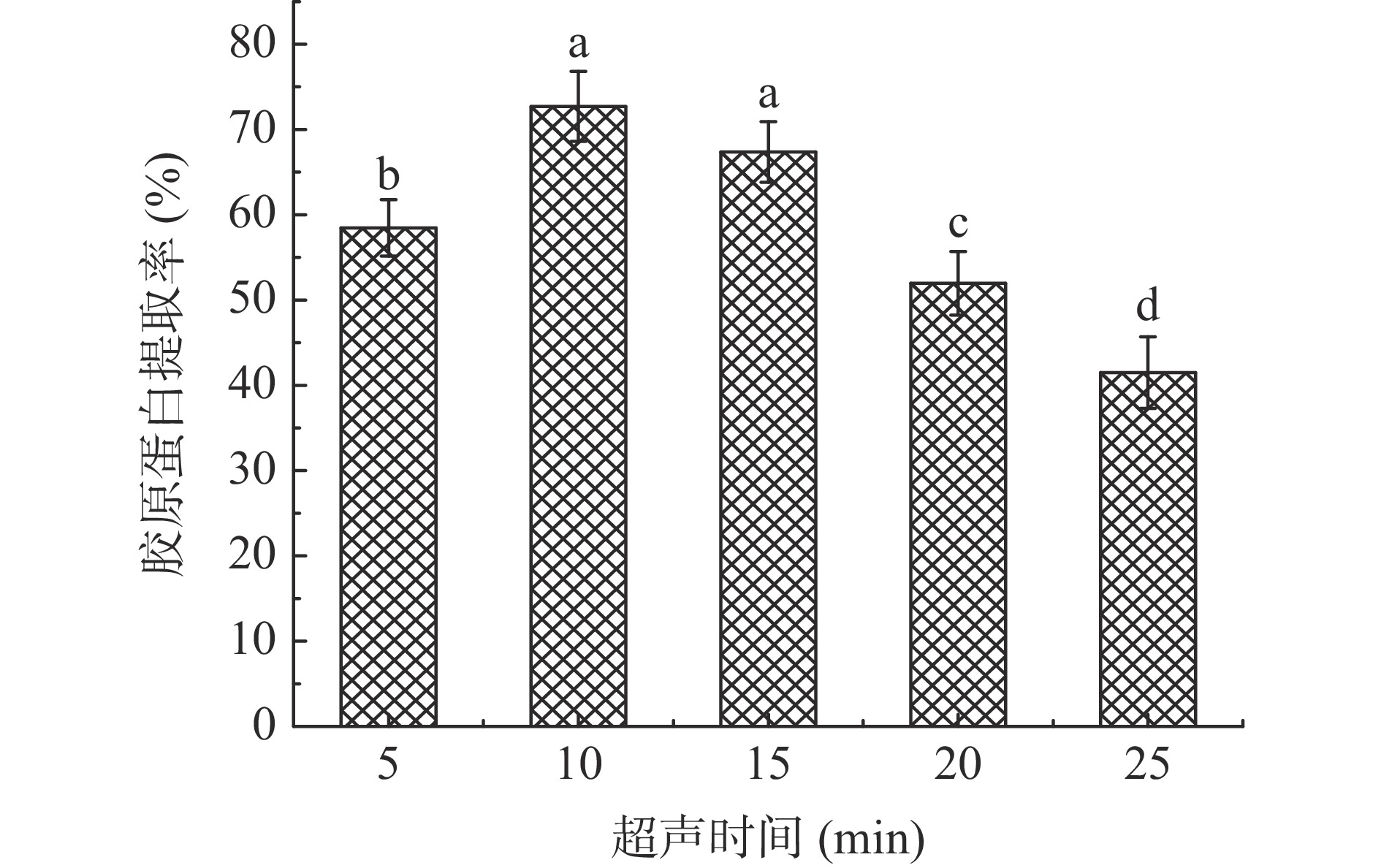
考察酶解过程中不同超声时间(5、10、15、20、25 min)对暗纹东方鲀鱼皮胶原蛋白提取率的影响,固定加酶量4.0%、酶解时间36 h、超声功率320 W进行提取。
1.2.7 响应面优化设计
在单因素实验基础上,以胶原蛋白提取率为响应值(Y),选取加酶量(A)、酶解时间(B)、超声功率(C)和超声时间(D)四个因素为自变量,利用Design-Expert软件中Box-Behnken11中心组合设计4因素3水平的响应面分析方法,进一步对暗纹东方鲀鱼皮胶原蛋白的提取工艺进行优化。利用Design-Expert软件进行数据拟合,分析因素与水平设计如表1所示。
表 1 响应面分析因素与水平Table 1. Factors and levels of response surface experiment水平 因素 加酶量(A) 酶解时间(B) 超声功率(C) 超声时间(D) −1 3.0 24 280 5 0 4.0 36 320 10 1 5.0 48 360 15 1.2.8 胶原蛋白的纯化
葡聚糖凝胶G-200层析柱的制备[15]:将葡聚糖凝胶G-200填料浸泡在10倍体积的去离子水中,室温浸泡过夜,使其充分溶胀。选取柱长500 mm,内径26 mm的层析柱,采用自然沉降法装柱,用0.1 mol/L的冰乙酸溶液平衡。
参照闫鸣艳[15]的方法,将胶原蛋白粗提物溶于0.1 mol/L冰乙酸溶液中,过膜后上样至已达到平衡的葡聚糖凝胶G-200层析柱中,用0.1 mol/L冰乙酸溶液以流速为0.6 mL/min进行洗脱,用紫外检测器220 nm检测吸光度,收集胶原蛋白峰,透析后冻干。
高效液相色谱[15]:将上述冻干胶原蛋白样品溶于0.1 mol/L冰乙酸溶液中,用0.45 μm微孔滤膜过滤后,进行高效液相分析。色谱柱:Agilent TC-C18,内径4.6 mm,柱长150 mm;流动相:(A)5%乙腈+0.05%三氟乙酸(TFA)和(B)90%乙腈;流速0.8 mL/min;进样量:20 μL;紫外检测波长为220 nm。
1.2.9 纯化的胶原蛋白对酪氨酸酶抑制活性的测定
1.2.9.1 不同浓度胶原蛋白溶液对酪氨酸酶抑制活性的测定
酪氨酸酶的活力主要以酪氨酸酶催化L-DOPA(左旋多巴)氧化形成多巴醌的二酚酶活性来衡量[16]。将纯化后的暗纹东方鲀鱼皮胶原蛋白(Takifugu obscurus skin collagen,TOSK)与市售鱼皮胶原蛋白(Commercial fish skin collagen,CFSK)配制成0.2、0.4、0.6、0.8、1.0 mg/mL的样品溶液。称取6.8 g KH2PO4和0.94 g NaOH用蒸馏水溶解,定容至1000 mL,摇匀,配成pH6.8磷酸盐缓冲溶液。用磷酸盐分别溶解酪氨酸和酪氨酸酶,分别配制成1 mg/mL酪氨酸溶液和0.07 mg/mL酪氨酸酶溶液。准确配制试样1:2.0 mL磷酸盐缓冲溶液、0.5 mL酪氨酸溶液、2.0 mL酪氨酸酶溶液;试样2:2.5 mL磷酸盐缓冲溶液、2.0 mL酪氨酸酶溶液;试样3:1.5 mL磷酸盐缓冲溶液、0.5 mL 不同浓度胶原蛋白样品溶液、0.5 mL酪氨酸溶液、2.0 mL酪氨酸酶溶液;试样4:2.0 mL磷酸盐缓冲溶液、0.5 mL不同浓度胶原蛋白样品溶液、2.0 mL酪氨酸酶溶液。试样1~试样4分别混合均匀,置于37 ℃水浴锅中反应30 min后取出,立即于475 nm处测各样品的吸光度值。用市售鱼皮胶原蛋白与暗纹东方鲀鱼皮胶原蛋白作比较。计算公式如下:
酪氨酸酶抑制率(%)=[1−A3−A4A1−A2]×100 式中: A1:试样1的吸光度值;A2:试样2的吸光度值;A3:试样3的吸光度值;A4:试样4的吸光度值。
1.2.9.2 不同pH胶原蛋白溶液对酪氨酸酶抑制活性的测定
将纯化后的TOSK与CFSK配制成pH为4.5、5.0、5.5、6.0、6.5的胶原蛋白样品溶液,方法同1.2.9.1。
1.2.10 纯化的胶原蛋白对透明质酸酶抑制活性的测定
1.2.10.1 不同浓度胶原蛋白溶液对透明质酸酶抑制活性的测定
将纯化后的TOSK与CFSK配制成0.2、0.4、0.6、0.8、1.0 mg/mL的样品溶液,按照Elson-Morgan改良法测定不同浓度胶原蛋白对透明质酸酶的抑制作用,用市售鱼皮胶原蛋白与暗纹东方鲀鱼皮胶原蛋白作比较,实验过程如表2。计算公式如下:
表 2 透明质酸酶抑制活性测定实验步骤Table 2. Experimental procedure for determination of inhibitory activity of hyaluronidase试剂 a管(mL) b管(mL) c管(mL) d管(mL) 胶原蛋白样品溶液 0.5 0.5 − − 蒸馏水 − − 0.5 0.5 透明质酸酶 0.5 − 0.5 − 醋酸缓冲溶液 − 0.5 − 0.5 − 37 ℃,保温20 min CaCl2溶液 0.1 0.1 0.1 0.1 − 37 ℃,保温20 min 透明质酸钠 0.5 − 0.5 − 醋酸缓冲液 − 0.5 − 0.5 − 37 ℃,保温40 min;室温放置10 min 蒸馏水 0.5 0.5 0.5 0.5 NaOH溶液 0.1 0.1 0.1 0.1 乙酰丙酮溶液 0.5 0.5 0.5 0.5 − 沸水浴15 min;冰浴10 min;室温放置10 min P-DAB显色剂 1.0 1.0 1.0 1.0 − 充分振荡后加入无水乙醇至8 mL − 室温放置30 min − 530 nm处测定吸光值 注:-表示未添加试剂或试剂添加量为0。 透明质酸酶抑制率(%)=[1−Ac−AdAa−Ab]×100 式中:Aa:a管式样的吸光度值;Ab:b管式样的吸光度值;Ac:c管式样的吸光度值;Ad:d管式样的吸光度值。
1.2.10.2 不同pH胶原蛋白溶液对透明质酸酶抑制活性的测定
将纯化后的TOSK与CFSK配制成pH为4.5、5.0、5.5、6.0、6.5的胶原蛋白样品溶液,方法同1.2.10.1。
1.3 数据处理
所有实验均重复进行三次,结果表示为平均值±标准偏差的形式。采用SPSS 23.0软件对数据进行差异显著性比较分析,P<0.05为数据之间存在显著性差异,Origin 8.6软件处理和生成图像。
2. 结果与分析
2.1 暗纹东方鲀鱼皮基本营养成分和胶原蛋白含量
表3为鱼皮基本营养成分及胶原蛋白含量。由表3可知,暗纹东方鲀鱼皮粗蛋白含量为23.81%,高于鱿鱼、金枪鱼和罗非鱼皮;粗脂肪含量仅为0.08%,低于鱿鱼鱼皮(0.73%)、罗非鱼皮(1.56%)和金枪鱼皮(6.65%);且其胶原蛋白占粗蛋白含量的79.76%。可见暗纹东方鲀鱼皮质量非常高,具有在胶原蛋白提取过程中可以省去脱脂步骤的优势,有效节约提取成本和提高提取效率,可作为提取胶原蛋白的理想原料。
表 3 鱼皮基本营养成分和胶原蛋白含量(g/100 g,n=3)Table 3. Nutrient composition and collagen content of fish skin (g/100 g, n=3)2.2 单因素实验结果
2.2.1 胃蛋白酶加酶量对酶解反应的影响
胃蛋白酶主要作用于胶原蛋白端肽区域的苯丙氨酸和酪氨酸等,同时不破坏胶原蛋白的三螺旋结构,当加酶量较小时,底物相对过剩,导致酶与底物无法充分接触,从而提取率较低,胶原蛋白提取不充分造成损失;加酶量过大,使胶原蛋白被过度酶解,生成短肽,破坏胶原蛋白三股螺旋的完整性。本实验选取加酶量分别为1.0%、2.0%、3.0%、4.0%和5.0%,酶解时间36 h,在未使用超声辅助的条件下进行提取。如图1所示,随着加酶量的增加,酶与底物充分反应,胶原蛋白提取率显著上升;然而当加酶量从4.0%增加至5.0%时,胶原蛋白的三股螺旋结构被破坏,使得胶原蛋白的提取率下降。因此,酶添加量为4.0%时,胶原蛋白的提取率最高,为60.69 %。
2.2.2 酶解时间对酶解反应的影响
酶解时间过短,酶解反应不充分;时间过长不仅会造成酶解过度,也会增加生产成本。由图2可明显看出,暗纹东方鲀鱼皮中胶原蛋白提取率在36 h内呈现上升的趋势,此过程中胶原蛋白的溶出是固体溶质向溶剂传递的过程,在体系还未达平衡时,胶原蛋白的提取率随着时间的增加而逐渐上升[20],继续增加酶解的时间,部分胶原蛋白发生了水解,胶原蛋白提取率下降,最佳酶解时间为36 h,提取率为63.12%。
2.2.3 超声功率对酶解反应的影响
超声辅助技术与常规的酶解法联合使用,超声处理能够破坏原料的组织结构使胶原蛋白暴露,还能破坏蛋白质间的相互作用从而促进胶原蛋白的溶出,进一步提高胶原蛋白的提取率,缩短提取的时间。由图3可知,随着超声功率的逐渐增加,暗纹东方鲀鱼皮胶原蛋白的提取率呈现上升的趋势,当超声功率达320 W时胶原蛋白的提取率最高,鱼皮中大部分胶原蛋白已经溶出,但过高的超声功率会对胶原蛋白产生机械性损伤,破坏胶原的三螺旋结构,使其裂解为较短的肽链。为了避免胶原蛋白的高级结构被破坏,所以选择320 W为提取暗纹东方鲀鱼皮胶原蛋白的超声功率,胶原蛋白的提取率为72.70%,表明超声处理能够明显增加胶原蛋白的提取率。
2.2.4 超声时间对酶解反应的影响
由图4可知,暗纹东方鲀鱼皮胶原蛋白的提取率随着超声时间的增加呈现先增加后降低的趋势。超声时间在5~10 min时胶原蛋白增加显著(P<0.05),在10 min时达到最大提取率;继续增加超声处理的时间,其产生的空化效应和机械作用的增强,会加快胶原蛋白的降解,破坏胶原蛋白原有的完整三螺旋结构[21],经胃蛋白酶处理会产生较短的胶原蛋白肽,导致具有完整三螺旋结构的胶原蛋白提取率呈下降的趋势,故超声时间选为10 min,提取率为72.40%。
实验表明,胃蛋白酶加酶量4.0%、酶解时间36 h、超声功率320 W,超声时间10 min,暗纹东方鲀鱼皮胶原蛋白提取率最高为72.4%±4.1%,高于超声波辅助提取骆驼皮胶原蛋白的提取率41.99%[22],高于青鱼鱼皮胶原蛋白的提取率45.3%[23]。
2.3 响应面分析结果
根据单因素实验基础和Box-Behnken原理,以暗纹东方鲀鱼皮胶原蛋白提取为响应值,设计的响应面分析实验,用Design-Expert 11软件进行数据处理分析,实验设计及结果如表4所示。
表 4 Box-Behnken试验设计和胶原蛋白提取率Table 4. Box-Behnken experimental design and collagen extraction rate results实验号 A B C D Y:提取率(%) 1 −1 0 1 0 58.7±1.8 2 0 0 −1 −1 68.5±2.5 3 1 0 −1 0 59.2±2.7 4 0 −1 0 1 56.6±1.4 5 0 0 0 0 73.8±1.9 6 1 0 1 0 58.3±2.9 7 0 0 0 0 74.2±1.2 8 −1 0 −1 0 58.6±1.7 9 0 0 0 0 70.9±1.9 10 1 −1 0 0 56.2±2.1 11 0 0 0 0 72.9±2.6 12 1 0 0 1 60.6±3.0 13 0 1 0 −1 65.3±2.6 14 −1 0 0 1 58.8±2.1 15 0 0 1 −1 65.2±2.7 16 0 0 −1 1 67.1±1.4 17 1 1 0 0 59.8±1.7 18 0 0 1 1 63.3±1.8 19 0 −1 −1 0 59.6±1.6 20 0 1 1 0 66.6±2.9 21 −1 0 0 −1 57.4±2.0 22 1 0 0 −1 63.9±1.9 23 0 −1 0 −1 61.9±3.1 24 0 1 −1 0 62.6±2.5 25 −1 1 0 0 53.7±2.8 26 0 1 0 1 61.2±2.6 27 0 −1 1 0 59.8±2.9 28 −1 −1 0 0 53.2±1.9 29 0 0 0 0 71.2±2.2 对表4进行回归拟合分析,得到多元二次回归方程模型为:
Y=73.224+1.457A+1.821B−0.293C−1.236D+0.752AB−0.237AC−1.170AD+0.950BC+0.295BD−0.122CD−9.989A2−7.715B2−3.837C2−3.548D2
由表5可知,模型F=18.69,P<01,表明模型的显著性极高,且失拟项F=3.12,P=0.1418>0.05,失拟项不显著,表明模型预测值与实际值之间的误差比较小,具有良好的拟合程度。对回归方程进行显著性检验,决定系数R2=0.9492,校正决定系数R2Adj=0.8984,说明暗纹东方鲀鱼皮胶原蛋白最佳提取工艺条件可以利用回归方程预测。F值可以反映回归模型的有效性,其值越大,说明该因素对胶原蛋白提取率的影响就越显著,由表5可知,4个因素对胶原蛋白提取率的影响顺序为酶解时间(B)>加酶量(A)>超声时间(D)>超声功率(C)。
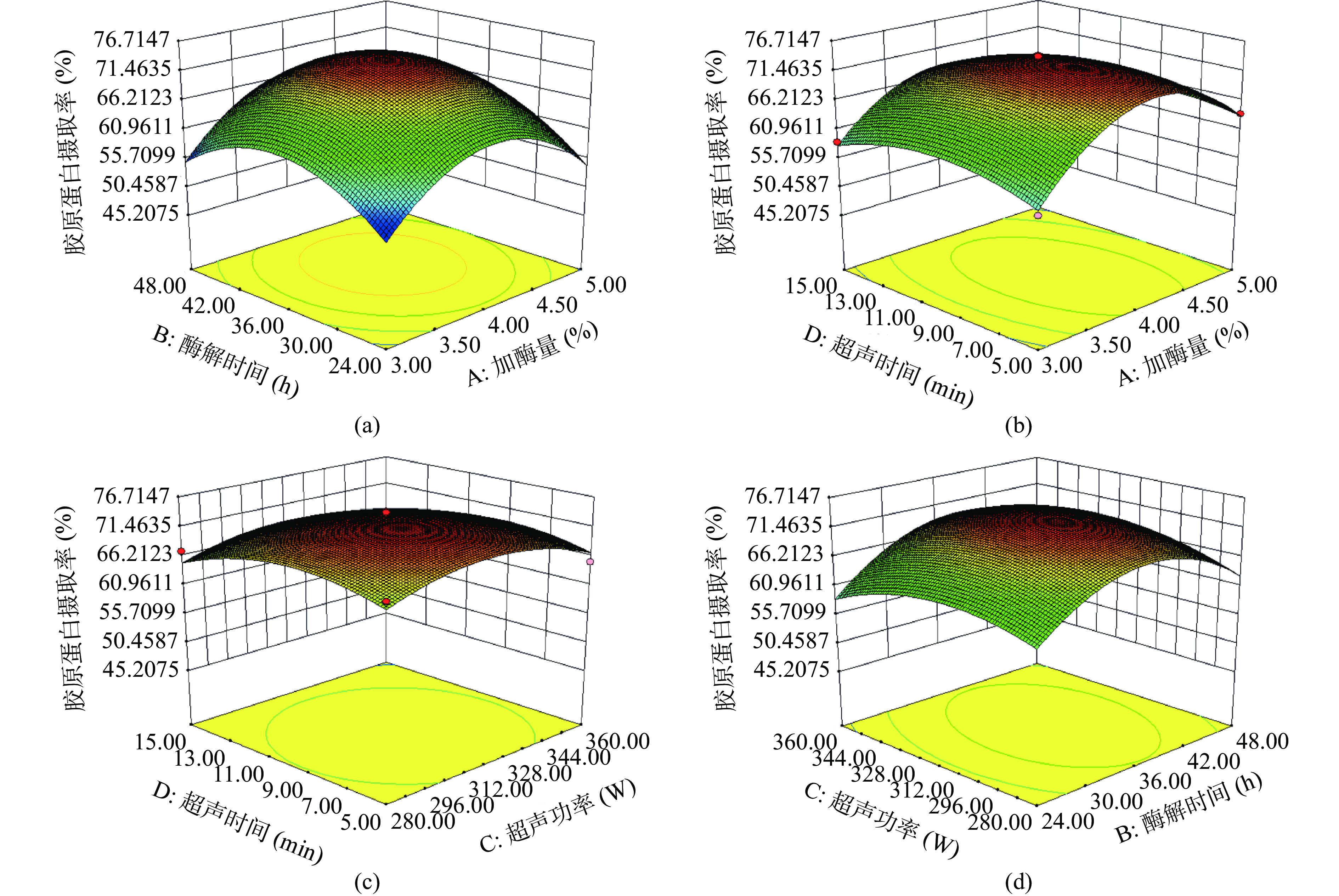
表 5 回归模型方差分析和系数显著性检验Table 5. Variance analysis and significance test of regression model方差来源 平方和 自由度 均方 F值 P值 显著性 模型项 981.76 14 70.13 18.69 < 01 ** A 25.46 1 25.46 6.79 0.0208 * B 39.79 1 39.79 10.6 0.0057 * C 1.03 1 1.03 0.28 0.6081 N D 18.33 1 18.33 4.88 0.0443 * AB 2.27 1 2.27 0.6 0.4501 N AC 0.23 1 0.23 0.06 0.8098 N AD 5.48 1 5.48 1.46 0.247 N BC 3.61 1 3.61 0.96 0.3433 N BD 0.35 1 0.35 0.093 0.7652 N CD 0.06 1 0.06 0.016 0.9011 N A2 647.23 1 647.23 172.5 < 01 ** B2 386.12 1 386.12 102.91 < 01 ** C2 95.48 1 95.48 25.45 02 ** D2 81.65 1 81.65 21.76 04 ** 残差 52.53 14 3.75 − − − 失拟项 46.57 10 4.66 3.12 0.1418 N 净误差 5.96 4 1.49 − − − 总和 1034.29 28 − − − − 注:**为极显著(P<0.001),*为显著(0.001≤P<0.05),N为不显著(P≥0.05),其中P值越小显著性越高。 根据单因素实验基础和Box-Behnken原理,以暗纹东方鲀鱼皮胶原蛋白提取率为响应值,设计的响应面分析实验,用Design-Expert 11软件进行数据处理分析,结果表明加酶量和超声功率、酶解时间和超声时间的交互作用不显著,交互作用显著的实验结果如图5所示。
最优条件验证:通过Design-Expert11软件分析,加酶量4.23%、酶解时间37.69 h、超声功率318.56 W、超声时间8.64 min为暗纹东方鲀鱼皮胶原蛋白提取的最优方案,胶原蛋白的理论提取率为70.6%。考虑到实际操作的可行性,在加酶量4.2%、酶解时间38 h、超声功率320 W、超声时间9 min的条件下进行验证试验3次,得到胶原蛋白提取率为71.6%±2.7%,与理论得率无显著差异(P>0.05),证明应用该模型进行预测是可行的。
2.4 胶原蛋白的进一步纯化
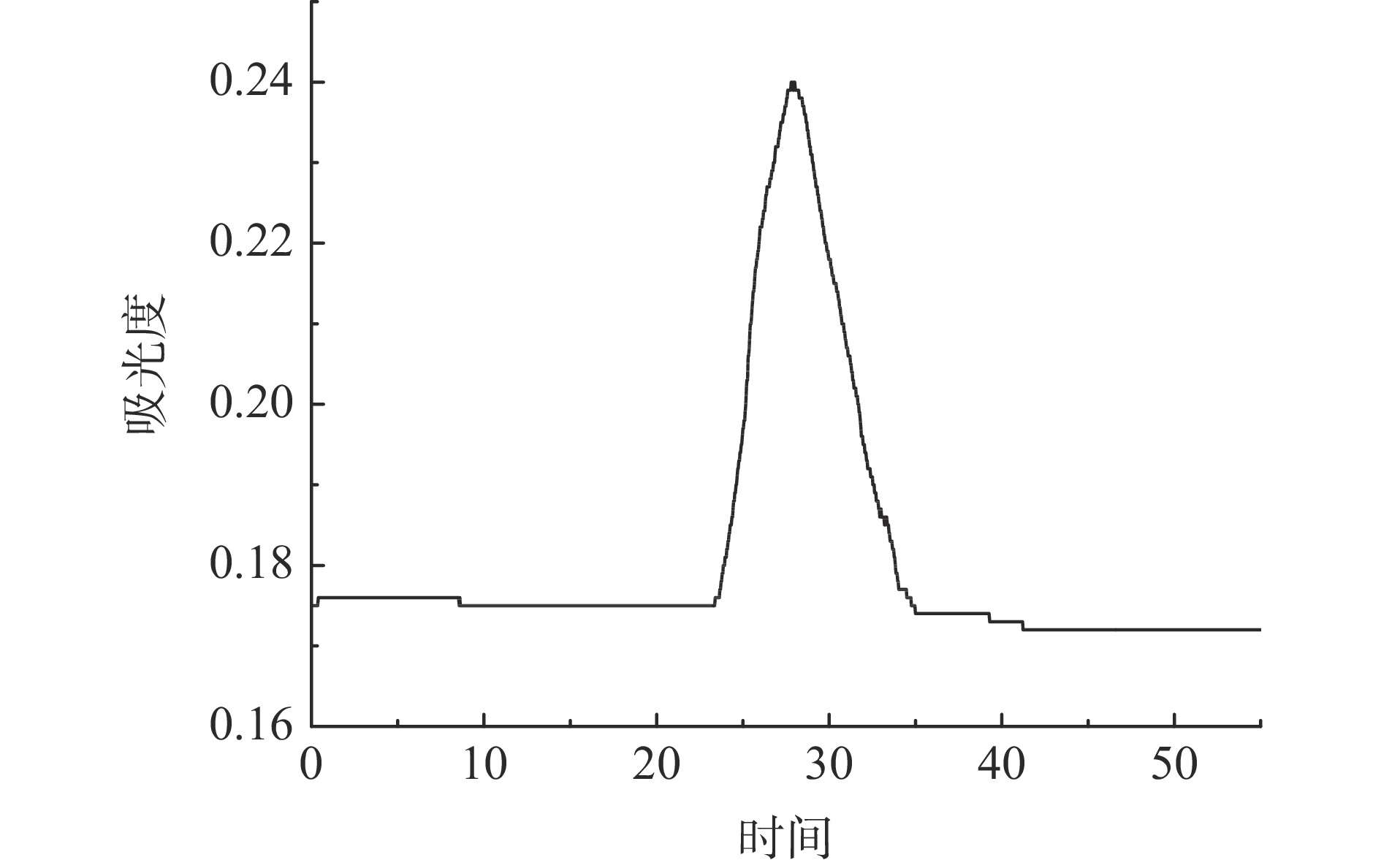
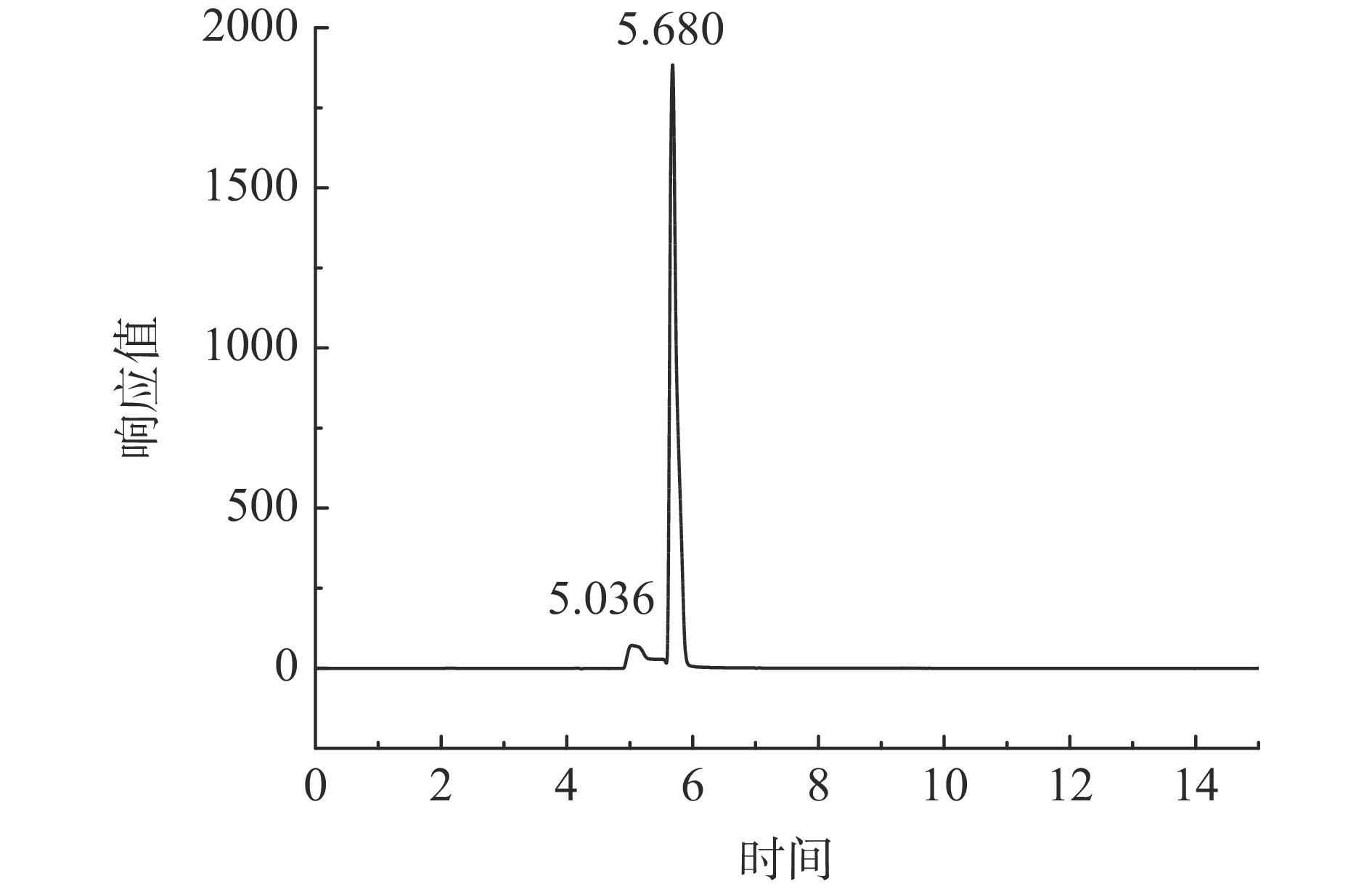
凝胶柱层析法纯化是根据蛋白质分子量的大小不同而达到分离的效果,属于体积排阻法。图6为暗纹东方鲀胶原蛋白进一步葡聚糖凝胶G-200的柱层析纯化,胶原蛋白经洗脱液洗脱后,形成一个较大的单峰,为大分子的胶原蛋白,因分子量大难以进入凝胶内部而被先洗脱下来。收集色谱峰的对应部分样品通过HPLC检测,检测结果如图7所示,在5.036 min处有一个小峰,而在5.68 min处形成一个尖锐洗脱峰,说明胶原蛋白样品分子量较为单一,所制取的胶原蛋白的纯度较高,采用羟脯氨酸含量测定初步估算胶原蛋白的纯度近90.11%。该纯化结果与狭鳕鱼皮胶原蛋白纯化结果相似[14],均可获得高纯度的胶原蛋白。
2.5 胶原蛋白对酪氨酸酶抑制活性的影响
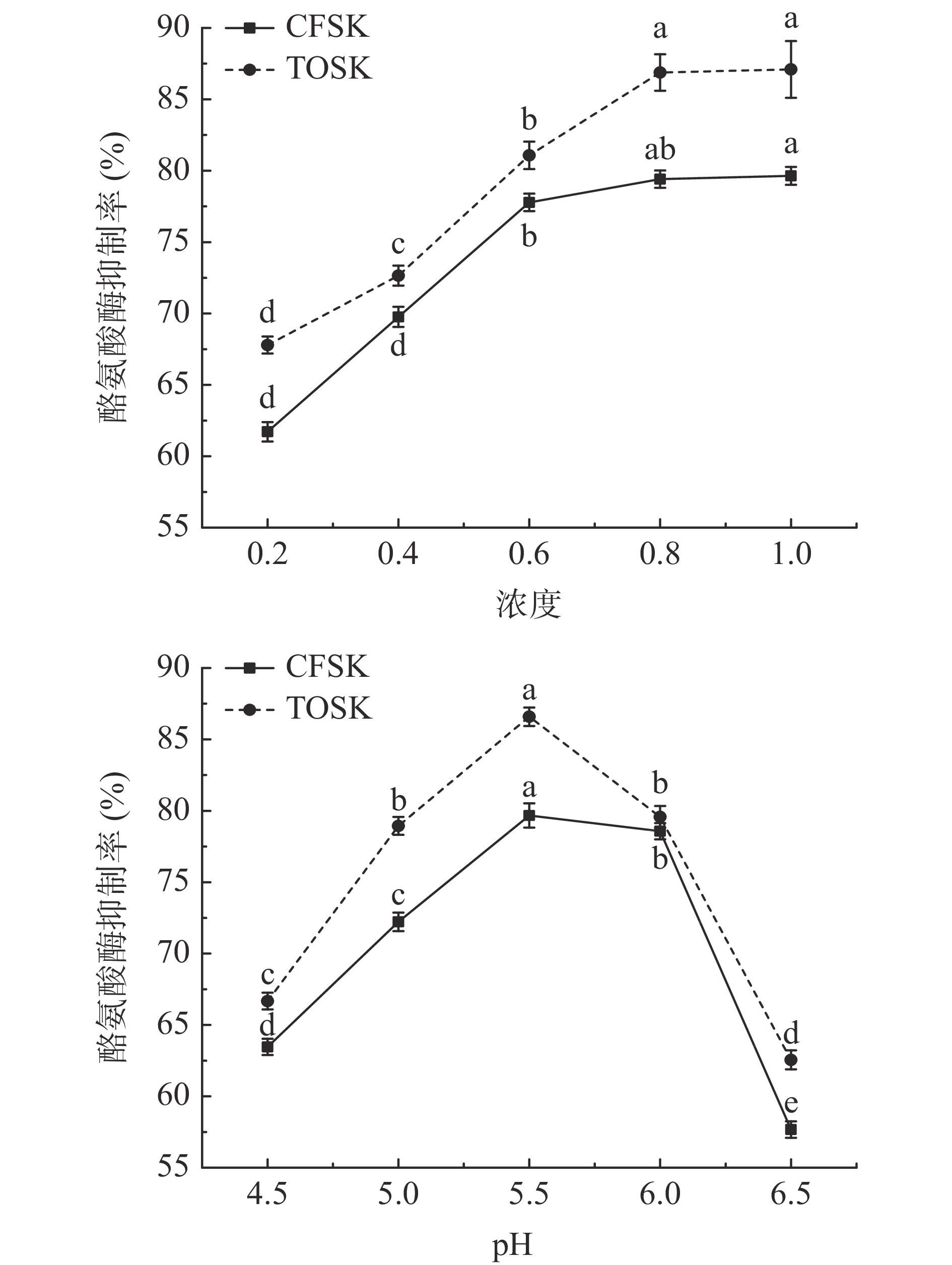
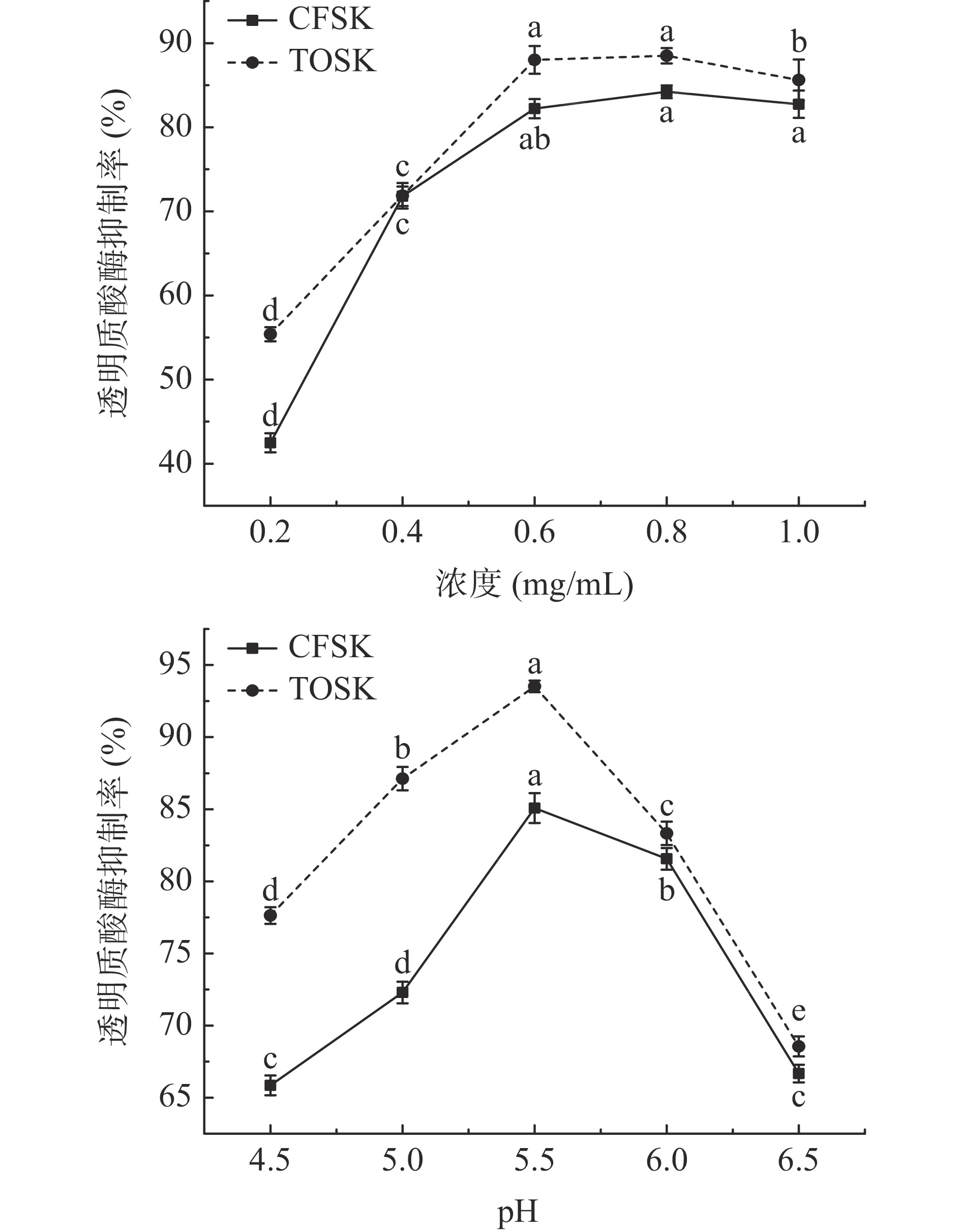
黑色素是一种生物色素,是酪氨酸经过化学反应形成的,主要与皮肤变黑、老年斑、雀斑等的形成有关,而酪氨酸酶能够限制黑色素的形成[24]。对不同浓度和不同pH条件下CFSK和TOSK对酪氨酸酶抑制的活性研究如图8所示,两种鱼皮胶原蛋白均具有抑制酪氨酸酶活性的作用,其原因可能是鱼皮的胶原蛋白与酪氨酸酶的底物结构相类似,可以与酪氨酸酶的位点相结合,达到竞争性抑制酪氨酸酶的活性[25]。随着浓度的增加,两种鱼皮胶原蛋白对酪氨酸酶的抑制率呈现先上升趋势。不同鱼皮胶原对酪氨酸酶抑制率不同,且随着pH的变化抑制率发生改变,但都在pH 5.5时达最大值;通过对CFSK和TOSK的酪氨酸酶抑制率进行比较,可以得出TOSK>CFSK。暗纹东方鲀鱼皮胶原蛋白对酪氨酸酶抑制率始终高于市售鱼皮胶原蛋白,可能由于暗纹东方鲀鱼皮脂肪含量非常低,在胶原蛋白纯化时省去了脱脂处理步骤,一定程度上减少了有机溶剂对胶原蛋白结构上的破坏,尽可能多的保留了胶原与酪氨酸酶的结合位点。虽然根据羟脯氨酸含量初步估算,提取胶原的纯度低于市售胶原蛋白标品,本实验采用葡聚糖凝胶纯化除去了小分子胶原蛋白肽等,也有可能与不同原料胶原蛋白的提取条件等影响因素有关,对胶原蛋白完整空间超螺旋结构的影响,需后续实验进一步验证。
![]() 图 8 不同浓度及pH鱼皮胶原蛋白的酪氨酸酶抑制率注:图中同一物质不同字母表示差异显著(P<0.05);图9同。Figure 8. Tyrosinase inhibition rate of fish skin collagen at different concentrations and pH
图 8 不同浓度及pH鱼皮胶原蛋白的酪氨酸酶抑制率注:图中同一物质不同字母表示差异显著(P<0.05);图9同。Figure 8. Tyrosinase inhibition rate of fish skin collagen at different concentrations and pH2.6 胶原蛋白对透明质酸酶抑制活性的影响
透明质酸是一种胞外粘多糖,呈现透明胶状,当透明质酸被降解时,导致细胞间的粘滞性和交联性降低,不仅水分、营养物质可以穿过细胞膜,连病毒等有害物质也可轻易穿过物理防御屏障细胞膜,导致炎症的发生[26]。因此,抑制透明质酸酶活性可对炎症反应具有一定的预防作用。两种鱼皮胶原蛋白不同浓度及pH条件下对透明质酸酶抑制率的测定结果如图9所示。由图可知,鱼皮胶原蛋白对透明质酸酶具有抑制作用,其抑制效果最佳为浓度0.8 mg/mL,此时两种鱼皮胶原蛋白的透明质酸酶抑制率基本接近,达80%~85%;两种鱼皮胶原蛋白对透明质酸酶抑制率的效果随着pH的增加呈现先上升后下降的趋势,于pH 5.5时效果最好,暗纹东方鲀鱼皮胶原蛋白的透明质酸酶抑制率为93.52%,说明暗纹东方鲀鱼皮胶原蛋白具有较强的潜在抗炎应用价值。
3. 结论
暗纹东方鲀鱼皮粗蛋白含量占干重的96.05%,胶原蛋白占粗蛋白含量的79.76%;脂肪含量占干重的0.32%,在胶原蛋白纯化时可省去脱脂处理步骤,是制取胶原蛋白的优质原料。本研究采用单因素实验结合响应面优化暗纹东方鲀鱼皮胶原蛋白的提取条件,实验结果显示:胃蛋白酶加酶量4.2%、酶解时间38 h、辅助超声提取功率320 W,超声时间9 min,胶原蛋白提取率最高为71.6%±2.7%。采用葡聚糖凝胶G-200柱层析法对提取、盐析除杂的暗纹东方鲀鱼皮胶原蛋白进一步地纯化,初步估算胶原蛋白的纯度近90.11%。
通过对比纯化的暗纹东方鲀鱼皮胶原蛋白和市售鱼皮胶原蛋白对酪氨酸酶和透明质酸酶抑制率研究其在化妆品中应用的可行性,结果显示酪氨酸酶抑制率及透明质酸酶抑制率整体变化趋势一致,随着浓度的增加呈现先上升后平稳或略有下降,随着pH增加呈现先上升后下降的趋势,其效果最佳表现在浓度为0.8 mg/mL时,pH为5.5时,酪氨酸酶抑制率达85%左右,而透明质酸酶的抑制效果可高达90%,所制取的胶原蛋白具有潜在的美白和抗炎应用价值;而暗纹东方鲀鱼皮胶原蛋白的总体功效要优于市售鱼皮胶原蛋白,为将来拓宽水产胶原蛋白的应用市场提供理论依据。
-
图 8 不同浓度及pH鱼皮胶原蛋白的酪氨酸酶抑制率
注:图中同一物质不同字母表示差异显著(P<0.05);图9同。
Figure 8. Tyrosinase inhibition rate of fish skin collagen at different concentrations and pH
表 1 响应面分析因素与水平
Table 1 Factors and levels of response surface experiment
水平 因素 加酶量(A) 酶解时间(B) 超声功率(C) 超声时间(D) −1 3.0 24 280 5 0 4.0 36 320 10 1 5.0 48 360 15 表 2 透明质酸酶抑制活性测定实验步骤
Table 2 Experimental procedure for determination of inhibitory activity of hyaluronidase
试剂 a管(mL) b管(mL) c管(mL) d管(mL) 胶原蛋白样品溶液 0.5 0.5 − − 蒸馏水 − − 0.5 0.5 透明质酸酶 0.5 − 0.5 − 醋酸缓冲溶液 − 0.5 − 0.5 − 37 ℃,保温20 min CaCl2溶液 0.1 0.1 0.1 0.1 − 37 ℃,保温20 min 透明质酸钠 0.5 − 0.5 − 醋酸缓冲液 − 0.5 − 0.5 − 37 ℃,保温40 min;室温放置10 min 蒸馏水 0.5 0.5 0.5 0.5 NaOH溶液 0.1 0.1 0.1 0.1 乙酰丙酮溶液 0.5 0.5 0.5 0.5 − 沸水浴15 min;冰浴10 min;室温放置10 min P-DAB显色剂 1.0 1.0 1.0 1.0 − 充分振荡后加入无水乙醇至8 mL − 室温放置30 min − 530 nm处测定吸光值 注:-表示未添加试剂或试剂添加量为0。 表 3 鱼皮基本营养成分和胶原蛋白含量(g/100 g,n=3)
Table 3 Nutrient composition and collagen content of fish skin (g/100 g, n=3)
表 4 Box-Behnken试验设计和胶原蛋白提取率
Table 4 Box-Behnken experimental design and collagen extraction rate results
实验号 A B C D Y:提取率(%) 1 −1 0 1 0 58.7±1.8 2 0 0 −1 −1 68.5±2.5 3 1 0 −1 0 59.2±2.7 4 0 −1 0 1 56.6±1.4 5 0 0 0 0 73.8±1.9 6 1 0 1 0 58.3±2.9 7 0 0 0 0 74.2±1.2 8 −1 0 −1 0 58.6±1.7 9 0 0 0 0 70.9±1.9 10 1 −1 0 0 56.2±2.1 11 0 0 0 0 72.9±2.6 12 1 0 0 1 60.6±3.0 13 0 1 0 −1 65.3±2.6 14 −1 0 0 1 58.8±2.1 15 0 0 1 −1 65.2±2.7 16 0 0 −1 1 67.1±1.4 17 1 1 0 0 59.8±1.7 18 0 0 1 1 63.3±1.8 19 0 −1 −1 0 59.6±1.6 20 0 1 1 0 66.6±2.9 21 −1 0 0 −1 57.4±2.0 22 1 0 0 −1 63.9±1.9 23 0 −1 0 −1 61.9±3.1 24 0 1 −1 0 62.6±2.5 25 −1 1 0 0 53.7±2.8 26 0 1 0 1 61.2±2.6 27 0 −1 1 0 59.8±2.9 28 −1 −1 0 0 53.2±1.9 29 0 0 0 0 71.2±2.2 表 5 回归模型方差分析和系数显著性检验
Table 5 Variance analysis and significance test of regression model
方差来源 平方和 自由度 均方 F值 P值 显著性 模型项 981.76 14 70.13 18.69 < 01 ** A 25.46 1 25.46 6.79 0.0208 * B 39.79 1 39.79 10.6 0.0057 * C 1.03 1 1.03 0.28 0.6081 N D 18.33 1 18.33 4.88 0.0443 * AB 2.27 1 2.27 0.6 0.4501 N AC 0.23 1 0.23 0.06 0.8098 N AD 5.48 1 5.48 1.46 0.247 N BC 3.61 1 3.61 0.96 0.3433 N BD 0.35 1 0.35 0.093 0.7652 N CD 0.06 1 0.06 0.016 0.9011 N A2 647.23 1 647.23 172.5 < 01 ** B2 386.12 1 386.12 102.91 < 01 ** C2 95.48 1 95.48 25.45 02 ** D2 81.65 1 81.65 21.76 04 ** 残差 52.53 14 3.75 − − − 失拟项 46.57 10 4.66 3.12 0.1418 N 净误差 5.96 4 1.49 − − − 总和 1034.29 28 − − − − 注:**为极显著(P<0.001),*为显著(0.001≤P<0.05),N为不显著(P≥0.05),其中P值越小显著性越高。 -
[1] 农业部渔业渔政管理局. 中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2021. Fisheries and Fishery Administration of the Ministry of Agriculture. China fisheries statistical yearbook [M]. Beijing: China Agricultural Press, 2021.
[2] 王纯纯, 乔琨, 陈贝, 等. 河豚毒素的性质及应用研究进展[J]. 渔业研究,2021,43(5):539−548. [WANG C C, QIAO K, CHEN B, et al. Progress in the study of the nature and application of tetrodotoxin[J]. Fisheries Research,2021,43(5):539−548. [3] ZHANG J, ZOU M, ZHANG M, et al. Impact of telopeptides on self-assembly properties of snakehead (Channa argus) skin collagen[J]. Food Biophysics,2016(11):380−387.
[4] 刘永峰, 刘毅, 张振兴, 等. 鱼胶原蛋白提取方法研究进展[J]. 食品工业,2013,34(12):206−210. [LIU Y F, LIU Y, ZHANG Z X, et al. Research progress of fish collagen extraction method[J]. Food Industry,2013,34(12):206−210. [5] KOTCH F W, RONALD T R. Self-assembly of synthetic collagen triple helices[J]. P Natl Acad Sci,2006(9):3028−3033.
[6] 张建忠, 安辛欣, 王林, 等. 草鱼皮酸溶性和酶溶性胶原蛋白的提取及性质[J]. 食品科学,2006,27(12):556−559. [ZHANG J Z, AN X X, WANG L, et al. Extraction and properties of acid-soluble and enzyme-soluble collagen from grass carp skin[J]. Food Science,2006,27(12):556−559. doi: 10.3321/j.issn:1002-6630.2006.12.139 [7] 周瑞, 李若男, 周丽莎, 等. 暗纹东方鲀鱼皮胶原蛋白的提取及其特性[J]. 水产学报,2020,44(8):1349−1359. [ZHOU R, LI R N, ZHOU L S, et al. Extraction and characteristics of collagens from the skin of puffer fish[J]. Journal of Aquaculture,2020,44(8):1349−1359. [8] 王晴, 钱玉梅, 李红侠, 等. 罗非鱼鱼皮胶原蛋白酶法提取工艺及特性研究[J]. 攀枝花学院学报,2020,37(5):6−10. [WANG Q, QIAN Y M, LI H X, et al. Study on the enzymatic extraction process and characteristics of collagen from non-fish skin[J]. Journal of Panzhihua College,2020,37(5):6−10. [9] JRIDI M, NASRI R, LASSOUED I, et al. Chemical and biophysical properties of gelatins extracted from alkali-pretreated skin of cuttlefish (Sepia officinalis) using pepsin[J]. Food Research International, 2013, 54(2): 1680-1687.
[10] 严秋萍, 邬应龙, 李月娥, 等. 齐口裂腹鱼骨胶原蛋白超声波辅助提取工艺及其特性研究[J]. 食品与机械,2017,33(12):154−159. [YAN Q P, WU Y L, LI Y E, et al. Ultrasonic-assisted extraction process and its characteristics of collagen from fish collagen[J]. Food and Machinery,2017,33(12):154−159. [11] 万春燕, 王英华, 邬元娟, 等. 胶原蛋白在食品中的应用现状及其发展前景[J]. 中国食物与营养,2008(9):24−26. [WAN C Y, WANG Y H, WU Y J, et al. Current status of collagen application in food and its development prospect[J]. China Food and Nutrition,2008(9):24−26. [12] 乐彩虹, 陶宁萍, 徐逍. 暗纹东方鲀鱼皮胶原蛋白肽脱苦前后苦味物质的变化[J]. 食品与发酵工业,2021,47(4):87−95. [LE C H, TAO N P, XU X, et al. Changes in bitter substances of collagen peptides from the skin of the dark oriental fish, P. orientalis, before and after de bittering[J]. Food and Fermentation Industry,2021,47(4):87−95. [13] ARUMUGAM G, SHARMA D, BALAKRISHNAN R M, et al. Extraction, optimization and characterization of collagen from sole fish skin[J]. Sustainable Chemistry & Pharmacy,2018,9:19−26.
[14] 王镜岩. 生物化学(上册)[M]. 北京: 高等教育出版社, 2002. WANG J Y. Biochemistry (upper volume) [M]. Beijing: Higher Education Press, 2002.
[15] 闫鸣艳. 狭鳕鱼皮胶原蛋白结构和物理特性的研究[D]. 青岛: 中国海洋大学, 2009. YAN M Y. Study on the structural and physical properties of collagen from pollock skin[D]. Qingdao: Ocean University of China, 2009.
[16] SMIRNOFF N, CUMBES Q J. Hydroxyl radical scavenging activity of compatible solutes[J]. Phytochemistry,1989,28(4):1057−1060.
[17] 管雪娇, 邓尚贵. 鱿鱼皮营养成分分析[J]. 安徽农业科学,2013,41(27):11135−11137. [GUAN X J, DENG S G. Nutritional composition analysis of squid skin[J]. Anhui Agricultural Science,2013,41(27):11135−11137. doi: 10.3969/j.issn.0517-6611.2013.27.094 [18] 黄丹丹, 马良, 韩霜, 等. 超声预处理影响金枪鱼皮胶原酶解工艺及机理初探[J]. 食品与发酵工业,2017,43(4):141−146. [HUANG D D, MA L, HAN S, et al. A preliminary investigation on the process and mechanism of ultrasonic pretreatment affecting collagen digestion of tuna skin[J]. Food and Fermentation Industry,2017,43(4):141−146. [19] 杨树奇, 曾少葵, 周春霞, 等. 3种鱼皮的基本成分及氨基酸组成分析[J]. 广东海洋大学学报,2010,30(1):97−100. [YANG S Q, ZENG S K, ZHOU C X, et al. Analysis of the basic composition and amino acid composition of three fish skin species[J]. Journal of Guangdong Ocean University,2010,30(1):97−100. doi: 10.3969/j.issn.1673-9159.2010.01.019 [20] 于浩. 鹿骨胶原蛋白的制备及抗氧化活性研究[D]. 长春: 长春工业大学, 2016. YU H. Preparation and antioxidant activity of deer bone collagen[D]. Changchun: Changchun University of Technology, 2016.
[21] 荆卉, 孙俊, 牟瑶瑶, 等. 超声波物化效应及其对蛋白质改性的应用研究进展[J]. 中国食品学报,2021,21(6):321−330. [JING H, SUN J, MOU Y Y, et al. Advances in ultrasonic physicochemical effects and their application to protein modification[J]. Chinese Journal of Food,2021,21(6):321−330. [22] 史睿, 何静, 吉日木图. 超声波辅助提取骆驼皮胶原蛋白的工艺及结构表征[J]. 中国食品学报,2022,22(2):213−223. [SHI R, HE J, JI R M T, et al. Ultrasonic-assisted extraction of camel skin collagen and structural characterization[J]. Chinese Journal of Food,2022,22(2):213−223. [23] 王锡念, 徐志善, 孙钦军, 等. 超声波辅助酶解提取鮟鱅鱼皮胶原蛋白的工艺优化[J]. 食品工业科技,2019,40(1):175−180. [WANG X N, XU Z S, SUN Q J, et al. Process optimization of ultrasound-assisted enzymatic extraction of collagen from monkfish skin[J]. Food Industry Science and Technology,2019,40(1):175−180. [24] YOU J K, NO J K, JI H L, et al. 4,4'-Dihydroxybiphenyl as a new potent tyrosinase Inhibitor[J]. Biological and Pharmaceutical Bulletin,2005,28(2):323−327. doi: 10.1248/bpb.28.323
[25] 郭海阳, 莫林兰, 谭海生, 等. 茶皂素的美白功效及其抑菌和抗氧化活性研究[J]. 中国粮油学报,2020,35(6):83−89. [GUO H Y, MO L L, TAN H S, et al. Study on the whitening efficacy of tea saponins and their antibacterial and antioxidant activities[J]. Chinese Journal of Grain and Oil,2020,35(6):83−89. doi: 10.3969/j.issn.1003-0174.2020.06.013 [26] 钟秋琴. 葛根美白活性物质的分离提取及在化妆品中的应用[D]. 无锡: 江南大学, 2008. ZHONG Q Q. Isolation and extraction of whitening active substances from pueraria mirifica and their application in cosmetics[D]. Wuxi: Jiangnan University, 2008.






 下载:
下载:


 下载:
下载:
