Screening of Superior Lactic Acid Bacteria in Persimmon Vinegar Broth and Analysis of Its Tolerance and Function
-
摘要: 为了从柿子醋醪中获得适合植物基质发酵的具有产酸能力强、耐受性能好和功能性强的乳酸菌。以自然发酵的柿子醋醪为目标乳酸菌供体,采用MRS液体培养基培养、溶钙圈法初步筛选,分离得到5株乳酸菌菌株。通过对菌株的产酸能力、耐受性、抗氧化能力以及产β-葡萄糖苷酶水平进行测定,对综合性能较强的两株乳酸菌菌株进行形态学及16S rDNA分析。结果表明:经筛选鉴定得到的两株优良乳酸菌为嗜酸乳杆菌(Lactobacillus acidophilus)和植物乳杆菌(Lactobacillus plantarum)。两株乳酸菌菌株产酸能力分别为2.00、2.24 g/100 mL;最低耐受pH均为1.5;最高耐受乙醇浓度均为10%;胆盐耐受性均为1%、最高耐受NaCl浓度均为7%;对ABTS+、DPPH、O2−自由基清除能力分别为65.12%和62.26%,77.42%和68.89%,93.76%和87.89%;产β-葡萄糖苷酶能力分别为26.37,30.27 IU/L。本文从柿子醋醪中获得用于植物基质发酵的具有较强生物学性能的两株乳酸菌菌株,该菌株为益生菌的开发提供了菌种资源。Abstract: In order to obtain lactic acid bacteria (LAB) with a strong acid production capacity, good tolerance, and high function from persimmon vinegar broth, which is suitable for plant substrate fermentation. Using the persimmon vinegar broth naturally fermented as a source of lactic acid bacteria, five strains were isolated using MRS liquid culture medium and calcium-dissolving circle methods. The abilities of producing acid, tolerance, antioxidant and β-glucosidase production of the 5 LABs were measured, the morphology and 16S rDNA identification of the screened two LABs with stronger comprehensive performance were analyzed. Based on the results of the screening, Lactobacillus acidophilus and Lactobacillus plantarum were identified as two excellent strains of lactic acid bacteria. Both lactic acid bacteria produced acid at a rate of 2.00 and 2.24 g/100 mL, respectively. Among the pH tolerances, the lowest was 1.5, the highest was 10% for ethanol, 1% for bile salts, and 7% for NaCl. The scavenging abilities of screened two LABs on ABTS+, DPPH, O2- free radicals were 65.12% and 62.26%, 77.42% and 68.89%, 93.76% and 87.89%, respectively. The production of β-glucosidase were 26.37 and 30.27 IU/L. In this paper, the two LABs strains with strong biological properties were obtained from persimmon vinegar broth for plant substrate fermentation, which could provide strain resources for the development of probiotics.
-
柿子是我国特色的植物基水果,我国柿子种植面积占世界总种植面积的90%,产量占世界总产量的78%[1],居世界之首;成熟新鲜的柿果中含有大量的维生素A、维生素C、钙、磷、铁等营养物质[2]。但柿果多产于山区,虽产量大却不耐贮存和运输,导致大量柿子腐烂,由此风味物质丰富、健康营养的果醋应运而生[3]。
乳酸菌(Lactic acid bacteria,LAB)是一类发酵碳水化合物产生乳酸的厌氧或兼性厌氧型革兰阳性细菌[4-5]。乳酸菌代谢产生的有机酸[6]等物质具有降低胃肠道pH、抑制或杀死肠道病原菌[7]、调节肠道菌群平衡[8-9]、改善食品风味[10]、提高食品的保藏性和附加值[11]的特点。因而人们将乳酸菌作为一种安全无毒的功能微生物被广泛应用于食品、医药等领域[12-13]。贺晓洁等[14]从传统发酵辣椒制品中筛选出1株耐盐乳酸菌并将其应用于红酸汤生产中;朱坤[15]、王文涛等[16]通过筛选得到优良乳酸菌并将其应用于发酵饲料中,发现动物肉质更加健康;孙悦等[17]从酸菜汤中分离筛选出对耐药性Escherichia coli拮抗活性较强的乳酸菌,以期利用生物抗菌剂控制耐药菌的生长。随着人们对食品健康化、多样化的消费需求,对乳酸菌在不同发酵基质中的适应性和耐受性提出了更高的要求,目前在非乳基质中现有的乳酸菌具有存在生长缓慢及需要驯化的问题[18],因此筛选适合植物基质发酵的乳酸菌是开发益生菌类相关健康食品的关键问题之一。
研究发现自然发酵的柿子醋醪中含有一定量的具有耐高酸醇特性的乳酸菌[19]。因此本文以自然发酵的柿子醋醪为优良乳酸菌的供体,筛选出具有产酸能力强、耐受性能好、抗氧化能力强及产β-葡萄糖苷酶水平高且潜在具有适合于植物基质发酵能力的优良乳酸菌,为进一步应用和开发乳酸菌相关健康品提供了菌种资源。
1. 材料与方法
1.1 材料与仪器
柿子醋醪 洛阳市柿王醋业有限公司;Ezup柱式细菌基因组DNA抽提试剂盒 生工生物工程股份有限公司;E.Z.N.A™ Mag-Bind Soil DNA Kit OMEGA生物;Qubit3.0 DNA检测试剂盒 Life Technologies;Qubit® 3.0荧光剂 美国英杰生命技术有限公司;DPPH、ABTS 上海蓝季生物科技发展有限公司;Tris 天津市科密欧化学试剂有限公司;对硝基苯基-β-D-吡喃半乳糖苷(pNPG) 上海源叶生物科技有限公司;MRS液体培养基 蛋白胨10 g、牛肉膏10 g、酵母粉5 g、葡萄糖20 g、K2HPO4 2 g、柠檬酸三胺2 g、乙酸钠5 g、吐温80 1 mL、MgSO4 0.58 g、MnSO4 0.25 g、蒸馏水1000 mL;选择培养基 在MRS液体培养基的基础上添加2%的琼脂以及1%的CaCO3。
Pico-21台式离心机 美国Thermo Fisher科技公司;UV-2600紫外可见分光光度计 尤尼柯(上海)仪器有限公司;XSP-2CA显微镜 上海光学仪器六厂;DYCZ-21电泳槽 北京市六一仪器厂;FR-1000凝胶成像系统 上海复日科技有限公司;ETC 811 PCR仪 北京东胜创新生物科技有限公司。
1.2 实验方法
1.2.1 乳酸菌的分离与纯化
取柿子醋醪3 mL于MRS液体培养基中进行菌体培养,梯度稀释至10−7、10−8、10−9并吸取200 μL涂布于MRS选择培养基上,每个稀释度做3个平行试验,37 ˚C恒温培养36~48 h。观察菌落,将产生溶钙圈的菌落单独选取出来,并对菌落的形态进行记录[20]。
1.2.2 菌株形态学特性
1.2.2.1 菌落表型
观察并记录菌落的透明程度、颜色、表面光滑程度、边缘形状、大小、干湿状态及凹凸情况等。
1.2.2.2 革兰氏染色及镜检
用接种环挑取适量已纯化的不同表型的单菌落固定到载玻片上。进行革兰氏染色、镜检,选取细胞呈杆状或球状的革兰氏阳性菌进行后续实验[21]。
1.2.3 菌株的发酵特性
1.2.3.1 菌株生长曲线
将菌株活化后,接种至MRS液体培养基中于37 ℃静置培养,每隔4 h取样,在600 nm处测定吸光度,以培养时间(0~72 h)为横坐标,OD值为纵坐标,绘制生长曲线[22]。
1.2.3.2 产酸能力
参照步骤1.2.3.1,每隔4 h取样测定总酸度值(以乳酸计)并记录。以培养时间72 h为横坐标,MRS培养液的酸度值为纵坐标,绘制供试菌株产酸值动态变化曲线;总酸度测定参照GB 12456-2021食品中总酸的测定[23],结果以乳酸计。
1.2.4 菌株的耐受性
1.2.4.1 耐酸性测试
将供试菌株活化后分别接种到pH为1.5、2.5、3.5、4.5、5.5的培养基中静置培养[24],24 h时取样测OD600值,用相应空白培养基作参比,每组实验做三次。
1.2.4.2 耐乙醇能力
将供试菌株分别接种到乙醇浓度为2%、4%、6%、8%、10%的培养基中静置培养[24],24 h时取样测OD600值,用相应空白培养基作参比,每组实验做三次。
1.2.4.3 耐胆盐测试
将供试菌株分别接种到猪胆盐浓度为0.05%、0.1%、0.5%、1.0%、1.5%的培养基中静置培养[24],24 h时取样测OD600值,用相应空白培养基作参比,每组实验做三次。
1.2.4.4 耐渗透压能力
将供试菌株分别接种到NaCl质量分数为3%、4%、5%、6%、7%、8%的培养基中静置培养[25],24 h时取样测OD600值,用相应空白培养基作参比,每组实验做三次。
1.2.5 菌株的功能性分析
1.2.5.1 抗氧化性
发酵上清液的制备:将菌株活化后,接种至MRS液体培养基中37 ℃静置培养。菌株传至3代培养24 h后,10000 r/min离心10 min,收集发酵上清液。
DPPH自由基清除率的测定:取5 mL DPPH溶液,加入0.6 mL上清液混匀,避光放置30 min,517 nm处测其吸光度记为A1,按公式计算DPPH自由基的清除率[26]:
式中:E为自由基清除率,%;A0为以蒸馏水代替样品测得的吸光度值;A2为以无水乙醇代替DPPH溶液测得的吸光度值。
超氧阴离子自由基( O2−·)清除率的测定:取1 mL上清液,加入5 mL Tris-HCl缓冲液振荡混匀后,加入12 mmol/L邻苯三酚0.2 mL,反应4 min后加入0.2 mL浓HCl终止反应,320 nm处测吸光度为A1,按公式计算O2−·清除率[27]:
式中:E为自由基清除率,%;A0为以蒸馏水代替样品测得的吸光度值;A2为以蒸馏水代替邻苯三酚溶液测得的吸光度值。
ABTS+自由基清除率的测定:取上清液2 mL,加入8 mL ABTS工作液,振荡混匀6 min后于734 nm处测定其吸光度为A1,按公式计算ABTS+自由基的清除率[28]:
式中:E为自由基清除率,%;A0为以蒸馏水代替样品测得的吸光度值;A2为以0.2 mol/L pH7.4的磷酸缓冲液代替ABTS+工作液测得的吸光度值。
1.2.5.2 产β-葡萄糖苷酶能力
对硝基苯酚(pNP)标准曲线:分别配制浓度为5、10、20、30、40、50、60 μmoL/L的pNP标准溶液,分别取2 mL不同浓度标准溶液加入1 mL的Na2CO3溶液混匀,400 nm下测定其吸光度值[29]。pNP标准曲线方程:y=0.0123x−0.0066,R2=0.9994。
菌株培养24 h,4 ℃条件下10000 r/min离心10 min,收集菌体。用生理盐水重悬2次后得粗酶液。将粗酶液经沸水浴加热10 min即得到失活的酶液。
β-葡萄糖苷酶的活性测定:取0.1 mL粗酶液,加入1.8 mL pH5.0的乙酸-乙酸钠缓冲溶液,于37 ℃水浴预热5 min;加入已于37 ℃水浴预热10 min的5 mmol/L的对硝基苯基-β-D-吡喃半乳糖苷(pNPG)溶液1 mL,10 min后加入1 mL Na2CO3溶液终止反应,于400 nm处测吸光值,以失活的酶液为空白,计算酶活力[30]:
式中:U为酶活力,IU/L;C为pNP含量,μmol/L;10为反应时间,min;N为原酶液稀释倍数;0.1为添加酶液体积,mL。
1.3 菌株分子生物学鉴定
1.3.1 基因组DNA提取
采用Ezup柱式细菌基因组DNA抽提试剂盒(SK8255),按照试剂盒使用说明进行细菌基因组DNA抽提。
1.3.2 PCR扩增
采用引物27F(5'-AGTTTGATCMTGGCTCAG-3')和1492R(5'-GGTTACCTTGTTACGACTT-3')。PCR反应体系为:Mix混合物15 μL;双蒸水12 μL;DNA模版1 μL;正反引物各1 μL,扩增程序为:96 ℃预变性5 min;96 ℃变性20 s;62 ℃退火20 s;72 ℃延伸30 s;共35个循环,得到PCR产物[31]。line-height-add:-0.3pt
1.3.3 PCR产物检测及纯化
将PCR产物进行琼脂糖凝胶电泳检测,使用1%琼脂糖凝胶、150 V电压、100 mA电流电泳20 min观察条带性状。按照磁珠纯化标准操作流程对PCR产物进行纯化。
1.3.4 测序及结果比对
对PCR产物进行琼脂糖凝胶电泳检测及纯化后上机检测,测序工作委托六合华大基因科技有限公司进行。将测序结果进行Blast比对,并采用MEGA 7构建系统发育树。
1.4 数据处理
采用Excel 2016、Origin 2018、MEGA 7和SPSS 23.0数据软件进行数据处理与分析。
2. 结果与分析
2.1 乳酸菌筛选结果
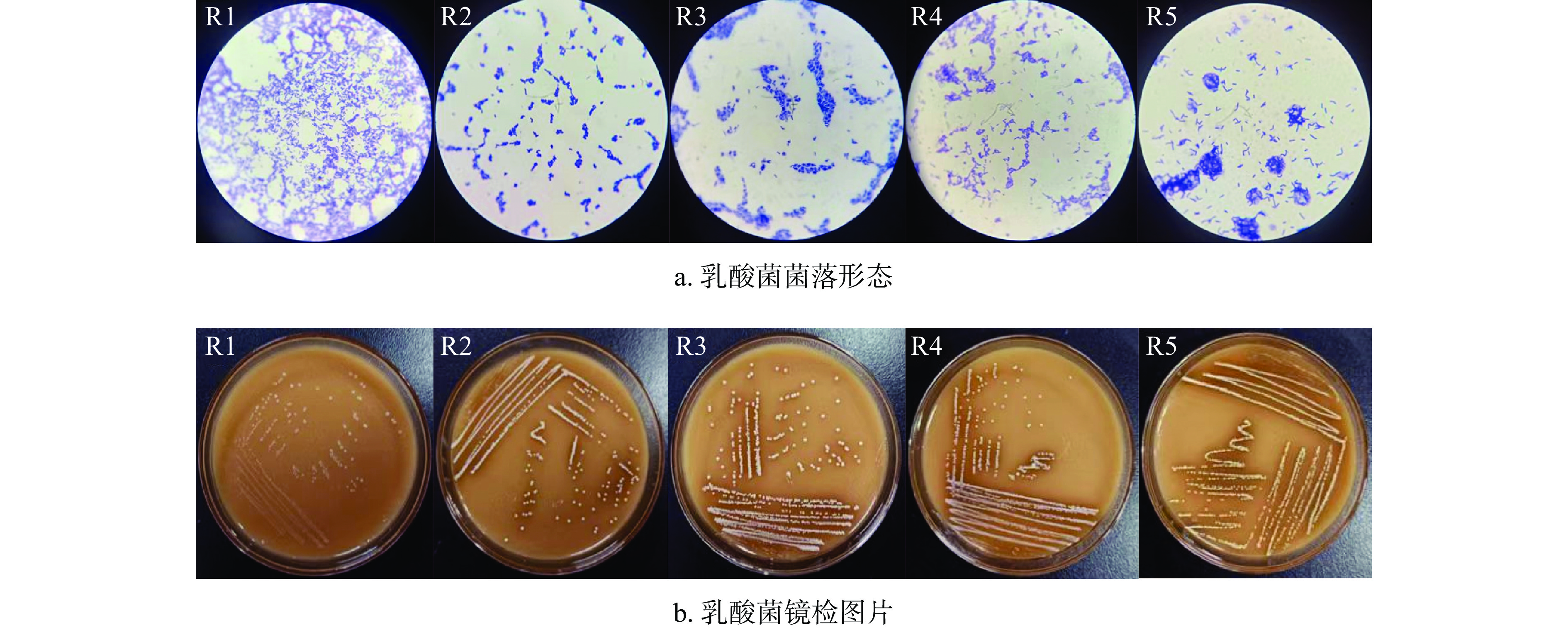
通过培养纯化,共筛选到五株乳酸菌,分别编号为R1、R2、R3、R4、R5。菌落形态见图1a:五株乳酸菌菌落均呈乳白色且表面凸起、边缘光滑、湿润有光泽;革兰氏染色镜检结果见图1b:菌株染色结果均为阳性,细胞形态为杆状且无芽孢,单个、成对或成簇排列。
2.2 菌株的发酵特性
2.2.1 菌株的生长曲线
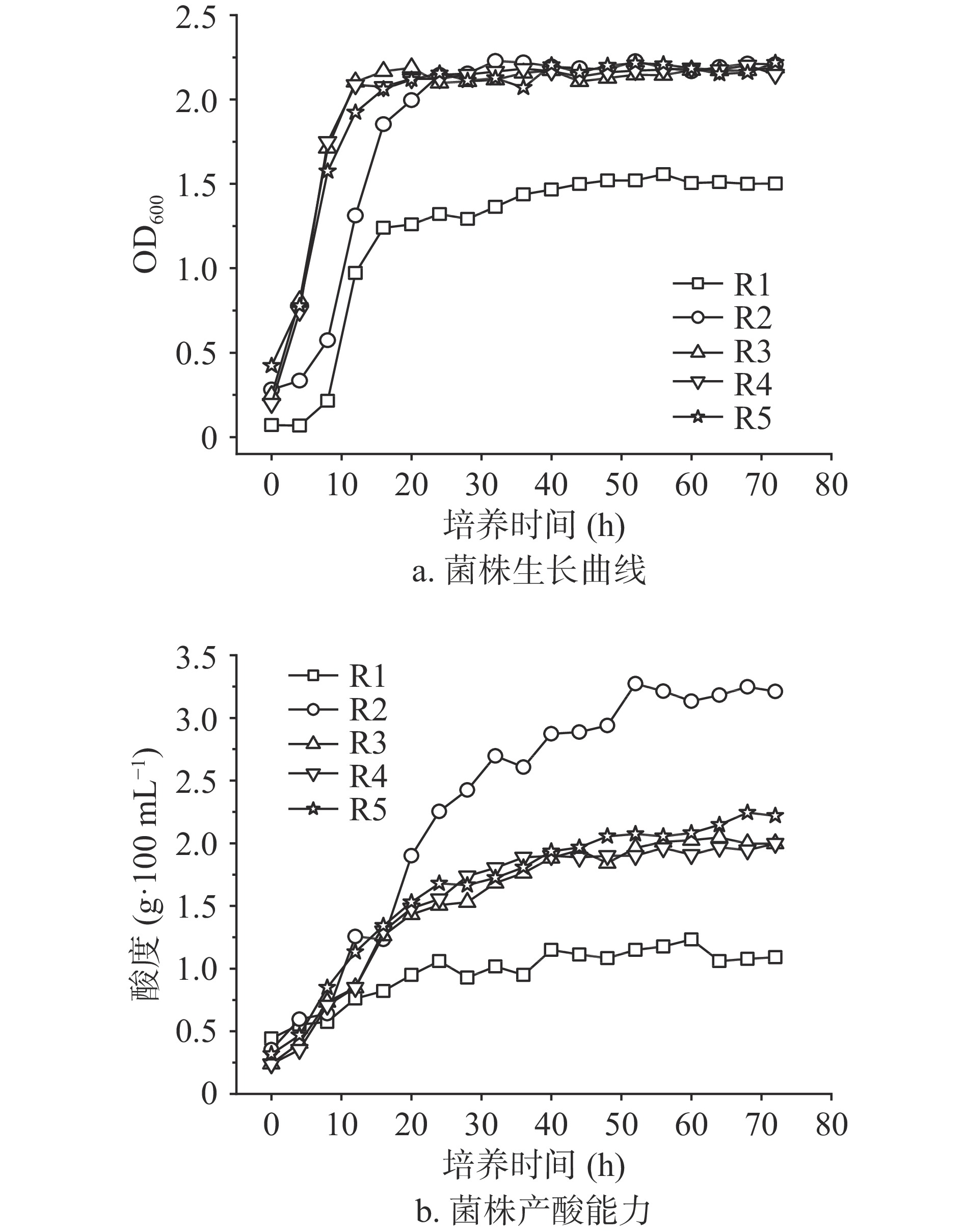
根据图1的筛选结果,对五株乳酸菌进行生长曲线研究,结果如图2a所示。R1~R5均经过约4 h的延滞期后进入对数生长期。在前4 h,R3~R5的生长速度比R1、R2快;4 h后均进入对数生长期,菌体量急剧增加;20 h左右进入稳定期,菌体浓度趋于稳定,其中R1-R4四株乳酸菌的OD值在2.0及以上,而R1生长量最低。
2.2.2 菌株的产酸能力
乳酸菌通过厌氧发酵产生乳酸、乙酸以及其他挥发性有机酸,使发酵的植物基质pH降低,从而抑制有害微生物滋生,达到改善物质营养、风味及延长保存期的目的[7,10]。结果如图2b所示,R1产酸能力最弱,在25 h前产酸速率稍强,25 h后呈现小幅度波动,产乳酸量最高为1.233 g/100 mL;R2产酸能力最强,前30 h产酸速率大,30 h后逐渐减慢,最高达到3.248 g/100 mL;R3~R5产酸能力差别不大,前25 h产酸速率较大,25 h后产酸速度减慢,产酸量最高分别为2.011、1.997和2.245 g/100 mL。五株乳酸菌产酸速率均呈现先快后慢直至不再增加的趋势,通过图2综合分析这可能是因为前期营养物质丰富、菌体量少,乳酸菌不断增殖而产酸速率较快;但随着营养物质的锐减、菌体量逐渐呈饱和状态,以及环境pH不断下降,导致乳酸菌的产酸速率减慢直至不再增加。
2.3 菌株的耐受性及功能性结果
2.3.1 菌株的耐受性
2.3.1.1 菌株耐酸能力
具有较强耐酸能力的乳酸菌才能顺利通过胃酸屏障,到达肠道内发挥其益生作用[25]。对五株乳酸菌进行耐酸性实验,结果如表1所示,随着pH的不断减小,菌株的生长能力呈减弱趋势,说明环境pH降低后,乳酸菌的生长受到了一定程度的阻碍,甚至死亡,菌体量急剧下降。在pH为1.5~2.5时,R2~R5的生长受到抑制,但仍有一定的存活和生长;而R1在五组不同pH条件下,均呈现较低的生长量,说明R1的耐酸性最差。pH为2.5时,R4生长情况最好,其OD值为0.25,R2、R3、R5没有明显差别;在pH为3.5时,R5生长情况最佳,其OD值高达1.194,其次是R3、R2和R4。姜蕾等[32]对筛得的axb74和axb79菌株进行耐酸性实验,结果发现axb74最高耐酸为pH3.5,其OD值为0.18;axb79最高耐酸为pH3.0,其OD值为0.16。本实验筛得的菌株R2~R5在pH1.5和pH2.5时OD值均在0.13以上;当pH为3.5及以上时,OD值高达0.4以上,其耐酸性远远优于axb74和axb79菌株。
表 1 菌株耐酸能力Table 1. Acid resistance of the strains菌株编号 不同pH对应的OD值 1.50 2.50 3.50 4.50 5.50 R1 0.033±0.002Bb 0.035±0.002Cb 0.040±0.001Eb 0.062±0.006Eb 0.0686±0.004Ba R2 0.135±0.002Ad 0.144±0.003Bd 0.616±0.004Cc 2.029±0.029Bb 2.477±0.067Aa R3 0.144±0.005Ad 0.143±0.003Bd 0.724±0.008Bc 1.73±0.032Db 2.472±0.031Aa R4 0.161±0.002Ae 0.250±0.014Ad 0.418±0.008Dc 1.876±0.025Cb 2.468±0.096Aa R5 0.146±0.001Ad 0.166±0.005Bd 1.194±0.009Ac 2.104±0.019Ab 2.478±0.108Aa 注:不同大写字母表示同一pH不同菌株差异显著(P<0.05);不同小写字母表示同一菌株不同pH差异显著(P<0.05)。 2.3.1.2 菌株耐乙醇能力
在植物基质发酵过程中通常会加入酵母菌等益生菌进行协同发酵,而酵母菌在发酵过程中会产生乙醇[33-34],因此耐乙醇能力也是筛选乳酸菌的重要指标。对五株乳酸菌进行耐乙醇实验,结果如表2所示,随着乙醇浓度的不断增加,菌株的生长能力呈显著减弱趋势,说明在高浓度的乙醇中乳酸菌的生长会受到一定程度的影响。在耐乙醇能力实验中,由表2可知R4的耐乙醇能力最强,R1最差。当乙醇浓度为4%时,R4和R2的菌体量最大。当乙醇浓度提高到10%时,R4和R5的菌体量最大,R3、R2次之,但这四株乳酸菌的OD值仍高达0.95以上;有文献[32]报道发现筛得的axb74和axb79菌株在乙醇浓度为10%时,菌株R2~R5的OD值远大于axb74和axb79菌株的OD值。
表 2 菌株耐乙醇能力Table 2. Ethanol resistance of the strains菌株编号 不同乙醇浓度对应的OD值 2% 4% 6% 8% 10% R1 1.098±0.007Ca 0.990±0.008Db 0.562±0.003Dc 0.167±0.011Dd 0.086±0.006Ee R2 2.405±0.035Ba 2.121±0.019Bb 1.837±0.017Bc 1.663±0.005Bd 0.950±0.004De R3 2.402±0.045Ba 1.917±0.008Cb 1.706±0.010Cc 1.330±0.004Cd 1.075±0.003Ce R4 2.635±0.034Aa 2.370±0.135Ab 2.108±0.012Ac 1.902±0.026Ad 1.611±0.008Ae R5 2.645±0.031Aa 2.117±0.032Bb 2.080±0.022Ab 1.904±0.015Ac 1.481±0.016Bd 注:不同大写字母表示同一乙醇浓度下不同菌株差异显著(P<0.05);不同小写字母表示同一菌株不同乙醇浓度下差异显著(P<0.05)。 2.3.1.3 菌株耐胆盐能力
小肠内胆盐的含量一般在0.03%~0.3%,只有具有一定胆盐耐受能力的乳酸菌才能通过肠道,进而对人体发挥其益生作用,因此乳酸菌的耐胆盐能力也是在肠道存活的重要条件[35]。五株乳酸菌对胆盐的耐受性能测试数据如表3所示,其结果表明,除R1外,其余四株乳酸菌在胆盐浓度为0.05%~0.5%时生长状态良好,其中R2和R3表现出了较强的胆盐耐受性,其OD值均在0.99以上,说明可以在正常的胆盐范围内大量存活。胆盐浓度为1%时,菌株的胆盐耐受性能均减弱,但R3、R2仍有大量菌体存活;当胆盐浓度为上升至1.5%时,R2生长情况明显高于其他四株乳酸菌。相较王娴等[36]研究的乳酸菌A、B,菌株R2~R5的耐胆盐能力更好。
表 3 菌株耐胆盐能力Table 3. Bile salt tolerance of the strains菌株编号 不同猪胆盐浓度对应的OD值 0.05% 0.1% 0.5% 1% 1.5% R1 0.094±0.006Dd 0.350±0.006Eb 0.702±0.003Da 0.146±0.002Dc 0.046±0.010De R2 1.992±0.012Ba 1.942±0.017Ba 0.996±0.005Bb 0.538±0.004Bc 0.421±0.016Ad R3 2.063±0.016Aa 2.060±0.026Aa 1.108±0.003Ab 0.663±0.005Ac 0.133±0.020Cd R4 1.693±0.013Ca 0.835±0.008Dc 1.026±0.010Bb 0.528±0.003Bd 0.109±0.009Ce R5 2.083±0.041Aa 0.993±0.004Cb 0.743±0.008Cc 0.477±0.021Cd 0.367±0.014Be 注:不同大写字母表示同一胆盐浓度下不同菌株差异显著(P<0.05);不同小写字母表示同一菌株不同胆盐浓度下差异显著(P<0.05)。 2.3.1.4 菌株耐渗透压能力
当体内渗透压浓度突然变化时会影响乳酸菌生长代谢[25]。因此对五株乳酸菌进行了耐渗透压实验,结果如表4所示,五株乳酸菌生长能力均随着NaCl浓度的增大而显著降低,说明NaCl浓度对菌株的生长有一定的抑制作用。在相同NaCl浓度环境条件下各菌株的生长状态不同,表明不同菌株对NaCl的耐受能力有差异。R2、R3表现的耐渗透压能力最强,R1最差。当NaCl浓度为3~5%时,R5生长状态良好,OD值均稳定在1.69以上;当NaCl浓度升高到6%及以上时,R2和R3的生长能力明显高于其他三株乳酸菌,说明R2和R3相比较其他菌株具有较强的耐渗透压能力。王娴等[36]在对A、B两株乳酸菌进行耐渗透压实验时发现:当NaCl浓度为7%、培养24 h时,乳酸菌A的OD值为0.4左右,乳酸菌B的OD值仅为0.1左右,其耐渗透压能力低于菌株R2~R5。
表 4 菌株耐渗透压能力Table 4. Osmotic pressure resistance of strains菌株编号 不同NaCl浓度对应的OD值 3% 4% 5% 6% 7% R1 0.582±0.005Ca 0.437±0.037Cb 0.285±0.002Ec 0.212±0.004Dc 0.082±0.003Cd R2 2.432±0.025Aa 2.270±0.046Ab 1.906±0.011Bc 1.237±0.014Ad 0.605±0.002Ae R3 2.398±0.081Aa 2.222±0.016Ab 1.695±0.012Cc 1.101±0.004Bd 0.664±0.012Ae R4 2.085±0.033Ba 1.646±0.008Bb 1.212±0.004Dc 0.718±0.004Cd 0.466±0.008Be R5 2.350±0.097Aa 2.256±0.128Aa 2.081±0.018Ab 0.792±0.003Cc 0.488±0.005Bd 注:不同大写字母表示同一NaCl浓度下不同菌株差异显著(P<0.05);不同小写字母表示同一菌株不同NaCl浓度下差异显著(P<0.05)。 2.3.2 菌株的功能性
2.3.2.1 菌株的抗氧化性
当机体代谢过程中产生的自由基含量过高时,生物大分子与其结合会造成机体损伤,引发多种疾病[37]。因此探究了这五株乳酸菌清除ABTS+、DPPH和O2−自由基的能力。如图3a可知,五株菌株对ABTS+自由基的清除能力无明显差异,且均大于60%;R1对DPPH自由基的清除能力高达89.69%,其余四株乳酸菌对的DPPH自由基的清除率也均高于65%,且R1对DPPH自由基的清除能力明显高于R2~R5;对O2−自由基的清除能力R2~R5均在80%以上,其中R2高达93.76%,均远远高于R1清除O2−自由基的能力。王晓鹏等[38]在人源乳酸菌抗氧化实验中,筛选的乳酸菌对DPPH自由基的清除能力与R1~R5清除能力相差不大,但R1~R5对O2-自由基的清除能力远大于其筛得的乳酸菌。通过结果综合表明,除R1外,R2~R5四株菌株对三种自由基的清除能力均比较强。
2.3.2.2 菌株的产β-葡萄糖苷酶能力
β-葡萄糖苷酶可以使得一些植物基发酵物如水果、茶叶中的风味前体物质水解为有浓郁天然风味的香气物质,同时也可以协助纤维素酶降解纤维素[38],因此乳酸菌的产β-葡萄糖苷酶能力是衡量其发酵性能的重要指标。根据pNP标准曲线得出pNP浓度,最终测得五株乳酸菌产β-葡萄糖苷酶能力如下图3b所示,菌株产β-葡萄糖苷酶能力最强的是R3,其次为R2,分别为30.27和26.37 IU/L;最差的是R1,仅为0.47 IU/L。钱超等[39]在筛选高产β-葡萄糖苷酶的乳酸菌实验中发现,各个菌株间酶活差异较大,从2.2到10.1 U/g。本实验结果符合菌株间酶活差异较大的特点。
2.4 菌株的生物学鉴定结果
综合对比以上五株菌株的发酵特性、耐受性以及功能特性的结果分析,最终选择相对综合能力较强的R2、R3进行后续实验。R2、R3的PCR产物电泳结果如下图4所示,条带清晰可进行后续实验。测序结果为:R2和R3的16S rDNA序列碱基数分别为1492和1460 bp。
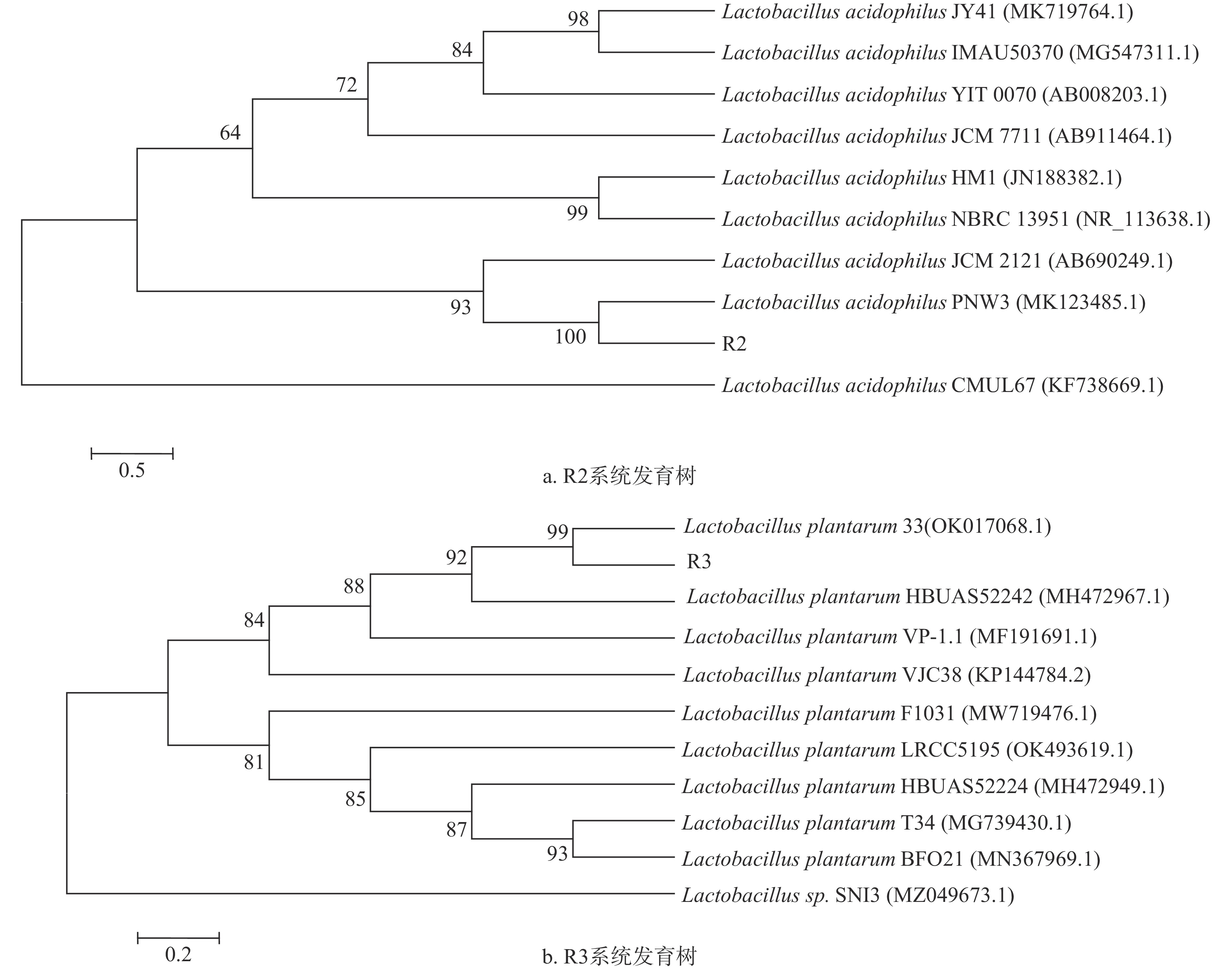
根据Blast结果,用软件MEGA 7对16S rDNA进行同源性分析,构建系统发育树,结果如图5所示。R2和R3分别与嗜酸乳杆菌(Lactobacillus acidophilus)和植物乳杆菌(Lactobacillus plantarum)同源性达到100%和99%。
3. 结论
本研究通过采用纯化培养方式从柿子醋醪中分离出五株乳酸菌,经过产酸能力、耐受性性、抗氧化能力和产β-葡萄糖苷酶能力分析,最终筛选得到两株综合能力突出的乳酸菌,其经过形态学和16S rDNA序列鉴定后,确定其为Lactobacillus acidophilus和Lactobacillus plantarum。
两株乳酸菌产酸能力分别为2.00、2.24 g/100 mL,产β-葡萄糖苷酶能力分别为26.37、30.27 IU/L;其在耐受性实验中均表现出良好的耐受能力,尤为突出的是其耐渗透压能力,当NaCl浓度升高到6%及以上时两株乳酸菌的生长能力明显高于其他菌株;且其也同时具备良好的ABTS+、DPPH和O2−自由基清除能力。
研究结果表明这两株乳酸菌具有产酸能力强、耐受性能好、抗氧化能力强及产β-葡萄糖苷酶水平高的优良品质。本实验从柿子醋醪中筛得五株乳酸菌,对乳酸菌的耐受性和功能性进行了分析,结果发现两株性能优良的乳酸菌可作为植物基质发酵的潜在益生菌;接下来可以对乳酸菌在植物基质上的发酵能力进一步分析,为适用于非乳基质上的乳酸菌提供菌种资源。
-
表 1 菌株耐酸能力
Table 1 Acid resistance of the strains
菌株编号 不同pH对应的OD值 1.50 2.50 3.50 4.50 5.50 R1 0.033±0.002Bb 0.035±0.002Cb 0.040±0.001Eb 0.062±0.006Eb 0.0686±0.004Ba R2 0.135±0.002Ad 0.144±0.003Bd 0.616±0.004Cc 2.029±0.029Bb 2.477±0.067Aa R3 0.144±0.005Ad 0.143±0.003Bd 0.724±0.008Bc 1.73±0.032Db 2.472±0.031Aa R4 0.161±0.002Ae 0.250±0.014Ad 0.418±0.008Dc 1.876±0.025Cb 2.468±0.096Aa R5 0.146±0.001Ad 0.166±0.005Bd 1.194±0.009Ac 2.104±0.019Ab 2.478±0.108Aa 注:不同大写字母表示同一pH不同菌株差异显著(P<0.05);不同小写字母表示同一菌株不同pH差异显著(P<0.05)。 表 2 菌株耐乙醇能力
Table 2 Ethanol resistance of the strains
菌株编号 不同乙醇浓度对应的OD值 2% 4% 6% 8% 10% R1 1.098±0.007Ca 0.990±0.008Db 0.562±0.003Dc 0.167±0.011Dd 0.086±0.006Ee R2 2.405±0.035Ba 2.121±0.019Bb 1.837±0.017Bc 1.663±0.005Bd 0.950±0.004De R3 2.402±0.045Ba 1.917±0.008Cb 1.706±0.010Cc 1.330±0.004Cd 1.075±0.003Ce R4 2.635±0.034Aa 2.370±0.135Ab 2.108±0.012Ac 1.902±0.026Ad 1.611±0.008Ae R5 2.645±0.031Aa 2.117±0.032Bb 2.080±0.022Ab 1.904±0.015Ac 1.481±0.016Bd 注:不同大写字母表示同一乙醇浓度下不同菌株差异显著(P<0.05);不同小写字母表示同一菌株不同乙醇浓度下差异显著(P<0.05)。 表 3 菌株耐胆盐能力
Table 3 Bile salt tolerance of the strains
菌株编号 不同猪胆盐浓度对应的OD值 0.05% 0.1% 0.5% 1% 1.5% R1 0.094±0.006Dd 0.350±0.006Eb 0.702±0.003Da 0.146±0.002Dc 0.046±0.010De R2 1.992±0.012Ba 1.942±0.017Ba 0.996±0.005Bb 0.538±0.004Bc 0.421±0.016Ad R3 2.063±0.016Aa 2.060±0.026Aa 1.108±0.003Ab 0.663±0.005Ac 0.133±0.020Cd R4 1.693±0.013Ca 0.835±0.008Dc 1.026±0.010Bb 0.528±0.003Bd 0.109±0.009Ce R5 2.083±0.041Aa 0.993±0.004Cb 0.743±0.008Cc 0.477±0.021Cd 0.367±0.014Be 注:不同大写字母表示同一胆盐浓度下不同菌株差异显著(P<0.05);不同小写字母表示同一菌株不同胆盐浓度下差异显著(P<0.05)。 表 4 菌株耐渗透压能力
Table 4 Osmotic pressure resistance of strains
菌株编号 不同NaCl浓度对应的OD值 3% 4% 5% 6% 7% R1 0.582±0.005Ca 0.437±0.037Cb 0.285±0.002Ec 0.212±0.004Dc 0.082±0.003Cd R2 2.432±0.025Aa 2.270±0.046Ab 1.906±0.011Bc 1.237±0.014Ad 0.605±0.002Ae R3 2.398±0.081Aa 2.222±0.016Ab 1.695±0.012Cc 1.101±0.004Bd 0.664±0.012Ae R4 2.085±0.033Ba 1.646±0.008Bb 1.212±0.004Dc 0.718±0.004Cd 0.466±0.008Be R5 2.350±0.097Aa 2.256±0.128Aa 2.081±0.018Ab 0.792±0.003Cc 0.488±0.005Bd 注:不同大写字母表示同一NaCl浓度下不同菌株差异显著(P<0.05);不同小写字母表示同一菌株不同NaCl浓度下差异显著(P<0.05)。 -
[1] 刘滔, 朱维, 李春美. 我国柿子加工产业的现状与对策[J]. 食品工业科技,2016,37(24):369−375. [LIU T, ZHU W, LI C M. Present situation and countermeasures of persimmon processing industry in China[J]. Science and Technology of Food Industry,2016,37(24):369−375. [2] 张清安, 陈锦屏, 刘平, 等. 柿产品的综合开发利用[J]. 农牧产品开发,2001(5):23−24. [ZHANG Q A, ZHEN J P, LIU P, et al. Comprehensive development and utilization of persimmon products[J]. Agriculture Products Development,2001(5):23−24. [3] 包蓉, 郑皓, 芦艳, 等. 柿果醋自然发酵下优势酵母菌的分离鉴定[J]. 中国酿造,2012,31(3):78−82. [BAO R, ZHENG H, LU Y, et al. Separation and identification of superior yeast at natural fermentation condition[J]. China Brewing,2012,31(3):78−82. doi: 10.3969/j.issn.0254-5071.2012.03.022 [4] 李军训, 罗学刚, 高洁, 等. 益生菌的分类、生理功能与有效性评价研究进展[J]. 中国农业科技导报,2010,12(6):49−55. [LI J X, LUO X G, GAO J, et al. Research progress on classification, physiological function and validity evaluation of probiotics[J]. Journal of Agricultural Science and Technology,2010,12(6):49−55. [5] 石青松. 乳酸菌发酵饲料的制作及其对断奶仔猪生长性能和肠道健康的影响[D]. 南京: 南京农业大学, 2016. SHI Q S. Production of lactic acid bacteria fermented solid feed and study on its effect on growth performance and intestine health in piglets[D]. Nanjing: Nanjing Agricultural University, 2016.
[6] VUYST L D, LEROY F. Functional role of yeasts, lactic acid bacteria, and acetic acid bacteria in cocoa fermentation processes[J]. FEMS Microbiology Reviews,2020,44(4):432−453. doi: 10.1093/femsre/fuaa014
[7] HAI D, KONG L, LU Z, et al. Inhibitory effect of different chicken erived lactic acid bacteria isolates on drug resistant Salmonella SE47 isolated from eggs[J]. Letters in Applied Microbiology,2021,73(1):54−63. doi: 10.1111/lam.13475
[8] LIU H, ZHANG J, ZHANG S, et al. Oral administration of Lactobacillus fermentum I5007 favors intestinal development and alters the intestinal microbiota in formula-fed piglets[J]. Journal of Agricultural and Food Chemistry,2014,62(4):860. doi: 10.1021/jf403288r
[9] LIU Z J, XU C, TIAN R, et al. Screening beneficial bacteriostatic lactic acid bacteria in the intestine and studies of bacteriostatic substances[J]. Journal of Zhejiang University-Science B,2021,22(7):533−547. doi: 10.1631/jzus.B2000602
[10] WANG Y Q, WU J T, LÜ M X, et al. Metabolism characteristics of lactic acid bacteria and the expanding applications in food industry[J]. Frontiers in Bioengineering and Biotechnology,2021,9:612285. doi: 10.3389/fbioe.2021.612285
[11] MUCK R E, NADEAU E M G, MCALLISTER T A, et al. Silage review: Recent advances and future uses of silage additives[J]. Journal of Dairy Science,2018,101(5):3980−4000. doi: 10.3168/jds.2017-13839
[12] RODRIGUEZ H, CURIEL J A, LANDETE J M, et al. Food phenolics and lactic acid bacteria[J]. International Journal of Food Microbiology,2009,132(2-3):79−90. doi: 10.1016/j.ijfoodmicro.2009.03.025
[13] 翟清燕, 郑世超, 李新玲, 等. 乳酸菌的分类鉴定及在食品工业中的应用[J]. 食品安全质量检测学报,2019,10:5260−5265. [ZHAI Q Y, ZHENG S C, LI X L, et al. Classification and identification of lactic acid bacteria and application in food industry[J]. Journal of Food Safety and Quality,2019,10:5260−5265. doi: 10.3969/j.issn.2095-0381.2019.16.006 [14] 贺晓洁, 赵良忠, 李明, 等. 耐盐乳酸菌的筛选及其诱变育种与耐受性研究[J]. 食品与发酵工业,2022,48(1):84−90. [HE X J, ZHAO L Z, LI M, et al. Screening and breeding of salt-tolerant lactic acid bacteria[J]. Food and Fermentation Industries,2022,48(1):84−90. [15] 朱坤. 发酵饲料对育肥猪生长性能、肉品质及结肠微生物的影响[D]. 南京: 南京农业大学, 2018. ZHU K. Effects of fermented feed on growth performance, meat quality and colon microbiota in finishing pigs[D]. Nanjing: Nanjing Agricultural University, 2018.
[16] 王文涛, 何鑫淼, 吴赛辉, 等. 发酵饲料对巴民杂交猪肉质性能影响的研究[J]. 猪业科学,2021,38(10):118−120. [WANG W T, HE X M, WU S H, et al. Effect of fermented feed on meat quality of hybrid of Berkshire pig and Min pig[J]. Swine Industry Science,2021,38(10):118−120. doi: 10.3969/j.issn.1673-5358.2021.10.026 [17] 孙悦, 刘佳伊, 陈璐, 等. 抗耐药性大肠杆菌乳酸菌的筛选及抑菌机制[J]. 食品科学,2021,42(2):121−127. [SUN Y, LIU J Y, CHEN L, et al. Screening of lactic acid bacteria for antagonistic activity against drug-resistant Escherichia coli and underlying mechanism[J]. Food Science,2021,42(2):121−127. [18] SALMERÓN I. Fermented cereal beverages: From probiotic, prebiotic and synbiotic towards Nanoscience designed healthy drinks[J]. Letters in Applied Microbiology,2017,65(2):114−124. doi: 10.1111/lam.12740
[19] WANG D H, WANG M Y, CAO L W, et al. Changes and correlation of microorganism and flavor substances during persimmon vinegar fermentation[J]. Food Bioscience, 2022, 46: 101565.
[20] 卢佳音. 发酵蔬菜中菌的分离鉴定及其益生性研究[D]. 哈尔滨: 东北农业大学, 2018. LU J Y. The isolation, identification and probiotic properties of lactic acid bacteria from sauerkraut[D]. Harbin: Northeast Agricultural University, 2018.
[21] 赵山山, 杨园园, 周玉岩, 等. 贵州泡菜中乳酸菌的分离鉴定及其在泡菜发酵中的应用[J]. 中国酿造,2020,39(12):113−119. [ZHAO S S, YANG Y Y, ZHOU Y Y, et al. Isolation and identification of lactic acid bacteria from Guizhou pickles and its application in pickle fermentation[J]. China Brewing,2020,39(12):113−119. [22] 栗永乐. 酸菜中乳酸菌的分离鉴定以及益生特性的研究[D]. 呼和浩特: 内蒙古农业大学, 2012. JIA Y L. The isolation, identification and probiotic properties of lactic acid bacteria from sauerkraut[D]. Hohhot: Inner Mongolia Agricultural University, 2012.
[23] 中华人民共和国国家卫生健康委员会, 国家市场监督管理总局. GB 12456-2021 食品安全国家标准食品中总酸的测定[S]. 北京: 中国标准出版社, 2021. National Health Commission of the People's Republic of China, State Administration for Market Regulation. GB 12456-2021 National food safety standard for determination of total acids in food[S]. Beijing: China Standard Press, 2021.
[24] 林龙镇, 邹卫玲, 李安章, 等. 产酸、耐酸乳酸菌的分离鉴定及益生特性[J]. 华南农业大学学报,2018,39(2):95−102. [LIN L Z, ZOU W L, LI A Z, et al. Isolation, identification and probiotic characteristics of acid-producing and acid-resistant Lactobacillus strains[J]. Journal of South China Agricultural University,2018,39(2):95−102. [25] 降初祝玛, 陈炼红, 张岩. 传统牦牛酸奶源高产胞外多糖乳酸菌特性及发酵性能[J]. 食品工业科技,2021,42(21):140−147. [JIANG C Z M, CHEN L H, ZHANG Y. The characteristics and fermentation performance of lactic acid bacteria with high extracellular polysaccharide production from traditional yak yogurt[J]. Science and Technology of Food Industry,2021,42(21):140−147. [26] TANTICHARAKUNSIRI W, MANGMOOL S, WONGSARIYA K, et al. Characteristics and upregulation of antioxidant enzymes of kitchen mint and oolong tea kombucha beverages[J]. Journal of Food Biochemistry,2021,45(1):e13574.
[27] CHENG H, HUANG G L, HUANG H L. The antioxidant activities of carboxymethylated garlic polysaccharide and its derivatives[J]. International Journal of Biological Macromolecules,2019,140:1054−1063. doi: 10.1016/j.ijbiomac.2019.08.204
[28] XIA T, YAO J H, ZHANG J, et al. Evaluation of nutritional compositions, bioactive compounds, and antioxidant activities of Shanxi aged vinegars during the aging process[J]. Journal of Food Science,2018,83(10):2638−2644. doi: 10.1111/1750-3841.14356
[29] 李志华. 产β-葡萄糖苷酶乳酸菌菌株的特性研究[D]. 延吉: 延边大学, 2014. LI Z H. Study on characteristics of lactic acid bacteria strains producing β-glucosidase[D]. Yanji: Yanbian University, 2014.
[30] 刘德海, 郝益民, 岳丹丹, 等. 一株产β-葡萄糖苷酶菌株的筛选及酶学性质研究[J]. 中国酿造,2013,32(6):47−51,60. [LIU D H, HAO Y M, YUE D D, et al. Isolation of a strain withβ-glucosidase and its enzymatic properties[J]. China Brewing,2013,32(6):47−51,60. [31] DOMINGOS-LOPES M F P, STANTON C, ROSS P R, et al. Genetic diversity, safety and technological characterization of lactic acid bacteria isolated from artisanal Pico cheese[J]. Food Microbiology,2017,63:178−190. doi: 10.1016/j.fm.2016.11.014
[32] 姜蕾, 周雪燕, 王斌, 等. 新疆酿酒葡萄表皮乳酸菌的分离鉴定及耐受性分析[J]. 中国酿造,2018,37(12):71−75. [JIANG L, ZHOU X Y, WANG B, et al. Isolation, identification and tolerance analysis of lactic acid bacteria from Xinjiang wine grape skin[J]. China Brewing,2018,37(12):71−75. doi: 10.11882/j.issn.0254-5071.2018.12.014 [33] 王静涵, 张斯童, 滕利荣, 等. 益生菌发酵中药的研究现状及产品开发[J]. 食品工业科技,2020,41(14):337−343,348. [WANG J H, ZHANG S T, TENG L R, et al. Research status and product development of probiotic fermentation of traditional Chinese medicine[J]. Science and Technology of Food Industry,2020,41(14):337−343,348. [34] 豆康宁. 微生物发酵法改良大豆肽风味[J]. 中国粮油学报,2018,33(2):31−35,66. [DOU K N. Improvement of soybean peptide flavor by microbial fermentation[J]. Journal of the Chinese Cereals and Oils Association,2018,33(2):31−35,66. doi: 10.3969/j.issn.1003-0174.2018.02.006 [35] 赵小茜, 魏旭丹, 陈戴玲, 等. 产多糖植物乳杆菌的耐酸耐胆盐能力[J]. 乳业科学与技术,2016,39(3):1−3. [ZHAO X Q, WEI X D, CHEN D L, et al. Acid and bile salt tolerance of exopolysaccharide-producing strains of Lactobacillus plantarum[J]. Journal of Dairy and Technology,2016,39(3):1−3. doi: 10.15922/j.cnki.jdst.2016.03.001 [36] 王娴, 赵湘涛. 两株乳酸菌的耐受特性分析与研究[J]. 中国酿造,2013,32(11):87−90. [WANG X, ZHAO X T. Analysis and study on the tolerance property of two lactic acid bacteria[J]. China Brewing,2013,32(11):87−90. doi: 10.3969/j.issn.0254-5071.2013.11.021 [37] 李唤宇, 高原, 牟光庆, 等. 乳酸菌抗氧化活性研究进展[J]. 食品研究与开发,2019,40(7):194−202. [LI H Y, GAO Y, MOU G Q, et al. Antioxidant activity of lactic acid bacteria[J]. Food Research and Development,2019,40(7):194−202. [38] 王小鹏, 闫爽, 高亚欣, 等. 人源乳酸菌的筛选鉴定及抗氧化活性研究[J]. 中国乳品工业,2022,50(6):16−21,64. [WANG X P, YAN S, GAO Y X, et al. Identification and antioxidant analysis of lactobacillus from elder people intestine[J]. China Dairy Industry,2022,50(6):16−21,64. [39] 钱超, 杨文丹, 张宾乐, 等. 高产β-葡萄糖苷酶的乳酸菌在葡萄汁酸面团面包中的应用[J]. 食品与机械,2017,33(5):14−20. [QIAN C, YANG W D, ZHNG B L, et al. Application of high producing β-glucosidase lactic acid bacteria in raisin sourdough bread[J]. Food and Machinery,2017,33(5):14−20.









 下载:
下载:

 下载:
下载:
