Anti-aging Effects and Mechanisms of Recombinant Human-derived Collagen on Aging Mouse Induced by D-Galactose
-
摘要: 为探究重组人源胶原蛋白(recombinant human-derived collagen,RHC)的抗衰老作用及机制,通过300 mg/kg D-半乳糖腹腔注射构建衰老小鼠模型,并采用不同剂量RHC进行干预,研究衰老模型小鼠皮肤透明质酸、胶原蛋白、脂褐素、羟脯氨酸含量、抗氧化酶活性、与表皮细胞增殖分化和胶原蛋白合成相关的关键基因、蛋白的表达量等变化。结果表明,与衰老模型组(SLM)相比,小鼠经过RHC干预后,皮肤的褶皱程度明显减轻,胶原蛋白含量和含水量显著增加(P<0.05),超氧化物歧化酶(Superoxide dismutase,SOD)含量增加,丙二醛(Malondialdehyde,MDA)含量显著减少(P<0.0001)。与SLM组相比,RHC处理组的抗氧化指标,如谷胱甘肽过氧化物酶(GSH-Px)含量显著增加,而褐质素含量、病理评分均有所降低,且不同剂量处理组之间也有一定的差异性。此外,RHC处理组小鼠皮肤中的关键基因(EGFR、TIMP-1、COL1A2、COL3A1、TGF-βⅠ、TGF-βⅡ)的表达水平呈上升趋势, MMP-1、MMP-3 基因和蛋白的表达降低。综上所述,RHC具有良好的抗皮肤衰老作用,其作用机制可能通过抗氧化、以及改善 EGFR、TGF 信号通路,调节 MMPs和TIMPs 动态平衡,促进表皮细胞的增殖分化和胶原蛋白合成从而起到延缓皮肤衰老的作用。Abstract: In order to explore the anti-aging effect and mechanism of recombinant recombinant human-derived collagen (RHC), the aging mouse model was constructed through 300 mg/kg D-galactose intraperitoneal injection, and different doses of RHC were used to study the changes of hyaluronic acid, collagen, lipofuscin, hydroxyproline content, antioxidant enzyme activity, key genes and protein expression related to epidermal cell proliferation and differentiation and collagen synthesis. The results showed that compared with the aging model group (SLM), the intervention groups that was gavaged RHC had significantly less skin folds, higher collagen content (P<0.05) and superoxide dismutase (SOD), while lower malondialdehyde (MDA) content in the skins (P<0.0001). Compared with the SLM group, antioxidant indicators such as glutathione peroxidase (GSH-Px) content were increased in the RHC intervention groups, while lipofuscin content and pathological scores were reduced, and significant effect were also observed. In addition, the expression levels of key genes and protein (EGFR, TIMP-1, COL1A2, COL3A1, TGF-βⅠ, TGF-βⅡ) were increased, while those of MMP-1, MMP-3 in the skin of mouse were decreased in the RHC intervention groups. In conclusion, RHC has a good anti-aging effect on the skin, and its mechanism may be related to increase antioxidant effect, promote the EGFR, TGF pathway, and modulate the expression balance of MMPs and TIMPs, promote the proliferation and differentiation of epidermal cells, and the synthesis of collagen.
-
Keywords:
- recombinant human-derived collagen /
- D-galactose /
- aging model /
- anti-aging /
- lipofuscin
-
衰老是机体随着年龄增长而发生的一种退行性变化过程[1],受多种因素调控,涉及机体的不同组织与细胞[2],其中,皮肤衰老是其重要的表现形式,如皱纹出现、皮肤干燥、角化过度以及色素沉着[3]。此外,老年斑[4]的出现也标志着组织和细胞进入衰老阶段。Ogrodnik等[5]认为衰老是损伤与改变的过程和稳定替换与修复过程相互作用的结果,但以上两个过程均涉及基因作用、氧消耗率、代谢率及自由基的产生。大量证据表明[6],正常的衰老过程是由一个活性氧(ROS)诱导的多步骤过程。另外,线粒体功能障碍也是衰老的特征之一[7],据相关研究报道,可以通过抗氧化和延长端粒的方式延缓细胞衰老[8]。目前发现,白藜芦醇[9]、雷帕霉素[10]、姜黄素[11]等药物具有抗衰老的作用,但都存在一些局限性,主要表现为生物利用率低。因此,寻找和探索新的抗衰老药物就显得尤为重要。
胶原蛋白又称胶原质,主要从动物组织中提取,并通过基因工程菌进行高密度发酵得到[12]。是一种能够在一定程度上延缓细胞衰老的蛋白肽[13],它主要包括动物胶原蛋白和重组人源胶原蛋白(recombinant human-derived collagen,RHC)两种。重组人源胶原蛋白(RHC)是根据人胶原蛋白的特性进行优化或引入特殊功能的氨基酸序列,通过重组表达得到的具有类似胶原蛋白特性的蛋白[14]。它具有独特的化学结构,与动物源的胶原蛋白相比,重组型人源胶原蛋白具有良好的生物相容性与生物降解性[15-16],在生物医用材料、美容化妆品、食品保健等领域有着广阔的应用前景[17-18]。重组人源胶原蛋白(RHC)作为一种新型胶原蛋白,与人的皮肤细胞同根同源,具有基因亲和性,可以外源性地给予皮肤补充胶原蛋白,连接皮肤因创伤和感染造成的皮肤纤维断裂,抑制黑色素生成,抑制瘢痕,加速皮肤愈合[19]。郭亚媛[20]通过HE染色实验发现,小鼠经RHC/TG-cell处理后,发现其能够促进损伤皮肤的修复,能够使缺损皮肤在短时间内再生,促进成纤维细胞分泌细胞生长所需的生长因子。另外,牛佳玮等[21]通过给小鼠灌胃恭城油茶发现恭城油茶能够较好的抑制肝损伤从而进一步延缓衰老。
现阶段国内外对重组人胶原蛋白的研究都集中在骨修复[22]、皮肤创面敷料[23]、肌腱修复[24]、药物输送[25-26]、和美容[27]等方面,对于抗衰老方面的研究鲜有,且对其抗衰老机制尚不清楚,因此本实验以D-半乳糖衰老小鼠为衰老模型,通过测定皮肤中衰老基础指标、抗氧化酶活性及关键基因和蛋白的表达来探究RHC胶原蛋白的抗衰老机制,为开发以RHC胶原蛋白为原料的新型保健食品奠定了试验基础。
1. 材料与方法
1.1 材料与仪器
重组人源胶原蛋白(RHC) 由江苏江山聚源生物技术有限公司提供;胶原蛋白 由深圳金富源生物科技有限公司提供,嘉丽达产品,纯度为91.9%;SPF级KM雌性小鼠 体重18~22 g,由广东省医学实验动物中心提供,生产许可证号:SCXK(粤)2018-0002,实验动物质量合格证号:NO.44007200092153;饲料 由广东省医学实验动物中心提供,许可证号:粤饲证(2019)05073,合格证号:NO.44200300022730。小鼠饲养于本单位屏障实验室,实验动物使用许可证号:SYXK(粤)2018-0137;ELISA Kit试剂盒 上海碧云天生物试剂有限公司;谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)、总抗氧化能力(T-AOC)、过氧化氢酶(CAT)、丙二醛(MDA)试剂盒、ELISA抗氧化酶试剂盒 均由南京建成生物工程研究所提供;多聚甲醛 由济南腾博化工有限公司提供;二甲苯 由东莞市新都化工有限公司提供;巴比妥钠 纯度为99%,由湖北成丰化工有限公司提供。
PHS2-25超低温冰箱 青岛海尔;POWER/PAC3000电泳仪 美国Bio-Rad;Varioskan Lux多功能酶标仪 无锡华卫德朗仪器有限公司;H2050R冷冻离心机 上海卢湘仪离心机仪器有限公司;赛多利斯电子天平 上海精密仪器仪表有限公司;HistoStar组织包埋机 沈阳恒松科技有限公司;HM340E病理切片机 深圳市汇沃科技有限公司;TPJ-A组织摊片机 金华市益迪医疗设备有限公司;奥斯微专业金相光学显微镜 东莞市瑞显光学仪器有限公司;Bio-Rad凝胶成像系统 伯乐生命医学产品(上海)有限公司(bio-rad);检测试剂盒均由客户提供,包括皮肤组织中透明质酸、羟脯氨酸和脂褐素,血清炎症因子和血清抗氧化指标的检测试剂盒。
1.2 实验方法
1.2.1 动物分组及处理
参照Kong等[28]的实验造模方法稍作修改,如表1,将72只SPF级KM雌性小鼠随机分为6组,每组12只,分别为NC正常对照组、SLM衰老模型组、RHC低、中、高剂量组,300 mg/kg的DC胶原蛋白干预组;其中,NC对照组小鼠每日于颈背处皮下注射等体积0.85%生理盐水;SLM组小鼠每日于颈背处皮下注射300 mg/kg的D-半乳糖,其余各组每日皮下注射300 mg/kg的D-半乳糖造模后,每天早上一次性经口灌胃给药相应胶原蛋白,低、中、高剂量分别为50、500、1000 mg/kg;连续灌胃6周,一周称量一次小鼠体重,根据体重计算给药体积(0.1 mL/10 g)。
表 1 实验分组与设计Table 1. Experimental group and design编号 组别 受试物 剂量(mg/kg) 给药方式 给药周期 小鼠数量 NC 正常对照组 − − ig 6 周 12只 SLM 衰老模型组 − − ig 6 周 12只 LRHC RHC低剂量 RHC低剂量 50 ig 6 周 12只 MRHC RHC中剂量 RHC中剂量 500 ig 6 周 12只 HRHC RHC高剂量 RHC高剂量 1000 ig 6 周 12只 DC 胶原蛋白干预组 胶原蛋白 1000 ig 6 周 12只 注:ig表示经口灌胃。 1.2.2 血清及皮肤组织匀浆的制备
参照Kong等[28]的实验方法稍作修改,使用1%巴比妥钠(3.5 μL/g)麻醉各组小鼠,用眼球采血法将全血放置2 mL EP管中,4 ℃冰箱内静置2 h后,在低温冷冻离心机以3500 r/min离心15 min,取上清液分装并放置于−80 ℃冰箱内保存备用;
剪取2 cm×2 cm背部皮肤,剪去皮下组织,用预冷生理盐水冲洗干净,剪成2块,一部分放置于固定液中,另一部分放于封口袋中于−80 ℃冰箱中冻存;
1.2.3 皮肤中透明质酸、羟脯氨酸、胶原蛋白、脂褐素含量的测定
参照薛文等[29]的方法,采用ELISA Kit分别测定皮肤组织中透明质酸、羟脯氨酸、胶原蛋白、脂褐素含量Ⅰ型和Ⅲ型胶原蛋白的含量。
1.2.4 RHC对小鼠皮肤组织中抗氧化指标测定
参照钟召兵[30]的方法稍作修改, 采用ELISA抗氧化酶试剂盒检测皮肤组织上清液中抗氧化酶活性。
1.2.5 RHC对小鼠关键基因表达水平测定
参照林才云等[31]的方法,用Trizol法提取皮肤组织RNA,采用5×PrimeScript RT Master Mix进行逆转录合成cDNA,SYBR Premix Ex Taq Ⅱ试剂盒进行qPCR,分别测定MMP-1、MMP-3、TIMP-1、EGFR、COL3A1、COL2A1基因表达量。
1.2.6 RHC对小鼠的关键蛋白表达水平测定
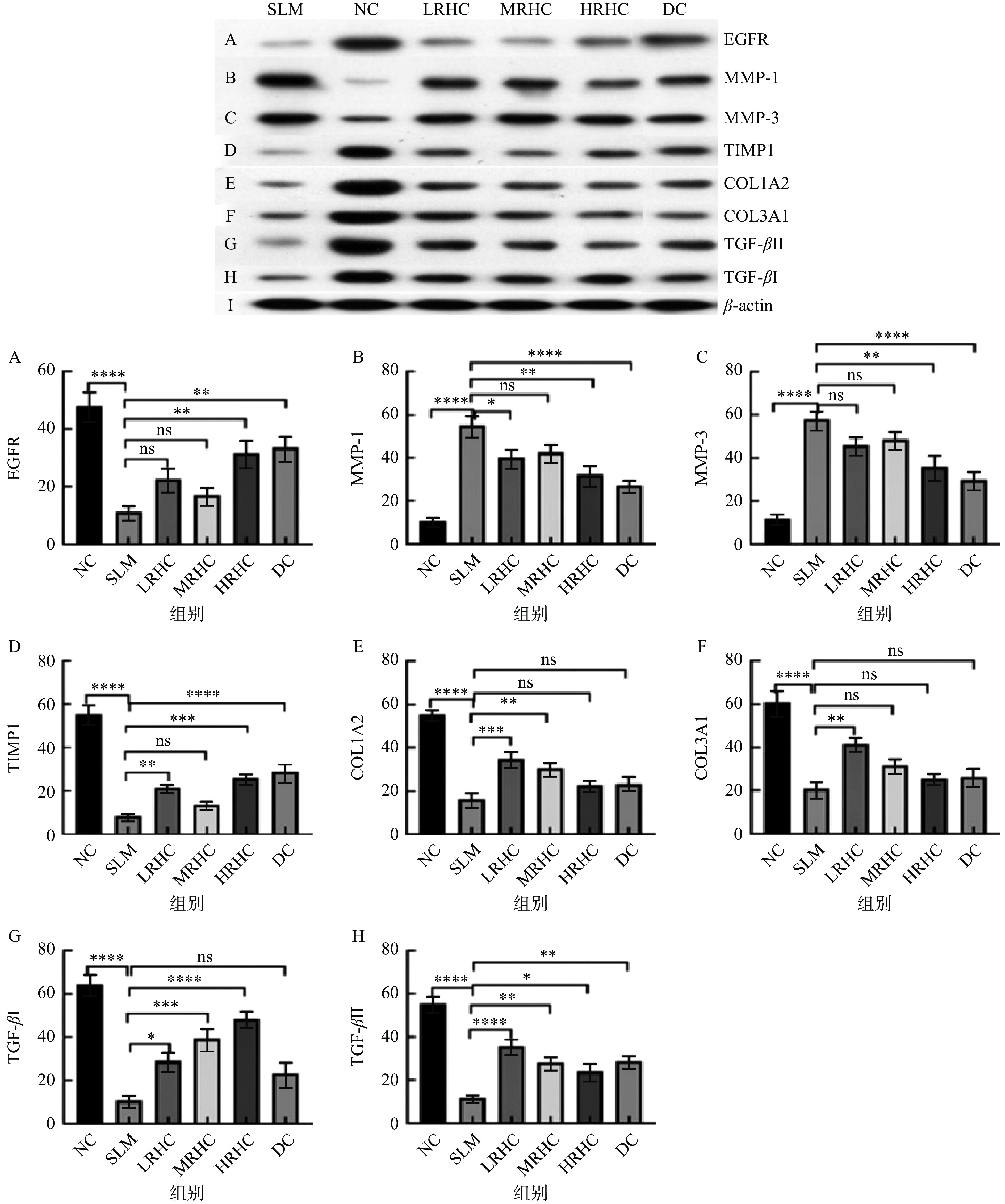
提取小鼠皮肤总蛋白,以12% SDS-PAGE凝胶电泳分离,转膜2 h至甲醇处理后的聚丙二氟乙烯膜(PVDF)上,转膜,置于摇床,用含5%脱脂奶粉的TBS-T封闭液封闭1 h,然后加入一抗β-actin(1:50000)、MMP-1(1:500)、MMP-3(1:500)、TIMP-1(1:500)、EGFR(1:500)室温孵育2 h,采用TBS-T洗5次,每次15 min,加入二抗(1∶2000)室温孵育1 h,TBS-T洗5次,每次15 min,最后加入ECL显色液显色。将显影得到的条带进行灰度分析,以β-actin为内参,以MMP-1、MMP-3、TIMP-1、EGFR各条带与内参条带灰度值的比值表示蛋白表达水平。
1.2.7 组织病理学观察
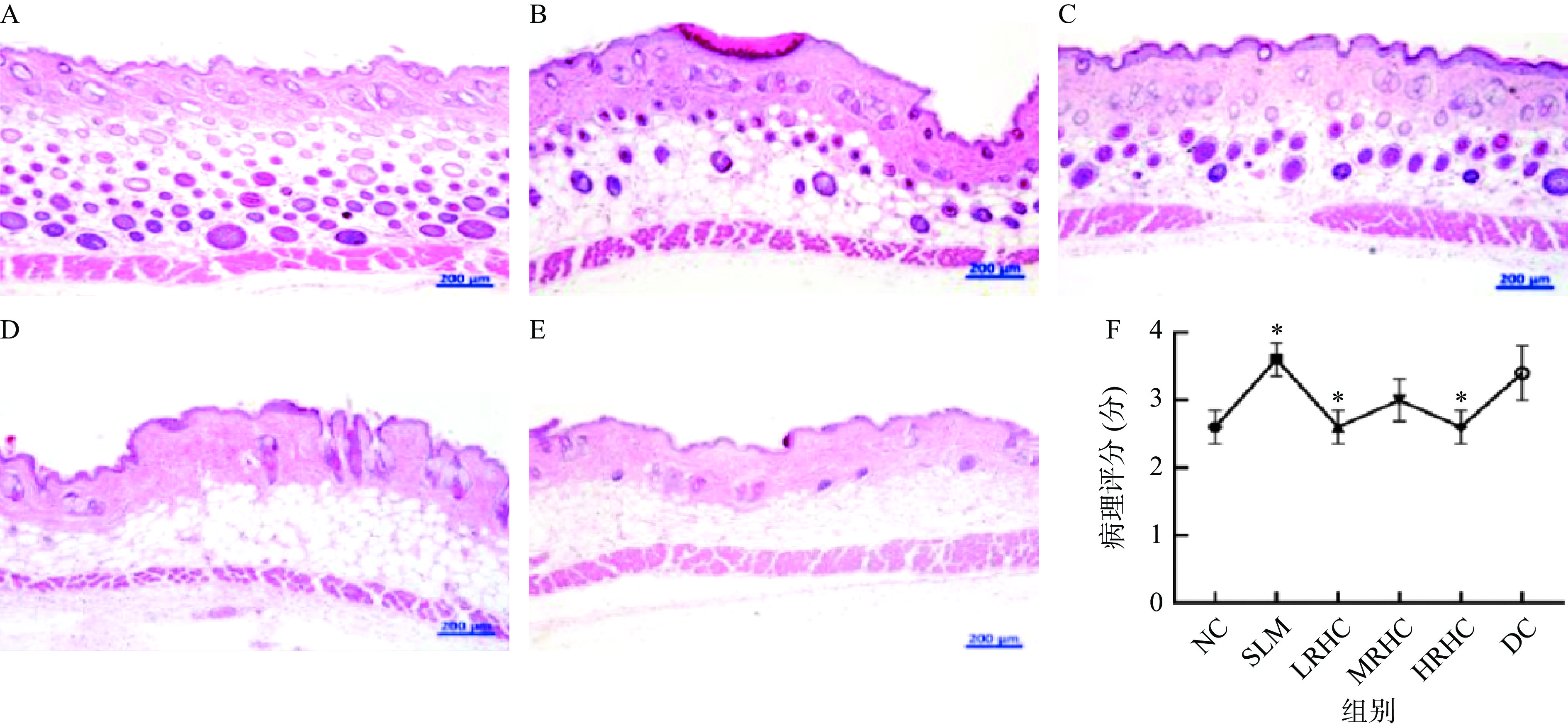
参照康俞莉等[32]方法及表2皮肤损伤评分标准对小鼠皮肤进行病理评分。取材:切取试验小鼠一部分皮肤组织,迅速用4%多聚甲醛中性液固定24 h。将固定好的组织取出置于通风橱内,用手术刀修平整,放于对应标签脱水盒内。
表 2 皮肤损伤评分标准Table 2. Score standard of skin injury皮肤病理学改变 积分 最高分 A.棘层肥厚(a) 轻度(表皮为正常厚度1.5~3倍) 1 3 中度(表皮为正常厚度3~4倍) 2 重度(表皮为正常厚度4倍以上) 3 B.过度角化 (b)颗粒层增厚 1 1 (c)角层增厚 1 1 C.其他表皮改变 (d)颗粒层缺乏 1 1 (e)角化不全 1 1 (f)表皮细胞空泡化或细胞内水肿或基底细胞液化变性 1 1 (g)海绵形成 棘细胞间水肿 1 2 水疱形成 2 D.表皮坏死 (h)表皮坏死 轻度(占表皮切面的1/3以下) 8 15 中度(占表皮切面的1/3~2/3) 10 重度(占表皮切面的2/3以上) 15 E.真皮变化 (i)真皮结缔组织血管扩张充血或水肿 1 1 (j)胶原纤维变性或解离 1 1 (k)真皮炎细胞浸润 轻度 1 3 中度 2 重度 3 脱水浸蜡:将脱水盒放入脱水机内的吊篮,用乙醇梯度脱水:75%乙醇4 h,85%乙醇2 h,90%乙醇2 h,95%乙醇1 h。紧接着用无水乙醇I和无水乙醇Ⅱ各洗脱30 min,随后用50%乙醇和50%二甲苯、二甲苯Ⅰ、二甲苯Ⅱ各浸泡10 min,使其保持透明。最后,用65 ℃融化石蜡Ⅰ、65 ℃融化石蜡Ⅱ、65 ℃融化石蜡Ⅲ各浸渍1 h。
包埋:将融化的蜡置于包埋框内,待蜡凝固前将组织从脱水盒内取出按照包埋面的要求放入包埋框。−20 ℃冻台冷却,待蜡块凝固后取出修整。
切片:将修整好的蜡块置于石蜡切片机切片,厚4 μm。将组织切片于40 ℃摊片机内温水上展平,用载玻片捞起,60 ℃烘箱内烤片,直至烤化后取出。
HE染色观察:石蜡切片脱蜡:二甲苯Ⅰ20 min→二甲苯Ⅱ20 min→无水乙醇Ⅰ5 min→无水乙醇Ⅱ5 min→75%酒精5 min,自来水清洗;苏木素染色:切片分别置于苏木素染液染3~5 min,自来水洗,分化液分化,自来水洗,返蓝液返蓝,流水冲洗;伊红染色:切片依次由85%、95%的梯度酒精脱水5 min后,置于伊红染液中染色5 min;脱水封片:切片依次置于无水乙醇I 5 min→无水乙醇II 5 min→无水乙醇Ⅲ 5 min→二甲苯Ⅰ 5 min→二甲苯Ⅱ 5 min透明,中性树胶封片;显微镜镜检,图像采集分析。
1.3 数据处理
数据处理采用Origin 8.1,采用GraphPad Prism 8做图,采用ANOVA对数据的差异性进行统计分析,结果表示为平均值±标准差。
2. 结果与分析
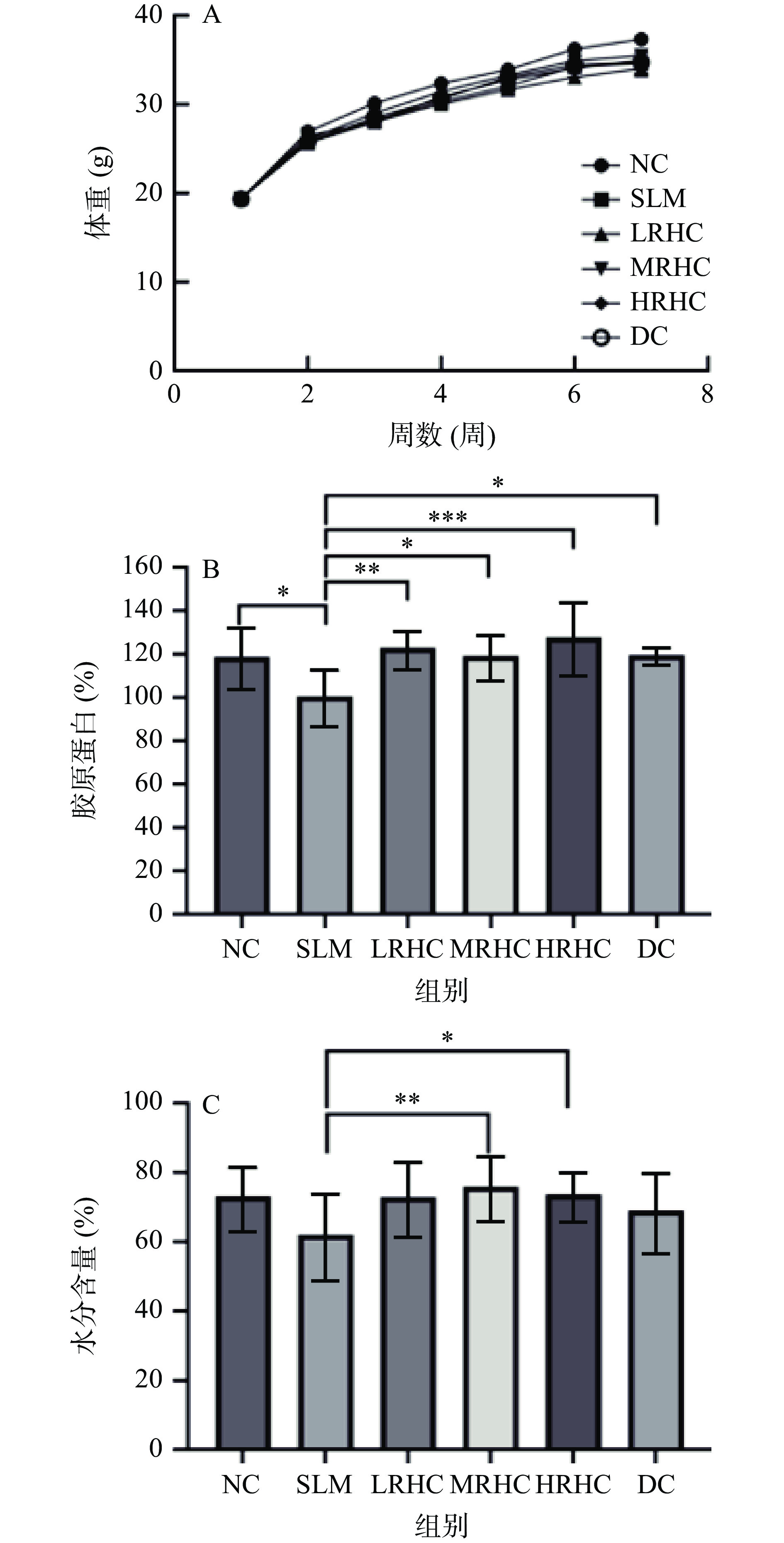
2.1 RHC对小鼠体重和皮肤胶原蛋白及水分含量的影响
NC组小鼠毛色顺滑、光亮,行为正常;SLM组小鼠则毛色缺乏光泽,有精神萎靡现象、行为活动迟缓等衰老体征,当小鼠经过RHC干预后这些衰老症状有所改善。小鼠体重增长情况是反应生命体征的一个重要指标[28],在实验过程中各组小鼠体重缓慢增长,各组间体重并无明显差异(图1A),表明RHC胶原蛋白对小鼠生长发育无不良影响;胶原蛋白对补充皮肤水分起着至关重要的作用,可以促进作为保湿成分的透明质酸的生成,令皮肤更加水分充盈,从而帮助肌肤吸取大量的水分[28];当皮肤组织细胞的水分减少,会导致细胞皱缩、老化、组织缺水、萎缩,从而加速衰老[29]。如图1B显示,与NC组相比,SLM组小鼠皮肤胶原蛋白含量显著降低(P<0.05),表明其衰老程度高于NC组,与SLM组相比,其他剂量组胶原蛋白含量略有增加,且与RHC浓度呈现一定的剂量依赖性。如图1C所示,经过RHC样品干预后的小鼠其皮肤的水分含量与SLM组相比显著增加(P<0.05),且随着RHC浓度的增加呈现一定的剂量依赖性。熊慧等[33]采用干燥法测定小鼠皮肤水分含量发现九龙虫可以明显改善衰老小鼠皮肤水分含量,与该实验得出类似的结论。表明RHC不仅可以增加小鼠皮肤胶原蛋白含量的增加,也可以增加水分含量,具有一定抗衰老效果。
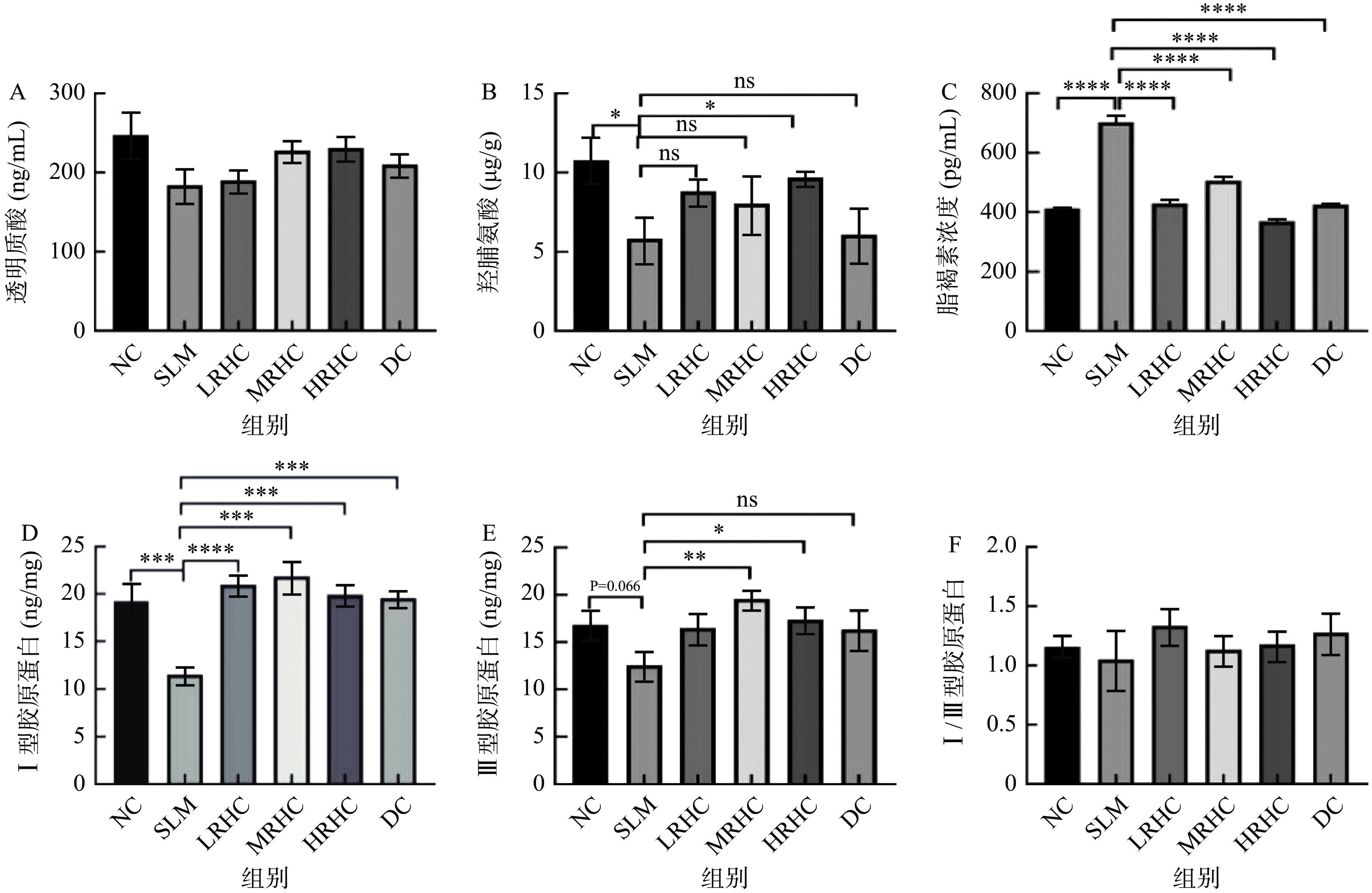
2.2 RHC对小鼠皮肤透明质酸、羟脯氨酸、脂褐素、胶原蛋白含量的影响
透明质酸是一种粘多糖,具有特殊的保水作用,能够促进创口愈合、改善皮肤营养代谢、防止衰老[34],羟脯氨酸是构成皮肤胶原蛋白的特有成分之一,能够促进皮肤纤维细胞的生长,有效反映出皮肤的衰老程度[35];脂褐素,又称老年色素,在机体内不能被降解和胞吐,当皮肤组织细胞的水分减少时会导致细胞皱缩、老化、萎缩,从而产生脂褐素[36]。胶原蛋白对补充皮肤水分起着至关重要的作用,可以促进作为保湿成分的透明质酸的生成,从而帮助肌肤吸取大量的水分,令皮肤更加水润充盈[37],而Ⅰ型胶原蛋白决定皮肤轮廓、Ⅲ型胶原蛋白决定皮肤弹性及细腻程度。研究结果如图2所示,与NC组相比,SLM组羟脯氨酸、胶原蛋白含量、脂褐素含量、I型胶原蛋白含量有显著差异(P<0.05,P<0.001),表明D-半乳糖衰老小鼠模型造模成功;在图2C和图2D中,与NC组相比,SLM组脂褐素含量显著升高(P<0.0001),Ⅰ型胶原蛋白含量显著降低(P<0.0001);与SLM组相比,RHC低、中、高剂量组和DC组脂褐素含量显著降低(P<0.0001)。该结果与伍春[38]在研究党参多糖多抗衰老小鼠的影响中的结果类似。图2E中SLM组与RHC中剂量组相比具有差异性(P<0.05),RHC低、中、高剂量组虽有先增后减的趋势,但没有显著性差异。初步表明RHC胶原蛋白能够促进皮肤中透明质酸、羟脯氨酸和胶原蛋白的产生,减少皮肤脂褐素积累,缓解皮肤衰老。
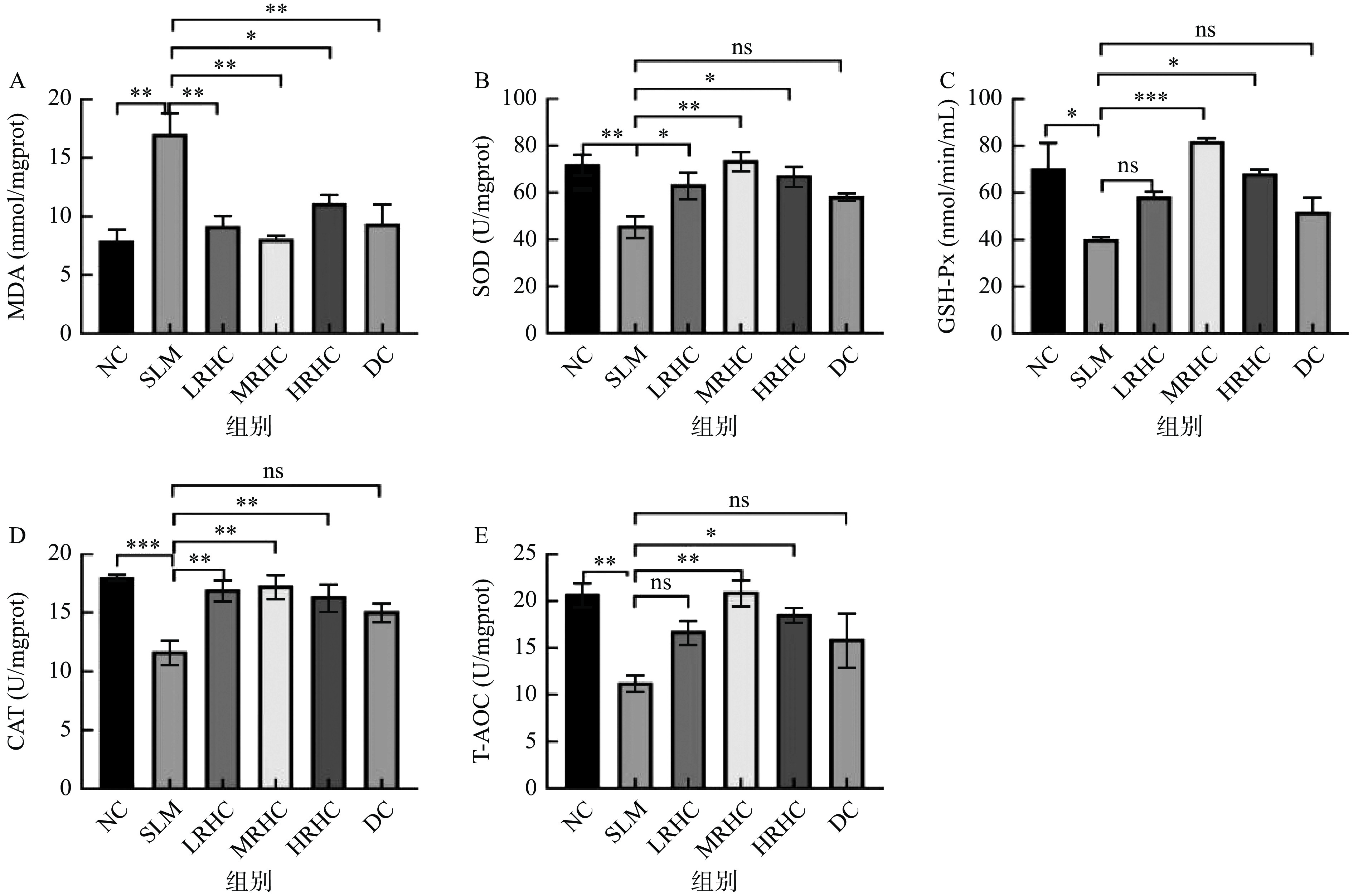
2.3 皮肤组织抗氧化指标的测定
大量研究表明D-半乳糖注射诱导能够加速小鼠衰老,正常情况下集体会产生氧化应激,产生MDA及其他脂质过氧化,MDA的分解产物会引起细胞的损伤,因此MDA是衡量脂质过氧化反应的重要指标;机体内SOD是抗氧化系统中发挥主要作用的酶,它们作为抗氧化机制下游的酶能够间接反应机体被自由基攻击程度[35],GSH-Px参与体内GSH催化反应,清除机体内过量的氧自由基,是衡量抗氧化能力大小的重要因素之一,增强酶活性,产生自由基[35]。由图3A结果显示,与NC组相比,SLM组小鼠皮肤匀浆中MDA含量显著增加(P<0.0001),且SLM组与添加了RHC的中、高剂量组相比都具有显著性(P<0.0001)。由图3B可知,SLM组与NC组相比SOD值显著降低(P<0.01),RHC低、中、高剂量组与SLM组相比显著升高,且中剂量组效果最好。由图3C可知,添加了RHC的低、中、高剂量组与NC组相比具有显著性(P<0.05)。有相关研究表明,党参能使高强度训练后的大鼠心肌线粒体SOD活性增强,MDA含量显著减少,显示出较好的抗氧化作用[39],与本实验的研究结果类似。在图3D和3E中,SLM组小鼠皮肤匀浆中CAT和T-AOC活性显著低于NC组(P<0.0001)。图3D中,与SLM组相比,MRHC组CAT的含量显著升高(P<0.001),HRHC组与DC组相比也具有显著差异性(P<0.01),而LRHC、MRHC、HRHC之间呈现出先增后减的趋势,但没有显著差异性;图3E中,与SLM组相比,LRHC、MRHCT-AOC的含量显著升高(P<0.001),且添加了RHC的低、中、高剂量组随着剂量的增加呈现出先增后减的趋势,此结果与王岚等[40]的研究结果类似。表明RHC胶原蛋白能够增强机体内抗氧化酶活性,清除体内自由基,降低过氧化物代谢产物丙二醛含量,提高机体抗氧化能力,从而延缓衰老。
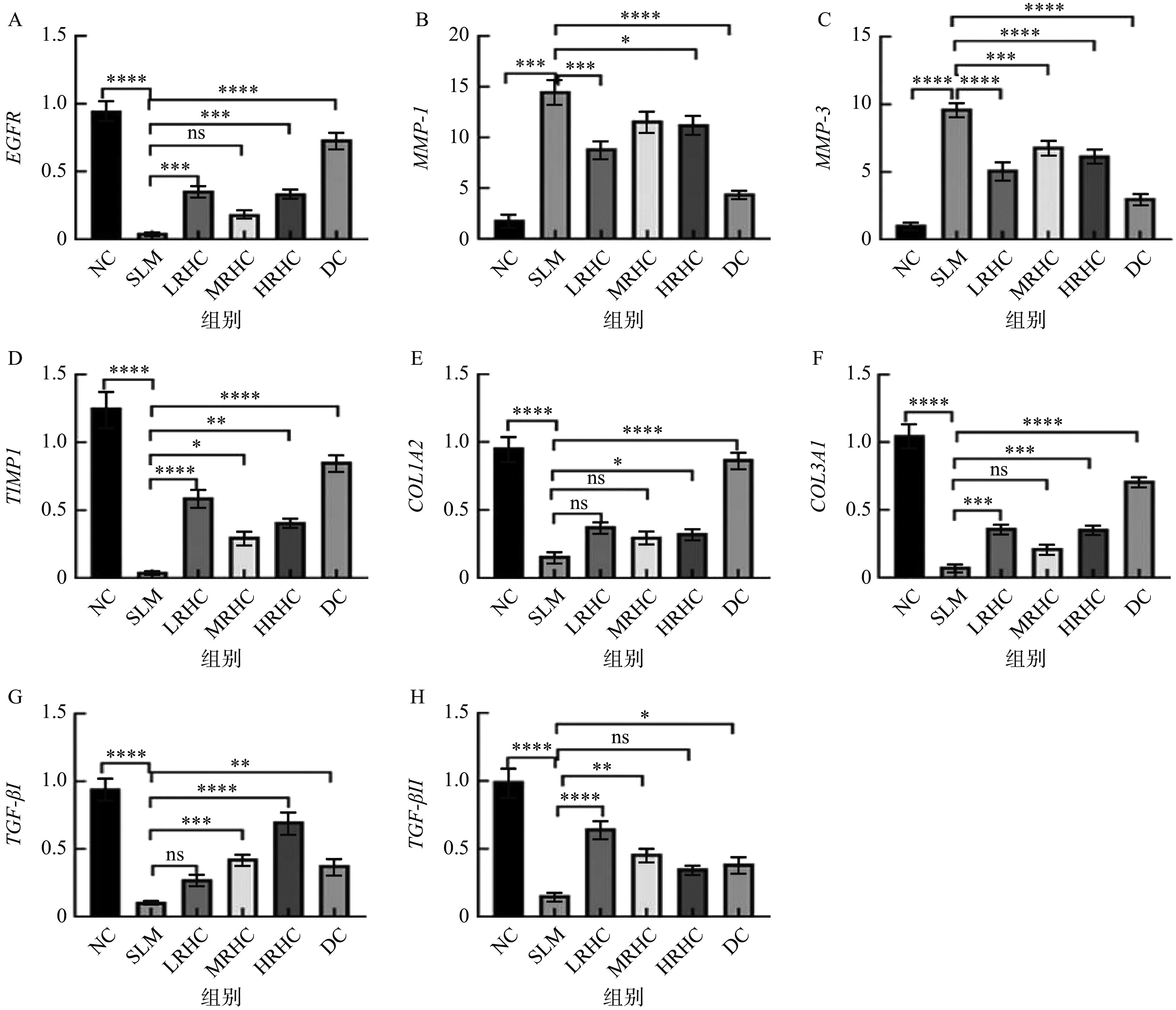
2.4 RHC对小鼠关键基因表达水平测定
EGFR因子作为ErbB受体家族中的一种跨膜蛋白受体因子,调控细胞的增殖、分化和凋亡;基质金属蛋白酶MMP家族中MMP-1、MMP-2、MMP-3、MMP-7和MMP-9被视为修复损伤和减缓细胞凋亡中正常组织重构的重要因子;TIMP-1是基质金属蛋白酶的组织抑制剂,TIMPs家族抑制MMPs家族功能,两者共同维护细胞外基质稳态[36]。许多临床实验已经证实MMPs过表达与癌症的高敏感性和致死率有关,这预示着MMPs同疾病发展的早期和末期都有关系[37];COL1A2可激活NF-κB信号通路,促进抗凋亡基因表达上调,促进皮肤成纤维细胞的凋亡,又有研究发现TGF-β能够通过激活细胞发生自噬,促进COL纤维蛋白表达[38]。
结果如图4所示,与NC组相比,SLM组小鼠EGFR、TMP-1、COL1A2、COL3A1、TGF-βⅠ和TGF-βⅡ基因表达显著升高(P<0.0001),与SLM组相比,EGFR、TMP-1、COL3A1、TGF-βⅡ基因表达显著升高(P<0.001),表明RHC胶原蛋白能够促进皮肤表皮细胞增值,维护内源性抑制物的动态平衡,且对纤维细胞的生长、分化和免疫功能具有调节作用。与NC组相比,SLM组小鼠的MMP-1和MMP-3均显著升高(P<0.0001),但经过RHC干预后其表达量均呈显著下降趋势,伍春[38]通过研究也得出了与本实验类似的结论。表明RHC胶原蛋白能够促进表皮细胞的增殖分化,改善细胞衰老。
2.5 RHC对小鼠关键蛋白表达水平测定
EGFR调控的信号通路对细胞的生长、增殖和分化等生理过程发挥重要的作用,EGFR蛋白的表达能够促进上皮细胞、成纤维细胞和胶质细胞的生长、增值和分化[41];基质金属蛋白酶家族(Matrix metalloproteinases,MMPs)具有多种生物调节作用,能够参与细胞增殖、凋亡、血管生成过程[42],在细胞外基质及组织的重塑和皮肤的正常生理及病理过程扮演重要角色;而组织金属蛋白酶抑制物(Tissue metalloproteinase inhibitors,TIMPs)作为MMPs的内源性抑制物,它的过量表达与胶原酶活性的降低有密切关系;又有研究表明COL1A2和COL3A1基因的表达与胶原蛋白的合成量有密切的关系,且能够促进真皮成纤维细胞的增殖[43];TGF-β是一类多功能的细胞因子,能够调节细胞生长和分化,促进细胞外基质的合成以及促进表皮细胞的增值[44]。
结果如图5所示,与NC组相比,SLM组小鼠皮肤中EGFR、TMP-1、COL1A2、COL3A1、TGF-βⅠ和TGF-βⅡ的表达量显著降低(P<0.0001),但经过RHC干预后其表达量较模型组显著升高,表明RHC能够促进表皮细胞的增殖分化,促进机体胶原蛋白的合成,调节机体体内促凋亡蛋白的表达。与NC组相比,SLM组小鼠皮肤中MMP-1和MMP-3蛋白表达量显著升高(P<0.0001),表明RHC胶原蛋白在一定程度上可以调节上述机体内与胶原蛋白合成相关蛋白的表达水平,促进胶原蛋白的合成,从而能够延缓皮肤衰老。
2.6 组织病理评分
小鼠皮肤组织切片病理及积分如图6所示,图6A显示NC组小鼠皮肤表皮层结构完整规则,细胞分层清晰,表皮与真皮界限清晰,真皮纤维组织排列呈波浪形,排列有序,分布均匀且胶原纤维束状排列整齐。图6B中,与NC组相比,SLM组小鼠皮肤组织切表皮层角质层增厚且不规则,角化不全,表皮中度坏死,细胞层纤维组织排列紊乱,且病理组织积分较NC组显著升高(图6F,P<0.05)。图6C~图6E显示,经过RHC干预后,小鼠皮肤组织均有所改善,表皮结构基本恢复,但仍可见表皮角质层增厚,发现在HRHC组修复效果更加明显。另外,由图6F可以看出,SLM组的评分与NC组和RHC的不同剂量组相比都具有显著性(P<0.05),同时RHC剂量组与胶原蛋白干预组相比也有显著性(P<0.05),马作霖[45]通过研究不同乳清粉对小鼠抗衰老的研究中发现乳清粉可改善衰老机体肝脏的慢性炎症,本实验的研究结果与此类似。
3. 结论
本研究利用D-半乳糖构建的衰老小鼠为模型,评价了RHC的抗衰老作用。结果表明,RHC胶原蛋白具有显著的抗皮肤衰老功效,中剂量和高剂量的RHC能够显著降低脂褐素水平,提高羟脯氨酸、透明质酸和胶原蛋白含量;并且能够显著降低皮肤组织中MDA含量,提高SOD、GSH-Px、CAT和T-AOC活性,与此同时能够促进EGFR、TMP-1、COL1A2、COL3A1、TGF-βⅠ和TGF-βⅡ蛋白的表达量,促进表皮细胞的增值、胶原蛋白的合成及修复皮肤表面损伤,从而起到延缓皮肤衰老的作用。RHC作为一种人工合成的蛋白肽,在促进和加快细胞生长、增殖、合成蛋白质或多肽物质、缓解皮肤衰老和创伤修复方面有重要作用,但皮肤抗衰老作用机制较为复杂,尽管该研究针对RHC对D-半乳糖致衰老小鼠的皮肤抗衰老作用进行了大量研究,为后续研究提供了一定的数据支撑,但仍有不足之处,后续可以在该研究基础上采用分子生物学、基因技术等手段深入研究。
-
表 1 实验分组与设计
Table 1 Experimental group and design
编号 组别 受试物 剂量(mg/kg) 给药方式 给药周期 小鼠数量 NC 正常对照组 − − ig 6 周 12只 SLM 衰老模型组 − − ig 6 周 12只 LRHC RHC低剂量 RHC低剂量 50 ig 6 周 12只 MRHC RHC中剂量 RHC中剂量 500 ig 6 周 12只 HRHC RHC高剂量 RHC高剂量 1000 ig 6 周 12只 DC 胶原蛋白干预组 胶原蛋白 1000 ig 6 周 12只 注:ig表示经口灌胃。 表 2 皮肤损伤评分标准
Table 2 Score standard of skin injury
皮肤病理学改变 积分 最高分 A.棘层肥厚(a) 轻度(表皮为正常厚度1.5~3倍) 1 3 中度(表皮为正常厚度3~4倍) 2 重度(表皮为正常厚度4倍以上) 3 B.过度角化 (b)颗粒层增厚 1 1 (c)角层增厚 1 1 C.其他表皮改变 (d)颗粒层缺乏 1 1 (e)角化不全 1 1 (f)表皮细胞空泡化或细胞内水肿或基底细胞液化变性 1 1 (g)海绵形成 棘细胞间水肿 1 2 水疱形成 2 D.表皮坏死 (h)表皮坏死 轻度(占表皮切面的1/3以下) 8 15 中度(占表皮切面的1/3~2/3) 10 重度(占表皮切面的2/3以上) 15 E.真皮变化 (i)真皮结缔组织血管扩张充血或水肿 1 1 (j)胶原纤维变性或解离 1 1 (k)真皮炎细胞浸润 轻度 1 3 中度 2 重度 3 -
[1] TURNHEIM K. When drug therapy gets old: Pharmacokinetics and pharmacodynamics in the elderly[J]. Experimental Gerontology,2003,38(8):843−853. doi: 10.1016/S0531-5565(03)00133-5
[2] 魏姝玥, 王海英, 李爱兰, 等. 脂肪干细胞对D-半乳糖致裸鼠皮肤老化的拮抗作用及对皮肤恢复功能的影响[J]. 中国美容医学,2020,29(1):62−67. [WEI Z Y, WANG H Y, LI A L, et al. Antagonistic effect of adipose-derived stem cells on skin aging induced by D-galactose in nude mice and its effect on skin recovery[J]. Chinese Journal of Aesthetic Medicine,2020,29(1):62−67. doi: 10.15909/j.cnki.cn61-1347/r.003476 [3] CHATTOPADHYAY S, RAINES R T. Review collagen-based biomaterials for wound healing[J]. Biopolymers,2014,101(8):21−33.
[4] 蔡东联. 不可忽视老年斑的危害[J]. 求医问药,2012(10):41. [CAI D L. Don't ignore the dangers of age spots[J]. Seek Medical,2012(10):41. [5] OGRODNIK M, SALMONOWICZ H, GLADYSHEV V N. Integrating cellular senescence with the concept of damage accumulation in aging: Relevance for clearance of senescent cells[J]. Aging Cell,2019,18(1):e12841. doi: 10.1111/acel.12841
[6] KUDRYAVTSEVA A V, KRASNOV G S, DMITRIEV A A, et al. Mitochondrial dysfunction and oxidative stress in aging and cancer[J]. Oncotarget,2016,7(29):44879−44905. doi: 10.18632/oncotarget.9821
[7] TERMAN A, KURZ T, NAVRATIL M, et al. Mitochondrial turnover and aging of long-lived postmitotic cells: The mitochondrial-lysosomal axis theory of aging[J]. Antioxidants & Redox Signaling,2010,12(4):503−535.
[8] SARETZKI G. Telomeres, telomerase and ageing[J]. Sub-Cellular Biochemistry,2018,9:221−308.
[9] DAVALLI P, MITIC T, CAPORALI A, et al. ROS, cell senescence, and novel molecular mechanisms in aging and age-related diseases[J]. Oxidative Medicine and Cellular Longevity,2016,2016:3565127.
[10] AUNG-HTUT M T, AYER A, BREITENBACH M, et al. Oxidative stresses and ageing[J]. Subcell Biochem,2012,57:13−54.
[11] GOMEZ-LINTON D R, ALAVEZ S, ALARCON-AGUILA A, et al. Some naturally occurring compounds that increase longevity and stress resistance in model organisms of aging[J]. Biogerontology,2019,20(5):583−603. doi: 10.1007/s10522-019-09817-2
[12] 米钰, 惠俊峰, 范代娣, 等. 类人胶原蛋白生物相容性实验研究[J]. 西北大学学报( 自然科学版),2004,34(1):66−72. [MI Y, HUI J F, FAN D D, et al. The biocompatibility of human-like collagen[J]. Journal of Northwest University (Natural Science Edition),2004,34(1):66−72. [13] YOON D, YOON D, CHA H J, et al. Enhancement of wound healing efficiency mediated by artificial dermis functionalized with EGF or NRG1[J]. Biomedical Materials (Bristol, England),2018,13(4):45007. doi: 10.1088/1748-605X/aaac37
[14] 余建军, 赵铧. 重组类人胶原蛋白研究应用进展[J]. 日用化学品科学,2022,45(2):48−51. [YU J J, ZHAO H. Progress in the research and application of recombinant human collagen[J]. Daily Chemicals Science,2022,45(2):48−51. doi: 10.3969/j.issn.1006-7264.2022.02.011 [15] YUAN T, ZHANG L, LI K F, et al. Collagen hydrogel as an immunomodulatory scaffold in cartilage tissue engineering[J]. Journal of Biomedical Materials Research. Part B, Applied Biomaterials,2014,102(2):337−344. doi: 10.1002/jbm.b.33011
[16] AN B, LIN Y S, BRODSKY B, et al. Collagen interactions: Drug design and delivery[J]. Advanced Drug Delivery Reviews,2016,97:69−84. doi: 10.1016/j.addr.2015.11.013
[17] JIA Q, LUO Y. The selective roles of chaperone systems on overexpression of human-like collagen in recombinant Escherichia coli[J]. J Ind Microbiol Biotechnol,2014,41(11):1667−1675. doi: 10.1007/s10295-014-1500-x
[18] TANG Y, YANG X, HANG B, et al. Efficient production of hydroxylated human-like collagen via the co-expression of three key genes in Escherichia coli origami (DE3)[J]. Applied Biochemistry and Biotechnology,2016,178(7):1458−1470. doi: 10.1007/s12010-015-1959-6
[19] 齐志峰, 郑双进, 张晓瑜, 等. 射频联合重组人源胶原蛋白凝胶修复面部皮肤屏障功能的研究[J]. 中国医疗美容,2020,10(3):48−52. [QI Z F, ZHENG S J, ZHANG X Y, et al. Radiofrequency combined with recombinant human collagen-gel to repair the function of facial skin barrier[J]. China Medical Cosmetology,2020,10(3):48−52. doi: 10.19593/j.issn.2095-0721.2020.03.013 [20] 郭亚媛. 重组人胶原蛋白水凝胶复合成纤维细胞修复皮肤缺损的实验研究[D]. 西安: 西北大学, 2019. GUO Y Y. The study of recombinant human collagen hydrogel containing fibroblastsin repairing skin defect[D]. Xi'an: Northwest University, 2019.
[21] 牛佳玮, 莫玲, 王子锃, 等. 恭城油茶减轻D-半乳糖致小鼠衰老的氧化应激[J]. 现代食品科技,2021,37(4):1−6. [NIU J W, MO L, WANG Z C, et al. Gongcheng oil tea attenuates oxidative stress in d-galactose-induced aging mice[J]. Modern Food Science & Technology,2021,37(4):1−6. doi: 10.13982/j.mfst.1673-9078.2021.4.0913 [22] XIAO LIAN F, XIAO FANG Z, SHI QI L, et al. Preparation of aminated fish scale collagen and oxidized sodium alginate hybrid hydrogel for enhanced full-thickness wound healing[J]. International Journal of Biological Macromolecules,2020,164:626−637. doi: 10.1016/j.ijbiomac.2020.07.058
[23] JING C, PAN W, YAN NAN L, et al. Double crosslinked HLC-CCS hydrogel tissue engineering scaffold for skin wound healing[J]. International Journal of Biological Macromolecules,2020,155:625−635. doi: 10.1016/j.ijbiomac.2020.03.236
[24] LEI H, CHEN HUI ZHU, DAI DI F. Optimization of human-like collagen composite polysaccharide hydrogel dressing preparation using response surface for burn repair[J]. Carbohydrate Polymers, 2020, 239.
[25] HUI Z, YU XIAO L, CAN WEN C, et al. Responsive drug-delivery microcarriers based on the silk fibroin inverse opal scaffolds for controllable drug release[J]. Applied Materials Today, 2020, 19(C): 100540.
[26] FAROKHI M, MOTTAGHITALAB F, REIS R L, et al. Functionalized silk fibroin nanofibers as drug carriers: Advantages and challenges[J]. Journal of Controlled Release, 2020, 321(C): 324-347.
[27] 宋晓娟. 类人胶原蛋白治疗颜面再发性皮炎疗效观察及研究[J]. 吉林医学,2016,37(9):2259−2260. [SONG X J. Study on the efficacy of human-like collagen in the treatment of facial reoccurring dermatitis[J]. Jilin Medical Journal,2016,37(9):2259−2260. doi: 10.3969/j.issn.1004-0412.2016.09.088 [28] KONG S Z, LI JC, LI S D, et al. Anti-aging effect of chitosan oligosaccharide on d-galactose-induced subacute aging in mice[J]. Mar Drugs,2018,16(6):181. doi: 10.3390/md16060181
[29] 薛文, 秦菊, 努尔买买提·阿穆提, 等. 不同ELISA和AGID试剂盒检测马传染性贫血病毒抗体的比较[J]. 中国动物检疫,2022,39(7):103−107. [XUE W, QIN J, NURMAIMAITI·A, et al. Comparison of different ELISA and AGID kits for equine infectious anemia virus antibodies[J]. Chinese Animal Quarantine,2022,39(7):103−107. [30] 钟召兵. 澳州进口与中国本地荷斯坦牛血清抗氧化指标和微量元素含量比较研究[J]. 中国奶牛,2022(7):16−19. [ZHONG Z B. Comparative study on antioxidant index and trace element content of Australian imported and local Holstein cattle in China[J]. Chinese Dairy Cows,2022(7):16−19. doi: 10.19305/j.cnki.11-3009/s.2022.07.004 [31] 林才云, 王联珠, 许加超, 等. 培养条件对副溶血性弧菌AI-2活性及其合成关键基因表达水平的影响[J]. 食 品安全质量检测学报,2020,11(9):2924−2929. [LIN C Y, WANG L Z, XU J C, et al. Effects of culture conditions on AI-2 activity of V. parahaemolyticus and the expression levels of key genes for synthesis[J]. Food Safety and Quality Testing Journal,2020,11(9):2924−2929. [32] 康俞莉, 赵颖, 章强强. 荧光原位杂交法观察小鼠皮肤组织切片中型无绿藻感染的研究[J]. 中华皮肤科杂志,2014,47(9):646−649. [KANG Y L, ZHAO Y, ZHANG Q Q. Observation of medium-free green algae infection in mouse skin tissue sections by fluorescence in situ hybridization[J]. The Chinese Journal of Dermatology,2014,47(9):646−649. [33] 熊慧, 戢丹菊, 杨家林, 等. 九龙虫对衰老小鼠皮肤的影响[J]. 鄂州大学学报,2021,28(5):108−110. [XIONG H, YANG J L, LIU D H, et al. Effects of Kowloon worm on skin of aged mice[J]. The Journal of Ezhou University,2021,28(5):108−110. doi: 10.16732/j.cnki.jeu.2021.05.037 [34] 颜泽清, 娄红军, 王元. 透明质酸对犬皮肤水分的改善效果研究[J]. 中国工作犬业,2019(9):14−15. [YAN Z Q, LOU H J, WANG Y. Study on the effect of hyaluronic acid on the improvement of skin moisture in dogs[J]. China Working Dog,2019(9):14−15. [35] TOMOKO, ASAI T, OIKAWA F, et al. Food-derived collagen peptides, Prolyl-Hydroxyproline (Pro-Hyp), and Hydroxyprolyl-Glycine (Hyp-Gly) enhance growth of primary cultured mouse skin fibroblast using fetal bovine serum free from hydroxyprolyl peptide[J]. International Journal of Molecular Sciences,2019,21(1):229.
[36] GILCHREST B A, GARMYS M, YEAR M. Aging and photoaging effect gene expression in cultured human keratinocyte[J]. Arch Dermatol,1994,130(1):82−86. doi: 10.1001/archderm.1994.01690010086013
[37] 李卫, 元发芝. 皮肤衰老及抗衰老研究进展[J]. 中华医学美学美容杂志,2004,10(1):60−61. [LI W, YUAN F Z. Advances in skin ageing and anti-ageing research[J]. Chinese Journal of Medical Aesthetics and Cosmetology,2004,10(1):60−61. [38] 伍春. 党参多糖对D-半乳糖致衰老小鼠皮肤抗氧化作用及基因表达谱的影响[D]. 兰州: 甘肃中医学院, 2014 WU C. Effect of Dangshen polysaccharide on skin antioxidant effect and gene expression profile of D-galactose-induced aging mice[D]. Lanzhou: College of Traditional Chinese Medicine, 2014.
[39] 王振富. 党参对大强度训练大鼠心肌线粒体抗氧化能力的的影响[J]. 江苏医药,2011,37(13):1515−1518. [WANG Z F. Effect of Dangshen on the antioxidant capacity of myocardial mitochondria in intensively trained rats[J]. Jiangsu Medicine,2011,37(13):1515−1518. [40] 王岚, 张帆, 王艳, 等. 甘肃党参水提物对 D-半乳糖所致衰老小鼠脑组织 SOD、MDA 影响的实验研究[J]. 中国中医药科技,2010,17(2):148−149. [WANG L, ZHANG F, WANG Y, et al. Experimental study on the effect of Gansu Dangshen water extract on brain tissue SOD and MDA in aging mice caused by D-galactose[J]. Chinese TCM Science and Technology,2010,17(2):148−149. [41] WILSON J, BALKWILL F. The role of cytokines in the epithelial cancer microenvironment[J]. Seminars in Cancer Biology,2002,12(2):113−120.
[42] SHEN B C, LIEN H C, H N, et al. Increased expression and activation of gelatinolytic matrix metalloproteinases is associated with the progression and recurrence of human cervical cancer[J]. Cancer Research,2003,63(10):6537−6542.
[43] NIETO N. 335 Kupffer cells induce a fibrogenic response by transactivating the COL1A1 and COL1A2 promoters and by decreasing collagen I degradation[J]. Journal of Hepatology,2006,44(S2):S129−S129.
[44] QUAN T, HE T, KANG S, et al. Ultraviolet Irradiation alters transforming growth factor β/smad pathway in human skin in vivo[J]. Journal of Investigative Dermatology,2002,119(2):499−506. doi: 10.1046/j.1523-1747.2002.01834.x
[45] 马作霖. 乳清粉调节D-半乳糖诱导衰老小鼠肠道菌群结构及抗衰老作用研究[D]. 兰州: 甘肃农业大学, 2021. MA Z L. Study on intestinal flora structure and anti-aging effect of D-galactose [D]. Lanzhou: Gansu Agricultural University, 2021.





 下载:
下载:
 下载:
下载:
