Fatty Acid Analysis of Brown Spotted Grouper (Epinephelus fuscoguttatus) Muscle and Its by-Products
-
摘要: 为了评估褐点石斑鱼的脂肪酸组成特点,采用固相萃取和气相色谱技术对鱼肉、头、皮和内脏的脂质含量、总脂及各脂类脂肪酸组成,甘油三酯(triacylglycerols, TAG)和磷脂(phospholipids, PL)中脂肪酸的位置分布进行了较全面的分析。石斑鱼鱼头和内脏中含有丰富的糖脂(saccharolipids, SL)和PL。在各组织总脂中,必需脂肪酸的含量占总脂肪酸的24.17%~24.51%,二十二碳六烯酸(docosahexaenoic acid, DHA)及二十碳五烯酸(eicosapentaenoic acid, EPA)的含量为12.42%~13.73%,动脉粥状硬化指数、血栓形成指数和n-6/n-3的比例处于较低水平。多不饱和脂肪酸(polyunsaturated fatty acids, PUFA),尤其是DHA+EPA(28.43%~37.37%)在PL中的比例要远高于在其它脂类中的占比。饱和脂肪酸主要分布在TAG和PL的sn-2位,单不饱和脂肪酸主要分布在TAG的sn-1,3位和PL的sn-2位,PUFA倾向于分布在TAG的sn-1,3位和PL的sn-1位;TAG中,DHA主要分布在sn-2位,而在PL中DHA主要分布在sn-1位,有利于提高DHA的生物利用率。因此,褐点石斑鱼脂质组成丰富,DHA在TAG和PL中的位置分布特点使其更易被人体所利用,可以作为DHA-TAG和DHA-PL的潜在来源,具有较高的综合利用价值。Abstract: In order to evaluate the fatty acid composition characteristics of brown spotted grouper, a comprehensive analysis of the lipid yields, fatty acid compositions of total lipid and different lipid classes, and the stereospecific distributions of fatty acids in triacylglycerols (TAG) and phospholipids (PL) in muscle, head, skin and viscera was performed using solid-phase extraction and gas chromatography (GC) techniques. Rich saccharolipids (SL) and PL were found in the head and viscera. In the total fat of each tissue, the content of essential fatty acids ranged from 24.17% to 24.51% of the total fatty acids, and the content of docosahexaenoic acid (DHA) and eicosapentaenoic acid (EPA) ranged from 12.42% to 13.73% of the total fatty acids, with the index of atherogenicity, index of thrombogenicity and n-6/n-3 ratio were at low levels. Moreover, polyunsaturated fatty acids (PUFA), especially DHA+EPA (28.43%~37.37%), accounted for a much higher percentage of PL than in other lipid classes. Saturated fatty acids were mainly distributed in the sn-2 positions of TAG and PL, and monounsaturated fatty acids were mainly distributed in sn-1,3 positions of TAG and sn-2 position of PL. Furthermore, PUFA tended to be distributed in sn-1,3 positions of TAG and sn-1 position of PL. Interesting, DHA was mainly bonded to the sn-2 site of TAG and sn-1 site of PL, which was beneficial for their bioavailability. Hence, the lipid profiles of brown spotted grouper are abundant, and the positional distribution characteristics of DHA in TAG and PL makes it easier to be utilized by human body, which can be a potential source of DHA-TAG and DHA-PL with high comprehensive utilization value.
-
褐点石斑鱼(Epinephelus fuscoguttatus),又称老虎斑石斑鱼,属辐鳍亚纲、鲈形目、鮨科、石斑鱼亚科,其肉质鲜美,营养价值丰富,为暖水性的名贵鱼类,广泛分布于印度洋和太平洋的热带和亚热带海域,在我国主要分布在南海海域[1]。近5年来,随着石斑鱼深海网箱养殖技术的成熟,石斑鱼已经成为我国重要的养殖经济鱼类。2021年中国渔业年鉴报告[2]显示2020年石斑鱼的全国养殖量为19.20万吨。
褐点石斑鱼作为最主要的石斑鱼鱼种之一,由于营养丰富、高蛋白、低脂肪等特点,深受人们青睐。如今,国内外对于其研究多集中在养殖与疾病防治[3]、杂交育种[4]和鱼肉营养价值的分析[5]等。鱼类在加工中会产生大量的副产物(头、皮、骨和内脏),Rai等[6]对鱼副产物进行了研究,发现鱼副产物中脂质较为丰富,可达活体重量的4.00%~43.8%。在国内,针对于褐点石斑鱼的脂质营养价值分析研究仅检索到陈晓婷等[5]分析了四种石斑鱼(珍珠龙胆石斑鱼、鞍带石斑鱼、褐点石斑鱼和青石斑鱼)的肌肉营养成分,其中褐点石斑鱼脂肪酸含量以单不饱和脂肪酸(monounsaturated fatty acids, MUFA, 36.41%)最高,其次是饱和脂肪酸(saturated fatty acids,SFA, 35.38%)和多不饱和脂肪酸(polyunsaturated fatty acids, PUFA, 28.72%)。现有的对石斑鱼脂质的分析仅是简单地分析了鱼肉脂质含量和脂肪酸组成,对于其副产物的研究还较少。此外,脂肪酸生物活性的发挥不仅与其含量有关而且还与其结合的脂类和酯化位置特性等有关[7]。Michalski等[8]报道称酯化在甘油三酯sn-2位的脂肪酸与酯化在sn-1,3位的脂肪酸相比更易被小肠细胞直接吸收利用。Zhang等 [9]报道称磷脂形式的二十二碳六烯酸(docosahexaenoic acid,DHA)和二十碳五烯酸(eicosapentaenoic acid,EPA)膳食比甘油三酯和乙酯形式的DHA/EPA膳食具有更高的生物利用度。目前,对褐点石斑鱼各脂类(甘油三酯、磷脂和糖脂等)的脂肪酸组成,脂肪酸在甘油三酯和磷脂中位置分布的研究还鲜有报道。本研究以褐点石斑鱼为研究对象,对其鱼肉、鱼头、鱼皮和内脏的脂质(包括脂质得率、总脂脂肪酸组成、各脂类脂肪酸组成、甘油三酯和磷脂中脂肪酸的位置分布)进行了较全面的营养评估,以探讨褐点石斑鱼及其副产物的脂质组成特点,为提高褐点石斑鱼及其副产物的综合利用率,为其低价值副产物的高值化利用提供理论参考。
1. 材料与方法
1.1 材料与仪器
褐点石斑鱼 购于海南省海口市三西路水产市场;37种混合脂肪酸甲酯标准品(色谱纯) 美国Nu Chek-Prep公司;猪胰脂肪酶(≥125 U/mg) 上海Sigma-Aldrich公司;磷脂酶A2(≥600 U/mg) 美国Sigma-Aldrich公司;正己烷 色谱级,美国Tedia公司;所有分离用有机溶剂 均为分析纯,国药集团化学试剂有限公司。
7890A型气相色谱仪(配有氢离子火焰检测器)(gas chromatography-flame ionization detector, GC-FID) 美国Aglient公司;SHA-B 双功能水浴恒温振荡器 江苏金坛亿通电子有限公司;CNW固相萃取真空装置 上海安谱实验科技股份有限公司;RV 10 auto FLEX旋转蒸发仪 德国艾卡公司;TDL-5-A离心机 上海安亭科技仪器厂;DSY-VI型水浴氮吹仪 北京东方精华苑科技有限公司。
1.2 实验方法
1.2.1 鱼样预处理
共15尾(体重为423.27±60.35 g,体长为20.11±1.03 cm)体表完整、规格相近的褐点石斑鱼,分三批次购买(2021年10月、11月和12月)于海南省海口市三西路水产市场。将石斑鱼洗净,去掉鱼鳞和鱼鳃后,将整鱼分割为肉、头、皮和内脏四部分,分别绞碎、均浆后装入密封袋中,放入−20 ℃冰箱备用。
1.2.2 总脂提取
总脂的提取采用氯仿-甲醇法[10]。取约1 g均浆后的鱼组织置于50 mL离心管中,加入9 mL氯仿:甲醇溶液(2:1,V/V),水浴振荡器振荡90 min后加入2.25 mL的氯化钾溶液(0.88%,W/V),继续振荡30 min,过滤,4200 r/min下离心10 min,取下层液体氮气吹干得到总脂、总脂脂肪酸组成分析见方法1.2.5和1.2.6。总脂的得率计算公式如下:
1.2.3 不同脂质的分离
采用固相萃取法(solid-phase extraction, SPE)对总脂进行分离[11-12]。采用Si-SPE小柱(15 mL氯仿预活化)将总脂分为中性脂、糖脂(saccharolipids, SL)和磷脂(phospholipids, PL),三者分别被10 mL的氯仿(含1%乙酸)、10 mL丙酮:甲醇溶液(9:1,V/V)和10 mL甲醇洗脱,收集洗脱液,氮气吹干分别得到中性脂、糖脂和磷脂。
采用Florisil-SPE小柱(6 mL正己烷预活化)分离中性脂[13]。中性脂样品溶于1 mL氯仿转移至萃取柱,分别用12 mL体积比为15:85、30:70、75:25和5:95的乙醚:正己烷溶液洗脱得到甘油三酯(triacylglycerols, TAG)、甘油二酯(diacylglycerols, DAG)、甘油一酯(monoacylglycerols, MAG)和游离脂肪酸(free fatty acids,FFA)。各脂类脂肪酸组成分析见方法1.2.5和1.2.6。
1.2.4 TAG和PL中脂肪酸的位置分布分析
1.2.4.1 TAG中脂肪酸的位置分布分析
采用猪胰脂肪酶对TAG进行酶解[14]。称取10 mg的TAG和10 mg的猪胰腺酶置于离心管中,然后加入2.5 mL的氯化钙溶液(2.2%)、2.5 mL胆酸盐溶液(0.05%)和10 mL的tris-HCl缓冲溶液(1 mol/L,pH7.6)。混合液经涡旋混匀1 min后于37 ℃下水浴振荡3 min,该反应过程重复3次。最后加入6 mL乙醚终止反应,4200 r/min下离心10 min,收集上清液,氮气吹干得到TAG的酶解产物。
将NH2-SPE小柱放置在固相萃取真空装置上,取6 mL的正己烷加入小柱中使其预活化。TAG酶解液的分离通过预活化的NH2-SPE完成。TAG的酶解产物复溶于二氯甲烷中,混匀后上样,用8 mL的正己烷:乙酸乙酯溶液(85:15,V/V)洗脱杂质,然后用6 mL的二氯甲烷:甲醇(2:1,V/V)洗脱sn-2 MAG,收集洗脱液氮吹得sn-2MAG样品,脂肪酸组成分析见方法1.2.5和1.2.6。TAG中sn-1,3位脂肪酸的相对含量通过公式[15]计算得到。
式中:TAG%为某个脂肪酸占TAG中总脂肪酸的百分比;sn-2 MAG%为某个脂肪酸占sn-2 MAG中总脂肪酸的百分比。
1.2.4.2 PL中脂肪酸的位置分布分析
采用磷脂酶A2对PL进行酶解[16]。将适量的PL(1~5 mg)、0.1 mL磷脂酶A2溶液(将25 mg磷脂酶A2和2 mg氯化钙溶于5 mL浓度为1 mol/L,pH8.0 的tris-HCl 缓冲溶液)和2 mL乙醚(含有0.02%的BHT)混合在室温下振荡3 h,然后加入2 mL的甲醇和1 mL的氯仿萃取,收集有机相氮气下吹干。
PL酶解产物的分离同样通过NH2-SPE小柱实现[14]。PL酶解产物复溶于三氯甲烷后上样,采用5 mL的乙醚:乙酸(98:2,V/V)洗脱FFA(PL的sn-2位)和5 mL的甲醇洗脱Lyso-PL(PL的sn-1位),收集洗脱液氮气吹干,甲酯化后通过GC-FID分析脂肪酸组成,脂肪酸组成分析见方法1.2.5和1.2.6。
1.2.5 总脂及各脂类中脂肪酸的甲酯化
总脂及各脂类中脂肪酸(除FFA中脂肪酸外)的甲酯化采用碱法甲基化法[17]。称取2 mg样品溶于1.5 mL正己烷中,加入100 μL甲醇钠甲醇溶液(0.50 mol/L)和40 μL乙酸甲酯,室温下反应20 min后于−20 ℃放置10 min,取出立即加入60 μL草酸溶液(0.37 mol/L),4200 r/min下离心10 min,取上清液过无水硫酸钠小柱除去水分,氮气吹干得到脂肪酸甲酯。
FFA中脂肪酸的甲酯化采用三氟化硼-甲醇法[18-19]。取1~2 mg FFA样品溶解于1 mL三氟化硼-甲醇溶液中(14%,V/V),置于90 ℃水浴温育10 min,然后加入1 mL蒸馏水和1 mL正己烷结束反应,4200 r/min下离心10 min,收集上清液过无水硫酸钠小柱,氮气吹干得到脂肪酸甲酯。
1.2.6 气相色谱分析
将甲酯化处理后的样品用1 mL正己烷复溶于进样瓶,待测。色谱柱:CP-Sil 88毛细管柱(100 m×0.25 mm,0.20 µm);升温程序:起始温度45 ℃保持4 min,以13 ℃/min升至175 ℃,保持27 min,再以4 ℃/min升至215 ℃,保持35 min;进样量:1 µL[20]。脂肪酸通过对比样品峰和混合标准品峰的保留时间来定性。脂肪酸采用峰面积归一化法进行定量(以占总脂肪酸的百分比表示)。
1.3 数据处理
结果以平均数±标准差(Mean±SD)表示,所有实验均为3个重复,使用SPSS 26.0软件对实验数据进行统计分析,采用单因素方差分析和Duncan's多重比较分析进行显著性检验,显著性水平为P<0.05。
2. 结果与分析
2.1 不同部位总脂得率和各脂类的分布
由表1可知,褐点石斑鱼不同部位的总脂得率具有显著差异(P<0.05),其中以鱼内脏中总脂得率最高(占湿重的13.97%),鱼肉中最低(1.53%),属于低脂(Lean)鱼类。与陈晓婷等[5]报道的肌肉脂肪含量较高的鞍带石斑鱼(7.04%)和珍珠龙胆石斑鱼(3.10%)相比,褐点石斑鱼肉更符合人们所追求的低脂的膳食要求。此外,褐点石斑鱼中含有较高水平的糖脂和磷脂,鱼头中糖脂和磷脂分别占总脂的13.42%和8.75%,高于Swapna等[21]所报道的Catla鱼头中糖脂(10.20%)和磷脂(2.40%)的水平;内脏中糖脂和磷脂含量分别为10.78%和2.96%,略高于Catla鱼内脏中糖脂(10.60%)和磷脂(2.00%)[21]的水平。这表明作为副产物的头和内脏是海洋源糖脂和磷脂的潜在来源,值得进一步开发利用。
表 1 褐点石斑鱼不同部位总脂得率(占湿重%)和各脂类分布(占总脂%)Table 1. Total lipid (% wet weight) and lipid classes (% total lipid) in different tissues of Epinephelus fuscoguttatus部位 总脂得率 甘油三酯 甘油二酯 甘油一酯 游离脂肪酸 糖脂 磷脂 鱼肉 1.53±0.10d 75.32±1.83b 3.89±0.61b 3.87±0.30a 0.40±0.09b 7.75±0.50c 7.06±0.73b 鱼头 7.46±0.35b 68.20±0.85c 5.20±0.46ab 3.21±0.24b 1.14±0.14a 13.42±1.37a 8.75±0.84a 鱼皮 2.57±0.27c 80.80±1.36a 3.83±0.89b 2.10±0.18c 1.12±0.30a 5.66±1.14d 2.88±0.29c 鱼内脏 13.97±0.97a 68.10±0.65c 6.17±0.90a 2.77±0.23b 1.24±0.28a 10.78±1.18b 2.96±0.69c 注:同列不同字母表示差异显著(P<0.05)。 2.2 不同部位总脂脂肪酸组成
如表2所示,褐点石斑鱼四个部位中PUFA水平最高(占总脂肪酸的40.07%~41.19%),其次是SFA(33.16%~34.72%)和MUFA(25.21%~25.93%),这与韩丽娜等[22]报道的黄金石斑鱼中PUFA>SFA>MUFA的趋势一致。然而在陈晓婷等[5]所报道的珍珠龙胆石斑鱼和鞍带石斑鱼中SFA>PUFA>MUFA,这表明鱼类脂肪酸的组成受其品种的影响。此外,陈晓婷等[5]所报道的褐点石斑鱼中MUFA>SFA>PUFA,与本实验所研究的同种石斑鱼的趋势(PUFA>SFA>MUFA)相反,这可能与养殖环境以及喂养饲料的不同有关。PUFA主要分为n-3和n-6型PUFA,石斑鱼各部位中n-6 PUFA(21.85%~22.21%)含量要高于n-3 PUFA(17.85%~19.06%)的含量,这主要归因于褐点石斑鱼含有丰富的亚油酸。有研究报道称饮食中n-6/n-3 PUFA的低摄入量有利于降低心血管疾病和癌症的风险[23]。如表2所示,褐点石斑鱼各部位中n-6/n-3 PUFA值要远小于FAO/WHO提出的4:1这一参考值。此外,动脉粥状硬化指数(index of atherogenicity,AI)和血栓形成指数(index of thrombogenicity,TI)也被用来评价脂质的营养价值,低AI和TI值的脂质摄入可以有效预防动脉粥状硬化和血栓等心血管慢性疾病的发生[16],褐点石斑鱼中AI值和TI值都处于较低水平。
表 2 褐点石斑鱼不同部位总脂脂肪酸的组成(占总脂肪酸的百分比%)Table 2. Fatty acid compositions in different tissues of Epinephelus fuscoguttatus (% of total fatty acids)脂肪酸 鱼肉 鱼头 鱼皮 鱼内脏 C12:0 0.08±0.00b 0.08±0.00b 0.08±0.00b 0.09±0.00a C14:0 4.03±0.24b 4.19±0.06b 4.10±0.05b 4.53±0.01a C15:0 0.53±0.02c 0.56±0.01ab 0.54±0.00bc 0.57±0.01a C16:0 19.68±0.02b 20.02±0.10a 20.04±0.25a 20.18±0.01a C17:0 0.55±0.00b 0.56±0.00ab 0.56±0.01ab 0.56±0.00a C18:0 6.87±0.22b 6.56±0.03c 7.06±0.03ab 7.16±0.08a C19:0 0.13±0.02a 0.11±0.00a 0.12±0.02a 0.13±0.01a C20:0 0.66±0.03c 0.69±0.00bc 0.71±0.01b 0.78±0.01a C22:0 0.48±0.08b 0.52±0.01ab 0.57±0.03a 0.59±0.02a C24:0 0.14±0.01a 0.12±0.01b 0.13±0.01ab 0.13±0.01ab ∑SFA 33.16±0.26c 33.39±0.20c 33.92±0.35b 34.72±0.11a 9cC14:1 0.06±0.00b 0.06±0.00b 0.05±0.01b 0.19±0.01a 9cC16:1 4.27±0.21b 4.60±0.01a 4.35±0.03b 4.37±0.04b 10cC17:1 0.24±0.01b 0.26±0.01a 0.25±0.00ab 0.24±0.01b 6cC18:1 0.07±0.00a 0.08±0.01a 0.08±0.02a 0.07±0.01a 9cC18:1 18.31±0.20a 18.24±0.03a 18.17±0.28a 17.65±0.07b 11cC18:1 2.69±0.02a 2.70±0.01a 2.68±0.02a 2.69±0.01a ∑cis MUFA 25.65±0.43ab 25.93±0.04a 25.59±0.29ab 25.21±0.08b 9c12cC18:2 n-6 20.38±0.28a 20.42±0.12a 20.18±0.19a 20.19±0.07a C18:3 n-6 0.08±0.00a 0.08±0.01a 0.08±0.01a 0.08±0.01a C18:3 n-3 3.19±0.15b 3.42±0.05a 3.28±0.06ab 3.28±0.05ab C20:2 n-6 0.31±0.02a 0.31±0.01a 0.30±0.00a 0.31±0.02a C20:3 n-6 0.10±0.01a 0.10±0.00a 0.09±0.01b 0.10±0.00a C20:3 n-3 0.45±0.03ab 0.43±0.01b 0.43±0.01b 0.47±0.02a C20:4 n-6 0.82±0.13a 0.67±0.01b 0.73±0.04ab 0.69±0.00ab C22:2 n-6 0.15±0.01b 0.12±0.00c 0.17±0.01b 0.54±0.00a C20:5 n-3 EPA 4.44±0.08a 4.52±0.03a 4.47±0.08a 4.15±0.01b C22:3 n-3 0.25±0.01a 0.24±0.00a 0.24±0.01a 0.24±0.00a C22:4 n-6 0.14±0.01b 0.13±0.01bc 0.12±0.02c 0.19±0.00a C22:5 n-6 0.16±0.03ab 0.10±0.03b 0.18±0.04a 0.11±0.03b C22:5 n-3 1.44±0.02a 1.41±0.00b 1.41±0.01b 1.44±0.01a C22:6 n-3 DHA 9.30±0.84a 8.70±0.12ab 8.81±0.38ab 8.27±0.08b ∑PUFA 41.19±0.61a 40.67±0.18ab 40.5±0.64ab 40.07±0.05b ∑n-3 PUFA 19.06±0.72a 18.73±0.17ab 18.65±0.51ab 17.85±0.06b ∑n-6 PUFA 22.14±0.14ab 21.94±0.14bc 21.85±0.18c 22.21±0.04a EPA+DHA 13.73±0.90a 13.23±0.13ab 13.29±0.47ab 12.42±0.09b EFA 24.39±0.30a 24.51±0.16a 24.20±0.26a 24.17±0.12a n-6/n-3 1.16 1.17 1.17 1.24 AI 0.36 0.36 0.37 0.38 TI 0.37 0.38 0.39 0.41 注:同行不同字母表示差异显著(P < 0.05);AI(动脉粥状硬化指数,Atherogenic index)= (C12:0+C14:0+C16:0)/(n-3 PUFA+n-6 PUFA+MUFA);TI(血栓形成指数,Thrombogenic index)=(C14:0+C16:0+C18:0)/(0.5×MUFA+0.5×n-6 PUFA+0.3×n-3 PUFA)[14]。 以DHA和EPA为代表的海洋源n-3 PUFA,被报道具有广泛生理功能,如治疗老年痴呆、促进大脑和视力的发育、预防和治疗心血管疾病等[24]。褐点石斑鱼中DHA+EPA的含量占总脂肪酸的12.42%~13.73%,其中DHA(占总脂肪酸的8.27%~9.30%)的含量要高于EPA(4.15%~4.52%)的含量,这与其它海水鱼(如珍珠龙胆石斑鱼、鞍带石斑鱼[5]和黄鳍马面鲀[25]等)中DHA和EPA的分布情况一致。必需脂肪酸(essential fatty acids,EFA)作为必须从食物中获取的脂肪酸,与机体细胞合成、大脑和视力的发育和生物膜脂质的构成有关。褐点石斑鱼中EFA的含量占总脂肪酸的24%左右,高于黄鳍马面鲀[25](5.64%)、史氏鲟[26](13.20%)和红罗非鱼[27](15.49%)等常见鱼种,这表明褐点石斑鱼是一种较好的必需脂肪酸的天然膳食来源。与蓝圆鯵[14]等海水鱼相比,褐点石斑鱼中的EPA和DHA的含量略低,但是其必需脂肪酸的含量相对较高,这使得其营养价值更加全面,食用褐点石斑鱼可同时满足人体对PUFA和EFA的需求。
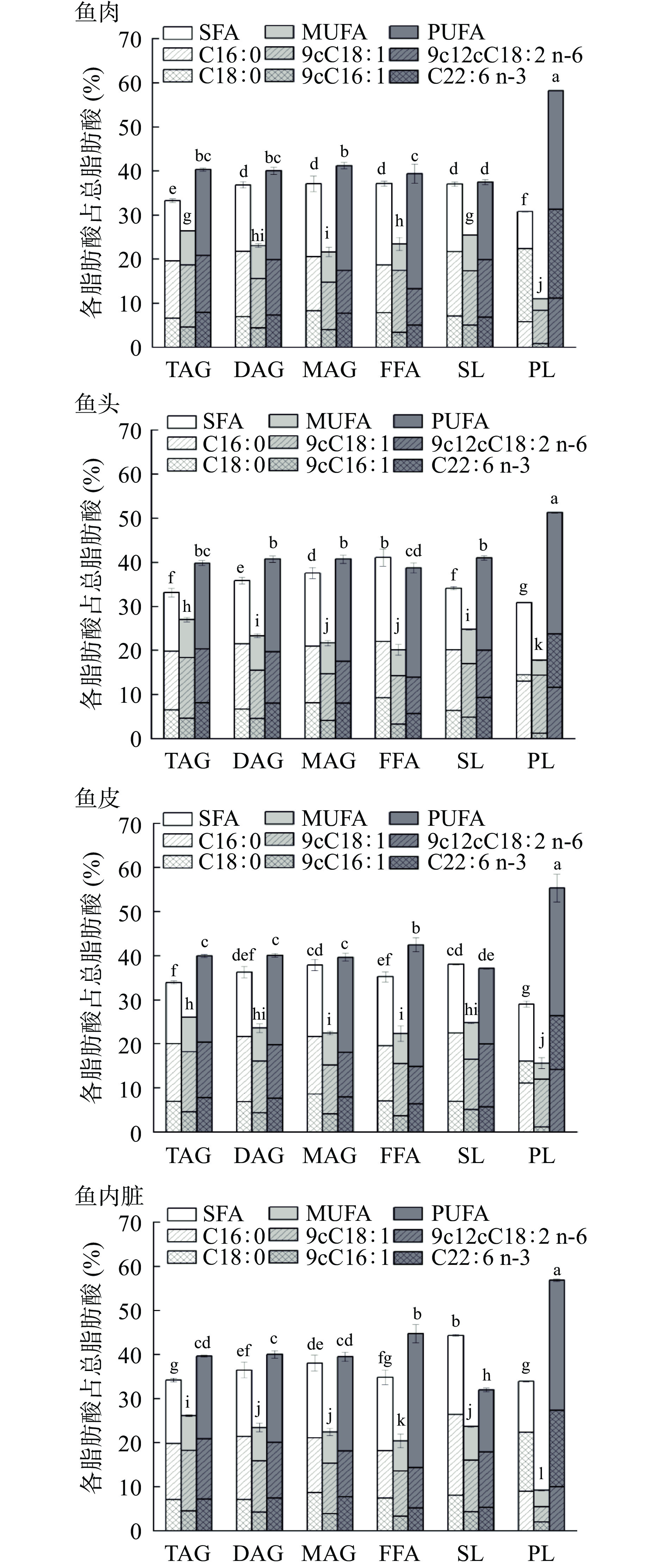
2.3 各部位不同脂质中脂肪酸的分布
从图1可以看出,鱼肉PL中PUFA的含量要远高于其它脂类中PUFA的含量,同样的情况也存在于鱼头、鱼皮和内脏中,这与之前He等[14]对蓝圆鯵的研究相吻合。鱼肉、鱼头、鱼皮和内脏各类脂质中,MUFA均是以9cC18:1(分别占总脂肪酸的8.37%~18.66%、14.24%~18.38%、11.93%~18.19%和5.49%~18.24%)和9cC16:1(0.84%~4.97%、1.24%~4.85%、1.15%~5.13%和2.04%~4.55%)为主要脂肪酸。在四个部位PL中C18:0 (22.35%、14.51%、16.05%和22.33%)和C22:6 n-3(31.35%、23.72%、26.40%和27.34%)分别是最主要的SFA和PUFA。然而在TAG、DAG、MAG、FFA和SL中SFA以C16:0 (18.63%~21.79%、19.82%~22.05%、19.53%~22.50%和18.22%~26.37%)为主,PUFA以9c12cC18:2 n-6(13.26%~20.80%、13.89%~20.32%、14.90%~20.38%和14.38%~20.85%)为主。
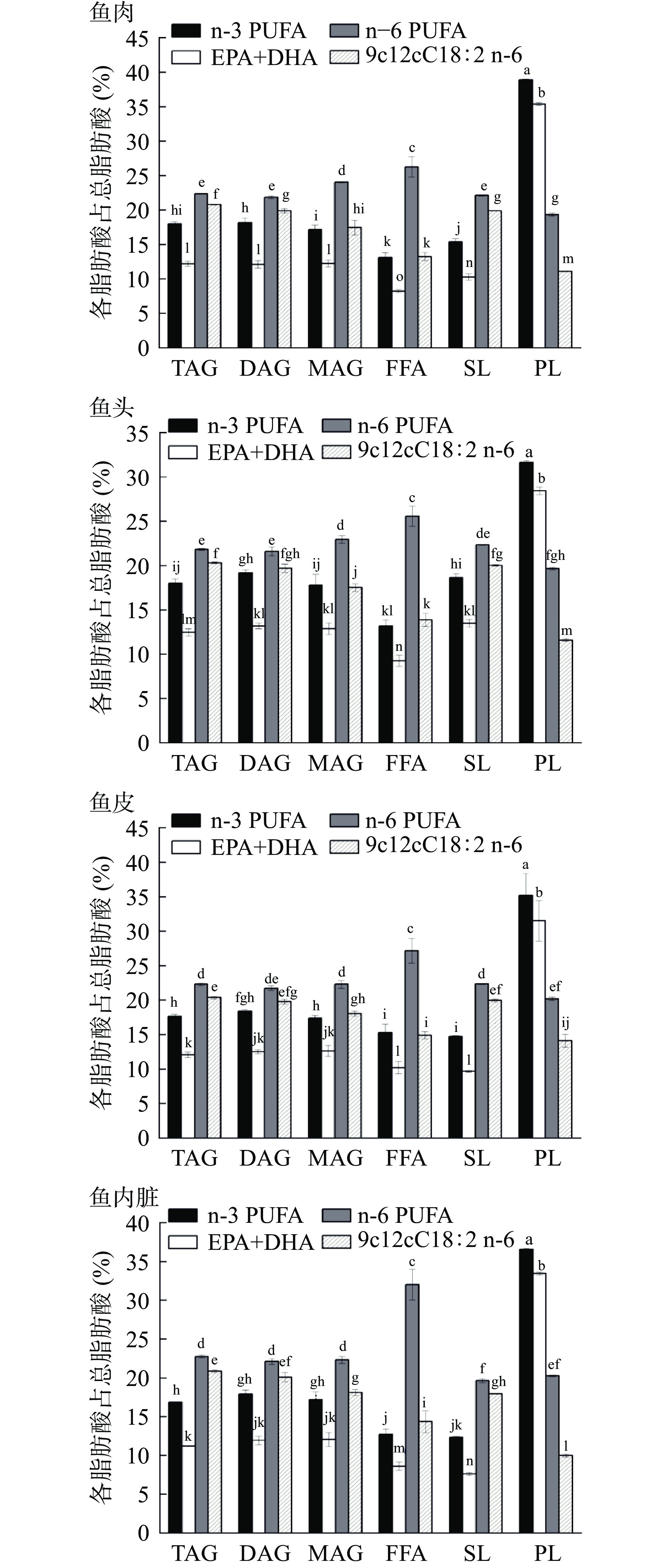
图2是不同部位和各脂类中n-3 PUFA和n-6 PUFA的分布情况,可以看出四个部位中n-3 PUFA在PL中的含量要远高于在TAG等其它脂类中的含量。此外,n-3 PUFA在鱼肉、鱼皮和鱼内脏TAG和DAG中没有显著性差异(P>0.05),在鱼头TAG中n-3 PUFA水平要低于其在DAG中的水平;在鱼肉、鱼皮和鱼内脏SL和FFA中n-3 PUFA的水平较其它脂类低,在鱼头FFA中n-3 PUFA的水平最低;四个部位中除了PL外,其它脂类中n-6 PUFA要高于n-3 PUFA。更值得关注的是,石斑鱼所有部位PL中含有较高水平的DHA+EPA(占总脂肪酸的28.43%~37.37%)。有报道称DHA-PL在降低肝脏和血清甘油三酯水平以及增加脑中n-3浓度方面表现出比TAG和乙酯型DHA更高效的生物活性 [28-29],这是由于长链多不饱和脂肪酸的代谢作用很大程度上取决于核受体,如过氧化物酶体增殖物激活受体-α、肝核因子-4和甾醇调节元件结合蛋白-1,介导的基因表达的调节,而各种磷脂类能够作为核受体的配体[30]。此外,在食用膳食脂质时,它们主要在肠内消化,在肠内脂质被分解成游离脂肪酸和其它残留物质,如单甘酯、乙醇或溶血磷脂胆碱等,并被肠壁的肠细胞吸收,而溶血磷脂是DHA穿过血脑屏障的首选载体,所以磷脂型的DHA更容易被人体所吸收利用[31]。Rossmeisl等[30]报道称,DHA-PL在预防肥胖方面比DHA-TAG更具优势。DHA-PL比DHA-TAG更容易被吸收,因为磷脂的两亲特性可能会影响脂肪滴的表面组成,从而促进水解酶在吸收前的结合[32]。因此,褐点石斑鱼脂质可以作为DHA-PL的潜在来源,具有较高的开发潜力。
2.4 甘油三酯和磷脂中脂肪酸的位置分布
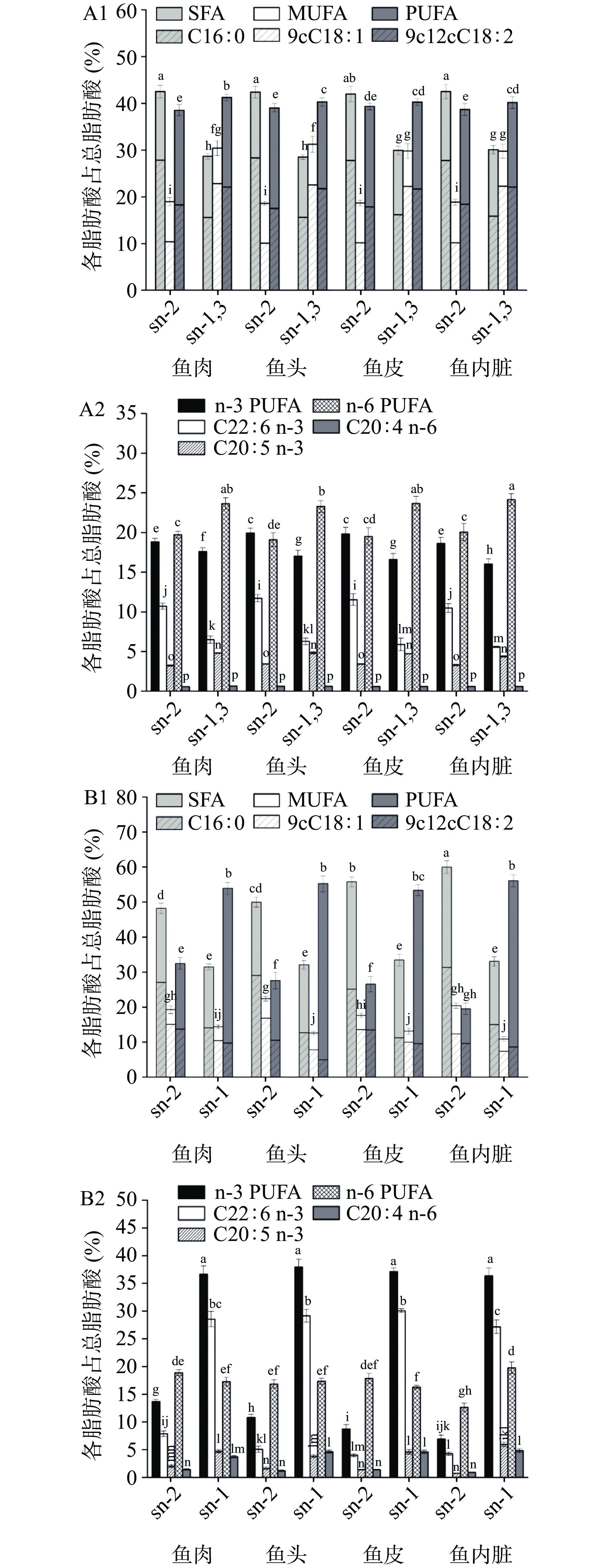
有研究表明脂肪酸的生物活性和理化性质不仅与脂肪酸的浓度相关,而且还与脂肪酸分布情况以及酯化的位置相关[7]。由图3可见,不同脂肪酸在TAG和PL中位置分布情况不同。图3-A1为SFA、MUFA和PUFA在TAG中的位置分布情况,可以看出SFA主要分布在TAG的sn-2位,MUFA和PUFA更倾向于分布于sn-1,3位。棕榈酸(C16:0)作为最主要的SFA,主要酯化在TAG的sn-2位(占总脂肪酸的27.75%~28.29%),有研究表明棕榈酸结合在TAG的sn-2位置更易被人体吸收,而结合在TAG的sn-1,3位的棕榈酸容易在小肠内形成不溶性钙皂,造成婴儿体内矿物质和能量的损失[33]。此外,9cC18:1(OA)和9c12cC18:2(LA)均倾向于酯化在TAG的sn-1,3位(22.20%~22.80%和21.64%~22.08%)。已有报道称sn-OPO和sn-OPL是母乳中主要的甘油三酯类型,它们在改善婴幼儿对钙和脂质的吸收发挥着重要的作用[33]。褐点石斑鱼的甘油三酯中,PA、OA和LA的位置分布特点符合母乳脂中最主要的两种特殊结构OPO和OPL中脂肪酸的位置分布规律,这表明褐点石斑鱼脂质可以成为商业婴儿配方奶粉中的脂肪来源[34-35]。四个组织中n-3和n-6 PUFA在TAG中的位置分布如图3-A2所示,n-6 PUFA倾向于分布于sn-1,3位,这可能归因于9c12cC18:2主要分布在sn-1,3位;C20:4 n-6在sn-2和sn-1,3中的分布没有明显差异。对于n-3 PUFA而言,其在sn-2位(18.63%~19.94%)的含量略高于sn-1,3位(16.01%~17.62%),但是作为最主要的n-3 PUFA的DHA和EPA,两者的分布规律恰恰相反,EPA倾向于酯化在sn-1,3位上,而DHA则更倾向于酯化在sn-2位。此外,有报道称酯化在TAG的sn-2位的DHA比酯化在sn-1,3位的更容易被肠粘膜吸收[36]。
褐点石斑鱼PL中SFA、MUFA和PUFA的位置分布如图3-B1所示,四个部位中SFA在PL中的位置分布与其在TAG中的分布情况一致,均主要结合在sn-2位(占总脂肪酸的48.21%~60.00%);C16:0也主要结合在PL的sn-2位(25.16%~31.34%)。MUFA(17.68%~22.40%)和9cC18:1(12.39%~16.85%)在PL中的位置分布与其在TAG中的分布相反,它们主要酯化在PL的sn-2位。PL中的PUFA主要结合在sn-1位,这与在TAG中的分布情况相一致,但其主要归因于较高含量的DHA和EPA;然而9c12cC18:2在PL中主要结合在sn-2位(9.68%~13.73%),与其在TAG中的位置分布不同。对于n-3和n-6 PUFA在PL中的位置分布情况如图3-B2所示,鱼肉、鱼头和鱼皮PL中n-6 PUFA在sn-1和sn-2位分布情况没有明显差异,而在鱼内脏中,n-6 PUFA主要分布在sn-1位;C20:4 n-6在各组织PL中均主要酯化在sn-1位(3.72%~4.81%)。值得注意的是,n-3 PUFA主要分布在PL的sn-1位(36.33%~37.93%),这与其在TAG中n-3 PUFA主要分布在sn-2位的位置分布特点相反,表明n-3 PUFA在TAG和PL中的位置分布不同。DHA和EPA作为最主要的n-3 PUFA,均倾向于酯化在PL的sn-1位(27.16%~30.07%和3.83%~5.93%)。Sugasini等[31]研究表明,膳食中来自PL的sn-1位的DHA相比于来自TAG和sn-2位的DHA更容易在大脑中积累并且能更有效地发挥其功能,这是因为TAG型的DHA主要以乳糜颗粒的形式被吸收,其首先被心脏、肌肉和脂肪组织部分吸收,然后被肝脏吸收,而来自PL的sn-1位DHA,在体内可以被分解成溶血磷脂胆碱型DHA,其可以被有效地运输到大脑中。根据上述TAG和PL的脂肪酸位置分布特性,褐点石斑鱼油可能是功能性脂质的潜在来源,具有较好的开发潜力。
3. 结论
本研究对褐点石斑鱼鱼肉、鱼头、鱼皮和鱼内脏中脂质的得率,总脂及各脂类中脂肪酸的组成,甘油三酯和磷脂中脂肪酸的位置分布特性进行分析,与现有的只针对其鱼肉脂质含量和脂肪酸组成的研究而言本研究更为全面,在评估其脂质营养价值方面更具说服力,可为褐点石斑鱼及其副产物的营养评估和高值化利用提供理论参考。褐点石斑鱼鱼头和内脏的总脂得率相对较高;各组织均含有较丰富的糖脂和磷脂,尤其是鱼头中糖脂(13.42%)和磷脂(8.75%)含量最高,褐点石斑鱼各组织均可作为糖脂和磷脂的良好来源;四个组织总脂中PUFA的含量最丰富,尤其是亚油酸、DHA和EPA含量较高,n-6/n-3、AI和TI值均处于较低水平,有利于降低心血管疾病的发生。此外,在对各脂类脂肪酸组成以及脂肪酸在甘油三酯和磷脂的位置分布分析中发现,PUFA在磷脂中的比例要远高于在甘油三酯和其它脂类中的比例,尤其是DHA占比最高;DHA主要酯化在甘油三酯的sn-2位和磷脂的sn-1位,这种分布特点的甘油三酯和磷脂型DHA具有更高的生物利用率,因此褐点石斑鱼可以作为甘油三酯和磷脂型DHA的良好来源。综合而言,褐点石斑鱼不同部位的脂质均具有较高的营养价值,可作为提取功能性脂质和开发功能性食品的优质原材料。
-
表 1 褐点石斑鱼不同部位总脂得率(占湿重%)和各脂类分布(占总脂%)
Table 1 Total lipid (% wet weight) and lipid classes (% total lipid) in different tissues of Epinephelus fuscoguttatus
部位 总脂得率 甘油三酯 甘油二酯 甘油一酯 游离脂肪酸 糖脂 磷脂 鱼肉 1.53±0.10d 75.32±1.83b 3.89±0.61b 3.87±0.30a 0.40±0.09b 7.75±0.50c 7.06±0.73b 鱼头 7.46±0.35b 68.20±0.85c 5.20±0.46ab 3.21±0.24b 1.14±0.14a 13.42±1.37a 8.75±0.84a 鱼皮 2.57±0.27c 80.80±1.36a 3.83±0.89b 2.10±0.18c 1.12±0.30a 5.66±1.14d 2.88±0.29c 鱼内脏 13.97±0.97a 68.10±0.65c 6.17±0.90a 2.77±0.23b 1.24±0.28a 10.78±1.18b 2.96±0.69c 注:同列不同字母表示差异显著(P<0.05)。 表 2 褐点石斑鱼不同部位总脂脂肪酸的组成(占总脂肪酸的百分比%)
Table 2 Fatty acid compositions in different tissues of Epinephelus fuscoguttatus (% of total fatty acids)
脂肪酸 鱼肉 鱼头 鱼皮 鱼内脏 C12:0 0.08±0.00b 0.08±0.00b 0.08±0.00b 0.09±0.00a C14:0 4.03±0.24b 4.19±0.06b 4.10±0.05b 4.53±0.01a C15:0 0.53±0.02c 0.56±0.01ab 0.54±0.00bc 0.57±0.01a C16:0 19.68±0.02b 20.02±0.10a 20.04±0.25a 20.18±0.01a C17:0 0.55±0.00b 0.56±0.00ab 0.56±0.01ab 0.56±0.00a C18:0 6.87±0.22b 6.56±0.03c 7.06±0.03ab 7.16±0.08a C19:0 0.13±0.02a 0.11±0.00a 0.12±0.02a 0.13±0.01a C20:0 0.66±0.03c 0.69±0.00bc 0.71±0.01b 0.78±0.01a C22:0 0.48±0.08b 0.52±0.01ab 0.57±0.03a 0.59±0.02a C24:0 0.14±0.01a 0.12±0.01b 0.13±0.01ab 0.13±0.01ab ∑SFA 33.16±0.26c 33.39±0.20c 33.92±0.35b 34.72±0.11a 9cC14:1 0.06±0.00b 0.06±0.00b 0.05±0.01b 0.19±0.01a 9cC16:1 4.27±0.21b 4.60±0.01a 4.35±0.03b 4.37±0.04b 10cC17:1 0.24±0.01b 0.26±0.01a 0.25±0.00ab 0.24±0.01b 6cC18:1 0.07±0.00a 0.08±0.01a 0.08±0.02a 0.07±0.01a 9cC18:1 18.31±0.20a 18.24±0.03a 18.17±0.28a 17.65±0.07b 11cC18:1 2.69±0.02a 2.70±0.01a 2.68±0.02a 2.69±0.01a ∑cis MUFA 25.65±0.43ab 25.93±0.04a 25.59±0.29ab 25.21±0.08b 9c12cC18:2 n-6 20.38±0.28a 20.42±0.12a 20.18±0.19a 20.19±0.07a C18:3 n-6 0.08±0.00a 0.08±0.01a 0.08±0.01a 0.08±0.01a C18:3 n-3 3.19±0.15b 3.42±0.05a 3.28±0.06ab 3.28±0.05ab C20:2 n-6 0.31±0.02a 0.31±0.01a 0.30±0.00a 0.31±0.02a C20:3 n-6 0.10±0.01a 0.10±0.00a 0.09±0.01b 0.10±0.00a C20:3 n-3 0.45±0.03ab 0.43±0.01b 0.43±0.01b 0.47±0.02a C20:4 n-6 0.82±0.13a 0.67±0.01b 0.73±0.04ab 0.69±0.00ab C22:2 n-6 0.15±0.01b 0.12±0.00c 0.17±0.01b 0.54±0.00a C20:5 n-3 EPA 4.44±0.08a 4.52±0.03a 4.47±0.08a 4.15±0.01b C22:3 n-3 0.25±0.01a 0.24±0.00a 0.24±0.01a 0.24±0.00a C22:4 n-6 0.14±0.01b 0.13±0.01bc 0.12±0.02c 0.19±0.00a C22:5 n-6 0.16±0.03ab 0.10±0.03b 0.18±0.04a 0.11±0.03b C22:5 n-3 1.44±0.02a 1.41±0.00b 1.41±0.01b 1.44±0.01a C22:6 n-3 DHA 9.30±0.84a 8.70±0.12ab 8.81±0.38ab 8.27±0.08b ∑PUFA 41.19±0.61a 40.67±0.18ab 40.5±0.64ab 40.07±0.05b ∑n-3 PUFA 19.06±0.72a 18.73±0.17ab 18.65±0.51ab 17.85±0.06b ∑n-6 PUFA 22.14±0.14ab 21.94±0.14bc 21.85±0.18c 22.21±0.04a EPA+DHA 13.73±0.90a 13.23±0.13ab 13.29±0.47ab 12.42±0.09b EFA 24.39±0.30a 24.51±0.16a 24.20±0.26a 24.17±0.12a n-6/n-3 1.16 1.17 1.17 1.24 AI 0.36 0.36 0.37 0.38 TI 0.37 0.38 0.39 0.41 注:同行不同字母表示差异显著(P < 0.05);AI(动脉粥状硬化指数,Atherogenic index)= (C12:0+C14:0+C16:0)/(n-3 PUFA+n-6 PUFA+MUFA);TI(血栓形成指数,Thrombogenic index)=(C14:0+C16:0+C18:0)/(0.5×MUFA+0.5×n-6 PUFA+0.3×n-3 PUFA)[14]。 -
[1] 雷从改, 林海城. 老虎斑深水网箱养殖技术初探[J]. 科学养鱼,2011(2):36−37. [LEI C G, LIN H C. Preliminary study on cage culture technology of tiger grouper in deep water[J]. Scientific Fish Farming,2011(2):36−37. [2] 农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会. 2021中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2021: 22−26 Bureau of Fisheries, Ministry of Agriculture and Rural Affairs, National Fisheries Technology Extension Center, China Society of Fisheries. 2021 China fishery statistical yearbook[M]. Beijing: China Agricultural Press, 2021: 22−26.
[3] 刘荣军. 石斑鱼养殖疾病预防措施[J]. 科学养鱼,2021(12):52−53. [LIU R J. Prevention measures of grouper culture diseases[J]. Scientific Fish Farming,2021(12):52−53. doi: 10.3969/j.issn.1004-843X.2021.12.030 [4] NANKERVIS L, COBCROFT J M, NGUYEN N V, et al. Advances in practical feed formulation and adoption for hybrid grouper (Epinephelusfuscoguttatus♀×E.lanceolatus♂) aquaculture[J]. Reviews in Aquaculture,2022,14(1):288−307. doi: 10.1111/raq.12598
[5] 陈晓婷, 林瑜, 路海霞, 等. 4种石斑鱼肌肉中营养成分分析与评价[J]. 渔业研究,2020,42(5):463−472. [CHEN X T, LIN Y, LU H X, et al. Analysis and evaluation of nutritional components in muscle of four grouper species[J]. Journal of Fisheries Research,2020,42(5):463−472. [6] RAI A K, SWAPNA H C, BHASKAR N, et al. Potential of seafood industry byproducts as sources of recoverable lipids: Fatty acid composition of meat and nonmeat component of selected Indian marine fishes[J]. Journal of Food Biochemistry,2012,36(4):441−448. doi: 10.1111/j.1745-4514.2011.00549.x
[7] HUNTER J E. Studies on effects of dietary fatty acids as related to their position on triglycerides[J]. Lipids,2001,36(7):655−668. doi: 10.1007/s11745-001-0770-0
[8] MICHALSKI M C, GENOT C, GAYET C, et al. Multiscale structures of lipids in foods as parameters affecting fatty acid bioavailability and lipid metabolism[J]. Progress in lipid research,2013,52(4):354−373. doi: 10.1016/j.plipres.2013.04.004
[9] ZHANG T T, XU J, WANG Y M, et al. Health benefits of dietary marine DHA/EPA-enriched glycerophospholipids[J]. Progress in Lipid Research,2019,75:100997. doi: 10.1016/j.plipres.2019.100997
[10] FLOCH J, LEES M, SLOANE STANLEY G H. A simple method for the isolation and purification of total lipids from animal tissues[J]. Journal of Biological Chemistry,1957,226:497−509. doi: 10.1016/S0021-9258(18)64849-5
[11] HE C, CAO J, JIANG X, et al. Fatty acid profiles of triacylglycerols and phospholipids of sea-cage cultured Trachinotus blochii: A comparative study of head, viscera, skin, bone, and muscle[J]. Journal of Food Science,2019,84(3):650−658. doi: 10.1111/1750-3841.14458
[12] RINCÓN-CERVERA M Á, GONZÁLEZ-BARRIGA V, VALENZUELA R, et al. Profile and distribution of fatty acids in edible parts of commonly consumed marine fishes in Chile[J]. Food Chemistry,2019,274:123−129. doi: 10.1016/j.foodchem.2018.08.113
[13] 吴琳, 刘四磊, 魏芳, 等. Florisil固相萃取法联用气相色谱测定油脂中sn-2位脂肪酸[J]. 中国油料作物学报,2015,37(2):227−233. [WU L, LIU S L, WEI F, et al. Determination of sn-2 position fatty acid in oils by SPE method with Florisil extraction cartridge coupled with gas chromatography[J]. Chinese Journal of Oil Crop Sciences,2015,37(2):227−233. [14] HE C, SUN Z X, QU X C, et al. A comprehensive study of lipid profiles of round scad (Decapterus maruadsi) based on lipidomic with UPLC-Q-Exactive Orbitrap-MS[J]. Food Research International,2020,133:109138. doi: 10.1016/j.foodres.2020.109138
[15] LEI L, LI J, LI G Y, et al. Stereospecific analysis of triacylglycerol and phospholipid fractions of five wild freshwater fish from Poyang Lake[J]. Journal of Agricultural and Food Chemistry,2012,60(7):1857−1864. doi: 10.1021/jf204584t
[16] WENG C, DENG Z Y, ZHANG N, et al. Lipid profiles of Chinese soft-shell turtle eggs (Pelodiscus sinensis)[J]. Journal of Food Composition and Analysis,2020,94:103627. doi: 10.1016/j.jfca.2020.103627
[17] 曹君. 不同脂肪酸结构食用油的氧化规律及其动力学研究[D]. 南昌: 南昌大学, 2015 CAO J. Oxidative patterns and kinetics of edible oils with different fatty acid compositions[D]. Nanchang: Nanchang University, 2015.
[18] CHIU H H, KUO C H. Gas chromatography-mass spectrometry-based analytical strategies for fatty acid analysis in biological samples[J]. Journal of Food and Drug Analysis,2020,28(1):60−73. doi: 10.1016/j.jfda.2019.10.003
[19] 黄峥, 盛灵慧, 马康, 等. 5种脂肪酸甲酯化方法的酯化效率研究[J]. 中国油脂,2013,38(9):86−88. [HUANG Z, SHENG L H, MA K, et al. Efficiency of five methods for fatty acids methyl esterification[J]. China Oils and Fats,2013,38(9):86−88. [20] 曹君, 李静, 覃雯, 等. 气相色谱法测定奶茶中的反式脂肪酸[J]. 食品科学,2011,32(18):159−163. [CAO J, LI J, QIN W, et al. Determination of trans fatty acids in milk tea by gas chromatography[J]. Food Science,2011,32(18):159−163. [21] SWAPNA H C, RAI A K, BHASKAR N, et al. Lipid classes and fatty acid profile of selected Indian fresh water fishes[J]. Journal of Food Science and Technology,2010,47(4):394−400. doi: 10.1007/s13197-010-0065-6
[22] 韩丽娜, 李志鸿, 朱海, 等. 黄金石斑鱼肌肉蛋白质和脂肪酸成分分析及评价[J]. 食品研究与开发,2022,43(2):145−149. [HAN L N, LI Z H, ZHU H, et al. Analysis and evaluation of protein and fatty acid composition in Petenia splendida muscle[J]. Food Research and Development,2022,43(2):145−149. [23] MANSON J E, COOK N R, LEE I M, et al. Marine n−3 fatty acids and prevention of cardiovascular disease and cancer[J]. New England Journal of Medicine,2019,380(1):23−32. doi: 10.1056/NEJMoa1811403
[24] SHAHIDI F, AMBIGAIPALAN P. Omega-3 polyunsaturated fatty acids and their health benefits[J]. Annual Review of Food Science and Technology,2018,9:345−381. doi: 10.1146/annurev-food-111317-095850
[25] 庄海旗, 刘江琴, 钟宇, 等. 六种鳞鲀亚目鱼肌肉脂肪酸分析和比较[J]. 现代食品科技,2020,36(9):101−108. [ZHUANG H Q, LIU J Q, ZHONG Y, et al. Comparison of fatty acid composition in muscles of six species of Balistoidei[J]. Modern Food Science and Technology,2020,36(9):101−108. [26] 罗钦, 柯文辉, 李冬梅, 等. 3种特种水产品肌肉中脂肪酸组成比较及主成分综合评价[J]. 南方农业学报,2019,50(10):2286−2292. [LUO Q, HE W H, LI D M, et al. Analysis on fatty acid compositions in muscle of three special aquatic products and comprehensive evaluation of principal components[J]. Journal of Southern Agriculture,2019,50(10):2286−2292. [27] 朱定贵. 红罗非鱼亲鱼组织脂肪酸组成分析[J]. 西南农业学报,2012,25(2):713−717. [ZHU D G. Analysis of fatty acid composition in Red Tilapia parent fish[J]. Journal of Southern Agriculture,2012,25(2):713−717. doi: 10.3969/j.issn.1001-4829.2012.02.073 [28] CHE H, CUI J, WEN M, et al. Long-term effects of docosahexaenoic acid-bound phospholipids and the combination of docosahexaenoic acid-bound triglyceride and egg yolk phospholipid on lipid metabolism in mice[J]. Journal of Ocean University of China,2018,17(2):392−398. doi: 10.1007/s11802-018-3444-7
[29] TANG X, LI Z J, XU J, et al. Short term effects of different omega-3 fatty acid formulation on lipid metabolism in mice fed high or low fat diet[J]. Lipids in Health and Disease,2012,11(1):1−8. doi: 10.1186/1476-511X-11-1
[30] ROSSMEISL M, MACEK J Z, KUDA O, et al. Metabolic effects of n-3 PUFA as phospholipids are superior to triglycerides in mice fed a high-fat diet: Possible role of endocannabinoids[J]. PloS One,2012,7(6):e38834. doi: 10.1371/journal.pone.0038834
[31] SUGASINI D, YALAGALA P C R, GOGGIN A, et al. Enrichment of brain docosahexaenoic acid (DHA) is highly dependent upon the molecular carrier of dietary DHA: Lysophosphatidylcholine is more efficient than either phosphatidylcholine or triacylglycerol[J]. The Journal of Nutritional Biochemistry,2019,74:108231. doi: 10.1016/j.jnutbio.2019.108231
[32] MUN S, DECKER E A, MCCLEMENTS D J. Influence of emulsifier type on in vitro digestibility of lipid droplets by pancreatic lipase[J]. Food Research International,2007,40(6):770−781. doi: 10.1016/j.foodres.2007.01.007
[33] SUN C, WEI W, ZOU X, et al. Evaluation of triacylglycerol composition in commercial infant formulas on the Chinese market: A comparative study based on fat source and stage[J]. Food Chemistry,2018,252:154−162. doi: 10.1016/j.foodchem.2018.01.072
[34] 曹江, 邹孝强, 金青哲, 等. 改性巴沙鲶鱼油制备1, 3-二油酸-2-棕榈酸甘油三酯的研究[J]. 食品工业科技,2015,36(22):216−220, 324. [CAO J, ZOU X Q, JIN Q Z, et al. Modification of basa catfish oil for preparation of 1, 3-dioleoyl-2-palmitoylglycerol[J]. Science and Technology of Food Industry,2015,36(22):216−220, 324. [35] ZOU X, JIN Q, GUO Z, et al. Preparation of human milk fat substitutes from basa catfish oil: Combination of enzymatic acidolysis and modeled blending[J]. European Journal of Lipid Science and Technology,2016,118(11):1702−1711. doi: 10.1002/ejlt.201500591
[36] JIN J, JIN Q, WANG X, et al. High sn-2 docosahexaenoic acid lipids for brain benefits, and their enzymatic syntheses: A review[J]. Engineering,2020,6(4):424−431. doi: 10.1016/j.eng.2020.02.009







 下载:
下载:
 下载:
下载:
