Effect of Cold Dormancy Combined with Film Packaging on Quality and Metabolism of Crassostrea gigas during Ecological Ice Temperature Keep Alive
-
摘要: 为优化牡蛎流通作业模式,探明不同保活前处理方式对牡蛎无水保活期活力、品质的影响,本研究模拟实际产业运输,将采捕后的太平洋牡蛎冷链运输到销售地,经过人工海水复苏、净化后,分别采用散装处理以及低温诱导休眠结合薄膜包裹,2种不同保活前处理方式处置后,在生态冰温(0 ℃)条件下进行无水保活;分别测定不同保活时间下牡蛎存活率、质量损失率、菌落总数和大肠菌群以及肌肉品质的变化规律。结果表明,冷休眠薄膜组牡蛎在生态冰温条件下无水保活9 d,其存活率仍高于95%;质量损失率为3.95%,显著优于散装处理组(P<0.05);各组牡蛎在保活9 d后菌落总数、大肠菌群均符合国际限量标准,其中冷休眠结合薄膜包裹处理对牡蛎微生物生长繁殖抑制作用较为显著(P<0.05);随着保活时间的延长,散装组牡蛎L*值、∆E值劣变速率显著快于冷休眠薄膜组(P<0.05);硬度、弹性、胶黏性、咀嚼性也同样显示散装组牡蛎下降速率更为明显;保活9 d后,散装组牡蛎TVB-N含量增加了2.4倍,冷休眠薄膜组TBA值略有上升,肌肉品质显著优于散装组(P<0.05);微观组织结构也同样显示冷休眠薄膜组牡蛎肌肉结构紧密程度更好。研究表明,与净化后散装处理相比,冷休眠结合薄膜包裹的保活前处理方式能有效提升活体牡蛎在流通过程中存活率,减缓肌肉品质劣变速率,该保活前处理模式明显优于目前国内电商普遍采用的活体太平洋牡蛎流通作业模式。Abstract: To optimize the oyster circulation operation mode and investigate the effects of different pre-treatment methods on the vitality and quality of oysters during the anhydrous preservation period, the actual industrial transportation was simulated, the harvested Crassostrea gigas were transported by cold chain to the place of sale, after artificial seawater recovery and depuration, they were treated in bulk and low temperature induced dormancy with film wrapping respectively and then treated under ecological ice temperature (0 ℃) for waterless preservation. The survival rate, weight loss rate, total bacterial count and coliform and muscle quality of oyster were measured. The results showed that the survival rate of oysters in the cold dormant film group was still higher than 95% when they were kept in ecological ice temperature without water for 9 d. The weight loss rate was 3.95%, which was significantly better than that of the bulk treatment group (P<0.05); the total bacterial count and coliform in all groups of oysters met the international limits after 9 d. The inhibition of the growth and reproduction of microorganisms of oysters treated by cold dormancy combined with film wrapping was more obvious (P<0.05); with the extension of the preservation time, the rate of deterioration of L* and ∆E values of oysters in bulk treatment group was significantly faster than that of the cold dormant film group (P<0.05); the rate of decline in adductor muscle hardness, elasticity, adhesion and chewiness was also more pronounced in the bulk treatment group. After 9 d of preservation, the TVB-N content of oysters in the bulk treatment group increased by 2.4 times; TBA values increased slightly in the cold dormant film group and the quality of muscle was significantly better than that of the bulk treatment group (P<0.05) while the microstructure also showed a better compactness of oyster muscle in the cold dormant film group. The study shows that compared with the bulk treatment after purification, the cold dormancy with film wrapping pre-treatment can effectively improve the survival rate of live oysters in circulation and slow down the rate of muscle quality deterioration, this preservation pre-treatment mode is significantly better than the live Crassostrea gigas circulation mode commonly adopted by domestic e-commerce nowadays.
-
牡蛎又称蚝、海蛎子,属软体动物门,双壳纲,在我国沿海地区广泛养殖,2020年总产量约为542万吨,是我国第一大养殖贝类[1]。鲜活牡蛎由于其保留了原有的口感及营养物质,深受消费者青睐。然而鲜蛎肉含水量较高,组织脆弱,自身携带大量微生物且处于可繁殖状态,不利于其鲜活销售。目前,活体太平洋牡蛎主要有两种鲜销模式:一种是采捕上岸后直接在陆基清洗、净化、销售,该模式主要面对沿海及周边城市消费者;另一种模式则充分利用牡蛎干露耐受期,采捕上岸后简易清洗表面泥沙,立即冷链运输至内陆市场采用人工海水复苏、清洗,净化后再进行保活销售。研究表明,牡蛎经干露-再复水处置其活力可达到全新的水平[2],但关于其活力恢复后,二次保活流通过程中肌肉品质变化研究尚未见报道。因此,明确牡蛎无水流通过程中活力及肌肉品质劣变规律对于提升其活品质量至关重要。
生态冰温无水保活技术为当前活体贝类主要采用的保活流通方法[3-6],该技术核心是通过降温预冷以诱导机体处于休眠状态,从而降低其呼吸与代谢,最终达到高效运输的目的[7]。然而,目前国内牡蛎产业保活流通作业时缺乏降温预冷工序,鲜活牡蛎经暂养净化后直接置于装有冰袋的泡沫箱内,然后进入保活流通过程[8]。该作业模式下,牡蛎极易受到冷应激胁迫损伤,机体处于半休眠或苏醒状态,需消耗更多能量物质以维持机体正常生命活动,在长时低温保活流通过程中必然对牡蛎的鲜度及品质造成影响。此外,活体牡蛎在无水流通过程中面临微生物污染,蛋白质及脂质氧化导致品质发生劣变等问题;大量研究已证实,采用塑料薄膜包裹不仅能隔绝微生物污染,还可减缓品质劣变速率,而且具有价格低廉、方便、易用等特点,目前该方法已被广泛应用于新鲜果蔬流通[9],但在活体贝类流通中仍鲜见。因此,本研究将人工海水复苏、净化后的太平洋牡蛎通过低温诱导休眠处理,采用通透性材料包裹后进行生态冰温保活,并以国内电商运输活体太平洋牡蛎流通作业模式作为对照,结合存活、微生物、生理代谢指标变化,系统分析太平洋牡蛎在保活过程中品质劣变规律,以期为优化双壳贝类保活运输流程及提升其存活质量提供技术和理论参考。
1. 材料与方法
1.1 材料与仪器
实验所用的活体太平洋牡蛎(Crassostrea gigas) 于2021年9月购自山东威海灯塔水母海洋科技有限公司,平均生物学指标如下:壳长(117.88±4.05)mm,壳宽(62.34±5.85)mm,壳高(30.55±2.60)mm,湿质量(123.69±6.69)g。牡蛎采捕后保留外壳污泥不做其他处理,每50 kg分装于铺有海水冰的泡沫箱中,经专用牡蛎冷链运输车(0~4 ℃),运输48 h抵达广东海洋大学水产品保活流通实验室。样品到达时箱体中心温度为8.6 ℃,立即用灭菌人工海水复苏、清洗表面泥污,挑选外壳完整、无机械损伤的个体进行暂养净化,以消除捕捞和运输操作时的应激反应;恒温泡沫箱(材质为聚苯乙烯,450 mm×250 mm×200 mm,厚度:30 mm) 定制于东莞泡沫箱工厂;PVC保鲜薄膜(材质为聚氯乙烯,200 mm×50 mm,厚度0.05 mm) 定制于广东正兴包装公司;海水晶 江西盐通科技有限公司;营养琼脂(NA)、结晶紫中性红胆盐琼脂(VRBA) 北京陆桥技术有限公司;三氯乙酸、2-硫代巴比妥酸、氧化镁 均为分析纯,国药集团化学试剂公司。
贝类暂养净化系统 广州创岭水产有限公司;YC-800低温恒温层析柜 北京亚星仪科公司;SPX-250B生化培养箱 上海博迅公司;PR224ZH精密天平 美国OHAUS公司;VAP450全自动凯氏定氮仪 德国Gerhardt公司;Varioskan Flash全自动酶标仪 美国Thermo公司;TMS-PRO质构仪 美国FTC公司;CR-20色差仪、E-100光学显微镜 日本尼康公司。
1.2 实验方法
1.2.1 净化方法
净化流程参照(SC/T 3013-2002),按太平洋牡蛎养殖海区盐度(31‰±0.5‰),在贝类净化系统中配制人工海水;开启增氧设备持续曝气24 h;以流速2.5 m3/h通过紫外灯管循环灭菌制冷至25 ℃;通臭氧至海水臭氧浓度0.15 mg/L;将清洗后的牡蛎分装于塑料筐(600 mm×420 mm×315 mm),置于预冷的人工海水中净化24 h;净化完成后随机挑选状态良好、富有活力的牡蛎进行后续实验。
1.2.2 牡蛎分组及生态冰温保活处理
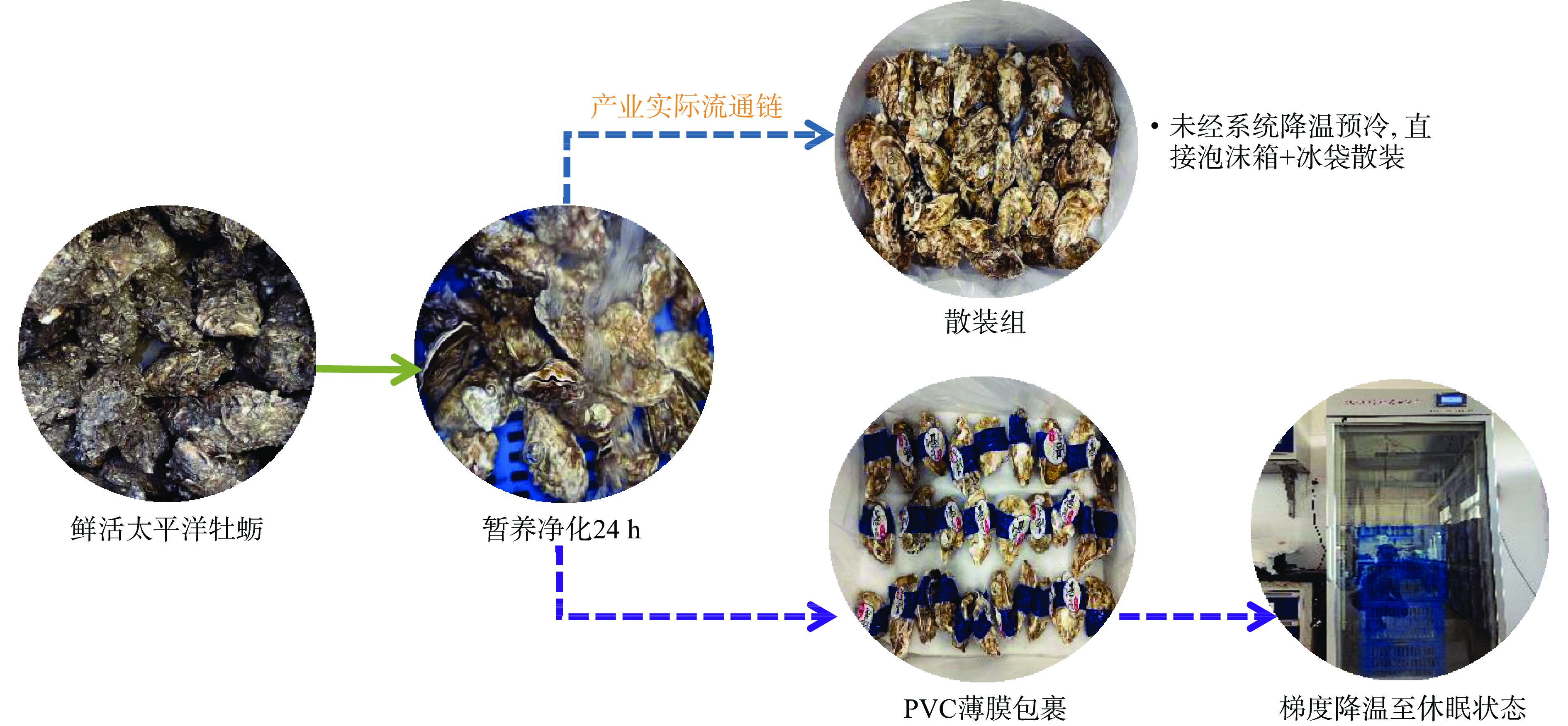
参照本团队前期实验方法,将净化后挑选的500个太平洋牡蛎随机分为2组,每组250个;将其中一组牡蛎模拟当前国内电商太平洋牡蛎流通作业方法,在泡沫箱中分装,约5 kg/箱;装箱前在箱底平铺一层无菌海水制备而成的冰袋,加盖后置于温度设定为0 ℃的低温恒温层析柜内进行无水保活,记为散装对照组[8]。另一组牡蛎采用聚氯乙烯(PVC)薄膜在壳口处进行逐个包裹处理;包裹完成后将其分装于塑料周转筐中,置于低温恒温层析柜内,参照郝爽等[10]的冷驯化方法进行诱导休眠处理,处理方式为调节恒温层析柜,从25±0.5 ℃开始,以5 ℃/h的速率降至生态冰温休眠温度(0±0.5 ℃),温度每下降5 ℃停留90 min,避免温度急剧下降造成应激损伤;冷驯化后,迅速将牡蛎分装于套有保湿内膜袋的泡沫箱中,装箱前在箱底平铺一层无菌海水制备而成的冰袋,加盖后放置在温度设定为0 ℃的层析柜中进行无水保活,记为冷休眠薄膜组。整体实验设计详见图1,各实验组均从装箱完成后,置于0 ℃低温恒温层析柜内开始计算保活时间,保活周期为9 d,分别在保活期每天监测牡蛎存活及质量损失情况,另取肌肉组织检测相关理化指标,闭壳肌切片进行微观结构观察分析。
1.2.3 存活率及质量损失率监测
检活方法参照高加龙等[8]的实验方法,根据公式计算存活率并绘制存活曲线,存活率=(存活数/初始个体总数)×100;质量损失率监测:参照申淑琦等[4]的实验方法,质量损失率为保活前后牡蛎质量损失与初始质量之比。
1.2.4 微生物指标测定
每组随机取5个活牡蛎,在流水下将外壳冲洗干净;无菌刨取牡蛎全脏器放入无菌均质袋中,密封后采用拍打式匀浆机均质1~2 min;取匀浆肉糜按质量(g)体积(mL)比1:9的比例加入无菌生理盐水制成样品匀液;菌落总数,参照GB 4789.2-2016 《食品微生物学检验 菌落总数测定》;大肠菌群,参照GB 4789.3-2016《食品微生物学检验 大肠菌群计数》规定进行,平行测定三次,结果以对数值表示。
1.2.5 色泽测定
色泽测定参照牛改改等[11]的方法,采用手持式色差仪测定牡蛎腹部的亮度值L*、红度值a*、黄度值b*,以新鲜牡蛎为对照计算ΔE值,计算方法参照公式(1)。
ΔE=√(L*−L0∗)2+(a*−a0*)2+(b*−b*0)2 (1) 式中:ΔE为色差值;L0*、a0*、b0*分别为牡蛎初始亮度、红度、黄度值;L*、a*、b*分别为牡蛎保活第n天亮度、红度、黄度值。
1.2.6 质构特性测定
参照郭迅等[12]的方法,采用质构仪对活体牡蛎腹部组织和闭壳肌进行测定分析,应用P/50平底柱形探头对试样进行两次压缩TPA模式测试,设定参数:探头下降速率2 mm/s、测试中速率1 mm/s、测试后速率5 mm/s、压缩型变量50%、停留间隔时间5 s、每组样品测定6次。
1.2.7 理化代谢指标测定
1.2.7.1 牡蛎肌肉组织采集
每组随机取活牡蛎30个,迅速开壳刨取牡蛎全脏器,用预冷质量分数为0.86%生理盐水漂洗,吸水纸拭干表面水分,混合匀浆后液氮速冻放于−80 ℃保存,待测。
1.2.7.2 pH测定
pH的测定按照(GB 5009.237-2016)进行,将牡蛎匀浆肉糜按质量(g)体积(mL)比1:9的比例加入生理盐水制成样品匀液,静置30 min,用pH计测定。
1.2.7.3 TVB-N测定
TVB-N含量测定按照(GB 5009.228-2016)进行,取牡蛎匀浆肌肉5.000 g,根据半微量定氮原理,利用设定好程序的全自动凯氏定氮仪测定牡蛎肉TVB-N值。
1.2.7.4 TBA值测定
TBA值测定参考FAUSTMAN等[13]的方法,略有修改。准确称取牡蛎匀浆肉糜1.000 g于离心管中,加入5 mL预冷质量分数为20%三氯乙酸溶液和4 mL蒸馏水,均质后于冰浴中静置1 h,冷冻离心(8000 r/min,10 min,4 ℃),过滤取上清液转移至10 mL容量瓶,定容,取5 mL样液加入5 mL TBA溶液,振荡后沸水浴反应20 min,冷却至室温于532 nm波长处测其吸光度A。TBA值=A×7.8,结果以mg/kg表示。
1.2.7.5 组织微观结构观察
微观组织切片观察参考CHEN等[14]的方法,取活牡蛎刨取闭壳肌置于4%多聚甲醛溶液固定,流水冲洗固定液,用50%、70%、80%、95%乙醇梯度脱水,用常规石蜡进行包埋切片,苏木素-伊红(HE)染色,利用光学显微镜对其进行组织学观察。
1.3 数据处理
实验结果均平行测定三次,数据以平均值±标准差表示,对非正态分布数据存活率采用平方根反正弦变换后进行统计分析,数据处理采用SPSS 26.0软件进行单因素方差分析,Duncans法进行多重比较,差异显著水平P<0.05,采用Graph Pad Prism 8.0软件绘图。
2. 结果与分析
2.1 不同前处理方式对牡蛎生态冰温保活期生命体征的影响
2.1.1 存活率分析
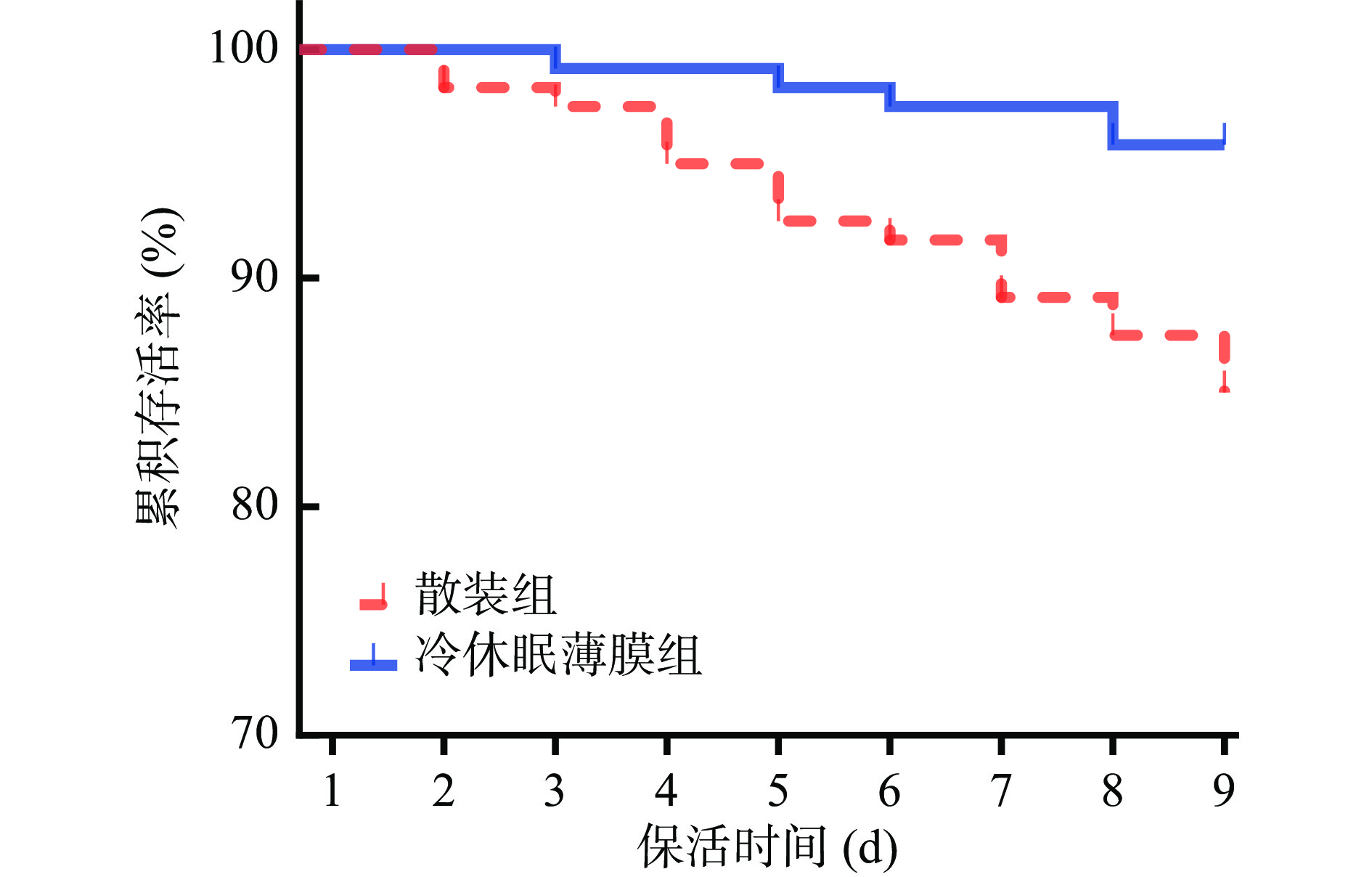
太平洋牡蛎生态冰温保活期存活曲线变化如图2所示。随着保活时间的延长,太平洋牡蛎存活率均呈下降趋势。散装组在保活第2 d开始出现死贝,冷休眠薄膜组在保活第3 d开始出现死贝;对比2种不同处理方式,冷休眠薄膜组存活率明显高于散装对照组;保活9 d后散装组与冷休眠薄膜组牡蛎存活率分别为85%和95%。两种不同保活前处理方式下牡蛎存活率均高于85%,与高加龙等[8]对净化后的香港牡蛎(Crassostrea hongkongensis)散装处理,在4 ℃条件下进行生态冰温保活的研究结果接近(保活9 d,存活率>90%)。主要原因是太平洋牡蛎在生态冰温条件下呼吸与代谢均降至最低水平,因此可以长时保持其生命活力[15];但冷休眠薄膜组牡蛎存活率高于散装对照组,主要原因是牡蛎经冷驯化休眠处理后,降低了机体生理代谢活动,同时薄膜包裹能让牡蛎始终维持在休眠状态,避免了贮藏期间环境波动牡蛎敞壳呼吸,从而保证其处于鲜活状态[15]。
2.1.2 质量损失率
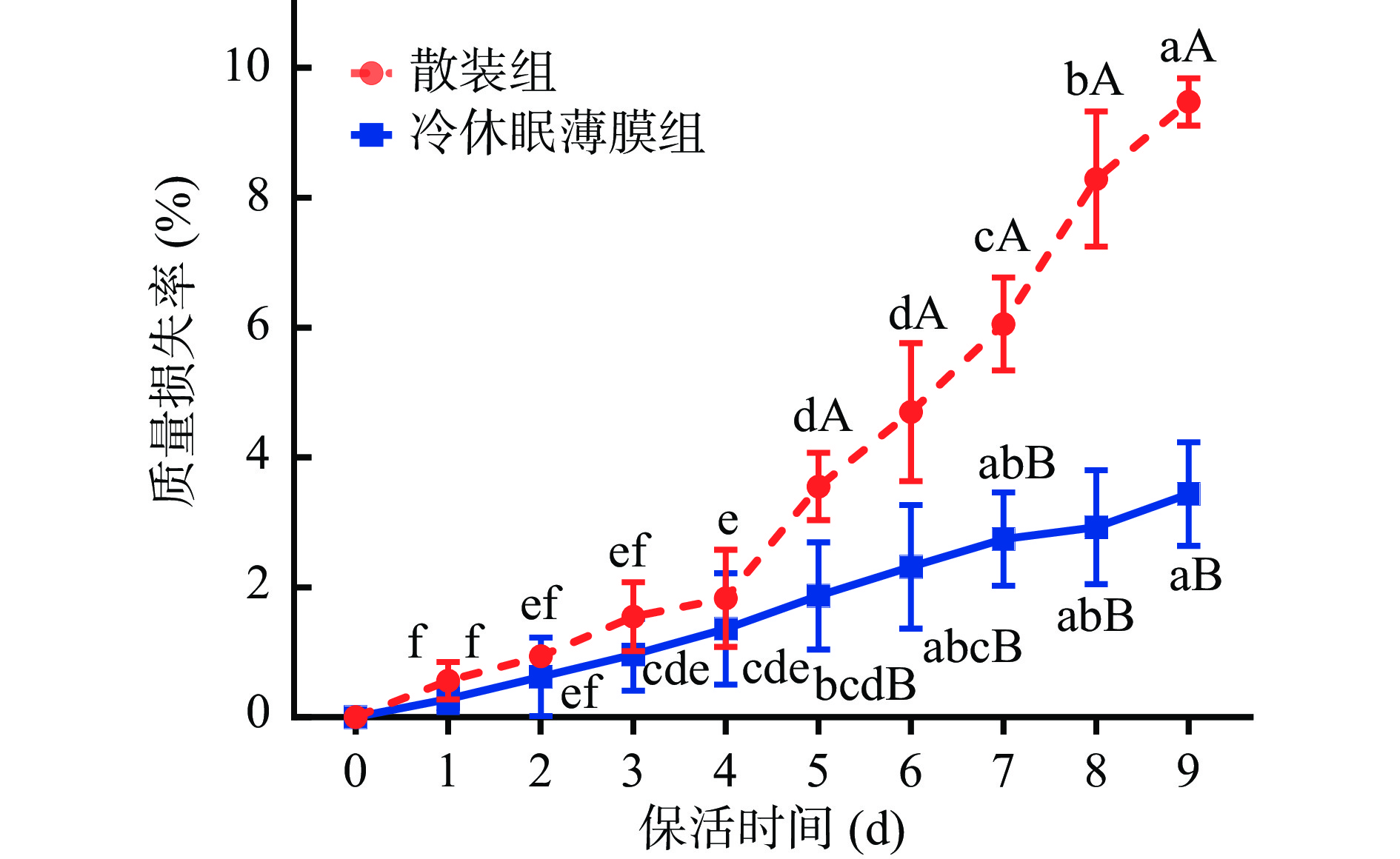
太平洋牡蛎生态冰温过程中质量损失变化如图3所示。随着保活时间延长,各不同处理组牡蛎质量损失率均呈明显上升趋势;从保活第5 d开始,散装组牡蛎质量损失率急剧上升,显著快于冷休眠薄膜组(P<0.05),保活9 d后散装组与冷休眠薄膜组牡蛎质量损失率分别为9.47%、3.95%。本研究发现,在贮藏中后期散装组牡蛎壳腔内有明显液体析出,泡沫箱底部略微出现液体累积现象。可见在相同温度条件下,不同保活前处理方式对太平洋牡蛎质量损失率影响较大,采用冷休眠结合薄膜包裹处理对牡蛎生态冰温保活过程中质量损失影响最小,这可能是冷驯化处理后贝类处于休眠状态,呼吸代谢均降至最低水平,而薄膜包裹能够避免贮藏过程中环境波动造成牡蛎苏醒、张壳呼吸,从而减少体内水分流失[10]。结合图2存活曲线分析,太平洋牡蛎通过冷驯化休眠处置并采用薄膜包裹在生态冰温条件下保活,其存活率及质量损失率均能保持在最佳水平。在其他双壳贝类保活研究中,海湾扇贝(Argopecten irradias)在0 ℃散装条件下,贮藏9 d后其质量损失率高达5%[4]。虾夷扇贝(Patinopecten yessoensis)[16]在4 ℃条件下散装贮藏3 d,其质量损失率高达7%。可见,不同保活前处理方式对活体贝类存活质量产生较大影响,诱导休眠结合薄膜包裹可减少活体牡蛎营养流失。
2.2 不同前处理方式对牡蛎生态冰温保活期微生物指标的影响
微生物的生长及代谢是导致鲜活贝类活力减弱的主要原因,太平洋牡蛎在生态冰温保活过程中微生物变化如图4所示。随着保活时间的延长,各不同处理组牡蛎菌落总数及大肠菌群呈上升趋势。由图4-a可知,太平洋牡蛎保活前其体内菌落总数为2.84 lg CFU/g,符合国际微生物标准委员会对新鲜双壳贝类的微生物限量标准(菌落总数的限量为5.69 lg CFU/g)[17]。保活前3 d散装组牡蛎体内菌落总数变化不显著(P>0.05);保活第5 d开始,散装组牡蛎菌落总数增长速率显著快于冷休眠薄膜组(P<0.05);保活9 d后,各组牡蛎菌落总数急剧上升与保活前相比均具有显著性差异(P<0.05),但冷休眠薄膜组牡蛎菌落总数值显著低于散装组(P<0.05)。由图4-b大肠菌群数值变化可知,太平洋牡蛎在生态冰温保活期内大肠菌群数值变化趋势与菌落总数基本一致,可见,冷休眠结合薄膜包裹的保活前处理方式能有效减缓微生物的生长与繁殖,延长活品牡蛎无水保活时间。参考图2、3牡蛎的生命体征变化,各不同处理组牡蛎在保活第5 d开始存活率显著下降,质量损失率上升;当箱体内死蛎上升到一定数量时会影响同一环境下其他牡蛎微生物总数,进而对其生命体征造成影响。但各不同前处理方式下牡蛎体内菌落总数在保活9 d后均未超过上述标准,表明冰温条件下抑制了牡蛎体内腐败微生物的生长繁殖,有利于维持保活期内牡蛎的活力,这与祁剑飞等[18]研究结果相似。
2.3 不同前处理方式对牡蛎生态冰温保活期色泽的影响
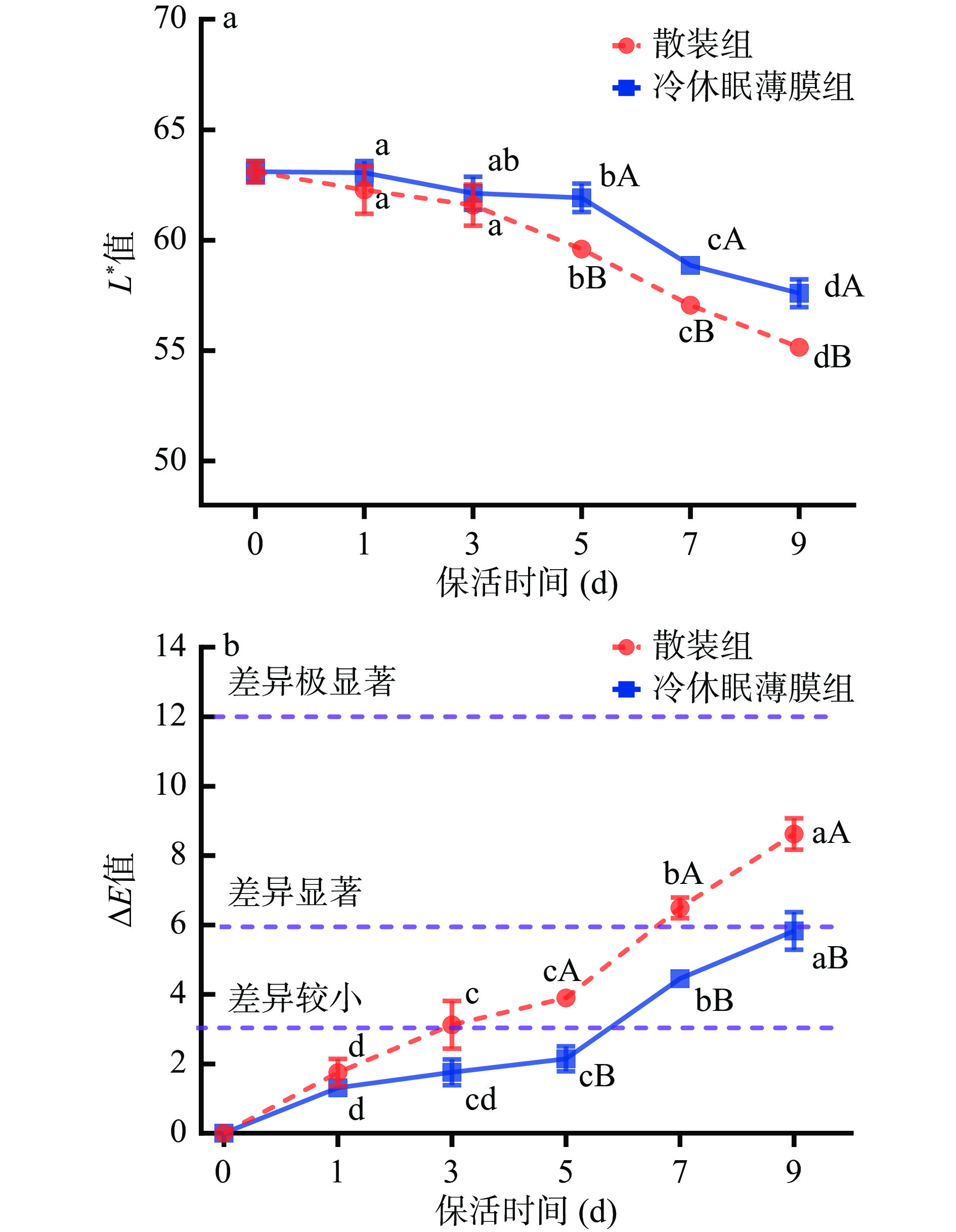
色泽变化是反映牡蛎无水保活过程中品质劣变的关键指标。牡蛎在生长过程中主要以浮游藻类为食,新鲜牡蛎腹部呈亮黄色,在无水保活过程中由于脂肪氧化及体内细菌和酶作用下色素发生降解。由图5可知,随着保活时间的延长,牡蛎腹部肌肉L*值呈下降趋势,∆E值呈上升趋势,说明活蛎在无水保活过程中汁液流失,色泽变暗。保活前3 d牡蛎肉L*值与∆E值变化不显著(P>0.05),保活5~9 d,各保活组牡蛎肌肉L*值、∆E值变化速率均呈显著性差异(P<0.05),且散装组牡蛎色泽变化速率显著快于冷休眠薄膜组(P<0.05)。KACHELE等[19]研究表明,色泽变化程度与体内脂肪氧化呈正相关,不饱和脂肪酸氧化生成的自由基与胺类物质发生反应,产生黄色色素,导致色差值变大。可见,鲜活牡蛎在无包装条件下品质劣变速率较快,远远大于冷休眠薄膜处理引起的色泽变化。CHUNG等[20]研究发现,合浦珠母贝(Pinctada fucata)在低温条件下贮藏,其色泽随着时间的延长而加深。PAN等[6]研究发现,海湾扇贝在无水保活过程中,其色差值随着保活时间的延长而加深,均与本研究结果相似。
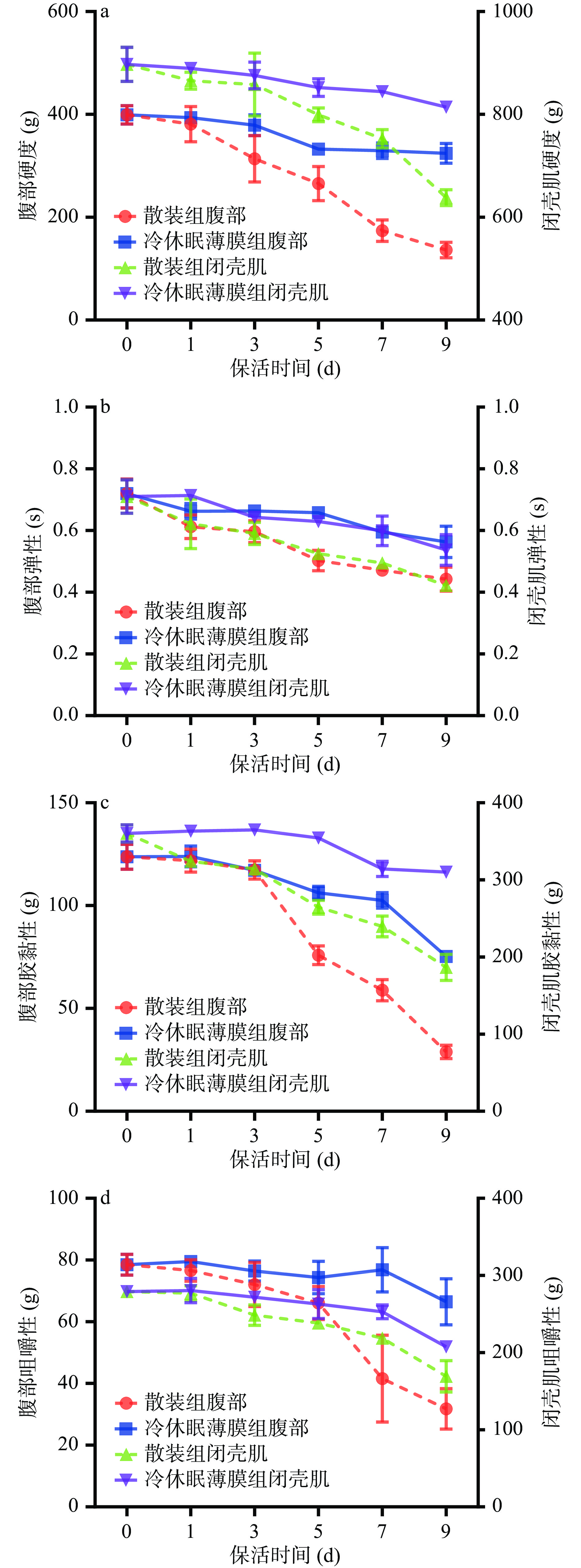
2.4 不同前处理方式对牡蛎生态冰温保活期质构品质的影响
质构剖面分析法通过模拟人口腔的咀嚼动作从而分析食品的质构特性,是反映肌肉品质变化的关键指标之一[21]。太平洋牡蛎无水保活过程中质构特性变化如图6所示,随着保活时间的延长,牡蛎腹部和闭壳肌硬度(图6-a)、弹性(图6-b)、胶黏性(图6-c)、咀嚼性(图6-d)均呈下降趋势。保活0~3 d牡蛎各项质构指标呈缓慢下降趋势,保活5~9 d牡蛎各项质构指标降幅更为明显。结合图4微生物变化趋势分析,由于活蛎体内携带大量可繁殖微生物,在长时、低温、干露保活过程中引起肌肉软化、硬度下降、口感变差[22]。而牡蛎经冷休眠薄膜处理其质构品质优于散装组,这主要是预冷休眠降低了牡蛎生理代谢活动,薄膜包裹能始终让牡蛎保持在休眠状态,减少体内蛋白质损耗及水分流逝,抑制了微生物生长繁殖[15]。可见,采用预冷结合薄膜包裹的前处理方式能有效延缓活品牡蛎长时流通过程中品质发生劣变。ZHANG等[23]研究表明低温条件下长时贮藏对牡蛎肉的质构特性有显著影响,这与本实验结果相符。
2.5 不同前处理方式对牡蛎生态冰温保活期理化代谢指标的影响
保活研究中常用的品质评价方法包括:存活率、质量损失率、微生物、营养成分损耗、生理生化指标等。本团队前期也针对活体太平洋牡蛎无水流通中存活及营养成分消耗进行了研究,发现太平洋牡蛎体内糖原及脂肪在生态冰温保活过程中下降较为明显,保活9 d后分别下降了41.36%、21.32%;水分及粗蛋白含量略有下降,比保活前分别降低了4.37%、5.46%;乳酸含量逐渐上升,是保活前的2.41倍[15]。鉴于采用能量物质代谢变化难以全面反映无水保活过程中在整体品质劣变速率,因此,本研究在经典品质指标的基础上,重点通过生理代谢途径解析活体牡蛎无水保活过程中肌肉品质指标的劣变规律。
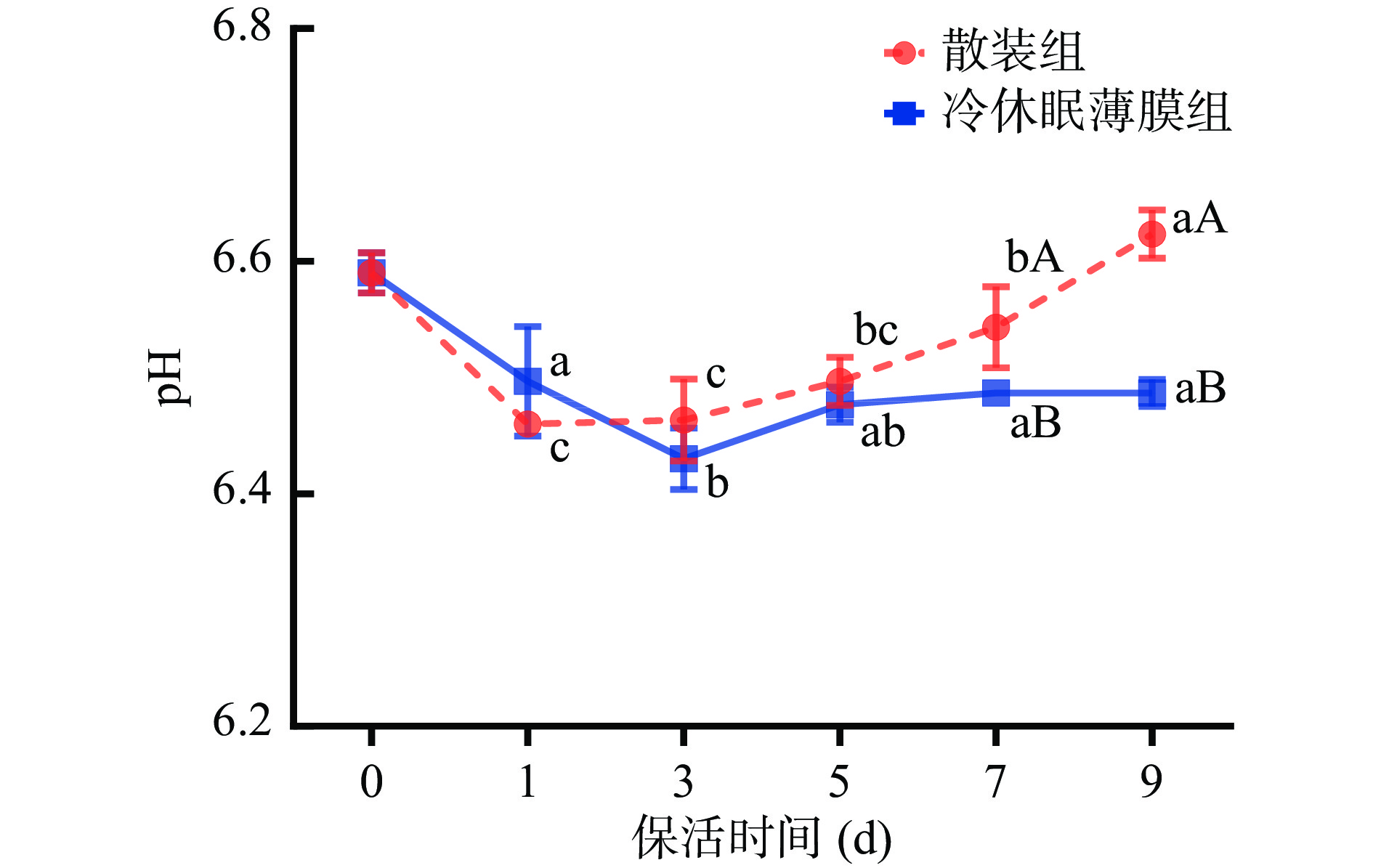
2.5.1 pH
pH是反映活品贝类流通过程中新鲜度的重要指标之一,研究发现活贝pH一般处于6.3~7.5之间[6]。如图7所示,太平洋牡蛎在生态冰温保活期内pH呈先下降后上升趋势。这与刘慧慧等[24]研究无水保活条件下菲律宾蛤仔(Ruditapes philippinarum)pH变化趋势相似。各不同处理组在保活前3 d牡蛎pH呈下降趋势,保活第5 d开始,散装组牡蛎肌肉pH上升速率显著快于冷休眠薄膜组,保活9 d后散装组牡蛎pH显著高于冷休眠薄膜组(P<0.05)。主要原因是牡蛎在长时冰温保活过程中微生物急剧增长以及自溶酶作用下蛋白质降解生成胺类碱性物质[8],因此牡蛎肌肉pH呈上升趋势。另有研究表明,pH变化在0.1~0.2个单位之间表明其鲜度保存良好[25]。可见牡蛎通过冷驯化结合薄膜包裹处理能延缓无水保活期品质劣变速率,达到较好的保活效果。
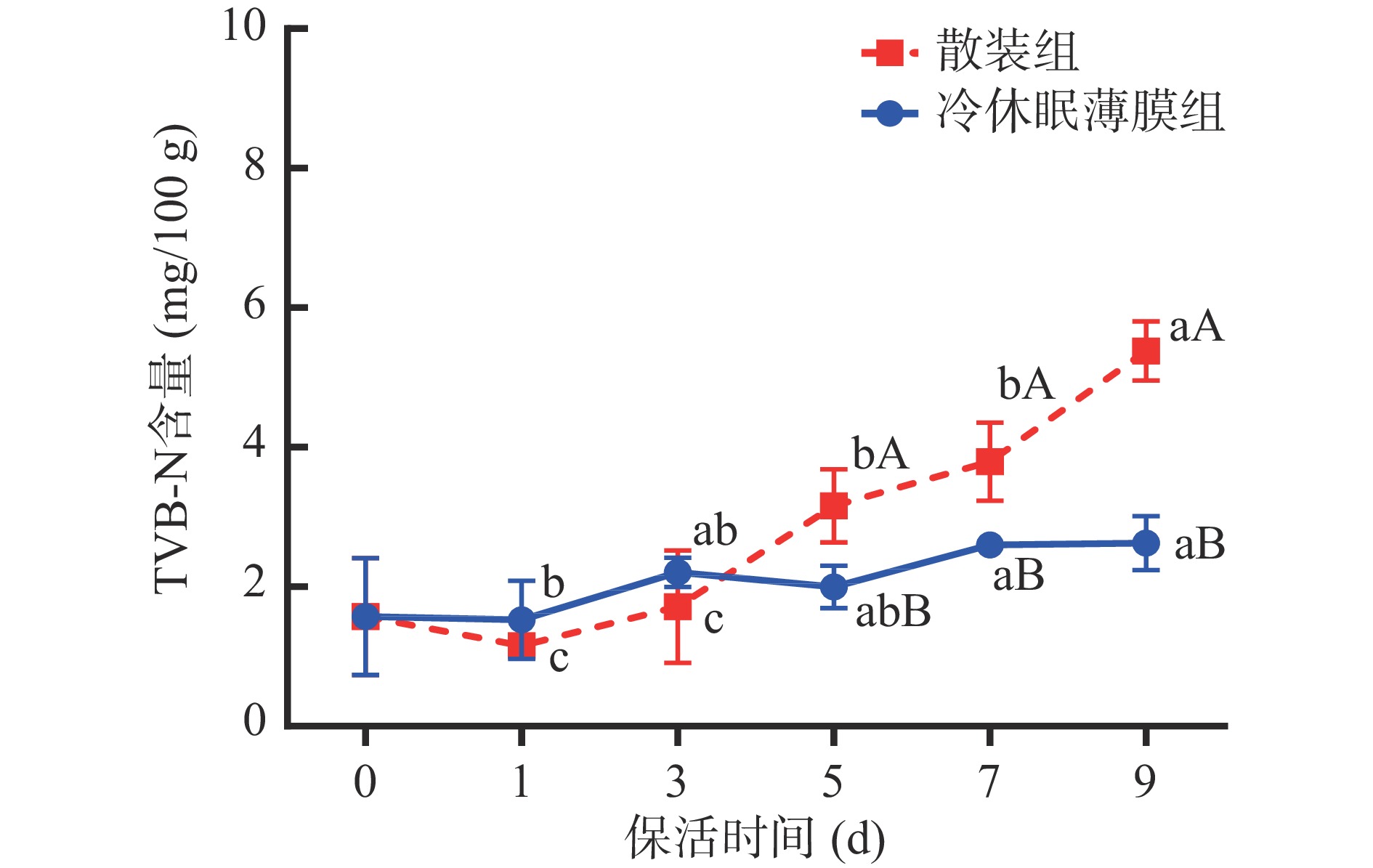
2.5.2 TVB-N
TVB-N广泛用于评价贝类鲜度的重要指标,其与蛋白质和氨基酸等含氮化合物的降解有关[26]。由图8可知,随着保活时间的延长,太平洋牡蛎TVB-N值呈上升趋势。保活前牡蛎TVB-N值为1.58 mg/100 g;保活3 d内各组牡蛎肌肉TVB-N值无显著变化(P>0.05);保活第5 d开始各实验组牡蛎肌肉TVB-N值呈缓慢增长趋势;保活9 d后散装组牡蛎TVB-N值增长至5.37 mg/100 g,显著高于冷休眠薄膜组(P<0.05)。结合图4微生物数值变化分析,牡蛎在保活第5 d开始微生物急剧增长,微生物代谢与酶促反应使牡蛎肌肉中的蛋白质降解生成大量胺类物质,导致牡蛎TVB-N含量急剧升高[27]。但各实验组TVB-N含量均符合食品安全国家标准中对新鲜双壳贝类TVB-N限值(≤15 mg/100 g),可见牡蛎在冰温条件下保活抑制了TVB-N含量增长,两种前处理方式均能保持牡蛎处于鲜活状态,但相比于净化后散装流通方式,采用薄膜包裹对牡蛎组织TVB-N含量抑制效果更为明显。
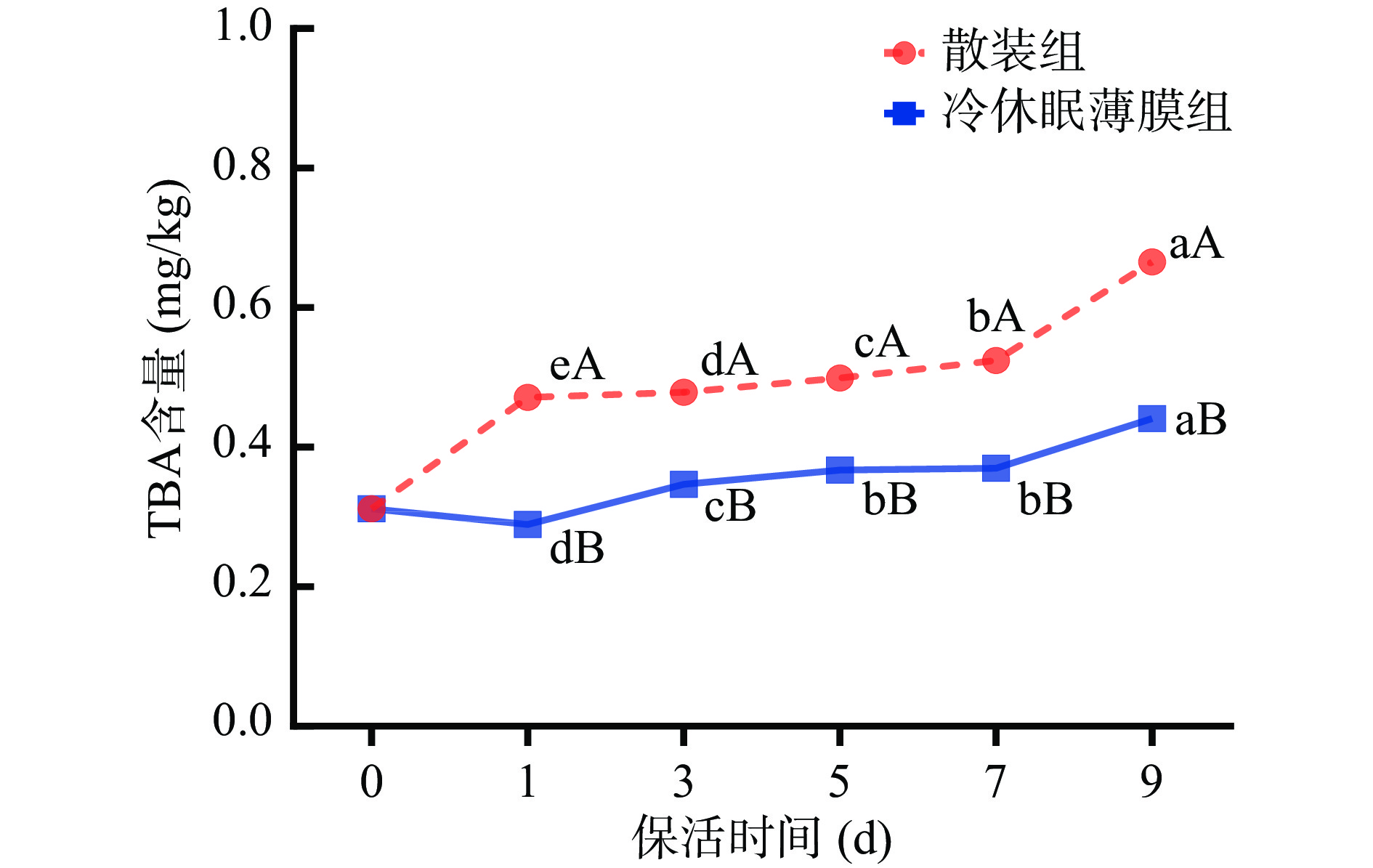
2.5.3 TBA
牡蛎脂肪含量为11.9%,不饱和脂肪酸总量与脂肪酸总量的比值为41.02%~50.79%[28]。因其不饱和脂肪酸含量丰富,极易氧化变质,TBA值可用于反映活体牡蛎脂质氧化情况,是评价牡蛎鲜活状态的重要指标。由图9可知,随着保活时间延长,太平洋牡蛎TBA值总体呈上升趋势,且散装组增长速率显著快于冷休眠薄膜组(P<0.05),保活9 d后散装组与冷休眠薄膜组牡蛎TBA值分别为0.67和0.44 mg/kg。研究表明,TBA值超过1 mg/kg时,肉质就会产生难以接受的气味[29]。可见在冰温保活期内活蛎肉维持在较高的鲜度值。但牡蛎通过冷驯化结合薄膜包裹处理后,保活效果明显优于散装处理。主要原因是未经冷驯化休眠的牡蛎在急性冷应激胁迫下极易造成脂质氧化损伤,生成氢过氧化物,随着胁迫时间的延长脂质氢过氧化物产生醛、酮类小分子物质加剧牡蛎品质发生劣变[30]。张毅等[31]研究发现,牡蛎在冰温条件下贮藏TBA值升高缓慢,与本研究结果相似。
2.5.4 微观组织结构变化
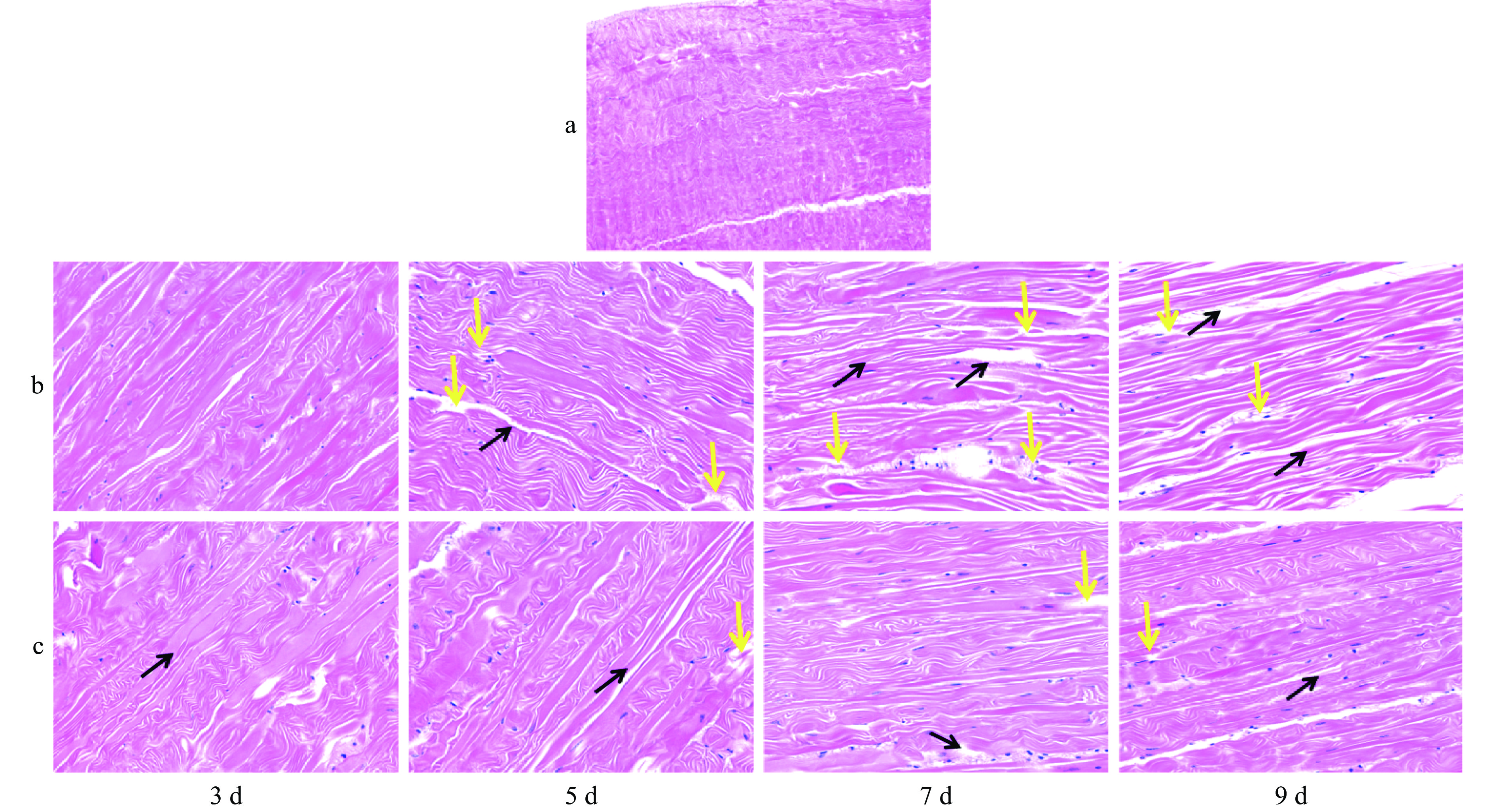
由图10-a可见,保活前太平洋牡蛎闭壳肌细胞纤维大小均排列整齐、紧密结合、均匀分布、肌肉内膜光滑平缓、细胞内无空隙;保活至第3 d,散装组牡蛎闭壳肌细胞内空隙增加;保活9 d后散装组牡蛎肌肉组织纤维细胞空隙明显加剧,肌纤维出现明显断裂,组织发生降解结构被破坏。散装组与冷休眠薄膜组相比,结构破坏更为明显。主要是因为牡蛎在长时冰温胁迫下肌肉组织间易生成冰晶,对肌内细胞产生机械损伤,水分流逝加快,结构蛋白和肌原纤维蛋白被分解,肌肉纤维结构发生劣变[32]。
3. 结论
本研究通过模拟牡蛎产业运输实际,探讨不同前处理方式对太平洋牡蛎生态冰温保活期品质及代谢的影响。结果表明:太平洋牡蛎在生态冰温(0 ℃)条件下保活,能有效延缓保活期内品质劣变速率,但不同保活前处理方式对牡蛎肌肉品质有一定影响;活体牡蛎经低温诱导休眠结合薄膜包裹处理后,在生态冰温条件下保活9 d,其存活率高达95%。相较于净化后散装处理方式,经冷休眠薄膜处理的牡蛎能有效缓解肌肉组织水分流失,同时抑制了菌落总数及大肠菌群的增长繁殖,减缓了肌肉组织色泽、质构品质劣变;延缓pH、TVB-N、TBA值的急剧上升;微观组织结构也同样表明冷休眠薄膜组牡蛎闭壳肌纤维结构更为完整有序,肌纤维组织未出现明显断裂。综上,为减少牡蛎运输损耗及提高整体存活质量,建议实际生产过程中,宜采用冷驯化休眠结合薄膜包裹的保活前处理方法。本研究结果可为鲜活牡蛎保活流通提供技术和理论参考。
-
-
[1] 中华人民共和国农业农村部. 2020中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2021. Ministry Agriculture and Rural Affairs of the People's Republic of China. 2020 China fishery statistical yearbook[M]. Beijing: China Agriculture Publishing House, 2021
[2] 徐美禄, 冷寒冰, 李亚烜, 等. 捕后干藏-复水处理对太平洋牡蛎活品贮藏稳定性的影响[J]. 大连海洋大学学报,2019,34(6):828−833. [XU M L, LENG H B, LI Y X, et al. Influence of air exposure-rehydration post-harvest on stable storage of Pacific oyster Crassostrea gigas[J]. Journal of Dalian Ocean University,2019,34(6):828−833. doi: 10.16535/j.cnki.dlhyxb.2018-294 [3] 胡园, 李敏, 方军, 等. 基于保活和品质变化规律分析缢蛏(Sinonovacula constricta)贮藏过程中的代谢特性[J]. 现代食品科技,2018,34(3):32−38. [HU Y, LI M, FANG J, et al. The metabolic characteristics of razor clams (Sinonovacula constricta) during storage based on the analysis of survival rate and quality change[J]. Modern Food Science and Technology,2018,34(3):32−38. [4] 申淑琦, 万玉美, 申亮, 等. 温度、湿度和氧气对海湾扇贝无水保活的影响[J]. 大连海洋大学学报,2014,29(5):492−497. [SHEN S Q, WAN Y M, SHEN L. Effects of temperature, humidity and oxygen on keeping-alive without water of bay scallop Argopecten irradians[J]. Journal of Dalian Ocean University,2014,29(5):492−497. [5] BARRENTO S, POWELL A. The effect of transportation and re-watering strategies on the survival, physiology and batch weight of the blue mussel, Mytilus edulis[J]. Aquaculture,2016,450:194−198. doi: 10.1016/j.aquaculture.2015.07.021
[6] PAN L, LIN C, ZhANG G, et al. Effects of purification, temporary rearing and low temperature waterless-keeping alive-transportation on quality characteristics of live Patinopecten yessoensis[J]. Transactions of the Chinese Society of Agricultural Engineering,2017,33(19):301−307.
[7] FAN X, QIN X, ZHANG C, et al. Metabolic and anti-oxidative stress responses to low temperatures during the waterless preservation of the hybrid grouper (Epinephelus fuscogutatus♀×Epinephelus lanceolatus♂)[J]. Aquaculture,2019,508:10−18. doi: 10.1016/j.aquaculture.2019.04.054
[8] 高加龙, 章超桦, 秦小明, 等. 不同温度无水保活对香港牡蛎微生物和基本营养成分的影响[J]. 广东海洋大学学报,2020,40(5):90−96. [GAO J L, ZHANG C H, QIN X M, et al. Effects of different temperatures waterless keep alive on total number of bacteria and coliform group, and basic nutritional compositions in Crassostrea hongkongensis[J]. Journal of Guangdong Ocean University,2020,40(5):90−96. doi: 10.3969/j.issn.1673-9159.2020.05.011 [9] ABDUL KHALIL H P S, BANERJEE A, SAURABH C K, et al. Biodegradable films for fruits and vegetables packaging application: preparation and properties[J]. Food Engineering Reviews,2018,10(3):139−153. doi: 10.1007/s12393-018-9180-3
[10] 郝爽, 张敏. 不同冷胁迫方式对缢蛏无水保活期抗氧化酶活性及脂质过氧化的影响[J]. 大连海洋大学学报,2020,35(4):584−590. [HAO S, ZHANG M. Effects of different cold stress methods on antioxidant enzyme activity and lipid peroxidation of zazor clam Sinonovacula constricta during keeping alive under air exposure[J]. Journal of Dalian Ocean University,2020,35(4):584−590. doi: 10.16535/j.cnki.dlhyxb.2019-134 [11] 牛改改, 秦成丰, 游刚, 等. 解冻方式对近江牡蛎肉感官特征和理化指标的影响[J]. 食品工业科技,2020,41(16):271−278. [NIU G G, QIN C F, YOU G, et al. Effects of thawing methods on sensory characteristics and physicochemical indices of oyster (Ostrea rivularis Gould ) meat[J]. Science and Technology of Food Industry,2020,41(16):271−278. doi: 10.13386/j.issn1002-0306.2020.16.043 [12] 郭迅, 曾名湧, 董士远. 牡蛎蒸煮过程中的品质变化[J]. 食品科学,2021,42(5):24−31. [GUO X, ZENG M Y, DONG S Y. Quality changes of oysters during steaming[J]. Food Science,2021,42(5):24−31. doi: 10.7506/spkx1002-6630-20200229-333 [13] FAUSTMAN C, SPECHT S M, MALKUS L A, et al. Pigment oxidation in ground veal: Influence of lipid oxidation, iron and zinc[J]. Meat Science,1992,31(3):351−362. doi: 10.1016/0309-1740(92)90064-B
[14] CHEN X, LYU M, GAN H, et al. Impact of chitosan-based coatings on myofibrillar protein denaturation, muscle microstructure and lipid oxidation of oyster (Crassostrea hongkongensis) during 0 ℃ storage[J]. Journal of Aquatic Food Product Technology,2020,29(10):1001−1012. doi: 10.1080/10498850.2020.1828525
[15] 林恒宗, 高加龙, 梁志源, 等. 冷胁迫方式对太平洋牡蛎无水保活期氧化应激及能量消耗的影响[J]. 广东海洋大学学报,2022,42(2):95−103. [LIN H Z, GAO J L, LIANG Z Y, et al. Effect of cold stress methods on antioxidant and energy metabolism of Crassostrea gigas in water-free live storage period[J]. Journal of Guangdong Ocean University,2022,42(2):95−103. doi: 10.3969/j.issn.1673-9159.2022.02.012 [16] 周晏琳, 刘洋, 李亚烜, 等. 虾夷扇贝抗氧化酶SOD和CAT与活品贮藏稳定性的关联[J]. 食品工业科技,2020,41(6):254−258, 271. [ZHOU Y L, LIU Y, LI Y X, et al. Correlation of antioxidant enzyme SOD and CAT to live storage stability of Yesso scallop (Patinopecten yessoensis)[J]. Science and Technology of Food Industry,2020,41(6):254−258, 271. doi: 10.13386/j.issn1002-0306.2020.06.043 [17] 江艳华, 姚琳, 朱文嘉, 等. 国内外水产品微生物限量标准的比对分析[J]. 中国渔业质量与标准,2015,5(4):6−16. [JIANG Y H, YAO L, ZHU W J. et al. Comparison and analysis of microbiological limit for aquatic products at home and abroad[J]. Chinese Fishery Quality and Standards,2015,5(4):6−16. [18] 祁剑飞, 曾志南, 宁岳, 等. 葡萄牙牡蛎的净化及其低温贮藏研究[J]. 渔业现代化,2016,43(5):36−41. [QI J F, ZENG Z N, NING Y, et al. Depuration and low-temperature storage of portuguese oyster (Crassostrea angulata)[J]. Fisheries Modernization,2016,43(5):36−41. doi: 10.3969/j.issn.1007-9580.2016.05.007 [19] KACHELE R, ZHANG M, GAO Z, et al. Effect of vacuum packaging on the shelf-life of silver carp (Hypophthalmichthys molitrix) fillets stored at 4 ℃[J]. LWT,2017,80:163−168. doi: 10.1016/j.lwt.2017.02.012
[20] CHUNG W H, HOWIESON J, CHAKLADER M D R. The ameliorative effects of low-temperature pasteurization on physicochemical and microbiological quality of raw Akoya pearl oyster (Pinctada fucata)[J]. Food Control,2021,129:108241. doi: 10.1016/j.foodcont.2021.108241
[21] YAN W, ZHANG Y, YANG R, et al. Combined effect of slightly acidic electrolyzed water and ascorbic acid to improve quality of whole chilled freshwater prawn (Macrobrachium rosenbergii)[J]. Food Control,2020,108:106820. doi: 10.1016/j.foodcont.2019.106820
[22] XIE J, WANG Z, WANG S, et al. Textural and quality changes of hairtail fillets (Trichiurus haumela) related with water distribution during simulated cold chain logistics[J]. Food Science and Technology International,2020,26(4):291−299. doi: 10.1177/1082013219888306
[23] ZHANG J, WALTON W C, WANG Y. Quantitative quality evaluation of Eastern oyster (Crassostrea virginica) cultured by two different methods[J]. Aquaculture Research,2017,48(6):2934−2944. doi: 10.1111/are.13126
[24] 刘慧慧, 周晏琳, 张晴, 等. 菲律宾蛤仔捕后干露处置对其复水湿藏稳定性的影响[J]. 大连海洋大学学报,2018,33(2):244−250. [LIU H H, ZHOU Y L, ZHANG Q, et al. Effect of air exposure on biochemical metabolism of harvested Manila clam Ruditapes philippinarum during live wet storage[J]. Journal of Dalian Ocean University,2018,33(2):244−250. doi: 10.16535/j.cnki.dlhyxb.2018.02.017 [25] 李来好, 彭城宇, 岑剑伟, 等. 冰温气调贮藏对罗非鱼片品质的影响[J]. 食品科学,2009,30(24):439−443. [LI L H, PENG C Y, CEN J W, et al. Effect of ice-temperature controlled atmosphere storage on quality of tilapia fillets[J]. Food Science,2009,30(24):439−443. doi: 10.3321/j.issn:1002-6630.2009.24.101 [26] MIAO L, WALTON W C, WANG L, et al. Characterization of polylactic acids-polyhydroxybutyrate based packaging film with fennel oil, and its application on oysters[J]. Food Packaging and Shelf Life,2019,22:100388. doi: 10.1016/j.fpsl.2019.100388
[27] WANG R, HU X, AGYEKUMWAA A K, et al. Synergistic effect of kojic acid and tea polyphenols on bacterial inhibition and quality maintenance of refrigerated sea bass (Lateolabrax japonicus) fillets[J]. LWT,2021,137:110452. doi: 10.1016/j.lwt.2020.110452
[28] 王允茹, 蔡秋杏, 张晨晓, 等. 北部湾海区几种常见牡蛎基础营养及脂肪酸成分比较分析[J]. 食品安全质量检测学报,2021,12(7):2849−2854. [WANG Y R, CAI Q X, ZHANG C X, et al. Comparative analysis of basic nutrition and fatty acid composition of several common oysters in Beibugulf[J]. Journal of Food Safety Quality,2021,12(7):2849−2854. doi: 10.19812/j.cnki.jfsq11-5956/ts.2021.07.052 [29] SONNA L A, FUJITA J, GAFFIN S L, et al. Invited review: Effects of heat and cold stress on mammalian gene expression[J]. Journal of Applied Physiology,2002,92(4):1725−1742. doi: 10.1152/japplphysiol.01143.2001
[30] MOOSAYA-NASAB M, OLIYAEI N. Physicochemical evaluation of sausages prepared by lantern fish (Benthosema pterotum) protein isolate[J]. Food Science & Nutrition,2018,6(3):617−626.
[31] 张毅, 万金庆, 杨帆, 等. 低盐冰温脱水牡蛎的贮藏性[J]. 食品与发酵工业,2020,46(19):136−142. [ZHANG Y, WAN J Q, YANG F, et al. Storage properties of low salt-controlled freezing-point dehydration oyster[J]. Food and Fermentation Industries,2020,46(19):136−142. doi: 10.13995/j.cnki.11-1802/ts.024456 [32] 梁钻好, 陈海强, 梁凤雪, 等. 液浸速冻对牡蛎水分迁移及品质的影响[J]. 食品科学,2019,40(23):233−238. [LIANG Z H, CHEN H Q, LIANG F X, et al. Impact of immersion freezing on oyster quality and water migration[J]. Food Science,2019,40(23):233−238. doi: 10.7506/spkx1002-6630-20181101-016





 下载:
下载:


 下载:
下载:
