Optimization of Extraction Process of Flavonoids from Aronia melanocarpas' Leaves and Analysis of Their Antioxidant and Bile Salt Binding Capacity
-
摘要: 以超声波辅助法提取黑果腺肋花楸叶黄酮(Flavonoids from Aronia melanocarpas' leaves,AMF),探究其体外抗氧化活性和胆酸盐结合能力。以黄酮得率为指标,在单因素(液料比、乙醇浓度、超声功率、超声时间)的基础上,结合响应面法,优化AMF的提取工艺,并以DPPH·、ABTS+·清除率及总还原能力为指标,考察AMF的抗氧化活性;以胆酸钠、牛黄胆酸钠、甘氨胆酸钠为结合对象,考察AMF的胆酸盐结合能力。结果表明,AMF的最优提取工艺为:液料比61:1 mL/g、乙醇浓度60%、超声功率100 W、超声时间59 min,黄酮得率为24.22%±0.29%,与模型预测值(24.27%)接近。最优工艺制备的AMF对DPPH·、ABTS+·清除率较强,其IC50值分别为0.32、0.16 mg/mL;质量浓度为0.5 mg/mL时,总还原能力较好,其吸光值为1.09;AMF对胆酸钠、牛黄胆酸钠、甘氨胆酸钠具有较强结合能力,结合率的IC50值分别为0.76、3.01、6.49 mg/mL。综上,AMF有较强的抗氧化和胆酸盐结合能力。本研究可为AMF进一步开发天然抗氧化剂和降血脂药物提供依据。Abstract: In this study, the antioxidant and bile salt binding activities of flavonoids from Aronia melanocarpas' leaves (AMF) by ultrasound-assisted extraction. Based on single factors (liquid-solid ratio, ethanol concentration, ultrasonic power and ultrasonic time) and response surface method, the extraction process of AMF was optimized with flavonoid yield as the index. The antioxidant activity of AMF was evaluated by DPPH·, ABTS+· scavenging rate and reduction power. The bile salt binding ability of AMF was investigated by using sodium cholate, sodium taurocholate and sodium glycocholate as binding objects. The results showed that the optimal extraction conditions were as follows: The liquid-solid ratio of 61:1 mL/g, the ethanol concentration of 60%, the ultrasonic power of 100 W, and the ultrasonic time of 59 min. Under the optimized conditions, the yield of flavonoids was 24.22%±0.29%, which approximated the predicted value (24.27%). The IC50 of DPPH and ABTS+ radicals scavenging capacities of AMF were 0.32 and 0.16 mg/mL, respectively. The AMF demonstrated the strongest reducing power with an absorbance value of 1.09 at the sample concentration of 0.5 mg/mL. The IC50 of AMF for the binding rate of sodium cholate, sodium taurocholate and sodium glycocholate were 0.76, 3.01 and 6.49 mg/mL, respectively. In summary, AMF exhibited strong antioxidant and bile salt binding capacity. This study could provide a basis for AMF to further develop natural antioxidants and hypolipidemic drugs.
-
随着生活质量提高和饮食结构改变,高血脂症已成为人体的易患病,症状的形成与氧化应激密切相关。该症一般采用药物治疗,结合胆酸盐能力可反映药物对高血脂症的治疗效果[1]。化学合成药物价格昂贵、毒副作用大,故亟需开发天然、低毒性且耐受性强的抗氧化剂、降血脂药物[2]。黑果腺肋花楸(Aronia melanocarpa),蔷薇科,腺肋花楸属,多年生落叶灌木,又称不老莓、野樱莓,是具有食用、药用、园林、生态价值等的经济树种[3]。其果实和叶均含有多酚[4]、黄酮[5]、多糖等多种活性物质,具有提高记忆力、抗癌、抗氧化及抗菌等功效[5-9],两者有较好的食用和药用价值。叶片与果实存在共有的生物活性物质,且叶片的黄酮和多酚含量更高[4-5],故叶片具有一定的降血脂潜力,可作为开发新型药物的天然植物资源。
目前,大量研究表明植物中的黄酮类物质能够安全有效地控制高血脂症,如金银花[10]、南非叶[11]的总黄酮提取物均能改善高脂诱导小鼠肝脏的氧化应激水平,维持血液中正常脂质水平。关于黑果腺肋花楸叶片的研究报道仅有多糖提取工艺和抗氧化活性,而黄酮工艺优化和降血脂功能的研究鲜有报道,Do等[12]通过测定黑果腺肋花楸叶片在生长阶段中多酚和类黄酮含量的变化,以此评价不同阶段的抗氧化能力,表明黑果腺肋花楸叶片具有一定的抗氧化活性;Zdunić等[13]通过研究黑果腺肋花楸叶片的生物活性成分,发现叶片具有一定的抗氧化能力。因此,研究黑果腺肋花楸叶黄酮的最优提取工艺,并测定其抗氧化、结合胆酸盐能力,有助于推动黑果腺肋花楸叶生物活性领域的研究。
本文通过单因素结合响应面法,优化超声波辅助法提取AMF的工艺参数,以DPPH·、ABTS+·的清除率和总还原能力为指标,考察AMF的抗氧化活性;以胆酸钠、牛黄胆酸钠、甘氨酸钠为指标,考察AMF的结合胆酸盐能力,以期为AMF开发天然的抗氧化剂和降血脂药物提供依据,对其生物活性领域的发展具有重要意义。
1. 材料与方法
1.1 材料与仪器
黑果腺肋花楸的干燥叶片 辽宁省瓦房店市驼山镇前大地村提供;芦丁标准品 HPLC≥98%,上海源叶科技有限公司;牛黄胆酸钠 分析纯,上海源叶科技有限公司;DPPH(>97.0%)、ABTS(>98.0%) 分析纯,合肥博美生物科技有限责任公司;胆酸钠、甘氨酸钠 分析纯,上海麦克林生化科技有限公司;硫酸 分析纯,云南杨林工业开发区汕滇药业有限公司;铁氰化钾、磷酸盐缓冲液、三氯乙酸、六水合三氯化铁、抗坏血酸、亚硝酸钠、氢氧化钠、硝酸铝、无水乙醇 分析纯,天津市风船化学试剂科技有限公司。
UV-2600紫外可见分光光度计 日本岛津仪器公司;YB-250A型高速多功能粉碎机 永康市速峰工贸有限公司;SHZ-DⅢ循环水式多用真空泵 上海力辰邦西仪器科技有限公司;SB25-12DTDS超声波清洗机 宁波新艺超声设备有限公司;Sigma3K15离心机 德国西格玛离心机有限公司;HB 10 S96旋转蒸发仪 艾卡仪器设备有限公司;DK-98-Ⅱ电热恒温水浴锅 天津市泰斯特仪器有限公司;DHG-9240A电热恒温鼓风干燥机 上海齐欣科学仪器有限公司;SpectraMax190酶标仪 美谷分子仪器有限公司。
1.2 实验方法
1.2.1 AMF的提取工艺
将黑果腺肋花楸叶置于45 ℃烘箱24 h后,粉碎,过80目筛,储藏于4 ℃冰箱备用。精确称量500.0 mg黑果腺肋花楸叶粉末于不同体积的乙醇溶液中,按设定参数进行超声,超声后真空抽滤,将滤液以相应提取溶剂定容至50 mL,得AMF粗提液。
1.2.2 黄酮含量的测定
参照刘佳等[14]的方法稍做改动,绘制芦丁标准曲线。配制浓度为0.05 mg/mL芦丁标准品母液,芦丁质量浓度(x)和吸光值(y)的线性回归方程为y=0.01167+7.53571x,R2=0.999。取1.2.1制备的黄酮粗提液1 mL稀释15倍,取1 mL样液于25 mL容量瓶,按标曲的绘制方法加入相应的溶剂显色后,于510 nm测定吸光值。将吸光值代入标准曲线计算样液中黄酮浓度,按照公式计算黄酮得率。
(1) 式中:c为黄酮浓度,mg/mL;n为稀释倍数;v为待测液体积,mL;M为黑果腺肋花楸叶粉末质量,mg。
1.2.3 AMF提取单因素实验
以液料比60:1 mL/g、乙醇浓度为70%、超声功率为80 W、超声时间为60 min、温度45 ℃为基本条件,分别考察液料比(40:1、50:1、60:1、70:1、80:1 mL/g)、乙醇浓度(40%、50%、60%、70%、80%)、超声功率(60、80、100、120、140 W)、超声时间(20、40、60、80、100 min)对提取AMF得率的影响。
1.2.4 AMF提取响应面优化实验
基于单因素实验结果,选取液料比、乙醇浓度、超声功率、超声时间为响应因素,AMF得率为响应值,利用Box-Behnken实验原理设计四因素三水平的优化实验。因素及水平编码如表1。
表 1 响应面实验因素水平设计Table 1. Factors and Levels of response surface methodology水平 因素 A液料比(mL/g) B乙醇浓度(%) C超声功率(W) D超声时间(min) −1 50 50 80 40 0 60 60 100 60 +1 70 70 120 80 1.2.5 AMF抗氧化及降血脂活性研究
将黑果腺肋花楸叶经最优工艺提取,减压浓缩得黄酮粗提物,分别测定AMF粗提物的抗氧化、降血脂活性。
1.2.5.1 DPPH·清除能力的测定
参考Li等[15]的方法适当调整,各取2 mL不同浓度样液与0.05 mg/mL DPPH-无水乙醇溶液,37 ℃孵育30 min,在517 nm处测定吸光值Ap。用60%乙醇溶液代替样液测定吸光值Aq,用无水乙醇代替DPPH-无水乙醇溶液测定吸光值Aw。按以下公式计算AMF对DPPH·清除率:
(2) 式中:Ap为样品组的吸光值;Aw为样品控制组的吸光值;Aq为空白组的吸光值。
1.2.5.2 ABTS+·清除能力的测定
参考Feng等[16]的方法适当调整,将7 mmol/L ABTS·与5 mmol/L过硫酸钾溶液等体积混合,静置反应12 h,得ABTS+·反应液。用蒸馏水稀释ABTS+·反应液吸光值至0.700(±0.02),现用现配。取200 μL不同浓度的样液与3.8 mL ABTS+·反应液,暗反应6 min,在734 nm测定吸光值Ap。用60%乙醇溶液代替样液测定吸光值Aq,用蒸馏水代替ABTS+·溶液测定吸光值Aw。按以下公式计算AMF对ABTS+·清除率:
(3) 式中:Ap为样品组的吸光值;Aw为样品控制组的吸光值;Aq为空白组的吸光值。
1.2.5.3 总还原能力的测定
参照Liu等[17]的方法适当调整,采用铁氰化钾还原法,各取不同浓度的样液、pH=6.6磷酸缓冲液、1%铁氰化钾1 mL均匀混合于50 ℃的水浴中20 min,加入10%三氯乙酸溶液1 mL,混匀后离心(4000 r/min)10 min。分别取1 mL上清液、蒸馏水和0.1%三氯化铁,均匀混合静置10 min,700 nm处测定吸光值。还原力的大小用样品的吸光值表示。
1.2.5.4 结合胆酸盐能力的测定
参照芦宇等[18]的方法适当调整,各取1 mL不同浓度的样液,加入4 mL 0.3 mmol/L胆酸盐溶液(pH为6.3的胆酸钠、牛黄胆酸钠、甘氨胆酸钠溶液),在37 ℃、120 r/min的恒温振荡器振荡1 h后,离心(5000 r/min)5 min,取1 mL上清液加入3 mL 60%的硫酸溶液,于70 ℃水浴20 min,再冰浴5 min,387 nm处测定吸光度Ap。用60%乙醇溶液代替样液测定吸光值Aq,用pH=6.3磷酸盐缓冲液代替胆酸盐溶液测定吸光值Aw。按以下公式计算AMF对胆酸盐的结合率:
(4) 式中:Ap为样品组的吸光值;Aw为样品控制组的吸光值;Aq为空白组的吸光值。
1.3 数据处理
上述实验,均平行实验三次,以平均值±标准偏差为结果。采用Design-Expert.V8.0.6.1软件进行响应面实验设计;用SPSS20.0软件进行数据分析;用GraphPad Prism 8软件对数据进行绘图。
2. 结果与分析
2.1 单因素实验
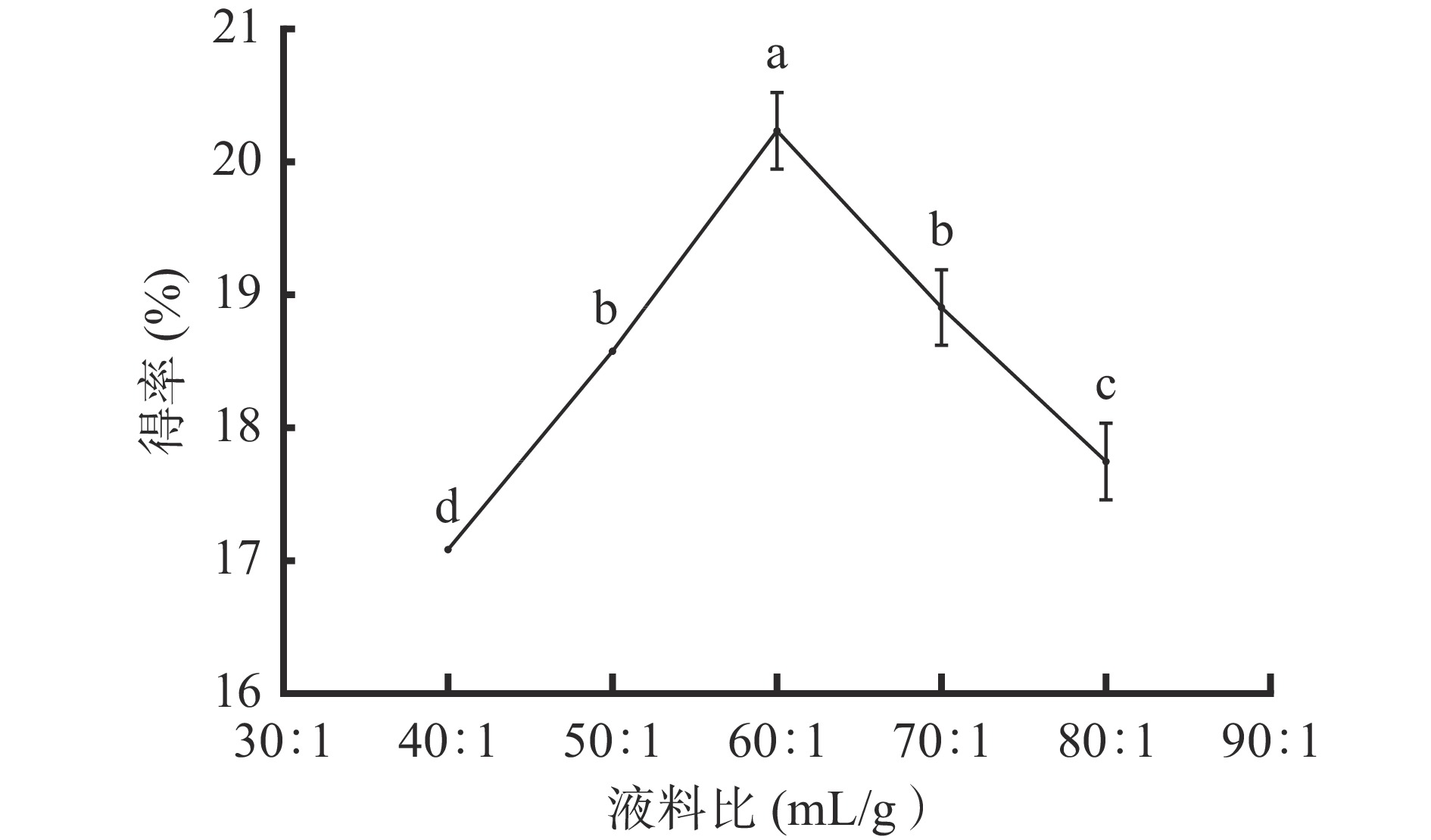
2.1.1 液料比对AMF得率的影响
图1可知,液料比为40:1~60:1 mL/g范围内,黄酮得率随液料比增大呈显著(P<0.05)上升趋势,在液料比为60:1 mL/g时,黄酮得率达到最大值,为20.24%;当液料比大于60:1 mL/g时,黄酮得率呈显著(P<0.05)下降趋势。其原因为液料比过小,黑果腺肋花楸叶未被溶剂完全浸没,不利于黄酮充分溶出;当液料比为60:1 mL/g时,黑果腺肋花楸叶被充分浸没,其黄酮成分已充分溶出;继续增大液料比,黑果腺肋花楸叶中的其他醇溶成分溶出,使黄酮在提取剂中溶解量减小,导致黄酮得率下降[19]。因此,选择液料比为50:1、60:1、70:1 mL/g进行响应面实验。
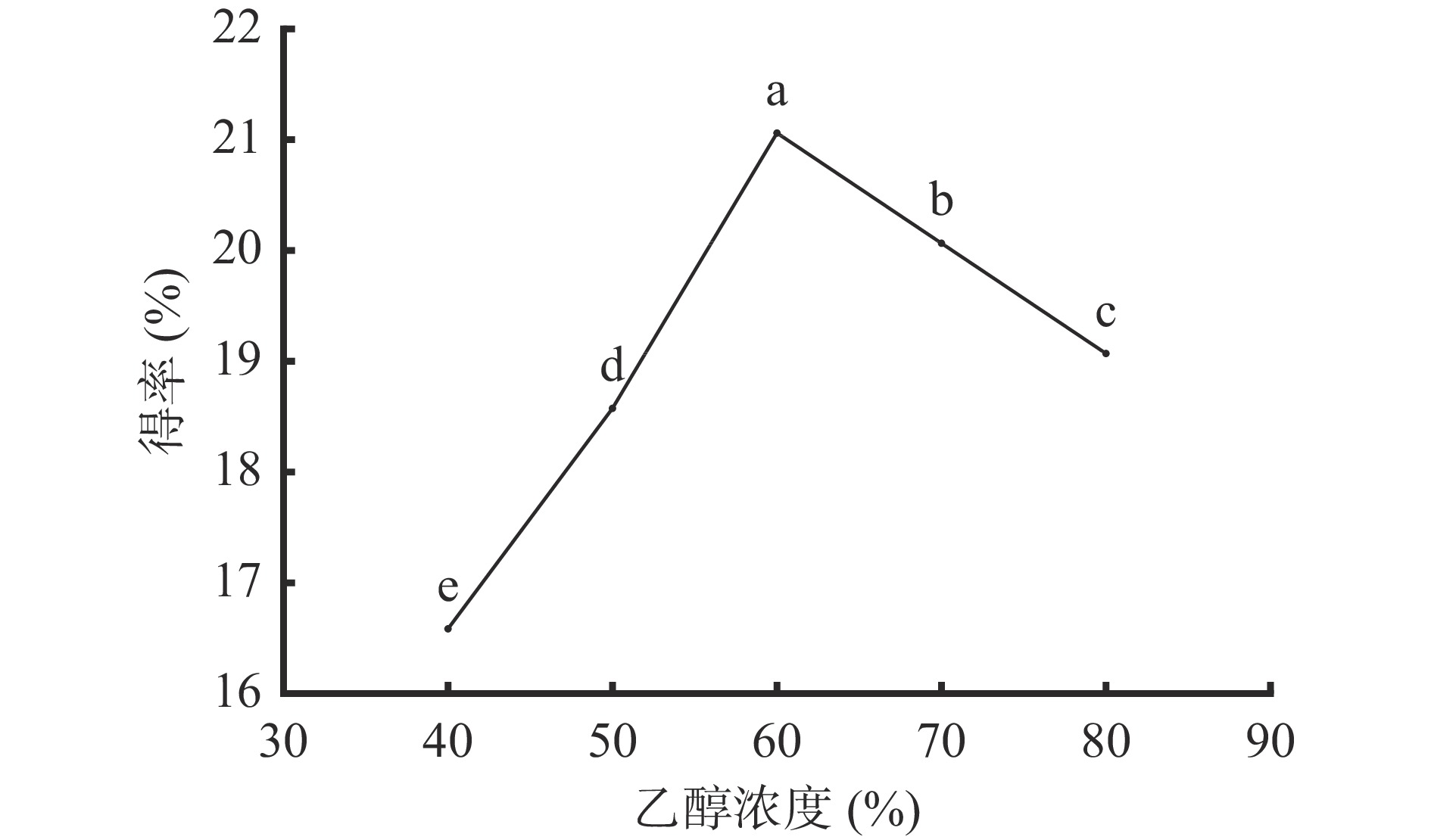
2.1.2 乙醇浓度对AMF得率的影响
图2可知,乙醇浓度为40%~60%范围内,乙醇浓度越大越有利于黑果腺肋花楸叶中黄酮成分溶出,黄酮得率与乙醇浓度呈正相关;乙醇浓度为60%时,黄酮成分基本溶出,得率达到最大值,为21.06%;但继续增大乙醇浓度,黄酮得率呈显著(P<0.05)下降趋势。其原因是细胞内外的浓度差与乙醇浓度相关,乙醇浓度过高易使其他醇溶性物质溶出,阻碍黄酮成分溶出[20],黄酮得率降低。因此,选择50%、60%、70%进行响应面实验。
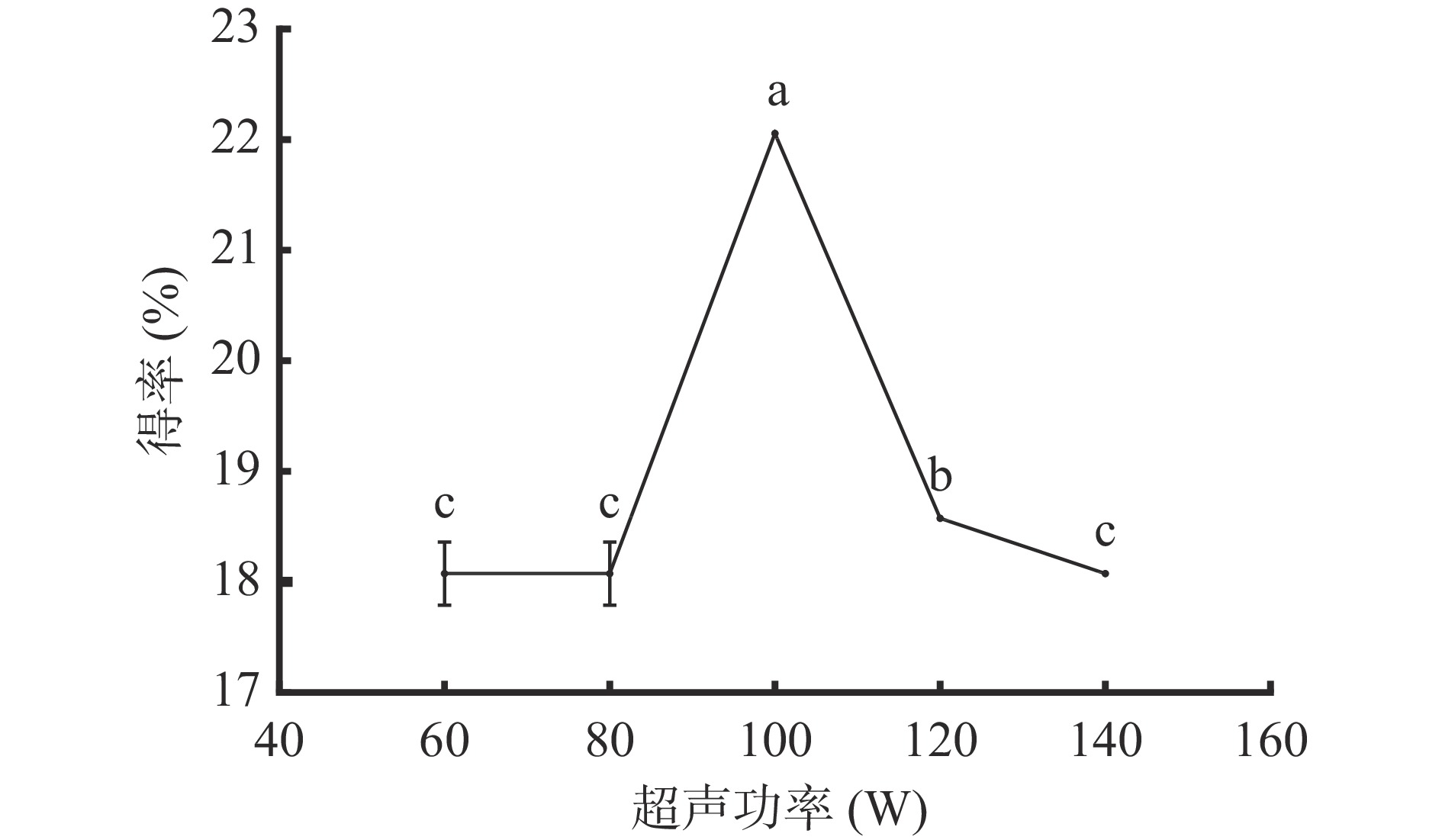
2.1.3 超声功率对AMF得率的影响
图3可知,超声功率为60 W与超声功率为80 W对黄酮得率无显著影响,当超声功率为100 W时,黄酮得率达到最大值,为22.06%;继续加大功率,黄酮得率呈显著(P<0.05)下降趋势。其原因是超声功率低产生的机械及空化效应对细胞壁的破坏程度小,不利于黄酮成分溶出;增大超声功率能增强对细胞壁的破坏作用,但过大的超声功率,产生的强大机械振动会使提取剂流动加快,导致超声波的停留时间减少,并且空化作用增强后产生的大量无用空化泡会增加超声波的散射衰减,黄酮得率降低[21]。因此,选择80、100、120 W进行响应面实验。
2.1.4 超声时间对AMF得率的影响
由图4可知,超声时间在20~60 min范围内,黄酮得率呈显著(P<0.05)上升趋势,当超声时间为60 min时,黄酮得率有最大值,为19.41%;延长超声时间至100 min时,黄酮得率呈显著(P<0.05)的下降趋势。其原因是超声时间过短,黑果腺肋花楸叶中的黄酮不能充分溶出,但超声时间过长,超声波的空化效应、机械效应以及热效应会导致黄酮空间构型被改变,且其他醇溶性成分的溶出量增大,黄酮得率下降[22,23]。因此,选择40、60、80 min进行响应面实验。
2.2 响应面优化结果与分析
2.2.1 响应面优化设计及结果
在单因素实验结果基础上,选液料比(A)、乙醇浓度(B)、超声功率(C)、超声时间(D)为响应设计变量,AMF得率为响应值,用Design-Expert 8.0设计实验,优化AMF提取工艺。表2为响应面实验设计及结果。
表 2 响应面实验设计及结果Table 2. Design and results of response surface experiment实验号 A B C D 黄酮得率(%) 1 0 −1 −1 0 17.25 2 0 1 0 −1 18.25 3 0 1 1 0 18.33 4 0 0 1 −1 18.91 5 1 0 0 −1 19.57 6 −1 0 −1 0 16.75 7 −1 0 0 −1 17.91 8 1 0 0 1 18.58 9 0 0 −1 −1 19.41 10 0 −1 0 1 19.82 11 1 0 −1 0 21.23 12 0 1 0 1 17.75 13 1 0 1 0 16.59 14 0 −1 1 0 16.92 15 0 1 −1 0 17.83 16 0 −1 0 −1 19.57 17 −1 1 0 0 19.07 18 1 1 0 0 18.00 19 −1 0 1 0 17.08 20 −1 −1 0 0 17.42 21 0 0 1 1 17.58 22 0 0 0 0 24.54 23 −1 0 0 1 18.08 24 0 0 −1 1 19.57 25 0 0 0 0 24.05 26 0 0 0 0 24.30 27 0 0 0 0 23.55 28 0 0 0 0 24.55 29 1 −1 0 0 19.16 2.2.2 响应面方差分析
上述实验结果通过多元回归方程拟合,得液料比、乙醇浓度、超声功率、超声时间为影响因子的多元二次方程为Y=24.20+0.57A−0.083B−0.55C−0.19D−0.73AB−1.24AC−0.29AD+0.21BC−0.19BD−0.37CD−3.02A2−3.03B2−3.28C2−2.34D2。由表3可知,模型F=16.43,P<0.0001,模型差异性极显著,表明方程与实际情况拟合良好,反应黄酮得率与各因素之间的关系。失拟项P=0.0610>0.05,表明非实验因素对实验结果影响较小,该模型和方程可用于优化AMF提取工艺。决定系数R2=0.9426,该值越接近1,表明实验实测值与模型预测值之间的相关性越高[24]。CV(变异系数)=4.34%<10%,精密度为12.519>4,表明模型可靠。分析F值和P值可知各工艺因素对响应值的显著差异,F值越大,影响作用越明显,P值越小,越显著[25]。一次项A、C,交互项AC对黄酮得率差异显著(P<0.05);二次项A2、B2、C2、D2对黄酮得率差异极显著(P<0.01),影响AMF得率的因素顺序为:A(液料比)>C(超声功率)>D(超声时间)>B(乙醇浓度)。
表 3 响应面拟合回归方程的方差分析结果Table 3. Variance analysis results of response surface fitting regression equation来源 平方和 自由度 均方 F值 P值 显著性 模型 162.57 1 11.61 16.43 <0.0001 ** A 3.95 1 3.95 5.59 0.0331 * B 0.083 1 0.083 0.12 0.7376 C 3.67 1 3.67 5.19 0.0389 * D 0.42 1 0.42 0.59 0.4547 AB 2.11 1 2.11 2.98 0.1062 AC 6.19 1 6.19 8.76 0.0103 * AD 0.34 1 0.34 0.48 0.5011 BC 0.17 1 0.17 0.24 0.6294 BD 0.14 1 0.14 0.20 0.6638 CD 0.56 1 0.56 0.79 0.3896 A2 59.25 1 59.25 83.85 <0.0001 ** B2 59.66 1 59.66 84.43 <0.0001 ** C2 69.85 1 69.85 98.85 <0.0001 ** D2 35.46 1 35.46 50.18 <0.0001 ** 残差 9.89 14 0.71 失拟项 9.20 10 0.92 5.31 0.0610 纯误差 0.69 4 0.17 总和 172.46 28 R2=0.9426 R2adj=0.8853 注:P<0.05表明模型或各因素影响显著差异,以“*”表示;P<0.01表明模型或因素影响极显著差异,以“**”表示。 2.2.3 响应面实验中交互项作用分析
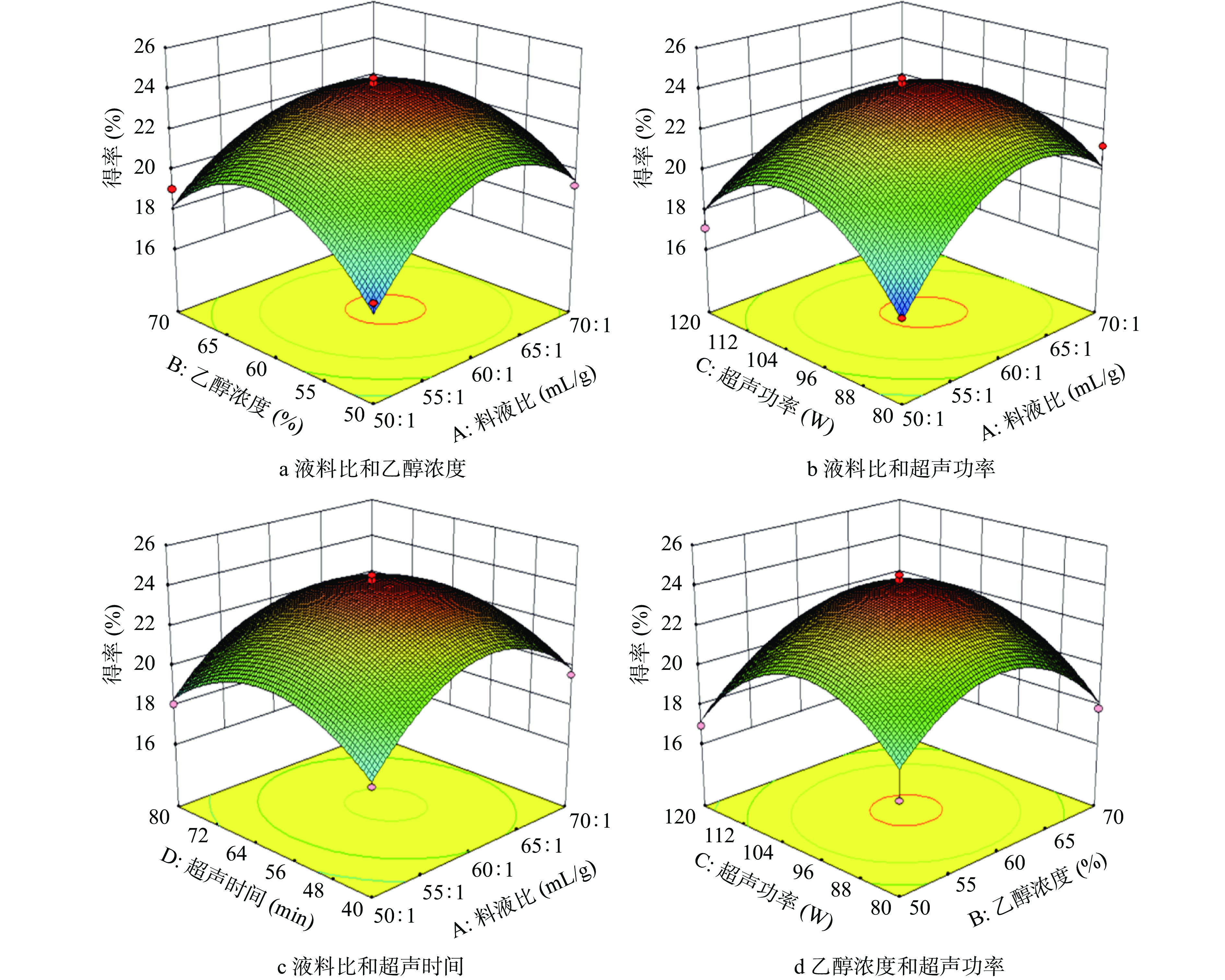
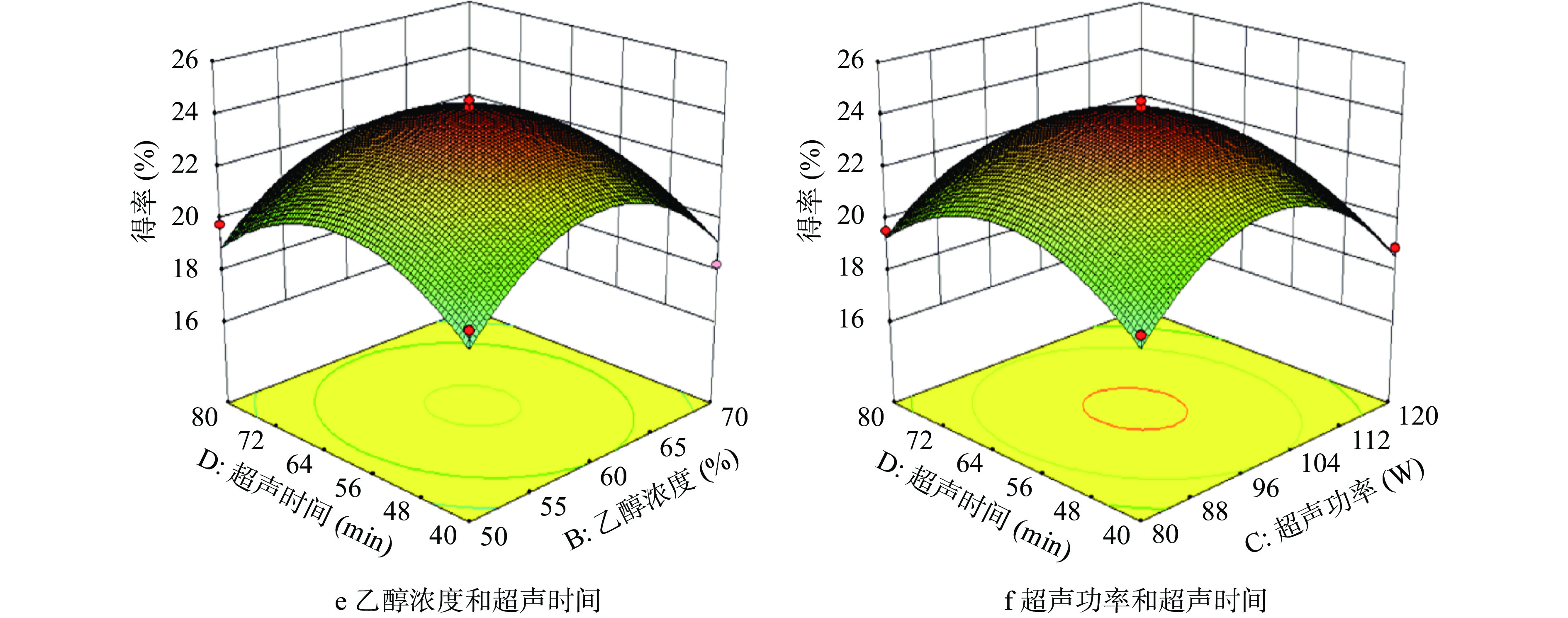
响应面图能直观反映出实验因素两两交互作用的显著程度,响应面3D曲面图坡度越陡峭,等高线越密集并呈椭圆形或马鞍形时,表明两因素之间的交互越显著[26]。由图5可知,交互作用相液料比与超声功率的响应图较其他交互作用更为陡峭,表明该交互因素对AMF得率影响显著,这与表3方差分析结果一致。
2.2.4 最优工艺条件及模型验证
以AMF得率为评价指标,通过Box-Behnken模型优化分析得到黄酮最优提取工艺为液料比61.23:1 mL/g、乙醇浓度59.69%、超声功率97.87 W、超声时间59.24 min,黄酮得率的预测值为24.27%。为验证模型的有效性,结合实际情况将最优工艺调整为61:1 mL/g、60%、100 W、59 min,该条件下提取黄酮的得率为24.22%±0.29%,与预测值接近,说明模型可靠。
2.3 AMF抗氧化及降血脂活性
2.3.1 DPPH·清除能力
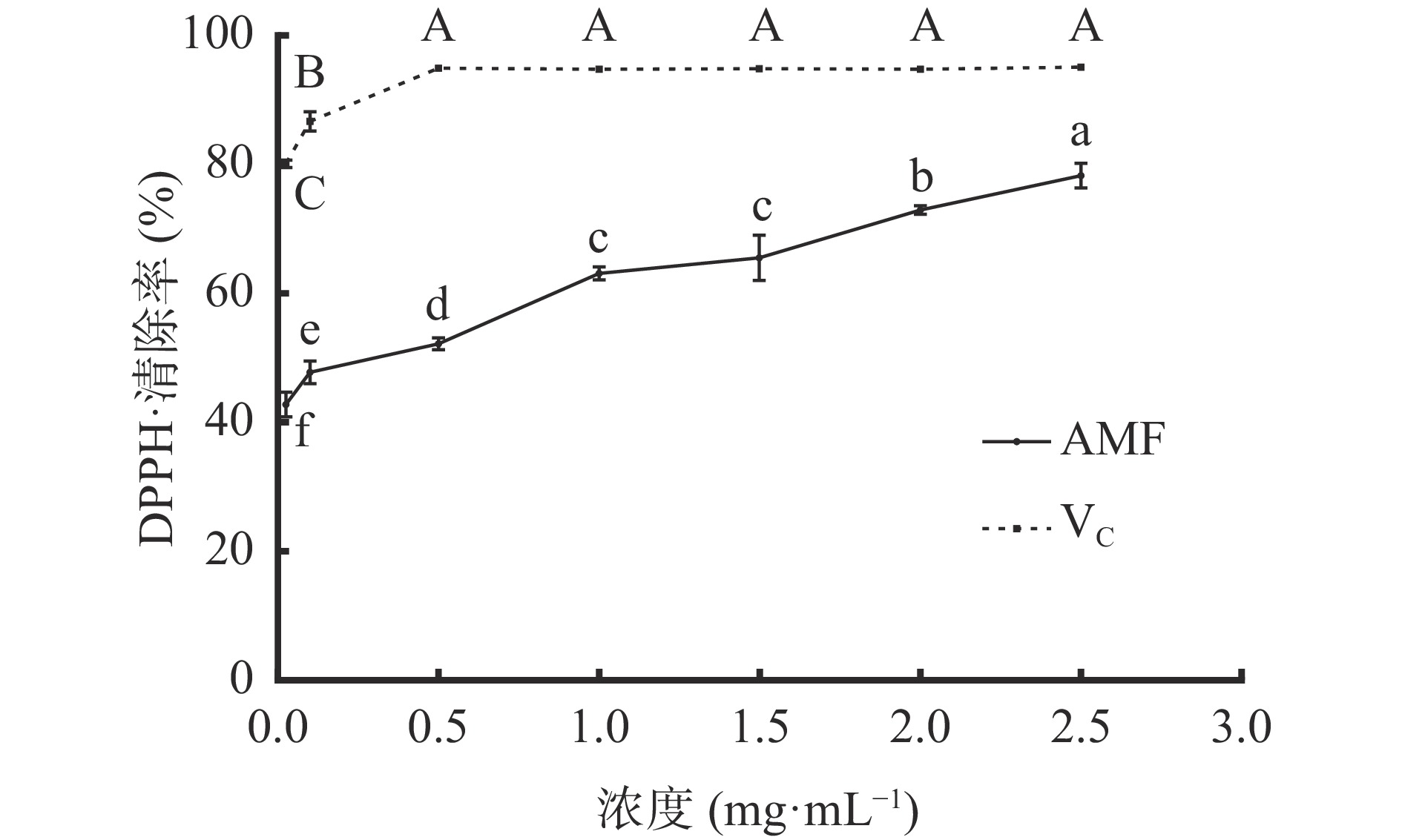
图6可知,质量浓度0.025~0.5 mg/mL范围内,VC和AMF对DPPH·清除效果随浓度升高而显著(P<0.05)增强。浓度大于0.5 mg/mL时,VC对DPPH·清除率维持在94%~95%,各浓度间的清除效果无显著(P>0.05)差异。浓度为1.5~2.5 mg/mL范围内,AMF对DPPH·清除率随浓度的升高而显著(P<0.05)上升,其清除率范围为65%~78%,DPPH·的IC50为0.32 mg/mL。上述结果较刘静等[27]研究黑果腺肋花楸果中黄酮对DPPH·的IC50更小,AMF对DPPH·的清除效果强于果实中黄酮,原因是AMF含量高于果实中黄酮含量,而黄酮具备较强的自由基捕捉能力,抗氧化活性的强弱与其含量的高低、结构中取代基的性质和位置等均有关[28]。
2.3.2 ABTS+·清除能力
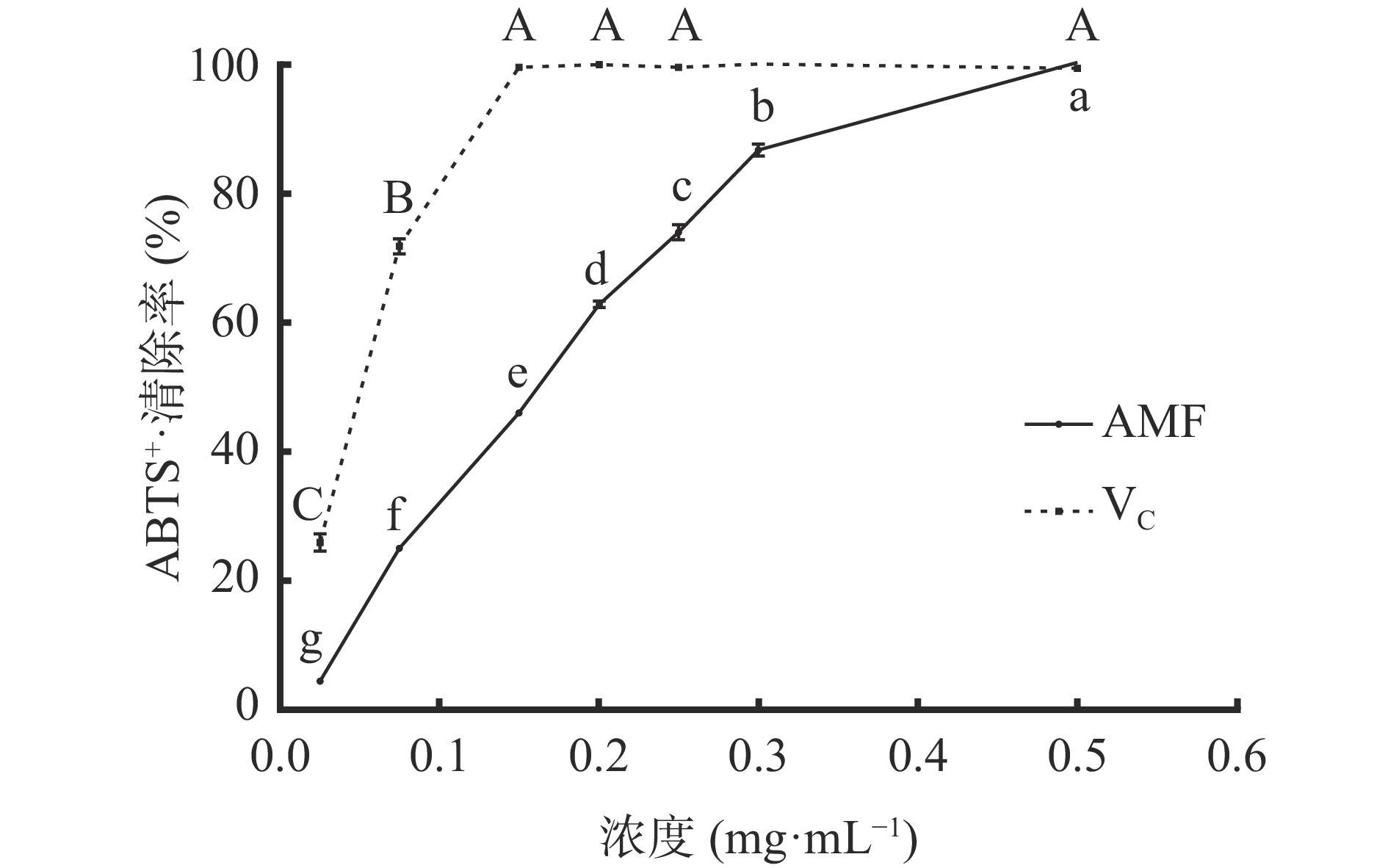
图7可知,质量浓度为0.025~0.15 mg/mL范围内,VC对ABTS+·清除效果随浓度升高而显著(P<0.05)增强;质量浓度为0.075 mg/mL时,VC对ABTS+·清除率为71.89%±1.19%,大于AMF对ABTS+·清除率25.03%±0.26%。在质量浓度为0.025~0.5 mg/mL范围内,AMF对ABTS+·清除效果随浓度升高而显著(P<0.05)增强,ABTS+·清除率的IC50为0.16 mg/mL,在浓度0.5 mg/mL时,AMF对ABTS+·清除率与VC一致,清除率为99.47%。AMF对ABTS+·清除率的IC50小于对DPPH·清除率IC50,其原因为抗氧性能力不仅取决于类黄酮的极性,还取决于自由基的选择性和作用机理,黄酮类化合物的不同化学结构导致了其对不同自由基的清除能力的差异[29],AMF对ABTS+·的清除能力强于对DPPH·的清除能力。
2.3.3 总还原能力
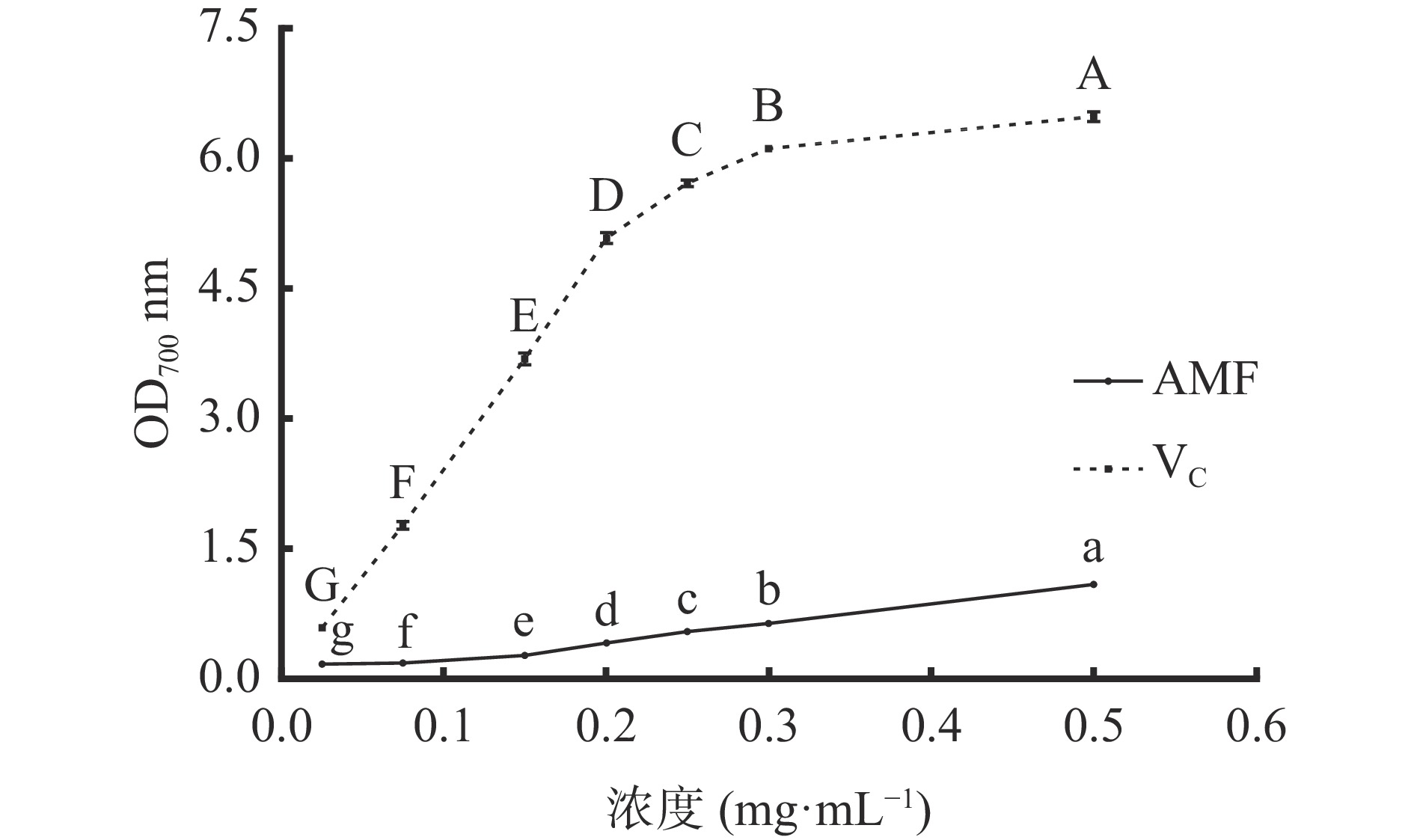
图8可知,质量浓度为0.025~0.5 mg/mL范围内,VC和AMF的还原能力随浓度增大而显著(P<0.05)增强。质量浓度为0.5 mg/mL,AMF的吸光值为1.09,低于VC的吸光值。AMF的总还原能力虽不及VC,但AMF的自然资源丰富,制备方法简单,生产成本低,是一种较理想的天然抗氧化剂。
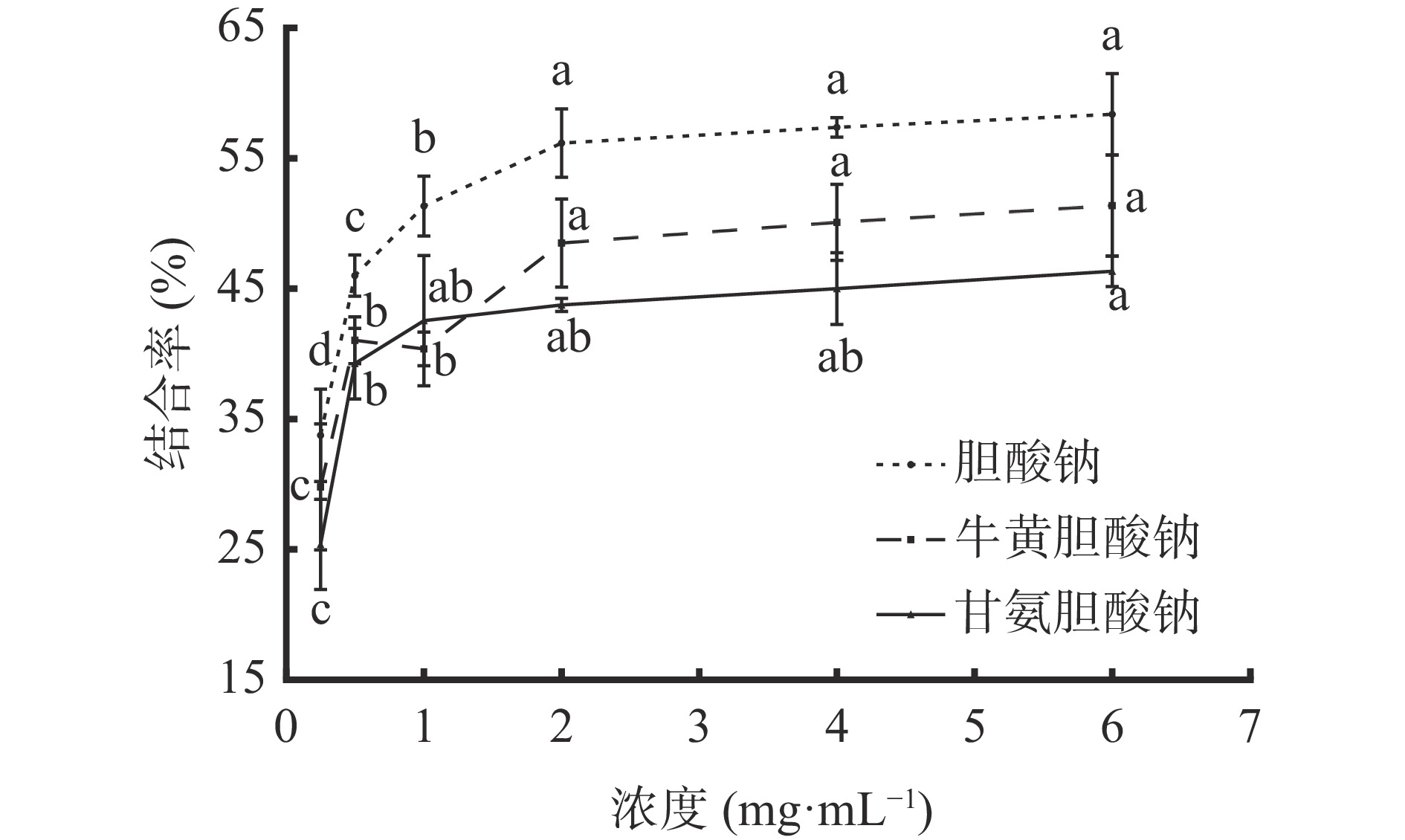
2.3.4 结合胆酸盐能力
甘氨胆酸、牛黄胆酸、胆酸均属于结合型初级胆汁酸,与Na+或K+形成结合性初级胆酸盐。胆汁酸盐是胆固醇的降解产物,黄酮类化合通过与胆酸盐结合,降低胆汁酸的重吸收率,从而降低胆固醇的含量[30]。图9可知,质量浓度为0.25~0.5 mg/mL范围内,AMF对胆酸钠、牛黄胆酸钠、甘氨胆酸钠的结合率随浓度增加显著(P<0.05)上升;在质量浓度为2~6 mg/mL时,结合率随浓度增加呈缓慢增长趋势,差异不显著(P>0.05);在质量浓度为6 mg/mL时,对胆酸钠、牛黄胆酸钠、甘氨胆酸钠的结合率分别为58.38%、51.40%、46.36%。AMF对胆酸钠的结合率高于牛黄胆酸钠、甘氨胆酸钠,其IC50分别为0.76、3.01、6.49 mg/mL,说明AMF对胆酸盐的结合能力较好,具有潜在的降血脂功效。
3. 结论
本文采用超声波辅助法提取AMF,经单因素和响应面实验优化,确定最优工艺条件为:液料比61:1 mL/g、乙醇浓度60%、超声功率100 W、超声时间59 min,该条件下的黄酮得率为24.22%±0.29%(n=3),与预测值(24.27%)接近,模型可靠。AMF对DPPH·和ABTS+·清除率的IC50值分别为0.32和0.16 mg/mL,在浓度为0.5 mg/mL时,对铁离子还原力较好,吸光值为1.09;AMF对胆酸钠、牛黄胆酸钠和甘氨胆酸钠结合率的IC50值分别为0.76、3.01和6.49 mg/mL。综上,AMF具有较好的抗氧化、结合胆酸盐能力,且在一定的浓度范围内抗氧化、结合胆酸盐能力与黄酮含量呈剂量效应。
本研究为AMF开发天然抗氧化剂和降血脂药物提供理论依据,但需对其组分进行测定,分离单体化合物,确定具体的抗氧化、降血脂物质,同时对其体内降血脂机制进一步研究。
-
表 1 响应面实验因素水平设计
Table 1 Factors and Levels of response surface methodology
水平 因素 A液料比(mL/g) B乙醇浓度(%) C超声功率(W) D超声时间(min) −1 50 50 80 40 0 60 60 100 60 +1 70 70 120 80 表 2 响应面实验设计及结果
Table 2 Design and results of response surface experiment
实验号 A B C D 黄酮得率(%) 1 0 −1 −1 0 17.25 2 0 1 0 −1 18.25 3 0 1 1 0 18.33 4 0 0 1 −1 18.91 5 1 0 0 −1 19.57 6 −1 0 −1 0 16.75 7 −1 0 0 −1 17.91 8 1 0 0 1 18.58 9 0 0 −1 −1 19.41 10 0 −1 0 1 19.82 11 1 0 −1 0 21.23 12 0 1 0 1 17.75 13 1 0 1 0 16.59 14 0 −1 1 0 16.92 15 0 1 −1 0 17.83 16 0 −1 0 −1 19.57 17 −1 1 0 0 19.07 18 1 1 0 0 18.00 19 −1 0 1 0 17.08 20 −1 −1 0 0 17.42 21 0 0 1 1 17.58 22 0 0 0 0 24.54 23 −1 0 0 1 18.08 24 0 0 −1 1 19.57 25 0 0 0 0 24.05 26 0 0 0 0 24.30 27 0 0 0 0 23.55 28 0 0 0 0 24.55 29 1 −1 0 0 19.16 表 3 响应面拟合回归方程的方差分析结果
Table 3 Variance analysis results of response surface fitting regression equation
来源 平方和 自由度 均方 F值 P值 显著性 模型 162.57 1 11.61 16.43 <0.0001 ** A 3.95 1 3.95 5.59 0.0331 * B 0.083 1 0.083 0.12 0.7376 C 3.67 1 3.67 5.19 0.0389 * D 0.42 1 0.42 0.59 0.4547 AB 2.11 1 2.11 2.98 0.1062 AC 6.19 1 6.19 8.76 0.0103 * AD 0.34 1 0.34 0.48 0.5011 BC 0.17 1 0.17 0.24 0.6294 BD 0.14 1 0.14 0.20 0.6638 CD 0.56 1 0.56 0.79 0.3896 A2 59.25 1 59.25 83.85 <0.0001 ** B2 59.66 1 59.66 84.43 <0.0001 ** C2 69.85 1 69.85 98.85 <0.0001 ** D2 35.46 1 35.46 50.18 <0.0001 ** 残差 9.89 14 0.71 失拟项 9.20 10 0.92 5.31 0.0610 纯误差 0.69 4 0.17 总和 172.46 28 R2=0.9426 R2adj=0.8853 注:P<0.05表明模型或各因素影响显著差异,以“*”表示;P<0.01表明模型或因素影响极显著差异,以“**”表示。 -
[1] 孙茹欣. 驼血降血脂生物活性肽的制备与鉴定[D]. 呼和浩特: 内蒙古农业大学, 2021 SUN R X. Preparation and identification of lipid-lowering bioactive peptides from camel blood[D]. Hohhot: Inner Mongolia Aagricultural University, 2021.
[2] 同政泉, 刘婷婷, 张闪闪, 等. 猴头菇多肽的制备及体外抗氧化、降血脂活性研究[J/OL]. 吉林农业大学学报: 1−8[2022-01-24]. doi: 10.13327/j.jjlau.2021.093. TONG Z Q, LIU T T, ZHANG S S, et al. Preparation of Hericium erinaceus polypeptides and their antioxidation and hypolipidemic activity in vitro[J/OL]. Journal of Jilin Agricultural University: 1−8[2022-01-24]. doi: 10.13327/j.jjlau.2021.1093.
[3] 陈妍竹, 胡文忠, 姜爱丽, 等. 黑果腺肋花楸功能作用及食品加工研究进展[J]. 食品工业科技,2016,37(9):397−400. [CHEN Y Z, HU W Z, JIANG A L, et al. Food processing and functional character of Aronia melanocarpa[J]. Science and Technology of Food Industry,2016,37(9):397−400. [4] TELESZKO M, WOJDYŁO A. Comparison of phenolic compounds and antioxidant potential between selected edible fruits and their leaves[J]. Journal of Functional Foods,2015,14:736−746. doi: 10.1016/j.jff.2015.02.041
[5] CVETANOVIĆ A, ZENGIN G, ZEKOVIĆ Z, et al. Comparative in vitro studies of the biological potential and chemical composition of stems, leaves and berriesAronia melanocarpa's extracts obtained by subcritical water extraction[J]. Food and Chemical Toxicology,2018,121:458−466. doi: 10.1016/j.fct.2018.09.045
[6] LEE H M, KONG B J, KWON S S, et al. Antioxidative activities of Aronia melanocarpa fruit and leaf extracts[J]. Journal of the Society of Cosmetic Scientists of Korea,2013,39(4):337−345. doi: 10.15230/SCSK.2013.39.4.337
[7] IWASHIMA T, KUDOME Y, KISHIMOTO Y, et al. Aronia berry extract inhibits TNF-α-induced vascular endothelial inflammation through the regulation of STAT3[J]. Food Nutrition Research,2019,63(1):3361−3369.
[8] YAMANE T, KOZUKA M, KONDA D, et al. Improvement of blood glucose levels and obesity in mice given Aronia juice by inhibition of dipeptidyl peptidase IV andα-glucosidase[J]. The Journal of Nutritional Biochemistry,2016,31:106−112. doi: 10.1016/j.jnutbio.2016.02.004
[9] BERMÚDEZ-SOTO M J, LARROSA M, GARCIA-CANTALEJO J M, et al. Up-regulation of tumor suppressor carcinoembryonic antigen-related cell adhesion molecule 1 in human colon cancer caco-2 cells following repetitive exposure to dietary levels of a polyphenol-rich chokeberry juice[J]. Journal of Nutritional Biochemistry,2007,18(4):259−271. doi: 10.1016/j.jnutbio.2006.05.003
[10] 朱琪, 曾立, 李庚喜, 等. 金银花水提取总黄酮对高血脂小鼠的降血脂机制研究[J]. 中国预防医学杂志,2020,21(7):737−743. [ZHU Q, ZENG L, LI G X, et al. Preliminary study on the mechanism of water extraction from honeysuckle total flavonoids on blood lipids in hyperlipidemic mice[J]. Chinese Preventive Medicine,2020,21(7):737−743. [11] 叶雅沁, 李泳宁, 李小芬, 等. 南非叶总黄酮的降血脂作用[J]. 食品工业科技,2020,41(16):304−307. [YE Y Q, LI Y N, LI X F, et al. Hypolipidemic activity of the total flavonoids from Bitter leaf[J]. Science and Technology of Food Industry,2020,41(16):304−307. [12] DO THI N, HWANG E S. Bioactive compound contents and antioxidant activity in aronia (Aronia melanocarpa) leaves collected at different growth stages[J]. Preventive nutrition and food science,2014,19(3):204. doi: 10.3746/pnf.2014.19.3.204
[13] ZDUNIĆ G, ARADSKI A A, GOĐEVAC D, et al. In vitro hypoglycemic, antioxidant and antineurodegenerative activity of chokeberry (Aronia melanocarpa) leaves[J]. Industrial crops and products,2020,148:112328. doi: 10.1016/j.indcrop.2020.112328
[14] 刘佳, 王莹, 陈昕昕, 等. 黑果腺肋花楸总黄酮提取工艺优化及抗氧化活性研究[J]. 青岛农业大学学报(自然科学版),2017,34(4):267−272,313. [LIU J, WANG Y, CHEN X X, et al. Optimization of flavonoids extraction process from Aronia melanocarpa and its antioxidant activity[J]. Journal of Qingdao Agricultural University(Natural Science),2017,34(4):267−272,313. [15] LI C, HUANG Q, FU X, et al. Characterization, antioxidant and immunomodulatory activities of polysaccharides from Prunella vulgaris Linn[J]. International Journal of Biological Macromolecules,2015,75:298−305. doi: 10.1016/j.ijbiomac.2015.01.010
[16] FENG Y N, ZHANG X F. Polysaccharide extracted from Huperzia serrata using response surface methodology and its biological activity[J]. International Journal of Biological Macromolecules,2020,157:267−275. doi: 10.1016/j.ijbiomac.2020.04.134
[17] LIU Y, DU Y Q, WANG J H, et al. Structural analysis and antioxidant activities of polysaccharide isolated from Jinqian mushroom[J]. International Journal of Biological Macromolecules,2014,64:63−68. doi: 10.1016/j.ijbiomac.2013.11.029
[18] 芦宇, 吕长鑫, 焦天慧, 等. 聚酰胺纯化红树莓籽黄酮及其结合胆酸盐能力评价[J]. 中国食品学报,2019,19(10):172−178. [LU Y, LV C X, JIAO T H, et al. Ability of bile salt-binding of red raspberry seed flavonoids purifuication by polyamide[J]. Journal of Chinese Institute of Food Science and Technology,2019,19(10):172−178. [19] 任世达, 方晓敏, 罗雁非, 等. 超声波辅助提取玉米花丝多酚工艺优化及其抑菌活性研究[J]. 食品工业科技,2021,42(17):201−208. [REN S D, FANG X M, LUO Y F, et al. Optimization of ultrasonic-assisted extraction of corn silk polyphenols and its antibacterial activity[J]. Science and Technology of Food Industry,2021,42(17):201−208. [20] 杨宗玲, 李晗, 范方宇, 等. 超声辅助酶法提取无籽刺梨果渣中黄酮的工艺优化及其抗氧化活性[J]. 食品工业科技,2021,42(13):184−192. [YANG Z L, LI H, FAN F Y, et al. Ultrasound-assisted enzymatic extraction of flavonoids from Rosa sterilis pomace and its antioxidant activity[J]. Science and Technology of Food Industry,2021,42(13):184−192. [21] 谭春远, 阎杰, 黄惠敏, 等. 特纳草黄酮超声强化提取工艺的响应面法优化及其抗氧化性[J]. 食品工业科技,2021,42(16):191−198. [TAN C Y, YAN J, HUANG H M, et al. Optimization of ultrasonic-assisted extraction process of flavonoids from damiana by response surface methodology and its antioxidant activity[J]. Science and Technology of Food Industry,2021,42(16):191−198. [22] 李艳艳, 王俊青, 刘王文, 等. 响应面法优化超声辅助提取大果青扦叶总黄酮及其抗氧化性研究[J]. 食品研究与开发,2020,41(22):30−36. [LI Y Y, WANG J Q, LIU W W, et al. Study on optimization of ultrasonic assisted extracting process of total flavonoids from Picea neoveitchii leaves by response surface methodology and its antioxidant activity[J]. Food Research and Development,2020,41(22):30−36. [23] LI J K, WU C C, LI F, et al. Optimization of ultrasound-assisted water extraction of flavonoids from Psidium guajava leaves by response surface analysis[J]. Preparative Biochemistry and Biotechnology,2019,49(1):21−29. doi: 10.1080/10826068.2018.1466158
[24] 宋越冬, 陈晓庆, 张毓敏, 等. 荞麦叶黄酮的提取工艺优化及其抗氧化性[J]. 食品工业科技,2021,42(7):180−187. [SONG Y D, CHEN X Q, ZHANG Y M, et al. Optimization of extraction process of flavonoids from Fagopyrum esculentum moench leaves and its antioxidant properties[J]. Science and Technology of Food Industry,2021,42(7):180−187. [25] 陈建福, 彭敏. 芦柑叶总黄酮的提取工艺优化及其抗氧化活性研究[J]. 食品研究与开发,2021,42(4):117−122. [CHEN J F, PENG M. Optimization of extraction technology of total flavonoids from ponkan leaves and its antioxidant activity[J]. Food Research and Development,2021,42(4):117−122. [26] 高林晓, 马文升, 石慧丽, 等. Box-Behnken模型优化水麻叶总黄酮提取工艺及抗氧化活性分析[J]. 食品工业科技,2021,42(12):184−190. [GAO L X, MA W S, SHI H L, et al. Optimization of the ultrasound extraction technology and antioxidant activity analysis of the total flavonoids from Debregeasia orientalis leaves by box-behnken method[J]. Science and Technology of Food Industry,2021,42(12):184−190. [27] 刘静, 徐莉莉. 黑果腺肋花楸黄酮提取工艺优化及体外抗氧化研究[J]. 食品研究与开发,2017,38(3):60−65. [LIU J, XU L L. Study on black fruit Aronia flavonoids extraction process and its antioxidant activity[J]. Food Research and Development,2017,38(3):60−65. [28] 任红, 郑少杰, 张小利, 等. 基于不同抗氧化机制的黄酮类化合物构效关系研究进展[J]. 食品工业科技,2016,37(2):384−388. [REN H, ZHENG S J, ZHANG X L, et al. Research progress on the structure-activity relationship of flavonoid compounds based on different antioxidant mechanism[J]. Science and Technology of Food Industry,2016,37(2):384−388. [29] 崔泰花, 赵熙成, 戴雪纯, 等. 桔梗不同极性溶剂提取物抗氧化活性及成分分析[J]. 食品科技,2019,44(12):241−246, 252. [CUI T H, ZHAO X C, DAI X C, et al. Research on composition and antioxidant activities of different solvent extracts from Platycodon grandiflorum[J]. Food Science and Technology,2019,44(12):241−246, 252. [30] 田月月. 水溶性大豆多糖体外结合重金属和胆汁酸盐的研究[D]. 无锡: 江南大学, 2016 TIAN Y Y. In vitro binding of heavy metals and bile salts by soybean soluble polysaccharides[D]. Wuxi: Jiangnan University, 2016.






 下载:
下载:




 下载:
下载:
