Optimization of Extraction Technology and Physicochemical Properties of Polysaccharide from Sea Cucumber Intestines
-
摘要: 为有效提高海参废弃物利用率,本文以海参肠废弃物为原料,采用热水提取法提取海参肠多糖,结合响应面法优化提取工艺并分析海参肠多糖理化性质。结果表明,海参肠多糖最优提取工艺条件为:提取时间1 h、提取温度80 ℃、料液比1:8(mg/mL)、重复提取2次,在此条件下多糖的平均得率为4.43%±0.17%。利用高效液相色谱法分析该条件下提取的多糖平均分子量为4.91×106 Da。通过气相色谱法分析海参肠多糖主要由岩藻糖、甘露糖和阿拉伯糖组成,含有部分半乳糖和葡萄糖。采用热重分析仪研究热力学性质,发现温度在309 ℃时多糖结构发生崩解,在800 ℃时多糖重量损失为85.46%。运用扫描电子显微镜观察形貌结构,发现多糖表面是由不均匀椭圆形球状颗粒组成。以上结果初步揭示了热水提取海参肠多糖的特性,为海参废弃物资源利用提供了理论基础。Abstract: In order to effectively improve the utilization rate of sea cucumber wastes, this paper used sea cucumber intestines wastes as raw materials to extract polysaccharides by hot water extraction method. Combined with response surface methodology to optimize the extraction process and analyzed the physicochemical properties of sea cucumber intestines polysaccharides. Results showed that, the experimental results showed that the optimal extraction conditions of sea cucumber intestines polysaccharides were as follows: Extraction time 1 h, extraction temperature 80 ℃, solid-liquid ratio 1:8 (mg/mL) and repetition of the extracting procedure 2 times. Under these conditions, the average yield of polysaccharides was 4.43%±0.17%. The average molecular weight of the polysaccharides extracted under this condition was 4.91×106 Da by high performance liquid chromatography. Sea cucumber intestinal polysaccharides were mainly composed of fucose, mannose and arabinose, as well as part of galactose and glucose by gas chromatography. The thermogravimetric analysis was used to analyse the thermodynamic properties. It was found that the polysaccharides structure disintegrated at 309 ℃, and the weight loss of polysaccharides were 85.46% at 800 ℃. The surface of polysaccharides were observed as non-uniform elliptical spherical particles by scanning electron microscope. The results preliminarily revealed the characteristics of hot water extraction of sea cucumber intestines polysaccharides, and would provide a theoretical basis for the utilization of sea cucumber waste resources.
-
随着我国经济发展,海参需求量不断增加,截止2018年,我国干海参产量约为4379吨,约占全球干海参产量11.2%[1]。海参加工行业经过多年的发展,目前市场产值已超过500亿元[1]。然而,在海参产业高度工业化和技术化发展的同时也带来了大量环境问题,其中包括海参肠在内的海参内脏等废弃物的随意处理,不仅对生态环境造成污染,也浪费了大量的营养物质。国内外科研人员针对海参内脏资源进行了部分研究,对海参内脏中的营养物质进行提取鉴定和生物活性研究。海参内脏主要包括海参肠、海参卵和海参精等。目前,研究表明海参内脏具有极高的营养价值和医疗价值[2-3]。海参内脏含有丰富的活性物质,如蛋白质、多糖、脂肪酸、皂苷、性腺色素以及微量元素等[4-8]。海参内脏具有多种生物学活性,如抑癌、抗氧化和降血脂等[9-12]。杨佳洪等[13]比较不同蛋白酶对海参内脏的酶解能力,并通过响应面分析法优化海参内脏的酶解条件,发现中性蛋白酶对海参内脏具有更好的酶解效果,酶解产物具有较好的抗氧化活性。海参内脏多糖表现出极强的体外抗氧化能力,且与浓度呈正相关,与体壁多糖相比,具有更强的羟自由基和超氧阴离子自由基清除能力[14]。此外,有研究显示从海参中提取的糖胺聚糖能够显著降低高脂饮食大鼠的血清指数,具有良好的降血脂效果[11]。
多糖是海参内脏的重要组成成分。海参内脏多糖主要存在于海参肠壁、呼吸树以及卵、精细胞。海参多糖主要有海参糖胺聚糖和海参岩藻多糖两类,其糖链与蛋白相结合,具有抗凝、抗血栓、促纤溶等作用[15-16]。海参多糖常用的提取方法有化学水解法、酶解法和热水法。化学水解法和酶解法通过破坏多糖和蛋白质间的连结使二者分离[3]。化学水解法操作简单,但会过度降解多糖分子并出现脱硫现象。杨涛等[17]采用碱性蛋白酶水解海参内脏,蛋白质和总糖提取率高达60%~70%。酶解法在不改变糖链结构的基础上,使蛋白质与多糖实现分离,从而达到提取多糖的目的,但提取率较低。热水法则可将大部分多糖溶出到热水中,且对多糖的破坏较小,操作简单,广泛应用于工业生产中[18]。海参肠是海参内脏的重要组成部分,海参肠多糖的抗氧化能力大于体壁多糖,这可能与两部位多糖结构、含量或化学成分不同有关。为了合理利用海参废弃物资源,将海参内脏细分,本研究针对海参肠多糖进行分离鉴定。相对于其他提取方法,热水提取法操作简单、对多糖结构破坏性小且成本较低,因此本研究采用热水法从海参肠中提取多糖,并结合响应面法对海参肠多糖的提取工艺进行优化,拟获取最佳提取工艺,进一步分析其理化性质,为海参废弃物资源利用提供理论支持。
1. 材料与方法
1.1 材料与仪器
海参内脏废弃物 由百德福生物技术有限公司(中国河北)提供;咔唑、石油醚、硫酸、乙醇、牛血清蛋白、硫酸钠、葡萄糖醛酸 国药集团化学试剂有限公司;鼠李糖、阿拉伯糖、木糖、甘露糖、半乳糖、葡萄糖、岩藻糖 上海源叶生物科技有限公司;所有化学试剂 均为分析纯。
AB204-N电子分析天平 上海精科实业有限公司;TDL-5-A离心机 上海安亭科技仪器厂;QL-901微型福特混频器 海门麒麟贝尔仪器制造有限公司;RE-52AA旋转蒸发器 上海正荣生化仪器厂;DGG-101-1电动鼓风干燥箱 天津天宇仪器有限公司;JY-20高速粉碎机 九阳电器有限公司;KDN-08C数字温控蒸煮器 上海鑫佳仪器有限公司;Modulyod-230冷冻干燥机 美国Thermo公司;TU-1810紫外分光光度计 北京普析通用有限公司;TA-Q50热重分析仪 美国TA公司;SU1510扫描电子显微镜 日本日立公司;LC-20A高效液相色谱仪 日本岛津公司;7890A气相色谱仪 美国安捷伦公司。
1.2 实验方法
1.2.1 海参肠组分测定
海参肠组分分析采用以下标准方法进行测定:灰分(GB 5009.4-2016)、水分(GB 5009.3-2016)、脂肪(GB 5009.6-2016)和蛋白质(GB 5009.5-2016)。
1.2.2 海参肠预处理
将海参肠从海参内脏器官中分离,自来水洗涤后烘干备用。利用高速粉碎机将干燥的海参肠物料粉碎,过60目筛备用。
1.2.3 多糖含量测定
采用苯酚-硫酸法[19]测定多糖含量。浓度为0.1 mg/mL葡萄糖溶液作为标准品溶液。取标准品溶液0、0.1、0.2、0.3、0.4、0.5、0.6 mL,置于不同试管中,并用蒸馏水补齐至1 mL,分别加入6%苯酚溶液1.0 mL,迅速加入硫酸5.0 mL,置于冰中20 min。冷却至室温后,于波长490 nm处测定吸光度。以标准品浓度(x)为横坐标、吸光度(y)为纵坐标,绘制标准曲线,得回归方程为y=0.0134x+0.01(R2=0.999)。
1.2.4 海参肠多糖的提取工艺
称取50 mg海参肠粉末料液比为1:8(mg/mL),于80 ℃热水条件下提取1 h,沉淀重复浸提2次,并于4000 r/min离心10 min,收集上清液。上清液在60 ℃下真空浓缩,将上清液浓缩至一定体积后采用Sevag法去除蛋白,加入3倍体积的无水乙醇在4 ℃静置12 h后,4000 r/min离心10 min,将沉淀重新溶于蒸馏水中,冷冻干燥得到海参肠粗多糖。海参肠多糖得率计算公式如下:
海参肠多糖得率(%)=MM0×100 (1) 式中:M:干燥后海参肠多糖的质量,mg;M0:海参肠粉末的质量,mg。
1.2.5 海参肠多糖提取单因素实验
固定因素水平为提取时间1 h、提取温度80 ℃、提取次数2次、料液比1:8(mg/mL)。考察不同提取时间(0.25、0.5、1、1.5、2.0、2.5 h)、不同提取温度(60、70、80、90、100 ℃)、不同料液比(1:7、1:8、1:9、1:10、1:11、1:12 mg/mL)和不同提取次数(1、2、3、4、5次)对多糖得率的影响。
1.2.6 响应面法优化海参肠多糖提取工艺
根据单因素实验结果选取因素水平,建立4因素3水平Box-Benhnken试验。以多糖得率为响应值,优化海参肠多糖提取工艺。响应面试验设计因素水平表如表1所示。
表 1 响应面因素水平设计Table 1. Factors and levels of response surface analysis水平 因素 X1提取温度
(℃)X2提取次数
(次)X3提取时间
(h)X4料液比
(mg/mL)-1 70 1 0.5 1:7 0 80 2 1.0 1:8 1 90 3 1.5 1:9 1.2.7 海参肠多糖理化性质研究
1.2.7.1 海参肠多糖分子量分布测定
用超纯水配制2 mg/mL多糖溶液,过0.22 μm滤膜,采用高效液相色谱仪进行检测,凝胶色谱柱型号为OHpak SB-805 HQ(8.0 mm×300 mm),以超纯水作为流动相,流速为0.8 mL/min,样品进样量为20 μL。根据葡聚糖标准品的相对分子量(5300、3700、2400、2000、500、110、70和40 kDa)和保留时间制作标准曲线为Y=0.0012X5−0.0353X4+0.3229X3−0.7967X2−3.0039X+19.6627,R2=0.999,其中X为相对保留时间,Y为相对分子量。
1.2.7.2 单糖组成分析
采用气相色谱法测定海参肠多糖的单糖组成[20]。取1 mL三氟乙酸(2 mol/L)加入含有10 mg海参肠多糖的三角瓶中,于120 ℃下水解6 h。酸降解产物经真空浓缩干燥,加入1 mL甲醇,真空旋干,重复此操作5次以除尽三氟乙酸。分别向酸降解产物及5 mg单糖标品(甘露糖,鼠李糖,阿拉伯糖,半乳糖,葡萄糖,肌醇和岩藻糖)中加入30 mg钠硼氢化钠(NaBH4)和2 mL蒸馏水,室温充分反应1.5 h,向反应液滴加冰醋酸以除尽多余的NaBH4,混合溶液经真空浓缩干燥,加入2 mL 0.1%(v/v)盐酸甲醇溶液,振荡混合,真空浓缩干燥,共重复4次。干燥后,向混合物中分别加入0.5 mL吡啶和0.5 mL乙酸酐,封管,105 ℃的烘箱中反应1 h,得糖醇乙酰乙酯衍生化产物。将衍生化产物过0.22 μm滤膜后进行气相色谱(GC)分析。色谱条件:进样量5 μL,分流比10:1。气相色谱柱为 Cat No.C-07-004,OV-1701柱型(30 m×0.5 m×0.32 mm);氢离子火焰检测器,检测器温度250 ℃。载气为高纯氮气(99.999%)。升温程序:初始温度150 ℃,维持1 min,10 ℃/min升温至200 ℃,维持10 min,5 ℃/min升温至220 ℃,维持5 min,1.5 ℃/min升温至终温240 ℃,并保留20 min。
1.2.7.3 海参肠多糖热重分析
精确称取3 mg海参肠多糖于铝制坩埚中。加热温度范围为30~800 ℃,升温速率为10 ℃/min,压力保持在10 kPa[21]。
1.2.7.4 海参肠多糖扫描电镜分析
将干燥后的海参肠多糖粘附于样品台上,后置于离子溅射仪中镀金,在5.0 kV的加速电压下通过扫描电子显微镜进行观察,在不同放大倍数(500×、1000×和2000×)下观察海参肠多糖,获取多糖电镜照片[22]。
1.3 数据处理
所有测定指标均作3次平行处理,结果以平均值±标准差表示。实验数据用Design-Expert DX10 software软件进行分析,数据分析采用Origin 9.2软件。方差分析采用(one-way AVONA)进行显著性检验,显著水平P<0.05。
2. 结果与分析
2.1 海参肠组分分析结果
用于本研究的海参肠原料预处理后脂肪、蛋白质、多糖、水分和灰分含量如表2所示。结果表明海参肠中蛋白质含量极高,多糖含量相对较高,海参废弃物具有良好的营养价值。
表 2 海参肠原料组分(%)Table 2. Ingredients of sea cucumber intestines raw material (%)组分 脂肪 蛋白质 多糖 水分 灰分 含量 0.96±0.14 72.89±0.11 6.84±0.02 10.03±0.30 3.95±0.10 2.2 单因素实验结果
2.2.1 提取时间对海参肠多糖得率的影响
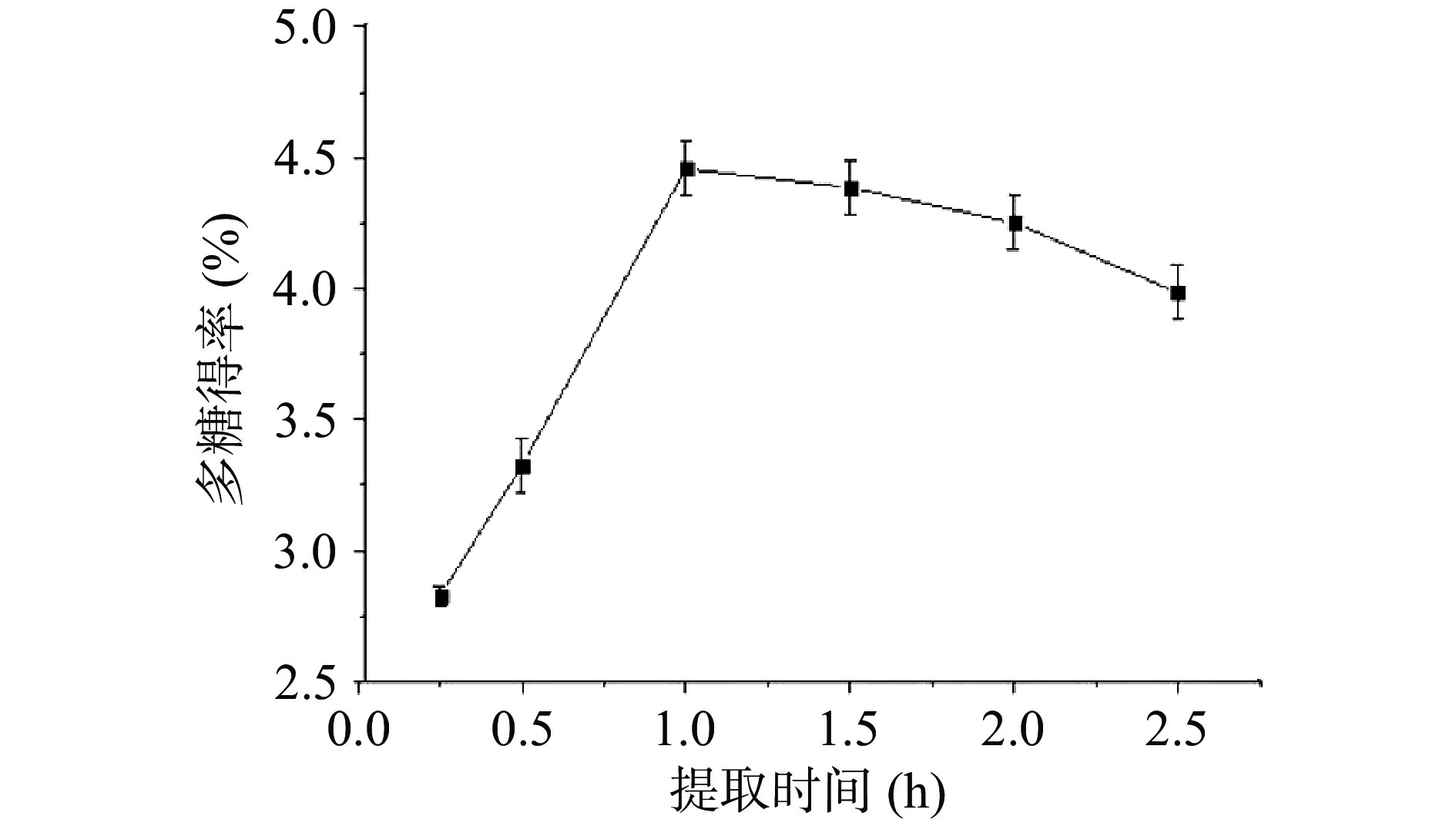
如图1所示,海参肠多糖得率在0.5~1 h范围内,随着时间的增加而增加。当提取时间为1 h时,海参肠多糖得率最高,达到4.41%,随后开始下降。起初由于时间不足,多糖提取未完全。随后多糖得率增加可能是由于热水浸提破坏细胞壁,多糖大量释放,但随着提取时间继续增加,多糖得率增加不明显,同时增加能耗[23]。因此,提取时间1 h海参肠多糖得率最大。张睿聪[24]利用碱提法提取海参多糖,最佳提取时间为1 h。
2.2.2 提取温度对海参肠多糖得率的影响
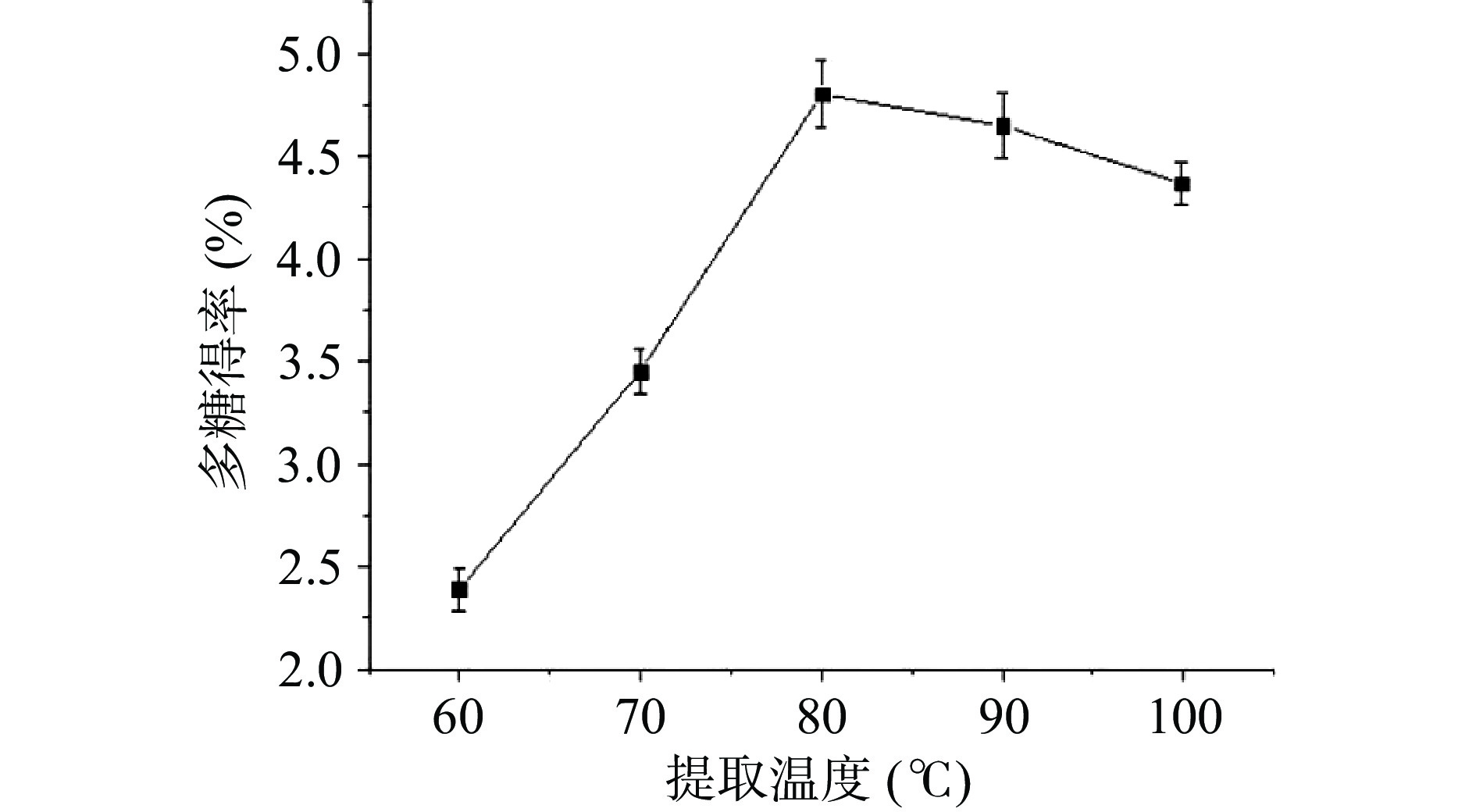
如图2所示,在温度60~80 ℃范围内,随着温度的增加,海参肠多糖得率升高并在80 ℃时达到最大值。多糖得率的增加可能是由于分子运动加速,海参肠多糖的电导率升高而引起的[18]。此外,海参肠多糖在溶液中的溶解度和扩散性随着温度的升高而增加。温度超过80 ℃时,多糖得率略有下降,过高的提取温度不仅增加能耗,还可能会破坏多糖的结构[25]。朱启源[26]利用热水法提取蛋白酶酶解后的海参肉糜多糖,最佳温度为105 ℃,与本研究略有差异。高温提取能够间接使酶失活,减小酶对多糖得率的影响。
2.2.3 提取次数对海参肠多糖得率的影响
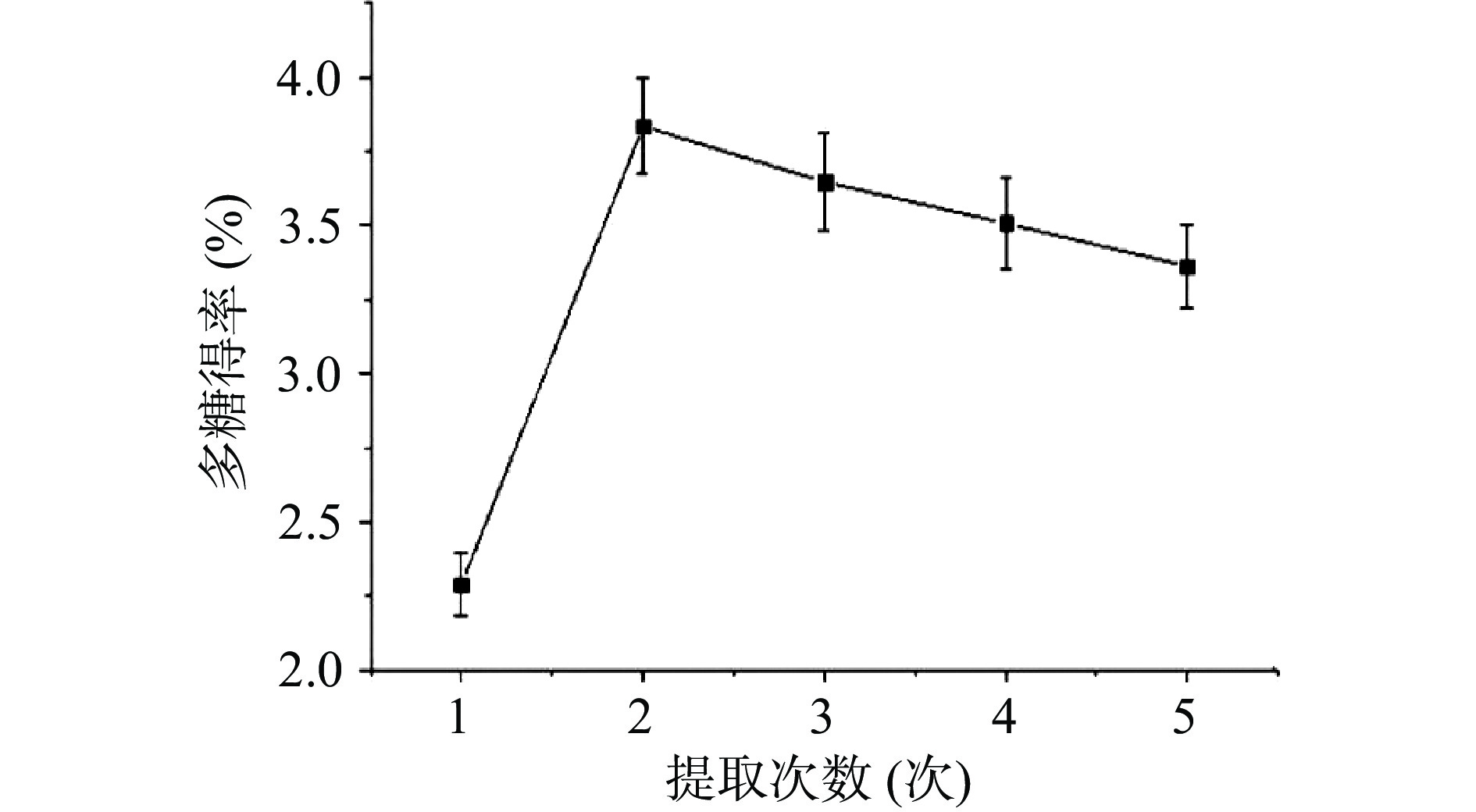
如图3所示,提取次数为1~2次时,海参肠多糖得率随着次数增加而增加。当提取次数大于2次时,海参肠多糖得率略有下降,可能由于提取次数的增加,多糖的损失也增加。当提取次数为2次时,海参肠多糖得率达到最大。
2.2.4 料液比对海参肠多糖得率的影响
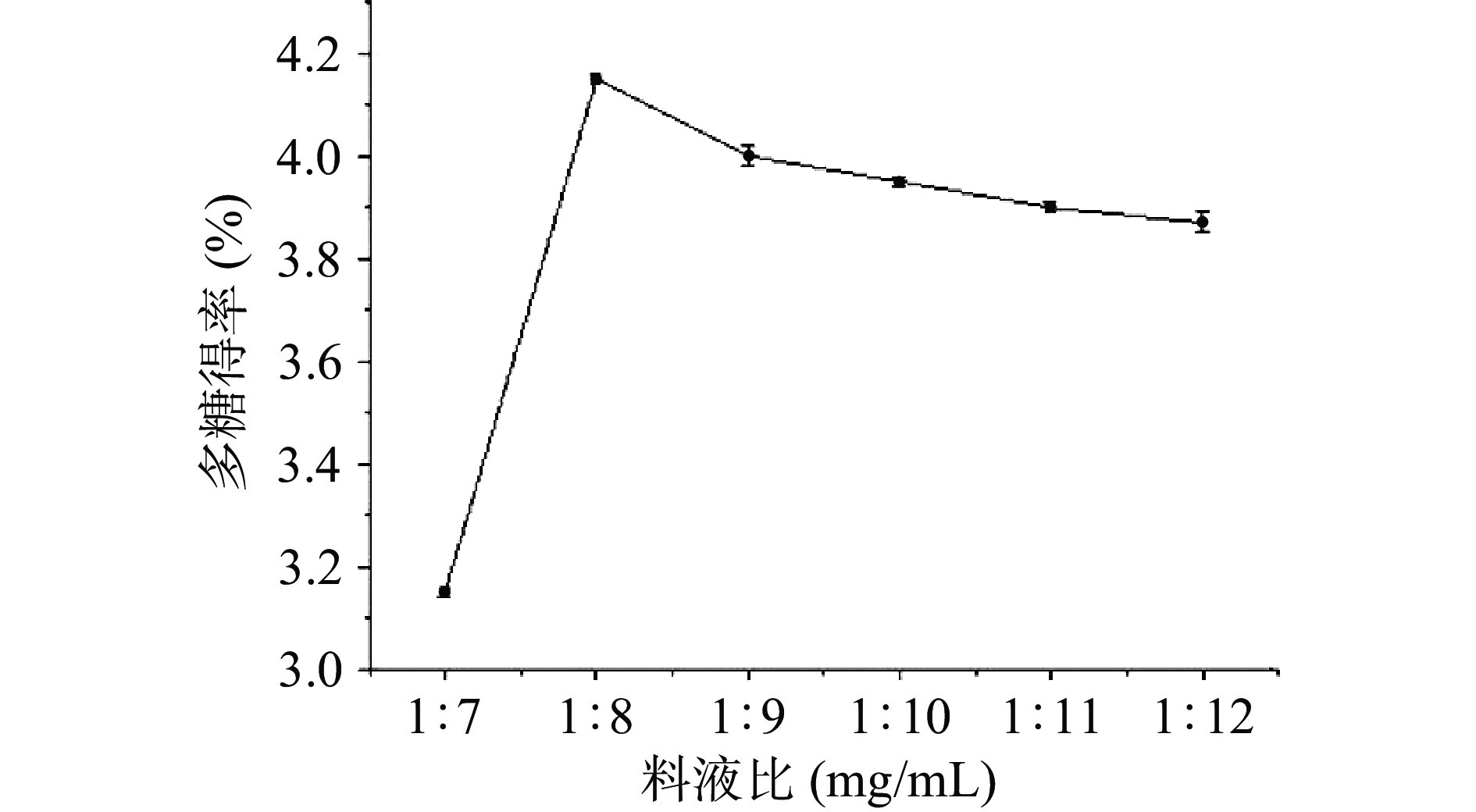
料液比对海参肠多糖的影响如图4所示。随着料液比的增加,多糖得率逐渐增加。在料液比为1:8(mg/mL)时,得率最大,为4.13%。当料液比超过1:9(mg/mL)时,多糖提率逐渐下降。因此,在海参肠多糖提取过程中,1:8(mg/mL)为最佳料液比。料液比过低,会导致多糖提取不完全,相反,料液比过高也会浪费原料,并增加多糖提取液浓缩分离难度[27]。杨东达[1]利用未干燥海参内脏提取粗多糖时料液比为1:30(g/mL),原料中水分含量对多糖提取料液比具有重要影响。
2.3 响应面试验设计与结果
实验设计及结果见表3,回归模型方差分析见表4。利用Design-Expert DX10 software软件进行试验结果分析得到多元回归方程:Y=4.14+0.35X1+8.63X2+5.13X3+2.32X4−0.03X1X2−0.03X1X3−0.02X1X4−0.45X2X3−0.10X2X4−0.01X3X4−0.03X12−1.38X22−0.26X32−0.05X42,其中R2=0.9443,R2Adj=0.9378,由方差分析可知回归方程模型极显著(P<0.01),说明该模型的可信度水平大于99.90%;失拟项不显著(P>0.05),说明此模型与实际拟合较好,实验方法可靠,所得方程与实际拟合中非正常误差所占比例较小,因此可以用此回归方程代替真实实验点分析实验结果。同时由海参肠多糖得率的回归系数检验值F的大小可知,在实验范围内,各因素对海参肠多糖得率影响的大小顺序依次为:X4(料液比)>X3(提取时间)>X2(提取次数)>X1(提取温度)。
表 3 响应面设计及结果Table 3. Design and results of response surface实验号 X1 X2 X3 X4 Y多糖得率(%) 1 0 1 0 −1 3.525 2 −1 0 1 0 3.962 3 0 −1 0 −1 3.535 4 0 0 −1 −1 3.435 5 0 0 0 0 4.397 6 0 −1 −1 0 3.157 7 0 0 0 0 4.477 8 0 −1 1 0 3.937 9 0 1 −1 0 3.528 10 −1 −1 0 0 3.537 11 0 0 0 0 4.546 12 1 0 1 0 3.875 13 0 0 −1 1 4.529 14 0 0 0 0 4.258 15 1 −1 0 0 3.998 16 0 1 0 1 3.867 17 1 0 0 −1 3.978 18 −1 0 −1 0 3.514 19 −1 0 0 −1 3.425 20 −1 1 0 0 3.625 21 0 −1 0 1 4.472 22 1 0 0 1 3.983 23 1 1 0 0 3.537 24 −1 0 0 1 4.275 25 0 1 1 0 3.411 26 0 0 0 0 4.233 27 0 0 1 −1 3.712 28 1 0 −1 0 3.604 29 0 0 1 1 4.260 表 4 响应面二次模型多糖得率的方差和回归系数分析Table 4. Analysis of variance and regression coefficient of polysaccharide yield in response surface quadratic model方差来源 平方和 自由度 均方 F值 P值 显著性 模型 2.61 14 0.19 34.74 <0.0001 ** X1 0.03 1 0.03 6.33 0.0247 * X2 0.05 1 0.05 8.61 0.0109 * X3 0.30 1 0.30 55.47 <0.0001 ** X4 0.69 1 0.69 128.63 <0.0001 ** X1X2 0.08 1 0.08 14.03 0.0022 ** X1X3 0.00 1 0.08 1.47 0.2456 X1X4 0.18 1 0.18 33.31 <0.0001 ** X2X3 0.20 1 0.20 37.67 <0.0001 ** X2X4 0.00 1 0.00 1.77 0.2050 X3X4 0.00 1 0.00 0.10 0.7549 X12 0.14 1 0.14 26.47 0.0001 ** X22 0.78 1 0.78 144.80 <0.0001 ** X32 0.44 1 0.44 81.22 <0.0001 ** X42 0.02 1 0.02 3.03 0.1039 残差 0.08 14 0.01 失拟项 0.06 10 0.005 1.12 0.4960 纯误差 0.02 4 0.004 总和 2.68 28 注:*P<0.05表示差异显著;**P<0.01表示差异极显著。 2.4 各因素之间的交互作用
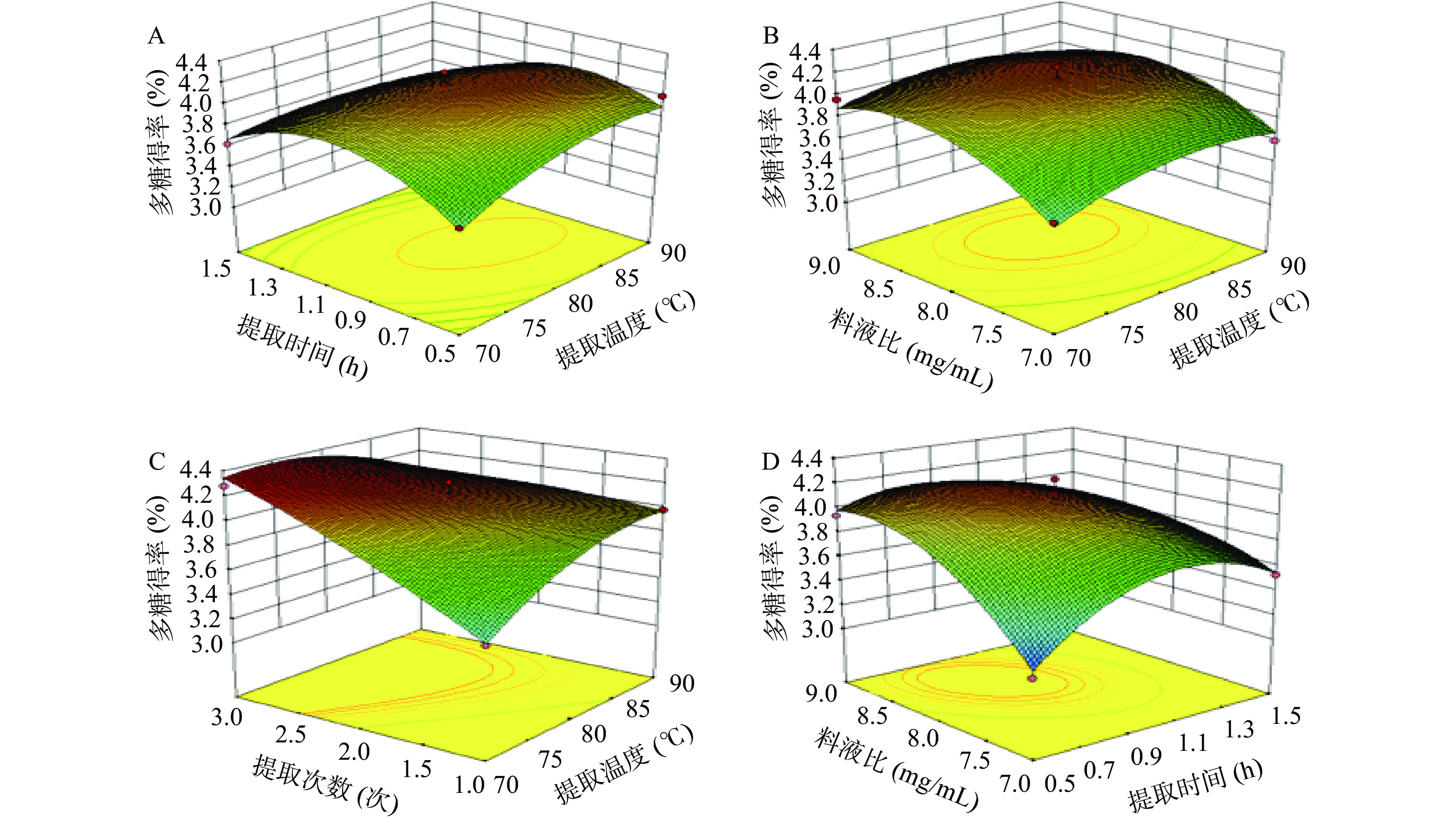
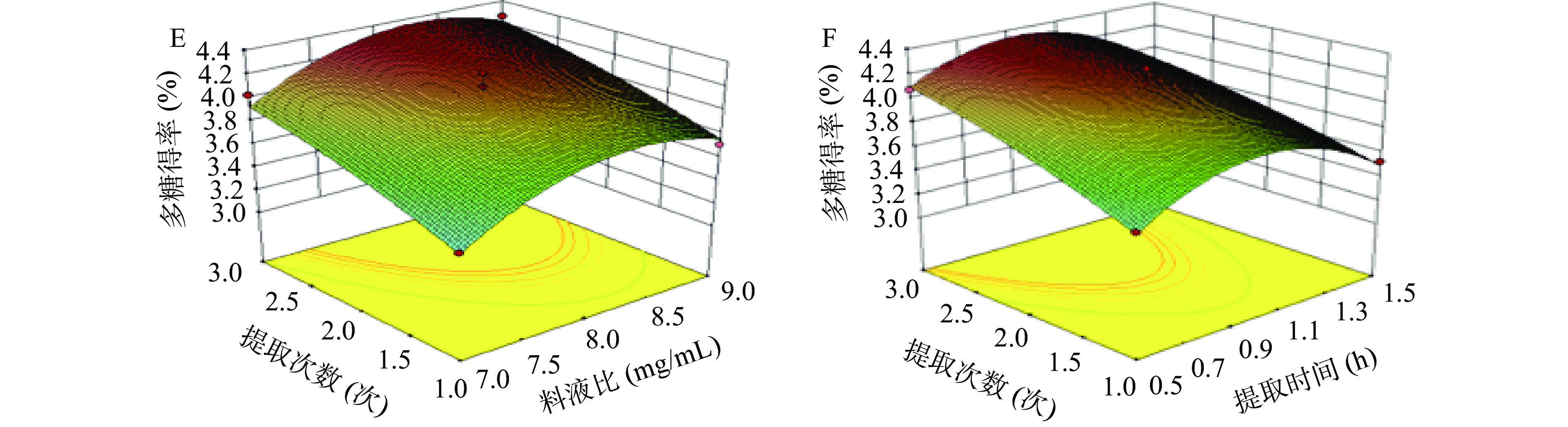
提取海参肠多糖各因素间交互作用见图5。通过响应曲面立体图可以清晰地看出各因素之间的相互作用对多糖得率的影响作用。
提取温度和提取时间的交互关系如图5A所示,等高线图接近圆形,表明提取温度和提取时间之间交互作用不明显并且对多糖提取得率影响不显著;图5B显示了料液比与提取温度的交互作用,当提取时间和提取次数一定时,等高线图形状接近椭圆形,表明料液比和提取温度之间交互作用对多糖得率影响显著;在图5C中,当提取时间和料液比一定时,随着提取次数和提取温度的增加,提取次数和提取温度之间交互作用显著;由图5D可知等高线接近圆形,表明料液比和提取时间交互作用不显著;图5E所示,等高线图图形接近圆形,表明提取次数和料液比的交互关系不显著;从图5F中可以看出,交互曲面整体近似拱形曲面,且曲面纵向跨度较大,表明提取次数和提取时间之间交互作用对多糖得率影响显著。
经响应面优化后最优条件为:提取温度81.70 ℃,提取时间1.16 h,料液比1:8.56(mg/mL),提取次数2次,模型预测海参肠多糖提取得率为4.486%。依据实际操作条件,将工艺修正为提取温度80 ℃,提取次数2次,提取时间1 h,料水比1:8(mg/mL),得到实测多糖得率为4.43%±0.17%。
2.5 海参肠多糖的理化性质分析
2.5.1 海参肠多糖分子量的测定
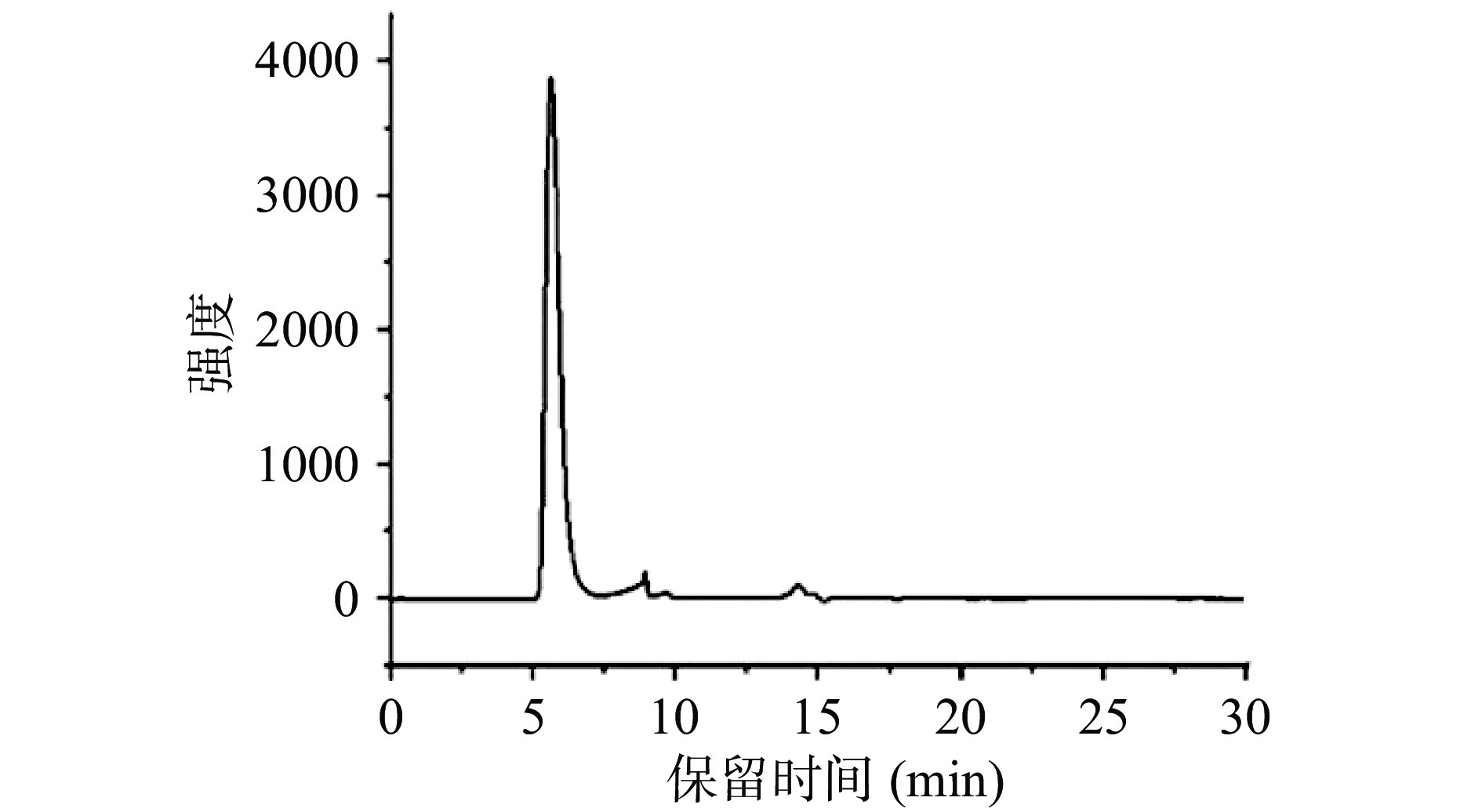
海参肠多糖的分子量分布如图6所示。由于海参肠中含有大量蛋白质,为了鉴定海参肠多糖纯度,测定水提海参肠多糖中总糖含量和蛋白质含量,结果分别为86.69%±0.32%和6.34%±0.47%,表明绝大部分蛋白质已去除。将海参肠多糖出峰时间代入分子量标准曲线,得出海参肠多糖的平均分子量为4.91×106 Da。朱启源[26]利用酶解法海参内脏中得到两个组分多糖,分子量分别为1.81×105和2.09×105 Da。因此,提取方法的不同对多糖结构具有重要影响。酶解方法在提取多糖的同时,对多糖结构产生破坏,降低多糖分子量。本研究中海参肠多糖多分散性指数(Mw/Mn)为1.017,从其多分散性指标来看,该多糖为均质多糖[22]。
2.5.2 单糖组分分析结果
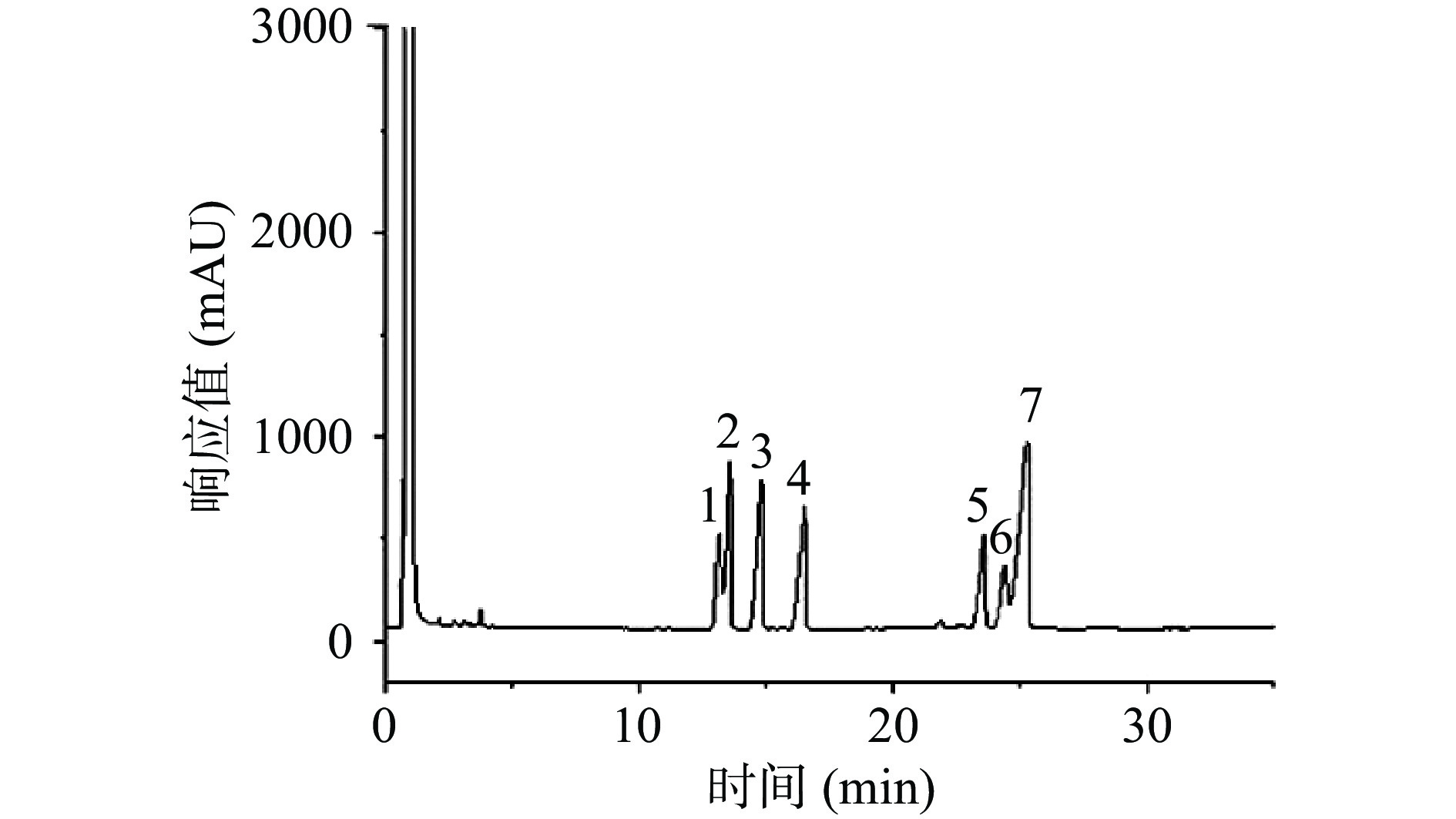
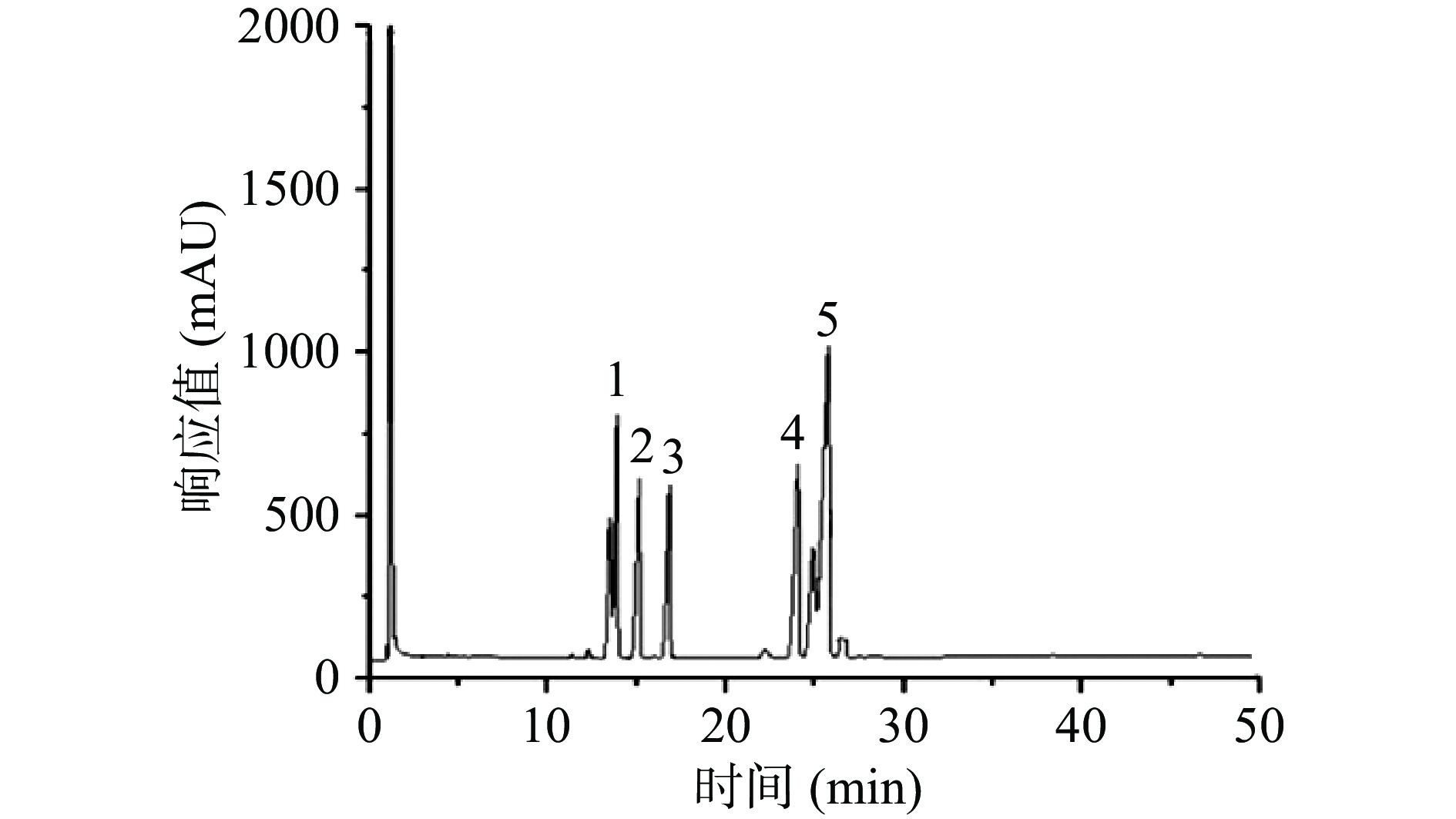
将海参肠多糖的各峰保留时间与单糖标准品的保留时间对比可知,海参肠多糖主要由五种不同的单糖组成,包括甘露糖、阿拉伯糖、半乳糖、葡萄糖和岩藻糖(表5、图7~图8)。根据峰面积、校正因子及单糖相对分子质量计算海参肠多糖各单糖的摩尔百分比分别为22.3:19.31:11.78:3.22:42.57。从单糖组成来看,海参肠多糖主要由岩藻糖、甘露糖和阿拉伯糖组成,含有部分半乳糖和葡萄糖。目前对海参多糖研究较多的为肠壁多糖,主要由氨基糖醛酸、氨基半乳糖和岩藻糖组成,并包含微量的甘露糖和阿拉伯糖。其中岩藻糖存在α-岩藻糖硫酸酯残基和β-岩藻糖硫酸酯残基两种形式,是一种酸性粘多糖[28-29]。本研究中海参肠多糖组成中含有大量的岩藻糖,符合海参多糖的特征。
表 5 单糖组成结果Table 5. Results of monosaccharide composition组成 保留时间(min) 峰面积 摩尔百分比(%) 甘露糖 13.582 816323 22.026 阿拉伯糖 14.856 1301867 19.305 半乳糖 16.524 598443 11.783 葡萄糖 24.439 257006 3.219 岩藻糖 25.344 904806 42.568 2.5.3 海参肠多糖热力学性质分析
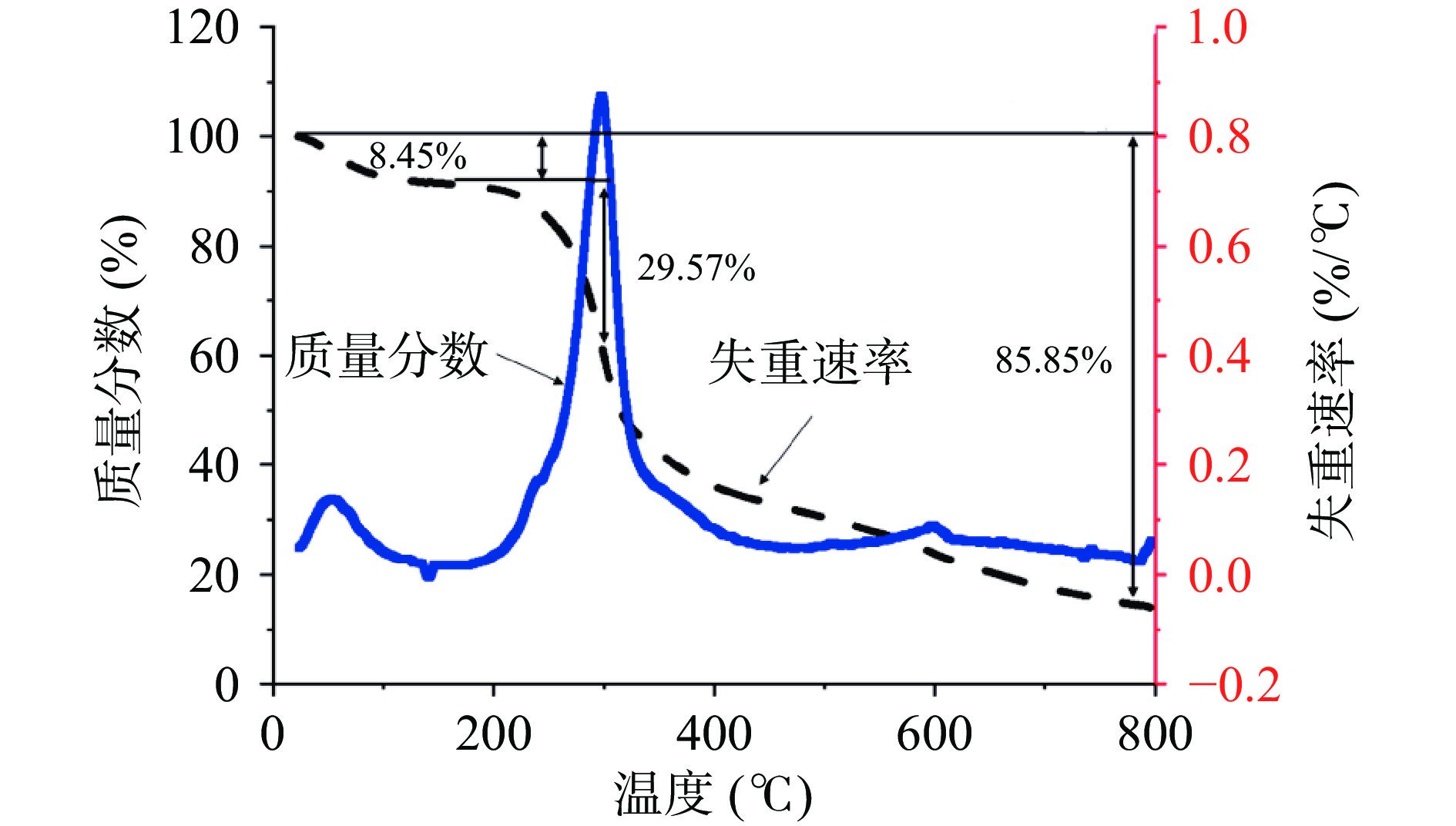
热重分析过程中的质量损失及分解温度如图9所示。在30~150 ℃的温度范围内,海参肠多糖的质量出现损失,这可能是由于失去了自由水和结合水[1]。温度在200~400 ℃范围内,质量损失率最大,达到88.42%,这可能是由于多糖的结构发生崩解,从而导致质量损失增加[30]。在海参内脏多糖热力学实验中发现多糖热崩解温度约为240 ℃,低于本研究多糖结构热崩解温度,可能是由于多糖结构与组成的不同导致[1]。
2.5.4 海参肠多糖表观形貌分析
采用扫描电镜在不同放大倍数下(500×、1000×、2000×)对海参肠多糖的形貌结构进行分析(图10),结果表明,海参肠多糖表面由椭圆形颗粒组成,但在500×倍数下,颗粒不明显;1000×和2000×倍数下颗粒聚集。表面由球形颗粒或椭圆形颗粒构成了一个网状层,这种表面结构为聚合物之间的连接提供了可能[31]。同样,在放大倍数较大时(5000×),海参内脏多糖也表现出了不规则的球状结构[1],与本研究结果相近。
3. 结论
本文利用热水提取法提取海参肠多糖,通过单因素实验和响应面优化得到最佳提取条件为:提取时间1 h、提取温度80 ℃、提取次数2次、料液比1:8(mg/mL),在此条件下多糖的平均得率为4.43%。由理化性质分析结果可知,海参肠多糖为均质多糖,分子量较大。海参肠多糖主要由五种不同的单糖组成,包括甘露糖、阿拉伯糖、半乳糖、葡萄糖和岩藻糖。当加热到800 ℃时,海参肠多糖的重量损失达到85.46%,且当温在309 ℃时,海参肠多糖的结构发生崩解。海参肠多糖是由球形颗粒或椭圆形颗粒构成的网状层,这种表面结构有益于聚合物之间的连接,本研究为海参废弃物资源利用提供科学基础和理论依据。
-
表 1 响应面因素水平设计
Table 1 Factors and levels of response surface analysis
水平 因素 X1提取温度
(℃)X2提取次数
(次)X3提取时间
(h)X4料液比
(mg/mL)-1 70 1 0.5 1:7 0 80 2 1.0 1:8 1 90 3 1.5 1:9 表 2 海参肠原料组分(%)
Table 2 Ingredients of sea cucumber intestines raw material (%)
组分 脂肪 蛋白质 多糖 水分 灰分 含量 0.96±0.14 72.89±0.11 6.84±0.02 10.03±0.30 3.95±0.10 表 3 响应面设计及结果
Table 3 Design and results of response surface
实验号 X1 X2 X3 X4 Y多糖得率(%) 1 0 1 0 −1 3.525 2 −1 0 1 0 3.962 3 0 −1 0 −1 3.535 4 0 0 −1 −1 3.435 5 0 0 0 0 4.397 6 0 −1 −1 0 3.157 7 0 0 0 0 4.477 8 0 −1 1 0 3.937 9 0 1 −1 0 3.528 10 −1 −1 0 0 3.537 11 0 0 0 0 4.546 12 1 0 1 0 3.875 13 0 0 −1 1 4.529 14 0 0 0 0 4.258 15 1 −1 0 0 3.998 16 0 1 0 1 3.867 17 1 0 0 −1 3.978 18 −1 0 −1 0 3.514 19 −1 0 0 −1 3.425 20 −1 1 0 0 3.625 21 0 −1 0 1 4.472 22 1 0 0 1 3.983 23 1 1 0 0 3.537 24 −1 0 0 1 4.275 25 0 1 1 0 3.411 26 0 0 0 0 4.233 27 0 0 1 −1 3.712 28 1 0 −1 0 3.604 29 0 0 1 1 4.260 表 4 响应面二次模型多糖得率的方差和回归系数分析
Table 4 Analysis of variance and regression coefficient of polysaccharide yield in response surface quadratic model
方差来源 平方和 自由度 均方 F值 P值 显著性 模型 2.61 14 0.19 34.74 <0.0001 ** X1 0.03 1 0.03 6.33 0.0247 * X2 0.05 1 0.05 8.61 0.0109 * X3 0.30 1 0.30 55.47 <0.0001 ** X4 0.69 1 0.69 128.63 <0.0001 ** X1X2 0.08 1 0.08 14.03 0.0022 ** X1X3 0.00 1 0.08 1.47 0.2456 X1X4 0.18 1 0.18 33.31 <0.0001 ** X2X3 0.20 1 0.20 37.67 <0.0001 ** X2X4 0.00 1 0.00 1.77 0.2050 X3X4 0.00 1 0.00 0.10 0.7549 X12 0.14 1 0.14 26.47 0.0001 ** X22 0.78 1 0.78 144.80 <0.0001 ** X32 0.44 1 0.44 81.22 <0.0001 ** X42 0.02 1 0.02 3.03 0.1039 残差 0.08 14 0.01 失拟项 0.06 10 0.005 1.12 0.4960 纯误差 0.02 4 0.004 总和 2.68 28 注:*P<0.05表示差异显著;**P<0.01表示差异极显著。 表 5 单糖组成结果
Table 5 Results of monosaccharide composition
组成 保留时间(min) 峰面积 摩尔百分比(%) 甘露糖 13.582 816323 22.026 阿拉伯糖 14.856 1301867 19.305 半乳糖 16.524 598443 11.783 葡萄糖 24.439 257006 3.219 岩藻糖 25.344 904806 42.568 -
[1] 杨东达. 海参内脏多糖的分离、结构鉴定、免疫活性及其应用研究[D]. 泉州: 华侨大学, 2020 YANG D D. Isolation, structure identification, immune activity and application of visceral polysaccharide from sea cucumber[D]. Quanzhou: Overseas Chinese University, 2020.
[2] YUAN W, LIU C, WANG X, et al. Evaluation and analysis of nutritional composition for different parts of sea cucumber Apostichopus joponicus[J]. Sci Technol Food Industry,2010,31(5):348−350.
[3] BORDBAR S, ANWAR F, SAARI N. High-value components and bioactives from sea cucumbers for functional foods-a review[J]. Marine Drugs,2011,9(10):1761−1805. doi: 10.3390/md9101761
[4] BLANEY T, JEFFREY M. Nutritional composition and antioxidant properties of protein hydrolysates prepared from echinoderm byproducts[J]. International Journal of Food Science & Technology,2010,45(1):147−154.
[5] HUSNI A, JEON J S, UM B H, et al. Tyrosinase inhibition by water and ethanol extracts of a far eastern sea cucumber, Stichopus japonicus[J]. Journal of the Science of Food & Agriculture,2011,91(9):1541−1547.
[6] WANG Y, KANG W, XIN S, et al. Analysis study of trace elements in abalone and sea cucumber[J]. Spectroscopy & Spectral Analysis,2009,29(2):511−514.
[7] GAO F, YANG H, XU Q, et al. Effect of water temperature on digestive enzyme activity and gut mass in sea cucumber Apostichopus japonicus (Selenka), with special reference to aestivation[J]. Chinese Journal of Oceanology and Limnology,2009,27(4):714−722. doi: 10.1007/s00343-009-9202-3
[8] YAN F, TIAN X, DONG S, et al. Isolation, selection and characterization of low-temperature organic-pollutant-degrading bacteria in sea cucumber ponds[J]. Journal of Fishery Sciences of China,2013,19(4):626−634. doi: 10.3724/SP.J.1118.2012.00626
[9] JIANG Y, WANG Y, MAI K, et al. Effects of different microbes on fermenting feed for sea cucumber (Apostichopus japonicus)[J]. Journal of Ocean University of China,2015,14(5):873−880. doi: 10.1007/s11802-015-2591-3
[10] WANG J, FU J, XU L, et al. Involvement of the PI3K/Akt pathway in the hypoglycemic effects of sea cucumber Apostichopus japonicas in diabetic rats[J]. Journal of Shenzhen University Science & Engineering,2011,28(2):172−177.
[11] LIU H, KO W, HU M. Hypolipidemic effect of glycosaminoglycans from the sea cucumber, Metriatylascabrar, in rats fed a cholesterol-supplemented diet[J]. Journal of Agricultural and Food Chemistry,2002,50(12):3602−3606. doi: 10.1021/jf020070k
[12] PANGESTUTI R, ARIFIN Z. Medicinal and health benefit effects of functional sea cucumbers[J]. Journal of Traditional and Complementary Medicine,2017,8(3):341−351.
[13] 杨佳洪, 黄义松, 魏好程, 等. 海参内脏酶解工艺条件的优化[J]. 食品工业科技,2017,38(3):180−185. [YANG J H, HUANG Y S, WEI H C, et al. Optimization of enzymatic hydrolysis conditions of sea cucumber viscera[J]. Science and Technology of Food Industry,2017,38(3):180−185. doi: 10.13386/j.issn1002-0306.2017.03.026 [14] 陈涛. 3种仿刺参多糖的提取纯化和抗氧化研究[D]. 上海: 上海海洋大学, 2010 CHEN T. Study on extraction, purification and antioxidation of three polysaccharides from Stichopus japonicus[D]. Shanghai: Shanghai Ocean University, 2010.
[15] 韦豪华, 张红玲, 李兴太. 海参化学成分及生物活性研究进展[J]. 食品安全质量检测学报,2017,8(6):2054−2061. [WEI H H, ZHANG H L, LI X T. Research progress on chemical constituents and biological activities of sea cucumber[J]. Journal of Food Safety and Quality Inspection,2017,8(6):2054−2061. doi: 10.3969/j.issn.2095-0381.2017.06.019 [16] 汤奎. 不同色型刺参营养成分分析及多糖的生物活性研究[D]. 咸阳: 西北农林科技大学, 2021 TANG K. Analysis of nutrient components of sea cucumber with different color types and study on biological activity of polysaccharides[D]. Xianyang: Northwest Agricultural and Forestry University, 2021.
[17] 杨涛, 万端极, 吴正奇, 等. 海参内脏制备海参多肽工艺优化及其抗氧化测定[J]. 食品科技,2014,39(3):218−222. [YANG T, WAN D J, WU Z Q, et al. Optimization of the preparation process of sea cucumber polypeptide from the viscera of sea cucumber and its antioxidant assay[J]. Food Technology,2014,39(3):218−222. [18] 孙俊乐, 顾相瑞, 李梦瑶, 等. 响应面法优化三颗针多糖提取工艺[J]. 当代化工研究,2021(23):128−132. [SUN J L, GU X R, LI M Y, et al. Optimization of extraction process of polysaccharide from Sanjiezhen by response surface methodology[J]. Contemporary Chemical Research,2021(23):128−132. doi: 10.3969/j.issn.1672-8114.2021.23.043 [19] ROBYT J F, BEMIS S. Use of the autoanalyzer for determining the blue value of the amylose iodine complex and total carbohydrate by phenol sulfuric acid[J]. Analytical Biochemistry,1967,19(1):56−60. doi: 10.1016/0003-2697(67)90133-9
[20] NISHA P, THANGAVEL M. Isolation and characterization of exopolysaccharide from biofilm producing marine bacteria[J]. World Journal of Pharmaceutical Sciences,2014:846−853.
[21] ZHU J, CHEN Z, CHEN L, et al. Comparison and structural characterization of polysaccharides from natural and artificial seenriched green tea[J]. International Journal of Biological Macromolecules,2019,130:388−398. doi: 10.1016/j.ijbiomac.2019.02.102
[22] YUN L Y, WU T, LIU R, et al. Structural variation and microrheological properties of a homogeneous polysaccharide from wheat germ[J]. Journal of Agricultural and Food Chemistry,2018,66(11):2977−2987. doi: 10.1021/acs.jafc.7b04730
[23] CHEN C, YOU L J, ABBASI A M, et al. Optimization for ultrasound extraction of polysaccharides from mulberry fruits with antioxidant and hyperglycemic activity in vitro[J]. Carbohydrate Polymers,2015,130:122−132. doi: 10.1016/j.carbpol.2015.05.003
[24] 张睿聪. 海参多糖的提取纯化、理化性质及活性的研究[D]. 天津: 天津科技大学, 2020. ZHANG R C. Studies on the extraction, purification, physicochemical properties and activity of sea cucumber polysaccharides[D]. Tianjin: Tianjin University of Science and Technology, 2020.
[25] WU Y, YI L, LI E, et al. Optimization of glycyrrhiza polysaccharide liposome by response surface methodology and its immune activities[J]. International Journal of Biological Macromolecules,2017,102:68−77. doi: 10.1016/j.ijbiomac.2017.04.006
[26] 朱启源. 两种海参多糖组分的制备及其改善大鼠2型糖尿病作用研究[D]. 广州: 华南理工大学, 2020 ZHU Q Y. Preparation of two sea cucumber polysaccharide components and their effects on improving type 2 diabetes in rats[D]. Guangzhou: South China University of Technology, 2020.
[27] 胡蕾, 叶鹏, 彭子木, 等. 蒸汽爆破麦胚多糖提取工艺优化及其理化性质研究[J]. 食品工业科技,2021,42(1):149−155. [HU L, YE P, PENG Z M, et al. Optimization of extraction process and physicochemical properties of polysaccharides from wheat germ by steam explosion[J]. Science and Technology of Food Industry,2021,42(1):149−155. doi: 10.13386/j.issn1002-0306.2020040256 [28] 陈涛, 张健, 王茂剑. 木瓜蛋白酶提取仿刺参消化道多糖[J]. 食品科学,2010,31(20):226−229. [CHEN T, ZHANG J, WANG M J. Extraction of Stichopus japonicus digestive tract polysaccharides by papain[J]. Food Science,2010,31(20):226−229. [29] 林威威, 张健, 王茂剑, 等. 仿刺参肠道多糖的纯化及理化分析[J]. 食品科学,2011,32(17):118−122. [LIN W W, ZHANG J, WANG M J, et al. Purification and physicochemical analysis of intestinal polysaccharide of sea cucumber[J]. Food Science,2011,32(17):118−122. [30] ZHANG L, ZUO B, WU P, et al. Ultrasound effects on the acetylation of dioscorea starch isolated from Dioscorea zingiberensis C. H. Wright[J]. Chemical Engineering & Processing Process Intensification,2012,54(4):29−36.
[31] LIU X, XU S, DING X, et al. Structural characteristics of Medicago Sativa L. polysaccharides and Se-modified polysaccharides as well as their antioxidant and neuroprotective activities[J]. International Journal of Biological Macromolecules,2019,147(46):1099−1106.






 下载:
下载:

 下载:
下载:
