Optimization of Activated Carbon Decolorization Process of Water- and Alkali-Extracted Polysaccharides from Cordyceps taii
-
摘要: 目的:以贵州特色药用真菌戴氏虫草为实验材料,探究其水提多糖和碱提多糖的活性炭脱色工艺。方法:选取活性炭用量、脱色时间、脱色温度和脱色pH进行单因素实验,在此基础上通过四因素三水平正交试验分别对两种多糖活性炭脱色的最佳工艺进行优选。结果:戴氏虫草水提多糖和碱提多糖的最佳脱色条件分别为活性炭用量1.5和2 g/100 mL,脱色时间10和30 min,脱色温度50和70 ℃,脱色pH为4和8。各自最优条件下,水提多糖的脱色率和多糖保留率分别为92.12%±0.45%和73.46%±0.33%,碱提多糖的脱色率和多糖保留率分别为75.67%±0.66%和56.72%±0.47%。结论:活性炭吸附法对戴氏虫草水提多糖和碱提多糖具有明显的脱色效果,且多糖保留率高。该脱色工艺简单高效,成本低廉,适合工业化应用。Abstract: Objective: Cordyceps taii is a kind of characteristic medical fungus resource in Guizhou. In this study, the decolorization process of activated carbon for water- and alkali-extracted polysaccharides from C. taii was explored.
Methods: Based on the single factor experiment of active carbon dosage, decolorization time, decolorization temperature and decolorization pH, the optimum decolorization processes of two kinds of polysaccharide with active carbon were optimized by four factors on three levels orthogonal experiment. Results: Optimal decolorization technology of water- and alkali-extracted polysaccharides were as follows: Active carbon dose were 1.5 and 2 g/100 mL, decolorization time were 10 and 30 min, decolorization temperature were at 50 and 70 °C, decolorization pH were at 4 and 8, respectively. Under the optimal conditions, the decolorization rate and the retention rate of water-extracted polysaccharides were 92.12%±0.45% and 73.46%±0.33%, and the decolorization rate and the retention rate of alkali-extracted polysaccharides were 75.67%±0.66% and 56.72%±0.47%, respectively. Conclusion: Active carbon adsorption had significant decolorization effect on water- and alkali-extracted polysaccharides from C. taii, and the retention rates of polysaccharides were both high. The decolorization process was simple, efficient, low cost and suitable for industrial application. -
戴氏虫草(Cordyceps taii)是1991年由我国学者梁宗琦教授等在贵州省首次发现、鉴定并命名的虫草类真菌,属于子囊菌纲,肉座菌目,麦角菌科,虫草菌属,与传统名贵药用真菌冬虫夏草、蝉花和蛹虫草同属,贵州民间多将其作滋补强壮药用[1]。现代药理研究证明,多糖是戴氏虫草主要活性成分之一,具有免疫调节、抗肿瘤、抗突变、抗辐射、抗氧化等多种药理活性[2-6]。特别是其优良的降血糖和调节血脂的功效[7],使得戴氏虫草多糖在功能食品和生物医药领域具有良好的应用潜力和前景。
多糖在提取纯化时,色素也很容易被提取出来,较深的颜色不仅干扰多糖的纯度,还影响多糖的定性定量、分离纯化及活性方面的研究,所以需要对多糖进行脱色处理[8]。近年来,有关戴氏虫草多糖提取方法的研究已有报道[9],但是针对其提取过程中的脱色研究,特别是对水提多糖和碱提多糖的脱色工艺进行对比研究还未见报道。因此,研究戴氏虫草多糖的脱色工艺对其工业生产和药用研发具有重要意义。目前国内外对多糖脱色的报道较多,但由于多糖来源不同,脱色方法也不尽相同,有H2O2氧化脱色法、金属络合法、离子交换树脂法、吸附法等[10]。H2O2和金属络合会破坏多糖的化学结构,产生杂质留在多糖溶液中,降低多糖的生物活性[11];树脂脱色法操作相对复杂且价格较贵[12-13];活性炭吸附法属于物理吸附,是一种固体表面现象,色素在分子引力或化学键力的作用下,吸附在活性炭表面,从而达到分离的目的[14-16]。活性炭价格便宜,对色素吸附能力较强,且脱色条件温和,不会破坏多糖的化学结构,是工业上较常用的一种多糖脱色材料[17-18]。
因此,本研究通过单因素实验和正交试验对比研究了活性炭对戴氏虫草水提多糖和碱提多糖色素的去除工艺,并确定了两种多糖最佳的脱色纯化工艺条件。研究结果将为戴氏虫草水提多糖和碱提多糖的进一步开发利用奠定基础。
1. 材料与方法
1.1 材料与仪器
戴氏虫草(Cordyceps taii)GYYA 0601菌株 保存在遵义医科大学附属医院医药生物技术研究所,戴氏虫草菌丝体根据前期开发的液体深层培养条件,由本实验室发酵制备。活性炭(粉状炭,食品糖类专业,≥200目) 阿拉丁试剂(上海)有限公司,使用前进行预处理,105 ℃烘干后备用;氯仿、无水乙醇、氢氧化钠、盐酸、硫酸 重庆川东化工(集团)有限公司;正丁醇 天津市富宇精细化工有限公司;苯酚 天津市致远化学试剂有限公司;葡萄糖 北京索莱宝科技有限公司;以上试剂 均为分析纯。
T&J-Ctype 50L全自动生物反应器 上海迪比尔;QHZ-98A摇床 太仓华美;UV2700紫外可见分光光度计 日本岛津;Milli-Q Direct 8超纯水制备系统 默克密理博;N-1100V旋转减压蒸发仪 东京理化;SHZ-III循环水真空泵 上海亚荣;GZX-9070MBE数显鼓风干燥箱 上海博讯;TLE204E电子天平、FE20 pH计 梅特勒-托利多;5810R台式高速冷冻离心机 德国艾本德公司;KQ-500DE超声波清洗机 昆山超声。
1.2 实验方法
1.2.1 戴氏虫草水提多糖和碱提多糖的制备
多糖制备参考实验室前期方法并进行适当调整[7]。提取流程如下:称取干燥的戴氏虫草发酵菌丝体粉末500 g,以料液比1:6加入95%乙醇除脂除杂,重复5次。5000 g离心10 min去除上清,滤渣按料液比1:5加入去离子水,85 ℃水浴提取2 h,间歇搅拌,过滤,此操作重复5次。滤渣回收备用,合并5次滤液,在旋转蒸发仪上浓缩至原体积的1/5,加入4倍体积无水乙醇,4 ℃冰箱中醇沉24 h,5000 g离心10 min收集沉淀,依次用无水乙醇、丙酮洗涤2次。将沉淀用一定体积去离子水溶解,Sevage法[19]除蛋白至水相和氯仿相交界处无明显蛋白层,减压浓缩干燥,得戴氏虫草水提多糖115 g。取之前回收滤渣,按料液比1:5加入0.5 mol/L的氢氧化钠溶液,60 ℃水浴提取2 h,重复5次后合并上清,用0.1 mol/L HCl溶液将上清pH调为7,浓缩。后续操作同水提多糖提取,最终得戴氏虫草碱提多糖70 g。分别称取一定量干燥的戴氏虫草水提多糖和碱提多糖,用去离子水溶解,使两种多糖的浓度均为5 mg/mL,备用。
1.2.2 活性炭脱色单因素实验
选取活性炭用量、脱色时间、脱色温度、脱色pH四个因素[20-22],分别做单因素实验。
1.2.2.1 活性炭用量对脱色率的影响
参考工业上活性炭脱色的用量范围,设置1、1.5、2、2.5、3和3.5 g/100 mL六个活性炭用量水平。水提多糖和碱提多糖溶液初始pH分别为4.86和7.23,用0.1 mol/L HCl溶液将水提多糖和碱提多糖pH分别调节为4和7,在40 ℃条件下振荡脱色40 min,过滤除炭后测定上清液吸光值。
1.2.2.2 脱色时间对脱色率的影响
设置10、20、30、40、50和60 min六个脱色时间,水提多糖活性炭用量为2 g/100 mL,用0.1 mol/L HCl溶液调节pH为4,碱提多糖活性炭用量为3 g/100 mL,用0.1 mol/L HCl溶液调节pH为7,然后在40 ℃条件下振荡脱色,过滤除炭后测定上清液吸光值。
1.2.2.3 脱色温度对脱色率的影响
设置30、40、50、60、70、80 ℃六个脱色温度,水提多糖活性炭用量为2 g/100 mL,用0.1 mol/L HCl溶液调节pH为4,振荡脱色20 min,碱提多糖活性炭用量为3 g/100 mL,用0.1 mol/L HCl溶液调节pH为7,振荡脱色50 min,过滤除炭后测定上清液吸光值。
1.2.2.4 脱色pH对脱色率的影响
设置3、4、5、6、7和8六个脱色pH,水提多糖活性炭用量为2 g/100 mL,在70 ℃条件下振荡脱色20 min,碱提多糖活性炭用量3 g/100 mL,在70 ℃条件下振荡脱色50 min离心,过滤除炭后测定上清液吸光值。
1.2.3 活性炭脱色正交试验
按单因素实验的结果,选择确定活性炭用量(A)、脱色时间(B)、脱色温度(C)、脱色pH(D)的3个水平,按L9(34)安排正交试验,过滤除去活性炭后检测分析多糖脱色率和多糖保留率,进行极差和方差分析,确定多糖脱色工艺的最优组合[23]。正交试验因素和水平见表1和表2。
表 1 戴氏虫草水提多糖脱色正交试验的因素水平设计Table 1. Factor levels design for orthogonal decolorization experiment of water-extracted polysaccharides from C. taii因素 水平(水提多糖) 1 2 3 A活性炭用量(g/100 mL) 1.5 2 2.5 B脱色时间(min) 10 20 30 C脱色温度(℃) 50 60 70 D脱色pH 3 4 5 表 2 戴氏虫草碱提多糖脱色正交试验的因素水平设计Table 2. Factor levels design for orthogonal decolorization experiment of alkali-extracted polysaccharides from C. taii因素 水平(碱提多糖) 1 2 3 A活性炭用量(g/100 mL) 2 2.5 3 B脱色时间(min) 30 40 50 C脱色温度(℃) 50 60 70 D脱色pH 6 7 8 1.2.4 脱色率的计算
参考文献选择420 nm处测定戴氏虫草水提和碱提多糖脱色前后的吸光值,计算脱色率[24-25]。
脱色率(%)=A脱色前−A脱色后A脱色前×100 式中:A脱色前表示多糖溶液脱色前420 nm处吸光值;A脱色后表示多糖溶液脱色后420 nm处吸光值。
1.2.5 多糖测定方法和多糖保留率的计算
多糖含量采用苯酚-硫酸法[26]测定,用移液管分别吸取葡萄糖对照品溶液0.0、0.2、0.4、0.6、0.8、1.0 mL,置于25 mL具塞试管中,再分别加入蒸馏水至体积为1.0 mL,加入1.0 mL 5%的苯酚和5 mL硫酸,混合均匀后置于30 ℃水浴锅中显色20 min,以葡萄糖标准液在490 nm下的吸光值为纵坐标,溶液浓度(μg/mL)为横坐标作图得标准曲线:Y=0.01113X-0.0094,R2=0.9991。糖浓度在10~100 μg/mL范围内,戴氏虫草水提和碱提多糖脱色前后分别使用苯酚-硫酸法测定490 nm处吸光值,经公式换算为糖浓度,计算多糖保留率。
多糖保留率(%)=M脱色后多糖M脱色前多糖×100 式中:M脱色后多糖表示多糖溶液脱色后糖浓度,μg/mL;M脱色前多糖表示多糖溶液脱色前糖浓度,μg/mL。
1.2.6 脱色效果评价
考虑脱色率和多糖保留率两项指标,且二者对于脱色影响效果一样,故本实验数据处理采用加权评分法,将各项指标除以该列最大值再乘以100为该项得分[27]。对脱色率和多糖保留率两项指标进行加权求和,设定二者的权重系数均为0.5,即得:综合评分=0.5×脱色率+0.5×多糖保留率。
1.3 数据处理
采用SPSS 21.0对正交试验结果进行极差和方差分析。*表示P<0.05显著性差异,**表示P<0.01极显著差异。
2. 结果与分析
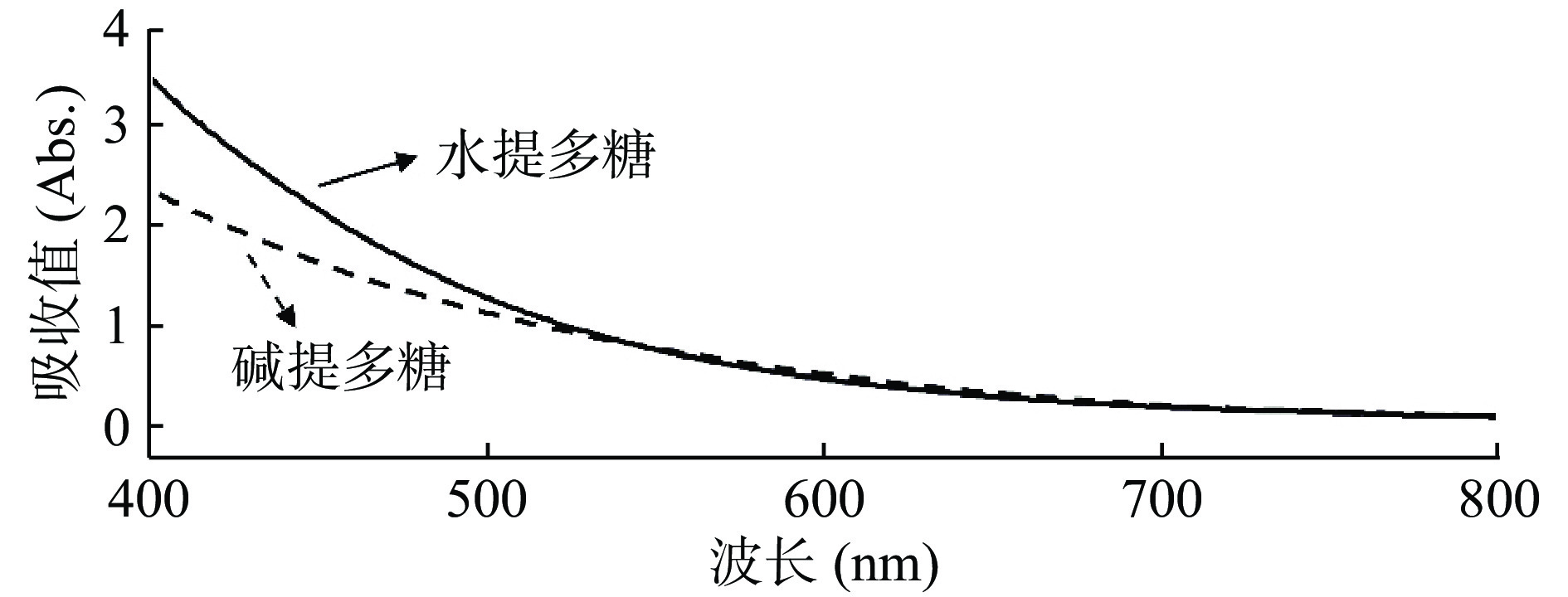
2.1 脱色率计算所用波长的确定
对多糖溶液在400~800 nm波长范围内进行扫描(见图1)。结果显示两种多糖溶液在可见光区均无最大吸收峰,且从400~800 nm范围内吸收呈逐渐下降趋势。根据两种多糖溶液脱色前均为黄褐色,故从溶液的互补色考虑,并参考蛹虫草多糖和香菇多糖等真菌多糖的脱色方法,选择420 nm处测定戴氏虫草水提和碱提多糖脱色前后的吸光值,计算脱色率。
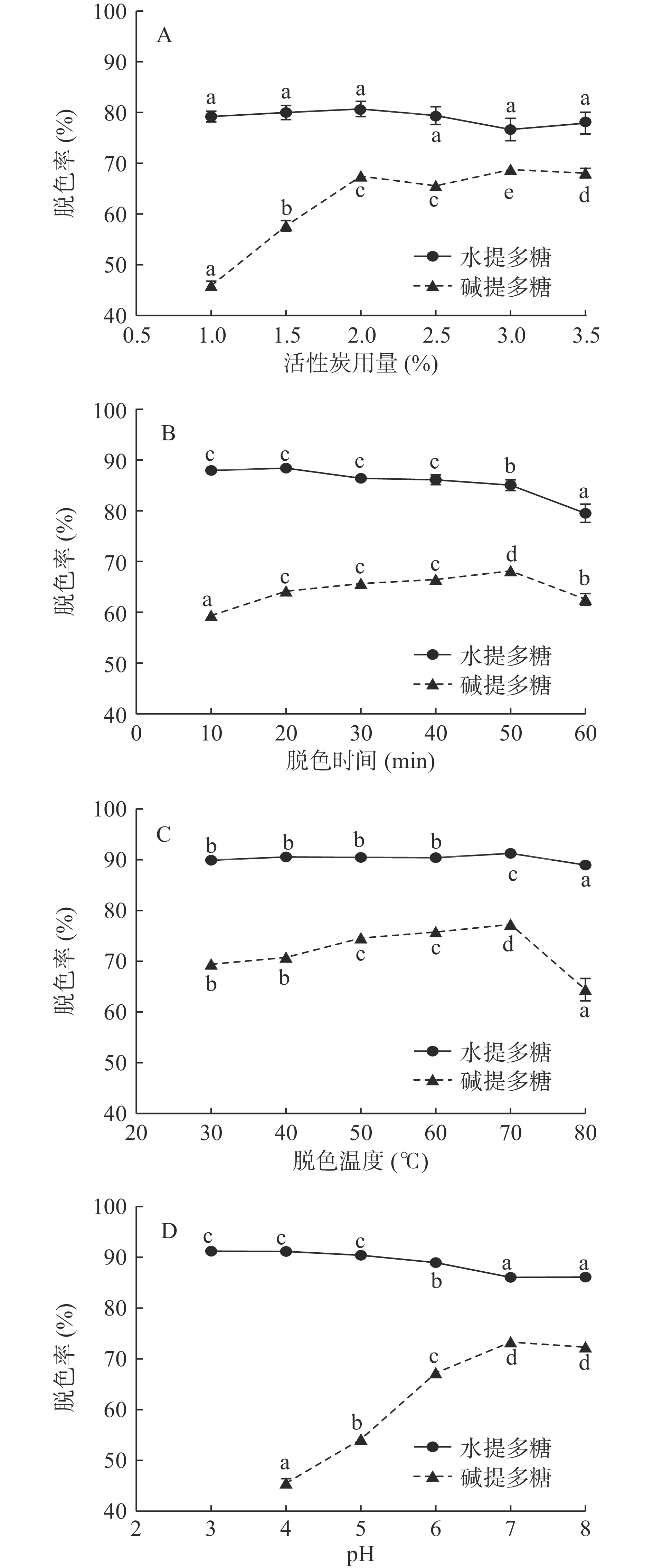
2.2 活性炭用量的影响
图2A显示随着活性炭用量的增加,水提多糖脱色率变化范围较小,在2 g/100 mL用量时脱色率最大为80.72%;碱提多糖随着活性炭用量的增加,脱色率显著提高(P<0.05),当用量超过2 g/100 mL以后,随着炭量的增加,脱色率几乎不再增加,可能原因是脱色过程已趋于平衡,在3 g/100 mL用量时脱色率最大为68.77%。故后续单因素实验,水提和碱提多糖脱色的活性炭用量分别选择2和3 g/100 mL。
2.3 脱色时间的影响
图2B显示,脱色时间20 min时,水提多糖脱色率最高为89.02%,随着时间继续增加,脱色率逐渐降低;碱提多糖脱色率随着时间增加逐渐升高,在50 min达到最大值为68.16%。活性炭脱色是一个动态可逆的吸附过程,由结果可知:相比于碱提多糖,活性炭对水提多糖色素的吸附饱和时间更短;随着吸附时间继续延长,色素可能从活性炭解析至溶液中,反而影响脱色效果。后续单因素实验,水提和碱提多糖脱色的时间分别选择20和50 min。
2.4 脱色温度的影响
图2C显示,随着温度的增加,水提多糖脱色率变化范围较小,在70 ℃时脱色率达到最大为91.56%;碱提多糖随着温度增加,脱色率逐渐升高,同样在70 ℃时达到最大为77.27%,当温度继续升高脱色率急剧下降。分析可能原因,温度增高可降低多糖溶液粘度,使其更易进入活性炭空隙,有利于色素的附着;但吸附作为物理过程,过高的温度也会降低活性炭对色素的吸附,且可能破坏多糖结构影响其活性[28]。后续单因素实验,水提和碱提多糖脱色温度均采用70 ℃。
2.5 脱色pH的影响
图2D显示,pH为3和4时,水提多糖脱色率分别为91.22%和91.16%,pH继续升高,脱色率逐渐降低;当调节碱提多糖溶液pH为3时出现沉淀,故从pH为4开始分析,结果显示碱提多糖脱色率随pH增加逐渐升高,在7时达到最大值为73.32%。由此推测,过低的pH可能影响碱提多糖的溶解度,使其不易进入活性炭空隙,从而影响色素的吸附脱除。
2.6 戴氏虫草水提多糖脱色最佳工艺条件的确定
综合4种因素对戴氏虫草水提多糖脱色效果的影响,采用L9(34)安排正交试验。因素水平表见表1,具体实验设计及实验结果见表3,并对正交试验结果进行了极差和方差分析,相关结果见表4和表5。
表 3 戴氏虫草水提多糖活性炭脱色正交试验结果Table 3. Results of orthogonal on decolorization of water-extracted polysaccharides from C. taii with activated carbon实验号 A B C D 脱色率(%) 多糖保留率(%) 综合评分 1 1 1 1 1 88.40±0.43 70.94±1.31 97.83±0.23 2 1 2 2 2 90.39±0.26 70.92±0.93 98.91±0.22 3 1 3 3 3 88.42±0.44 71.92±1.03 98.52±0.13 4 2 1 2 3 91.11±0.23 65.76±0.43 95.72±0.40 5 2 2 3 1 90.25±0.40 59.53±0.62 90.91±0.15 6 2 3 1 2 88.43±0.56 67.13±0.75 95.20±0.15 7 3 1 3 2 90.83±0.34 61.84±0.69 92.84±0.28 8 3 2 1 3 89.48±0.52 59.99±0.31 90.81±0.39 9 3 3 2 1 90.92±0.54 50.80±0.09 85.21±0.51 表 4 戴氏虫草水提多糖正交试验极差分析Table 4. Extremum difference analysis of orthogonal experiment of water-extracted polysaccharide from C. taii指标 A B C D 脱色率(%) k1 89.07 90.11 88.77 89.86 k2 89.93 90.04 90.81 89.88 k3 90.41 89.26 89.83 89.67 R 1.34 0.86 2.04 0.21 主要因素 C>A>B>D 最优水平 A3 B1 C2 D2 多糖保留率(%) k1 71.26 66.18 66.02 60.43 k2 64.14 63.48 62.49 66.63 k3 57.54 63.28 64.43 65.89 R 13.60 3.10 3.54 6.30 主要因素 A>D>C>B 最优水平 A1 B1 C1 D2 综合评分 k1 98.42 95.46 94.61 91.32 k2 93.94 93.55 93.28 95.65 k3 89.62 92.98 94.09 95.02 R 8.80 2.48 1.33 4.33 主要因素 A>D>C>B 最优水平 A1 B1 C1 D2 表 5 戴氏虫草水提多糖活性炭脱色率方差分析Table 5. Variance analysis of decolorization rate of water-extracted polysaccharide from C. taii with activated carbon指标 因素 SS df MS F 显著性 脱色率(%) A 8.33 2.00 4.17 15.03 <0.01 B 18.70 2.00 9.35 33.74 <0.01 C 4.00 2.00 2.00 7.22 <0.01 D 0.25 2.00 0.12 0.45 > 0.05 多糖保留率(%) A 847.26 2.00 423.63 711.97 <0.01 B 47.17 2.00 23.59 39.64 <0.01 C 56.18 2.00 28.09 47.21 <0.01 D 206.64 2.00 103.32 173.64 <0.01 综合评分 A 348.22 2.00 174.11 1903.47 <0.01 B 30.43 2.00 15.22 166.36 <0.01 C 8.11 2.00 4.06 44.35 <0.01 D 98.33 2.00 49.17 537.50 <0.01 注:SS,sum of squares of deviation from mean,离均差平方和;df,degree of freedom,自由度;MS,mean square,均方差;F,F-statistics,F值;P>0.05不显著,P<0.05显著,P<0.01极显著;表8同。 表4脱色率极差R结果显示C > A > B > D,即影响戴氏虫草水提多糖脱色率的因素依次是温度(C)、活性炭用量(A)、时间(B)和pH(D),A、B和C因素具有极显著差异(P<0.01),D因素无显著性差异(P>0.05);最优组合为A3B1C2D2,即活性炭用量2.5 g/100 mL、吸附时间10 min、吸附温度60 ℃、吸附pH为4。多糖保留率极差R结果显示A>D>C>B,即影响戴氏虫草水提多糖保留率的因素依次是活性炭用量(A)、pH(D)、温度(C)和时间(B),4个因素均具有极显著差异(P<0.01);最优组合为A1B1C1D2,即活性炭用量1.5 g/100 mL、吸附时间10 min、吸附温度50 ℃、吸附pH为4。从表4极差结果分析,活性炭用量和脱色温度对脱色率和多糖保留率的影响是相反的,活性炭用量越大,脱色率越高而多糖保留率越低,脱色温度在60 ℃时,脱色率最高而多糖保留率最低;脱色时间对脱色率和多糖保留率的影响均成负相关,随着脱色时间延长,脱色率和多糖保留率均呈下降趋势;pH变化对脱色率影响不显著,但随着pH增加多糖保留率呈先增后减的趋势,当pH为4时,多糖保留率最高。
综合考评,选择多糖脱色率和多糖保留率二者的综合评分来确定最佳工艺条件。综合评分R结果显示A>D>B>C,即影响因素依次是活性炭用量(A)、pH(D)、时间(B)和温度(C),四个因素均具有极显著差异(P<0.01);最优组合与多糖保留率一致,为A1B1C1D2,即活性炭用量1.5 g/100 mL、吸附时间10 min、吸附温度50 ℃、吸附pH为4。
2.7 戴氏虫草碱提多糖脱色最佳工艺条件的确定
戴氏虫草碱提多糖脱色的L9(34)正交试验各因素水平表见表2,具体实验设计及实验结果、极差和方差分析结果分别见表6、表7和表8。
表 6 戴氏虫草碱提多糖活性炭脱色正交试验结果Table 6. Results of orthogonal on decolorization of alkali-extracted polysaccharides from C. taii with activated carbon实验号 A B C D 脱色率(%) 多糖保留率(%) 综合评分 1 1 1 1 1 65.81±0.54 52.13±0.79 91.10±0.50 2 1 2 2 2 64.15±0.72 49.80±0.72 87.85±0.54 3 1 3 3 3 73.60±0.59 53.51±0.53 97.40±0.24 4 2 1 2 3 67.77±0.72 45.89±0.77 86.53±0.66 5 2 2 3 1 70.65±0.39 40.02±0.42 82.90±0.19 6 2 3 1 2 70.48±0.60 40.82±1.94 83.54±1.58 7 3 1 3 2 77.63±0.31 35.21±0.68 82.90±0.33 8 3 2 1 3 61.45±1.11 42.16±0.67 78.97±1.01 9 3 3 2 1 73.09±0.83 32.58±0.53 77.52±0.71 表 7 戴氏虫草碱提多糖正交试验极差分析Table 7. Extremum difference analysis of orthogonal experiment of alkali-extracted polysaccharide from C. taii指标 A B C D 脱色率(%) k1 67.85 70.40 65.91 69.85 k2 69.63 65.41 68.34 70.75 k3 70.72 72.39 73.96 67.61 R 2.87 6.97 8.04 3.14 主要因素 C>B>D>A 最优水平 A3 B3 C3 D2 多糖保留率(%) k1 51.82 44.41 45.04 41.58 k2 42.24 43.99 42.76 41.94 k3 36.65 42.31 42.91 47.19 R 15.17 2.10 2.28 5.61 主要因素 A>D>C>B 最优水平 A1 B1 C1 D3 综合指标(%) k1 92.12 86.84 84.54 83.84 k2 84.32 83.24 83.97 84.76 k3 79.80 86.15 87.73 87.64 R 12.32 3.60 3.77 3.80 主要因素 A>D>C>B 最优水平 A1 B1 C3 D3 表 8 戴氏虫草碱提多糖活性炭脱色率方差分析Table 8. Variance analysis of decolorization rate of alkali-extracted polysaccharide from C. taii with activated carbon指标 因素 SS df MS F 显著性 脱色率(%) A 37.87 2.00 18.94 27.09 <0.01 B 232.42 2.00 116.21 166.24 <0.01 C 306.57 2.00 153.28 219.28 <0.01 D 47.07 2.00 23.53 33.67 <0.01 多糖保留率(%) A 1058.85 2.00 529.43 664.99 <0.01 B 29.13 2.00 14.57 18.30 <0.01 C 22.33 2.00 11.17 14.02 <0.01 D 177.24 2.00 88.62 111.31 <0.01 综合评分 A 699.18 2.00 349.59 606.77 <0.01 B 65.69 2.00 32.84 57.00 <0.01 C 74.35 2.00 37.18 64.52 <0.01 D 70.64 2.00 35.32 61.31 <0.01 表7脱色率极差R结果显示C>B>D>A,即影响戴氏虫草碱提多糖脱色率的因素依次是温度(C)、时间(B)、pH(D)和活性炭用量(A),4个因素均具有极显著差异(P<0.01);最优组合为A3B3C3D2,即活性炭用量3 g/100 mL、吸附时间50 min、吸附温度70 ℃、吸附pH为7。多糖保留率极差R结果显示A>D>C>B,即影响戴氏虫草碱提多糖保留率的因素依次是活性炭用量(A)、pH(D)、温度(C)和时间(B),4个因素均具有极显著差异(P<0.01);最优组合为A1B1C1D3,即活性炭用量2 g/100 mL、吸附时间30 min、吸附温度50 ℃、吸附pH为8。从极差结果分析,活性炭用量对碱提多糖脱色率和多糖保留率的影响相反,活性炭用量越大,脱色率越高而多糖保留率越低;脱色时间与多糖保留率成负相关,随着时间增加,多糖保留率呈下降趋势,但多糖脱色率在脱色时间为40 min时最低;脱色温度与多糖脱色率成正相关,温度越高脱色率越高,而多糖保留率在脱色温度为50 ℃时最高;脱色pH与多糖保留率成正相关,pH越高多糖保留率越高,但多糖脱色率的最大值出现在pH为7时。
碱提多糖综合评分R结果显示A>D>C>B,即影响因素依次是活性炭用量(A)、pH(D)、温度(C)和时间(B),四个因素均具有极显著差异(P<0.01);最优组合为A1B1C3D3,即活性炭用量2 g/100 mL、吸附时间30 min、吸附温度70 ℃、吸附pH为8。
2.8 脱色工艺的验证
使用优化后的条件,即:水提多糖活性炭用量1.5 g/100 mL、吸附时间10 min、吸附温度50 ℃、吸附pH为4;碱提多糖活性炭用量2 g/100 mL、吸附时间30 min、吸附温度70 ℃、吸附pH为8,分别对二者进行脱色,并测定脱色率和多糖保留率,验证上述脱色工艺。结果戴氏虫草水提多糖脱色率和多糖保留率分别为92.12%±0.45%和73.46%±0.33%,戴氏虫草碱提多糖脱色率和多糖保留率分别为75.67%±0.66%和56.72%±0.47%,表明优化后的工艺条件稳定可行。
3. 讨论与结论
脱色作为多糖提取纯化过程中的重要一环,对多糖的结构鉴定和活性评价起着至关重要的影响[29-30]。目前,活性炭因其优良的脱色效果、低廉的成本和简单易行的操作工艺,且具有安全无毒、易去除的特性,仍广泛应用于天然活性多糖的脱色,如地参多糖[31]和马齿蕨多糖[32]。刘福岗等[33]分别使用活性炭法和双氧水法对白屈菜多糖的脱色工艺进行了对比研究,证明尽管双氧水法的多糖脱色率优于活性炭法(74.82% vs 70.51%),但多糖保留率明显劣于活性炭法(80.57% vs 95.79%),其原因可能源于双氧水对多糖结构的破坏。课题组前期也将D101型大孔树脂用于戴氏虫草水提多糖的纯化,该方法多糖脱色率和多糖保留率分别为64.84%和53.43%[9];而采用本研究开发的活性炭脱色法,即活性炭用量1.5 g/100 mL、吸附时间10 min、吸附温度50 ℃、吸附pH为4,戴氏虫草水提多糖的脱色率和多糖保留率分别为92.12%和73.46%,均优于大孔树脂法且操作过程更加简单。另外研究结果显示,戴氏虫草水提多糖的活性炭脱色效果明显优于碱提多糖,推测可能原因为水提多糖脱色的最佳pH为酸性,而碱提多糖脱色的最佳pH为碱性。文献报道活性炭对带电物质(如阴离子)的吸附能力与溶液pH有关:弱酸性物质在低pH时带电较少或不带电,较易被吸附,高pH时电荷较强,不利于吸附,故在酸性条件或偏酸性样品中活性炭具有更好的脱色效果[34]。
综上,本研究通过考察活性炭用量、脱色时间、脱色温度和脱色pH四个因素,对戴氏虫草水提和碱提多糖的活性炭脱色工艺进行了优化,证明活性炭吸附法对戴氏虫草水提多糖和碱提多糖具有显著的脱色效果,且多糖保留率高,该脱色工艺简单高效,成本低廉,适合工业化应用。
-
表 1 戴氏虫草水提多糖脱色正交试验的因素水平设计
Table 1 Factor levels design for orthogonal decolorization experiment of water-extracted polysaccharides from C. taii
因素 水平(水提多糖) 1 2 3 A活性炭用量(g/100 mL) 1.5 2 2.5 B脱色时间(min) 10 20 30 C脱色温度(℃) 50 60 70 D脱色pH 3 4 5 表 2 戴氏虫草碱提多糖脱色正交试验的因素水平设计
Table 2 Factor levels design for orthogonal decolorization experiment of alkali-extracted polysaccharides from C. taii
因素 水平(碱提多糖) 1 2 3 A活性炭用量(g/100 mL) 2 2.5 3 B脱色时间(min) 30 40 50 C脱色温度(℃) 50 60 70 D脱色pH 6 7 8 表 3 戴氏虫草水提多糖活性炭脱色正交试验结果
Table 3 Results of orthogonal on decolorization of water-extracted polysaccharides from C. taii with activated carbon
实验号 A B C D 脱色率(%) 多糖保留率(%) 综合评分 1 1 1 1 1 88.40±0.43 70.94±1.31 97.83±0.23 2 1 2 2 2 90.39±0.26 70.92±0.93 98.91±0.22 3 1 3 3 3 88.42±0.44 71.92±1.03 98.52±0.13 4 2 1 2 3 91.11±0.23 65.76±0.43 95.72±0.40 5 2 2 3 1 90.25±0.40 59.53±0.62 90.91±0.15 6 2 3 1 2 88.43±0.56 67.13±0.75 95.20±0.15 7 3 1 3 2 90.83±0.34 61.84±0.69 92.84±0.28 8 3 2 1 3 89.48±0.52 59.99±0.31 90.81±0.39 9 3 3 2 1 90.92±0.54 50.80±0.09 85.21±0.51 表 4 戴氏虫草水提多糖正交试验极差分析
Table 4 Extremum difference analysis of orthogonal experiment of water-extracted polysaccharide from C. taii
指标 A B C D 脱色率(%) k1 89.07 90.11 88.77 89.86 k2 89.93 90.04 90.81 89.88 k3 90.41 89.26 89.83 89.67 R 1.34 0.86 2.04 0.21 主要因素 C>A>B>D 最优水平 A3 B1 C2 D2 多糖保留率(%) k1 71.26 66.18 66.02 60.43 k2 64.14 63.48 62.49 66.63 k3 57.54 63.28 64.43 65.89 R 13.60 3.10 3.54 6.30 主要因素 A>D>C>B 最优水平 A1 B1 C1 D2 综合评分 k1 98.42 95.46 94.61 91.32 k2 93.94 93.55 93.28 95.65 k3 89.62 92.98 94.09 95.02 R 8.80 2.48 1.33 4.33 主要因素 A>D>C>B 最优水平 A1 B1 C1 D2 表 5 戴氏虫草水提多糖活性炭脱色率方差分析
Table 5 Variance analysis of decolorization rate of water-extracted polysaccharide from C. taii with activated carbon
指标 因素 SS df MS F 显著性 脱色率(%) A 8.33 2.00 4.17 15.03 <0.01 B 18.70 2.00 9.35 33.74 <0.01 C 4.00 2.00 2.00 7.22 <0.01 D 0.25 2.00 0.12 0.45 > 0.05 多糖保留率(%) A 847.26 2.00 423.63 711.97 <0.01 B 47.17 2.00 23.59 39.64 <0.01 C 56.18 2.00 28.09 47.21 <0.01 D 206.64 2.00 103.32 173.64 <0.01 综合评分 A 348.22 2.00 174.11 1903.47 <0.01 B 30.43 2.00 15.22 166.36 <0.01 C 8.11 2.00 4.06 44.35 <0.01 D 98.33 2.00 49.17 537.50 <0.01 注:SS,sum of squares of deviation from mean,离均差平方和;df,degree of freedom,自由度;MS,mean square,均方差;F,F-statistics,F值;P>0.05不显著,P<0.05显著,P<0.01极显著;表8同。 表 6 戴氏虫草碱提多糖活性炭脱色正交试验结果
Table 6 Results of orthogonal on decolorization of alkali-extracted polysaccharides from C. taii with activated carbon
实验号 A B C D 脱色率(%) 多糖保留率(%) 综合评分 1 1 1 1 1 65.81±0.54 52.13±0.79 91.10±0.50 2 1 2 2 2 64.15±0.72 49.80±0.72 87.85±0.54 3 1 3 3 3 73.60±0.59 53.51±0.53 97.40±0.24 4 2 1 2 3 67.77±0.72 45.89±0.77 86.53±0.66 5 2 2 3 1 70.65±0.39 40.02±0.42 82.90±0.19 6 2 3 1 2 70.48±0.60 40.82±1.94 83.54±1.58 7 3 1 3 2 77.63±0.31 35.21±0.68 82.90±0.33 8 3 2 1 3 61.45±1.11 42.16±0.67 78.97±1.01 9 3 3 2 1 73.09±0.83 32.58±0.53 77.52±0.71 表 7 戴氏虫草碱提多糖正交试验极差分析
Table 7 Extremum difference analysis of orthogonal experiment of alkali-extracted polysaccharide from C. taii
指标 A B C D 脱色率(%) k1 67.85 70.40 65.91 69.85 k2 69.63 65.41 68.34 70.75 k3 70.72 72.39 73.96 67.61 R 2.87 6.97 8.04 3.14 主要因素 C>B>D>A 最优水平 A3 B3 C3 D2 多糖保留率(%) k1 51.82 44.41 45.04 41.58 k2 42.24 43.99 42.76 41.94 k3 36.65 42.31 42.91 47.19 R 15.17 2.10 2.28 5.61 主要因素 A>D>C>B 最优水平 A1 B1 C1 D3 综合指标(%) k1 92.12 86.84 84.54 83.84 k2 84.32 83.24 83.97 84.76 k3 79.80 86.15 87.73 87.64 R 12.32 3.60 3.77 3.80 主要因素 A>D>C>B 最优水平 A1 B1 C3 D3 表 8 戴氏虫草碱提多糖活性炭脱色率方差分析
Table 8 Variance analysis of decolorization rate of alkali-extracted polysaccharide from C. taii with activated carbon
指标 因素 SS df MS F 显著性 脱色率(%) A 37.87 2.00 18.94 27.09 <0.01 B 232.42 2.00 116.21 166.24 <0.01 C 306.57 2.00 153.28 219.28 <0.01 D 47.07 2.00 23.53 33.67 <0.01 多糖保留率(%) A 1058.85 2.00 529.43 664.99 <0.01 B 29.13 2.00 14.57 18.30 <0.01 C 22.33 2.00 11.17 14.02 <0.01 D 177.24 2.00 88.62 111.31 <0.01 综合评分 A 699.18 2.00 349.59 606.77 <0.01 B 65.69 2.00 32.84 57.00 <0.01 C 74.35 2.00 37.18 64.52 <0.01 D 70.64 2.00 35.32 61.31 <0.01 -
[1] 梁宗琦. 中国真菌志[M]. 北京: 科学出版社, 2007 LIANG Z Q. Chinese flora[M]. Beijing: Science Press, 2007.
[2] XIAO J H, XIAO D M, CHEN D X, et al. Polysaccharides from the medicinal mushroom Cordyceps taii show antioxidant and immunoenhancing activities in a D-galactose-induced aging mouse model[J]. Evidence-Based Complementary and Alternative Medicine,2012:273435.
[3] 程萍, 雷艳霞, 刘杰麟. 戴氏虫草多糖诱导肿瘤细胞分化的研究[J]. 贵阳医学院学报,2015,40(8):806−809. [CHENG P, LEI Y X, LIU J L. Study of differentiation of tumor cells induced by Cordyceps taii polysaccharide[J]. Journal of Guiyang Medical College,2015,40(8):806−809. [4] 刘杰麟, 于敏, 查筑红. 戴氏虫草菌丝体水提物对放射损伤小鼠体液免疫的作用[J]. 生命科学研究,2000,4(4):362−366. [LIU J L, YU M, CHA Z H. Protection of water-extract of Cordyceps taii mycelia on humoral immune function in radiated mice[J]. Life Science Research,2000,4(4):362−366. doi: 10.3969/j.issn.1007-7847.2000.04.014 [5] 彭克军, 刘杰麟. 戴氏虫草多糖抗突变活性的研究[J]. 中药材,2008,31(1):86−88. [PENG K J, LIU J L. Study on the antimutagenicity of Cordyceps taii polysaccharide[J]. Journal of Chinese Medicinal Materials,2008,31(1):86−88. doi: 10.3321/j.issn:1001-4454.2008.01.032 [6] 王金彬, 章能胜, 王小董, 等. 戴氏虫草中具清除自由基活性的物质分析[J]. 安徽农业大学学报,2010,37(2):234−237. [WANG J B, ZHANG N S, WANG X D, et al. Analysis of radical scavenging active constituent in Cordyceps taii[J]. Journal of Anhui Agricultural University,2010,37(2):234−237. [7] LIU R M, DAI R, LUO Y, et al. Glucose-lowering and hypolipidemic activities of polysaccharides from Cordyceps taii in streptozotocin-induced diabetic mice[J]. BMC Complementary and Alternative Medicine,2019,19:230. doi: 10.1186/s12906-019-2646-x
[8] 李月, 王昀, 左绍远. 植物多糖脱色工艺研究进展[J]. 现代化工,2018,38(10):31−33,35. [LI Y, WANG Y, ZUO S Y. A review on decolorization technology of plant-based polysaccharides[J]. Modern Chemical Industry,2018,38(10):31−33,35. [9] 肖代敏, 吕纯莉, 曹喻, 等. 大孔吸附树脂分离纯化戴氏虫草多糖工艺研究[J]. 遵义医学院学报,2015,38(5):536−540. [XIAO D M, LÜ C L, CAO Y, et al. Studies on the separation and purification of Metarhizium taii polysaccharide by macroporous adsorption resin[J]. Journal of Zunyi Medical University,2015,38(5):536−540. [10] 文淅菊, 沈承菁, 孔圆圆, 等. 植物多糖脱色脱蛋白工艺及药理作用研究进展[J]. 化工科技,2021,29(6):67−71. [WEN Z J, SHEN C J, KONG Y Y, et al. Research on the decolorization and deproteinization technology of plant polysaccharide and its pharmacological effects[J]. Science & Technology in Chemical Industry,2021,29(6):67−71. doi: 10.3969/j.issn.1008-0511.2021.06.013 [11] WENG V, BRAZINHA C, COELHOSO I M, et al. Decolorization of a corn fiber arabinoxylan extract and formulation of biodegradable films for food packaging[J]. Membranes,2021,11(5):321. doi: 10.3390/membranes11050321
[12] LIANG L, LIU G, YU G, et al. Simultaneous decoloration and purification of crude oligosaccharides from pumpkin (Cucurbita moschata Duch) by macroporous adsorbent resin[J]. Food Chemistry,2019,277:744−752. doi: 10.1016/j.foodchem.2018.10.138
[13] HUANG R, ZHANG Q, YAO H, et al. Ion-exchange resins for efficient removal of colorants in Bis (hydroxyethyl) terephthalate[J]. ACS Omega,2021,6(18):12351−12360. doi: 10.1021/acsomega.1c01477
[14] HASSAN M M, CARR C M. A critical review on recent advancements of the removal of reactive dyes from dyehouse effluent by ion-exchange adsorbents[J]. Chemosphere,2018,209:201−219. doi: 10.1016/j.chemosphere.2018.06.043
[15] SHAO L, SUN Y, LIANG J, et al. Decolorization affects the structural characteristics and antioxidant activity of polysaccharides from Thesium chinense Turcz: Comparison of activated carbon and hydrogen peroxide decolorization[J]. International Journal of Biological Macromolecules,2020,155:1084−1091. doi: 10.1016/j.ijbiomac.2019.11.074
[16] WANG X, CHENG H, YE G, et al. Key factors and primary modification methods of activated carbon and their application in adsorption of carbon-based gases: A review[J]. Chemosphere, 2022, 287(Pt 2): 131995.
[17] 王辉, 句荣辉, 王丽, 等. 活性炭法对柿子粉多糖色素脱除的研究[J]. 农产品加工,2020,8:1−4. [WANG H, JU R H, WANG L, et al. Study on the decolorizing of polysaccharide from persimmon by activated carbon[J]. Farm Products Processing,2020,8:1−4. [18] GAYATHIRI M, PULINGAM T, LEE K T, et al. Activated carbon from biomass waste precursors: Factors affecting production and adsorption mechanism[J]. Chemosphere,2022,294:133764. doi: 10.1016/j.chemosphere.2022.133764
[19] 亓希武, 房海灵, 陈泽群, 等. 桃胶多糖脱蛋白工艺研究[J]. 现代食品,2021(8):104−107. [QI X W, FANG H L, CHEN Z Q, et al. Study on deproteinization process of polysaccharide from peach gum[J]. Modern Food,2021(8):104−107. [20] 徐丹鸿, 冯晓阳. 酸浆果多糖活性炭脱色工艺研究[J]. 现代农业科技,2017(15):248−249,257. [XU D H, FENG X Y. Study on decoloring process of polysaccharide from Physalis alkekengi L. var. franchetii (Mast.) Makino with active carbon[J]. Modern Agricultural Science and Technology,2017(15):248−249,257. doi: 10.3969/j.issn.1007-5739.2017.04.138 [21] 张达成, 秦允荣. 银耳多糖的活性炭脱色工艺研究[J]. 广东化工,2019,46(16):40−42. [ZHANG D C, QIN Y R. Study on decolorization process of activated carbon from Tremella polysaccharide[J]. Guangdong Chemical Industry,2019,46(16):40−42. doi: 10.3969/j.issn.1007-1865.2019.16.018 [22] 项碧华, 李小林. 可溶性大豆多糖活性炭脱色工艺研究[J]. 饮料工业,2017,20(2):12−15. [XIANG B H, LI X L. Study on decoloring technology of soybean soluble polysaccharide with activated carbon[J]. The Beverage Industry,2017,20(2):12−15. doi: 10.3969/j.issn.1007-7871.2017.02.004 [23] 车向前, 常明泉, 陈林, 等. 正交试验法优选白及多糖活性炭脱色工艺[J]. 中国药师,2017,20(8):1370−1373. [CHE X Q, CHANG M Q, CHEN L, et al. Optimization of activated carbon decolorization technology for Bletilla striata polysaccharide by orthogonal test[J]. China Pharmacist,2017,20(8):1370−1373. doi: 10.3969/j.issn.1008-049X.2017.08.010 [24] 吴君, 刘波, 梁伟玲, 等. 大孔树脂对蛹虫草粗多糖的脱色工艺研究[J]. 广州中医药大学学报,2015,32(4):739−744. [WU J, LIU B, LIANG W, et al. Study on decoloration process for crude polysaccharides from Cordyceps militaris Link. By microporous resin[J]. Journal of Guangzhou University of Traditional Chinese Medicine,2015,32(4):739−744. [25] 赵孝先, 高玲, 杨文, 等. 响应面法优化香菇多糖脱色工艺研究[J]. 食品研究与开发,2016,37(11):99−103. [ZHAO X X, GAO L, YANG W, et al. Optimization of decolorization of lentinan using response surface methodology[J]. Food Research and Development,2016,37(11):99−103. doi: 10.3969/j.issn.1005-6521.2016.11.024 [26] 罗春萍, 陆友利, 王星星. 苯酚-硫酸法快速测定多糖方法的优化[J]. 化工管理,2021,3:90−91,94. [LUO C P, LU Y L, WANG X X. Optimization of phenol sulfuric acid method for rapid determination of polysaccharide[J]. Chemical Enterprise Management,2021,3:90−91,94. [27] 于淼, 谢春阳, 姚成龙, 等. 黑果腺肋花楸果粗多糖提取及脱色工艺[J]. 粮食与油脂,2020,33(10):113−116. [YU M, XIE C Y, YAO C L, et al. Extraction and decolorization process of crude polysaccharide from Black chokeberry[J]. Cereals & Oils,2020,33(10):113−116. doi: 10.3969/j.issn.1008-9578.2020.10.029 [28] 许英伟, 肖小年, 刘剑青, 等. 响应面法优化内部沸腾法提取生米藠头多糖[J]. 南昌大学学报 ( 理科版 ) ,2012,36(5):449−452. [XU Y W, XIAO X N, LIU J Q, et al. Optimization of inner ebullition of polysaccharide from Sheng Mi Allium chinense by response surface methodology[J]. Journal of Nanchang University (Natural Science),2012,36(5):449−452. [29] 胡香玉. 多糖提取纯化领域专利技术综述[J]. 科技创新与应用,2016,18:76. [HU X Y. Summary of patented technologies in the field of polysaccharide extraction and purification[J]. Technology Innovation and Application,2016,18:76. [30] 郑霖华, 吴启赐, 陈巧玲, 等. 细梗香草皂苷活性炭脱色工艺及抑菌活性研究[J]. 中国食品添加剂,2021,32(11):67−72. [ZHENG L H, WU Q C, CHEN Q L, et al. Decolorization optimization of saponins from Lysimachia capillipes Hemsl by activated carbon and its antimicrobial activity[J]. China Food Additives,2021,32(11):67−72. [31] 杨申明, 熊正军, 王振吉, 等. 响应面法优化地参多糖脱色工艺及其抗氧化活性研究[J]. 粮食与油脂,2022,35(1):111−115. [YANG S M, XIONG Z J, WANG Z J, et al. Optimization of decolorization technology of Lycopus lucidus Turcz. polysaccharides by response surface methodology and its antioxidant activity[J]. Cereals & Oils,2022,35(1):111−115. doi: 10.3969/j.issn.1008-9578.2022.01.025 [32] 吴光杰, 李玉萍, 李资玲, 等. 马齿蕨多糖的活性炭脱色工艺优选[J]. 中国实验方剂学杂志,2013,19(12):43−45. [WU G J, LI Y P, LI Z L, et al. Optimization of depigmenting technology for polysaccharides from Portulaca oleracea with activated carbon[J]. Chinese Journal of Experimental Traditional Medical Formulae,2013,19(12):43−45. [33] 刘福岗, 冯素香, 张杰, 等. 白屈菜多糖果胶酶提取及脱色工艺的优化[J]. 中成药,2018,40(7):1622−1626. [LIU F G, FENG S X, ZHANG J, et al. Optimization of enzyme extraction and decolorization of Chelidonium majus L. polysaccharide[J]. Chinese Traditional Patent Medicine,2018,40(7):1622−1626. doi: 10.3969/j.issn.1001-1528.2018.07.039 [34] 付学鹏, 杨晓杰. 植物多糖脱色技术的研究[J]. 食品研究与开发,2007,28(11):166−169. [FU X P, YANG X J. Study on decolorization technology of plant polysaccharides[J]. Food Research and Development,2007,28(11):166−169. doi: 10.3969/j.issn.1005-6521.2007.11.051





 下载:
下载:


 下载:
下载:
