Enzymolysis of Fermented Corn Meal to Prepare Natural Umami Flavoring
-
摘要: 本研究以玉米粉为主要原料,利用谷氨酸棒杆菌发酵生产新型天然鲜味料。首先通过单因素实验和正交试验优化玉米粉酶解工艺;然后在摇瓶水平对谷氨酸棒杆菌GL-6发酵产谷氨酸的条件进行优化,确定最佳氮源及含量和最佳玉米粉酶解液添加量,然后在20 L发酵罐水平进行验证,将5%的麦芽糊精加入发酵液上清中喷雾干燥得到鲜味料样品,最后对样品进行成分检测及评定。结果表明,玉米粉最佳酶解工艺为固液比1:4,酶添加量1%,温度90 ℃,时间3 h,在该条件下酶解度DE值达到60.84%;谷氨酸棒杆菌GL-6发酵产谷氨酸的最佳氮源为酵母抽提物FIG12LS 30 g/L,玉米粉酶解液最佳添加量为50%(v/v);天然鲜味料样品MJ谷氨酸含量为43.9 g/100 g,氨基酸总含量为44.8 g/100 g,相较于不添加玉米粉酶解液发酵而得的鲜味料样品CK谷氨酸和氨基酸含量分别提高了24.0%和23.4%。此外,样品MJ富含坚果及咖啡风味的吡嗪类物质,相较于样品CK鲜味含量和营养价值均有提高,风味也更加丰富。本研究为用天然植物原料发酵生产鲜味料提供了新思路,提高了产品的市场竞争力。Abstract: In this study, corn meal was fermented by Corynebacterium glutamicum to produce a new natural flavoring materia. Firstly, the enzymatic hydrolysis process of corn meal was optimized by single factor experiment and orthogonal experiment. Then, the fermentation conditions of C. glutamicum GL-6 were optimized at shaking flask level to determine the best nitrogen source and content and the best addition amount of corn meal enzymolysis solution. Then verification was carried out at the level of 20 L fermenter. 5% Maltodextrin was added into the supernatant of fermentation broth and spray dried to obtain the umami sample. Finally, the composition of the sample was detected and evaluated. The results showed that the optimal enzymatic hydrolysis conditions were solid-liquid ratio 1:4, enzyme dosage 1%, temperature 90 ℃, time 3 h, under which the enzymatic hydrolysis degree DE value reached 60.84%. The optimal nitrogen source for glutamate production by C. glutamicum GL-6 fermentation was yeast extract FIG12LS 30 g/L, and the optimal addition amount of corn meal hydrolysate was 50%(v/v). The content of MJ glutamate was 43.9 g/100 g, and the total content of amino acid was 44.8 g/100 g, which increased by 24.0% and 23.4%, respectively, compared with that of CK without corn meal enzymolysis fermentation. In addition, sample MJ was rich in nutty and coffee-flavored pyrazines. Compared with sample CK, its umami content and nutritional value were improved, and its flavor was richer. This study provides a new idea for the production of umami flavoring by fermentation of natural plant materials and improves the market competitiveness of the product.
-
Keywords:
- natural umami /
- glutamate /
- corn meal /
- enzymatic hydrolysis /
- fermentation /
- orthogonal optimization
-
在食品中添加鲜味料可增强食品的风味特征,如持续性、温和感、浓厚感等[1]。近年来,随着市场巨大消费潜力的释放,传统的鲜味产品已不能满足消费者对健康和新口味的追求,美味、安全、健康、天然的新型发酵调味产品逐渐在国内外成为一种趋势,特别是营养型鲜味调味产品数量逐年增长。目前,我国批准许可使用的鲜味调味料有L-谷氨酸钠(MSG)、5′-鸟苷酸二钠(GMP)、5′-肌苷酸二钠(IMP)、5′-呈味核苷酸二钠、琥珀酸二钠、L-丙氨酸、甘氨酸,以及植物水解蛋白(HVP)、动物水解蛋白(HAP)、酵母抽提物(Yeast extracts)等[2-3]。这几类鲜味调味料中最主要的,应用最广的是L-谷氨酸钠,俗称味精。
谷氨酸的制备方法有多种,主要为蛋白质水解法、合成法和发酵法。发酵法是国内外普遍采用的方法,发酵菌株主要为谷氨酸棒状杆菌(Corynebacterium glutamicum)[4]。我国谷氨酸发酵水平长期居于世界领先水平。谷氨酸发酵基本工艺为淀粉水解制成糖后,配制成发酵培养基发酵生产,然后通过等电等方法分离纯化,再精制成为谷氨酸钠结晶。因传统发酵工艺存在原料来源不清洁、发酵产物杂质多、产物需要纯化等问题,不适合用于天然调味品的生产[5-7]。
以天然植物来源玉米粉进行发酵可实现鲜味料的天然化。玉米粉是指由玉米去麸研磨之后所形成的粉末状物质,里面包含除玉米皮之外的所有成分,如蛋白质、碳水化合物、脂肪、维生素、矿物质等,物产资源丰富,但仅作为粮食而言,经济价值较低,所以对玉米的深加工及多方面的应用尤为重要[8-9]。然而,目前用玉米粉作为原料发酵生产谷氨酸的研究较少,微生物直接利用玉米发酵的效率不高,如果将玉米粉中25%的碳水化合物经淀粉酶酶解后,可作为优质碳源供微生物生长利用。此外,酵母抽提物是发酵工业中的主要原料之一,营养丰富,可以大大提高菌种的生产速率及发酵产品得率,常作为氮源使用。同时酵母抽提物也是一种优良的天然调味料,其主要成分为多肽、氨基酸、呈味核苷酸、B族维生素及微量元素[10-13]。这两者共同发酵制备天然鲜味料,可大大提高发酵生产获得鲜味调味品的可能性,丰富天然鲜味料的营养价值,使其风味更加细腻,口感更加自然、顺畅,同时实现产品天然化。
为提高玉米粉的利用率,生产更加美味、安全、健康、天然的新型鲜味调味品。本文以玉米粉为原料利用谷氨酸棒杆菌发酵生产天然鲜味料,首先通过单因素实验和正交试验优化玉米粉酶解工艺,然后在摇瓶水平对谷氨酸棒杆菌GL-6发酵产谷氨酸的条件进行优化,确定最佳氮源及含量和最佳玉米粉酶解液添加量,接着在20 L发酵罐中进行验证,并将发酵液离心后喷雾干燥制成天然鲜味产品,最后评价其指标。本研究以期得到绿色、健康、安全,且更具市场竞争力的新产品,为天然植物来源为底物发酵生产新型鲜味料提供了新思路。
1. 材料与方法
1.1 材料与仪器
谷氨酸棒杆菌GL-6(Corynebacterium glutamicum GL-6) 由湖北工业大学发酵工程教育部重点实验室保藏;玉米粉 河南省璞阳县英伦玉米加工有限公司;淀粉酶AHA-400(酶活4000 U/mL) 安琪酵母股份有限公司;酵母抽提物FA31、FIG12LS、FM888、KA02、KU012 安琪酵母股份有限公司;食品级麦芽糊精(纯度98%) 浙江一诺生物科技有限公司。
玉米粉具体成分如表1所示。
表 1 玉米粉营养成分Table 1. Nutritional composition of corn meal项目 每100克 营养参考值 能量 1452 kJ 17% 蛋白质 7.9 g 13% 脂肪 3.0 g 5% 碳水化合物 75.6 g 25% 钠 0 mg 0% 谷氨酸 3 mg − 20 L发酵罐 上海保兴生物设备工程有限公司;SBA-40X型生物传感仪 济南延和生物科技有限公司;V-1300型可见分光光度计 上海美析仪器有限公司;HH-2型电子恒温不锈钢水浴锅 常州国华电器有限公司;FE28型pH计 梅特勒-托利多仪器(上海)有限公司;Ultimate 3000型高效液相色谱(high performance liquid chromatography,HPLC)仪 赛默飞世尔科技(中国)有限公司;HP6890/5975C型气相-质谱联用仪(GC-MS) 美国安捷伦公司;自动微萃取装置及萃取纤维 美国安捷伦公司;DB-WAX色谱柱 美国安捷伦公司;B-290型微型喷雾干燥器 瑞士步琦公司。
1.2 实验方法
1.2.1 玉米粉酶解工艺
称取100 g玉米粉,加入纯水充分溶解,确保溶解完全后总体积为1 L,加入占玉米粉干基1%的淀粉酶AHA-400,于90 ℃水浴锅中酶解2 h,酶解过程中每隔0.5 h用玻璃棒搅拌1 min。
1.2.2 单因素实验
本研究使用的玉米粉主要成分如表1所示,为提高玉米粉的利用率,用淀粉酶AHA-400进行酶解,选取固液比、酶添加量(以原料质量为基准)、温度和时间这四个主要影响酶解度(DE值)大小的因素进行单因素实验[14]。在酶添加量1%,温度90 ℃,酶解时间2 h的条件下,研究固液比1:9、1:4、1:2.3、1:1.5和1:1对酶解度的影响;在温度90 ℃,酶解时间2 h,固液比1:4的条件下,研究酶添加量0.5%、1%、2%、3%和4%对酶解度的影响;在酶添加量1%,酶解时间2 h,固液比1:4的条件下,研究酶解温度75、80、85、90和95 ℃对酶解度的影响;在酶添加量1%,温度85 ℃,固液比1:4的条件下,研究酶解时间1、2、3、4和5 h对酶解度和相对酶解率的影响。
1.2.3 正交试验
以单因素实验结果为依据,选择四因素三水平作L9(34)正交试验,因素水平见表2,以DE值为考察目标分析最佳酶解工艺方案。
表 2 正交试验因素水平设计Table 2. Factors and levels of the orthogonal tests水平 因素 A固液比 B酶添加量(%) C温度(℃) D时间(h) 1 1:4 1 85 2 2 1:2.3 3 90 3 3 1:1.5 4 95 4 1.2.4 菌种活化方法
将实验室斜面保藏的C. glutamicum GL-6接种1环到装有5 mL的液体培养基的西林瓶中活化,在32 ℃,200 r/min恒温培养振荡器培养24 h得到一级种子液。再将一级种子液按2%的接种量接种至装有50 mL液体培养基的250 mL摇瓶中培养,在30 ℃,200 r/min条件下培养24 h得到二级种子液。将二级种子液按2%的接种量接种到后续实验所用的培养基中,置于32 ℃,200 r/min恒温培养振荡器进行摇瓶培养。
1.2.5 玉米粉酶解液培养基组分优化及添加量的确定
根据预实验确定培养基组分为:葡萄糖22 g/L,蛋白胨10 g/L,琥珀酸1 g/L,尿素10 g/L,七水硫酸镁0.4 g/L,蛋氨酸0.5 g/L,磷酸氢二钾2.4 g/L,生物素0.3 mg/L,一水硫酸锰10 mg/L,维生素B1 0.2 mg/L。用HCl或NaOH调节pH至7.0,灭菌条件为121 ℃,20 min。在此基础上对氮源及其含量进行优化,采用不同型号的酵母抽提物FA31、FIG12LS、FM888、KA02、KU012替换培养基中的蛋白胨(peptone),在其他实验条件不变的情况下进行培养,比较C. glutamicum GL-6的生长情况及生产谷氨酸的能力,确定最佳氮源,并对其含量进行优化。
最佳酶解液添加量的确定:玉米粉酶解液用水稀释至不同浓度,在培养基优化后的基础上,在摇瓶水平添加不同含量玉米粉酶解液(0%、25%、50%、75%、100%)进行发酵,比较C. glutamicum GL-6生产谷氨酸的能力。
1.2.6 玉米粉酶解液培养条件
摇瓶培养条件:在250 mL摇瓶中装入50 mL液体培养基,接入2%的二级种子液,培养温度32 ℃,200 r/min,培养48 h。
20 L发酵罐培养条件:装液量60%,接入8%的二级种子液,通气量1.2 L/min,罐压0.03 MPa,消泡剂10 mL,初始pH为7.5,温度32 ℃,发酵周期为52 h。调控策略为0~44 h温度32 ℃,44~52 h温度36 ℃;溶氧20%,溶氧与转速偶联(转速范围为100~500 r/min)。发酵9 h开始持续补葡萄糖(50%),流速100 mL/h,流加浓氨水控制pH为7.5。发酵完成后葡萄糖糖含量低于3 g/L,发酵结束后发酵液离心取上清于4 ℃冷藏备用。
1.3 分析方法
1.3.1 酶解度及相对酶解率的测定
还原糖含量用3,5-二硝基水杨酸(DNS)比色法测定。葡萄糖标准曲线的绘制:准确配制浓度为0.1、0.2、0.3、0.4、0.5、0.6 g/L的葡萄糖标准溶液,以葡萄糖浓度为横坐标,以可见分光光度计吸收波长为540 nm测定的不同葡萄糖浓度的值(OD540)为纵坐标绘制葡萄糖标准曲线。标准方程为Y=1.808X+0.088,其中R2=0.9997。还原糖计算公式如下:
还原糖含量(g/L)=OD540−0.0881.808 (1) DNS法测定酶解度即DE(dextrose equivalent)值[15],计算公式如下:
酶解度(DE,%)=还原糖含量干物质含量×100 (2) 相对酶解率:以1 h酶解度为酶解率单位1,计算单位时间内增加的酶解度为相对酶解率,计算公式如下:
相对酶解率=DEhn−DEh1n−1(n=2,3,4,5) (3) 1.3.2 生物量的测定
取1 mL的发酵液,在离心机中12000 r/min,离心5 min,去掉上清,加入1 mL去离子水重悬菌种细胞,相同条件离心水洗三次,最后用1 mL去离子水重悬细胞,适当稀释后以去离子水为对照在可见光分光光度计600 nm处进行比色测定。读取OD600读数乘以稀释倍数得到的值作为最终OD600值。
1.3.3 谷氨酸含量的测定
使用SBA-40X型三通道生物传感仪测定谷氨酸含量[16]。配制100 g/dL的谷氨酸标准溶液作为标品定标,进样体积为25 µL,定标通过后,根据仪器检测范围适当稀释待测样品,然后测定读数。
1.3.4 鲜味料的制备
将发酵液离心取上清,在上清液中加5%的麦芽糊精用B-290型微型喷雾干燥器进行喷雾干燥。喷雾干燥的条件为:进口温度120 ℃,出口温度60 ℃,风机工作效率100%,蠕动泵工作效率18%[17]。最终得到粉末状的样品即为鲜味料,本文天然鲜味料样品为MJ(酶解组),鲜味料样品为CK(对照组,不加酶解液)。喷雾干燥会使发酵液发生浓缩,得到的鲜味料样品谷氨酸含量约为发酵液谷氨酸含量的4倍左右,且用生物传感仪和氨基酸分析仪对谷氨酸含量的检测结果是一致的。
1.3.5 滋味评定
由12名实验室感官评价员(6男6女),主要从鲜味、咸味、甜味、酸味和苦味5个项目进行打分,打分分值范围为0~10分,0~4分滋味评定一般,5~8分滋味评定中等,9~10滋味评定强烈,随后取平均值为滋味评价结果[18]。
1.3.6 总氮的测定
采用凯氏定氮法测定总氮的含量[19]。
1.3.7 总砷和总铅的测定
总砷的含量参考食品安全国家标准《GB 5009.11-2014》进行测定,总铅的含量参考食品安全国家标准《GB 5009.12-2017》进行测定。
1.3.8 17种游离氨基酸的测定
使用氨基酸分析仪测定17种游离氨基酸的含量。样品制备方式为:称取样品0.5~1 g(精确到 0.001 g)置于50 mL容量瓶中。加入20 mL磺基水杨酸超声至充分溶解后,定容至50 mL刻度,充分混匀,静置1 h后准确吸取上清液1 mL于25 mL容量瓶中,加入柠檬酸钠缓冲液定容至刻度,混匀后经0.45 μm微孔滤膜过滤至进样瓶,待检。溶剂标准为:氢氧化钠溶液:500 g/L;磺基水杨酸溶液:50 g/L;柠檬酸钠缓冲液:pH=2.2。称取19.6 g二水合柠檬酸钠,溶解后转入1000 mL容量瓶中,加入16.5 mL浓盐酸,加水至刻度,混匀。必要时,可用HCL或NaOH调节pH至2.2[20]。
1.3.9 挥发性风味物质的测定
使用气相-质普联用仪GC-MS测定。样品处理方式为:称取1 g(精确到 0.001 g)样品,1.5 g氯化钠和10 μL浓度为1.98 g/L的4-甲基2-戊醇(色谱纯)溶于5 mL去离子水中,经过0.22 μm滤膜过滤后取2 mL放入顶空萃取瓶中并放置于顶空进样器上,样品吹扫时间:30 min,样品预热时间:5 min,样品解吸附温度:180 ℃,样品吹扫温度:70 ℃。GC条件为:色谱柱为安捷伦DB-WAX柱(30 m×0.25 mm×0.25 μm),柱温为40 ℃(保持2 min),以2 ℃·min−1升温至250 ℃,保持5 min,总运行时间为112 min,汽化室温度为250 ℃,载气为高纯度He(99.999%),溶剂延迟时间为2 min。MS条件为:离子源为EI源,离子源温度为230 ℃,四级杆温度为150 ℃,电子源能量为70 eV,激活电压为1.6 V。用Qualitative Navigator B.08.00软件进行数据分析[21]。
1.4 数据处理
实验数据是三组平行实验的均值,用OriginPro2016软件作图,采用Excel 2010进行方差分析。
2. 结果与分析
2.1 玉米粉酶解工艺优化
2.1.1 单因素实验
由图1a所示,随着固液比的增加,酶解度(DE值)表现出先上升后下降的趋势,在固液比1:4时达到最大值,之后呈缓慢下降的趋势。这是因为在酶添加量一定时,随着固液比的增加,淀粉酶与玉米粉在反应过程中达到饱和平衡点并出现最大值。固液比1:4时,DE值达到54.64%,因此,1:4是最佳固液比。
由图1b所示,随着淀粉酶添加量的增加,DE值表现出先上升后下降的趋势,在酶添加量1%时达到最大值,之后呈缓慢下降的趋势。这是因为当底物充足时,随着酶添加量的增加,反应速率也随之增大,并随着结合程度逐渐增大,酶与玉米粉在反应过程中达到饱和平衡点并出现最大值。酶添加量1%时,DE值达到55.16%,酶解效果最好。因此,1%是最佳酶添加量。
由图1c所示,随着酶解温度的升高,DE值表现出先上升后下降的趋势,当酶解温度为85 ℃时,DE值最大,酶反应速率最大。这是由于酶促反应都有最适的温度范围,酶解温度过高和过低都会使酶的活力和结构发生改变,导致玉米粉酶解不够充分。当酶解温度为85 ℃时,DE值达到58.05%,酶解效果最好。因此,85 ℃是最佳酶解温度。
由图1d所示,随着时间的延长,DE值表现出持续上升的趋势。这是因为随着酶解时间的增加,淀粉酶与玉米粉之间充分接触,使反应速度增加,当酶解时间为5 h时,DE值达到58.92%。但3 h后DE值上升缓慢,考虑到不能一味的追求酶解度最高,而忽略时间成本。因此计算了相对酶解率进行筛选,比较单位时间内酶解度增加的速率,选择相对酶解率高的为最佳,酶解3 h相对酶解率达到3.01,酶解度为57.41%。因此,3 h是最佳酶解时间。
2.1.2 正交试验
以上单因素实验确定了各因素的最佳酶解条件,但各因素之间可能存在交互作用。为进一步研究各因素对玉米粉酶解的影响,采用L9(34)4因素3水平正交设计对酶解参数进行优化[22-23]。正交试验设计和结果如表3所示。
表 3 正交试验设计及结果Table 3. Orthogonal experimental design and results因素 A固液比 B酶添加量 C温度 D时间 酶解度DE(%) 1 1 1 1 1 58.60 2 1 2 2 2 60.21 3 1 3 3 3 58.78 4 2 1 2 3 58.59 5 2 2 3 1 57.85 6 2 3 1 2 56.51 7 3 1 3 2 56.91 8 3 2 1 3 54.13 9 3 3 2 1 57.01 k1 59.197 58.033 56.413 57.820 k2 57.650 57.397 58.603 57.877 k3 56.017 57.433 57.847 57.167 R 3.180 0.636 2.190 0.710 R值越大,该因素对试验结果的影响越大。由表3所示,各因素影响玉米粉酶解效果的顺序为:固液比(A)>温度(C)>时间(D)>酶添加量(B)。固液比是主要影响因素,其次是温度和时间,酶添加量对酶解度影响最小。基于以上分析确定最佳酶解工艺条件为A1B1C2D2,即固液比1:4,酶添加量1%,温度90 ℃,时间3 h。在此最佳条件下,酶解度达到60.84%。
2.2 C. glutamicum GL-6发酵产谷氨酸的条件优化
2.2.1 培养基氮源优化
采用不同型号的酵母抽提物FA31、FIG12LS、FM888、KA02、KU012替换培养基中的蛋白胨(peptone)培养48 h,C. glutamicum GL-6的生长情况及生产谷氨酸的能力如图2a、b所示,用酵母抽提物KA02培养12 h后OD600值达到16.49,用蛋白胨培养12 h后OD600值维持在10左右。酵母抽提物整体比蛋白胨培养效果要好,但数据有些波动,且每个数据点相差较小,难以区分哪种型号的酵母抽提物培养最佳。用酵母抽提物FIG12LS培养的谷氨酸含量相对较多,然而用蛋白胨培养的谷氨酸含量较低。用酵母抽提物FIG12LS培养24 h后,C. glutamicum GL-6的OD600值维持在13.00和16.00之间,谷氨酸含量最高为15.4 g/L,是蛋白胨培养的谷氨酸含量最高时的1.26倍。酵母抽提物FIG12LS虽然不是每个数据监测点含量都是最高的,但整体呈逐渐上升趋势,处于高点的数据监测点较多。因此,选用酵母抽提物FIG12LS培养效果最佳。
2.2.2 培养基氮源含量优化
确定酵母抽提物型号后,对其含量进行优化。如图3a、b所示,当酵母抽提物FIG12LS含量为30 g/L时,C. glutamicum GL-6生长相对较好,培养16 h生物量最高,OD600值为19.15,且谷氨酸含量相对较高,培养24 h谷氨酸含量最高为17.9 g/L。综上,酵母抽提物FIG12LS 30 g/L作为培养基氮源最佳。
2.2.3 玉米粉酶解液添加量的确定
玉米粉酶解后成分复杂,在培养基中添加不仅会使培养基初糖含量发生变化,还可能含有某些抑制因子影响菌种生长。如图4所示,添加25%、50%、75%、100%玉米粉酶解液谷氨酸含量在前24 h均比0%的玉米粉酶解液添加量低,添加酶解液C. glutamicum GL-6生长缓慢,谷氨酸积累受到抑制,而添加50%和75%的玉米粉酶解液发酵24 h后谷氨酸含量比0%的玉米粉酶解液添加量高。当酶解液含量在100%时,谷氨酸含量增加较少(3.0 g/L)。综上,添加50%的玉米粉酶解液即玉米粉含量100 g/L效果最佳,发酵42 h谷氨酸含量达到15.9 g/L。
2.2.4 20 L发酵罐水平扩大培养
为满足工业化生产需要,在20 L发酵罐水平扩大培养,以添加0%的玉米粉酶解液发酵作为对照组(图5a),以加入50%玉米粉酶解液发酵为酶解组(图5b),分别发酵52 h比较谷氨酸含量。有研究表明,谷氨酸棒杆菌的最适生长温度与产物生成所需温度不同,其最适生长温度为30~32 ℃,谷氨酸形成的最适温度为34~37 ℃[24-25]。发酵结果如图5a所示,对照组发酵44 h C. glutamicum GL-6 OD600值达到79.87,在44 h时升温至36 ℃,生物量下降,谷氨酸含量升高,发酵52 h谷氨酸含量达到84.0 g/L。如图5b所示,酶解组发酵44 h C. glutamicum GL-6 OD600值达到75.01,在44 h时升温至36 ℃,生物量下降,谷氨酸含量升高,发酵52 h谷氨酸含量达到98.0 g/L。酶解组和对照组OD600值基本一致,酶解组比对照组谷氨酸含量提高16.7%,酶解组由于加入了玉米酶解液发酵,初糖含量较高,较对照组高77.3%。综上,玉米粉酶解液不仅可以用来发酵生产谷氨酸,而且可以促进谷氨酸的积累。
2.3 天然鲜味料检测分析
2.3.1 外观及滋味评定
将上述两罐发酵结束后的发酵液离心后在上清液中分别添加5%的麦芽糊精进行喷雾干燥,得到鲜味料样品CK(对照组)和天然鲜味料样品MJ(酶解组)。产品图片如图6所示,样品CK和样品MJ均为微黄色粉末,但样品MJ相较于样品CK黄色偏深。
对图6所示的两种样品进行滋味评定,结果如图7所示。两种样品主要为咸鲜味,且样品MJ比样品CK更鲜。两种样品均有甜味,且样品MJ较样品CK甜。样品MJ基本无酸味,样品CK略微有些酸味。两种样品基本都无苦味。综上,样品MJ不仅比样品CK鲜味更强,感官整体评价还更优。
2.3.2 基础指标
根据调味料的质量检测标准,检测了样品的几个主要指标,如表4所示,样品CK还原糖含量为4.3 g/100 g,总氮含量为59.2 g/100 g,样品MJ还原糖含量为14.0 g/100 g,总氮含量为72.5 g/100 g。样品MJ还原糖和总氮含量分别比样品CK高225.6%和22.5%,而且图7所示的滋味评定中甜味感官与两种样品检测到的还原糖含量基本一致。样品总砷总铅均未超标,符合食品添加剂安全标准[26]。
表 4 各样品指标检测结果Table 4. Test results of each sample样品 还原糖(g/100 g) 总氮(g/100 g) 总砷(mg/kg) 总铅(mg/kg) CK 4.3 59.2 0.01 0.1 MJ 14.0 72.5 0.01 0.0 2.3.3 17种游离氨基酸
氨基酸种类较多,具有功能和营养性,除了谷氨酸有较强的鲜味外,甘氨酸具有甜味,能调和酸味和咸味,丙氨酸具有特殊鲜味和甜味,可提高食品的营养价值,改善食品的风味[27-28]。因此,两种样品进行氨基酸成分测定,结果如图8所示,样品CK的氨基酸总量为36.3 g/100 g,其中谷氨酸含量为35.4 g/100 g,样品MJ的氨基酸总量为44.8 g/100 g,其中谷氨酸含量为43.9 g/100 g,是样品CK的1.2倍。图7所示的滋味评定中鲜味感官与氨基酸含量检测结果基本一致。各样品中氨基酸的主要成分为谷氨酸,其他氨基酸含量很少,其中样品MJ的谷氨酸和丙氨酸含量最高,其他氨基酸含量也相对较高,可能是加入玉米酶解液共同发酵产生的。
2.3.4 挥发性风味物质
挥发性风味是产品可接受性重要因素之一,良好的风味可带来愉悦的感觉,对产品进行风味分析尤为重要。如表5所示,样品中共检测到23种主要挥发性风味物质,其中吡嗪类物质8种,酸类物质5种,酮类物质5种。吡嗪类物质种类多且含量高,样品CK 2,5-二甲基吡嗪和2,6-二甲基吡嗪含量分别达到1.301 μg/g和1.429 μg/g,样品MJ 2,3,5-三甲基吡嗪和川芎嗪含量分别达到7.118 μg/g和6.113 μg/g。此外,样品CK酸味较重,醋酸和辛酸含量分别达到1.855 μg/g和3.994 μg/g,样品MJ也有些许酸味,己酸含量达到1.152 μg/g。吡嗪类物质是鲜味的主要来源,它不仅能够提供鲜味,还有坚果和咖啡的风味,此外,一些吡嗪类物质,如川芎嗪还具有一定的药用价值[28-30]。醋酸和辛酸具有刺激性和酸败感,己酸则具有脂肪果味。图7所示的滋味评定与表5所示的挥发性风味物质检测结果基本一致。综上,样品MJ作为天然鲜味调味品风味良好,可广泛应用于食品领域。
表 5 两种样品挥发性风味检测结果Table 5. Volatile flavor test results of two samples序号 CAS 中文名称 风味 含量(μg/g) 样品CK 样品MJ A1 109-08-0 2-甲基吡嗪 坚果味、霉味和涩味 0.222 0.000 A2 123-32-0 2,5-二甲基吡嗪 霉味、土豆、可可和坚果味 1.301 0.000 A3 108-50-9 2,6-二甲基吡嗪 坚果味、面包味和咖啡霉味 1.429 0.259 A4 13925-03-6 2-乙基-6-甲基吡嗪 烤榛子味 0.172 0.000 A5 14667-55-1 2,3,5-三甲基吡嗪 生坚果皮、巧克力、咖啡和可可味 0.876 7.118 A6 13360-65-1 3-乙基-2,5-甲基吡嗪 榛子味 0.401 0.000 A7 1124-11-4 川芎嗪 坚果霉味、可可、花生和咖啡味 0.000 6.113 A8 13925-07-0 3,5-可可吡嗪 甜味、坚果味、焦糖味、咖啡和可可味 0.222 0.000 B1 64-19-7 醋酸 刺鼻的酸味和过熟的水果味 1.855 0.000 B2 142-62-1 己酸 芝士果味和酚类脂肪味 0.000 1.152 B3 107-92-6 丁酸 酸味、奶酪和奶油味 0.000 0.059 B4 124-07-2 辛酸 酸败味、肥皂味、干酪和白兰地味 3.994 0.097 B5 334-48-5 正癸酸 肥皂味和蜡质果味 0.000 0.203 C1 3848-24-6 2,3-已二酮 奶油味、水果味和烤焦糖味 0.194 0.000 C2 2345-28-0 2-十五烷酮 脂肪味、辛辣味和花香味 0.000 0.587 C3 106-68-3 3-辛酮 蘑菇味、酮味、干酪味和霉味 0.059 0.000 C4 593-08-8 2-十三烷酮 脂肪味、泥土味和乳制品味 0.000 0.032 C5 119-61-9 二苯甲酮 塑料味、天竺葵草药味和玫瑰酚味 0.012 0.000 D 3777-69-3 2-正戊基呋喃 霉味和熟焦糖味 0.042 0.000 E 104-76-7 2-乙基己醇 甜的脂肪果味 0.032 0.000 F 120-72-9 吲哚 动物粪便味、泥土苯酚味和化学香料味 0.048 0.000 G 100-52-7 苯甲醛 樱桃果味、坚果和热带水果味 0.000 0.244 H 7786-61-0 2-甲氧基-4-乙烯基苯酚 烟熏味、培根味、丁香酚醛味和木香味 0.073 0.000 3. 结论
该研究以玉米粉为主要原料,利用谷氨酸棒杆菌GL-6(Corynebacterium glutamicum GL-6)发酵生产新型天然鲜味料。首先通过单因素实验和正交试验得到玉米粉最佳酶解工艺为固液比1:4,酶添加量1%,温度90 ℃,时间3 h,在此最佳条件下DE值达到60.84%;同时在摇瓶水平确定了C. glutamicum GL-6发酵产谷氨酸的最佳氮源为酵母抽提物FIG12LS 30 g/L,玉米粉酶解液最佳添加量为50%(v/v),接着在20 L发酵罐水平进行发酵验证,并将发酵液离心取上清加入5%的麦芽糊精喷雾干燥成粉末,该粉末即为本文研究所得的天然鲜味料;最后对样品进行成分检测和评定。结果表明该产品MJ谷氨酸含量为43.9 g/100 g,氨基酸总含量为44.8 g/100 g,相较于样品CK含量分别提高了24.0%和23.4%。此外,产品富含坚果及咖啡风味的吡嗪类物质,相较于对照组鲜味物质含量和营养价值均有提高,风味也更加丰富。综上所述,玉米粉发酵生产的天然鲜味料,不仅风味良好,营养素更丰富,还实现了大宗农产品的深加工,为生产企业利用天然食品原料发酵生产新型鲜味料开辟了一条新的途径,具有广阔的市场前景。
-
表 1 玉米粉营养成分
Table 1 Nutritional composition of corn meal
项目 每100克 营养参考值 能量 1452 kJ 17% 蛋白质 7.9 g 13% 脂肪 3.0 g 5% 碳水化合物 75.6 g 25% 钠 0 mg 0% 谷氨酸 3 mg − 表 2 正交试验因素水平设计
Table 2 Factors and levels of the orthogonal tests
水平 因素 A固液比 B酶添加量(%) C温度(℃) D时间(h) 1 1:4 1 85 2 2 1:2.3 3 90 3 3 1:1.5 4 95 4 表 3 正交试验设计及结果
Table 3 Orthogonal experimental design and results
因素 A固液比 B酶添加量 C温度 D时间 酶解度DE(%) 1 1 1 1 1 58.60 2 1 2 2 2 60.21 3 1 3 3 3 58.78 4 2 1 2 3 58.59 5 2 2 3 1 57.85 6 2 3 1 2 56.51 7 3 1 3 2 56.91 8 3 2 1 3 54.13 9 3 3 2 1 57.01 k1 59.197 58.033 56.413 57.820 k2 57.650 57.397 58.603 57.877 k3 56.017 57.433 57.847 57.167 R 3.180 0.636 2.190 0.710 表 4 各样品指标检测结果
Table 4 Test results of each sample
样品 还原糖(g/100 g) 总氮(g/100 g) 总砷(mg/kg) 总铅(mg/kg) CK 4.3 59.2 0.01 0.1 MJ 14.0 72.5 0.01 0.0 表 5 两种样品挥发性风味检测结果
Table 5 Volatile flavor test results of two samples
序号 CAS 中文名称 风味 含量(μg/g) 样品CK 样品MJ A1 109-08-0 2-甲基吡嗪 坚果味、霉味和涩味 0.222 0.000 A2 123-32-0 2,5-二甲基吡嗪 霉味、土豆、可可和坚果味 1.301 0.000 A3 108-50-9 2,6-二甲基吡嗪 坚果味、面包味和咖啡霉味 1.429 0.259 A4 13925-03-6 2-乙基-6-甲基吡嗪 烤榛子味 0.172 0.000 A5 14667-55-1 2,3,5-三甲基吡嗪 生坚果皮、巧克力、咖啡和可可味 0.876 7.118 A6 13360-65-1 3-乙基-2,5-甲基吡嗪 榛子味 0.401 0.000 A7 1124-11-4 川芎嗪 坚果霉味、可可、花生和咖啡味 0.000 6.113 A8 13925-07-0 3,5-可可吡嗪 甜味、坚果味、焦糖味、咖啡和可可味 0.222 0.000 B1 64-19-7 醋酸 刺鼻的酸味和过熟的水果味 1.855 0.000 B2 142-62-1 己酸 芝士果味和酚类脂肪味 0.000 1.152 B3 107-92-6 丁酸 酸味、奶酪和奶油味 0.000 0.059 B4 124-07-2 辛酸 酸败味、肥皂味、干酪和白兰地味 3.994 0.097 B5 334-48-5 正癸酸 肥皂味和蜡质果味 0.000 0.203 C1 3848-24-6 2,3-已二酮 奶油味、水果味和烤焦糖味 0.194 0.000 C2 2345-28-0 2-十五烷酮 脂肪味、辛辣味和花香味 0.000 0.587 C3 106-68-3 3-辛酮 蘑菇味、酮味、干酪味和霉味 0.059 0.000 C4 593-08-8 2-十三烷酮 脂肪味、泥土味和乳制品味 0.000 0.032 C5 119-61-9 二苯甲酮 塑料味、天竺葵草药味和玫瑰酚味 0.012 0.000 D 3777-69-3 2-正戊基呋喃 霉味和熟焦糖味 0.042 0.000 E 104-76-7 2-乙基己醇 甜的脂肪果味 0.032 0.000 F 120-72-9 吲哚 动物粪便味、泥土苯酚味和化学香料味 0.048 0.000 G 100-52-7 苯甲醛 樱桃果味、坚果和热带水果味 0.000 0.244 H 7786-61-0 2-甲氧基-4-乙烯基苯酚 烟熏味、培根味、丁香酚醛味和木香味 0.073 0.000 -
[1] 孟鸿菊, 杨坚. 功能性鲜味剂的最新研究进展[J]. 中国食品添加剂,2007(1):109−113. [MENG H J, YANG J. The research progresses of functional fresh taste medicinal preparation[J]. China Food Additives,2007(1):109−113. doi: 10.3969/j.issn.1006-2513.2007.01.025 MENG H J, YANG J. The research progresses of functional fresh taste medicinal preparation[J]. China Food Additives, 2007(1): 109-113. doi: 10.3969/j.issn.1006-2513.2007.01.025
[2] 周爱梅. 增味剂的应用及发展[J]. 农产品加工,2009(8):10−11. [ZHOU A M. Application and development of flavor enhancers[J]. Agricultural Processing,2009(8):10−11. ZHOU A M. Application and development of flavor enhancers[J]. Agricultural Processing, 2009(8): 10-11.
[3] 田斌, 朱振宝. 食品增味剂及其发展前景[J]. 食品研究与开发,2007(11):175−177. [TIAN B, ZHU Z B. The development of food flavor enhancer[J]. Food Research and Development,2007(11):175−177. doi: 10.3969/j.issn.1005-6521.2007.11.053 TIAN B, ZHU Z B. The development of food flavor enhancer[J]. Food Research and Development, 2007(11): 175-177. doi: 10.3969/j.issn.1005-6521.2007.11.053
[4] 黄继红, 蔡凤英, 关丹, 等. 中国味精工业100年综述[J]. 中国调味品,2020,45(3):167−171. [HUANG J H, CAI F Y, GUAN D, et al. A review of monosodium glutamate industry in China in the past 100 years[J]. China Condiment,2020,45(3):167−171. doi: 10.3969/j.issn.1000-9973.2020.03.034 HUANG J H, CAI F Y, GUAN D, et al. A review of monosodium glutamate industry in China in the past 100 years[J]. China Condiment, 2020, 45(3): 167-171. doi: 10.3969/j.issn.1000-9973.2020.03.034
[5] 户红通, 徐达, 徐庆阳, 等. 谷氨酸清洁发酵工艺研究[J]. 中国酿造,2018,37(10):51−56. [HU H T, HU D, XU Q Y, et al. Study on clean fermentation process of glutamic acid[J]. China Brewing,2018,37(10):51−56. doi: 10.11882/j.issn.0254-5071.2018.10.010 HU H T, HU D, XU Q Y, et al. Study on clean fermentation process of glutamic acid[J]. China Brewing, 2018, 37(10): 51-56. doi: 10.11882/j.issn.0254-5071.2018.10.010
[6] 郇月伟, 董吉子, 董力青, 等. 谷氨酸生产提取工艺的改进研究[J]. 发酵科技通讯,2013,42(1):44−45. [HUAN Y W, DONG J Z, DONG L Q, et al. Improvement of extraction technology for glutamic acid production[J]. Fermentation Technology Newsletter,2013,42(1):44−45. doi: 10.3969/j.issn.1674-2214.2013.01.014 HUAN Y W, DONG J Z, DONG L Q, et al. Improvement of extraction technology for glutamic acid production[J]. Fermentation Technology Newsletter, 2013, 42(1): 44-45. doi: 10.3969/j.issn.1674-2214.2013.01.014
[7] 范玉和. 关于谷氨酸提取的不同工艺思路[J]. 发酵科技通讯,2012,41(4):19−20. [FANG Y H. Different technological ideas about extraction of glutamic acid[J]. Fermentation Technology Newsletter,2012,41(4):19−20. doi: 10.3969/j.issn.1674-2214.2012.04.006 FANG Y H. Different technological ideas about extraction of glutamic acid[J]. Fermentation Technology Newsletter, 2012, 41(4): 19-20. doi: 10.3969/j.issn.1674-2214.2012.04.006
[8] 吴丽娟. 玉米皮膳食纤维粉质特性的研究及其片剂的研制[D]. 长春: 吉林农业大学, 2011 WU L J. Study on farinograph properties of corn spermoderm dietary fiber and preparation of its tablet[D]. Changchun: Jilin Agricultural University, 2011.
[9] 邢荣平, 黄欣, 焦建伟. 对我国玉米种业发展的思考[J]. 农业与技术,2018,38(15):156−157. [XING R P, HUANG X, JIAO J W. Thinking about the development of corn seed industry in China[J]. Agriculture and Technology,2018,38(15):156−157. XING R P, HUANG X, JIAO J W. Thinking about the development of corn seed industry in China[J]. Agriculture and Technology, 2018, 38(15): 156-157.
[10] IN M, KIM D C, CHAE H J. Downstream process for the production of yeast extract using brewer's yeast cells[J]. Biotechnology and Bioprocess Engineering,2005,10(1):85−90. doi: 10.1007/BF02931188
[11] 张晓桐, 朱萌, 毛志海, 等. 酵母抽提物提取工艺及应用的研究进展[J]. 中国调味品,2019,44(2):160−163. [ZHANG X T, ZHU M, MAO Z H, et al. Research on extraction process and application of yeast extracts[J]. China Condiment,2019,44(2):160−163. doi: 10.3969/j.issn.1000-9973.2019.02.036 ZHANG X T, ZHU M, MAO Z H, et al. Research on extraction process and application of yeast extracts[J]. China Condiment, 2019, 44(2): 160-163. doi: 10.3969/j.issn.1000-9973.2019.02.036
[12] 朱曼利, 郭会明, 洪厚胜, 等. 酵母抽提物的研究概况[J]. 中国调味品,2017,42(2):175−180. [ZHU M L, GUO H M, HONG H S, et al. Research overview on yeast extract[J]. China Condiment,2017,42(2):175−180. doi: 10.3969/j.issn.1000-9973.2017.02.039 ZHU M L, GUO H M, HONG H S, et al. Research overview on yeast extract[J]. China Condiment, 2017, 42(2): 175-180. doi: 10.3969/j.issn.1000-9973.2017.02.039
[13] ALIM A, SONG H, LIU Y, et al. Flavour-active compounds in thermally treated yeast extracts[J]. Journal of the Science of Food and Agriculture,2018,98(10):3774−3783. doi: 10.1002/jsfa.8891
[14] 李杨, 吴慧, 马丽媛, 等. 基于响应曲面法的玉米粉复合酶解工艺优化研究[J]. 粮食与油脂,2021,34(7):123−127. [LI Y, WU H, MA L Y, et al. Optimization of corn flour compound enzymatic hydrolysis technology based on response surface methodology[J]. Grains and Oils,2021,34(7):123−127. doi: 10.3969/j.issn.1008-9578.2021.07.031 LI Y, WU H, MA L Y, et al. Optimization of corn flour compound enzymatic hydrolysis technology based on response surface methodology[J]. Grains and Oils, 2021, 34(7): 123-127. doi: 10.3969/j.issn.1008-9578.2021.07.031
[15] 赵凯, 许鹏举, 谷广烨. 3, 5-二硝基水杨酸比色法测定还原糖含量的研究[J]. 食品科学,2008(8):534−536. [ZHAO K, XU P J, GU G Y. Study on determination of reducing sugar content using 3, 5-dinitrosalicylic acid method[J]. Food Science,2008(8):534−536. doi: 10.3321/j.issn:1002-6630.2008.08.127 ZHAO K, XU P J, GU G Y. Study on determination of reducing sugar content using 3, 5-dinitrosalicylic acid method[J]. Food Science, 2008(8): 534-536. doi: 10.3321/j.issn:1002-6630.2008.08.127
[16] 张金露, 吴涛, 唐艳. 生物传感仪-除NH4+法测定发酵液中L-谷氨酸含量的研究[J]. 中国食品添加剂,2021,32(1):86−91. [ZHANG J L, WU T, TANG Y. Study on determination of L-glutamic acid by biosensor removing NH4+ method[J]. China Food Additives,2021,32(1):86−91. ZHANG J L, WU T, TANG Y. Study on determination of L-glutamic acid by biosensor removing NH4+ method[J]. China Food Additives, 2021, 32(1): 86-91.
[17] 李汴生, 卢嘉懿, 阮征. 植物乳杆菌发酵不同果蔬汁风味品质研究[J]. 农业工程学报,2018,34(16):293−299. [LI B S, LU J N, RUAN Z. Favor quality of different fruit and vegetable juices fermented by Lactobacillus plantarum[J]. Transactions of the Chinese Society of Agricultural Engineering,2018,34(16):293−299. doi: 10.11975/j.issn.1002-6819.2018.19.037 LI B S, LU J N, RUAN Z. Favor quality of different fruit and vegetable juices fermented by Lactobacillus plantarum[J]. Transactions of the Chinese Society of Agricultural Engineering, 2018, 34(16): 293-299. doi: 10.11975/j.issn.1002-6819.2018.19.037
[18] CORONEL-DELGADO A Y, CIRO-VELÁSQUEZ H J, RESTREPO-MOLINA D A. Spray drying of liquid extracts of curcumin: process performance and product quality properties[J]. Ingenieria y Competividad,2017,19(1):229−239.
[19] 刘军. 食品中蛋白质凯氏定氮法测定比较[J]. 食品安全导刊,2021(12):147, 149. [LIU J. Comparison of protein determination in food by Kjeldahl nitrogen determination[J]. China Food Safety,2021(12):147, 149. doi: 10.16043/j.cnki.cfs.2021.12.081 LIU J. Comparison of protein determination in food by Kjeldahl nitrogen determination[J]. China Food Safety, 2021(12): 147, 149. doi: 10.16043/j.cnki.cfs.2021.12.081
[20] 刘娜, 邓莉, 张俊杰. 顶空固相微萃取-气相色谱质谱-嗅闻法测定不同品牌红腐乳挥发性风味物质[J]. 中国调味品,2017,42(7):146−151, 155. [LIU N, DENG L, ZHANG J J. Analysis of volatile flavor compounds in red preserved bean curd with different brands by headspace solid phase micro-extraction and gas chromatography-olfactometry-mass spectrometry[J]. China Condiment,2017,42(7):146−151, 155. doi: 10.3969/j.issn.1000-9973.2017.07.032 LIU N, DENG L, ZHANG J J. Analysis of volatile flavor compounds in red preserved bean curd with different brands by headspace solid phase micro-extraction and gas chromatography-olfactometry-mass spectrometry[J]. China Condiment, 2017, 42(7): 146-151, 155. doi: 10.3969/j.issn.1000-9973.2017.07.032
[21] KIM Y, KIM E, SON H J, et al. Identification of a key umami-active fraction in modernized Korean soy sauce and the impact thereof on bitter-masking[J]. Food Chemistry,2017,233:256−262. doi: 10.1016/j.foodchem.2017.04.123
[22] CHAO Z. Study on the reuse process of hydrolysate from γ-polyglutamic acid fermentation residues[J]. Arabian Journal of Chemistry,2021(14):103145.
[23] CHAVAN S. Optimization of enzymatic hydrolysis of bamboo biomass for enhanced saccharification of cellulose through Taguchi orthogonal design[J]. Journal of Environmental Chemical Engineering,2021,9(1):104807. doi: 10.1016/j.jece.2020.104807
[24] 刘小德. 耐温谷氨酸棒杆菌F343发酵谷氨酸的研究[D]. 无锡: 江南大学, 2010 LIU X D. Study on the L-glutamate fermentation by the Corynebacteria glutamicum F343 of temneratnre tolerance[D]. Wuxi: Jiangnan University, 2010.
[25] 乔郅钠, 徐美娟, 龙梦飞, 等. TCA循环关键节点对L-谷氨酸合成的影响[J]. 生物工程学报,2020,36(10):2113−2125. [QIAO Z N, XU M J, LONG M F, et al. Effect of key notes of TCA cycle on L-glutamate production[J]. Chinese Journal of Biotechnology,2020,36(10):2113−2125. doi: 10.13345/j.cjb.200038 QIAO Z N, XU M J, LONG M F, et al. Effect of key notes of TCA cycle on L-glutamate production[J]. Chinese Journal of Biotechnology, 2020, 36(10): 2113-2125. doi: 10.13345/j.cjb.200038
[26] CHEN Z. Effects of fermentation with Lactiplantibacillus plantarum GDM1.191 on the umami compounds in shiitake mushrooms (Lentinus edodes)[J]. Food Chemistry,2021,364:130789.
[27] 郭媛, 王丽娟, 邱婷, 等. L-丙氨酸在食品工业中的应用潜力[J]. 中国调味品,2017,42(7):177−180. [GUO Y, WANG L J, QIU T, et al. Application potential of L-alanine in food industry[J]. China Condiment,2017,42(7):177−180. doi: 10.3969/j.issn.1000-9973.2017.07.039 GUO Y, WANG L J, QIU T, et al. Application potential of L-alanine in food industry[J]. China Condiment, 2017, 42(7): 177-180. doi: 10.3969/j.issn.1000-9973.2017.07.039
[28] GOH K M, LAI O M, ABAS F, et al. Effects of sonication on the extraction of free-amino acids from moromi and application to the laboratory scale rapid fermentation of soy sauce[J]. Food Chemistry,2017,215:200−208. doi: 10.1016/j.foodchem.2016.07.146
[29] LEI Y, XIE S, GUAN X, et al. Methoxypyrazines biosynthesis and metabolism in grape: A review[J]. Food Chemistry,2018,245:1141−1147. doi: 10.1016/j.foodchem.2017.11.056
[30] YAN Y, CHEN S, HE Y, et al. Quantitation of pyrazines in Baijiu and during production process by a rapid and sensitive direct injection UPLC-MS/MS approach[J]. Food Science & Technology,2020,128:109371.





 下载:
下载:
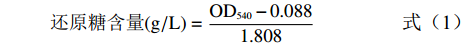

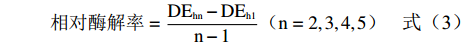








 下载:
下载:
