Individual Determination of Two Kinds of Flavonoids and Their Glycosides in Nepeta bracteata by HPLC
-
摘要: 目的:建立HPLC法分别定量测定大苞荆芥中木犀草素、芹菜素及其糖苷木犀草素-7-O-β-D-葡萄糖醛酸苷(LGCRP)、芹菜素-7-O-葡萄糖醛酸苷(AGCRP)的方法。方法:采用 C18 柱(250 mm×4.6 mm, 5 μm),以乙腈-0.1%磷酸水溶液(0.1:99.9,v/v)为流动相进行梯度洗脱,检测波长347 nm,流速1 mL/min,柱温30 ℃;优化了提取溶剂、溶剂加入量、提取时间等药材前处理方法;通过系统适用性试验,线性关系、检出限及定量限考察,精密度、重复性、稳定性及加标回收率试验,验证方法的适用性。结果:木犀草素、芹菜素和LGCRP、AGCRP分别在3.080~12.321、4.753~19.010、5.67~22.68、9.97~39.86 μg/mL范围内与各自峰面积呈良好的线性关系,r值均大于0.9993;检出限分别为0.11、0.08、0.03、0.03 μg/mL,定量限分别为0.35、0.23、0.09、0.10 μg/mL,精密度、稳定性和重复性均良好,加标回收率范围分别为98.8%~102.8%、92.9%~98.1%、93.9%~97.9%、93.7%~97.3%。结论:两套方法操作简便、灵敏度高、稳定性好、准确度高、适用性强,可用于大苞荆芥中2个黄酮及其糖苷类成分的定量测定,从而为大苞荆芥药材质量标准的制定提供依据。
-
关键词:
- 大苞荆芥 /
- 木犀草素 /
- 芹菜素 /
- 木犀草素-7-O-β-D-葡萄糖醛酸苷 /
- 芹菜素-7-O-葡萄糖醛酸苷 /
- 高效液相色谱法
Abstract: Objective: To establish two HPLC methods for determination content of luteolin, apigenin, and their glucosides such as luteolin-7-O-β-D-glucuronide (LGCRP), apigenin-7-O-glucuronide (AGCRP) in Nepeta bracteata. Methods: The determination was performed on C18 column(250 mm×4.6 mm, 5 μm)with mobile phase consisted of acetonitrile-0.1% phosphoric acid solution (0.1:99.9, v/v) at the flow rate of 1.0 mL/min. The detection wavelength was 347 nm, and the column temperature was 30 ℃. The methods of pretreatment such as extraction solvent, amount of solvent, extraction time were optimized. Then, applicability of methods was investigated by system suitability test, linear relationship, limit of detection and limit of quantification inspection, precision, repeatability, stability, recovery test. Results: The linear ranges of luteolin, apigenin, LGCRP, AGCRP were 3.080~12.321, 4.753~19.010, 5.67~22.68, 9.97~39.86 μg/mL, r≥0.9993, the limit of detection were 0.11, 0.08, 0.03, 0.03 μg/mL, and the limit of quantification were 0.35, 0.23, 0.09, 0.10 μg/mL. The precision, repeatability and stability were good, the recovery were in the range of 98.8%~102.8%, 92.9%~98.1%, 93.9%~97.9%, 93.7%~97.3%. Conclusion: Both methods can be used for the quantitative determination of two flavonoids and their glycosides in Nepeta bracteata because there are simple operation, high sensitivity, good stability, high accuracy and strong applicability. Thus, it provide a basis for the formulation of the quality standard of Nepeta bracteata. -
大苞荆芥为唇形科(Labiatae)荆芥属大苞荆芥(Nepeta bracteata Benth)的干燥全草,维吾尔名为“祖发印地”,收载于《阿力卡农》《依合提亚拉提拜地依》《买克散艾地维》等古籍中,其生干生热、温肺平喘、祛寒止咳、燥湿祛痰、发汗解毒、消炎退肿[1-2]。《维吾尔药志》中记载大苞荆芥全草具有止咳平喘、清热利湿的作用,用于治疗气管炎、咳嗽气喘、感冒发烧等症[3]。由于荆芥属植物营养丰富、气味独特,常被用作食品调味剂和保鲜剂使用[4-5]。但目前尚无专门针对大苞荆芥的质量研究报道,大多数文章都是将大苞荆芥作为神香草或硬尖神香草的混淆品进行性状鉴别[6]、薄层色谱鉴别[7]、HPLC法测定齐墩果酸与熊果酸含量及指纹图谱的对比研究[8]。因此,建立大苞荆芥的含量测定方法,进而制定其质量标准,对于大苞荆芥原料质量的控制及其在保健食品中的应用具有重要的现实意义。
虽然大苞荆芥在民间使用较为广泛,但国内外有关大苞荆芥的研究报道较少,张萌等[9]报道大苞荆芥总多糖对哮喘大鼠有明显的干预效果,其作用主要表现在大苞荆芥总多糖对Th1/Th2细胞相关细胞因子(IFN-γ和IL-4)失衡等免疫学改变的逆转作用以及对IL-6和IL-17等炎症细胞因子表达的抑制;阿不都热依木·玉苏甫等[2]研究发现,大苞荆芥总黄酮具有抗菌消炎、止咳、祛痰、平喘作用。由文献可知,大苞荆芥的活性成分应该为多糖和黄酮类成分,但大苞荆芥总多糖与大多数植物多糖一样,主要通过调节机体免疫系统而发挥作用,其特征性不强。而黄酮类化合物大多数具有显著的消炎、抗过敏、抗菌、抗病毒、止咳、祛痰、抗自由基氧化等作用,并广泛应用于食品药品中[10-11],与大苞荆芥的功能作用吻合。故本实验选择黄酮类成分作为大苞荆芥含量测定的指标成分。ABDUWAKI等[12]从大苞荆芥总黄酮中分离得到木犀草素、芹菜素、芹菜素-7-O-葡萄糖醛酸苷(Apigenin-7-O-glucuronide, AGCRP)、木犀草素-7-O-β-D-葡萄糖醛酸苷(Luteolin-7-O-β-D-glucuronide, LGCRP)、木犀草素-7-0-β-半乳糖苷、香叶木素-7-0-β-D-葡萄糖苷等多种黄酮及黄酮苷类成分。本课题组通过前期预实验发现大苞荆芥中木犀草素、芹菜素、LGCRP、AGCRP含量相对较高且分离度较好,故选择定量测定以上黄酮及其糖苷类成分。另外,由于大苞荆芥中木犀草素、芹菜素与其糖苷的性质、含量相差较为悬殊,且出峰时间间隔较远,若在一个条件下同时测定四个成分,则会导致有效成分提取不充分、单次测定耗时较长、峰形及分离度不好等问题,故采用两套方法分别测定木犀草素、芹菜素及LGCRP、AGCRP的含量。
1. 材料与方法
1.1 材料与仪器
15 批大苞荆芥药材生产批号分别为 S1(20151029)、S2(20170830)、S3(20171030)、S4(20181211)、S5(20190117)、S6(20190207)、S7(20190523)、S8(20191119)、S9(20191209)、S10(20200507)、S11(20200526)、S12(20200530)、S13(20200601)、S14(20200715)、S15(20200826) S3~S9购自新疆新绿宝药业有限公司,其他均购自新疆麦迪森维药有限公司。15批药材经新疆维吾尔自治区药品检验研究院艾买提江·阿依甫别克副主任药师鉴定为唇形科荆芥属大苞荆芥的干燥全草。木犀草素 中国食品药品鉴定研究院,批号:111520-200504,纯度≥98%;芹菜素 上海源叶生物科技有限公司,批号:TO4S8F43072,纯度≥98%;LGCRP 中国食品药品鉴定研究院,批号:111968-201602,纯度97.7%;AGCRP 广州隽沐生物科技股份有限公司,批号:DM21032005,纯度99.48%;乙腈 色谱纯,Sigma公司;所有试剂如未特殊标明均为分析纯;水为纯净水。
AL204-IC型电子天平 梅特勒-托利多仪器上海有限公司;KQ5200型超声波清洗仪 昆山市超声仪器有限公司;TG16B型高速离心机 盐城市凯特实验仪器有限公司;LC-16高效液相色谱仪 苏州市岛津仪器有限公司。
1.2 木犀草素、芹菜素含量测定方法学研究
1.2.1 对照品溶液的制备
精密称取木犀草素11.1 mg、芹菜素10.9 mg,分别置于10 mL量瓶中,加甲醇定容至刻度,分别配成浓度为1.11、1.09 mg/mL的对照品储备液。
1.2.2 供试品溶液的制备
称取大苞荆芥药材(粉粹,过20目筛,制成粗粉)约2.00 g,置于50 mL具塞锥形瓶中,加70%乙醇,摇匀,称定重量,固定超声波功率为300 W,超声提取30 min,用70%乙醇补足减失重量,摇匀,过滤,离心10 min(14000 r/ min),上清液作为供试品溶液待测。
1.2.3 色谱条件
色谱柱:InertSustion C18柱(250 mm×4.6 mm,5 μm);流动相A:乙腈溶液,流动相B:0.1%磷酸水溶液(0.1:99.9,v/v)[13-14];流速:1.0 mL/min;检测波长:347 nm;柱温30 ℃;进样量20 μL,按表1洗脱程序进行洗脱[15-16]。
表 1 洗脱程序Table 1. Elution program时间(min) 流动相A(%) 流动相B(%) 洗脱方法 0~15 25→32 75→68 线性洗脱 15~20 32→33 68→67 线性洗脱 20~25 33→41.5 67→58.5 线性洗脱 25~30 41.5→25 58.5→75 线性洗脱 30~35 25 75 等度 1.2.4 样品前处理方法的考察
1.2.4.1 提取溶剂的考察
称取同一批大苞荆芥药材粉末,分为6组,每组3份,每份约2.00 g,按“1.2.2”项下方法制备供试品溶液,每组分别加入甲醇、70%甲醇、50%甲醇、无水乙醇、70%乙醇、50%乙醇溶剂[17-19],使用液相色谱仪测定,并按公式(1)计算木犀草素、芹菜素含量。
(1) 式中:C表示供试品浓度,μg/mL,由峰面积代入标准曲线计算得出;D表示溶液稀释体积,mL;m表示药材取样量,g。
1.2.4.2 溶剂加入量的考察
称取同一批大苞荆芥药材粉末,分为5组,每组3份,每份约2.00 g,按“1.2.2”项下方法制备供试品溶液,每组分别加入70%乙醇20、30、40、50、60 mL,使用液相色谱仪测定[20],并按公式(1)计算木犀草素、芹菜素含量。
1.2.4.3 提取时间的考察
称取同一批大苞荆芥药材粉末,分为5组,每组3份,每份约2.00 g,按“1.2.2”项下方法制备供试品溶液,每组分别超声提取10、20、30、40、50 min,使用液相色谱仪测定[21-23],并按公式(1)计算木犀草素、芹菜素含量。
1.2.5 方法学考察
1.2.5.1 系统适用性试验
在上述色谱条件下,取各对照品、供试品及溶剂空白溶剂依次进样,检测HPLC条件是否符合要求。
1.2.5.2 线性关系、检出限及定量限
分别精密吸取对照品储备液用70%乙醇制成含木犀草素3.080~12.321 μg/mL,芹菜素4.753~19.010 μg/mL的混合对照品溶液,以对照品浓度X(μg/mL)为横坐标,峰面积Y为纵坐标,分别计算对照品木犀草素、芹菜素的线性回归方程和线性范围,按信噪比(S/N)约为3计算检出限(LOD),以S/N约为10计算定量限(LOQ)。
1.2.5.3 精密度试验
吸取同一对照品连续进样5次,在“1.2.3”色谱条件下测定峰面积并计算RSD值。
1.2.5.4 稳定性试验
称取同一批大苞荆芥药材粉末参照“1.2.2”的方法进行制备,于0、2、4、6、8、12、18、24 h进样并测定峰面积,计算RSD值。
1.2.5.5 重复性试验
称取同一批大苞荆芥药材粉末6份照参“1.2.2”的方法进行制备,于“1.2.3”色谱条件进样检测,确定峰面积并计算含量与RSD值。
1.2.5.6 加标回收率试验
精密称取已知含量样品约1.00 g,按低、中、高浓度分别加入木犀草素、芹菜素对照品储备液,置于50 mL具塞锥形瓶中,加70%乙醇,摇匀,称定重量,固定超声波功率为300 W,超声提取30 min,用70%乙醇补足减失重量,摇匀,过滤,离心10 min(14000 r/ min),进样测定,按供试品处理方法得溶液,记录峰面积,并按公式(2)计算加标回收率。
(2) 1.2.5.7 大苞荆芥药材中木犀草素、芹菜素含量测定
称取15批大苞荆芥药材粉末制成供试品溶液,并按“1.2.3”色谱条件进样检测,并按公式(1)计算各批次大苞荆芥中木犀草素、芹菜素的含量。
1.3 LGCRP、AGCRP含量测定方法学研究
1.3.1 对照品溶液的制备
精密称取LGCRP 11.5 mg、AGCRP 11.6 mg,分别置于10 mL量瓶中,加甲醇定容至刻度,分别配成浓度为1.15、1.16 mg/mL的对照品储备液。
1.3.2 供试品溶液的制备
称取同一批大苞荆芥药材粉末0.25 g,置于50 mL具塞锥形瓶中,加50%甲醇,摇匀,称定重量,固定超声波功率为300 W,超声提取20 min,用50%甲醇补足减失重量,摇匀,过滤,离心10 min(14000 r/min)上清液作为供试品溶液待测。
1.3.3 色谱条件
按照“1.2.3”项的方法,按表2洗脱程序进行洗脱[24-27]。
表 2 洗脱程序Table 2. Elution program时间(min) 流动相A(%) 流动相B(%) 洗脱方法 0~10 18→24.5 82→75.5 线性洗脱 10~15 24.5→24.9 75.5→75.1 线性洗脱 15~20 24.9→24.5 75.1→75.5 线性洗脱 20~25 24.5→18 75.5→82 线性洗脱 25~30 18 82 等度 1.3.4 样品前处理方法的考察
1.3.4.1 提取溶剂的考察
称取同一批大苞荆芥药材粉末,分为6组,每组3份,每份约0.25 g,同“1.2.4.1”的方法制备供试品溶液,并按1.2.4.1方法,注入液相色谱仪测定,并按公式(1)计算LGCRP、AGCRP含量。
1.3.4.2 溶剂加入量的考察
称取同一批大苞荆芥药材粉末,分为5组,每组3份,每份约0.25 g,同“1.2.4.2”的方法制备并注入液相色谱仪测定,并按公式(1)计算LGCRP、AGCRP含量。
1.3.4.3 提取时间的考察
称取同一批大苞荆芥药材粉末,分为5组,每组3份,每份约0.25 g,同“1.2.4.3”的方法制备并注入液相色谱仪测定,并按公式(1)计算LGCRP、AGCRP含量。
1.3.5 方法学考察
1.3.5.1 系统适用性试验
在上述色谱条件下,取各对照品、供试品及溶剂空白溶剂依次进样,检测HPLC条件是否符合要求。
1.3.5.2 线性关系、检出限及定量限
分别精密吸取对照品储备液用50%甲醇制成含LGCRP 5.67~22.68 μg/mL,AGCRP 9.97~39.86 μg/mL的混合对照品溶液二,以对照品浓度X(μg/mL)为横坐标,峰面积Y为纵坐标,分计算到对照品LGCRP、AGCRP的线性回归方程和线性范围,按信噪比(S/N)约为3计算检测限(LOD),以S/N约为10计算定量限(LOQ)。
1.3.5.3 精密度试验、稳定性试验、重复性试验
方法同“1.2.5”。
1.3.5.4 加标回收率试验
分别精密称取已知含量样品约0.125 g,按低、中、高浓度分别加入LGCRP、AGCRP对照品储备液,置于50 mL具塞锥形瓶中,加50%甲醇,摇匀,称定重量,固定超声波功率为300 W,超声提取20 min,用50%甲醇补足减失重量,摇匀,过滤,离心10 min(14000 r/ min),进样测定,按供试品处理方法得溶液,记录峰面积,并按公式(2)计算加样回收率。
1.3.5.5 大苞荆芥药材中LGCRP、AGCRP含量测定
称取15批大苞荆芥药材粉末制成供试品溶液,采用“1.3.3”色谱条件进样检测,并按公式(1)计算各批次大苞荆芥中LGCRP、AGCRP的含量。
1.4 数据处理
通过与SHIMADZU LC-16仪器配套的LabSolutions色谱处理软件完成数据采集分析,采用Excel、Origin 2018软件进行图形绘制及处理,每组重复3次,结果用
2. 结果与分析
2.1 木犀草素、芹菜素含量测定结果
2.1.1 样品前处理方法的考察
考虑木犀草素、芹菜素具有易溶于甲醇及乙醇的水溶液的特点[28]。本实验对6种提取溶剂进行考察。结果显示,随着甲醇或乙醇在水中比例的增加,木犀草素、芹菜素的含量呈上升趋势,用70%乙醇提取时木犀草素、芹菜素含量均最高,但用纯甲醇及无水乙醇提取时木犀草素、芹菜素含量均最低,因木犀草素、芹菜素属于极性化合物,根据中药化学成分与溶剂间“极性相似相容”的原理,选择对有效成分溶解度大的溶剂作为提取溶剂[29],因此,选择70%乙醇作为提取溶剂,结果见图1a。
![]() 图 1 不同提取条件对大苞荆芥中木犀草素、芹菜素含量的影响(n=3)注:a:提取溶剂;b:溶剂加入量;c:提取时间;图3同。Figure 1. Effects of different extraction conditions on the content of luteolin and apigenin in Nepeta bracteata (n=3)
图 1 不同提取条件对大苞荆芥中木犀草素、芹菜素含量的影响(n=3)注:a:提取溶剂;b:溶剂加入量;c:提取时间;图3同。Figure 1. Effects of different extraction conditions on the content of luteolin and apigenin in Nepeta bracteata (n=3)图1b中可以看出,随着溶剂加入量的增加,木犀草素、芹菜素的含量呈上升趋势,当加入量为50 mL时,木犀草素、芹菜素的含量均达到最高,但再增加到60 mL时,其含量略有下降,因为溶剂的溶解性能、溶解能力,通过溶剂的溶解度来确定,合适的溶剂用量能提高有效成分的溶解度,而溶解度达到全溶解状态后,再增加溶剂用量时会降解有效成成分的含量。说明加入50 mL溶剂就能充分提取药材中2种黄酮,故确定溶剂加入量为50 mL。
由于超声提取比常规提取效率高并节省时间,通常药材进行超声处理20~45 min即可获得较好的提取效果,图1c显示,提取时间从10 min增加到20 min时,木犀草素、芹菜素含量未发生明显变化,到30 min时其含量有所提高,而提取时间增加到40 min之后其含量开始下降,这是因为超声提取可使生物分子解聚,使细胞壁上的有效成分更快地溶解于溶剂中,一般提取时间在20~40 min即可获得最佳提取效率,而提取时间过长影响提取效率会降低有效成分的含量,故选择超声提取时间为30 min。
2.1.2 方法学考察
2.1.2.1 系统适应性试验
确定色谱条件时参考了多篇测定木犀草素、芹菜素含量的文献[30-34]。最终确定色谱条件为乙腈溶液:0.1%磷酸水溶液为流动相,流速1.0 mL/min,检测波长347 nm。此条件下色谱峰出峰时间快且对称性好,分离度>1.5,理论塔板数>5000,空白溶剂无干扰,符合实验要求。结果见图2。
2.1.2.2 线性关系、检出限及定量限
结果表明,木犀草素和芹菜素浓度分别在3.080~12.321、4.753~19.010 μg/mL范围内与峰面积具有良好的线性关系,相关系数达到0.9993以上。木犀草素和芹菜素的LOD分别为0.11和0.08 μg/mL,木犀草素和芹菜素的LOQ分别为0.35和0.23 μg/mL。结果见表3。
表 3 木犀草素和芹菜素的回归方程、相关系数、线性范围、检出限及定量限Table 3. Regression equation, correlation coefficient, linear range, limit of detection and limit of quantification of luteolin and apigenin黄酮类
化合物线性范围
(μg/mL)线性回归方程 相关系
数(r)LOD
(μg/mL)LOQ
(μg/mL)木犀草素 3.080~12.321 y=114535x−5573.7 0.9993 0.11 0.35 芹菜素 4.753~19.010 y=118650x+8346.3 0.9997 0.08 0.23 2.1.2.3 精密度试验
取混合对照品溶液按色谱条件连续进样6次,记录峰面积。求得木犀草素、芹菜素峰面积的RSD值分别为0.62%、0.73%,表明仪器的精密度良好。
2.1.2.4 稳定性试验
取同一供试品溶液,分别于0、2、4、6、8、12、18、24 h按色谱条件进样检测峰面积。求得木犀草素、芹菜素含量的RSD值分别为0.90%、1.33%,表明制备的供试品溶液在24 h之内较为稳定。
2.1.2.5 重复性试验
取同一大苞荆芥药材,平行制备6份供试品溶液,进样测定峰面积。求得木犀草素、芹菜素平均含量分别为109.825、170.621 µg/g,RSD值分别为1.39%、1.39%,说明该方法重复性良好。
2.1.2.6 加标回收率试验
木犀草素、芹菜素加标回收率范围分别为98.8%~102.8%、92.9%~98.1%,RSD值范围分别为0.97%~2.25%、0.24%~2.94%,表明方法准确度高,结果见表4。
表 4 加标回收率试验结果(n=3)Table 4. Standard recovery test results (n=3)黄酮类
化合物分组 称样量
(g)样品中
量(mg)加入量
(mg)测得量
(mg)回收率
(%)平均回
收(%)RSD
(%)木
犀
草
素低 1.0026 110.110 88.8 201.128 102.5 101.83 0.97 1.0021 110.050 88.8 200.906 102.3 1.0021 110.050 88.8 199.481 100.7 中 1.0028 110.133 111 224.202 102.7 100.10 2.25 1.0028 110.133 111 219.806 98.8 1.0025 110.100 111 219.872 98.8 高 1.0020 110.046 132 243.228 100.8 101.23 1.38 1.0027 110.123 132 245.91 102.8 1.0022 110.068 132 242.869 100.1 芹
菜
素低 1.0026 171.060 135.16 303.660 98.1 96.13 2.94 1.0021 170.970 135.16 302.748 97.4 1.0021 170.970 135.16 296.527 92.9 中 1.0028 171.099 168.95 333.201 95.9 95.63 0.24 1.0028 171.099 168.95 332.48 95.5 1.0025 171.048 168.95 332.497 95.5 高 1.0020 170.962 202.74 365.321 95.8 94.17 1.50 1.0027 171.081 202.74 360.420 93.4 1.0022 170.996 202.74 360.332 93.3 2.2 LGCRP、AGCRP含量测定结果
2.2.1 样品前处理方法的考察
本实验对6种提取溶剂进行考察。结果显示,使用50%甲醇或70%乙醇提取时,LGCRP、AGCRP的含量均较高,且用50%甲醇提取LGCRP、AGCRP含量均最高,但用纯甲醇及无水乙醇提取时LGCRP、AGCRP含量均最低,因此,选择50%甲醇作为提取溶剂,结果见图3a。
图3b中可以看出,随着溶剂加入量的增加,LGCRP、AGCRP的含量呈上升趋势,当加入量为50 mL时,LGCRP、AGCRP的含量均达到最高,但再增加到60 mL时,其含量明显下降,说明加入50 mL溶剂能充分提取药材中2种黄酮苷,故确定溶剂加入量为50 mL。
图3c显示,与提取10 min相比,提取时间为20 min时LGCRP、AGCRP含量均明显提高,而提取时间增加到30 min之后其含量明显下降,故选择超声提取时间为20 min。
2.2.2 方法学考察
2.2.2.1 系统适用性试验
最终确定色谱条件为乙腈溶液:0.1%磷酸水溶液为流动相,流速1.0 mL/min,检测波长347 nm。此条件下色谱峰出峰时间快且对称性好,分离度>1.5,理论塔板数>5000,空白溶剂无干扰,符合实验要求。结果见图4。
2.2.2.2 线性关系、检出限及定量限
结果表明,LGCRP和AGCRP浓度分别在5.67~22.68、9.97~39.86 μg/mL范围内与峰面积具有良好的线性关系,相关系数达到0.9997以上。LGCRP和AGCRP的LOD均为0.03 μg/mL,LGCRP和AGCRP的LOQ分别为0.09和0.10 μg/mL。结果见表5。
表 5 LGCRP、AGCRP的回归方程、相关系数、线性范围、检出限及定量限Table 5. Regression equation, correlation coefficient, linear range, limit of detection and limit of quantification of LGCRP, AGCRP黄酮苷类
化合物线性范围
(μg/mL)线性回归方程 相关系
数(r)LOD
(μg/mL)LOQ
(μg/mL)LGCRP 5.67~22.68 y=86579x−95679 0.9997 0.03 0.09 AGCRP 9.97~39.86 y=79161x−70048 0.9997 0.03 0.10 2.2.2.3 精密度试验取
混合对照品溶液按色谱条件连续进样6次,记录峰面积。求得LGCRP、AGCRP峰面积的RSD值分别为0.67%、0.83%,表明该方法精密度良好。
2.2.2.4 稳定性试验
取同一供试品溶液,分别于0、2、4、6、8、12、18、24 h按色谱条件进样检测峰面积。求得LGCRP、AGCRP含量的RSD值分别为1.23%、1.07%,表明制备的供试品溶液在24 h之内较为稳定。
2.2.2.5 重复性试验
取同一大苞荆芥药材,平行制备6份供试品溶液,进样测定峰面积。求得LGCRP、AGCRP含量分别为2.147、4.194 mg/g的RSD值分别为1.10%、0.79%,说明该方法重复性良好。
2.2.2.6 加标回收率试验
LGCRP、AGCRP加标回收率范围分别为93.9%~97.9%、93.7%~97.3%,RSD值范围分别为1.01%~1.65%、1.12%~1.74%,表明方法准确度高,结果见表6。
表 6 加标回收率试验结果(n=3)Table 6. Standard recovery test results (n=3)黄酮苷类
化合物分组 称样量
(g)样品中
量(mg)加入量
(mg)测得量
(mg)回收率
(%)平均回
收(%)RSD
(%)L
G
C
R
P低 0.1253 0.269 0.216 0.475 95.3 95.11 1.19 0.1252 0.269 0.216 0.476 96.1 0.1257 0.270 0.216 0.472 93.9 中 0.1259 0.270 0.270 0.529 95.9 96.96 1.01 0.1250 0.268 0.270 0.533 97.9 0.1259 0.270 0.270 0.532 97.1 高 0.1255 0.269 0.324 0.576 94.6 95.88 1.65 0.1257 0.269 0.324 0.586 97.7 0.1252 0.269 0.324 0.578 95.4 A
G
C
R
P低 0.1253 0.526 0.420 0.924 94.8 95.02 1.52 0.1252 0.526 0.420 0.931 96.6 0.1257 0.527 0.420 0.921 93.7 中 0.1259 0.528 0.525 1.022 94.1 94.54 1.12 0.1250 0.524 0.525 1.027 95.7 0.1259 0.528 0.525 1.020 93.7 高 0.1255 0.526 0.630 1.120 94.2 95.43 1.74 0.1257 0.527 0.630 1.124 94.8 0.1252 0.525 0.630 1.138 97.3 2.2.3 样品含量测定
检测15批大苞荆芥中的木犀草素、芹菜素、LGCRP、AGCRP含量,结果见表7,15批样品木犀草素含量为63.501~126.337 µg/g,芹菜素含量为44.964~321.198 µg/g,LGCRP含量为1.556~3.051 mg/g,AGCRP含量为2.533~7.154 mg/g。建议大苞荆芥药材中木犀草素、芹菜素、LGCRP、AGCRP的含量限度分别不得少于60.00 µg/g、40.00 µg/g、1.50 mg/g、2.50 mg/g。
表 7 样品含量测定结果(n=3,样品号 生产批号 供应商 木犀草素
(µg/g)芹菜素
(µg/g)LGCRP
(mg/g)AGCRP
(mg/g)S1 20151029 新疆麦迪森维药有限公司 77.944±4.2303 44.964±1.0538 1.834±0.2779 2.533±0.5686 S2 20170830 新疆麦迪森维药有限公司 91.835±4.8588 68.458±1.5975 3.009±0.0159 7.154±0.1171 S3 20171030 新疆新绿宝药业有限公司 64.639±3.5139 70.554±1.6110 1.845±0.0540 3.476±0.0512 S4 20181211 新疆新绿宝药业有限公司 94.873±2.4680 57.844±0.4318 2.001±0.0222 3.758±0.0805 S5 20190117 新疆新绿宝药业有限公司 126.028±4.1160 89.599±0.5231 2.872±0.0571 4.764±0.0246 S6 20190207 新疆新绿宝药业有限公司 97.726±1.0098 95.019±0.8707 2.212±0.0819 4.874±0.0897 S7 20190523 新疆新绿宝药业有限公司 126.337±4.6965 81.602±0.5320 2.341±0.0284 3.628±0.2395 S8 20191119 新疆新绿宝药业有限公司 63.501±2.0144 86.549±0.7141 1.779±0.0063 4.568±0.0847 S9 20191209 新疆新绿宝药业有限公司 107.539±4.9277 90.288±1.4263 3.051±0.1072 5.560±0.0775 S10 20200507 新疆麦迪森维药有限公司 121.375±1.3216 114.537±0.7888 2.022±0.0422 5.314±0.0756 S11 20200526 新疆麦迪森维药有限公司 115.866±2.2057 99.303±1.9857 2.743±0.1030 5.679±0.1027 S12 20200530 新疆麦迪森维药有限公司 65.932±0.4287 109.539±0.7033 1.556±0.0248 3.323±0.1071 S13 20200601 新疆麦迪森维药有限公司 65.859±0.9382 239.109±2.8767 2.019±0.0254 6.319±0.1757 S14 20200715 新疆麦迪森维药有限公司 109.826±1.3531 170.621±1.8052 2.147±0.0025 4.194±0.0181 S15 20200826 新疆麦迪森维药有限公司 108.714±0.6129 321.198±1.4197 2.045±0.0455 5.871±0.1480 不同生产批号大苞荆芥中芹菜素含量差异较大,最高含量与最低含量相差近7倍。且大苞荆芥中芹菜素含量随储藏时间的延长存在降低的趋势,与文献报道一致。丁春光等[35]认为不同储藏年限广陈皮黄酮类化合物含量随储藏时间延长而降低。含量降低的原因比较复杂,既可能与药材储藏过程中相关酶的活性变化有关[36],也可能与药材挥发性成分的散失有关[37]。
3. 结论
本实验优化了提取溶剂、溶剂加入量、提取时间等药材前处理方法,并通过系统适用性试验,线性关系、检出限及定量限考察,精密度、重复性、稳定性及加标回收率试验进行了含量测定方法学验证,建立了HPLC法分别定量测定大苞荆芥中木犀草素、芹菜素及其糖苷木犀草素-7-O-β-D-葡萄糖醛酸苷(LGCRP)、芹菜素-7-O-葡萄糖醛酸苷(AGCRP)的方法。结果显示木犀草素、芹菜素和LGCRP、AGCRP分别在3.080~12.321、4.753~19.010、5.67~22.68、9.97~39.86 μg/mL范围内与各自峰面积呈良好的线性关系,r值均大于0.9993;检出限分别为0.11、0.08、0.03、0.03 μg/mL,定量限分别为0.35、0.23、0.09、0.10 μg/mL,精密度、稳定性和重复性均良好,加标回收率范围分别为98.8%~102.8%、92.9%~98.1%、93.9%~97.9%、93.7%~97.3%。表明两套方法操作简便、灵敏度高、稳定性好、准确度高、适用性强,可用于大苞荆芥中2个黄酮及其糖苷类成分的定量测定,为大苞荆芥药材质量的控制及其在成方制剂中的应用奠定了基础。
-
图 1 不同提取条件对大苞荆芥中木犀草素、芹菜素含量的影响(n=3)
注:a:提取溶剂;b:溶剂加入量;c:提取时间;图3同。
Figure 1. Effects of different extraction conditions on the content of luteolin and apigenin in Nepeta bracteata (n=3)
表 1 洗脱程序
Table 1 Elution program
时间(min) 流动相A(%) 流动相B(%) 洗脱方法 0~15 25→32 75→68 线性洗脱 15~20 32→33 68→67 线性洗脱 20~25 33→41.5 67→58.5 线性洗脱 25~30 41.5→25 58.5→75 线性洗脱 30~35 25 75 等度 表 2 洗脱程序
Table 2 Elution program
时间(min) 流动相A(%) 流动相B(%) 洗脱方法 0~10 18→24.5 82→75.5 线性洗脱 10~15 24.5→24.9 75.5→75.1 线性洗脱 15~20 24.9→24.5 75.1→75.5 线性洗脱 20~25 24.5→18 75.5→82 线性洗脱 25~30 18 82 等度 表 3 木犀草素和芹菜素的回归方程、相关系数、线性范围、检出限及定量限
Table 3 Regression equation, correlation coefficient, linear range, limit of detection and limit of quantification of luteolin and apigenin
黄酮类
化合物线性范围
(μg/mL)线性回归方程 相关系
数(r)LOD
(μg/mL)LOQ
(μg/mL)木犀草素 3.080~12.321 y=114535x−5573.7 0.9993 0.11 0.35 芹菜素 4.753~19.010 y=118650x+8346.3 0.9997 0.08 0.23 表 4 加标回收率试验结果(n=3)
Table 4 Standard recovery test results (n=3)
黄酮类
化合物分组 称样量
(g)样品中
量(mg)加入量
(mg)测得量
(mg)回收率
(%)平均回
收(%)RSD
(%)木
犀
草
素低 1.0026 110.110 88.8 201.128 102.5 101.83 0.97 1.0021 110.050 88.8 200.906 102.3 1.0021 110.050 88.8 199.481 100.7 中 1.0028 110.133 111 224.202 102.7 100.10 2.25 1.0028 110.133 111 219.806 98.8 1.0025 110.100 111 219.872 98.8 高 1.0020 110.046 132 243.228 100.8 101.23 1.38 1.0027 110.123 132 245.91 102.8 1.0022 110.068 132 242.869 100.1 芹
菜
素低 1.0026 171.060 135.16 303.660 98.1 96.13 2.94 1.0021 170.970 135.16 302.748 97.4 1.0021 170.970 135.16 296.527 92.9 中 1.0028 171.099 168.95 333.201 95.9 95.63 0.24 1.0028 171.099 168.95 332.48 95.5 1.0025 171.048 168.95 332.497 95.5 高 1.0020 170.962 202.74 365.321 95.8 94.17 1.50 1.0027 171.081 202.74 360.420 93.4 1.0022 170.996 202.74 360.332 93.3 表 5 LGCRP、AGCRP的回归方程、相关系数、线性范围、检出限及定量限
Table 5 Regression equation, correlation coefficient, linear range, limit of detection and limit of quantification of LGCRP, AGCRP
黄酮苷类
化合物线性范围
(μg/mL)线性回归方程 相关系
数(r)LOD
(μg/mL)LOQ
(μg/mL)LGCRP 5.67~22.68 y=86579x−95679 0.9997 0.03 0.09 AGCRP 9.97~39.86 y=79161x−70048 0.9997 0.03 0.10 表 6 加标回收率试验结果(n=3)
Table 6 Standard recovery test results (n=3)
黄酮苷类
化合物分组 称样量
(g)样品中
量(mg)加入量
(mg)测得量
(mg)回收率
(%)平均回
收(%)RSD
(%)L
G
C
R
P低 0.1253 0.269 0.216 0.475 95.3 95.11 1.19 0.1252 0.269 0.216 0.476 96.1 0.1257 0.270 0.216 0.472 93.9 中 0.1259 0.270 0.270 0.529 95.9 96.96 1.01 0.1250 0.268 0.270 0.533 97.9 0.1259 0.270 0.270 0.532 97.1 高 0.1255 0.269 0.324 0.576 94.6 95.88 1.65 0.1257 0.269 0.324 0.586 97.7 0.1252 0.269 0.324 0.578 95.4 A
G
C
R
P低 0.1253 0.526 0.420 0.924 94.8 95.02 1.52 0.1252 0.526 0.420 0.931 96.6 0.1257 0.527 0.420 0.921 93.7 中 0.1259 0.528 0.525 1.022 94.1 94.54 1.12 0.1250 0.524 0.525 1.027 95.7 0.1259 0.528 0.525 1.020 93.7 高 0.1255 0.526 0.630 1.120 94.2 95.43 1.74 0.1257 0.527 0.630 1.124 94.8 0.1252 0.525 0.630 1.138 97.3 表 7 样品含量测定结果(n=3,
Table 7 Sample content determination results (n=3,
样品号 生产批号 供应商 木犀草素
(µg/g)芹菜素
(µg/g)LGCRP
(mg/g)AGCRP
(mg/g)S1 20151029 新疆麦迪森维药有限公司 77.944±4.2303 44.964±1.0538 1.834±0.2779 2.533±0.5686 S2 20170830 新疆麦迪森维药有限公司 91.835±4.8588 68.458±1.5975 3.009±0.0159 7.154±0.1171 S3 20171030 新疆新绿宝药业有限公司 64.639±3.5139 70.554±1.6110 1.845±0.0540 3.476±0.0512 S4 20181211 新疆新绿宝药业有限公司 94.873±2.4680 57.844±0.4318 2.001±0.0222 3.758±0.0805 S5 20190117 新疆新绿宝药业有限公司 126.028±4.1160 89.599±0.5231 2.872±0.0571 4.764±0.0246 S6 20190207 新疆新绿宝药业有限公司 97.726±1.0098 95.019±0.8707 2.212±0.0819 4.874±0.0897 S7 20190523 新疆新绿宝药业有限公司 126.337±4.6965 81.602±0.5320 2.341±0.0284 3.628±0.2395 S8 20191119 新疆新绿宝药业有限公司 63.501±2.0144 86.549±0.7141 1.779±0.0063 4.568±0.0847 S9 20191209 新疆新绿宝药业有限公司 107.539±4.9277 90.288±1.4263 3.051±0.1072 5.560±0.0775 S10 20200507 新疆麦迪森维药有限公司 121.375±1.3216 114.537±0.7888 2.022±0.0422 5.314±0.0756 S11 20200526 新疆麦迪森维药有限公司 115.866±2.2057 99.303±1.9857 2.743±0.1030 5.679±0.1027 S12 20200530 新疆麦迪森维药有限公司 65.932±0.4287 109.539±0.7033 1.556±0.0248 3.323±0.1071 S13 20200601 新疆麦迪森维药有限公司 65.859±0.9382 239.109±2.8767 2.019±0.0254 6.319±0.1757 S14 20200715 新疆麦迪森维药有限公司 109.826±1.3531 170.621±1.8052 2.147±0.0025 4.194±0.0181 S15 20200826 新疆麦迪森维药有限公司 108.714±0.6129 321.198±1.4197 2.045±0.0455 5.871±0.1480 -
[1] 艾买提江·阿衣甫别克, 买买提·努尔艾合买提, 买买提江·阿布都瓦克. 维药“祖发”的本草考证[J]. 中国民族民间医药,2021,30(16):29−35. [AMATJAN A, MAMAT N, MUHAMMATJAN A. Herbal textual research on Uyghur medicine “zoufa”[J]. Chinese Journal of Ethnomedicine and Ethnopharmacy,2021,30(16):29−35. AMATJAN A, MAMAT N, MUHAMMATJAN A. Herbal textual research on Uyghur medicine “zoufa”[J]. Chinese Journal of Ethnomedicine and Ethnopharmacy, 2021, 30(16): 29-35.
[2] 阿不都热依木·玉苏甫, 麦合苏木·艾克木. 一种大苞荆芥总黄酮提取物的制备方法和用途[P]. 乌鲁木齐: CN106420919A, 2017-02-22. ABDUREYIM Y, MAHSUM A. Preparation method and application of total flavonoids extract of Nepeta bracteata[P]. Urumchi: CN106420919A, 2017-02-22.
[3] 刘勇民, 沙吾提·伊克木. 维吾尔药志[J]. 乌鲁木齐:新疆人民出版社,1999:426−429. [LIU Y M, SAWUT Y. Medical records[J]. Uighur: Xinjiang People's Publishing House,1999:426−429. LIU Y M, SAWUT Y. Medical records[J]. Uighur: Xinjiang People's Publishing House, 1999: 426-429.
[4] RENATA B, VILMA B, ONA R, et al. Essential oil composition of five Nepeta species cultivated in Lithuania and evaluation of their bioactivities, toxicity and antioxidant potential of hydrodistillation residues[J]. Food and Chemical Toxicology,2019,129:269−280. doi: 10.1016/j.fct.2019.04.039
[5] BAHARE S, MARCO V, KUMAR J A, et al. Nepeta species: From farm to food applications and phytotherapy[J]. Trends in Food Science & Technology,2018,80:104−122.
[6] 徐芳, 赵军, 何江, 等. 维药硬尖神香草与其混淆品大苞荆芥的生药学鉴别[J]. 中国药房,2012,23(35):3321−3323. [XU F, ZHAO J, HE J, et al. Pharmacognostic identification of Uygur medicine hyssopus cuspidatus and its adulterant Nepeta bracteata[J]. China Pharmacy,2012,23(35):3321−3323. doi: 10.6039/j.issn.1001-0408.2012.35.20 XU F, ZHAO J, HE J, et al. Pharmacognostic identification of Uygur medicine hyssopus cuspidatus and its adulterant Nepeta bracteata[J]. China Pharmacy, 2012, 23(35): 3321-3323. doi: 10.6039/j.issn.1001-0408.2012.35.20
[7] 阿提坎木·瓦合甫. 维药神香草及其混淆品大苞荆芥药材质量研究[D]. 乌鲁木齐: 新疆医科大学, 2014. ATIKANMU W. Studies on the quality evaluation of Hyssopus cuspidatus Boriss and its adulterant Nepeta bracteata Benth[D]. Urumqi: University of Xinjiang Medical, 2014.
[8] 帕丽达·阿不力孜, 阿提坎木·瓦合甫, 丛媛媛, 等. HPLC法测定维药神香草及混淆品大苞荆芥中齐墩果酸与熊果酸[J]. 中成药,2014,36(12):2570−2573. [PALIDA A, ATIKANMU W, CONG Y Y. Determination of oleanolic acid and ursolic acid in Uygur medicine Hyssopus cuspidatus Boriss. and its adulterant Nepeta bracteata Benth. by HPLC[J]. Chinese Traditional Patent Medicine,2014,36(12):2570−2573. doi: 10.3969/j.issn.1001-1528.2014.12.028 PALIDA A, ATIKANMU W, CONG Y Y. Determination of oleanolic acid and ursolic acid in Uygur medicine Hyssopus cuspidatus Boriss. and its adulterant Nepeta bracteata Benth. by HPLC[J]. Chinese Traditional Patent Medicine, 2014, 36(12): 2570-2573. doi: 10.3969/j.issn.1001-1528.2014.12.028
[9] 张萌, 马雪萍, 马东华, 等. 维吾尔药大苞荆芥总多糖对哮喘大鼠细胞因子的影响[J]. 免疫学杂志,2012,28(3):222−226. [ZHANG M, MA X P, MA D H, et al. The effects of polysaccharide from Nepeta bracteata Benth on cytokine level in asthma rats[J]. Immunological Journal,2012,28(3):222−226. ZHANG M, MA X P, MA D H, et al. The effects of polysaccharide from Nepeta bracteata Benth on cytokine level in asthma rats[J]. Immunological Journal, 2012, 28(3): 222-226.
[10] 钟永恒, 贾仕杰, 郝同江, 等. 甘草黄酮类化合物生理功能及其在食品中应用研究[J]. 中国林副特产,2016(3):91−94. [ZHONG Y H, JIA S J, HAO T J, et al. The study of physiologic function and application in food on the licorice flavonoids compounds[J]. Forest by-Product and Speciality in China,2016(3):91−94. ZHONG Y H, JIA S J, HAO T J, et al. The study of physiologic function and application in food on the Licorice flavonoids compounds[J]. Forest By-Product and Speciality in China, 2016(3): 91-94.
[11] 陈晓慧, 徐雅琴. 黄酮类化合物生物活性及在食品中的应用研究[J]. 食品工程,2006,9(3):12−14. [CHEN X H, XU Y Q. The physiological activities of flavonoids and their application research in food industry[J]. Food Engineering,2006,9(3):12−14. CHEN X H, XU Y Q, The physiological activities of flavonoids and their application research in food industry[J]. Food Engineering, 2006(3) : 12-14.
[12] ABDUWAKII M, ESHBAKOVA K A, DONG J C, et al. Flavonoids from flowers of Hyssopus cuspidatus[J]. Chemistry of Natural Compounds,2014,50(5):915−917. doi: 10.1007/s10600-014-1116-4
[13] NICO A. WALTERS et al. Improved HPLC method for rooibos phenolics targeting changes due to fermentation[J]. Journal of Food Composition and Analysis,2016,55:20−29.
[14] DENG B, WEI B H, HUANG S C, et al. HPLC determination of four flavonoids in rat plasma after oral ecliptae herba extract[J]. Journal of Chinese Medicinal Materials,2014,37(9):1636−1640.
[15] DAI B, HU Z, LI H, et al. Simultaneous determination of six flavonoids from Paulownia tomentosa flower extract in rat plasma by LC-MS/MS and its application to a pharmacokinetic study[J]. Journal of Chromatography B,2015,978(26):54−61.
[16] AIYALU R, NAGULSAMY S, VIVEKANANDAN K et al. Simultaneous estimation of luteolin and apigenin in methanol leaf extract of Bacopa monnieri Linn by HPLC[J]. British Journal of Pharmaceutical Research,2014,4(13):1629−1637. doi: 10.9734/BJPR/2014/9009
[17] 何云飞. Box-Behnken效应面法优化亳菊中4种黄酮类成分提取工艺[J]. 中国药师,2020,23(7):1344−1349. [HE Y F. Extraction optimization of 4 flavones in Dendranthema morifolium by Box-Behnken experimental design[J]. China Pharmacist,2020,23(7):1344−1349. doi: 10.3969/j.issn.1008-049X.2020.07.022 HE Y F. Extraction optimization of 4 flavones in Dendranthema morifolium by Box-Behnken experimental design[J]. China Pharmacist, 2020, 23(7): 1344-1349. doi: 10.3969/j.issn.1008-049X.2020.07.022
[18] 王文华, 吴小林, 夏平, 等. HPLC法研究紫苏子炒制前后5种成分的含量变化[J]. 中国药师,2020,23(9):1855−1858. [WANG W H, WU X L, XIA P, et al. Study on the content changes of 5 constituents in Fructus Periuae before and after stir-frying by HPLC[J]. China Pharmacist,2020,23(9):1855−1858. doi: 10.3969/j.issn.1008-049X.2020.09.045 WANG W H, WU X L, XIA P, et al. Study on the content changes of 5 constituents in Fructus Periuae before and after stir-frying by HPLC[J]. China Pharmacist, 2020, 23(9): 1855-1858. doi: 10.3969/j.issn.1008-049X.2020.09.045
[19] 王智儀, 郭佳佳, 曹智威, 等. 花生壳中提取木犀草素及其含量测定[J]. 生物化工,2021,7(3):61−63, 67. [WANG Z Y, GUO J J, CAO Z W, et al. Extraction of luteolin from peanut shells and content determination[J]. Biological Chemical Engineering,2021,7(3):61−63, 67. doi: 10.3969/j.issn.2096-0387.2021.03.016 WANG Z Y, GUO J J, CAO Z W, et al. Extraction of luteolin from peanut shells and content determination[J]. Biological Chemical Engineering, 2021, 7(3): 61-63, 67. doi: 10.3969/j.issn.2096-0387.2021.03.016
[20] 李宝霞, 董双涛. 高效液相色谱法测定北刘寄奴中木犀草素的含量及显微鉴别研究[J]. 海峡药学,2019,31(5):49−50. [LI B X, DONG S T. HPLC determination and microscopic identification of luteolin in Siphonostegia chinensis Benth[J]. Strait Pharmaceutical Journal,2019,31(5):49−50. doi: 10.3969/j.issn.1006-3765.2019.05.017 LI B X, DONG S T. HPLC Determination and microscopic identification of luteolin in Siphono-stegia chinensis Benth[J]. Strait Pharmaceutical Journal, 2019, 31(5): 49-50. doi: 10.3969/j.issn.1006-3765.2019.05.017
[21] 王玫瑰, 李星雨, 叶方, 等. 毛连菜不同采收期中绿原酸、异绿原酸A和木犀草苷的变化规律[J]. 中国药师,2019,22(11):2117−2119. [WANG M G, LI X Y, YE F, et al. Dynamic variation of chlorogenic acid, isochlorogenic acid A and luteoside in Picris hieracioides L. with different harvesting periods[J]. China Pharmacist,2019,22(11):2117−2119. doi: 10.3969/j.issn.1008-049X.2019.11.042 WANG M G, LI X Y, YE F, et al. Dynamic variation of chlorogenic acid, isochlorogenic acid A and luteoside in Picris hieracioides L. with different harvesting periods[J]. China Pharmacist, 2019, 22(11): 2117-2119. doi: 10.3969/j.issn.1008-049X.2019.11.042
[22] 宋冷梅, 徐倩倩, 孙迎东, 等. HPLC同时测定野菊花中4种黄酮苷类的含量[J]. 中国药师,2019,22(9):1728−1730. [SONG L M, XU Q Q, SUN Y D. Simultaneous determination of four flavonoid glycosides in Chrysanthemi Indici Flos by HPLC[J]. China Pharmacist,2019,22(9):1728−1730. doi: 10.3969/j.issn.1008-049X.2019.09.041 SONG L M, XU Q Q, SUN Y D. Simultaneous determination of four flavonoid glycosides in Chrysanthemi Indici Flos by HPLC[J]. China Pharmacist, 2019, 22(9): 1728-1730. doi: 10.3969/j.issn.1008-049X.2019.09.041
[23] 白秀蓉. 不同干燥方法对荆芥药材中5种有效成分含量的影响和评价[J]. 中国药师,2020,23(12):2476−2479. [BAI X R. Effect and evaluation of different drying methods on the contents of five effective components in Schizonepeta herba[J]. China Pharmacist,2020,23(12):2476−2479. doi: 10.3969/j.issn.1008-049X.2020.12.040 BAI X R. Effect and evaluation of different drying methods on the contents of five effective components in Schi-zonepeta herba[J]. China Pharmacist, 2020, 23(12): 2476-2479. doi: 10.3969/j.issn.1008-049X.2020.12.040
[24] 赵磊, 张会敏, 李煜彬, 等. 15种黄酮类化合物对烤鸡胸肉中杂环胺含量的影响[J]. 食品科学,2019,40(23):19−25. [ZHAO L, ZHANG H M, LI Y B et al. Effects of fifteen flavonoids on the contents of heterocyclic amines in roast chicken breast[J]. Food Science,2019,40(23):19−25. doi: 10.7506/spkx1002-6630-20181105-045 ZHAO L, ZHANG H M, LI Y B et al. Effects of fifteen flavonoids on the contents of heterocyclic amines in roast chicken breast[J]. Food Science, 2019, 40(23): 19-25. doi: 10.7506/spkx1002-6630-20181105-045
[25] 刘倩芸, 迪娜·吐尔洪, 李新霞, 等. HPLC法测定黄花柳花中5个黄酮类成分的含量[J]. 中华中医药杂志,2020,35(1):411−414. [LIU Q Y, DINA T, LI X X, et al. Determination of five flavonoids in flower of Salix caprea L. by HPLC[J]. China Journal of Traditional Chinese Medicine and Pharmacy,2020,35(1):411−414. LIU Q Y, Dina T. Determination of five flavonoids in flower of Salix caprea L. by HPLC[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2020, 35(1): 411-414.
[26] 郝羚竹, 翟宏宇, 闫茹月. HPLC法测定抱茎苦荬菜中木犀草素-7-O-β-D-葡萄糖醛酸苷的含量[J]. 智慧健康,2020,6(2):12−13, 27. [HAO L Z, ZHAI H Y, YAN R Y. Determination of luteolin-7-O-β-D-glucuronide in Ixeris arborescens by HPLC[J]. Smart Healthcare,2020,6(2):12−13, 27. HAO L Z, ZHAI H Y, YAN R Y, Determination of luteolin-7-O-β-D-glucuronide in Ixerisarborescens by HPLC[J]. Smart Healthcare, 2020, 6(2): 12-13, 27.
[27] JORDAN B W, MASON H, PHILIPUS P L, et al. Storage stability of sorghum phenolic extracts' flavones luteolin and apigenin[J]. LWT,2018,97(8):787−793.
[28] 郝彩琴, 陈海燕, 刘立轩. 柴胡地上部分总黄酮提取条件的优化[J]. 海峡药学,2019,31(1):33−36. [HAO C Q, CHEN H Y, LIU L X. Optimization of extraction conditions of total flavonoids from overground part of Bupleurum[J]. Strait Pharmaceutical Journal,2019,31(1):33−36. doi: 10.3969/j.issn.1006-3765.2019.01.012 HAO C Q, CHEN H Y, LIU L X. Optimization of extraction conditions of total flavonoids from overground part of Bupleurum[J]. Strait Pharmaceutical Journal, 2019, 31(1): 33-36. doi: 10.3969/j.issn.1006-3765.2019.01.012
[29] MIAO Q, MI Y Q, CUI J M et al. Determination of chitosan content with Schiff base method and HPLC[J]. International journal of Biological Macromolecules,2021,182(1):1537−1542.
[30] 李亚军, 梁忠厚. 黄酮类化合物提取研究进展[J]. 粮食与油脂,2021,34(11):14−17. [LI Y J, LIANG Z H. Research progress on extraction of flavonoids[J]. Cereals & Oils,2021,34(11):14−17. doi: 10.3969/j.issn.1008-9578.2021.11.004 LI Y J, LIANG Z H. Research progress on extraction of flavonoids[J]. Cereals & Oils, 2021, 34(11): 14-17. doi: 10.3969/j.issn.1008-9578.2021.11.004
[31] BARDAKCI H, ACAR E T, KIRMIZIBEKMEZ H. Simultaneous quantification of six flavonoids in four Scutellaria taxa by HPLC-DAD method[J]. Rev Bras Farmacogn,2018,29(1):17−23.
[32] ARM A, KJK B, DBK A, et al. Matrix solid-phase dispersion extraction method for HPLC determination of flavonoids from buckwheat sprouts[J]. LWT,2020,133(1):110−121.
[33] DONG R, SU J, NIAN H, et al. Chemical fingerprint and quantitative analysis of flavonoids for quality control of sea buckthorn leaves by HPLC and UHPLC-ESI-QTOF-MS[J]. Journal of Functional Foods,2017,37(10):513−522.
[34] TEWARI R, GUPTA M, AHMAD F, et al. Extraction, quantification and antioxidant activities of flavonoids, polyphenols and pinitol from wild and cultivated Saraca asoca bark using RP-HPLC-PDA-RI method[J]. Industrial Crops and Products,2017,103(9):73−80.
[35] 丁春光, 孙素琴, 周群, 等. 应用HPLC-DAD及HPLC-HRMS技术研究不同贮存年限陈皮的指纹图谱[J]. 中国新药杂志,2008(11):927−930. [DING C G, SUN S Q, ZHOU Q. Chemical fingerprint analysis of tangerine peel reserved for different years by HPLC-DAD and HPLC-HRMS[J]. Chinese Journal of New Drugs,2008(11):927−930. doi: 10.3321/j.issn:1003-3734.2008.11.008 DING C G, SUN S Q, ZHOU Q. Chemical fingerprint analysis of tangerine peel reserved for different years by HPLC-DAD and HPLC-HRMS[J]. Chinese Journal of New Drugs, 2008(11): 927-930. doi: 10.3321/j.issn:1003-3734.2008.11.008
[36] 余祥英, 陈晓纯, 李玉婷, 等. 不同产地和不同贮藏年限陈皮的化学成分研究进展[J]. 食品安全质量检测学报,2020,11(12):3809−3817. [XU X Y, CEHN X C, LI Y T. Research progress on the chemical composition of Citri Reticulatae of different regions and different storage time[J]. Journal of Food Safety & Quality,2020,11(12):3809−3817. XU X Y, CEHN X C, LI Y T. Research progress on the chemical composition of Citri Reticulatae of different regions and different storage time[J]. Journal of Food Safety & Quality, 2020, 11(12): 3809-3817.
[37] 魏香兰, 万颖, 方如塘, 等. 不同贮藏年限白芍的化学成分分析[J]. 西北药学杂,2012,27(1):19−21. [WEI X L, WAN Y, FANG R T. Chemical composition analysis of Paeonia lactiflora Pall of different storage time[J]. Northwest Pharmaceutical Journal,2012,27(1):19−21. WEI X L, WAN Y, FANG R T. Chemical composition analysis of Paeonia Lactiflora Pall of different storage time[J]. Northwest Pharmaceutical Journal, 2012, 27(1): 19-21.





 下载:
下载:

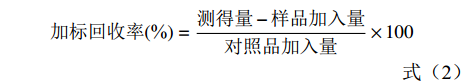
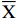




 下载:
下载:
