Optimization of Enzymatic Preparation Technology of Antioxidant Peptide from Volvariella volvacea by Response Surface Methodology
-
摘要: 以草菇为原料提取蛋白质,蛋白酶酶解蛋白制备抗氧化肽。以DPPH自由基清除率为指标,在单因素实验基础上,结合响应面法优化草菇抗氧化肽的提取工艺。通过超滤分离纯化获得不同分子量的肽段,采用DPPH自由基清除率、Fe2+螯合率和还原力法测定超滤组分的抗氧化活性。结果表明:中性蛋白酶为最优酶解蛋白酶,最佳酶解工艺条件为酶解时间3.70 h,加酶量3.81%,底物质量浓度3.11 g/100 mL,在此条件下,酶解产物的DPPH自由基清除率为69.85%±2.52%。通过超滤分级制备所得分子量最小的肽段F1(<3 kDa)具有最高的抗氧化活性,其DPPH自由基清除率、Fe2+螯合率和还原力分别为78.81%±1.56%、91.05%±1.65%、0.47±0.02。草菇抗氧化肽可作为潜在的天然抗氧化剂来源得到开发利用。Abstract: The antioxidant peptides were prepared from Volvariella volvacea protein by protease hydrolysis. Based on the single-factor test, the extraction conditions of antioxidant peptides from V. volvacea protein were optimized using response surface methodology. At the same time, peptides with different retention molecular weights were isolated by ultrafitration, and their antioxidant activity were detected through 2,2-dipheny1-1-picrylhydrazyl (DPPH) radical scavenging activity, Fe2+ chelating ability and reducing power. The results showed that the optimum enzyme for enzymatic hydrolysis was neutral protease, and the optimum process for antioxidant peptide was as follows: The enzymatic hydrolysis time was 3.70 h, the enzyme dosage was 3.81%, and the substrate mass concentration was 3.11 g/100 mL. Under the optimal enzymalysis conditions, DPPH free radical scavenging rate of the optimal hydrolysis products was 69.85%±2.52%. The F1 fraction with the lowest molecular weight (<3 kDa) exhibited the highest antioxidant activity. DPPH free radical scavenging rate, Fe2+ chelating ability and reducing power of F1 were 78.81%±1.56%, 91.05%±1.65%, 0.47±0.02. The antioxidant peptides from V. volvacea protein can be explored as a potential natural antioxidant.
-
草菇(Volvariella volvacea)隶属真菌界、担子菌门、伞菌目、光柄菇科、小苞脚菇属[1],是一种高价值食药用真菌,味道鲜美,口感滑嫩,营养丰富,具有提高免疫力、抗癌和降压等功效[2-5]。草菇中含有蛋白质、粗纤维、维生素和矿物质等多种功能活性成分,其中,蛋白质约占29%~41%(干重)[6-7],是提供优质蛋白质的合适来源。草菇人工栽培源自于中国,目前,我国是全球最大的草菇生产国[8]。当前,对草菇的研究主要集中在草菇多糖和多酚等方面,如钱礼顺[9]优化了超声辅助提取草菇子实体多糖工艺,通过进一步分离纯化,获得一种新型的α-葡聚糖;Kalava等[10]发现草菇菌丝体水提物中的多酚具有清除自由基的能力。由于草菇蛋白酶解抗氧化肽研究相对较少,所以开展草菇蛋白深加工和高附加值的生物活性肽研究尤为必要。
多肽在抗氧化方面具有优异的活性,是天然的抗氧化剂,能预防和减轻人体氧化应激引发的衰老、免疫疾病及其他各类疾病[11-13]。当前已有许多动植物源抗氧化肽的报道,如毛蚶蛋白[14]、鸡蛋清蛋白[15]和玉米蛋白[16]等。蛋白酶水解蛋白可将高分子的蛋白质转化为短链的多肽甚至是氨基酸,这些低分子量的多肽具有比原蛋白更高的生物活性[17]。而蛋白水解产物的抗氧化活性取决于蛋白质来源、蛋白酶类型,水解条件等[18-19],因此选择合适的条件水解蛋白具有重要的意义。
本实验以草菇为原料,通过蛋白酶水解制备抗氧化肽。经单因素实验和响应面试验对酶解条件进行优化,通过超滤分离纯化最佳酶解条件下制备的抗氧化肽,并测定其体外抗氧化活性,旨在为草菇抗氧化肽制备提供科学依据,提高草菇蛋白综合利用率。
1. 材料与方法
1.1 材料与仪器
草菇 上海市农业科学院;碱性蛋白酶(200 U/mg)、胰蛋白酶(250 U/mg) 上海麦克林生化科技有限公司;中性蛋白酶(100 U/mg)、木瓜蛋白酶(800 U/mg) 上海源叶生物科技有限公司;DPPH自由基清除能力试剂盒 北京艾普希隆生物科技有限公司;甲醇 国药集团化学试剂有限公司;其他试剂均为国产分析纯。
Labconco Free Zone冷冻干燥机 美国Labconco公司;HWS-24电热恒温水浴锅 上海一恒科技有限公司;TECAN Infinite 200 Pro多功能酶标仪 瑞士TECAN公司;R-134 a高速离心机 德国Eppendorf公司;Milli-Q Reference A+超纯水机 MerckMillipore公司。
1.2 实验方法
1.2.1 草菇预处理
草菇子实体洗净、切片、冷冻干燥、粉碎、过60目筛,于−80 ℃下保存备用。
1.2.2 蛋白质提取工艺
将草菇粉与超纯水按照1:10(w/v)的比例混匀,超声(100 Hz)20 min,静置4 h,8000 r/min下离心留上清液,采用80%硫酸铵于4 ℃沉淀,离心(6000 r/min, 20 min)留沉淀,将沉淀重新溶解在少量蒸馏水中。重新溶解的提取物使用10 kDa的透析袋于4 ℃下用超纯水透析48 h,冻干后保存于−80 ℃超低温冰箱内以备酶解使用。
1.2.3 酶解工艺流程
将草菇蛋白冻干粉按一定料液比加蒸馏水混匀,使用0.5 mol/L的NaOH调节至酶最适的pH,在酶最适合的温度平衡30 min,加酶,水浴酶解(使用0.5 mol/L的NaOH维持pH恒定)。灭酶(90 ℃,15 min),冷却后离心(4 ℃,8000 r/min,20 min),上清液冻干备用。
1.2.4 蛋白酶的筛选
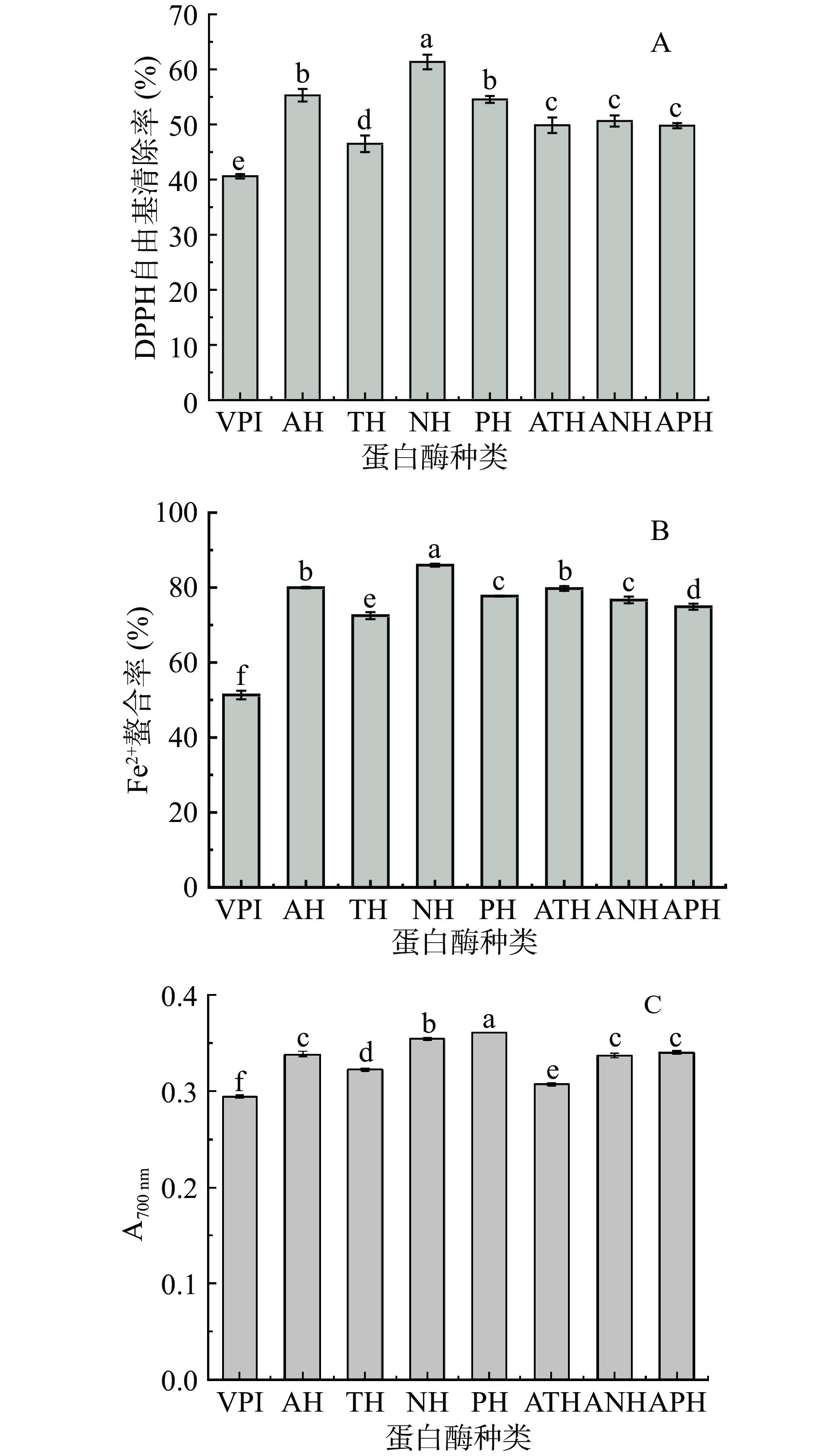
选用碱性蛋白酶、中性蛋白酶、胰蛋白酶、木瓜蛋白酶、碱性-中性蛋白酶(顺序酶解:首先加入碱性蛋白酶水解2 h,灭酶,然后调节温度和pH至第二种酶最适值,平衡30 min,加入第二种蛋白酶,水解2 h,灭酶。其余同。),碱性-胰蛋白酶、碱性-木瓜蛋白酶,在它们最佳酶解条件下对草菇蛋白进行酶解(表1),以DPPH自由基清除率、Fe2+螯合能力和还原力作为指标,筛选出合适的蛋白酶。
表 1 不同酶酶解条件Table 1. Hydrolysis conditions for the various enzymatic hydrolyses蛋白酶 温度
(℃)pH 酶解时间
(h)加酶量
(%)底物质量浓度
(g/100 mL)碱性蛋白酶 50 10.0 4 4 3 中性蛋白酶 45 7.5 4 4 3 胰蛋白酶 37 8.0 4 4 3 木瓜蛋白酶 37 7.0 4 4 3 碱性-中性蛋白酶 50~45 10.0~7.5 4 4 3 碱性-胰蛋白酶 50~37 10.0~8.0 4 4 3 碱性-木瓜蛋白酶 50~37 10.0~7.0 4 4 3 1.2.5 单因素实验
采用1.2.4筛选出的最适酶水解草菇蛋白制备抗氧化肽,以DPPH自由基清除率作为指标进行单因素实验设计。固定加酶量4%,底物质量浓度3 g/100 mL,探究酶解时间1、2、3、4、5 h对草菇蛋白酶解效果的影响;固定酶解时间4 h,底物质量浓度3 g/100 mL,探究加酶量2%、3%、4%、5%、6%对草菇蛋白酶解效果的影响;固定酶解时间4 h,加酶量4%,探究底物质量浓度1、2、3、4、5 g/100 mL对草菇蛋白酶解效果的影响。
1.2.6 响应面优化试验
在单因素实验的基础上,以DPPH自由基清除率为响应值,以酶解时间(A)、加酶量(B)、底物质量浓度(C)为自变量。根据Box-Behnken试验设计原理,设计三因素三水平响应面试验,试验因素与水平设计见表2。
表 2 响应面试验因素水平Table 2. Factors and levels of response surface experiment因素 水平 −1 0 1 A 酶解时间(h) 3 4 5 B 加酶量(%) 3 4 5 C 底物质量浓度(g/100 mL) 2 3 4 1.2.7 抗氧化活性测定
1.2.7.1 DPPH自由基清除率
按照试剂盒方法进行测定。在离心管中分别加入150 µL样品溶液,150 µL乙醇DPPH溶液,混匀后在室温下避光静置30 min,12000 r/min室温离心5 min,使用酶标仪于517 nm处测定吸光度A1。80%甲醇代替乙醇DPPH溶液测得吸光度为A2,80%甲醇代替样品测得吸光度为A0按照如下公式计算DPPH自由基清除率。
1.2.7.2 Fe2+螯合能力
参考马梦娇[20]的方法测定样品的Fe2+螯合率。在1 mL样品溶液中加入双蒸水3.7 mL、2 mmol/L的FeCl2溶液0.1 mL和5 mmol/L菲咯嗪0.2 mL,25 ℃下反应10 min,在562 nm处测定吸光度A1。双蒸水代替样品测得吸光度为A0,双蒸水代替菲咯嗪测得吸光度为A2。按照如下公式计算Fe2+螯合率。
1.2.7.3 还原力
参考Dong等[21]的方法略有修改测定样品的还原能力。将500 µL样品添加到500 µL的0.2 mol/L磷酸缓冲液(pH6.6)和500 µL的1%(w/v)铁氰化钾的混合液中。将混合物于50 ℃下水浴20 min,然后加入500 µL的10%(w/v)三氯乙酸,在8000 r/min下离心10 min。将500 µL上清液、500 µL双蒸水和100 µL的0.1%(w/v)氯化铁溶液在室温下反应10 min。在700 nm处测定溶液的吸光度,吸光度越大说明样品的还原能力越强。
1.2.8 超滤分级
将响应面优化最佳工艺条件下制备的酶解液使用10、3 kDa的超滤离心管进行分离纯化,得到3种不同分子量的多肽组分(F1<3 kDa;F2 3~10 kDa;F3>10 kDa),冻干后储存于−80 ℃,通过体外抗氧化试验评估其抗氧化活性。
1.3 数据处理
所有数据均为3次重复试验平均值±标准差,使用SPSS19.0软件进行统计学分析,Origin2019进行绘图,使用Design-Expert8.0.6进行响应面设计。
2. 结果与分析
2.1 蛋白酶的筛选
蛋白酶水解蛋白是生产生物活性肽最常用的方法。多肽的抗氧化活性和酶解所用蛋白酶种类有关,不同蛋白酶具有不同的酶切位点,可产生具有不同氨基酸和分子量的多肽[22]。因此筛选合适的蛋白酶是制备高活性抗氧化肽的关键步骤。使用4种不同的单酶和3种双酶酶解草菇蛋白,结果如图1所示,相较于草菇蛋白,酶解后产物的抗氧化活性均提高。其中中性蛋白酶酶解产物的DPPH自由基清除率和Fe2+螯合率最大,酶解4 h后,其DPPH自由基清除率为61.35%±1.33%,Fe2+螯合率为85.98%±0.38%,显著高于其它蛋白酶酶解产物(P<0.05)。木瓜蛋白酶酶解产物的还原力最大为0.36±0.00,其次是中性蛋白酶酶解产物0.35±0.01。中性蛋白酶酶解产物活性最高可能是因为它是内切酶[23],主要水解羧基侧含有色氨酸、酪氨酸、丙氨酸等芳香族氨基酸残基的肽键,这些氨基酸的含量与抗氧化活性呈正相关[24]。综合考虑,中性蛋白酶酶解产物具有较高抗氧化活性,因此选择中性蛋白酶对抗氧化肽的酶解条件进行进一步的优化研究。
2.2 单因素实验结果
2.2.1 酶解时间对酶解产物抗氧化活性的影响
酶解时间对草菇蛋白酶解产物DPPH自由基清除率的影响,结果如图2所示。随着酶解时间的增加,DPPH自由基清除率呈先增后减趋势,酶解时间为4 h时,多肽的DPPH自由基清除率达到峰值64.19%±1.07%,显著高于其它处理组(P<0.05)。由于酶解初期,底物含量高,可以充分与酶反应,产生具有较高活性的抗氧化肽。随着时间的不断延长,抗氧化肽可能会进一步酶解,从而导致抗氧化活性的降低[25]。因此,酶解时间对草菇蛋白酶解产物的自由基清除能力具有重要作用,选取4 h为最佳酶解时间进行下一步试验。孙菁茹等[26]从绿豆蛋白中制备抗氧化肽,抗氧化活性随着时间的增加先增大后减小,其研究结果与本研究一致。
2.2.2 加酶量对酶解产物抗氧化活性的影响
由图3可知,当加酶量为4%时,DPPH自由基清除率62.85%±1.20%,达到最大值,显著高于其它处理组(P<0.05)。随着加酶量的增加抗氧化活性呈现先增大后减小的趋势,这可能是因为随着加酶量的增加,酶与底物反应速率增加,但是加酶量过大会使蛋白质过度水解,产生分子量更小的肽段甚至是游离氨基酸,导致具有抗氧化活性的多肽含量降低[27]。因此,选取4%作为最佳加酶量。
2.2.3 底物质量浓度对酶解产物抗氧化活性的影响
底物质量浓度对DPPH自由基清除率的影响如图4所示,当底物质量浓度为3 g/100 mL时,蛋白酶酶解产物对DPPH自由基清除率达到最大值69.33%±0.43%,显著高于其它处理组(P<0.05)。随着底物质量浓度的增加,DPPH自由基清除率呈现先增加后减小的趋势,这可能是由于水在酶解反应中有利于其他分子的运动和扩散,底物质量浓度小时,酶与底物无法充分结合,而底物质量浓度过大,蛋白酶与底物接触不充分,蛋白质水解不充分[28],因此,选取最佳底物质量浓度为3 g/100 mL。
2.3 酶解工艺的响应面试验
2.3.1 响应面试验结果
综合单因素实验结果,以酶解时间、加酶量、底物质量浓度这3个因素为自变量,DPPH自由基清除能力为响应值,根据Box-Behnken试验设计原理进行响应面试验,试验设计方案与结果如表3所示。
表 3 响应面试验设计方案与结果Table 3. Experimental scheme and results of response surface试验号 因素 响应值 A 酶解时间 B 加酶量 C 底物质量浓度 DPPH自由基清除率(%) 1 0 −1 −1 52.67 2 0 0 0 68.85 3 0 1 −1 46.42 4 0 1 1 49.03 5 −1 1 0 56.72 6 0 0 0 68.79 7 1 −1 0 48.46 8 −1 0 1 57.82 9 0 0 0 69.54 10 0 0 0 70.26 11 0 −1 1 53.15 12 −1 0 −1 43.50 13 0 0 0 68.81 14 −1 −1 0 60.77 15 1 0 1 37.65 16 1 0 −1 43.50 17 1 1 0 46.14 2.3.2 模型的建立与方差分析
利用软件Design-Expert11进行多元回归拟合,得到回归模型方程:
Y=69.25−5.38A−2.09B+1.44C+0.4325AB−5.04AC+0.5325BC−10.46A2−5.76B2−13.17C2
回归方程的方差分析结果见表4。模型的显著水平P<0.0001,表明该回归模型极显著;实验所选模型的决定系数R2=0.9956,说明响应值的变化有99.56%来源于所选的变量,表明模型能有效地反映实验条件的变化;校正决定系数RAdj2=0.9899,表明仅有总变异的1.01%不能由该模型来解释;失拟项P值为0.0720>0.05,失拟项不显著,方程拟合度高,可以用该数学模型来预测实验结果。模型中A、B、C、AC、A2、B2、C2对DPPH自由基清除率影响极显著(P<0.01),由表4可知,F(A)=197.56,F(B)=29.86,F(C)=14.24,即各因素对草菇蛋白酶解产物抗氧化活性的影响顺序为酶解时间>加酶量>底物质量浓度。
表 4 回归模型方差分析及回归方程系数显著性检验Table 4. Significance test for variance analysis and coefficient constants of regression models来源 平方和 自由度 均方 F值 P值 显著性 模型 1854.93 9 206.10 175.68 <0.0001 ** A 231.77 1 231.77 197.56 <0.0001 ** B 35.03 1 35.03 29.86 0.0009 ** C 16.70 1 16.70 14.24 0.0070 ** AB 0.7482 1 0.7482 0.6378 0.4508 AC 101.71 1 101.71 86.69 <0.0001 ** BC 1.13 1 1.13 0.9668 0.3582 A2 461.01 1 461.01 392.96 <0.0001 ** B2 139.88 1 139.88 119.23 <0.0001 ** C2 730.17 1 730.17 622.39 <0.0001 ** 残差 8.21 7 1.17 失拟 6.54 3 2.18 5.23 0.0720 不显著 净误差 1.67 4 0.4174 总和 1863.14 16 决定系数R2 0.9956 校正决定系数RAdj2 0.9899 注: *表示显著,P<0.05;**表示极显著,P<0.01。 2.3.3 响应面优化试验结果
通过软件Design-Expert 11分析得到的各因素交互作用的曲线图和等高线图见图5。酶解时间曲线变化最大,其次是加酶量和底物质量浓度。当等高线趋于椭圆形时,表示两因素交互作用显著,圆形则表示交互作用不显著[29]。响应面坡度的陡峭程度也反映出处理条件的改变对响应值的影响。图5b中酶解时间和底物质量浓度的响应面弯曲程度最大,则其交互作用最显著,这一结果与表4的方差分析中显著性检验结果一致。
2.3.4 响应面优化验证
采用软件对酶解工艺进行优化,得出理论最佳酶解条件为酶解时间3.713 h、加酶量3.813%、底物质量浓度3.106 g/100 mL时,此时的DPPH自由基清除率最高,其预测值为70.294%。按照该条件进行验证实验,考虑实际操作的可行性,选取酶解时间3.70 h、加酶量3.81%、底物质量浓度3.11 g/100 mL,验证试验重复3次,测定DPPH自由基清除率为69.85%±2.52%,与理论值相近,证明拟合模型优化出的条件较为准确[30]。
2.4 超滤组分的抗氧化活性
超滤法可根据分子量大小快速且有效的对酶解产物进行分离纯化。因此使用3 kDa、10 kDa的超滤管对草菇蛋白酶解液进行分离,得到3个组分。表5可知,F1(<3 kDa)抗氧化活性显著高于F2(3~10 kDa)、F3(>10 kDa)和酶解产物(P<0.05)。其DPPH自由基清除率、Fe2+螯合率和还原力分别为78.81%±1.56%、91.05%±1.65%、0.47±0.02。多肽的抗氧化活性与其分子量大小和氨基酸组成种类及排列顺序相关[31-32],超滤分离后,分子量较小的多肽抗氧化活性更高,这可能是由于超滤分子量小的多肽具有较小的空间位阻,可以作为更好的电子供体,与自由基发生反应,将其转化为更稳定的产物[33-34]。Yang等[35]从鸭血浆肽超滤所得M1(<3 kDa)的DPPH自由基清除率、O2−·清除率和ABTS自由基清除活性分别为68.16%、18.95%和97.59 mmol/L TE/mg,显著(P<0.05)高于组分M2(3~10 kDa)和M3(>10 kDa),这一结果与本实验结果相似,表明分子量低的多肽具有更高的抗氧化活性。
表 5 中性蛋白酶酶解产物及其超滤组分的抗氧化活性Table 5. Antioxidant activities of neutral protease hydrolysates and their ultrafiltration componentsDPPH自由基清除率(%) Fe2+螯合率(%) 还原力 酶解液 69.85±2.52c 83.71±1.00b 0.35±0.03c F1(<3 kDa) 78.81±1.56a 91.05±1.65a 0.47±0.02a F2(3~10 kDa) 73.32±0.49b 83.18±1.16b 0.42±0.01b F3(>10 kDa) 58.51±1.07d 74.06±1.95c 0.30±0.07d 注:同列不同的字母表示差异显著(P<0.05)。 3. 结论
本实验以草菇蛋白为原料,通过蛋白酶酶解制备抗氧化肽,在单因素实验的基础上,结合响应面法优化草菇抗氧化肽的制备工艺。中性蛋白酶酶解草菇蛋白的优化条件为:酶解时间3.70 h、加酶量3.81%、底物质量浓度3.11 g/100 mL,此条件下,制备所得抗氧化肽DPPH自由基清除率为69.85%±2.52%。经超滤分离纯化所得分子量小于3 kDa的组分F1抗氧化活性显著高于分子量高的组分(P<0.05)。本实验为草菇抗氧化肽的制备提供了一定的理论基础,可通过对F1进行纯化、结构鉴定并探究其可能的作用机制,进一步为草菇蛋白的高值化应用提供一定科学依据。
-
表 1 不同酶酶解条件
Table 1 Hydrolysis conditions for the various enzymatic hydrolyses
蛋白酶 温度
(℃)pH 酶解时间
(h)加酶量
(%)底物质量浓度
(g/100 mL)碱性蛋白酶 50 10.0 4 4 3 中性蛋白酶 45 7.5 4 4 3 胰蛋白酶 37 8.0 4 4 3 木瓜蛋白酶 37 7.0 4 4 3 碱性-中性蛋白酶 50~45 10.0~7.5 4 4 3 碱性-胰蛋白酶 50~37 10.0~8.0 4 4 3 碱性-木瓜蛋白酶 50~37 10.0~7.0 4 4 3 表 2 响应面试验因素水平
Table 2 Factors and levels of response surface experiment
因素 水平 −1 0 1 A 酶解时间(h) 3 4 5 B 加酶量(%) 3 4 5 C 底物质量浓度(g/100 mL) 2 3 4 表 3 响应面试验设计方案与结果
Table 3 Experimental scheme and results of response surface
试验号 因素 响应值 A 酶解时间 B 加酶量 C 底物质量浓度 DPPH自由基清除率(%) 1 0 −1 −1 52.67 2 0 0 0 68.85 3 0 1 −1 46.42 4 0 1 1 49.03 5 −1 1 0 56.72 6 0 0 0 68.79 7 1 −1 0 48.46 8 −1 0 1 57.82 9 0 0 0 69.54 10 0 0 0 70.26 11 0 −1 1 53.15 12 −1 0 −1 43.50 13 0 0 0 68.81 14 −1 −1 0 60.77 15 1 0 1 37.65 16 1 0 −1 43.50 17 1 1 0 46.14 表 4 回归模型方差分析及回归方程系数显著性检验
Table 4 Significance test for variance analysis and coefficient constants of regression models
来源 平方和 自由度 均方 F值 P值 显著性 模型 1854.93 9 206.10 175.68 <0.0001 ** A 231.77 1 231.77 197.56 <0.0001 ** B 35.03 1 35.03 29.86 0.0009 ** C 16.70 1 16.70 14.24 0.0070 ** AB 0.7482 1 0.7482 0.6378 0.4508 AC 101.71 1 101.71 86.69 <0.0001 ** BC 1.13 1 1.13 0.9668 0.3582 A2 461.01 1 461.01 392.96 <0.0001 ** B2 139.88 1 139.88 119.23 <0.0001 ** C2 730.17 1 730.17 622.39 <0.0001 ** 残差 8.21 7 1.17 失拟 6.54 3 2.18 5.23 0.0720 不显著 净误差 1.67 4 0.4174 总和 1863.14 16 决定系数R2 0.9956 校正决定系数RAdj2 0.9899 注: *表示显著,P<0.05;**表示极显著,P<0.01。 表 5 中性蛋白酶酶解产物及其超滤组分的抗氧化活性
Table 5 Antioxidant activities of neutral protease hydrolysates and their ultrafiltration components
DPPH自由基清除率(%) Fe2+螯合率(%) 还原力 酶解液 69.85±2.52c 83.71±1.00b 0.35±0.03c F1(<3 kDa) 78.81±1.56a 91.05±1.65a 0.47±0.02a F2(3~10 kDa) 73.32±0.49b 83.18±1.16b 0.42±0.01b F3(>10 kDa) 58.51±1.07d 74.06±1.95c 0.30±0.07d 注:同列不同的字母表示差异显著(P<0.05)。 -
[1] 戴玉成, 周丽伟, 杨祝良, 等. 中国食用菌名录[J]. 菌物学报,2010,29(1):1−21. [DAI Y C, ZHOU L W, YANG Z L, et al. A revised checklist of edible fungi in China[J]. Mycosystema,2010,29(1):1−21. DAI Y C, ZHOU L W, YANG Z L, et al. A revised checklist of edible fungi in China[J]. Mycosystema, 2010, 29(1): 1-21.
[2] 刘学铭, 廖森泰, 陈智毅. 草菇的化学特性与药理作用及保鲜与加工研究进展[J]. 食品科学,2011,32(1):260−264. [LIU X M, LIAO S T, CHEN Z Y. Research advance in chemical properties, pharmacological activity of straw mushroom as well as fresh keeping and processing technologies for it[J]. Food Science,2011,32(1):260−264. LIU X M, LIAO S T, CHEN Z Y. Research advance in chemical properties, pharmacological activity of straw mushroom as well as fresh keeping and processing technologies for it[J]. Food Science, 2011, 32(1): 260-264.
[3] 秦惠娟, 杨健华, 陈屏, 等. 草菇子实体GC-MS分析及不同极性部位体外抗氧化活性研究[J]. 食品工业科技,2016,37(21):318−322, 328. [QIN H J, YANG J H, CHEN P, et al. GC-MS analysis of Volvariella volvacea fruiting bodies and different solvent extracts antioxidant activities in vitro[J]. Science and Technology of Food Industry,2016,37(21):318−322, 328. QIN H J, YANG J H, CHEN P, et al. GC-MS analysis of Volvariella volvacea fruiting bodies and different solvent extracts antioxidant activities in vitro[J]. Science and Technology of Food Industry, 2016, 37(21): 318-322+328.
[4] ROY A, PRASAD P, GUPTA N. Volvariella volvacea: A macrofungus having nutritional and health potential[J]. Asian Journal of Pharmacy and Technology,2014,4(2):110−113.
[5] BREENE W M. Nutritional and medicinal value of specialty mushrooms[J]. Journal of Food Protection,1990,53(10):883−894. doi: 10.4315/0362-028X-53.10.883
[6] BANIK S, NANDI R. Effect of supplementation of rice straw with biogas residual slurry manure on the yield, protein and mineral contents of Volvariella volvacea mushroom[J]. Journal of Scientific and Industrial Research,2000,59(5):407−412.
[7] TRIYONO S, HARYANTO A, TELAUMBANUA M, et al. Cultivation of straw mushroom (Volvariella volvacea) on oil palm empty fruit bunch growth medium[J]. International Journal of Recycling of Organic Waste in Agriculture,2019,8(4):381−392. doi: 10.1007/s40093-019-0259-5
[8] 何焕清, 肖自添, 彭洋洋, 等. 草菇栽培技术发展历程与创新研究进展[J]. 广东农业科学,2020,47(12):53−61. [HE H Q, XIAO Z T, PENG Y Y, et al. Development history and innovation research progress of straw mushroom cultivation technology[J]. Guangdong Agricultural Sciences,2020,47(12):53−61. HE H Q, XIAO Z T, PENG Y Y, et al. Development history and innovation research progress of straw mushroom cultivation technology[J]. Guangdong Agricultural Sciences, 2020, 47(12): 53-61.
[9] 钱礼顺. 超声辅助提取草菇子实体多糖及其结构表征与免疫活性评价[D]. 镇江: 江苏大学, 2019. QIAN S L. Ultrasound-assisted extraction optimization, structure characterization and immunomodulatory activity[D]. Zhenjiang: Jiangsu University, 2019.
[10] KALAVA S V, MENON S G. In vitro free radical scavenging activity of aqueous extract from the mycella of Volvariella volvacea (bulliard ex fries) singer[J]. International Journal Current Pharmaceutical Research,2012,4(3):7.
[11] LORENZO J M, MUNEKATA P E, GÓMEZ B, et al. Bioactive peptides as natural antioxidants in food products: A review[J]. Trends in Food Science & Technology,2018,79:136−147.
[12] LU X, ZHANG L, SUN Q, et al. Extraction, identification and structure-activity relationship of antioxidant peptides from sesame (Sesamum indicum L.) protein hydrolysate[J]. Food Research International,2019,116:707−716. doi: 10.1016/j.foodres.2018.09.001
[13] FENG Y X, RUAN G R, JIN F, et al. Purification, identification, and synthesis of five novel antioxidant peptides from Chinese chestnut (Castanea mollissima Blume) protein hydrolysates[J]. Food Science and Technology,2018,92:40−46.
[14] JIN J E, AHN C B, JE J Y. Purification and characterization of antioxidant peptides from enzymatically hydrolyzed ark shell (Scapharca subcrenata)[J]. Process Biochemistry,2018,72:170−176. doi: 10.1016/j.procbio.2018.06.001
[15] NIMALARATNE C, BANDARA N, WU J. Purification and characterization of antioxidant peptides from enzymatically hydrolyzed chicken egg white[J]. Food Chemistry,2015,188:467−472. doi: 10.1016/j.foodchem.2015.05.014
[16] JIN D X, LIU X I, ZHENG X Q, et al. Preparation of antioxidative corn protein hydrolysates, purification and evaluation of three novel corn antioxidant peptides[J]. Food Chemistry,2016,204:427−436. doi: 10.1016/j.foodchem.2016.02.119
[17] CUMBY N, ZHONG Y, NACZK M, et al. Antioxidant activity and water-holding capacity of canola protein hydrolysates[J]. Food Chemistry,2008,109(1):144−148. doi: 10.1016/j.foodchem.2007.12.039
[18] WANG L, MAO X Y, CHENG X, et al. Effect of enzyme type and hydrolysis conditions on thein vitro angiotensin I-converting enzyme inhibitory activity and ash content of hydrolysed whey protein isolate[J]. International Journal of Food Science & Technology,2010,45(4):807−812.
[19] LI X X, HAN L J, CHEN L J. In vitro antioxidant activity of protein hydrolysates prepared from corn gluten meal[J]. Journal of the Science of Food and Agriculture,2008,88(9):1660−1666. doi: 10.1002/jsfa.3264
[20] 马梦娇. 中华鳖肉抗氧化肽的制备及其抗衰老功能研究[D]. 无锡: 江南大学, 2020. MA M J. Preparation of antioxidant peptides from Chinese soft-shelled turtle and its anti-aging activity[D]. Wuxi: Jiangnan University, 2020.
[21] DONG Y, QI G, YANG Z, et al. Preparation, separation and antioxidant properties of hydrolysates derived from Grifola frondosa protein[J]. Analytical and Bioanalytical Chemistry,2015,33(6):500−506.
[22] ALASHI A M, BLANCHARD C L, MAILER R J, et al. Antioxidant properties of Australian canola meal protein hydrolysates[J]. Food Chemistry,2014,146:500−506. doi: 10.1016/j.foodchem.2013.09.081
[23] 宁诗文, 崔珊珊, 尚宏丽. 响应面法优化大黄花鱼肉蛋白水解工艺及多肽抗氧化性研究[J]. 食品工业科技,2020,41(13):219−226. [NING S W, CUI S S, SHANG H L. Optimization of the protein hydrolysis process by response surface method and the antioxidant properties of polypeptides in large yellow croaker[J]. Science and Technology of Food Industry,2020,41(13):219−226. NING S W, CUI S S, SHANG H L. Optimization of the protein hydrolysis process by response surface method and the antioxidant properties of polypeptides in Large Yellow Croaker[J]. Science and Technology of Food Industry, 2020, 41(13): 219-226.
[24] 谭梦. 低抗原性乳清蛋白的酶法制备及风味改善[D]. 杭州: 浙江大学, 2016. TAN M. The preparation of low antigenic whev protein by enzyme and flavor improvement[D]. Hangzhou: Zhejiang University, 2016.
[25] WANG D Y, SHAHIDI F. Protein hydrolysate from turkey meat and optimization of its antioxidant potential by response surface methodology[J]. Poult, 2018, 97(5): 1824−1831.
[26] 孙菁茹, 富天昕. 响应面法优化绿豆抗氧化肽的制备工艺[J]. 中国食品添加剂,2020,31(6):55−60. [SUN J R, FU T X. Optimization of preparation process of mung bean antioxidant peptideby response surface methodology[J]. China Food Additives,2020,31(6):55−60. SUN J R, FU T X. Optimization of preparation process of mung bean antioxidant peptideby response surface methodology[J]. China Food Additives, 2020, 31(6): 55-60.
[27] MA Y Y, XIONG Y L, ZHAI J J, et al. Fractionation and evaluation of radical scavenging peptides from in vitro digests of buckwheat protein[J]. Food Chemistry,2010,118(3):582−588. doi: 10.1016/j.foodchem.2009.05.024
[28] 马洪鑫. 藜麦蛋白抗氧化肽的制备及其作用机制研究[D]. 兰州: 西北民族大学, 2021. MA H X. Preparation and mechanism of quinoa protein antioxidnat peptides[D]. LanZhou: Northest Minzu University, 2021.
[29] FAN T, HU J G, FU L D, et al. Optimization of enzymolysis-ultrasonic assisted extraction of polysaccharides from Momordica charabtia L. by response surface methodology[J]. Carbohydrate Polymers,2015,115:701−706. doi: 10.1016/j.carbpol.2014.09.009
[30] ZHANG C, FAN D D, SHANG L A, et al. Optimization of fermentation process for human-like collagen production of recombinant Escherichia coli using response surface methodology[J]. Chinese Journal of Chemical Engineering,2010,18(1):137−142. doi: 10.1016/S1004-9541(08)60334-1
[31] HAO L, GAO X, ZHOU T, et al. Angiotensin I-converting enzyme (ACE) inhibitory and antioxidant activity of umami peptides after in vitro gastrointestinal digestion[J]. Journal of Agricultural and Food Chemistry,2020,68(31):8232−8241. doi: 10.1021/acs.jafc.0c02797
[32] KORHONEN H, PIHLANTO A. Bioactive peptides: Production and functionality[J]. International Dairy Journal,2006,16(9):945−960. doi: 10.1016/j.idairyj.2005.10.012
[33] 刘晓艺, 周玉岩, 过利敏, 等. 不同分子量红花籽抗氧化肽稳定性研究[J/OL]. 食品工业科技: 1−14[2022-06-13]. DOI: 10.13386/j.issn1002-0306.2021100248. LIU Z Y, ZHOU Y Y, GUO L M, et al. Stydy on the stability of antioxidant peptides from safflower with different molecular weight[J/OL]. Science and Technology of Food Industry: 1−14 [2022-06-13]. DOI: 10.13386/j.issn1002-0306.2021100248.
[34] KARAMI Z, AKBARI A B. Bioactive food derived peptides: A review on correlation between structure of bioactive peptides and their functional properties[J]. Journal of Food Science and Technology,2019,56(2):535−547. doi: 10.1007/s13197-018-3549-4
[35] YANG J, HUANG J C, DONG X L, et al. Purification and identification of antioxidant peptides from duck plasma proteins[J]. Food Chemistry,2020,319:126534. doi: 10.1016/j.foodchem.2020.126534





 下载:
下载:






 下载:
下载:
