Structural Characterization of Lipu Taro Globulin and Its Glucose Metabolism Activity on HepG2 Cells
-
摘要: 为了对荔浦芋球蛋白基本性质进行表征和探究其对细胞糖代谢影响的机制,测定了荔浦芋球蛋白的热稳定性、氨基酸组成和二级结构组成等性质;研究不同浓度荔浦芋球蛋白对胰岛素抵抗HepG2细胞的葡萄糖消耗量、肝糖原含量、己糖激酶和丙酮酸激酶活性的影响。结果表明,荔浦芋球蛋白的变性温度为79.30±1.36 ℃,对应焓值为7.46±0.53 J/g,该球蛋白富含天冬氨酸和谷氨酸,氨基酸评分为103.10%;二级结构组成为:β-折叠、无规卷曲、β-转角和α-螺旋含量分别为39.42%~42.14%、26.34%~31.38%、18.25%~24.16%和5.04%~13.27%;荔浦芋球蛋白能影响胰岛素抵抗细胞糖代谢,与对照组相比,球蛋白高剂量组(500 μg/mL)的葡萄糖消耗增加率40.62%±0.98%,肝糖原合成增加率26.35%±1.13%、己糖激酶活性增加率54.63%±2.48%和丙酮酸激酶活性增加率44.29%±2.64%。综上,荔浦芋球蛋白可以促进细胞葡萄糖的吸收、增加肝糖原合成和提高己糖激酶和丙酮酸激酶活性,从而影响糖代谢,作用机制可能与促进胰岛素分泌和增强糖酵解有关。Abstract: In order to characterize the basic properties of Lipu taro globulin and explore the mechanism of the effect on cell glucose metabolism globulin, thermal stability, amino acid composition and secondary structure composition were determined, and the effects of different concentrations of Lipu taro globulin on glucose consumption, liver glycogen content, hexokinase and pyruvate kinase activities of insulin resistant HepG2 cells were studied. The results showed that the denaturation temperature of Lipu taro globulin was 79.30±1.36 ℃, and the corresponding enthalpy values was 7.46±0.53 J/g. The globulin was rich of aspartic acid and glutamic acid, with an amino acid score of 103.10%. The secondary structure composition: The contents of β-sheet , random coil, β-turn and α-helix were 39.42%~42.14%, 26.34%~31.38%, 18.25%~24.16% and 5.04%~13.27%. Lipu taro globulin could affect glucose metabolism of insulin resistant cells, compared with the control group, Lipu taro globulin high dose group (500 μg/mL) increased glucose consumption by 40.62%±0.98%, increased liver glycogen content by 26.35%±1.13%, increased hexokinase activity by 54.63%±2.48% and increased pyruvate kinase activity by 44.29%±2.64%. In conclusion, Lipu taro globulin could promote cell glucose absorption, increase liver glycogen synthesis and improve the activities of hexokinase and pyruvate kinase, thus affecting glucose metabolism, the mechanism of action might be related to promoting insulin secretion and enhancing glycolysis.
-
芋头(Taro, Colocasia esculenta (L.) Schott.)俗名芋艿,天南星科魁芋属多年生草本植物。芋头分为魁芋、魁子兼用芋、多子芋和多头芋等,荔浦芋属于魁芋类。荔浦芋为广西特产,芋头蛋白属于块茎类蛋白,球蛋白占可溶性蛋白的80%左右,球蛋白相对分子量较低,与很多生物学活性相关。芋头的血糖生成指数值(Glycemic Index, GI)仅为47.7左右,低于山药(54)和土豆(66.4),但其淀粉含量高,因此推测芋头中可能存在糖苷酶影响的活性物质,而球蛋白与很多生物活性相关,芋头球蛋白对糖代谢影响及机理研究具有重要意义[1]。芋头蛋白具有抗氧化[2-3]、免疫调节[4-6]、抗肿瘤[7-8]、抗真菌[9-11]和血糖调节[12]等活性,一般采用α-淀粉酶抑制活性初步研究其血糖调节活性。McEwan 等[13]纯化得到两种α-淀粉酶抑制剂,能抑制动物来源的α-淀粉酶而不能抑制真菌淀粉酶。Seltzer等[14]纯化得一种糖蛋白,相对分子量11.80 kDa,pI=4.40,具有α-淀粉酶抑制活性。Kumari等[12]纯化出一种糖蛋白,相对分子量13.90 kDa,发现其能抑制α-淀粉酶,最适pH为6.90,70 ℃时保持81.50%的活性,可以抑制人的唾液α-淀粉酶和α-马铃薯淀粉酶。
胰岛素抵抗(Insulin Resistance,简称IR)是指机体内细胞对内源性或外源性胰岛素敏感性降低,导致外周靶组织对葡萄糖吸收效率下降的一种病理状态[15]。HepG2源于人的肝胚胎瘤细胞,保留了肝细胞的特征与功能,是体外研究胰岛素抵抗和糖代谢的理想模型[16]。糖原是葡萄糖的储存形式,HK和PK是糖酵解的限速酶,螺旋藻蛋白质能极显著提高胰岛素抵抗HepG2细胞的己糖激酶(Hexokinase,HK)和丙酮酸激(Pyruvate Kinase,PK)活性,通过促进糖酵解来调节糖代谢[17],可以通过葡萄糖消耗量,肝糖原合成量、己糖激酶和丙酮酸激酶活性表征活性物质对糖代谢功能影响的机制。
本课题前期采用0.10 mol/L的磷酸缓冲液(含0.30 mol/L NaCl,pH=6.8)提取、硫酸铵分离和DEAE-52离子交换层析法纯化得到一种纯度93.27%±0.62%的球蛋白,分子量为22.00 kDa,等电点5.6±0.2,具有α-淀粉酶和α-葡萄糖苷酶抑制活性,表现出一定的血糖调节潜力[18]。本文在此基础上对该球蛋白二级结构进行鉴定,并以葡萄糖消耗量、肝糖原含量、HK和PK活性为指标,首次阐明其对IR-HepG2细胞血糖调节的影响机理,有助于进一步理解荔浦芋球蛋白调节血糖的潜在机制,为荔浦芋球蛋白的活性研究奠定了基础。
1. 材料与方法
1.1 材料与仪器
荔浦芋球蛋白 前期实验提取纯化所得[18];HepG2细胞株、青霉素-链霉素溶液(双抗100×) 武汉普诺赛生命科技有限公司;DMEM高糖基础培养基、0.25%胰蛋白酶 比利时BI公司;胎牛血清(FBS) 浙江天杭生物科技股份有限公司;Cell Counting Kit 8试剂盒 新赛美生物科技有限公司;盐酸二甲双胍 上海麦克林生化科技有限公司;非变性组织/细胞裂解液、BCA蛋白浓度测定试剂盒 北京索莱宝科技有限公司;胰岛素、葡萄糖含量检测试剂盒 翼飞雪生物科技有限公司;糖原测定试剂盒、PK测定试剂盒、HK测定试剂盒 南京建成生物工程研究所。
DSC200PC差式扫描量热仪 德国耐驰仪器公司;NicoletiS10傅里叶变换红外光谱仪 美国热点公司;MOS-450圆二色谱仪 法国CBIO-LOGIN公司;L8900高速氨基酸分析仪 日本HITACHI公司;CLM-240B-8-CN二氧化碳培养箱 新加坡Esco公司;Infinite M200pro酶标仪 奥地利TECEN公司;CKX41SF倒置显微镜 日本OLYMPUS公司。
1.2 实验方法
1.2.1 球蛋白的差式扫描量热分析
采用差示扫描量热法测定球蛋白的热稳定性[19]。称取5.00 mg球蛋白,装在坩埚中测定TP和△H变化。仪器设置条件为:氮气气流量20 L/min,扫描温度范围25~150 ℃,升温速率10 ℃/min。
1.2.2 球蛋白二级结构鉴定
1.2.2.1 圆二色谱测定
参照Sharma等[20]的方法,配制0.25 mg/mL的球蛋白溶液,吸取适量注入1 mm光径比色皿中,采用圆二色谱仪在190~260 nm范围扫描。
1.2.2.2 红外光谱测定
参照孙佳锐等[21]的方法,将球蛋白与溴化钾混合研磨、压片,在4000~500 cm−1范围内扫描。
1.2.3 球蛋白氨基酸组成的测定
参照陈文等[22]的方法,采用氨基酸自动分析仪测定,称取50.00 mg球蛋白,酸水解后处理后过0.45 μm滤膜,上样进行氨基酸分析,并以纯化前的粗蛋白进行对照分析氨基酸含量变化。
1.2.4 球蛋白对IR-HepG2细胞糖代谢的影响
1.2.4.1 HepG2细胞的培养
细胞复苏后,收集细胞,加入新鲜的完全培养液,于37 ℃、5% CO2、湿度适宜的培养箱中培养,在倒置显微镜下观察细胞形态和密度,培养至汇合度90%后,用胰酶消化3~5 min,每2 d按1:3传代一次。
1.2.4.2 胰岛素抵抗细胞模型的建立
调整细胞浓度为1×105 cell/mL,接种于96孔板(200 μL/孔),培养至70%细胞汇合度,加入含浓度为10−5、10−6、10−7、10−8、10−9 mol/L的胰岛素培养24 h和10−7 mol/L胰岛素作用12、24、36 h和48 h,按照葡萄糖含量检测试剂盒说明书测定葡萄糖消耗量△GC,△GC=对照组细胞葡萄糖含量-样品组细胞葡萄糖含量。倒置显微镜下观察IR-HepG2细胞形态特征和生长状态。
采用CCK8法校正因细胞数量造成测定的结果差异。细胞活力的测定:按照试剂盒说明采用Cell Counting Kit 8(CCK8)法测定,计算细胞存活率,细胞存活率(%)=样品组细胞数/对照组细胞数×100。细胞数量标准曲线为:y=0.0131x+0.1895,R2=0.9970,其中,y为细胞浓度,单位1×104 cell/mL,x为OD450 nm。
1.2.4.3 荔浦芋球蛋白对IR-HepG2细胞葡萄糖消耗的影响
细胞复苏后于96孔板培养24 h后,对照组加培养基,模型组采用10−7 mol/L胰岛素作用36 h造模,每孔200 μL,模型组又分为二甲双胍(30 μg/mL)组和荔浦芋球蛋白高(500 μg/mL)、中(300 μg/mL)、低(100 μg/mL)剂量组[23],继续分别加入200 μL二甲双胍和相应浓度球蛋白,作用24 h后,测葡萄糖含量,计算△GC,葡萄糖消耗增加率(%)=(△GC样品组−△GC模型组)/△GC模型组×100。
1.2.4.4 荔浦芋球蛋白对IR-HepG2细胞肝糖原合成量和HK、PK活性的影响
细胞复苏后于6孔板培养24 h后,对照组加培养基,模型组采用10−7 mol/L胰岛素作用36 h造模,每孔2 mL,按1.2.4.3的方法加样2.00 mL,作用24 h后,胰酶消化,收集细胞,采用裂解液裂解细胞,12000 r/min在4 ℃离心5 min收集上清置于冰浴中,采用BCA试剂盒法测定蛋白质浓度,按试剂盒说明书测肝糖原含量和HK、PK活性,肝糖原合成增加率(%)=(样品组肝糖原含量−模型组肝糖原含量)/模型组肝糖原含量×100,酶活性增加率(%)=(样品组酶活性−模型组酶活性)/模型组酶活性×100。
1.3 数据处理
数据采用平均值±标准差的形式,每组做三个平行,采用SPSS 17.0、Excel 2010和Origin 8.0软件分析处理数据,圆二色谱数据采用Peakfit拟合软件和CDNN软件分析,红外数据处理采用OMNIC和Peakfit拟合软件分析。
2. 结果与分析
2.1 荔浦芋球蛋白的差式扫描量热分析
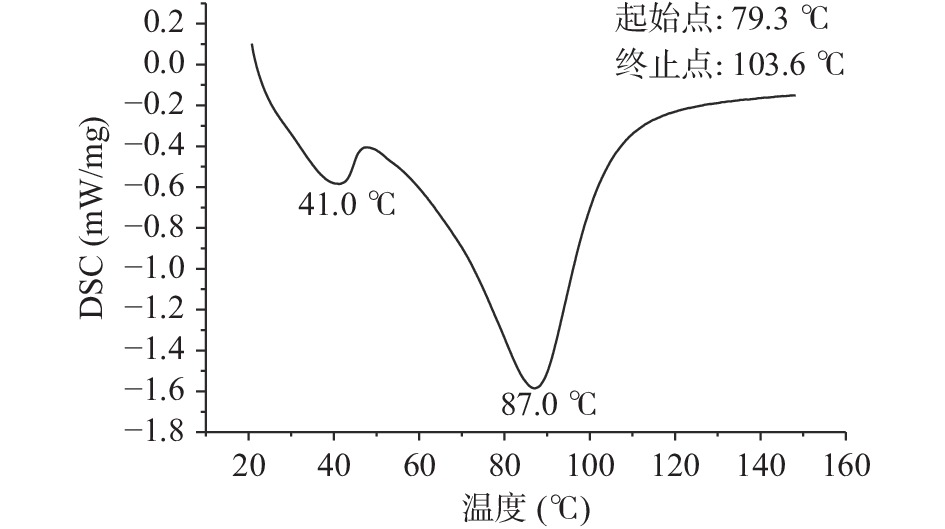
蛋白质的热稳定性可以用热变性温度TP和诱导变性所需要的能量焓值ΔH来表示。ΔH可以反映出蛋白分子的疏水性和亲水性以及聚集程度,与蛋白的二级结构有关,ΔH越大,表明蛋白亲水性和分子聚集度越高。在一定的升温或降温过程中,采用差示扫描量热仪对荔浦芋球蛋白质的热效应进行测定,可以间接反应蛋白质的结构及其所处的状态。从图1中可以看出,荔浦芋球蛋白的变性温度为79.30±1.36 ℃,ΔH为7.46±0.53 J/g,变性温度高说明蛋白具有较强的温度耐受性,亲水性和分子聚集度高,变性焓较高,说明球蛋白中有序结构所占比例较大。
2.2 荔浦芋球蛋白的二级结构鉴定
2.2.1 圆二色谱分析
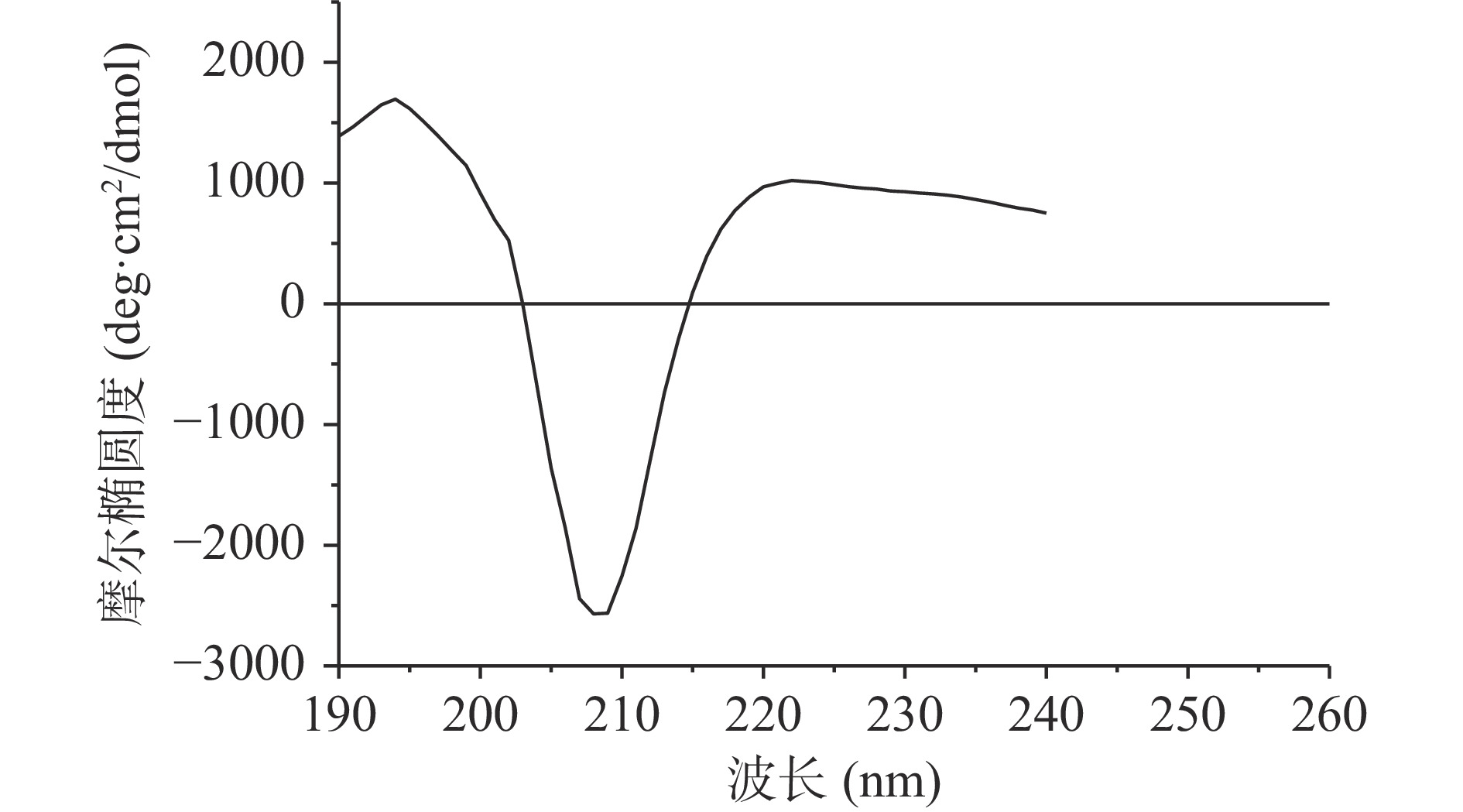
荔浦芋球蛋白的圆二色谱如图2所示,在209 nm附近有负的最大吸收峰,为β-折叠的特征负吸收峰,不存在α-螺旋的双负槽峰,因此可以推测球蛋白含有大量的β-折叠以及少量无规卷曲,少量或不含α-螺旋。利用CDNN软件计算荔浦芋球蛋白的二级结构含量:α-螺旋为8.12%,β-折叠为42.61%,无规卷曲为29.05%,β-转角为20.22%。
2.2.2 傅里叶红外光谱分析
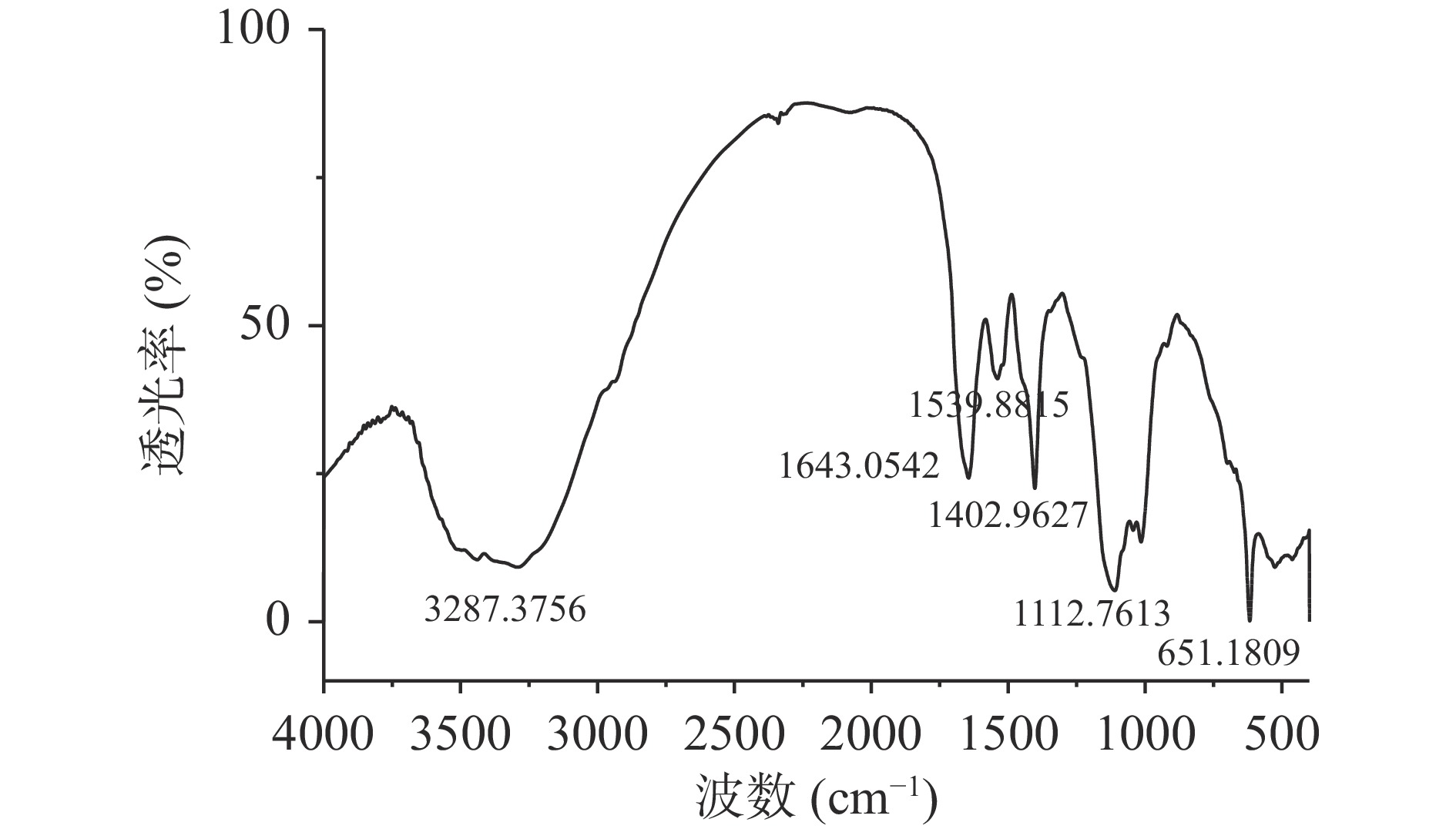
通过分析荔浦芋球蛋白的红外光谱图(图3示),在1402 cm−1处的吸收比1539 cm−1的强,它们分别是-HN-C=O的顺式和反式结构的吸收峰,且顺式构型能量比反式构型高,稳定性差,因此,表明荔浦芋球蛋白天然结构可能在旋蒸浓缩或硫酸铵分离过程中遭到了一定程度地破坏,1643 cm−1处的吸收峰表明球蛋白中含有C=O伸缩振动。
由表1可以得到荔浦芋球蛋白吸收峰的归属,一般蛋白质的二级结构主要受酰胺I区和酰胺III区的影响,因此,采用Peakfit拟合软件对荔浦芋球蛋白红外光谱的酰胺I区和酰胺III区进行二阶导数去卷曲和曲线拟合,进行多次拟合使残差最小,使重叠的图谱可以完全分开而有利于分辨,各个波长与其结构对照关系计算蛋白质二级结构比例。
由表2可知,荔浦芋球蛋白二级结构包括:5.04%~13.27%的α-螺旋,39.42%~42.14%的β-折叠,18.25%~24.16%的β-转角,26.34%~31.38%的无规卷曲。二级结构与圆二色谱略有差异,但趋势一致,含量由高到低依次是β-折叠、无规卷曲、β-转角、α-螺旋。
表 2 荔浦芋球蛋白二级结构组成Table 2. Secondary structure composition of Lipu taro globulin酰胺区域 二级结构组成 α-螺旋 β-折叠 β-转角 无规卷曲 酰胺I区 特征峰(cm−1) 1643 1619 1682(9.59),
1695(8.66)1646 含量(%) 13.27 42.14 18.25 26.34 酰胺III区 特征峰(cm−1) 1306 1234 1275 1258 含量(%) 5.04 39.42 24.16 31.38 注:括号内数据为特征峰所占比例,单位为%。 2.2.3 荔浦芋球蛋白氨基酸组成分析
荔浦芋球蛋白和粗蛋白的氨基酸组成如表3所示。荔浦芋球蛋白中含量最高的三种氨基酸均为天冬氨酸、谷氨酸和亮氨酸,纯化后分别占总氨基酸的17.70%、11.35%、10.39%,其中天冬氨酸和谷氨酸属于酸性氨基酸。
表 3 荔浦芋球蛋白氨基酸组成分析(g/100 g)Table 3. Amino acid composition of Lipu taro globlin (g/100 g)氨基酸种类 荔浦芋粗蛋白 荔浦芋球蛋白 天冬氨酸(Asp)3 13.95±0.08 15.16±0.08 苏氨酸(Thr)1 2.44±0.05 2.86±0.03 丝氨酸(Ser) 2.31±0.07 2.87±0.02 谷氨酸(Glu)3 7.97±0.06 9.72±0.05 甘氨酸(Gly)4 4.89±0.05 5.43±0.04 丙氨酸(Ala)4 3.61±0.04 4.61±0.03 半胱氨酸(Cys)6 1.26±0.03 1.24±0.01 缬氨酸(Val)1,4 4.79±0.05 5.46±0.02 蛋氨酸(Met)1,4,6 0.73±0.04 0.99±0.01 异亮氨酸(IIe)1,4 2.90±0.05 3.40±0.02 亮氨酸(Leu)4 8.08±0.03 8.90±0.05 酪氨酸(Tyr)5 1.90±0.02 1.08±0.01 苯丙氨酸(Phe)1,4,5 6.56±0.02 7.55±0.04 赖氨酸(Lys)1,2 3.97±0.02 4.61±0.03 组氨酸(His)1,2 1.97±0.01 2.18±0.01 精氨酸(Arg)2 5.09±0.03 5.91±0.02 脯氨酸(Pro)4 3.06±0.01 3.64±0.01 必需氨基酸 29.48±0.02 33.77±0.03 总氨基酸 75.48±0.07 85.61±0.11 注:1:必需氨基酸;2:碱性氨基酸;3:酸性氨基酸;4:疏水氨基酸;5:含苯环氨基酸;6:含硫氨基酸。 荔浦芋球蛋白必需氨基酸组成评价如表4,球蛋白的氨基酸评分为103.10%,必需氨基酸含量符合FAO/WHO成人推荐标准。
表 4 荔浦芋球蛋白必需氨基酸组成评价Table 4. Evaluation of essential amino acid composition of Lipu taro globlin必需
氨基酸FAO/WHO
模式
(g/100 g)粗蛋白
(g/100 g)球蛋白
(g/100 g)粗蛋白氨
基酸评分
(%)球蛋白氨
基酸评分
(%)苏氨酸 4.0 2.44 2.86 61.00 71.50 异亮氨酸 4.0 2.90 3.40 72.05 85.00 亮氨酸 7.0 8.08 8.90 115.40 127.10 蛋氨酸+半胱氨酸 3.5 1.99 2.23 56.90 63.70 苯丙氨酸+酪氨酸 6.0 8.46 8.63 141.00 143.80 赖氨酸 5.5 3.97 4.61 72.20 83.80 缬氨酸 5.0 4.79 5.46 95.80 109.20 氨基酸综合评分 35.0 32.63 36.09 93.20 103.10 脯氨酸(Pro)和丙氨酸(Ala)等与抑制二肽基肽酶-IV(DPP-IV)活性有关,能抑制碳水化合物水解生成葡萄糖[25]。α-葡萄糖苷酶和α-淀粉酶抑制活性受Leu和Pro这两种疏水氨基酸影响[26]。活性肽中的脯氨酸可能通过影响肽的柔韧性增加其与α-淀粉酶和α-葡糖苷酶的结合力[27],脯氨酸在碳末端区域的存在是有效肽抑制剂的一个共同特征,也有报道保护肽免受蛋白水解[28],亮氨酸被认为是通过代谢变构激活和/或膜去极化来增强胰岛素分泌的关键,碳末端精氨酸对多肽的抑制活性有积极作用[29]。
2.2.4 荔浦芋球蛋白对IR-HepG2细胞糖代谢的影响
2.2.4.1 胰岛素抵抗细胞模型的建立
由表5可知,在胰岛素浓度为1×10−7 mol/L时,细胞葡萄糖消耗最低,表明此时细胞处于胰岛素抵抗状态,显著减少了葡萄糖的吸收。
表 5 不同胰岛素浓度作用24 h后细胞的葡萄糖消耗量Table 5. Glucose consumption of cells exposed to different insulin concentrations for 24 h组别 浓度
(mol/L)葡萄糖消耗量
(μmol/mL)细胞存活
率(%)校正后葡萄糖消耗量
(μmol/106 cell)对照组 − 14.53±0.6a 100.00a 58.12±0.04a
胰岛素1×10−5 7.36±0.05c 90.15±0.25e 29.45±0.03c 1×10−6 6.85±0.03d 93.68±0.43d 27.39±0.03d 1×10−7 6.33±0.06d 95.41±0.31c 25.32±0.03e 1×10−8 7.48±0.05c 95.72±0.52c 29.93±0.04c 1×10−9 8.07±0.03b 96.37±0.19b 32.29±0.04b 注:同一列不同字母表示显著性差异(P<0.01)。 由表6可知,与对照组相比,36 h之前葡萄糖消耗量有显著差异,在36 h处差异达到最大,而48 h时虽然葡萄糖消耗量差异大,但其细胞存活率显著降低,因此胰岛素作用时间选择36 h。
表 6 1×10−7 mol/L胰岛素作用不同时间后葡萄糖消耗量Table 6. Glucose consumption of cells after 1×10−7 mol/L insulin treatment for different time作用时间(h) 葡萄糖消耗量(μmol/mL) 细胞存活率(%) 校正后葡萄糖消耗量(μmol/106 cell) 对照组 模型组 对照组 模型组 12 11.24±0.05 10.84±0.02** 98.26±0.26 16.87±0.05 36.25±0.03** 24 13.48±0.05 6.36±0.05** 97.98±0.51 40.43±0.07 25.32±0.05** 36 14.53±0.06 5.34±0.06** 97.41±0.43 58.12±0.04 23.17±0.03** 48 20.57±0.05 10.33±0.07** 95.64±0.16▼▼ 102.87±0.04 51.64±0.05** 注:**表示与对照组相比具有显著性差异(P<0.01);▼▼表示与作用时间12 h相比有显著性差异(P<0.01)。 2.2.4.2 荔浦芋球蛋白对IR-HepG2细胞葡萄糖消耗的影响
由表7可知,与对照组相比,模型组的葡萄糖消耗量显著降低,表明造模成功,可用于进一步研究,二甲双胍组和球蛋白组糖消耗量明显大于模型组,随球蛋白浓度的增加葡萄糖消耗量也增加,说明在该浓度范围内,葡萄糖消耗与荔浦芋球蛋白存在量效关系。当球蛋白浓度达到500 μg/mL时,葡萄糖消耗增加率达到40.62%±0.98%,阳性对照62.89%±0.71%,说明荔浦芋球蛋白能促进IR-HepG2对葡萄糖的消耗。CCK8检测结果显示,当球蛋白浓度为500 μg/mL,对细胞的抑制率接近20%,说明高浓度球蛋白会抑制细胞生长繁殖或对细胞造成损伤。
表 7 荔浦芋球蛋白对IR-HepG2细胞葡萄糖消耗量的影响Table 7. Effect of Lipu taro globuline on glucose consumption in IR-HepG2 cells组别 质量浓度(μg/mL) 葡萄糖消耗量(μmol/mL) 细胞存活率(%) 校正后葡萄糖消耗量
(μmol/106 cell)校正后葡萄糖消耗增加率(%) 对照组 − 16.27±0.04 100.00 81.22±0.32 − 模型组 − 6.30±0.02▼▼ 92.50±1.80▼▼ 31.48±0.19▼▼ − 二甲双胍 30 12.58±0.03** 97.40±1.50** 52.41±0.24** 62.89±0.71 荔浦芋
球蛋白100 7.99±0.05** 90.80±2.30 36.82±0.41** 16.97±0.18 300 9.48±0.06** 87.40±2.70** 41.52±0.55** 31.90±1.50 500 10.35±0.11** 80.50±2.50** 44.27±0.36** 40.62±0.98 注:▼▼P<0.01 VS 对照组;**P<0.01 VS 模型组。 2.2.4.3 荔浦芋球蛋白对IR-HepG2细胞肝糖原合成量和HK、PK活性的影响
由表8可知,模型组的肝糖原合成量和HK、PK活性均显著小于对照组(P<0.01),表明造模成功。与模型组相比,二甲双胍能极显著增加肝糖原合成量和HK、PK活性(P<0.01);荔浦芋球蛋白极显著增加肝糖原合成量,最高可以增加28.80%±1.26%,能显著增加PK活性(P<0.01),最高可以增加44.29%±2.64%,能显著增加HK活性(P<0.01),最高可以增加54.63%±2.48%。苦瓜蛋白增强糖尿病大鼠HK的活性[30],马鹿鹿角蛋白显著提高了糖尿病小鼠肝脏中HK和PK的活性[31],鲜味多肽显著提高小鼠的葡萄糖消耗量、HK和PK活性[32],螺旋藻蛋白质能极显著提高胰岛素抵抗HepG2细胞的HK和PK活性[33]。综上,活性蛋白作用于细胞表面受体通过改善胰岛素信号通路,促进葡萄糖转化为肝糖原,同时增强HK和PK活性,通过增强糖酵解途径调节糖代谢。
表 8 荔浦芋球蛋白对IR-HepG2细胞肝糖原合成量、HK和PK活性的影响Table 8. Effect of Lipu taro globuline on liver glycogen synthesis, activity of HK and PK in IR-HepG2 cells
组别
质量浓度(μg/mL)肝糖原 HK PK 含量(mg/g pro) 合成增加率(%) 活性(U/g pro) 活性增加率(%) 活性(U/g pro) 活性增加率(%) 对照组 − 6.92±0.57 − 9.85±0.26 − 49.24±1.47 − 模型组 − 3.85±0.22▲▲ − 5.42±0.15▲▲ − 27.61±0.89▲▲ − 二甲双胍组 30 6.77±0.47**▲▲ 75.90±3.91 9.36±0.12** 72.69±0.23 48.19±0.75**▲▲ 74.53±1.41 荔浦芋球蛋白组 100 4.45±0.36**▲▲ 15.31±0.81 6.07±0.27** 11.96±3.61 30.98±0.97**▲▲ 12.21±1.80 300 4.96±0.41**▲▲ 28.80±1.26 6.53±0.19** 20.54±1.81 35.54±1.02**▲▲ 28.71±2.03 500 4.86±0.38**▲▲ 26.35±1.13 8.38±0.22** 54.63±2.48 39.84±1.15**▲▲ 44.29±2.64 注:▲▲P<0.01 VS 对照组;**P<0.01 VS 模型组。 综上,荔浦芋球蛋白能增加IR-HepG2细胞的肝糖原合成量,提高HK、PK活性,可能是通过调节糖酵解缓解因胰岛素抵抗导致的葡萄糖吸收减少的情况,对于餐后血糖的调节具有指导意义。
3. 结论
荔浦芋球蛋白变性温度为79.30±1.36 ℃,对应焓值为7.46±0.53 J/g,二级结构组成含量为:β-折叠39.42%~42.14%,无规卷曲26.34%~31.38%,β-转角18.25%~24.16%,α-螺旋5.04%~13.27%。该球蛋白富含天冬氨酸和谷氨酸,符合一般植物贮藏蛋白的规律,氨基酸评分为103.10%,必需氨基酸含量符合FAO/WHO成人推荐标准。
本研究首次鉴定荔浦芋球蛋白二级结构,并以IR-HepG2细胞模型探究其对糖代谢的影响,球蛋白浓度为500 μg/mL时,葡萄糖消耗量增加40.62%±0.98%,肝糖原合成增加率为26.35%±1.13%,PK活性增加率为44.29%±2.64%,HK活性增加率为54.63%±2.48%,初步证明其可以通过促进葡萄糖吸收、增加肝糖原合成和增强糖酵解影响糖代谢,能显著改善胰岛素抵抗导致的葡糖糖吸收障碍。综上,荔浦芋球蛋白可能是通过作用于细胞表面通过胰岛素信号通路促进胰岛素分泌、增加肝糖原合成和增强糖酵解来影响糖代谢,其具体的作用机制需要研究胰岛素抵抗信号通路中相关基因和蛋白的表达来验证,在后续动物实验和应用于功能食品中时,可以通过微胶囊化等技术对蛋白进行包埋使其避开胃肠道消化达到靶器官再发挥作用。
-
区域 特征峰(cm−1) 峰归属 酰胺I区 1646.07 C=O伸缩振动 酰胺Ⅱ区 1537.53 NH面内弯曲振动和CN伸缩振动 酰胺III区 1237.55 CN伸缩振动和NH面内弯曲振动 酰胺Ⅳ区 661.89 O=C-N面内弯曲振动 酰胺Ⅴ区 741.37 NH面内弯曲振动 酰胺Ⅵ区 616.00 C=O面内弯曲振动 表 2 荔浦芋球蛋白二级结构组成
Table 2 Secondary structure composition of Lipu taro globulin
酰胺区域 二级结构组成 α-螺旋 β-折叠 β-转角 无规卷曲 酰胺I区 特征峰(cm−1) 1643 1619 1682(9.59),
1695(8.66)1646 含量(%) 13.27 42.14 18.25 26.34 酰胺III区 特征峰(cm−1) 1306 1234 1275 1258 含量(%) 5.04 39.42 24.16 31.38 注:括号内数据为特征峰所占比例,单位为%。 表 3 荔浦芋球蛋白氨基酸组成分析(g/100 g)
Table 3 Amino acid composition of Lipu taro globlin (g/100 g)
氨基酸种类 荔浦芋粗蛋白 荔浦芋球蛋白 天冬氨酸(Asp)3 13.95±0.08 15.16±0.08 苏氨酸(Thr)1 2.44±0.05 2.86±0.03 丝氨酸(Ser) 2.31±0.07 2.87±0.02 谷氨酸(Glu)3 7.97±0.06 9.72±0.05 甘氨酸(Gly)4 4.89±0.05 5.43±0.04 丙氨酸(Ala)4 3.61±0.04 4.61±0.03 半胱氨酸(Cys)6 1.26±0.03 1.24±0.01 缬氨酸(Val)1,4 4.79±0.05 5.46±0.02 蛋氨酸(Met)1,4,6 0.73±0.04 0.99±0.01 异亮氨酸(IIe)1,4 2.90±0.05 3.40±0.02 亮氨酸(Leu)4 8.08±0.03 8.90±0.05 酪氨酸(Tyr)5 1.90±0.02 1.08±0.01 苯丙氨酸(Phe)1,4,5 6.56±0.02 7.55±0.04 赖氨酸(Lys)1,2 3.97±0.02 4.61±0.03 组氨酸(His)1,2 1.97±0.01 2.18±0.01 精氨酸(Arg)2 5.09±0.03 5.91±0.02 脯氨酸(Pro)4 3.06±0.01 3.64±0.01 必需氨基酸 29.48±0.02 33.77±0.03 总氨基酸 75.48±0.07 85.61±0.11 注:1:必需氨基酸;2:碱性氨基酸;3:酸性氨基酸;4:疏水氨基酸;5:含苯环氨基酸;6:含硫氨基酸。 表 4 荔浦芋球蛋白必需氨基酸组成评价
Table 4 Evaluation of essential amino acid composition of Lipu taro globlin
必需
氨基酸FAO/WHO
模式
(g/100 g)粗蛋白
(g/100 g)球蛋白
(g/100 g)粗蛋白氨
基酸评分
(%)球蛋白氨
基酸评分
(%)苏氨酸 4.0 2.44 2.86 61.00 71.50 异亮氨酸 4.0 2.90 3.40 72.05 85.00 亮氨酸 7.0 8.08 8.90 115.40 127.10 蛋氨酸+半胱氨酸 3.5 1.99 2.23 56.90 63.70 苯丙氨酸+酪氨酸 6.0 8.46 8.63 141.00 143.80 赖氨酸 5.5 3.97 4.61 72.20 83.80 缬氨酸 5.0 4.79 5.46 95.80 109.20 氨基酸综合评分 35.0 32.63 36.09 93.20 103.10 表 5 不同胰岛素浓度作用24 h后细胞的葡萄糖消耗量
Table 5 Glucose consumption of cells exposed to different insulin concentrations for 24 h
组别 浓度
(mol/L)葡萄糖消耗量
(μmol/mL)细胞存活
率(%)校正后葡萄糖消耗量
(μmol/106 cell)对照组 − 14.53±0.6a 100.00a 58.12±0.04a
胰岛素1×10−5 7.36±0.05c 90.15±0.25e 29.45±0.03c 1×10−6 6.85±0.03d 93.68±0.43d 27.39±0.03d 1×10−7 6.33±0.06d 95.41±0.31c 25.32±0.03e 1×10−8 7.48±0.05c 95.72±0.52c 29.93±0.04c 1×10−9 8.07±0.03b 96.37±0.19b 32.29±0.04b 注:同一列不同字母表示显著性差异(P<0.01)。 表 6 1×10−7 mol/L胰岛素作用不同时间后葡萄糖消耗量
Table 6 Glucose consumption of cells after 1×10−7 mol/L insulin treatment for different time
作用时间(h) 葡萄糖消耗量(μmol/mL) 细胞存活率(%) 校正后葡萄糖消耗量(μmol/106 cell) 对照组 模型组 对照组 模型组 12 11.24±0.05 10.84±0.02** 98.26±0.26 16.87±0.05 36.25±0.03** 24 13.48±0.05 6.36±0.05** 97.98±0.51 40.43±0.07 25.32±0.05** 36 14.53±0.06 5.34±0.06** 97.41±0.43 58.12±0.04 23.17±0.03** 48 20.57±0.05 10.33±0.07** 95.64±0.16▼▼ 102.87±0.04 51.64±0.05** 注:**表示与对照组相比具有显著性差异(P<0.01);▼▼表示与作用时间12 h相比有显著性差异(P<0.01)。 表 7 荔浦芋球蛋白对IR-HepG2细胞葡萄糖消耗量的影响
Table 7 Effect of Lipu taro globuline on glucose consumption in IR-HepG2 cells
组别 质量浓度(μg/mL) 葡萄糖消耗量(μmol/mL) 细胞存活率(%) 校正后葡萄糖消耗量
(μmol/106 cell)校正后葡萄糖消耗增加率(%) 对照组 − 16.27±0.04 100.00 81.22±0.32 − 模型组 − 6.30±0.02▼▼ 92.50±1.80▼▼ 31.48±0.19▼▼ − 二甲双胍 30 12.58±0.03** 97.40±1.50** 52.41±0.24** 62.89±0.71 荔浦芋
球蛋白100 7.99±0.05** 90.80±2.30 36.82±0.41** 16.97±0.18 300 9.48±0.06** 87.40±2.70** 41.52±0.55** 31.90±1.50 500 10.35±0.11** 80.50±2.50** 44.27±0.36** 40.62±0.98 注:▼▼P<0.01 VS 对照组;**P<0.01 VS 模型组。 表 8 荔浦芋球蛋白对IR-HepG2细胞肝糖原合成量、HK和PK活性的影响
Table 8 Effect of Lipu taro globuline on liver glycogen synthesis, activity of HK and PK in IR-HepG2 cells
组别
质量浓度(μg/mL)肝糖原 HK PK 含量(mg/g pro) 合成增加率(%) 活性(U/g pro) 活性增加率(%) 活性(U/g pro) 活性增加率(%) 对照组 − 6.92±0.57 − 9.85±0.26 − 49.24±1.47 − 模型组 − 3.85±0.22▲▲ − 5.42±0.15▲▲ − 27.61±0.89▲▲ − 二甲双胍组 30 6.77±0.47**▲▲ 75.90±3.91 9.36±0.12** 72.69±0.23 48.19±0.75**▲▲ 74.53±1.41 荔浦芋球蛋白组 100 4.45±0.36**▲▲ 15.31±0.81 6.07±0.27** 11.96±3.61 30.98±0.97**▲▲ 12.21±1.80 300 4.96±0.41**▲▲ 28.80±1.26 6.53±0.19** 20.54±1.81 35.54±1.02**▲▲ 28.71±2.03 500 4.86±0.38**▲▲ 26.35±1.13 8.38±0.22** 54.63±2.48 39.84±1.15**▲▲ 44.29±2.64 注:▲▲P<0.01 VS 对照组;**P<0.01 VS 模型组。 -
[1] 杨月欣, 崔红梅, 王岩, 等. 常见谷类和薯类的血糖生成指数[J]. 营养学报,2003(2):185−189. [YANG Yuexin, CUI Hongmei, WANG Yan, et al. The glycemic index of common cereals and tubers products[J]. Journal of Nutrition,2003(2):185−189. YANG Yuexin, CUI Hongmei, WANG Yan, et al. The glycemic index of common cereals and tubers products[J]. 营养学报, 2003(2): 185-189.
[2] WU C Y, LIN K W. The antioxidative characteristics of taro and sweet potato protein hydrolysates and their inhibitory capability on angiotensin converting enzyme[J]. Food Science and Technology Research,2017,23(6):845−853. doi: 10.3136/fstr.23.845
[3] MOHAMMED A I, MEGAN J B, ALBERT W N, et al. Tuber storage proteins as potential precursors of bioactive peptides: An in silico analysis[J]. International Journal of Peptide Research and Therapeutics,2019,25(2):437−446. doi: 10.1007/s10989-018-9688-7
[4] PEREIRA P R, WINTER H C, VERICIMO M A, et al. Structural analysis and binding properties of isoforms of tarin, the GNA-related lectin from Colocasia esculenta[J]. Biochimica et Biophysica Acta,2015,1854(1):20−30. doi: 10.1016/j.bbapap.2014.10.013
[5] PEREIRA P R, AGUILA E M D, VERICIMO M A, et al. Purification and characterization of the lectin from taro (Colocasia esculenta) and its effect on mouse splenocyte proliferation in vitro and in vivo[J]. The Protein Journal,2014,33(1):92−99. doi: 10.1007/s10930-013-9541-y
[6] PEREIRA P R, CORREA A C N T, VERICIMO M A, et al. Tarin, a potential immunomodulator and COX-inhibitor lectin found in taro (Colocasia esculenta)[J]. Comprehensive Reviews in Food Science and Food Safety,2018,17(4):878−891. doi: 10.1111/1541-4337.12358
[7] KUNDU N, CAMPBELL P, HAMPTON B, et al. Antimetastatic activity isolated from Colocasia esculenta (taro)[J]. Anti-Cancer Drugs,2012,23(2):200−211. doi: 10.1097/CAD.0b013e32834b85e8
[8] YU J, LIU P, DUAN J, et al. Itches-stimulating compounds from Colocasia esculenta (taro): Bioactive-guided screening and LC-MS/MS identification[J]. Bioorganic & Medicinal Chemistry Letters,2015,25(20):4382−4386.
[9] CHAN Y S, WONG J H, NG T B. A cytokine-inducing hemagglutinin from small taros[J]. Protein & Peptide Letters,2010,17(7):823−830.
[10] HIRAI M, NAKAMURA K, IMAI T, et al. cDNAs encoding for storage proteins in the tubers of taro (Colocasia esculenta Schott)[J]. The Japanese Journal of Genetics,1993,68(3):229−236. doi: 10.1266/jjg.68.229
[11] BEZERRA I C, CASTRO L A B, NESHICH G, et al. A corm-specific gene encodes tarin, a major globulin of taro (Colocasia esculenta L. Schott)[J]. Plant Molecular Biology,1995,28(1):137−144. doi: 10.1007/BF00042045
[12] KUMARI B, SHAMA P, NATH A K. α-Amylase inhibitor in local Himalyan collections of Colocasia: Isolation, purification, characterization and selectivity towards α-amylases from various sources[J]. Pesticide Biochemistry and Physiology,2012,103(1):49−55. doi: 10.1016/j.pestbp.2012.03.003
[13] MCEWAN R, MADIVHA R P, DJAROVA T, et al. Alpha-amylase inhibitor of amadumbe (Colocasia esculenta): Isolation, purification and selectivity toward α-amylases from various sources[J]. African Journal of Biochemistry Research,2010,4(9):220−224.
[14] SELTZER R D, STRUMEYER D H. Purification and characterization of esculentamin, a proteinaceous α-amylase inhibitor from the taro root, Colocasia esculenta[J] Journal of Food Biochemistry, 2010.14(3), 199-217.
[15] 吴嘉璠. 茶黄素在HepG2细胞和2型糖尿病小鼠模型中改善胰岛素抵抗及其分子机制研究[D]. 杭州: 浙江大学, 2020. WU Jiafan. Study on the improvement of insulin resistance and molecular mechanism of theafronin in HepG2 cells and mice model of type 2 diabetes mellitus[D]. Hangzhou: Zhejiang University, 2020.
[16] 方飞, 吴新荣, 罗明俐, 等. HepG2细胞胰岛素抵抗模型的建立及在筛选桑叶有效部位中的应用[J]. 医药导报,2012,31(6):691−694. [FANG Fei, WU Xinrong, LUO Mingli, et al. Establishment of insulin resistance model of HepG2 cells and its application in screening effective parts of mulberry leaves[J]. Medical Review,2012,31(6):691−694. doi: 10.3870/yydb.2012.06.001 FANG Fei, WU Xinrong, LUO Mingli, et al. Establishment of insulin resistance model of HepG2 cells and its application in screening effective parts of Mulberry leaves[J]. Medical review, 2012, 31(6): 691-694. doi: 10.3870/yydb.2012.06.001
[17] HU S, FAN X, QI P, et al. Identification of anti-diabetes peptides from Spirulina platensis[J]. Journal of Functional Foods,2019,56:333−341. doi: 10.1016/j.jff.2019.03.024
[18] 马二兰, 林莹, 涂连, 等. 芋头球蛋白的提取纯化及其对α-淀粉酶和α-葡萄糖苷酶抑制活性研究[J]. 食品工业科技,2021,42(14):25−32. [MA Erlan, LIN Ying, TU Lian, et al. Extraction and purification of taro globulin and its inhibitory activity against α-amylase and α-glucosidase[J]. Science and Technology of Food Industry,2021,42(14):25−32. MA Erlan, LIN Ying, TU Lian, et al. Extraction and purification of taro globulin and its inhibitory activity against α-amylase and α-glucosidase[J]. Science and Technology of Food Industry, 201, 42(14): 25-32.
[19] RAO Q, LABIZA T P. Effect of moisture content on selected physicochemical properties of two commercial hen egg white powders[J]. Food Chemistry,2012,132(1):373−384. doi: 10.1016/j.foodchem.2011.10.107
[20] SHARMA G M, MUNDOMA C, SEAVY M, et al. Purification and biochemical characterization of Brazil nut (Bertholletia excelsa L.) seed storage proteins[J]. Journal of Agricultural & Food Chemistry,2010,58(9):5714−5723.
[21] 孙佳悦, 钱方, 姜淑娟, 等. 基于红外光谱分析热处理对牛乳蛋白质二级结构的影响[J]. 食品科学,2017,38(23):82−86. [SUN Jiayue, QIAN Fang, JIANG Shujuan, et al. Effects of heat treatment on protein secondary structure of milk based on infrared spectroscopy[J]. Food Science,2017,38(23):82−86. doi: 10.7506/spkx1002-6630-201723014 SUN Jiayue, QIAN Fang, JIANG Shujuan, et al. Effects of heat treatment on protein secondary structure of milk based on infrared spectroscopy[J]. Food Science, 2017, 38(23): 82-86. doi: 10.7506/spkx1002-6630-201723014
[22] 陈文, 王湘君, 赵阳, 等. 酸水解-全自动氨基酸分析仪测定方格星虫中氨基酸[J]. 食品工业科技,2017,38(3):299−304. [CHEN Wen, WANG Xiangjun, ZHAO Yang, et al. Determination of amino acids from Sipunculs nudus by acid hydrolysis-automatic amino acid analyzer[J]. Science and Technology of Food Industry,2017,38(3):299−304. CHEN Wen, WANG Xiangjun, ZHAO Yang, et al. Determination of amino acids from Sipunculs nudus by acid hydrolysis-automatic amino acid analyzer[J]. Science and Technology of Food Industry, 2017, 38(3): 299-304.
[23] 尤玲玲, 陈永慧, 刘金福, 等. 苦瓜皂苷对胰岛素抵抗HepG2细胞葡萄糖消耗量的影响[J]. 食品工业科技,2014,35(5):338−340. [YOU Lingling, CHEN Yonghui, LIU Jinfu, et al. The effect of momordica charantia saponins on glucose consumption of insulin-resistant HepG2 cells[J]. Science and Technology of Food Industry,2014,35(5):338−340. YOU Lingling, CHEN Yonghui, LIU Jinfu, et al. The effect of momordica charantia saponins on glucose consumption of insulin-resistant HepG2 cells[J]. Science and Technology of Food Industry, 2014, 35(5): 338-340.
[24] 童晶晶. 香芋蛋白的提取及其胰蛋白酶抑制剂的研究[D]. 广州: 华南理工大学, 2016. TONG Jingjing. Study on extraction of taro protein and its trypsin inhibitor[D]. Guangzhou: South China University of Technology, 2016.
[25] 刘志彤, 郑淋, 王晨阳, 等. 海参二肽基肽酶IV抑制肽的酶解制备及结构鉴定[J]. 现代食品科技,2020,36(8):166−174. [LIU Zhitong, ZHENG Lin, WANG Chenyang, et al. Preparation and structure identification of dipeptidyl peptidase IV inhibitory peptide from sea cucumber[J]. Modern Food Science and Technology,2020,36(8):166−174. LIU Zhitong, ZHENG Lin, WANG Chenyang, et al. Preparation and structure identification of dipeptidyl peptidase IV inhibitory peptide from sea cucumber[J]. Modern Food Science and Technology, 2020, 36(8): 166-174.
[26] YU Z, YIN Y, ZHAO W, et al. Anti-diabetic activity peptides from albumin against α-glucosidase and α-amylase[J]. Food Chemistry,2012,135(3):2078−2085. doi: 10.1016/j.foodchem.2012.06.088
[27] AUWAL I M, BESTER M J, NEITZ A W, et al. Rational in silico design of novel α-glucosidase inhibitory peptides and in vitro evaluation of promising candidates[J]. Biomedicine & Pharmacotherapy,2018,107:234−242.
[28] MEISEL H. Multifunctional peptides encrypted in milk proteins[J]. BioFactors,2004,21(1-4):55−61. doi: 10.1002/biof.552210111
[29] MOLLICA A, ZENGIN G, DURDAGI S, et al. Combinatorial peptide library screening for discovery of diverse α-glucosidase inhibitors using molecular dynamics simulations and binary QSAR models[J]. Journal of Biomolecular Structure & Dynamics,2018,1:726−740.
[30] RAMADHAN, NAWAS, ZHANG, et al. Purification and identification of a novel antidiabetic peptide from Chinese giant salamander (Andrias davidianus) protein hydrolysate against α-amylase and α-glucosidase[J]. International Journal of Food Properties,2018,20(sup3):3360−3372.
[31] MARELLA S, MADDIRELA D R, KUMAR E, et al. Mcy protein, a potential antidiabetic agent: Evaluation of carbohydrate metabolic enzymes and antioxidant status[J]. International Journal of Biological Macromolecules,2016,48:481−488.
[32] JIANG N, ZHANG S, ZHU J, et al. Hypoglycemic, hypolipidemic and antioxidant effects of peptides from red deer antlers in streptozotocin-induced diabetic mice[J]. Tohoku Journal of Experimental Medicine,2015,236(1):71−79. doi: 10.1620/tjem.236.71
[33] CHEN M D, PAN D D, ZHOU T Q, et al. Novel umami peptide IPIPATKT with dual dipeptidyl peptidase-IV and angiotensin I-converting enzyme inhibitory activities[J]. Journal of Agricultural and Food Chemistry,2021,69(19):5463−5470. doi: 10.1021/acs.jafc.0c07138





 下载:
下载:
 下载:
下载:
