Study on Basic Structure and Antioxidant Activity of Polysaccharides from Three Edible Fungi
-
摘要: 通过水提醇沉法提取香菇、黑木耳和红托竹荪的边角废料菌托中的多糖,并用Sevag试剂和透析法分离纯化,得到三种食用菌多糖。采用紫外分光光度计、高效凝胶渗透色谱法(high performance gel permeation chromatography,HPGPC)、红外光谱法(infrared spectroscopy,IR)、核磁共振波谱法(nuclear magnetic resonance,NMR)和刚果红实验分析三种食用菌多糖的分子量、官能团、糖苷键和三螺旋结构。将清除1,1-二苯基-2-三硝基苯肼自由基(1,1-diphenyl-2-trinitrophenylhydrazine free radical,DPPH·)和羟基自由基(Hydroxyl free radicals,OH·)的能力及Fe3+总还原力来判断三种食用菌多糖抗氧化能力,比较分析三种食用菌的基本结构和抗氧化活性。结果显示,制备的三种食用菌多糖都具有较好的均一性,分子量分布在万级和百万级。三种食用菌多糖含有相似的官能团,是既具有α构型又具有β构型的酸性多糖,且均具有三螺旋结构。此外,三种食用菌多糖在实验浓度范围内,均具有良好的抗氧化活性。其中红托竹荪菌托多糖在1.0 mg/mL浓度时对DPPH和在3.0 mg/mL浓度时对OH自由基的清除能力优于香菇和黑木耳多糖,高达66.86%和35.69%,对DPPH和OH自由基的清除能力IC50值分别为0.010和0.195 mg/mL。综上,三种食用菌多糖的基本结构无显著性差异,但抗氧化活性差异较大,为工业化生产利用红托竹荪边角废料提取食用菌多糖奠定基础。Abstract: In this study, polysaccharides from Lentinus edodes, Auricularia auricula and the waste from the corners of Dictyophora rubrovolvata were extracted by water extraction and alcohol precipitation, and separated and purified by Sevag reagent and dialysis. The molecular weight, functional groups, glycosidic bond and three helix structure of three edible fungi polysaccharides were analyzed by ultraviolet spectrophotometer, high performance gel permeation chromatography (HPGPC), infrared spectroscopy (IR), nuclear magnetic resonance spectroscopy (NMR) and Congo red experiment. The antioxidant capacity of polysaccharides from three edible fungi was evaluated by scavenging 1,1-diphenyl-2-trinitrophenylhydrazine free radical (DPPH·) and hydroxyl free radicals (OH·) and the total reducing power of Fe3+, and the basic structure and antioxidant activity of the three edible fungi were compared and analyzed. The results showed that the three edible fungus polysaccharides had good homogeneity, and the molecular weight distribution was in the order of tens of thousands and millions. The three edible fungus polysaccharides contained similar functional groups, which were the acidic polysaccharides with configuration both α and β, and all of them had triple helix structure. In addition, the three edible fungus polysaccharides had good antioxidant activity in the range of experimental concentration. When the concentration was 1.0 and 3.0 mg/mL, the DPPH and OH radical scavenging ability of Dictyophora rubrovolvata polysaccharide was better than that of Lentinus edodes and Auricularia auricula polysaccharide, up to 66.86% and 35.69%, their IC50 value were 0.010 and 0.195 mg/mL. In conclusion, there was no significant difference in the basic structure of polysaccharides from the three kinds of edible fungi, but there was a great difference in antioxidant activities, which laid a foundation for industrial production of extracting edible fungi polysaccharides from the waste of Dictyophora rubrovolvata.
-
红托竹荪(Dictyophora rubrovolvata)被称为“山珍之王”和“菌中王后”,是贵州省的特色食用菌产业之一,在贵州的栽培技术水平、产量和产值均为全国第一[1]。红托竹荪子实体分为菌盖、菌柄和菌托3个部分。其中不可食用的菌托约占整个竹荪鲜重的50%,采摘后被去掉,造成了资源浪费和环境污染[2-3]。食用菌中主要活性成分是多糖[4],具有降血脂、降血糖[5]、抗氧化、延缓衰老[6]、抗凝血、免疫调节[7]、抗肿瘤和抗病毒等[8-10]功效。研究发现红托竹荪菌托中的多糖是三个部分中含量最高、体外抗氧化活性最强的[11]。近年来关于红托竹荪多糖的研究主要集中在子实体可食部分的提取及其抗氧化,而关于红托竹荪菌托多糖的研究较少。滕春丽等[12]研究超声提取红托竹荪多糖的工艺及其膜分离方法;王新等[13]研究了红托竹荪子实体多糖对耐缺氧及抗运动疲劳效果的影响;叶敏等[14]比较了不同去蛋白方法对红托竹荪子实体多糖损失率和脱蛋白效果。
以上研究中均未有对红托竹荪的边角废料菌托的结构与生物活性的相关探究,因此为探索其构效关系,并与同为贵州省食用菌重点产业的香菇和黑木耳对比,提取三种食用菌多糖后去蛋白透析。采用紫外分光光度计、高效凝胶色谱(High Performance Gel Permeation Chromatography,HPGPC)、红外光谱(Infrared spectrum,IR)、核磁共振(Nuclear Magnetic Resonance,NMR)和刚果红实验对比分析红托竹荪菌托中多糖与其他食用菌多糖的基本结构。通过清除DPPH和OH自由基的能力及Fe3+总还原力来比较三种食用菌多糖抗氧化能力,为利用红托竹荪边角废料于工业化生产多糖制品,代替昂贵的食用菌多糖食品,开发红托竹荪边角废料的利用价值和食用菌深加工提供理论依据。
1. 材料与方法
1.1 材料与仪器
香菇、黑木耳、红托竹荪菌托 贵州省梵天菌业有限公司提供;标准品葡聚糖Dextran系列(T-2000、T-150、T-40、T10、T-5) 美国Sigma公司;溴化钾 光谱纯,上海阿拉丁试剂有限公司;透析袋3500 Da 北京索莱宝科技有限公司;铁氰化钾 分析纯,上海麦克林生化科技有限公司;1,1-二苯基-2-苦基肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 纯度98%,上海源叶生物科技有限公司;其他化学试剂 均为分析纯,国药集团化学试剂有限公司。
BSM220.4电子天平 上海卓精电子科技有限公司;Milli-Q实验室超纯水系统 昆明倍捷科技有限公司;SHB-Ⅲ循环水式多用真空泵 郑州长城科工贸有限公司;HH-4数显恒温水浴锅 金坛区西城新瑞仪器厂;1901PC紫外可见光分光光度计、723S可见分光光度计 上海棱光技术有限公司;FD-1A-50冷冻干燥机 北京博医康实验仪器有限公司;1525型高效液相色谱仪 美国Waters公司;iCAN 9傅里叶变换红外光谱仪 天津市能谱科技有限公司;Bruker Avance III-600 MHz超导核磁共振仪 瑞士Bruker公司。
1.2 实验方法
1.2.1 食用菌多糖的制备
分别称取粉碎后的食用菌10 g,按照料液比1:25(g/mL)加入蒸馏水,90 ℃提取2 h。抽滤后收集滤液,滤渣在相同条件下重复提取后合并两次滤液浓缩。加入适量的无水乙醇,配制成95%的乙醇浓度,室温下放置过夜。4000 r/min下离心,弃去上层乙醇溶液,底部沉淀加水溶解。采用Sevag法去除蛋白[15],加入4倍体积的Sevag试剂,匀浆机搅拌20 min后离心,去除中间层的变性蛋白,重复以上步骤至无蛋白。浓缩后装入透析袋中流水透析2 d,冷冻干燥后得到三种食用菌多糖。采用苯酚-硫酸法分别测定三种食用菌多糖纯度[16]。
1.2.2 紫外光谱分析
称取样品用水配制成1 mg/mL的溶液,在190~400 nm处的紫外分光光度计进行全扫描。
1.2.3 相对分子量测定
采用高效凝胶渗透色谱法(High-Performance Gel Permeation Chromatography,HPGPC)测定三种食用菌的相对分子量[17]。测试条件:Waters 1525型色谱仪,示差折光检测器;色谱柱:Ultrahydrogel™ Linear(300 mm×7.8 mm id×2);流动相:0.1 mol/L硝酸钠溶液;流速:0.9 mL/min;柱温:45 ℃。
葡萄标准曲线:称取Dextran T-2000(MW 2×107)、T-150(MW 133850)、T-40(MW 36800)、T10(MW 9750)、T-5(MW 2700)、MW 180)标准品用流动相溶解配制成5 mg/mL的标准分子量溶液。以洗脱峰的保留时间T(min)为横坐标,葡聚糖标准品分子量的对数值lgMW为纵坐标,其回归方程为y=13.8534x−0.4627,R2=0.9991。Breeze GPC软件对曲线进行回归拟合绘制分子量校正曲线。
1.2.4 红外光谱测定
取2 mg的三种多糖样品,与100 mg KBr混匀研磨,压片后在4000~400 cm−1进行傅里叶红外光谱测试[18]。
1.2.5 核磁共振分析
取三种食用菌30 mg,溶解于D2O重水中,移入核磁管中,在25 ℃条件下,用Bruker Avance III-600 MHz核磁共振波谱仪记录,1H NMR在600 MHz测定,13C NMR在150 MHz测定[19]。
1.2.6 刚果红实验
参考文献[20],分别吸取1 mL配制好的1 mg/mL不同食用菌多糖溶液与同体积80 μmol/L刚果红溶液混合,再加入4 mL用5 mol/L氢氧化钠原液配制成0、0.1、0.2、0.3、0.4、0.5 mol/L的氢氧化钠溶液,蒸馏水为空白对照,在25 ℃下反应10 min,400~700 nm处测量最大吸收波长。
1.2.7 抗氧化性分析
1.2.7.1 DPPH自由基清除率的测定
根据王莹等[21]的检测方法并加以改进。用无水乙醇配制0.08 mol/L的DPPH溶液。吸取2.0 mL不同浓度(0.2、0.4、0.6、0.8、1.0 mg/mL)的三种食用菌多糖样品溶液加入3.0 mL的DPPH溶液,混匀后避光反应30 min。蒸馏水为空白对照,于517 nm波长处测定吸光度值。
DPPH清除能力(%)=A0−(As−Ac)A0×100 (1) 式中:A0为蒸馏水+DPPH溶液的吸光度值;Ac为样品溶液+蒸馏水的吸光度值;As为样品溶液+DPPH溶液的吸光度值。
1.2.7.2 Fe3+总还原力测定
参考罗丽平等[22]的测定方法。吸取2.0 mL不同浓度(0.5、1.0、1.5、2.0、3.0 mg/mL)的食用菌多糖样品溶液,依次加入2.5 mL的0.2 mol/L,pH6.6的磷酸盐缓冲液和2.5 mL 1%的铁氰化钾后在50 ℃水浴锅中反应20 min。加入2.5 mL 10%的三氯乙酸,300 r/min离心10 min。吸取2.5 mL上清液加入2.5 mL蒸馏水和0.5 mL 0.1%的三氯化铁。蒸馏水为空白对照,700 nm处测定吸光度值。
还原力=Ah−A0 (2) 式中:Ah为样品溶液的吸光度值;A0为空白对照的吸光度值。
1.2.7.3 羟基自由基清除率的测定
按照林陈强等[23]的检测方法并改进。吸取1.0 mL不同浓度的食用菌多糖样品溶液(0.5 、1.0、1.5、2.0、3.0 mg/mL),依次加入用无水乙醇配制10.0 mmol/L的水杨酸溶液和9.0 mmol/L的FeSO4各1.0 mL混合均匀。再加入2.0 mL蒸馏水和1.0 mL 6.0 mmol/L的H2O2,37 ℃水浴反应10 min。蒸馏水为空白对照,在510 nm处测定吸光度值。
羟基自由基清除率(%)=A0−(As−Ac)A0×100 (3) 式中:A0为空白对照的吸光度值;As为样品+FeSO4+水杨酸+H2O2的吸光度值;Ac为样品+FeSO4+水杨酸的吸光度值。
1.3 数据处理
结果表示为平均值±标准差,采用SPSS13.0软件中的单因素方差分析(ANOVA)进行数据统计分析,P<0.05被认为是具有显著性差异。通过Origin 2019软件对数据进行作图,每组实验设置3次重复。
2. 结果与分析
2.1 三种食用菌多糖纯度测定
以葡萄糖标准品含量为横坐标,以吸光值为纵坐标绘制标准曲线,得标准线性方程为:y=8.0823x−0.0043,R2=0.9997。以香菇、黑木耳和红托竹荪菌托为原料分别制得的多糖含量为78%±0.23%、81%±0.15%和76%±0.36%。三种食用菌提取的多糖含量与研究[24-26]中的多糖含量相比较低,可能是产地和品种的不同所致。
2.2 三种食用菌多糖紫外光谱分析
三种食用菌紫外全扫描如图1所示,由于三种食用菌多糖的溶液颜色、组成物质及其稳定性的不同导致最大吸光度不同。在260和280 nm处红托竹荪菌托无特征吸收峰,在260 nm处香菇和黑木耳有特征吸收峰,说明通过Sevag脱蛋白和透析后红托竹荪菌托多糖样品不含核酸和蛋白质,而香菇和黑木耳含有少量核酸,不含蛋白质。
2.3 三种食用菌多糖的相对分子量差异
通过高效凝胶渗透色谱法测定三种不同食用菌多糖的相对分子量,三种样品中多糖的相对分子质量分布和其分布范围根据葡聚糖的标准曲线得到,其回归方程为y=13.3579x−0.5349,R2=0.9991。如表1所示,三种食用菌多糖的分子量分布均出现两个洗脱峰。其中香菇多糖的重均分子量(Mw)主要分布在1.18×104 Da,黑木耳多糖的重均分子量主要分布在1.29×104 Da,红托竹荪菌托多糖的重均分子量主要分布在3.89×104 Da。多分散系数(Mw/Mn)分别为0.61、0.39、1.20,多分散系数接近于1,分子量分布越均一。三种食用菌多糖均分布在万级和百万级,并且在分子量分布均一性上红托竹荪菌托多糖最好,香菇多糖其次,黑木耳多糖最差。
表 1 不同食用菌多糖的相对分子量Table 1. Relative molecular weights of polysaccharides from different edible fungi样品 保留时间
(min)数均分子量
Mn(Da)重均分子量
Mw(Da)峰面积
百分比
(%)香菇 峰1 14.450 5048044 2493241 10.36 峰2 18.581 19323 11833 89.64 黑木耳 峰1 14.533 2888182 1479232 23.76 峰2 17.317 33425 12910 76.24 红托竹荪
菌托峰1 11.713 70400757 15481643 2.42 峰2 17.343 32564 38948 97.58 2.4 三种食用菌红外光谱分析
采用傅里叶变换红外光谱法对三种食用菌多糖进行官能团分析。如图2所示,三种食用菌多糖的特征峰相似。在3400~3200 cm−1处的吸收峰是由O-H引起的伸缩振动,在2900 cm−1附近的吸收峰是由C-H伸缩振动引起的。三种食用菌多糖分别在3364、3363和3335 cm−1附近出现特征峰,证明三种多糖都存在羟基-OH。2925、2933和2931.72 cm−1是亚甲基-CH2的特征峰,羟基和亚甲基是多糖的特征基团[27]。1600 cm−1附近是酰胺基C=O的特征吸收峰,而在1417 cm−1附近出现的吸收峰是C=O对称伸缩振动引起的,证明三种食用菌多糖含有羧基-COOH。在1100 cm−1附近为C-O-C伸缩振动吸收峰,是吡喃糖环的特征峰[28]。在860.10、892.88、898.87 cm−1附近是β糖苷键的特征吸收峰,674.68、609.40、649.89 cm−1附近是α糖苷键特征吸收峰,由图可知,三种食用菌多糖是既具有α构型又具有β构型的酸性多糖。
2.5 三种食用菌多糖核磁共振分析
在图3中,三种食用菌多糖化学位移δ在4.5~5.5范围内,有2处异头氢质子H-1的化学位移。一般而言,α构型多糖分子异头氢的化学位移δ>5.0,β构型多糖分子异头氢化学位移δ<5.0[29]。这表明三种食用菌多糖既存在α构型又存在β构型,且δ5.31处的异头氢质子化学位移指示存在D-半乳糖醛酸(α构型)。
在图4中,三种食用菌在δ103.00附近含有一个异头碳信号,这是β糖苷键的典型信号峰。观察到被O取代的C-6的信号峰在δ68.83附近,未取代的C-6的信号峰处于δ60.71附近,说明可能存在β-(1→6)-D-吡喃葡萄糖。δ71附近为α构型C-2,C-3的吸收峰。δ73.04处是(1→6)糖苷键中的C-5。三种食用菌多糖的核磁共振分析进一步验证红托竹荪的边角废料菌托的多糖与可食用的食用菌多糖具有相似的结构,为其代替昂贵的食用菌原料生产多糖提供参考依据。
2.6 刚果红实验结果分析
根据三种食用菌多糖的最大吸收波长与刚果红溶液的相比是否发生红移判断三种食用菌多糖是否具有三重螺旋结构[30]。如图5所示,三种食用菌多糖的最大吸收峰与对照组相比发生红移,说明香菇、黑木耳和红托竹荪菌托多糖中存在三螺旋结构,与刚果红络合后在NaOH作用下发生一定的红移。
2.7 三种食用菌多糖抗氧化活性结果比较
通过测定三种食用菌多糖的DPPH和羟基自由基的清除率,以及对Fe3+总还原力来判定它们的抗氧化能力。从图6可以看出,三种食用菌多糖在实验浓度范围内,清除DPPH、OH自由基和还原Fe3+的能力均随着浓度的增加而增加。当浓度为1.0 mg/mL时,香菇、黑木耳和红托竹荪菌托多糖对DPPH自由基的清除率依次为59.84%、9.88%和66.86%,对DPPH自由基的清除能力的IC50值依次为0.055、0.180和0.010 mg/mL,红托竹荪菌托多糖对DPPH的清除率极显著高于香菇和黑木耳多糖(P<0.01)。当浓度为3.0 mg/mL时,香菇、黑木耳和红托竹荪菌托多糖对Fe3+总还原力分别为0.926、0.1552和0.5958,对Fe3+总还原力的IC50值依次为1.214、1.455和1.217 mg/mL,香菇和红托竹荪菌托多糖对Fe3+总还原力极显著高于黑木耳多糖(P<0.01),但香菇多糖与红托竹荪菌托多糖组间无显著性差异(P>0.05)。当浓度为3.0 mg/mL时,香菇、黑木耳和红托竹荪菌托对OH自由基的清除率分别为27.70%、12.91%和35.69%,对OH自由基的清除能力的IC50值依次为0.350、0.456和0.195 mg/mL,红托竹荪菌托对OH自由基的清除率极显著高于香菇和黑木耳(P<0.01)。综合DPPH和羟基自由基的清除率,以及对Fe3+总还原力实验结果来看,红托竹荪菌托多糖的抗氧化能力最佳,香菇多糖次之,黑木耳多糖最差。三种食用菌多糖的抗氧化能力差异较大,可能是由于种类差异或部分结构组成不同造成的。
3. 结论
多糖的结构对其生物活性有很大的影响,因此本研究分别对香菇、黑木耳和红托竹荪菌托中多糖的结构进行了测定,对比了三种食用菌多糖的抗氧化能力。通过Sevag脱蛋白和透析后红托竹荪托的多糖具有较好的均一性,三种多糖分子量均分布在万级和百万级。通过红外和核磁共振检测出三种食用菌多糖是具有三螺旋结构且含有相似的官能团的α和β构型的酸性多糖,三种食用菌多糖基本结构无显著性差异。此外,三种食用菌多糖都具备抗氧化活性,其中红托竹荪菌托多糖的抗氧化能力最佳,香菇多糖次之,黑木耳多糖最差。红托竹荪的菌托作为边角废料往往在采摘过程中被去掉丢弃造成浪费,就抗氧化活性上,可将其利用于抗氧化食品和药品的开发中,后续可研究其他的生物活性,代替昂贵的食用菌多糖产品,具有良好发展和应用前景。
-
表 1 不同食用菌多糖的相对分子量
Table 1 Relative molecular weights of polysaccharides from different edible fungi
样品 保留时间
(min)数均分子量
Mn(Da)重均分子量
Mw(Da)峰面积
百分比
(%)香菇 峰1 14.450 5048044 2493241 10.36 峰2 18.581 19323 11833 89.64 黑木耳 峰1 14.533 2888182 1479232 23.76 峰2 17.317 33425 12910 76.24 红托竹荪
菌托峰1 11.713 70400757 15481643 2.42 峰2 17.343 32564 38948 97.58 -
[1] 赵湘江, 杨兰. 贵州省食用菌产业发展研究[J]. 中国食用菌,2021,40(4):117−122. [ZHAO X J, YANG L. Study on the development of edible fungus industry in Guizhou Province[J]. Chinese Edible Fungi,2021,40(4):117−122. ZhAO X J, YANG L. Study on the development of edible fungus industry in Guizhou Province[J]. Chinese Edible Fungi, 2021, 40(4): 117-122.
[2] 孙燕, 李浪, 刘妮, 等. 红托竹荪不同部位的无机元素含量及相关性[J]. 贵州农业科学,2019,47(6):113−116. [SUN Y, LI L, LIU N, et al. The content and correlation of inorganic elements in different parts of Dendrophylla sinensis[J]. Guizhou Agricultural Sciences,2019,47(6):113−116. SUN Y, LI L, LIU N, et al. The content and correlation of inorganic elements in different parts of Dendrophylla sinensis[J]. Guizhou Agricultural Sciences, 2019, 47(6): 113-116.
[3] 梁亚丽, 秦礼康, 王何柱, 等. 红托竹荪及竹荪蛋各部位主要营养功能成分分析[J]. 食品与机械,2020,36(4):72−76. [LIANG Y L, QIN L K, WANG H Z, et al. Analysis of main nutritional function components in various parts of Dendrophylla oryzata and its eggs[J]. Food and Machinery,2020,36(4):72−76. LIANG Y L, QIN L K, WANG H Z, et al. Analysis of main nutritional function components in various parts of Dendrophylla oryzata and its eggs[J]. Food and Machinery, 2020, 36(4): 72-76.
[4] SUN Z Q, HAN Q H, DUAN L W, et al. Oridonin increases anticancer effects of lentinan in HepG2 human hepatoblastoma cells[J]. Oncology Letters,2018,15(2):53−56.
[5] WANG Y, HAN X, LI Y D, et al. Lentinan dose dependence between immunoprophylaxis and promotion of the murine liver cancer[J]. Oncotarget,2017,8(56):85−88.
[6] 邱军强, 张华, 刘迪迪, 等. 9种食用菌碱水提取物的抗氧化活性比较研究[J]. 食品研究与开发,2017,38(15):1−5. [QIU J Q, ZhANG H, LIU D D, et al. Comparative study on antioxidant activity of alkali water extracts from nine edible fungi[J]. Food Research and Development,2017,38(15):1−5. QIU J Q, ZhANG H, LIU D D, et al. Comparative study on antioxidant activity of alkali water extracts from nine edible fungi[J]. Food Research and Development, 2017, 38(15): 1-5.
[7] ZHANG Y R, ZHANG M, JIANG Y F, et al. Lentinan as an immunotherapeutic for treating lung cancer: A review of 12 years clinical studies in China[J]. Chinese Journal of Cancer Research,2018,8(1):51−54.
[8] WEI Y L, JING L W, HUI P H, et al. Functional polysaccharide lentinan suppresses human breast cancer growth via inducing autophagy and caspase-7-mediated apoptosis[J]. Journal of Functional Foods,2018,45(5):21−25.
[9] JINGMIN Y, ZHU L, QU Y H, et al. Analyses of active antioxidant polysaccharides from four edible mushrooms[J]. International Journal of Biological Macromolecules, 2019, 123: 945-956.
[10] JUAN J C, LÜ Q Q, ZHANG B, et al. Structural characterization and hepatoprotective activities of polysaccharides from the leaves of Toona sinensis (A. juss) Roem[J]. Carbohydrate Polymers,2019,212:89−101. doi: 10.1016/j.carbpol.2019.02.031
[11] 徐耀. 红托竹荪不同部位多糖提取及体外抗氧化活性研究[J]. 食品工业科技,2012,33(24):350−352. [XU Y. Study on extraction and antioxidant activity of polysaccharides from different parts of Dictyophora rubens[J]. Science and Technology of Food Industry,2012,33(24):350−352. XU Y. Study on extraction and antioxidant activity of polysaccharides from different parts of Dictyophora rubens[J]. Science and Technology of Food Industry, 2012, 33(24): 350-352.
[12] 滕春丽, 颜蜜, 向瑞琪, 等. 红托竹荪多糖的提取优化及膜分级分离的研究[J]. 食品安全质量检测学报,2021,12(12):4994−4990. [TENG C L, YAN M, XIANG R Q, et al. Study on extraction optimization and membrane separation of polysaccharide from Dictyophora solani[J]. Journal of Food Safety and Quality,2021,12(12):4994−4990. TENG C L, YAN M, XIANG R Q, et al. Study on extraction optimization and membrane separation of polysaccharide from Dictyophora solani[J]. Journal of Food Safety and Quality, 2021, 12(12): 4994-4990.
[13] 王新, 王强. 红托竹荪多糖的耐缺氧及抗运动疲劳能力的研究[J]. 中国食用菌,2020,39(12):83−86. [WANG X, WANG Q. Study on the anti-hypoxia and anti-exercise fatigue ability of polysaccharides from Phyllostachys ruthenophora[J]. Chinese Edible Fungi,2020,39(12):83−86. WANG X, WANG Q. Study on the anti-hypoxia and anti-exercise fatigue ability of polysaccharides from Phyllostachys ruthenophora[J]. Chinese Edible Fungi, 2020, 39(12): 83-86.
[14] 叶敏, 文竹, 王庆, 等. 不同方法对红托竹荪多糖的脱蛋白效果[J]. 贵州农业科学,2016,44(5):131−135. [YE M, WEN Z, WANG Q, et al. Effects of different methods on the deproteinization of polysaccharides from Phyllostachys oryzata[J]. Guizhou Agricultural Sciences,2016,44(5):131−135. YE M, WEN Z, WANG Q, et al. Effects of different methods on the deproteinization of polysaccharides from Phyllostachys oryzata[J]. Guizhou Agricultural Sciences, 2016, 44(5): 131-135.
[15] 苗晶囡, 邱军强, 李海霞, 等. 一种黑木耳酸性多糖的分离纯化及其结构鉴定[J]. 食品研究与开发,2019,40(6):1−8. [MIAO J N, QIU J Q, LI H X, et al. Isolation, purification and structure identification of acid polysaccharide from Auricularia auriculata[J]. Food Research and Development,2019,40(6):1−8. MIAO J N, QIU J Q, LI H X, et al. Isolation, purification and structure identification of acid polysaccharide from Auricularia auriculata[J]. Food Research and Development, 2019, 40(6): 1-8.
[16] QIN L, TIAN G T, YAN H, et al. Characterization of polysaccharides with antioxidant and hepatoprotective activities from the wild edible mushroom Russula vinosa Lindblad[J]. Journal of Agricultural and Food Chemistry,2014,62(35):8858−8866. doi: 10.1021/jf502632c
[17] 李鸥叶, 张全才, 施晓丹, 等. 基于高效凝胶渗透色谱法和离子色谱法的棘托竹荪提取物的质量控制[J]. 中国食品学报,2019,19(12):213−219. [LI O Y, ZHANG Q C, SHI X D, et al. Quality control of extracts from Dictyophora echinovolata by high performance gel permeation chromatography and ion chromatography[J]. Chinese Journal of Food Science,2019,19(12):213−219. LI O Y, ZHANG Q C, SHI X D, et al. Quality control of extracts from Dictyophora echinovolata by high performance gel permeation chromatography and ion chromatography[J]. Chinese Journal of Food Science, 2019, 19(12): 213-219.
[18] 王嘉铭, 雷于国, 胡国元, 等. 香菇多糖纯化前后结构和生物活性的比较[J]. 食品与生物技术学报,2020,39(1):99−106. [WANG J M, LEI Y G, HU G Y, et al. Comparison of structure and bioactivity of lentinan before and after purification[J]. Journal of Food and Biotechnology,2020,39(1):99−106. WANG J M, LEI Y G, HU G Y, et al. Comparison of structure and bioactivity of lentinan before and after purification[J]. Journal of Food and Biotechnology, 2020, 39(1): 99-106.
[19] 朱淼, 侯怡铃, 唐贤, 等. 2种竹荪多糖的结构鉴定及差异性分析研究[J]. 现代农业科技,2019(7):206−207. [ZHU M, HOU Y L, TANG X, et al. Structural identification and difference analysis of polysaccharides from two bamboo dictyophora species[J]. Modern Agricultural Science and Technology,2019(7):206−207. ZHU M, HOU Y L, TANG X, et al. Structural identification and difference analysis of polysaccharides from two bamboo dictyophora species[J]. Modern Agricultural Science and Technology, 2019(7): 206-207.
[20] LIU X, LIU H, YAN Y, et al. Structural characterization and antioxidant activity of polysaccharides extracted from jujube using subcritical water[J]. LWT,2020,117:108645. doi: 10.1016/j.lwt.2019.108645
[21] 王莹, 邢晓玲, 李屿君, 等. 香菇多糖脱蛋白工艺及其抗氧化活性研究[J]. 食品研究与开发,2020,41(14):98−103. [WANG Y, XING X L, LI Y J, et al. Deproteinization of lentinan and its antioxidant activity[J]. Food Research and Development,2020,41(14):98−103. WANG Y, XING X L, LI Y J, et al. Deproteinization of lentinan and its antioxidant activity[J]. Food Research and Development, 2020, 41(14): 98-103.
[22] 罗丽平, 李冰晶, 赵景芳, 等. 三种食用菌提取物体外抗氧化与降血糖活性研究[J]. 食品工业科技,2020,41(20):324−329. [LUO L P, LI B J, ZHAO J F, et al. Study on antioxidant and hypoglycemic activity of three edible fungi extracts in vitro[J]. Science and Technology of Food Industry,2020,41(20):324−329. LUO L P, LI B J, ZHAO J F, et al. Study on antioxidant and hypoglycemic activity of three edible fungi extracts in vitro[J]. Science and Technology of Food Industry, 2020, 41(20): 324-329.
[23] 林陈强, 陈济琛, 林新坚, 等. 响应面法优化棘托竹荪孢子多糖提取工艺及抗氧化活性研究[J]. 食品工业科技,2020,41(9):161−167. [LIN C Q, CHEN J C, LIN X J, et al. Optimization of extraction process and antioxidant activity of polysaccharide from spores of Dictyophora echinoides by response surface methodology[J]. Science and Technology of Food Industry,2020,41(9):161−167. LIN C Q, CHEN J C, LIN X J, et al. Optimization of extraction process and antioxidant activity of polysaccharide from spores of Dictyophora echinoides by response surface methodology[J]. Science and Technology of Food Industry, 2020, 41(9): 161-167.
[24] BISEN P S, BAGHELl R K, SANDIAN B S, et al. Lentinus edodes: A macrofungus with pharmacological activities[J]. Current Medicinal Chemistry,2010,17(22):2419−2430. doi: 10.2174/092986710791698495
[25] WU N J, CHIOU F J, WENG Y M, et al. In vitro hypoglycemic effects of hot water extract from Auricularia polytricha (wood ear mushroom)[J]. Int J Food Sci Nutr,2014,65(4):502. doi: 10.3109/09637486.2014.886183
[26] LIU X, CHEN Y, WU L, et al. Optimization of polysaccharides extraction from Dictyophora indusiata and determination of its antioxidant activity[J]. International Journal of Biological Macromolecules,2017,103(4):175−181.
[27] 刘露. 壮丽环苞菇多糖(CIS-A)和硫黄菌多糖(LSM-X)的结构鉴定及生物活性的研究[D]. 南充: 西华师范大学, 2018. LIU L. Structural identification and biological activity of Cyclobractus splendens polysaccharide (CIS-A) and Thiobacillus flavus polysaccharide (LSM-X)[D]. Nanchong: China West Normal University, 2018.
[28] 赵诗雨, 赵婷婷, 梁锐, 等. 三个不同产地香菇多糖的理化性质及生物活性研究[J]. 菌物学报,2020,39(8):1530−1537. [ZHAO S Y, ZHAO T T, LIANG R, et al. Study on physicochemical properties and bioactivity of lentinan from three different producing areas[J]. Chinese Journal of Fungi,2020,39(8):1530−1537. ZHAO S Y, ZHAO T T, LIANG R, et al. Study on physicochemical properties and bioactivity of lentinan from three different producing areas[J]. Chinese Journal of Fungi, 2020, 39(8): 1530-1537.
[29] 李亚平. 玉米须多糖结构表征及其生物活性的研究[D]. 吉林: 吉林化工学院, 2019. LI Y P. Structural characterization and biological activity of corn whisker polysaccharide[D]. Jilin: Jilin University of Chemical Technology, 2019.
[30] CHEN G J, KAN J Q. Characterization of a novel polysaccharide isolated from Rosa roxburghii Tratt fruit and assessment of its antioxidant in vitro and in vivo[J]. International Journal of Biological Macromolecules,2018,107:166−174. doi: 10.1016/j.ijbiomac.2017.08.160





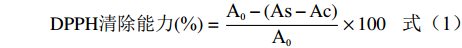



 下载:
下载:





 下载:
下载:
