Optimization of Germination Process of Isothiocyanate Enrichment in Broccoli Sprouts by Response Surface Methodology
-
摘要: 为优化ZnSO4与褪黑素联合处理下西兰花富集异硫氰酸酯的工艺条件。以西兰花发芽期间的异硫氰酸酯含量、芽长和鲜重为指标,先通过单因素实验研究发芽温度、发芽时间、ZnSO4处理浓度和褪黑素处理浓度对异硫氰酸酯含量和芽长及鲜重的影响,并在此基础上进一步通过响应面试验对其优化,同时分析异硫氰酸酯代谢相关指标的变化。实验结果显示,发芽温度、ZnSO4和褪黑素处理浓度及发芽时间均对西兰花富集异硫氰酸酯有显著影响。响应面试验优化得到了最优发芽工艺条件,西兰花发芽期间经4.69 mmol/L ZnSO4联合13.18 μmol/L褪黑素处理,于30 ℃发芽3 d时异硫氰酸酯含量达到最高,为451.27 mg/100 g mf。ZnSO4联合褪黑素处理的西兰花芽苗中硫代葡萄糖苷和萝卜硫素含量以及黑芥子酶活性均显著高于对照组(P<0.05)。本研究表明ZnSO4联合褪黑素处理是富集西兰花芽苗中异硫氰酸酯的有效手段,优化得到的发芽工艺可为生产富含异硫氰酸酯的西兰花芽苗提供技术支撑。Abstract: The accumulation of isothiocyanate in germinated broccoli under ZnSO4-melatonin treatment was optimized. The isothiocyanate content, bud length and fresh weight of broccoli during germination were used as indices to study the effects of germination temperature, germination time, ZnSO4 and melatonin treatment concentration on isothiocyanate by single factor experiment first, and on this basis, it was further optimized by response surface experiment. Meanwhile, the changes of isothiocyanate metabolism related indexes were analyzed. The results showed that germination temperature, germination time, ZnSO4 and melatonin treatment concentration all had significant effects on isothiocyanate enrichment. Response surface optimization experiment showed that when the broccoli was treated with 4.69 mmol/L ZnSO4 combined with 13.18 μmol/L melatonin at 30 ℃ for 3 days, the isothiocyanate content was up to the highest, which was 451.27 mg/100 g mf. The contents of glucosinolates and sulforapenin and the activity of myrosinase in broccoli sprouts under ZnSO4 combined with melatonin treatment were significantly higher than those in the control group(P<0.05). This study showed that ZnSO4-melatonin treatment was an effective means to enrich isothiocyanate in broccoli sprouts. The optimized germination process can provide technical support for the production of broccoli sprouts rich in isothiocyanate.
-
Keywords:
- broccoli /
- isothiocyanate /
- melatonin /
- ZnSO4 /
- germination
-
近年来,富含异硫氰酸酯(Isothiocyanates, ITCs)的保健食品的开发备受关注。ITCs是植物中天然的抗癌活性物质,对多种癌症均具有预防和抑制作用[1-2],其可通过抑制阶段I酶和激活阶段II酶的活性来发挥其抗癌功能[3]。同时,ITCs对人体还具有降血糖[4]、降血压[5]及预防心血管疾病[6]等多种生理作用。西兰花(Brassica oleracea L. var. italica)属于一年两生芸薹属植物,其ITCs含量远高于其他植物,但仍难以满足人们的生理需求[7]。通过生理调控定向促进西兰花芽苗积累ITCs,进而以富含ITCs的芽苗作为原料开发相关保健食品对于人体补充ITCs具有重要的意义。
研究发现,植物发芽期间经硫酸盐[8-9]、热激[10]、低温[11]等非生物胁迫处理后可有效提高ITCs含量。韩宇等[10]采用高温胁迫下施加ZnSO4联合Na2SeO3处理促进了西兰花芽苗中ITCs富集。郭强晖[12]研究了不同硫盐对西兰花芽苗中ITCs的富集效果,其中ZnSO4的效果最好。然而,各种胁迫处理在提高ITCs含量的同时却抑制了植物的生长,导致其产量显著降低。郭强晖[12]采用外源CaCl2处理缓解了ZnSO4对西兰花芽苗的生长抑制。近年来,褪黑素(Melatonin,MT)在缓解植物受到的非生物胁迫[13]方面的作用成为研究热点。褪黑素可作为植物生长的促进剂[14]、参与植物的发育和应激反应[15]、作为自由基清除剂[16]等方式使植物正常生长。同时,褪黑素对高等植物中的次级代谢产物含量也具有调控作用[17-18]。但褪黑素对于西兰花芽苗生长的影响尤其是对ITCs的代谢调控鲜见报道。
前期研究发现外源褪黑素可以缓解ZnSO4对西兰花芽苗的生长抑制并进一步富集ITCs。在此基础上,本文研究发芽温度、发芽时间、ZnSO4和褪黑素浓度对西兰花芽苗中ITCs含量变化的影响,并进一步通过响应面试验对其发芽条件进行优化,以期为生产富含ITCs的西兰花芽苗提供技术支撑。
1. 材料与方法
1.1 材料与仪器
西兰花种子 品种为优秀,2018年产自日本坂田公司,封装于密闭容器中,4 ℃保存备用;褪黑素(纯度>99%)、萝卜硫素(纯度>99%)、乙腈(色谱纯) 美国Sigma公司;葡萄糖测定试剂盒(F006-1-1) 南京建成生物工程研究所;ZnSO4(分析纯) 广东翁江化学试剂有限公司;其他生化试剂 均为国产分析纯。
世达(SATA) 91501 游标卡尺 湖南懋军宝工电子有限公司;PGX-150型智能光照培养箱 宁波海曙赛福实验仪器厂;752N紫外分光光度计 苏州嘉仕德科学仪器有限公司;DICO型台式离心机 Thermo Fisher有限公司;DK-S12型电热恒温水浴锅 上海森信实验仪器有限公司;KY-XW-80A漩涡混合器 济宁市同创机械有限公司;1260液相色谱仪 美国Agilent Technologies公司。
1.2 实验方法
1.2.1 种子发芽处理
称取西兰花种子适量,用1%次氯酸钠溶液浸泡消毒15 min,消毒后用去离子水冲洗至中性,用30 ℃蒸馏水浸泡种子4 h,随后置于铺有蛭石的透明盒中于30 ℃培养箱内发芽,每d光照16 h,黑暗8 h,每12 h喷施不同的处理液[12]。
1.2.2 单因素实验
采用浓度为4 mmol/L的ZnSO4、10 μmol/L的褪黑素培养西兰花芽苗,发芽温度30 ℃,发芽3、4、5、6 d后取样,测定芽长、鲜重等生理指标及ITCs含量。
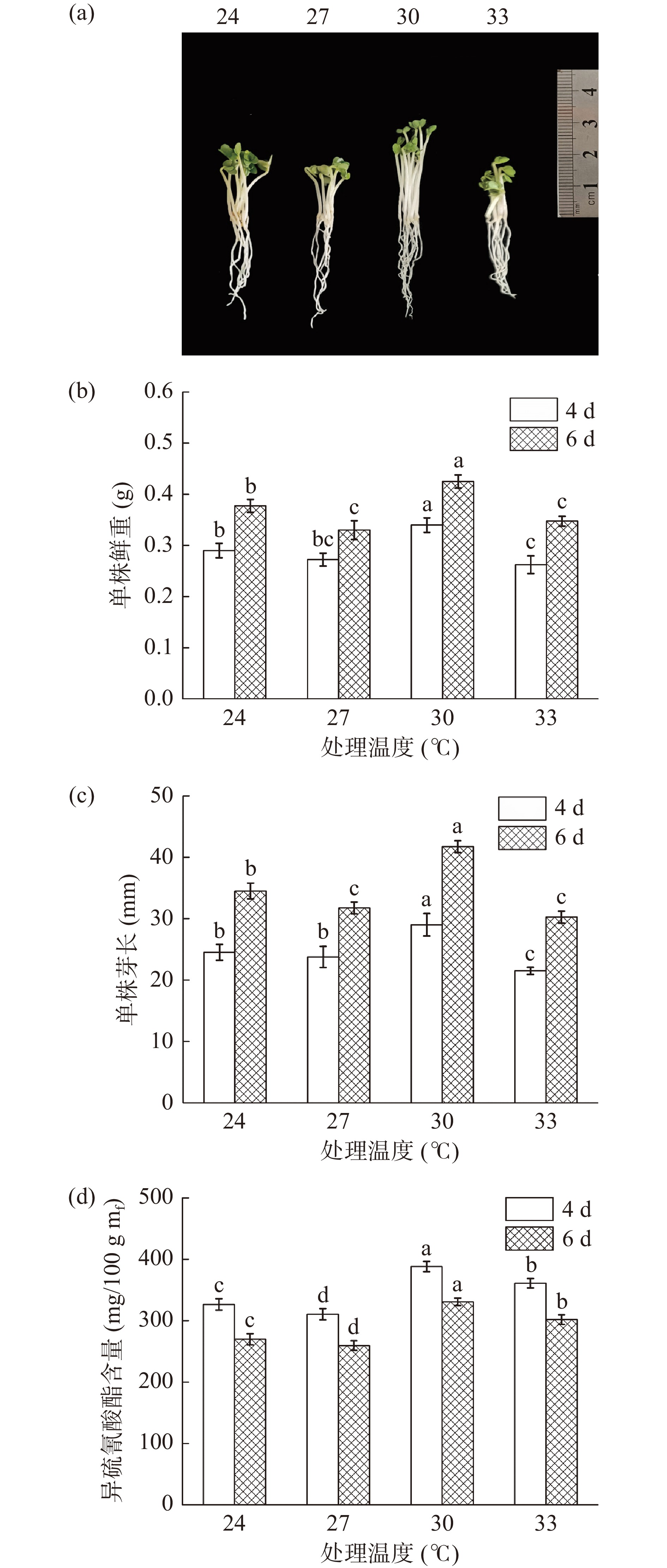
采用浓度为4 mmol/L的ZnSO4、10 μmol/L的褪黑素培养西兰花芽苗,发芽温度分别用24、27、30、33 ℃,发芽4、6 d后取样,测定芽长、鲜重等生理指标及ITCs含量。
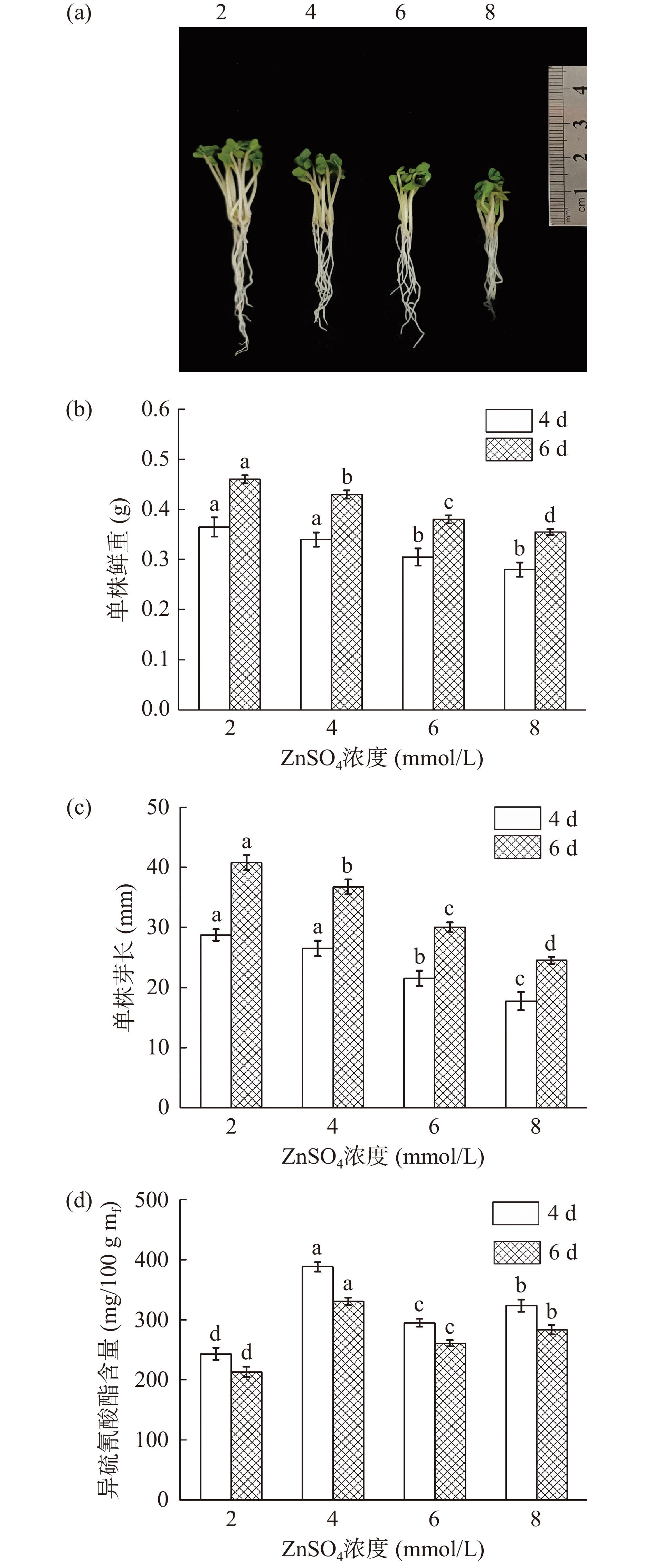
分别采用浓度为2、4、6、8 mmol/L的ZnSO4联合浓度为10 μmol/L的褪黑素培养西兰花芽苗,发芽温度30 ℃,发芽4、6 d后取样,测定芽长、鲜重等生理指标及ITCs含量。
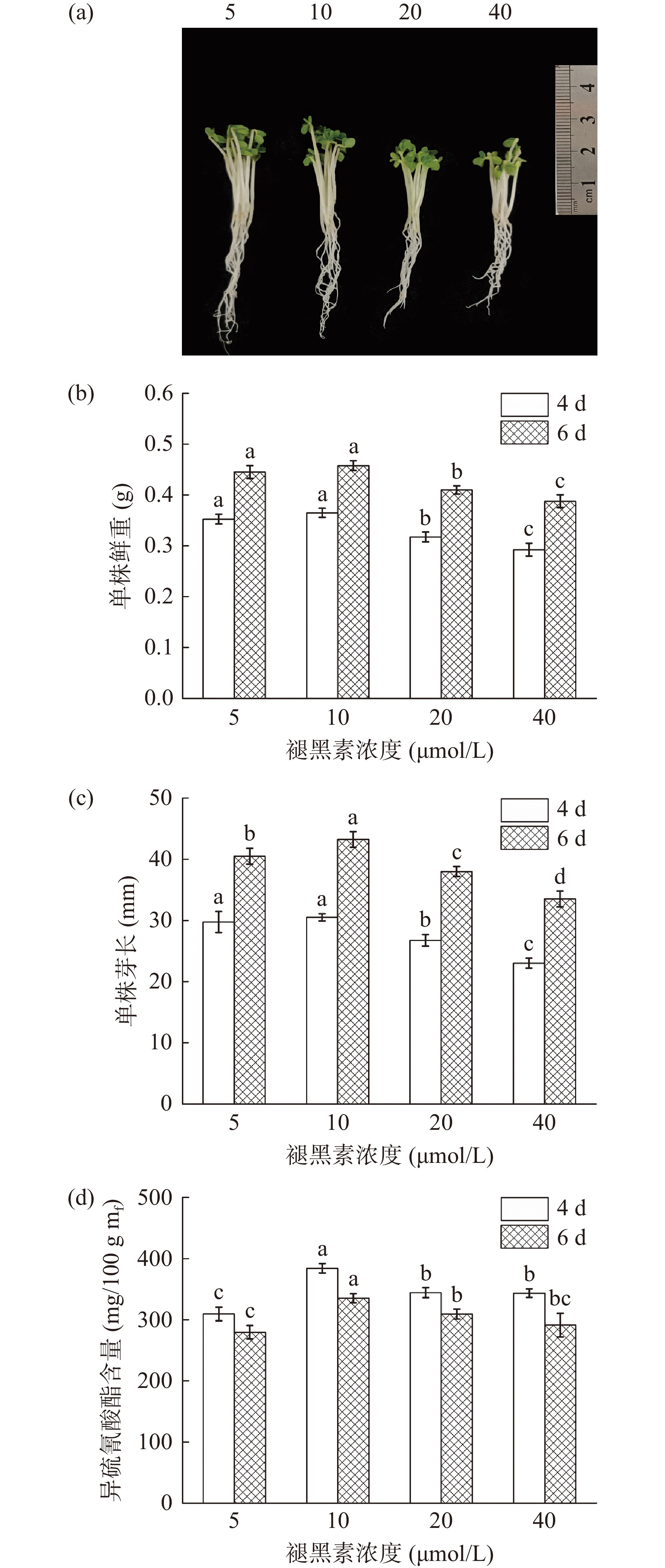
分别采用浓度为5、10、20、40 μmol/L的褪黑素联合浓度为4 mmol/L的ZnSO4培养西兰花芽苗,发芽温度30 ℃,发芽4、6 d后取样,测定芽长、鲜重等生理指标及ITCs含量。
1.2.3 响应面试验优化
在单因素实验的基础上,根据响应面Box-Behnken设计原理,选择ZnSO4浓度(A)、褪黑素浓度(B)和发芽时间(C)三个对ITCs含量富集影响的因子,以ITCs含量为响应值,求出ITCs含量的二次线性回归方程,找出最佳的发芽工艺。响应曲面设计因素水平见表1。
表 1 响应面试验因素与水平Table 1. The test factors and levels of response surface experiment水平 A ZnSO4浓度
(mmol/L)B 褪黑素浓度
(μmol/L)C 发芽时间
(d)−1 2 5 3 0 4 10 4 1 6 15 5 1.2.4 测定指标
1.2.4.1 芽长
随机选取30株西兰花芽苗,用游标卡尺测定其芽长并记录。
1.2.4.2 鲜重
随机选取10株西兰花芽苗,用精密天平测定其鲜重并记录。
1.2.4.3 ITCs含量测定
参照JIAO等[19]的方法并稍做修改。取0.3 g芽苗,加3 mL蒸馏水研磨,匀浆液置于40 ℃水浴3 h,再加入3 mL二氯甲烷震荡萃取30 min,10000 r/min离心15 min,取下清液100 μL,依次加入2 mL甲醇、1.8 mL 50 mmol/L硼酸缓冲液和0.2 mL 7 mmol/L 1,2-苯二硫醇的甲醇溶液,将混合液于65 ℃水浴反应1 h后,于365 nm波长处测定吸光度值。用萝卜硫素作标准曲线,计算样品ITCs含量。
本文中萝卜硫素标准曲线的线性回归方程为y=0.3072x+0.0373,R2=0.9957。
ITCs的计算公式为:
ITCs含量(mg/100gmf)=A1−0.03730.3072×M×N 式中:A1表示样品在365 nm下的吸光值;M表示萝卜硫素的摩尔质量,177.29 g/mol;N表示稀释倍数。
1.2.5 最优工艺下西兰花芽苗中ITCs代谢相关指标研究
按照优化得到的最优工艺条件发芽得到西兰花芽苗,蒸馏水发芽为对照处理,研究芽苗中硫代葡萄糖苷、萝卜硫素含量及黑芥子酶活性变化。
1.2.5.1 硫代葡萄糖苷含量
参照JIAO等[19]的方法并稍做修改,取50 μg西兰花样品于80 ℃恒温水浴中灭酶10 min,加入2 mL煮沸的70%甲醇,80 ℃恒温水浴中浸提10 min,冷却至室温10000 r/min 离心10 min,收集上清液,沉淀中再加入2 mL煮沸的70%甲醇重复浸提,将两次上清合并用煮沸的70%甲醇定容至6 mL待测。后按照王淑雯[9]的方法测定,样品中硫苷含量的计算公式如下:
硫苷含量(mg/gmd)=E1−E2E1标−E2标×C标×VM 式中:E1:a系列中样品显色液扣除空白对照后的OD值;E2:b系列中样品显色液扣除空白对照后的OD值;E1标:a系列中标准显色液扣除空白对照后的OD值;E2标:b系列中标准显色液扣除空白对照后的OD值;C标:硫苷标准液的浓度,mg/mL;V:硫苷样品的定容体积,mL;m:样品质量,g。
1.2.5.2 黑芥子酶活力
参照BUROW等[20]的方法进行测定。取0.2 g芽苗,加3 mL 0.1 mol/L,pH6.5磷酸盐缓冲液冰浴研磨,4 ℃条件下10000 r/min离心15 min,取上清液并利用蛋白质测定试剂盒测定其蛋白质含量。另取0.5 mL上清液与0.5 mL 0.25 mmol/L烯丙基硫苷溶液混合,于37 ℃水浴反应15 min后置于沸水5 min,并利用葡萄糖测定试剂盒测定葡萄糖含量。以每分钟被黑芥子酶转化生成1 nmol葡萄糖为1个酶活力单位(U·mg−1 prot)。
1.2.5.3 萝卜硫素含量
根据郭丽萍[21]的方法稍做修改。取0.50 g芽苗,加入4 mL蒸馏水,于37 ℃水解4 h,加入3 mL二氯甲烷萃取,水浴蒸发后用10%乙腈溶解,过0.45 μm膜,HPLC测定。色谱柱为Eclipse XDB-C18色谱柱,检测波长:254 nm,流速为0.6 mL/min,柱温为30 ℃,进样量为20 μL。洗脱程序:0 min~25 min~30 min,10%乙腈~60%乙腈~100%乙腈。
1.3 数据处理
试验设3次生物学重复,各指标测定设3次技术重复,结果以平均值±标准差(
¯X±SD )表示。试验数据采用DPS软件进行统计分析,均值间比较采用Tukey多重比较,在0.05水平上进行显著检验(P<0.05);响应面设计与分析采用Design Expert 11软件。2. 结果与分析
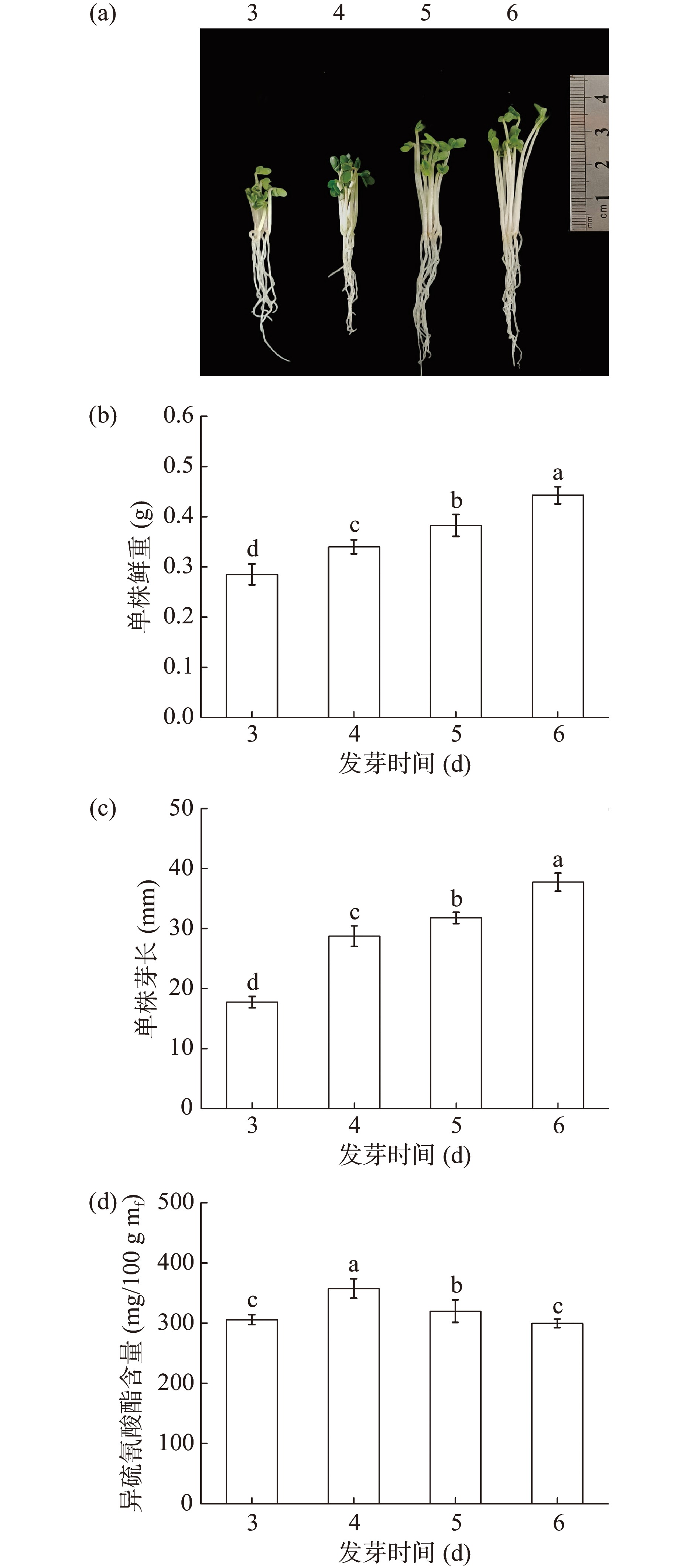
2.1 发芽时间对西兰花芽苗生长及其ITCs含量的影响
由图1可知,随着发芽时间的增加,西兰花芽苗的芽长和鲜重均显著增加(P<0.05),发芽6 d时芽长和鲜重分别为37.75 mm和0.44 g。同时,芽苗中ITCs含量随发芽时间的增加呈先增加后降低的趋势,发芽4 d的芽苗中ITCs含量最高为357.5 mg/100 g mf(图1d),其后ITCs含量显著下降(P<0.05)。相较4 d的芽苗,发芽6 d的芽苗中ITCs含量下降了19.36%。因此,确定发芽时间为4 d进一步优化。
2.2 发芽温度对西兰花芽苗生长及其ITCs含量的影响
由图2可知,温度对于西兰花芽苗生长状况和ITCs含量的影响并不呈线性变化。在发芽温度24~33 ℃范围内,经30 ℃处理的芽苗,其芽长和鲜重均显著高于其他各温度处理(P<0.05),发芽4 d时芽长和鲜重分别达到了29 mm和0.34 g。同样的,30 ℃处理下芽苗中ITCs含量与其它温度相比也具有显著性差异(P<0.05),发芽4 d时其含量最高为388.25 mg/100 g mf(图2d),因此,30 ℃是西兰花生长和富集ITCs的最适温度。
2.3 不同浓度ZnSO4对西兰花芽苗生长及其ITCs含量的影响
图3显示,随着ZnSO4处理浓度的升高,西兰花芽苗的生长逐渐受到抑制,发芽期间芽苗的芽长和鲜重均显著下降(P<0.05)。而ZnSO4溶液的施加对西兰花芽苗中ITCs的富集具有显著效果(P<0.05),ITCs含量随ZnSO4处理浓度增加呈先增加后降低趋势(P<0.05),经4 mmol/L ZnSO4处理发芽4 d的西兰花芽苗中ITCs含量最高,达到386.43 mg/100 g mf(图3d),分别为2、6、8 mmol/L处理的1.56倍、1.31倍和1.22倍。结合芽苗生长状况和ITCs的富集效果,确定ZnSO4浓度为4 mmol/L进一步优化。
2.4 不同浓度褪黑素对西兰花芽苗生长及其ITCs含量的影响
由图4可以看出,褪黑素施加浓度在5~40 μmol/L范围时,西兰花的芽长和鲜重均呈现先增加后降低的趋势,当褪黑素浓度为10 μmol/L时芽长和鲜重均最高。低浓度褪黑素溶液有利于西兰花芽苗生长,5和10 μmol/L处理组芽长和鲜重均显著高于20和40 μmol/L处理组(P<0.05),表明褪黑素浓度过高会抑制西兰花芽苗的生长。同时,随着褪黑素浓度的升高,西兰花中ITCs含量先增加后降低,与芽长和鲜重的变化趋势一致,经10 μmol/L褪黑素处理4 d时,西兰花芽苗中ITCs含量最高,达到391.35 mg/100 g mf(图4d),显著高于其他各处理(P<0.05)。确定褪黑素施加浓度为10 μmol/L并进一步优化。
2.5 响应面试验优化
2.5.1 响应面模型及显著性检验
在单因素实验的基础上,采用响应面法优化发芽西兰花中ITCs富集条件,实验设计与结果见表2。利用Design Expert 11软件进行二次多元回归拟合,得到ITCs含量对自变量A、B和C的二次多项回归拟合方程:
表 2 Box-Behnken试验设计和数据表Table 2. Box-Behnken design and data of ITCs production试验号 A ZnSO4浓度 B 褪黑素浓度 C 发芽时间 Y ITCs含量
(mg/100 g mf)1 −1 −1 0 212.91±13.24 2 1 0 1 339.67±11.79 3 −1 1 0 315.21±8.48 4 1 1 0 386.78±9.19 5 0 1 −1 436.75±6.84 6 1 0 −1 418.81±9.15 7 1 −1 0 321.94±12.74 8 −1 0 1 305.42±9.36 9 0 0 0 375.16±11.84 10 −1 0 −1 391.89±7.37 11 0 1 1 333.15±12.34 12 0 0 0 392.70±7.09 13 0 0 0 361.50±8.48 14 0 −1 −1 371.49±11.23 15 0 0 0 380.20±10.34 16 0 0 0 357.42±6.21 17 0 −1 1 318.27±11.74 Y=402.12+85.96A+45.29B−203.81C−0.94AB+0.92AC−2.52BC−8.14A2−1.26B2+23.13C2
回归方程中各变量的显著性程度由P值来判断[22],P值越小,则相应变量的显著性越高,由表3可知,响应曲面模型P=0.0047<0.01,说明拟合模型是极为显著的;失拟项P>0.05,表明失拟不显著,说明试验设计中的组合数已经足够多,可得出自变量对ITCs含量的影响。R2=0.9178,表明试验模型与真实值间有较好的拟合度。离散系数(coefficient of variation, CV)值较低(6.37%),表明实验值具有很高的精确度和可靠性[23]。考虑以上因素,说明该模型可以被应用于ITCs富集的分析与预测。
表 3 回归模型方差分析Table 3. ANOVA analysis for the response variables变异来源 平方和 自由度 均方 F值 P值 显著性 模型 39723.10 9 4413.68 8.69 0.0047 ** A 7307.01 1 7307.01 14.38 0.0068 ** B 7644.04 1 7644.04 15.04 0.0061 ** C 12995.38 1 12995.38 25.57 0.0015 ** AB 350.59 1 350.59 0.69 0.4336 AC 13.45 1 13.45 0.026 0.8754 BC 634.33 1 634.33 1.25 0.3008 A2 4469.00 1 4469.00 8.79 0.0209 * B2 4206.77 1 4206.77 8.28 0.0237 * C2 2252.24 1 2252.24 4.43 0.0733 残差 3557.30 7 508.19 失拟项 2738.48 3 912.83 4.46 0.0914 误差 818.83 4 204.71 总变异 43280.40 16 R2=0.9178 R2adj=0.8121 CV=6.37% 注:*表示在P<0.05水平上显著,**表示在P<0.01水平上显著。 根据P值大小,可以认为对ITCs含量影响依次为发芽时间(C)>褪黑素浓度(B)>ZnSO4浓度(A),并且一次项A、B、C对模型极显著(P<0.01),二次项A2、B2对模型影响显著(P<0.05)。
2.5.2 双因素间交互作用
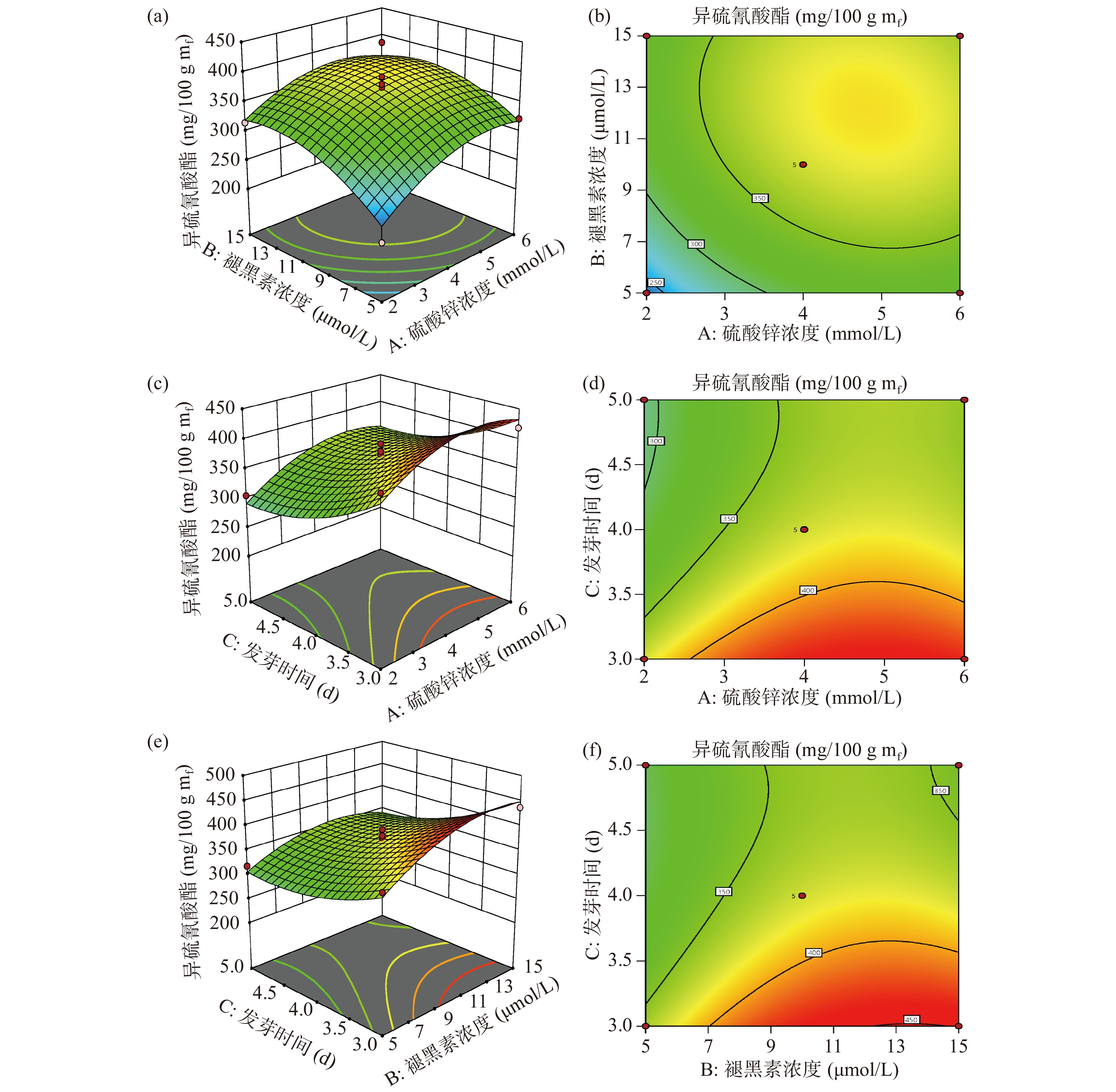
ZnSO4浓度与褪黑素浓度、发芽时间与ZnSO4浓度、褪黑素浓度和发芽时间的交互作用的响应面和等高线如图5所示。响应面坡度相对较陡表示两因素交互作用显著,坡度相对平缓表示两因素交互作用不显著。
由方差分析可知,三个因素两两之间的交互作用均不显著(P>0.05)。从图5a知,ITCs含量随着ZnSO4浓度、褪黑素浓度的增大均呈现先增大后减小的趋势。褪黑素浓度对ITCs的含量影响更为显著,表现为褪黑素浓度的方向上,响应面曲线的坡度较陡,而在ZnSO4浓度的方向上,响应面曲线的坡度较为平缓;从图5c可知,随着发芽时间的延长,ITCs含量呈现下降的趋势;而随着ZnSO4浓度的增大,ITCs含量呈现先上升后下降的趋势,发芽时间对ITCs的含量影响更为显著。从图5e可知,随着褪黑素浓度增大ITCs含量呈现先上升后下降的趋势,而随着发芽时间的延长ITCs含量呈现下降的趋势,发芽时间对ITCs的含量影响更为显著。
2.5.3 最优富集工艺的确定及验证性实验
利用软件对回归模型进行分析得出富集最大ITCs含量相对应的最佳条件是ZnSO4浓度为4.69 mmol/L,褪黑素浓度为13.18 μmol/L,发芽时间为3 d,ITCs含量最大值预计为455.57 mg/100 g mf。
发芽工艺验证性实验的结果如表4所示,此最优发芽条件下测得的ITCs含量为(451.27±10.11)mg/100 g mf,与预测值相近。
表 4 验证性实验设计和结果Table 4. Arrangement and results of validation trials试验 ZnSO4浓度
(mmol/L)褪黑素浓度
(μmol/L)发芽时间
(d)异硫氰酸酯含量
(mg/100 g mf)实际值 预测值 最优组合 4.69 13.18 3 451.27±10.11 455.57 随机组合 4 10 4 375.20±11.17 373.39 2.6 最优工艺下芽苗中ITCs代谢相关指标的变化
如图6所示,相较于对照组,经ZnSO4联合褪黑素发芽3 d的西兰花芽苗中硫代葡萄糖苷含量、黑芥子酶活力和萝卜硫素含量均显著增加,分别为178.33 mg/g md,113.21 U/100 mg,157.45 mg/100 g mf,是对照组的1.95倍、1.29倍和1.31倍。
3. 讨论与结论
植物中的ITCs经硫代葡萄糖苷(硫苷)在黑芥子酶作用下形成[24],ITCs含量在很大程度上取决于硫苷含量。芸薹属植物体内含硫量对硫苷的合成具有决定性作用,若含硫量不足,硫苷会被分解合成其他含硫物质以保证芽苗生长[25],从而导致ITCs含量的下降。因此,在西兰花芽苗发芽过程外源添加硫盐理论上可以达到提高硫苷含量以富集ITCs的目的。本试验结果表明,适宜浓度的ZnSO4的胁迫下,西兰花的生长和生物量受到抑制,但同时显著提高了西兰花芽苗中ITCs的含量(P<0.05)。适宜浓度的外源褪黑素可以缓解ZnSO4对芽苗的胁迫并成功富集ITCs。
本试验发现发芽4 d时西兰花芽苗中的ITCs含量显著高于发芽6 d的含量(P<0.05),这与之前的报道一致[26],可能是由于发芽天数的增加,芽苗为满足生长营养的需求,使得芽苗内硫苷含量降低[27-28],从而使ITCs含量降低,也有可能因为遭到胁迫时间太长而导致合成ITCs的相关酶活性被破坏或与ITCs相关物质不断消耗导致ITCs含量降低[29]。研究表明30 ℃是多种高等植物富集次生代谢产物的最适温度[30-32]。通过单因素实验确定西兰花富集ITCs的最适温度也为30 ℃,这与之前的报道一致[33]。植物发芽过程中,温度过高可能会促进某些酶的活性,导致植物体内发生异常的生化反应或引起部分蛋白质的变性,从而抑制植物生长,而温度过低影响植物生长的原因可能是蛋白质合成过程受阻、植物代谢紊乱等等。试验发现4 mmol/L ZnSO4下西兰花芽苗中ITCs含量最高,这与郭强晖[12]的研究结果一致,继续提高ZnSO4浓度并不会促进ITCs的富集,反而会增大对芽苗生长的抑制,这表明合适的ZnSO4浓度对ITCs富集的影响很大。本试验发现10 μmol/L褪黑素处理可以兼顾芽苗ITCs含量和生物量。低浓度的褪黑素(5~10 μmol/L)处理可以缓解芽苗受到的ZnSO4胁迫,促进芽苗的生长。尹永祺等[31]认为,褪黑素通过提高过氧化物酶(SOD)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)等抗氧化酶活性来清除西兰花体内的活性氧(ROS)以缓解ZnSO4的胁迫。习林杰[27]研究了不同浓度的褪黑素处理下生菜幼苗的根系变化,发现低浓度(10 μmol/L)的褪黑素对生菜生长具有促进作用,而高浓度(高于100 μmol/L)的褪黑素对生菜生长有抑制作用,说明褪黑素浓度对生菜幼苗根系具有浓度梯度效应,结合本研究可知褪黑素最佳作用浓度会因植物物种的不同而呈现差异。对于西兰花,褪黑素浓度过大(高于10 μmol/L)时会抑制其芽苗的生长。综上所述,ZnSO4胁迫和外源褪黑素的联合处理西兰花芽苗富集ITCs是完全可行的。
本研究通过单因素和响应面优化试验,得到三个因素影响程度大小顺序为:发芽时间>褪黑素浓度>ZnSO4浓度,并获得ZnSO4与褪黑素联合处理下西兰花富集ITCs的最优工艺条件:西兰花芽苗在30 ℃下喷施4.69 mmol/L ZnSO4和13.18 μmol/L褪黑素混合溶液发芽3 d,ITCs含量最高,达451.27 mg/100 g mf,同时芽苗中硫代葡萄糖苷和萝卜硫素含量以及黑芥子酶活力均显著增加(P<0.05)。
-
表 1 响应面试验因素与水平
Table 1 The test factors and levels of response surface experiment
水平 A ZnSO4浓度
(mmol/L)B 褪黑素浓度
(μmol/L)C 发芽时间
(d)−1 2 5 3 0 4 10 4 1 6 15 5 表 2 Box-Behnken试验设计和数据表
Table 2 Box-Behnken design and data of ITCs production
试验号 A ZnSO4浓度 B 褪黑素浓度 C 发芽时间 Y ITCs含量
(mg/100 g mf)1 −1 −1 0 212.91±13.24 2 1 0 1 339.67±11.79 3 −1 1 0 315.21±8.48 4 1 1 0 386.78±9.19 5 0 1 −1 436.75±6.84 6 1 0 −1 418.81±9.15 7 1 −1 0 321.94±12.74 8 −1 0 1 305.42±9.36 9 0 0 0 375.16±11.84 10 −1 0 −1 391.89±7.37 11 0 1 1 333.15±12.34 12 0 0 0 392.70±7.09 13 0 0 0 361.50±8.48 14 0 −1 −1 371.49±11.23 15 0 0 0 380.20±10.34 16 0 0 0 357.42±6.21 17 0 −1 1 318.27±11.74 表 3 回归模型方差分析
Table 3 ANOVA analysis for the response variables
变异来源 平方和 自由度 均方 F值 P值 显著性 模型 39723.10 9 4413.68 8.69 0.0047 ** A 7307.01 1 7307.01 14.38 0.0068 ** B 7644.04 1 7644.04 15.04 0.0061 ** C 12995.38 1 12995.38 25.57 0.0015 ** AB 350.59 1 350.59 0.69 0.4336 AC 13.45 1 13.45 0.026 0.8754 BC 634.33 1 634.33 1.25 0.3008 A2 4469.00 1 4469.00 8.79 0.0209 * B2 4206.77 1 4206.77 8.28 0.0237 * C2 2252.24 1 2252.24 4.43 0.0733 残差 3557.30 7 508.19 失拟项 2738.48 3 912.83 4.46 0.0914 误差 818.83 4 204.71 总变异 43280.40 16 R2=0.9178 R2adj=0.8121 CV=6.37% 注:*表示在P<0.05水平上显著,**表示在P<0.01水平上显著。 表 4 验证性实验设计和结果
Table 4 Arrangement and results of validation trials
试验 ZnSO4浓度
(mmol/L)褪黑素浓度
(μmol/L)发芽时间
(d)异硫氰酸酯含量
(mg/100 g mf)实际值 预测值 最优组合 4.69 13.18 3 451.27±10.11 455.57 随机组合 4 10 4 375.20±11.17 373.39 -
[1] ALLIYAGURU D L, YUAN J M, KWNSLER T W, et al. Isothiocyanates: Translating the power of plants to people[J]. Molecular Nutrition & Food Research,2018,62(18):965−973.
[2] ARES A M, NOZAL M J, BERNAL J. Extraction, chemical characterization and biological activity determination of broccoli health promoting compounds[J]. Journal of Chromatography A,2013,1313:78−95. doi: 10.1016/j.chroma.2013.07.051
[3] SOUNDARARAJAN P, KIM J S. Anti-carcinogenic glucosinolates in cruciferous vegetables and their antagonistic effects on prevention of cancers[J]. Molecules,2018,23(11):2983−2991. doi: 10.3390/molecules23112983
[4] 董笑克, 胡玉立, 洪明昭, 等. 辣木叶的降糖作用及其机制研究进展[J]. 环球中医药,2019,12(2):315−320. [DONG X K, HU Y L, HONG M Z, et al. Research progress of hypoglycemic effect and mechanism of Moringa oleifera leave[J]. Global Traditional Chinese Medicine,2019,12(2):315−320. doi: 10.3969/j.issn.1674-1749.2019.02.046 [5] KUMAGAI H, KASHIM A N, SEKI T, et al. Analysis of volatile components in essential oil of upland wasabi and their inhibitory effects on platelet aggregation[J]. Bioscience Biotechnology,2004,58(12):2131−2135.
[6] 陶亦垣, 黄文忠, 张维儒, 等. 制作工艺对云南甘蓝冲菜中异硫氰酸酯的影响研究[J]. 中国调味品,2018,43(6):45−48. [TAO Y H, HUANG W Z, ZHANG W R, et al. Study on the production proess affecting the isothiocyanate content in Yunnan cabbage chongcai[J]. China Condiment,2018,43(6):45−48. doi: 10.3969/j.issn.1000-9973.2018.06.010 [7] JEFFERY E H, BROWN A F, KURILICH A C, et al. Variation in content of bioactive components in broccoli[J]. Journal of Food Composition and Analysis,2003,16(3):323−330. doi: 10.1016/S0889-1575(03)00045-0
[8] 初婷, 彭畅, 郭丽萍. MgSO4处理对西兰花芽苗菜生理活性物质和抗氧化能力的影响[J]. 食品科学,2018,39(11):53−59. [CHU T, PENG C, GUO L P. Effect of MgSO4 treatment on bioactive compounds and antioxidant activity in broccoli sprouts[J]. Food Science,2018,39(11):53−59. doi: 10.7506/spkx1002-6630-201811009 [9] 王淑雯. 芥菜芽苗中异硫氰酸酯富集调控技术及其咀嚼片开发[D]. 扬州: 扬州大学, 2017. WANG S W. Enrichment and regulation of isothiocyanate in mustard sprout and development of its chewable tablets[D]. Yangzhou: Yangzhou University, 2017.
[10] 韩宇, 程雨薇, 沈敏熙, 等. 高温及其联合亚硒酸钠调控西兰花芽苗生理及异硫氰酸酯代谢研究[J]. 食品工业科技,2019,40(22):67−72. [HAN Y, CHENG Y W, SHEN M X, et al. Regulate effect of high temperature and its Na2SeO3 combination on the physiology and metabolism of isothiocyanates in broccoli sprouts[J]. Science and Techology of Food Industry,2019,40(22):67−72. [11] 李昕悦. 芝麻菜异硫氰酸酯富集技术研究[D]. 南京: 南京农业大学, 2018. LI X Y. Enrichment technololgy of isothiocyanates in rockets[D]. Nanjing: Nanjing Agricultural University, 2018.
[12] 郭强晖. 西兰花芽苗异硫氰酸酯富集与调控技术研究[D]. 南京: 南京农业大学, 2014. GUO Q H. Study on isothiocyanates accumulation and regulation techniques in germinated broccoli sprouts[D]. Nanjing: Nanjing Agricultural University, 2014.
[13] 巩彪, 史庆华. 园艺作物褪黑素的研究进展[J]. 中国农业科学,2017,50(12):2326−2337. [GONG B, SHI Q H. Review of melatonin in horticultural crops[J]. Scientia Agricultura Sinica,2017,50(12):2326−2337. doi: 10.3864/j.issn.0578-1752.2017.12.013 [14] ZHAO Y, TAN D X, LEI Q, et al. Melatonin and its potential biological functions in the fruits of sweet cherry[J]. Journal of Pineal Research,2013,55(1):79−88. doi: 10.1111/jpi.12044
[15] TAN D X, HARDELAND R, MANCHESTER L C, et al. Functional roles of melatonin in plants, and perspectives in nutritional and agricultural science[J]. Journal of Experimental Botany,2012,63(2):577−597. doi: 10.1093/jxb/err256
[16] MURCH S J, SAXENA P K. Melatonin: A potential regulator of plant growth and development[J]. Vitro Cellular & Development Biology Plant,2016,38(6):531−536.
[17] XU L L, YUE Q Y, BIAN F E, et al. Melatonin enhances phenolics accumulation partially via ethylene signaling and resulted in high antioxidant capacity in grape berries[J]. Frontiers in Plant Science,2017,8:1−12.
[18] WANG L, LUO Z S, YANG M Y, et al. Role of exogenous melatonin in table grapes: First evidence on contribution to the phenolics-oriented response[J]. Food Chemisty,2020,329:3−9.
[19] JIAO D, YU M C, HANKIN J H, et al. Total isothiocyanate contents in cooked vegetables frequently consumed in Singapore[J]. Journal of Agricultural and Food Chemistry,1998,46(3):1055−1058. doi: 10.1021/jf9706989
[20] BUROW M, LOSANSKY A, MÜLLER R, et al. The genetic basis of constitutive and herbivore-induced ESP-independent nitrile formation in Arabidopsis[J]. Plant Physiology,2009,149(1):561−574. doi: 10.1104/pp.108.130732
[21] 郭丽萍. 热激、低氧及JA和ABA调控西兰花芽苗萝卜硫素形成机理[D]. 南京: 南京农业大学, 2015. GUO L P. Regulation mechanism of sulforaphane formation in broccoli sprouts under heat and hypoxia stress as well as JA and ABA treatment[J]. Nanjing: Nanjing Agricultural University, 2015.
[22] ZHOU L, LI P X, ZHAO Y L, et al. Optimization of Soxhlet extraction of Antarctic krill lipid by response surface methodology[J]. Food Science,2017,38(24):165−170.
[23] CHOONIA H S, LELE S S. Three phase partitioning of β-galactosidase produced by an indigenous Lactobacillus acidophilus isolate[J]. Sep Purif Technol,2013,110:44−50. doi: 10.1016/j.seppur.2013.02.033
[24] LEE J G, LIM S, KIM J, et al. The mechanism of deterioration of the glucosinolate-myrosynase system in radish roots during cold storage after harvest[J]. Food Chemistry,2017,233:60−68. doi: 10.1016/j.foodchem.2017.04.104
[25] FALK K L, TOKUHISA J, GERSHENZON J. The effect of sulfur nutrition on plant glucosinolate content: Physiology and molecular mechanisms[J]. Plant Biology,2007,9(5):573−581. doi: 10.1055/s-2007-965431
[26] YIN Y Q, LIU Y, CHENG C. ITRAQ-based proteomic and physiological analyses of broccoli sprouts in response to exogenous melatonin with ZnSO4 stress[J]. RSC Adv,2021,11:12336. doi: 10.1039/D1RA00696G
[27] 习林杰. 盐胁迫下外源褪黑素对生菜幼苗根系的影响[D]. 杨凌: 西北农林科技大学, 2019. XI L J. Effects of exogenous melatonin on root system of lettuce seedlings under salt stress[D]. Yangling: Northwest A & F University, 2019.
[28] 王志英, 郭丽萍, 李倩倩, 等. 甘蓝苗生长过程中主要生理生化变化[J]. 食品科学,2015,36(3):6−11. [WANG Z Y, GUO L P, LI Q Q. Changes in main physiological and biochemical metabolism in cabbage sprouts during germination[J]. Food Science,2015,36(3):6−11. [29] 刘寅. 外源褪黑素调控ZnSO4胁迫下西兰花芽苗ITCs代谢机制[D]. 扬州: 扬州大学, 2021, 24−25. LIU Y. Exogenous melatonin regulates the metabolism mechanism of ITCs in broccoli sprouts under ZnSO4 stress[D]. Yangzhou: Yangzhou University, 2021, 24−25.
[30] ZHAO Y, XIE C, WANG P, et al. GABA regulates phenolics accumulation in soybean sprouts under NaCl stress[J]. Antioxidants,2021,10:990−991.
[31] 尹永祺, 吴进贤, 刘春泉, 等. 玉米籽粒低氧胁迫发芽期间主要生理生化和γ -氨基丁酸含量变化[J]. 食品科学,2014,35(17):105−106. [YIN Y Q, WU J X, LIU C Q, et al. Changes in Physio-biochemical indexes and γ-Aminobutyric acid content during germination of maize under hypoxia stress[J]. Food Science,2014,35(17):105−106. [32] 程超. 热激、MeJA及ABA富集芥菜芽苗褪黑素技术及机理研究[D]. 扬州: 扬州大学, 2020. 13−14. CHENG C. Study on technology and mechanism of enriching melatonin in mustard sprouts with heat shock, MeJA and ABA[D]. Yangzhou: Yangzhou University, 2020.
[33] XIE Y, SUN G, WANG L. Effects of spraying abscisic acid on photosynthetic physiology of lettuce seedlings under salt stress[J]. IOP Conference Series: Earth and Environmental Science,2018,199(1):23−25.





 下载:
下载:
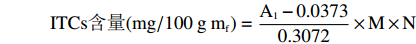
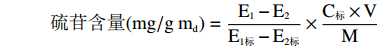

 下载:
下载:
