Expression of Recombinant β-Glucosidase in Bacillus subtilis and Its Enzymatic Characterization and Application in Preparation of Icariside II
-
摘要: 为获得安全高效的β-葡萄糖苷酶用于生物催化淫羊藿苷水解制备宝藿苷I,通过大肠杆菌-枯草芽孢杆菌穿梭载体pMA5在食品安全菌株枯草芽孢杆菌WB600中异源表达Thermotoga petrophila来源的耐热β-葡萄糖苷酶TpBgl3,研究了所表达重组酶的酶学性质及其水解宝藿苷制备宝藿苷I的工艺条件。结果表明,菌株在30 ℃、SR培养基中发酵培养48 h后,上清液中的β-葡萄糖苷酶酶活力达到69.68 U/mL。重组表达的TpBgl3最适温度为85 ℃,最适pH为4.0,在65 ℃、pH4.0下放置3 h仍能保持85%以上的相对酶活。在65 ℃、pH4.0、酶用量0.16 U/mg、反应时间20 min的优化条件下,其能将10 g/L的淫羊藿苷水解转化为7.50 g/L的宝藿苷I,摩尔转化率为98.67%。β-葡萄糖苷酶的枯草芽孢杆菌分泌表达为宝藿苷I及其他高附加值苷元类化合物的工业化安全高效生物制备提供了新途径。Abstract: To obtain a safe and efficient β-glucosidase for preparing icariside II from icariin by biocatalytic hydrolysis, a GRAS (generally recognized as safe) strain Bacillus subtilis WB600 was used as the host to produce a thermophilic β-glucosidase from Thermotoga petrophila, by construction of a Escherichia coli-Bacillus subtilis shuttle vector pMA5. Enzymatic properties of the recombinant enzyme and its process conditions of hydrolyzing icariin to prepare icariside II were studied. The result showed that after cultivated in SR culture for 48 h at 30 ℃, the activity of β-glucosidase in the fermented broth reached to 69.68 U/mL. TpBgl3 exhibited the maximal activity at 85 °C and pH4.0. More than 85% of the maximum activity was retained after incubation at 65 °C and pH4.0 for 3 h. Under optimized conditions of 65 °C, pH4.0, and 0.16 U/mg enzyme dosage, the recombinant enzyme could transform 10 g/L icariin into 7.50 g/L icariside II in 20 min with a molar conversion of 98.67%. The successful secretory expression of β-glucosidase in Bacillus subtilis could provide new ways to the industrial safe and efficient biopreparation of icariside II and other high-value-added aglycon compounds.
-
β-葡萄糖苷酶能够催化水解糖苷或寡糖中结合于末端非还原性的β-D-葡萄糖键,释放出糖基配体与葡萄糖,在食品医药、能源炼制以及饲料加工等领域具有重要的应用价值[1-3]。然而,目前工业应用的β-葡萄糖苷酶大多数来自植物与真菌,存在酶表达量低、酶活力偏低、热稳定性差等问题,生产使用成本较高。随着生物技术发展,基因克隆与异源表达成为获得高效β-葡萄糖苷酶的有效途径[4-6]。枯草芽孢杆菌作为安全级菌株,具有非致病性、培养简单快速、蛋白分泌能力强、产物不易形成包涵体等优点[7-9],是理想的β-葡萄糖苷酶的生产表达宿主,然而,目前有关β-葡萄糖苷酶枯草芽孢杆菌表达的研究报道并不多见。
2002年,国家卫生部将富含黄酮化合物的淫羊藿列为可用于保健食品的药食两用植物[10]。宝藿苷Ⅰ(别名淫羊藿次苷Ⅱ)作为淫羊藿苷、朝藿定A、朝藿定B、朝藿定C 等多种淫羊藿黄酮化合物的主要代谢产物,更易被人体吸收利用,具有抗肿瘤、抗骨质疏松、改善认知功能障碍等药理活性[11-16]。目前宝藿苷Ⅰ的制备主要通过蜗牛酶、纤维素酶或β-葡萄糖苷酶催化降解淫羊藿黄酮化合物进行[17-24]。催化效率高、酶学性质优异的β-葡萄糖苷酶的获取,将有助于改进现有的酶催化降解制备宝藿苷Ⅰ工艺,降低宝藿苷Ⅰ的工业生产成本。
虽然Thermotoga petrophila来源的耐热β-葡萄糖苷酶基因TpBgl3(GenBank: ABQ46916.1)已经成功实现大肠杆菌异源表达[25-26],并应用于人参皂苷与黄芩苷的生物制备[26-27],却尚未有TpBgl3枯草芽孢杆菌表达及其应用于宝藿苷Ⅰ生物制备的相关报道。鉴于耐高温酶的食品工业应用具有提高底物溶解浓度、降低反应体系粘度、防止反应体系染菌的优势,本研究利用大肠杆菌-枯草芽孢杆菌穿梭载体pMA5,在枯草芽孢杆菌WB600中对TpBgl3基因进行异源表达,并对重组表达的β-葡萄糖苷酶的酶学性质及其在酶法转化制备宝藿苷Ⅰ中的应用进行了测试,以期推动枯草芽孢杆菌表达系统以及β-葡萄糖苷酶TpBgl3在食品工业上的应用。
1. 材料与方法
1.1 材料与仪器
大肠杆菌coli DH5α、枯草芽孢杆菌Bacillus subtilis WB600、大肠杆菌-枯草芽孢杆菌穿梭质粒pMA5、含目的基因的载体pET-21a(+) 本研究室前期保藏;LB培养基:10 g/L蛋白胨,5 g/L酵母粉,10 g/L氯化钠;SR培养基: 15 g/L蛋白胨,25 g/L酵母粉,3 g/L磷酸氢二钾;质粒DNA抽提试剂盒、DNA回收试剂盒、卡那霉素 上海生工生物工程股份有限公司;DNA Marker、DNA聚合酶、限制性内切酶、重组酶ExnaseⅡ 赛默飞世尔科技(中国)有限公司;蛋白胨、酵母粉 Oxoid公司;对硝基苯基β-D-葡萄糖苷(pNPG)、对硝基苯酚(pNP) 西格玛奥德里奇(上海)贸易有限公司;淫羊藿苷、宝藿苷Ⅰ 成都曼思特生物科技有限公司;其他试剂 均为国产分析纯。
UV-1800型紫外分光光度计 日本岛津公司;SQ-510C立式自动压力蒸汽灭菌器 重庆雅马拓科技有限公司;SW-CJ-2FD超净工作台 苏州安泰空气技术有限公司;DHP-9082恒温振荡培养箱 上海一恒科学仪器有限公司;Sorvall Stratos高速冷冻离心机 赛默飞世尔科技(中国)有限公司;Bio-Rad PowerPac Basic电泳仪、T100 PCR仪 美国BIO-RAD公司;1200Series高效液相色谱 安捷伦科技(中国)有限公司。
1.2 实验方法
1.2.1 重组菌株的构建
按照表1设计引物从载体pET-21a(+)上扩增含酶切位点的β-葡萄糖苷酶基因TpBgl3(GenBank:ABQ46916.1)目的基因。使用限制性内切酶BamH I和Nde I对质粒pMA5进行双酶切,纯化回收线性化载体。在37 ℃下利用重组酶ExnaseⅡ对回收的线性化载体与目的基因片段进行重组,重组产物通过热击法转化至E.coli DH5α感受态细胞中进行质粒扩增。验证正确后,将构建成功的质粒转化到B. subtilis WB600中得重组菌。
表 1 引物信息Table 1. Primers used in this study引物名称 引物序列(5ˊ→3ˊ) PMA5(F) GGAGCGATTTACATATGATGATGGGAAAGATCGATG PMA5(R) CTCGACTCTAGAGGATCCTCATGGTTTGAATCTCTTC TpBg13(F) TTAACTTTAAGAAGGAGATATACATATGATGATGGGCAAGATCGACGAGA TpBg13(R) AGTGGTGGTGGTGGTGGTGGGATCCGGGCTTGAACCTCTTCTCGCCCTCC 1.2.2 重组菌株的发酵表达
在无菌环境中,将1 mL重组枯草芽孢杆菌B. subtilis WB600种子液接种到装有30 mL SR培养基(含50 μg/mL卡那霉素)的250 mL锥形瓶中,于30 ℃、200 r/min培养54 h。每6 h通过紫外吸收光度法(OD600)、重组酶的酶活力测定与聚丙烯酰胺凝胶电泳分别测定菌体浓度、发酵上清液的酶活力以及目标蛋白含量。
1.2.3 重组酶的酶活力测定
参考Xie等[24]报道的方法,采用醋酸-醋酸钠缓冲液(50 mmol/L,pH6.0)配制2 mmol/L pNPG底物溶液,取900 μL pNPG底物溶液,加入100 μL适当稀释的酶液在85 ℃、600 r/min下反应10 min,迅速加入1 mL的0.5 mol/L Na2CO3,混合均匀终止反应,测定反应体系在410 nm的吸光值。酶活力单位定义为反应条件下,每分钟水解pNPG释放1 μmol pNP所需的酶量。
1.2.4 重组酶的酶学性质
1.2.4.1 最适反应温度
在50、60、65、70、75、80、85、90与95 ℃下测定酶活力。以最高酶活力为100%,计算其他温度下的相对酶活力。
1.2.4.2 温度稳定性
重组酶溶液在65、75与85 ℃下温育3 h,每隔30 min取样,测定残留酶活力。
1.2.4.3 最适pH
使用50 mol/L的pH3.0甘氨酸-盐酸缓冲液、pH3.5~6.0醋酸-醋酸钠缓冲液、pH6.5~8.0磷酸盐缓冲溶液配制pNPG底物溶液。按照1.2.3方法,测定重组酶在pH3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5与7.0下的酶活力,以最高酶活力为100%,计算其他pH下的相对酶活力。
1.2.4.4 pH稳定性[28]
选用1.2.4.3中配制的pH3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5与7.0缓冲液配制重组酶溶液,在65 ℃下温育1 h后取样,测定残留酶活力。
1.2.4.5 金属离子对酶活的影响
在反应体系中添加终浓度为5 mmoL/L金属离子(K+、Mg2+、Ni2+、Ca2+、Co2+、Ba2+、Zn2+、Mn2+、Cu2+、Fe2+和Fe3+),测定酶活力。以未添加金属离子的酶活力为100%,计算金属离子存在下的相对酶活力。
1.2.5 宝藿苷I的酶解制备工艺
1.2.5.1 酶用量考察
10 mg 淫羊藿苷与1 mL缓冲液 (50 mmol/L、pH4.0)混合后,分别加入0.2、0.4、0.6、0.8、1.2、1.6与2.0 U的重组β-葡萄糖苷酶,于65 ℃反应1 h后,加入9 mL甲醇终止反应。按照1.2.6方法测定重组酶水解淫羊藿苷生成宝藿苷 I的转化率,确定酶适宜用量。
1.2.5.2 酶解时间考察
10 mg 淫羊藿苷与1 mL缓冲液 (50 mmol/L、pH4.0)混合后,在酶解温度65 ℃、加酶量0.16 U/mg下,分别反应0、1、5、10、20、30、40与60 min,测定重组酶水解淫羊藿苷生成宝藿苷I的转化率,确定最适酶解时间。
1.2.5.3 酶解pH考察
10 mg 淫羊藿苷分别与1 mL、50 mmol/L的pH4.0、4.5、5.0、5.5、6.0、6.5的缓冲液混合后,在酶解温度65 ℃、加酶量0.16 U/mg下反应20 min,测定重组酶水解淫羊藿苷生成宝藿苷 I的转化率,确定最适酶解pH。
1.2.5.4 酶解温度考察
10 mg淫羊藿苷与1 mL缓冲液(50 mmol/L、pH4.0)混合后,在加酶量0.16 U/mg下,分别于55、60、65、70、75、80 ℃下反应20 min,测定重组酶水解淫羊藿苷生成宝藿苷I的转化率,确定最适酶解温度。
1.2.6 宝藿苷I转化率的测定
参考于雪娥等[29]报道的方法,使用高效液相色谱测定淫羊藿苷与宝藿苷I含量,计算宝藿苷I转化率。
色谱条件:Ultimate C18色谱柱(4.6 mm×250 mm,5 μm);洗脱溶剂:流动相A(乙腈+0.1%甲酸),流动相B(水+0.1%甲酸);梯度洗脱条件为:0~10 min,30%流动相A;10~30 min,30%~100%流动相A;检测波长:270 nm;流速:1.0 mL/min;柱温:30 ℃;进样量:20 μL。
标准曲线绘制:精密称取淫羊藿苷与宝藿苷I,分别加入无水甲醇进行溶解稀释,配制质量浓度为0.2、0.4、0.6、0.8与1.0 mg/mL的对照样品。精密吸取各对照溶液20 μL,注入液相色谱仪,记录峰面积。以峰面积为纵坐标(Y),对照品溶液质量浓度(μg/mL)为横坐标(X),绘制淫羊藿苷与宝藿苷Ⅰ的标准曲线,得到线性回归方程分别为Y=44005X+170.38(R2=0.9984)与Y=55060X+309.61(R2=0.9993)。
宝藿苷I转化率为淫羊藿苷转化后实际得到宝藿苷Ⅰ与理论上得到宝藿苷Ⅰ的质量比。计算公式如下:
其中,C为根据标准曲线所计算的反应液所含宝藿苷Ⅰ质量浓度(mg/mL);V为反应液体积(mL);m为反应液中的底物淫羊藿苷质量(mg);514.52为宝藿苷Ⅰ的相对分子质量;676.66为淫羊藿苷的相对分子质量。
1.3 数据处理
每组数据重复三次,数据为平均值±标准偏差,使用Excel 2013进行数据图表处理与统计分析。
2. 结果与分析
2.1 重组菌株的构建与发酵表达
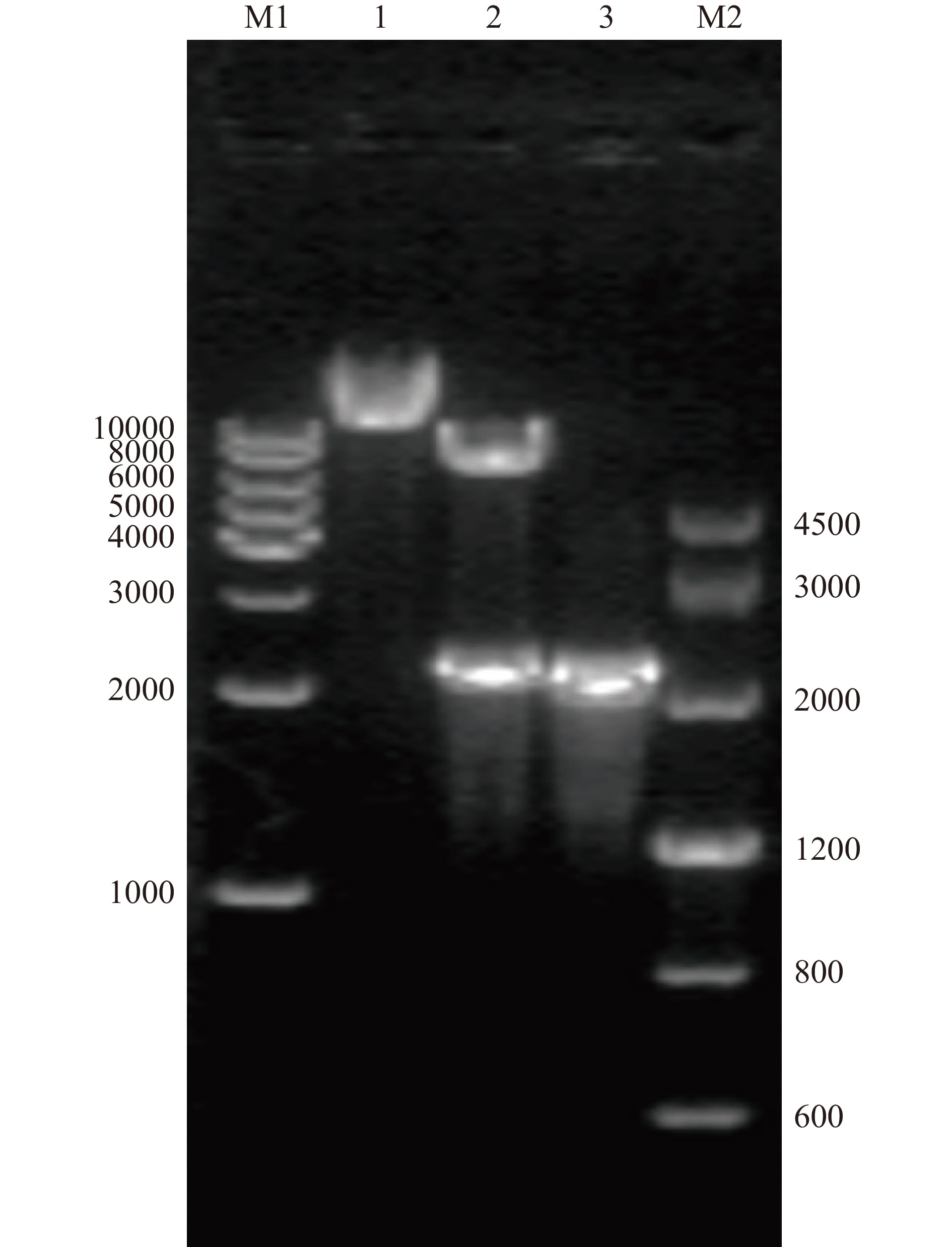
将β-葡萄糖苷酶TpBgl3的基因片段与pMA5线性化质粒进行重组连接,产物转化至E. coli DH5α感受态细胞中。重组表达载体经菌落PCR验证,结果如图1所示。重组质粒成功插入了大小约为2200 bp的基因片段,与β-葡萄糖苷酶TpBgl3理论基因长度一致,进一步将重组质粒送至苏州金唯智有限公司进行测序,测序结果确认重组质粒pMA5-TpBgl3构建成功且无核苷酸突变。
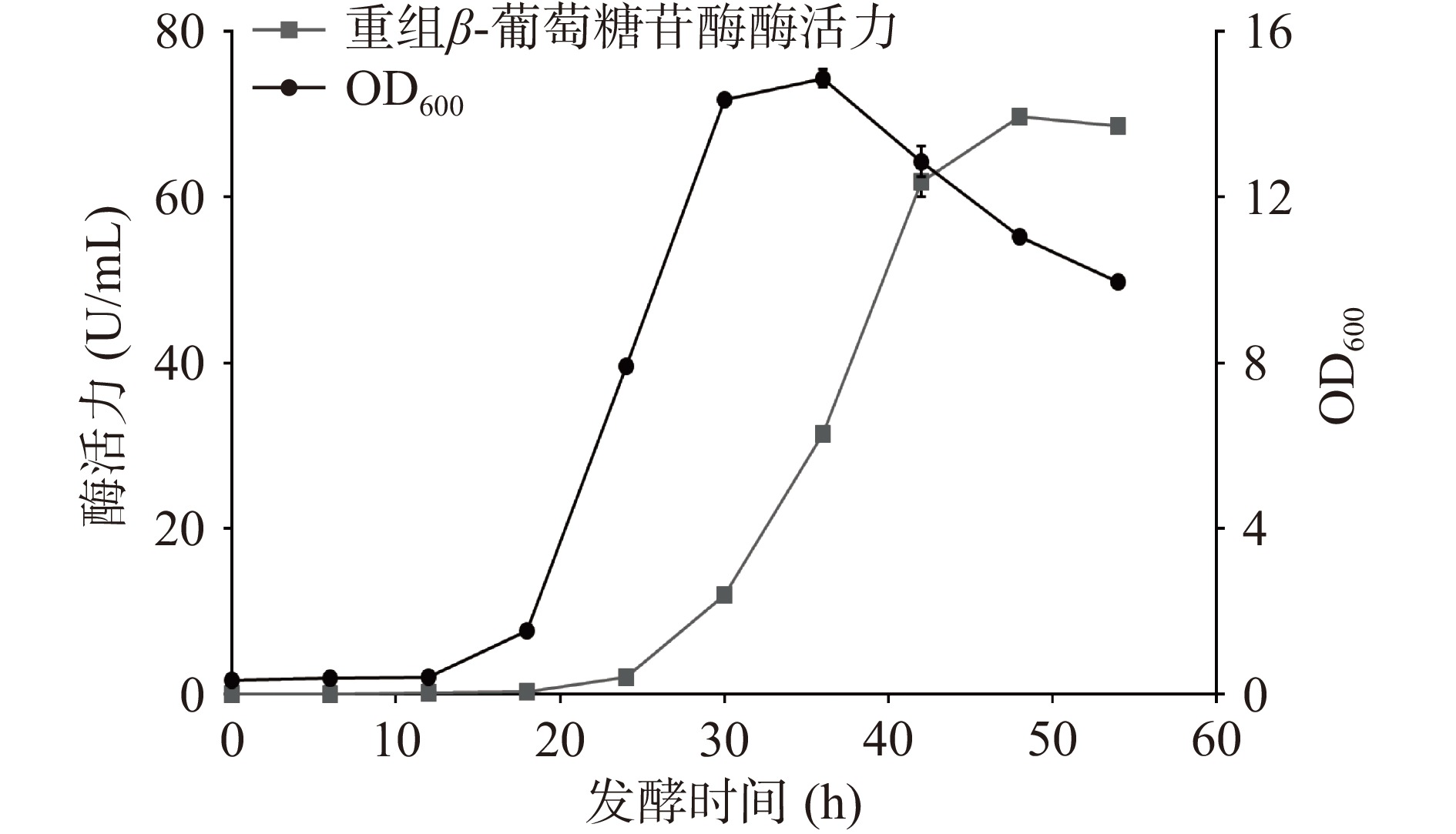
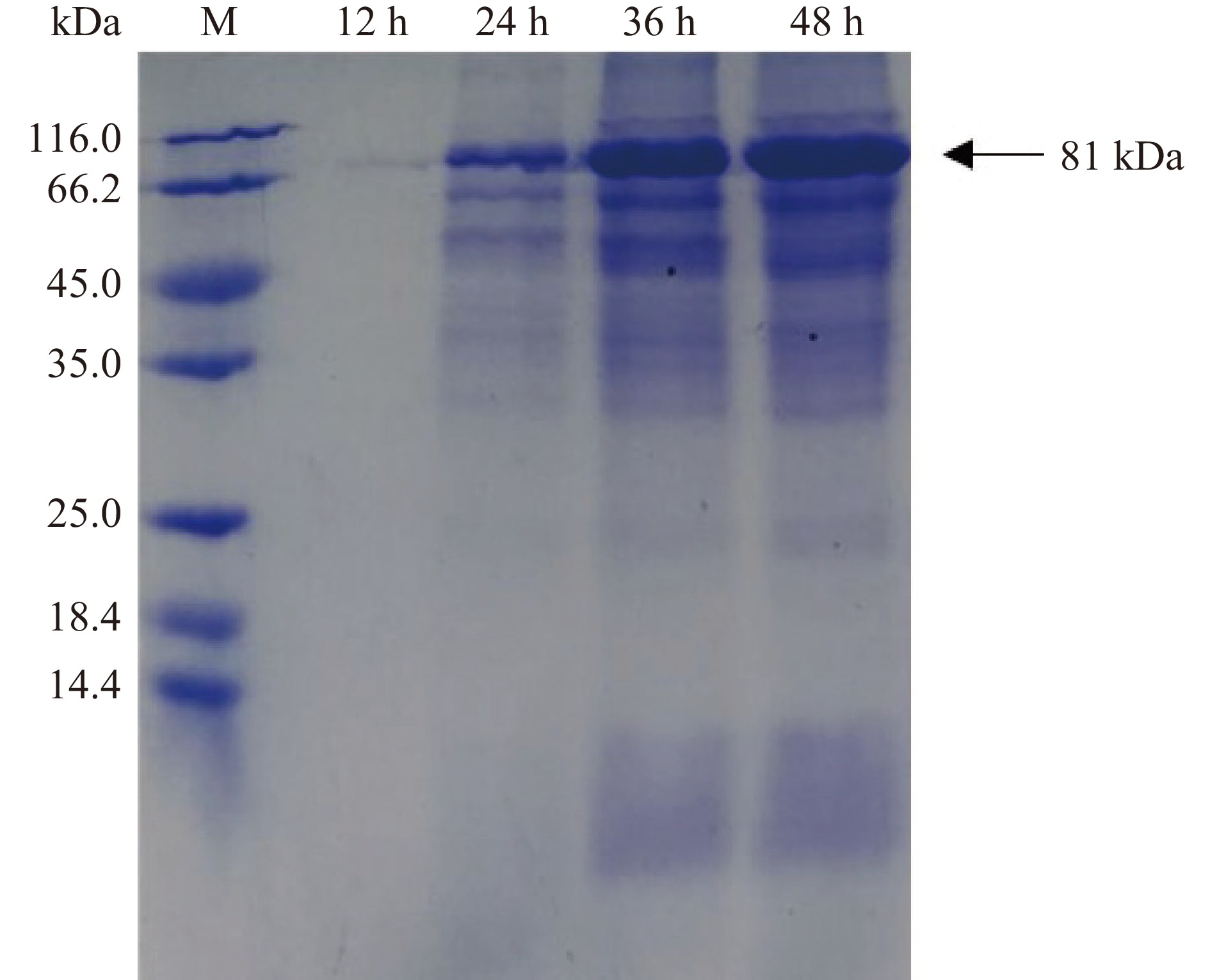
将重组质粒转入枯草芽孢杆菌WB600,在30 ℃下进行摇瓶发酵,定时取样测定OD600与酶活力,结果如图2所示。重组菌株培养12 h后生长速度加快进入对数期并在培养36 h时达到生长最高峰,之后进入衰亡期。在培养48 h时发酵液酶活力达到峰值,为69.68 U/mL。Xie等[26]通过pET-20b /DE3系统大肠杆菌异源表达β-葡萄糖苷酶TpBgl3,发现使用终浓度0.5 mmol/L的异丙基硫代半乳糖苷30 ℃诱导8 h后,发酵液的酶活力达到峰值,为21 U/mL。与之对比,本研究中的枯草芽胞杆菌重组表达β-葡萄糖苷酶TpBgl3,不仅生产安全性提高,产酶水平也有显著提升。此外,图3的SDS-PAGE检测结果显示,培养24 h后重组枯草芽孢杆菌的发酵上清液在81 kDa附近开始出现蛋白条带,与预期β-葡萄糖苷酶TpBgl3的分子量大小一致,随着培养时间延长,目标蛋白条带明显变粗变浓,也说明TpBgl3在枯草芽孢杆菌成功实现高效分泌表达。
2.2 重组β-葡萄糖苷酶酶学性质分析
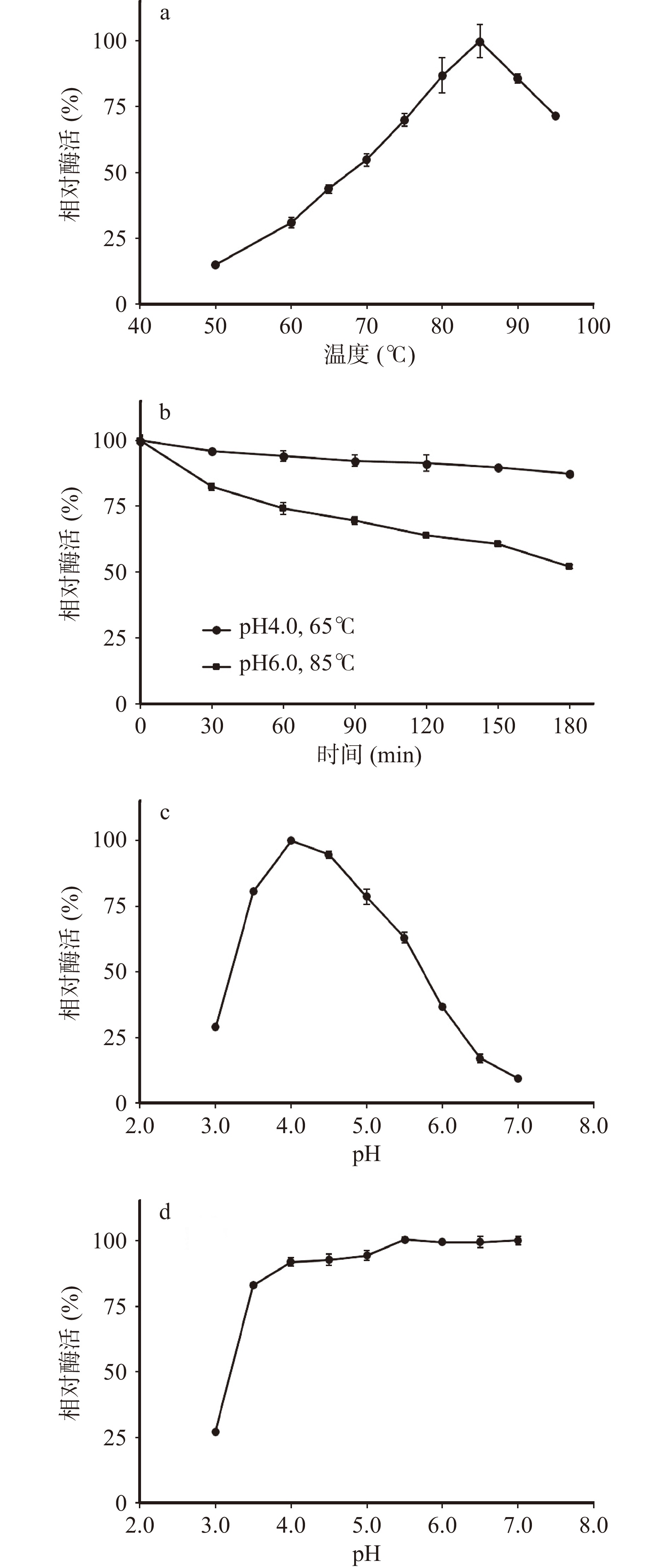
如图4a所示,枯草芽孢杆菌表达的TpBgl3最适温度为85 ℃。75~95 ℃范围内TpBgl3酶活力保持在最高值的70%以上。65 ℃下的酶活力为最高值的43.79%。由此可见,TpBgl3可以在较广的温度范围发挥催化活性。Cota等[25]通过pET-28a /DE3系统大肠杆菌表达的TpBgl3最适温度高于80 ℃,Xie等[26]通过pET-20b /DE3系统大肠杆菌表达的TpBgl3最适温度为90 ℃,尽管不同宿主重组表达的TpBgl3最适温度有所差异,却均表明TpBgl3具有较高的最适温度。
研究发现枯草芽孢杆菌表达的TpBgl3在pH4.0、85 ℃下孵育10 min迅速失活,在pH6.0、85 ℃与pH4.0、65 ℃下孵育3 h,却能分别保持54%和87%的相对酶活(图4b)。与此类似,Cota等[25]报道pET-28a /DE3系统大肠杆菌表达TpBgl3在pH 6.0和pH 4.0下99 ℃半衰期分别为462 min与5 min。Xie等[26]报道pET-20b/DE3大肠杆菌系统表达的TpBgl3在pH7.0、90 ℃下孵育3 h,能保持50%以上的相对酶活。说明TpBgl3的热稳定性与环境pH相关,酸性极端高温环境中容易失活,在弱酸性或中性条件下热稳定性良好。
如图4c所示,枯草芽孢杆菌重组表达的TpBgl3最适pH为4.0。而通过pET-28a/DE3系统与pET-20b /DE3系统大肠杆菌表达的TpBgl3最适pH分别为4.0与5.0[25-26]。与最适温度测试结果相似,虽然不同宿主重组表达的TpBgl3最适pH存在差异,却都显示出最适反应pH偏酸性。
考虑到TpBgl3在极端高温的酸性条件下容易失活,选择在高温65 ℃下考察TpBgl3的pH稳定性,结果显示TpBgl3在65 ℃、pH3.5~7.0孵育1 h仍能保持80%以上的相对酶活力(图4d),说明TpBgl3在65 ℃具有较好的酸碱环境适应性。
金属离子Mn2+、Ca2+、Zn2+、Ba2+、Co2+、Mg2+可以激活枯草芽孢杆菌表达TpBgl3的活性,而Cu2+、Fe2+和 Fe3+对酶活力具有抑制作用(表2),这与pET-20b /DE3系统大肠杆菌表达的TpBgl3酶学性质研究报道一致[26]。推测抑制酶活力的金属离子可能与酶活性部位的氨基酸残基结合,引起酶构象的改变,阻碍了酶与底物结合[28,30]。
表 2 金属阳离子对重组酶TpBgl3活性的影响Table 2. Effects of metal cations on the activity of recombinant TpBgl3金属离子 相对酶活(%) 对照 100.0±1.15 MgCl2 120.0±1.42 CaCl2 132.0±5.63 MnCl2 146.6±2.61 NiCl2 126.1±1.07 CoCl2 121.4±1.22 BaCl2 122.2±1.92 ZnCl2 127.9±1.91 KCl 101.7±2.69 CuSO4 92.9±2.13 FeSO4 86.2±2.67 FeCl3 88.9±0.02 2.3 重组β-葡萄糖苷酶催化制备宝藿苷Ⅰ研究
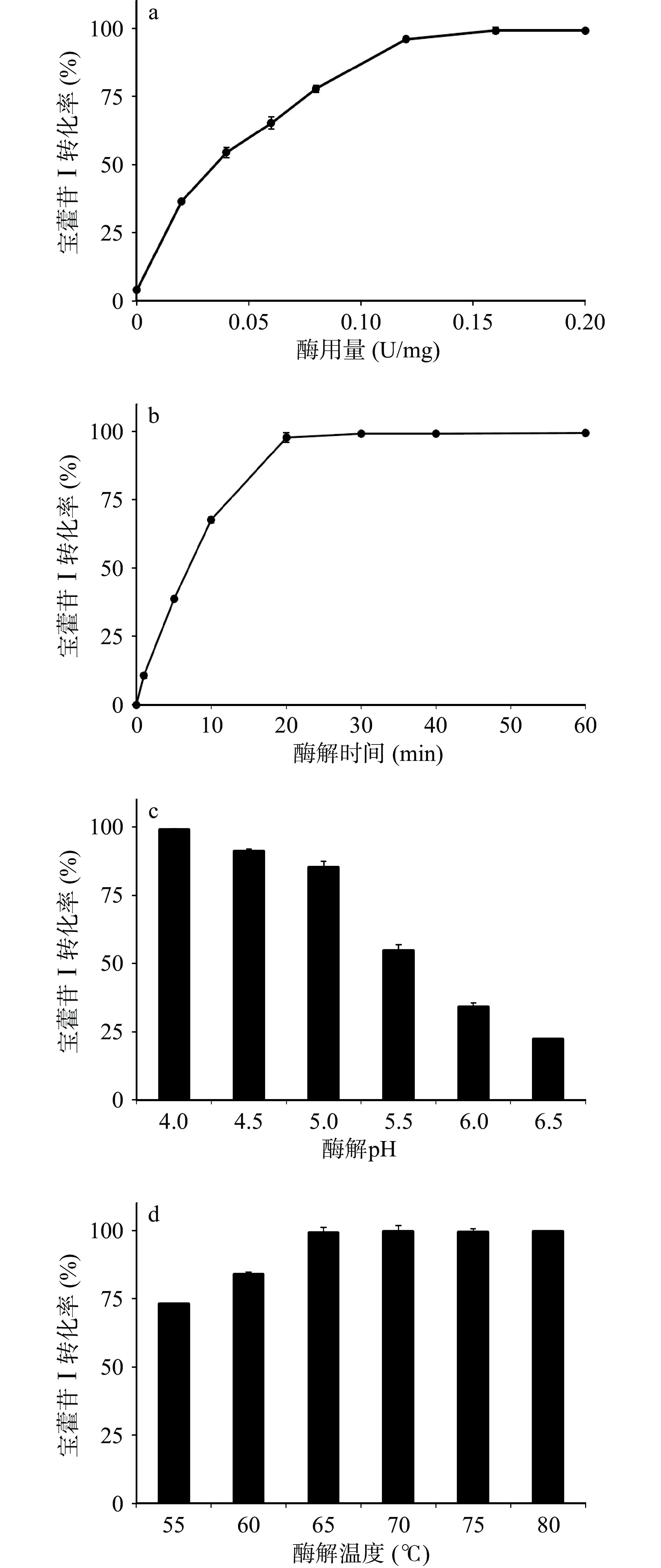
根据2.2测试的重组酶酶学性质,选择10 mg/mL的淫羊藿苷作为底物,设定反应体系pH为枯草芽孢杆菌重组表达TpBgl3的最适反应pH4.0,反应温度65 ℃,酶解时间1 h,考察酶用量对重组酶催化淫羊藿苷水解制备宝藿苷Ⅰ产率的影响,结果如图5a所示。随着酶用量的增加,酶与底物接触的几率增大,促进淫羊藿苷水解速度加快,宝藿苷Ⅰ的产率随之增加,当酶用量为0.12 U/mg时,宝藿苷Ⅰ产率的增加趋于平稳,当酶用量为0.16 U/mg时,酶与底物结合饱和,宝藿苷Ⅰ产率达到平衡。
酶解时间对宝藿苷Ⅰ产率的影响如图5b所示。在温度65℃、体系pH 4.0、酶用量0.16 U/mg下,酶解时间0~20 min范围内,宝藿苷Ⅰ的产率随着时间延长快速增加,酶解20 min时淫羊藿苷水解生成宝藿苷Ⅰ的转化率为98.67%,达到平衡,延长酶解时间宝藿苷Ⅰ产率呈现稳定的趋势。
考虑到淫羊藿苷的水溶解性差,其酶催化下的水解反应体系为悬浊液,与β-葡萄糖苷酶的酶活力测试水溶液反应体系有区别,而温度与pH是影响β-葡萄糖苷酶水解糖苷制备苷元的重要反应因素[27,31-33],对淫羊藿苷酶水解催化反应的温度与pH影响也进行了考察。结果如图5c与图5d所示,在酶用量0.16 U/mg、酶解时间20 min下,重组表达β-葡萄糖苷酶TpBgl3催化淫羊藿苷水解最适pH依旧为4.0,宝藿苷Ⅰ的转化率在65~80 ℃范围内无明显差异。
已报道的酶催化淫羊藿苷水解制备宝藿苷Ⅰ工艺中(见表3),常见底物浓度不超过10 mg/mL,pH维持在4.0~5.5,酶解温度40~50 ℃,酶解时间不少于1 h[17-24]。如Cheng等[21]使用Trichoderma viride来源的β-葡萄糖苷酶催化淫羊藿苷水解,在底物浓度1.0 mg/mL、pH4.0、温度41 ℃、用酶量9.8 U/mg优化条件下,水解淫羊藿苷1 h的宝藿苷Ⅰ转化率为95.03%。嗜热菌Ignisphaera aggregans来源、大肠杆菌重组表达的β-葡萄糖苷酶IagBgl1在底物浓度10 mg/mL、pH6.5、温度90 ℃、用酶量0.08 U/mg的优化反应条件下,水解淫羊藿苷20 min的宝藿苷Ⅰ转化率低于50%[24]。本研究表达的β-葡萄糖苷酶在底物浓度10 mg/mL、pH4.0、温度65 ℃下催化淫羊藿苷水解20 min,酶用量0.08 U/mg与0.16 U/mg下的宝藿苷Ⅰ转化率分别为65.24与98.67%。对比可见,枯草芽孢杆菌重组表达β-葡萄糖苷酶TpBgl3用于催化淫羊藿苷水解制备宝藿苷Ⅰ,具有酶用量小、用时短、转化效率高的特点。
表 3 酶催化淫羊藿苷水解制备宝藿苷Ⅰ工艺参数对比Table 3. Comparison of technological parameters for preparing icariside II by enzymatic hydrolysis of icariin酶种类 底物浓度
(mg/mL)酶用量
(U/mg)温度
(℃)pH 酶解
时间
(h)转化率
(%)参考
文献纤维素酶 10 500 50 5.2 48 94.38 [17] 纤维素酶 8.23 20 50 5.12 35.34 97.23 [18] β-葡萄糖苷酶 0.1 2.0 50 5.0 6.0 100 [19] β-葡萄糖苷酶 1.0 − 50 5.0 1.5 100 [20] β-葡萄糖苷酶 1.0 9.8 41 4.0 1.0 95.03 [21] β-葡萄糖苷酶 0.2 8.92 50 6.0 5.0 98 [22] β-葡萄糖苷酶 20 0.32 60 4.5 2.0 98.19 [23] β-葡萄糖苷酶 10 0.08 90 6.5 1.5 99.48 [24] β-葡萄糖苷酶 10 0.16 65 4.0 0.33 98.67 本研究 注:“−”缺少酶活力数据,无法计算以U/mg为单位的酶用量。 3. 结论
本研究在枯草芽孢杆菌WB600中成功实现了Thermotoga petrophila来源的β-葡萄糖苷酶TpBgl3的高效分泌表达,获得的TpBgl3具有较高的最适反应温度,在65 ℃下温度耐受性与酸耐受性良好,其应用于淫羊藿苷生物催化降解制备宝藿苷Ⅰ具有酶用量小、用时少、转化效率高的优势。这一研究有望为拓展枯草芽孢杆菌表达系统与β-葡萄糖苷酶的食品工业应用提供新思路。鉴于枯草芽孢杆菌表达系统安全性高、酶表达量高的优点,后期可以通过酶发酵条件优化、酶固定化、酶解工艺正交优化以及底物谱筛选等实验进一步提升枯草芽孢杆菌异源表达β-葡萄糖苷酶TpBgl3在宝藿苷Ⅰ以及其他珍贵苷元化合物生物制备上的应用潜力。
-
表 1 引物信息
Table 1 Primers used in this study
引物名称 引物序列(5ˊ→3ˊ) PMA5(F) GGAGCGATTTACATATGATGATGGGAAAGATCGATG PMA5(R) CTCGACTCTAGAGGATCCTCATGGTTTGAATCTCTTC TpBg13(F) TTAACTTTAAGAAGGAGATATACATATGATGATGGGCAAGATCGACGAGA TpBg13(R) AGTGGTGGTGGTGGTGGTGGGATCCGGGCTTGAACCTCTTCTCGCCCTCC 表 2 金属阳离子对重组酶TpBgl3活性的影响
Table 2 Effects of metal cations on the activity of recombinant TpBgl3
金属离子 相对酶活(%) 对照 100.0±1.15 MgCl2 120.0±1.42 CaCl2 132.0±5.63 MnCl2 146.6±2.61 NiCl2 126.1±1.07 CoCl2 121.4±1.22 BaCl2 122.2±1.92 ZnCl2 127.9±1.91 KCl 101.7±2.69 CuSO4 92.9±2.13 FeSO4 86.2±2.67 FeCl3 88.9±0.02 表 3 酶催化淫羊藿苷水解制备宝藿苷Ⅰ工艺参数对比
Table 3 Comparison of technological parameters for preparing icariside II by enzymatic hydrolysis of icariin
酶种类 底物浓度
(mg/mL)酶用量
(U/mg)温度
(℃)pH 酶解
时间
(h)转化率
(%)参考
文献纤维素酶 10 500 50 5.2 48 94.38 [17] 纤维素酶 8.23 20 50 5.12 35.34 97.23 [18] β-葡萄糖苷酶 0.1 2.0 50 5.0 6.0 100 [19] β-葡萄糖苷酶 1.0 − 50 5.0 1.5 100 [20] β-葡萄糖苷酶 1.0 9.8 41 4.0 1.0 95.03 [21] β-葡萄糖苷酶 0.2 8.92 50 6.0 5.0 98 [22] β-葡萄糖苷酶 20 0.32 60 4.5 2.0 98.19 [23] β-葡萄糖苷酶 10 0.08 90 6.5 1.5 99.48 [24] β-葡萄糖苷酶 10 0.16 65 4.0 0.33 98.67 本研究 注:“−”缺少酶活力数据,无法计算以U/mg为单位的酶用量。 -
[1] 张媛媛, 苏敏, 朴春红, 等. 微生物来源的β-葡萄糖苷酶在食品工业中应用进展[J]. 食品工业科技,2019,40(16):329−335. [ZHANG Y Y, SU M, PIAO C H, et al. Progress on the β-glucosidase from microorganisms and its applications in food industry[J]. Science and Technology of Food Industry,2019,40(16):329−335. [2] AHMED A, BATOOL K, BIBI A. Microbial β-glucosidase: sources, production and applications[J]. Journal of Applied & Environmental Microbiology,2017,5(1):31−46.
[3] SRIVASTAVA N, RATHOUR R, JHA S, et al. Microbial beta glucosidase enzymes: recent advances in biomass conversation for biofuels application[J]. Biomolecules,2019,9(6):220. doi: 10.3390/biom9060220
[4] LI Y, Hu X, SANG J, et al. An acid-stable β-glucosidase from Aspergillus aculeatus: gene expression, biochemical characterization and molecular dynamics simulation[J]. International Journal of Biological Macromolecules,2018,119:462−469. doi: 10.1016/j.ijbiomac.2018.07.165
[5] ZADA N S, BELDUZ A O, GÜLER H I, et al. Cloning, expression, biochemical characterization, and molecular docking studies of a novel glucose tolerant β-glucosidase from Saccharomonospora sp. NB11[J]. Enzyme and Microbial Technology,2021,148:109799. doi: 10.1016/j.enzmictec.2021.109799
[6] SHI X, XIE J, LIAO S, et al. High-level expression of recombinant thermostable β-glucosidase in Escherichia coli by regulating acetic acid[J]. Bioresource Technology,2017,241:795−801. doi: 10.1016/j.biortech.2017.05.105
[7] 康倩, 向梦洁, 张大伟. 枯草芽孢杆菌在系统与合成生物技术中研究进展及工业应用[J]. 生物工程学报,2021,37(3):923−938. [KANG Q, XIANG M J, ZHANG D W. Research progress and industrial application of Bacillus subtilis in systematic and synthetic biotechnology[J]. Chinese Journal of Biotechnology,2021,37(3):923−938. [8] ZHANG K, SU L, WU J. Recent advances in recombinant protein production by Bacillus subtilis[J]. Annual Review of Food Science and Technology,2020,11:295−318. doi: 10.1146/annurev-food-032519-051750
[9] VAVROVÁ L, MUCHOVÁ K, BARÁK I. Comparison of different Bacillus subtilis expression systems[J]. Research in Microbiology,2010,161(9):791−797. doi: 10.1016/j.resmic.2010.09.004
[10] 张华峰, 杨晓华. 淫羊藿在食品工业中的应用现状与展望[J]. 食品工业科技, 2010, 31(5): 390−393 ZHANG H F, YANG X H. Application of Herba Epimedii in food industry: Current status and prospect [J] Science and Technology of Food Industry, 2010, 31(5): 390−393.
[11] 李子豪, 柯仲成, 封亮, 等. 宝藿苷Ⅰ的制备方法及药理作用研究进展[J]. 中国中药杂志,2018,43(17):3444−3450. [LI Z H, KE Z C, FENG L, et al. Preparation method and pharmacological effect of baohuosideⅠ[J]. China Journal of Chinese Materia Medica,2018,43(17):3444−3450. [12] XIAO H H, ZHANG M B, XU J T, et al. Icariside II promotes proliferation and neuronal differentiation of neural stem cells via activating Wnt/β-catenin signaling pathway[J]. Phytotherapy Research,2021,35(5):2773−2784. doi: 10.1002/ptr.7022
[13] XI Y, JIANG T, YU J, et al. Preliminary studies on the anti-osteoporosis activity of baohuoside I[J]. Biomedicine & Pharmacotherapy,2019,115:108850.
[14] ZHOU J, DENG Y, LI F, et al. Icariside II attenuates lipopolysaccharide-induced neuroinflammation through inhibiting TLR4/MyD88/NF-κB pathway in rats[J]. Biomedicine & Pharmacotherapy,2019,111:315−324.
[15] MUHAMMAD K, AMARA M, IQBAL Q J, et al. Targeting apoptosis and multiple signaling pathways with icariside II in cancer cells[J]. International Journal of Biological Sciences,2015,11(9):1100−1112. doi: 10.7150/ijbs.11595
[16] 翟远坤, 葛宝丰, 陈克明, 等. 淫羊藿苷与其代谢产物淫羊藿次苷Ⅱ对骨髓间充质干细胞成骨性分化影响的比较研究[J]. 中药材,2010,33(12):1896−1900. [ZHAI Y K, GE B F, CHEN K M, et al. Comparative study on the osteogenic differentiation of rat bone marrow stromal cells effected by icariin and icariside II[J]. Journal of Chinese Medicinal Materials,2010,33(12):1896−1900. [17] 彭静, 马益华, 陈彦, 等. 固定化β-葡萄糖苷酶和蜗牛酶生物转化淫羊藿苷效率的比较研究[J]. 药学学报, 2015, 50(12): 1652-1659. PENG J, MA Y H, CHEN Y, et al. Transformation of icariin by immobilized β-glucosidase and snailase [J]. Acta Pharmaceutica Sinica 2015, 50 (12): 1652−1659.
[18] 贾东升, 贾晓斌, 赵江丽, 等. 纤维素酶转化淫羊藿苷制备宝藿苷Ⅰ的研究[J]. 中草药,2010,41(6):888−892. [JIA D S, JIA X B, ZHAO J L, et al. Preparation of baohuoside I by enzymolysis of icariin with cellulose[J]. Chinese Traditional and Herbal Drugs,2010,41(6):888−892. [19] 宋川霞, 陈红梅, 戴宇, 等. Plackett-Burman试验设计联用星点设计-效应面法优化纤维素酶水解淫羊藿苷为宝藿苷Ⅰ的工艺 [J]. 中药材, 2014, 37(11): 2082−2086. SONG Q X, CHEN H M, DAI Y, et al. Optimization of process of icraiin be hydrolyzed to BaohuosideⅠby cellulase based on Plackett-Burman design combined with CCD response surface methodology [J] Journal of Chinese Medicinal Materials, 2014, 37(11): 2082−2086.
[20] 张振海, 陈玲玲, 贾晓斌, 等. β-葡萄糖苷酶酶解淫羊藿苷制备宝藿苷Ⅰ的工艺研究[J]. 中国药房,2011,22(43):4059−4061. [ZHANG Z H, CHEN L L, JIA X B, et al. Preparation technology of baohuoside I by enzymolysis of icariin with β-glucosidase[J]. China Pharmacy,2011,22(43):4059−4061. [21] CHENG T, YANG J, ZHANG T, et al. Optimized biotransformation of Icariin into Icariside II by β-glucosidase from Trichoderma viride using central composite design method[J]. Bio Med Research International,2016:5936947.
[22] QUAN X, XU D, HUANG Z, et al. Preparation of icariside II from icariin by enzymatic hydrolysis method[J]. Fitoterapia,2010,81(5):437−442. doi: 10.1016/j.fitote.2009.12.006
[23] SHEN Y, WANG H, LU Y, et al. Construction of a novel catalysis system for clean and efficient preparation of baohuoside I from icariin based on biphase enzymatic hydrolysis[J]. Journal of Cleaner Production,2018,170:727−734. doi: 10.1016/j.jclepro.2017.09.192
[24] XIE J, XU H, JIANG J, et al. Characterization of a novel thermostable glucose-tolerant GH1 β-glucosidase from the hyperthermophile Ignisphaera aggregans and its application in the efficient production of baohuoside I from icariin and total epimedium flavonoids[J]. Bioorganic Chemistry,2020,104:104296. doi: 10.1016/j.bioorg.2020.104296
[25] COTA J, CORRÊA T L R, DAMÁSIO A R L, et al. Comparative analysis of three hyperthermophilic GH1 and GH3 family members with industrial potential[J]. New Biotechnology,2015,32(1):13−20. doi: 10.1016/j.nbt.2014.07.009
[26] XIE J, ZHAO D, ZHAO L, et al. Overexpression and characterization of a Ca2+ activated thermostable β-glucosidase with high ginsenoside Rb1 to ginsenoside 20(S)-Rg3 bioconversion productivity[J]. Journal of Industrial Microbiology & Biotechnology,2015,42(6):839−850.
[27] 李石平, 温建辉, 赵祎武, 等. 利用一种耐热耐糖β-葡萄糖苷酶制备黄芩素的研究[J]. 中国中药杂志,2015,40(23):4616−4622. [LI S P, WEN J H, ZHAO W W, et al. Preparation of baicalein using thermophilic and sugar-tolerant β-glucosidase[J]. China Journal of Chinese Materia Medica,2015,40(23):4616−4622. [28] 陶大炜, 宁喜斌. 产 α-环糊精葡萄糖基转移酶的菌株筛选、鉴定与酶学性质的初步研究[J]. 食品与发酵工业, 2021, 47(6): 145−151. TAO D, NING X. Screening, identification and enzymatic properties of α-cyclodextrin glycosyltransferase producing strains [J]. Food and Fermentation Industries, 2021, 47(6): 145−151.
[29] 于雪娥, 秦建平, 李家春, 等. 一测多评法同时测定淫羊藿总黄酮胶囊中7种黄酮类成分[J]. 中国实验方剂学杂志,2017,23(7):79−85. [YU X E, QIN J P, LI J C, et al. Simultaneous determination of 7 flavonoid compounds in yinyanghuo zonghuangtong capsule by quantitative analysis of multi-components with a single-marker[J]. Chinese Journal of Experimental Traditional Medical Formulae,2017,23(7):79−85. [30] 陈静, 郝伟伟, 王春梅, 等. 产β-葡萄糖苷酶真菌的筛选鉴定、纯化及酶学性质分析[J]. 食品科学,2013,34(5):191−196. [CHEN J, HAO W W, WANG C M, et al. Screening and identification of β-glucosidase-producing fungi, and purification and enzymatic analysis[J]. Food Science,2013,34(5):191−196. [31] 余奕宏, 顾苑婷, 丁筑红, 等. β-葡萄糖苷酶生物转化刺梨槲皮素糖苷的工艺优化[J]. 食品科学技术学报,2020,38(5):109−118. [YU Y H, GU Y T, DING Z H, et al. Optimization on biotransformation of quercetin glycosides in Rosa roxburghii by β- glucosidase[J]. Journal of Food Science and Technology,2020,38(5):109−118. doi: 10.3969/j.issn.2095-6002.2020.05.014 [32] 郭天赐, 赵石磊, 刘石生. 苦杏仁β-葡萄糖苷酶水解豆浆中大豆异黄酮的工艺研究[J]. 食品研究与开发,2019,40(12):82−88. [GUO T C, ZHAO S L, LIU S S. Study on the hydrolyzation of soybean isoflavone aglycones in soymilk by bitter almond β-glucosidase[J]. Food Research and Development,2019,40(12):82−88. doi: 10.3969/j.issn.1005-6521.2019.12.014 [33] 何成, 吴言, 孟春雨, 等. 新型β-葡萄糖苷酶 BglD2异源表达及水解虎杖苷能力[J]. 生物工程学报,2021,37(2):580−592. [HE C, WU Y, MENG CY, et al. Heterologous expression of a novel β-glucosidase BglD2 and its application in polydatin-hydrolyzing[J]. Chinese Journal of Biotechnology,2021,37(2):580−592.





 下载:
下载:
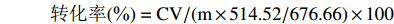
 下载:
下载:
