Study on Optimization and Activities of Rapeseed Meal Protein by Alkali-extraction and Acid-precipitation
-
摘要: 本文以菜籽饼粕为原料,采用单因素及响应面实验优化菜籽蛋白的碱溶酸沉工艺,以提高蛋白质的溶出效果,同时降低硫苷的溶出量,并对其活性进行探究。结果表明,当脱脂菜籽粕以1:40 g/mL的料液比在pH13.1、46 ℃的环境中浸提82 min后其蛋白质溶出率较高(平均8.78%)且硫苷溶出率相对较小(平均1.65%),并优选pH4.0的酸沉工艺;酸沉环节中的沉淀与上清液分别经真空冷冻干燥和喷雾干燥处理后即可得到菜籽粕酸沉蛋白和菜籽粕酸溶蛋白提取物两种产物。SDS-PAGE结果表明:两种提取物的主要蛋白成分分别为菜籽球蛋白(分子量在31 kDa、14~22 kDa)与菜籽白蛋白(<14.4 kDa),其中,菜籽粕酸沉蛋白提取物的粗蛋白含量可达(78.10%±0.53%);此外,两者均具有ABTS自由基清除能力,EC50值分别为1.372、0.438 mg/mL及一定的金黄色葡萄球菌生长抑制能力。本实验为拓宽菜籽粕蛋白提取物的应用提供了一定基础。Abstract: The aim of the study was to improve the yield of rapeseed meal protein and reduce the content of glucosinolate by optimizing the alkali-extraction and acid-precipitation process, and the bioactivities were also explored. And single factor experiment and response surface analysis were used. The results showed that the optimal conditions were as follows, solid-liquid ratio 1:40 g/mL, pH13.1, temperature 46 ℃ and extraction time 82 min. Under these conditions, the average yield of protein and glucosinolate content were 8.78% and 1.65%. And then pH4.0 was used for protein precipitation, while the sediments and supernatant were processed by vacuum freeze-drying and spray-drying respectively and correspondingly two sorts of protein extractions, rapeseed meal precipitated protein and rapeseed meal acid soluble protein. Furthermore, SDS-PAGE analysis showed that their main components were cruciferin (Mw 31 kDa、14~22 kDa) and napin (Mw<14.4 kDa), respectively. And the crude protein of rapeseed meal precipitated protein (78.10%±0.53%). What’s more, both two protein extraction processed the ability of scavenging ABTS free radicals and inhibiting effects on S. aureus, and the EC50 of the two extractions were 1.372 mg/mL and 0.438 mg/mL. Overall, this study might provide a theoretical basis for expending the application of rapeseed meal protein in the future.
-
Keywords:
- rapeseed meal protein /
- protein content /
- glucosinolate /
- antioxidant /
- antimicrobial activity
-
油菜籽是继大豆和棕榈之后的世界第三大植物油原料,饼粕作为其主要加工副产物,占比高达60%~65%,产量巨大。长期以来,菜籽粕绝大部分被用作饲料,附加值较低,但其蛋白质含量可高达30%~45%,且氨基酸组成合理,含有丰富的含硫氨基酸及一定量的赖氨酸,是一种优质的植物蛋白资源,利用前景广阔[1]。自2010年以来,已有Burcon及DSM等公司生产的菜籽蛋白先后被FDA(U.S. Food and Drug Administration)、EFSA(European Food Safety Authority)批准公认安全的(generally regarded as safe, GRAS)及食品新资源原料,菜籽蛋白正逐步从动物转向人类营养市场。我国作为油菜籽的生产大国,高附加值利用菜籽粕蛋白对提高油菜籽产业价值链意义重大。
油菜籽中的蛋白质主要包括菜籽球蛋白(cruciferin)、菜籽白蛋白(napin)及少量的油质蛋白,其中,菜籽球蛋白的平均分子量约为300~360 kDa、菜籽白蛋白的平均分子量约为14 kDa,分别具有良好的凝胶特性、成膜特性及一定的生物活性,应用前景良好[2-3]。目前,菜籽粕蛋白的制备方法包括:pH分段控制法[4-5]、盐溶法[6]、酶解法[7]及静电分离法[8]等,其中,pH分段控制法中的碱溶酸沉法是工业化生产最常用的方法,但仍存在目标蛋白选择性差且多关注酸沉淀蛋白的问题。同时,在菜籽饼粕蛋白的提取过程中,提高其得率的同时尽可能降低其抗营养物质(如硫苷等)的含量是非常有必要的。因此,本实验以浙江压榨菜籽饼粕为原料,以蛋白质和硫苷溶出率、蛋白质沉淀率为主要考察指标,通过单因素与响应面分析对菜籽饼粕蛋白的碱溶酸沉工艺进行优化,并对菜籽粕酸沉淀蛋白及酸溶解蛋白提取物进行分析研究,旨在为拓宽菜籽粕蛋白提取物的应用提供理论基础。
1. 材料与方法
1.1 材料与仪器
压榨菜籽饼粕 购置于浙江嘉兴;BSA、PBCl2 Sigma;黑芥子硫苷酸钾一水 上海源叶生物科技有限公司;考马斯亮蓝G-250、ABTS自由基试剂盒、SDS-PAGE凝胶制备试剂盒、预染蛋白Marker(14.4~97.4 kDa) 北京索莱宝科技有限公司;羧甲基纤维素钠、HCl、NaOH、乙醇等 均为分析纯,阿拉丁试剂(上海)有限公司;金黄色葡萄球菌(S.aureus)、大肠杆菌(E.coli)、黄青霉(P.chrysogenum) 中国科学院。
UV-1780型紫外可见分光光度计 岛津仪器(苏州)有限公司;HWS-26型电热恒温水浴锅 苏州江东精密仪器有限公司;AR223CN型电子天平 奥豪斯(常州)仪器有限公司;TGL-24M高速冷冻离心机 湖南平凡科技有限公司;KN680全自动凯氏定氮仪 山东海能科学仪器有限公司;YC-1800实验型喷雾干燥机 上海雅程仪器设备有限公司;DYZC-MINI4型电泳仪、WD-9143B凝胶成像系统 北京六一生物科技有限公司;BCN-1360型生物洁净工作台 北京东联哈尔仪器制造有限公司;XSP-SM4型双目生物显微镜 上海谱骞光学仪器有限公司。
1.2 实验方法
1.2.1 菜籽饼粕蛋白碱溶酸沉工艺
1.2.2 脱脂榨菜籽饼粕的制备
将菜籽饼粕粉碎过60目筛,以筛下饼粕粉为原料,石油醚为溶剂,按料液比1:10 g:mL在60~90 ℃下回流提取4 h后,自然干燥得脱脂菜籽饼粕,备用[9]。
1.2.3 菜籽饼粕蛋白碱溶工艺优化
实验过程中,脱脂菜籽饼粕与已调节好pH的碱溶液按一定比例混合均匀,恒温反应一定时间后,4 ℃条件下以5000 r/min离心15 min,然后取碱溶液测定其中蛋白质和硫苷含量。
1.2.3.1 单因素实验
以碱溶过程中菜籽饼粕中蛋白质和硫苷溶出量为测量指标,依次考察碱溶pH、碱溶时间、提取温度及料液比各因素的影响,单因素基础条件为:碱溶pH13.0,碱溶时间60 min,提取温度45 ℃,料液比1:40 g/mL。各因素的水平梯度为,碱溶pH:12.0、12.5、13.0、13.5、14.0;碱溶时间:40、60、80、100、120 min;提取温度:35、45、55、65、75 ℃;料液比:1:20、1:30、1:40、1:50、1:60 g/mL。
1.2.3.2 响应面优化试验
在单因素实验的基础上,确定料液比为1:40 g/mL,利用响应面分析法对pH、时间、温度3个因素进一步优化。根据Box-Behnken试验设计原理,选取pH(X1)、时间(X2)及温度(X3)为自变量,以蛋白质溶出率为响应值1(Y1),硫苷溶出率为响应值2(Y2)进行三因素三水平二指标的响应面分析,优化菜籽饼粕蛋白碱溶工艺条件,试验因素与水平设计见表1。
表 1 响应面试验设计因素与水平Table 1. Factors and levels of Box-Behnken design水平 因素 X1:pH X2:时间(min) X3:温度(℃) −1 12.5 60 45 0 13 80 55 1 13.5 100 65 1.2.3.3 蛋白质溶出率测定
采用考马斯亮蓝法测定不同碱溶条件下菜籽饼粕蛋白的溶出含量,具体参照罗群[10]的实验方法,并做适当修改,得到蛋白质浓度的标曲为:Y=0.0069x+0.0598,R2=0.9988(X表示BSA当量(mg)、Y表示溶液吸光度)。
蛋白质溶出率(%)=碱溶液中BSA当量脱脂菜籽饼粕质量×100 1.2.3.4 硫苷溶出率测定
参照王宁惠[11]和赵冬吉[12]的方法,利用氯化钯法对菜籽饼粕及其碱溶液中硫苷含量进行测定。精确称取黑芥子硫苷酸钾一水标准品0.02 g,用去离子水溶解后定容于10 mL 容量瓶中配成 4.8139 μmol/mL 标准液,稀释至所需浓度,取2 mL不同浓度标准液与3.0 mL 0.1% CMC 混合,再加入4.0 mmol/L PbCl2溶液2 mL,于室温反应1 h后测定其520 nm的吸光值,以PbCl2、羧甲基纤维素钠空白溶液作参比溶液制作标准曲线。得到黑芥子硫苷酸钾一水的标曲为:Y=0.555718x−0.00357,R2=0.999(X表示黑芥子硫苷酸钾一水浓度(μmol/mL)、Y表示溶液吸光度)。
准确称取粉碎菜籽饼粕0.1 g于10 mL试管中,沸水浴锅干蒸10 min后加入8 mL的90 ℃热水混匀,再在沸水浴中反应40 min,冷却静置后添加去离子水至10 mL摇匀并过滤,取2 mL过滤液按上述操作测定菜籽饼粕中硫苷含量;取菜籽饼粕碱溶液2 mL按上述操作测定其硫苷含量。以碱溶液中硫苷含量与菜籽饼粕中硫苷含量的比例为硫苷溶出率。
1.2.4 菜籽饼粕蛋白酸沉条件优化
在上述实验基础上,冷冻离心收集上清液后,优化菜籽蛋白沉淀pH(1.0、2.0、3.0、4.0、4.2、4.4、4.6、4.8、5.0),4 ℃条件下以6000 r/min离心10 min后离心收集沉淀,真空冷冻干燥得菜籽饼粕酸沉蛋白,并计算其得率[9];同时上清液经喷雾干燥得到酸溶蛋白提取物。采用凯氏定氮法测定菜籽饼粕碱溶液、酸沉蛋白、酸溶蛋白提取物的粗蛋白含量,其中,蛋白质换算系数为6.25[13]。
酸沉蛋白得率(%)=酸沉淀冻干蛋白样品质量脱脂饼粕的重量×100 1.2.5 菜籽饼粕蛋白提取物特征分析
1.2.5.1 SDS-PAGE凝胶电泳测定蛋白质分子质量分布
采用电泳仪进行SDS-PAGE凝胶电泳,按照WANG等[14]的方法,并作适当修改,具体方法如下:将菜籽饼粕碱溶液、酸沉淀蛋白、酸溶蛋白提取物分别(粗蛋白含量5 mg/mL,溶剂pH约为12.0的水溶液)与缓冲液(0.125 mol/L Tris-HCl(pH6.8)含1% SDS、2% β-巯基乙醇、5%甘油及0.025%溴酚蓝)按1:1体积比混合后煮沸约5 min,上样10 μL,80 V电泳1 h后,转为120 V继续电泳约2 h,电泳选用12%的分离胶和5%的浓缩胶,电泳结束后将凝胶置于40%甲醇与考马斯亮蓝-G250进行染色处理30 min后,于45%甲醇和10%乙酸溶液中脱色,待胶片背景蓝色呈透明状后进行凝胶电泳成像。
1.2.5.2 菜籽粕蛋白提取物清除ABTS自由基的能力
采用ABTS自由基清除能力检测试剂盒对菜籽粕酸沉蛋白及酸溶蛋白提取物的抗氧化能力进行测定。本实验在405 nm下测定样品的吸光值,其中,样品的吸光值记为A样品,以蒸馏水为空白吸光值记为A空白,试剂本底的照吸光值记为A对照。
ABTS自由基消除能力(%)=A空白−(A样品−A对照)A空白×100 1.2.5.3 菜籽粕蛋白质提取物抑菌特性探究
采用牛津杯抑菌圈法研究菜籽粕酸沉蛋白及酸溶蛋白提取物对金黄色葡萄球菌(S.aureus)、大肠杆菌(E.coli)、黄青霉菌(P.chrysogenum)的抗菌特性[15]。
首先将S.aureus、E.coli于LB琼脂培养基中活化24 h,挑取单菌落接种于100 mL LB液体培养基,于37 ℃、150 r/min培养24 h后,将菌体浓度调整至约为1.0×107 CFU/mL的菌悬液备用。P.chrysogenum接种到PDA培养基上28 ℃培养48 h后,用含有0.1%吐温80的无菌水制备其孢子悬浮液,并将孢子悬浮液浓度调整为1.0×107 孢子/mL。
分别吸取上述制备的S.aureus、E.coli菌悬液、P.chrysogenum孢子悬浮液0.02 mL接种到LB琼脂培养基及PDA培养基上并涂布均匀后,分布在牛津杯中加入0.05 mL酸沉淀蛋白溶液与酸溶蛋白提取物溶液,并以无菌PBS为对照,S.aureus、E.coli培养24 h,P.chrysogenum培养48 h后,观察其抑菌效果。
1.3 数据分析
研究中实验均重复3次,结果表示为平均值±标准差(SD),采用Design Expert 8.0.6、Origin 2017和SPSS 20对实验数据进行处理和分析。
2. 结果与分析
2.1 菜籽饼粕蛋白碱溶条件单因素实验
2.1.1 碱溶pH对碱溶液中蛋白质和硫苷溶出效果的影响
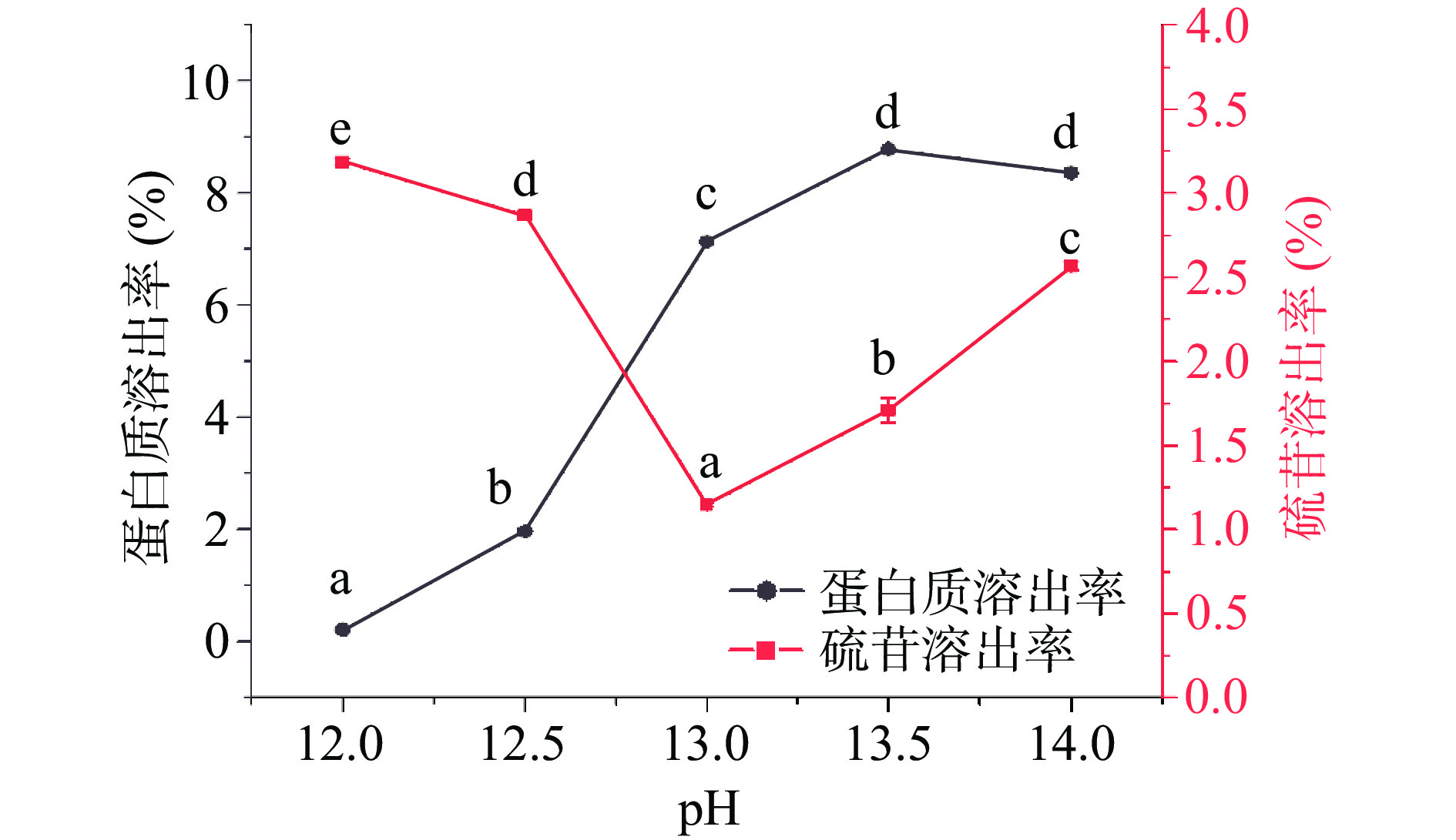
菜籽饼粕蛋白质的提取受到环境pH的影响显著(P<0.05),且一般高强度碱溶浸提工艺更有利于氮物质的溶出[9]。如图1所示,碱溶液中蛋白质的溶出率随pH的增加而增大,并在pH为13.0条件下发生显著增高(P<0.05),且在pH13.5时达到最大(约为8.78%)而后降低,这可能与饼粕中蛋白质与植酸类物质的结合稳定性受pH影响有关,即植酸可与菜籽蛋白中的赖氨酸(pKa=10.53)、精氨酸(pKa=12.48)分别通过-NH2、-CN3H4发生相互作用,随着碱溶阶段pH的增大,蛋白-植酸复合物的稳定性会逐渐下降,进而提高蛋白质的溶出效果[16]。FETZER等[17]的研究也表明弱碱性浸提环境对菜籽粕蛋白的提取效果无显著影响,只有当pH增加至11.0后,蛋白质提取率才会明显提升约9%~12%。从图1可看出,碱溶液中硫苷的含量随pH的增大表现出先降低后增高的趋势,并在pH13.0时达到最低,为(1.15%±0.01%),与ZHANG等[9]研究发现的硫苷在中高强度碱环境浸提过程中会随pH的增加出现降低的结果相吻合,这主要与硫苷在较强碱性条件下会转化为3-丁烯腈及硫葡糖等小分子有关[18]。另外,实验中可发现在相对较弱的碱性浸提环境中,蛋白质和硫苷的溶出比例成反比,以蛋白质溶出最大化同时尽可能降低硫苷的溶出率,本实验优选pH13.0进行下一步实验。此外,本研究pH与以往文献优化pH相比较高,主要是因为本实验以物料混合前水溶液pH为优化值[9,17,19]。
2.1.2 碱溶时间对碱溶液中蛋白质和硫苷溶出率的影响
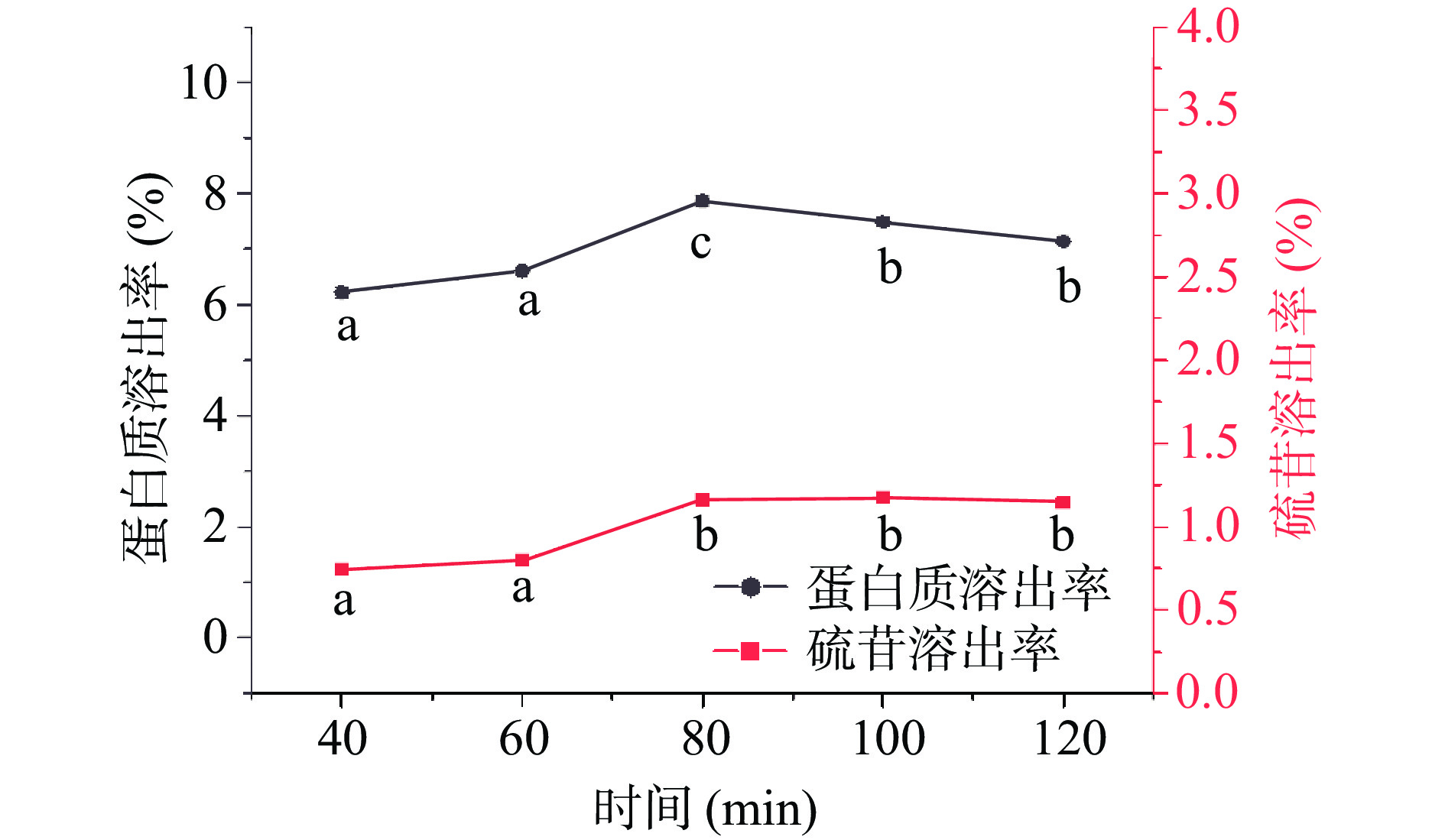
由图2可以看出,菜籽饼粕碱溶液中的蛋白质溶出率与硫苷溶出率变化规律一致,均随着浸提时间的延长表现出先增加后持平或缓慢下降的趋势,并在浸提时间为80 min时达到最大,此时碱溶液中蛋白质和硫苷的溶出率分别为(7.86%±0.09%)和(1.16%±0.01%)。对比以往研究也可发现,当碱溶浸提至一定时间后,浸提时间的延长对有效物质的溶出已无明显作用,多次短时浸提可能在实际操作过程中更有利于提高生产效率[17]。本实验优选80 min进行下一步实验。
2.1.3 碱溶温度对碱溶液中蛋白质和硫苷溶出率的影响
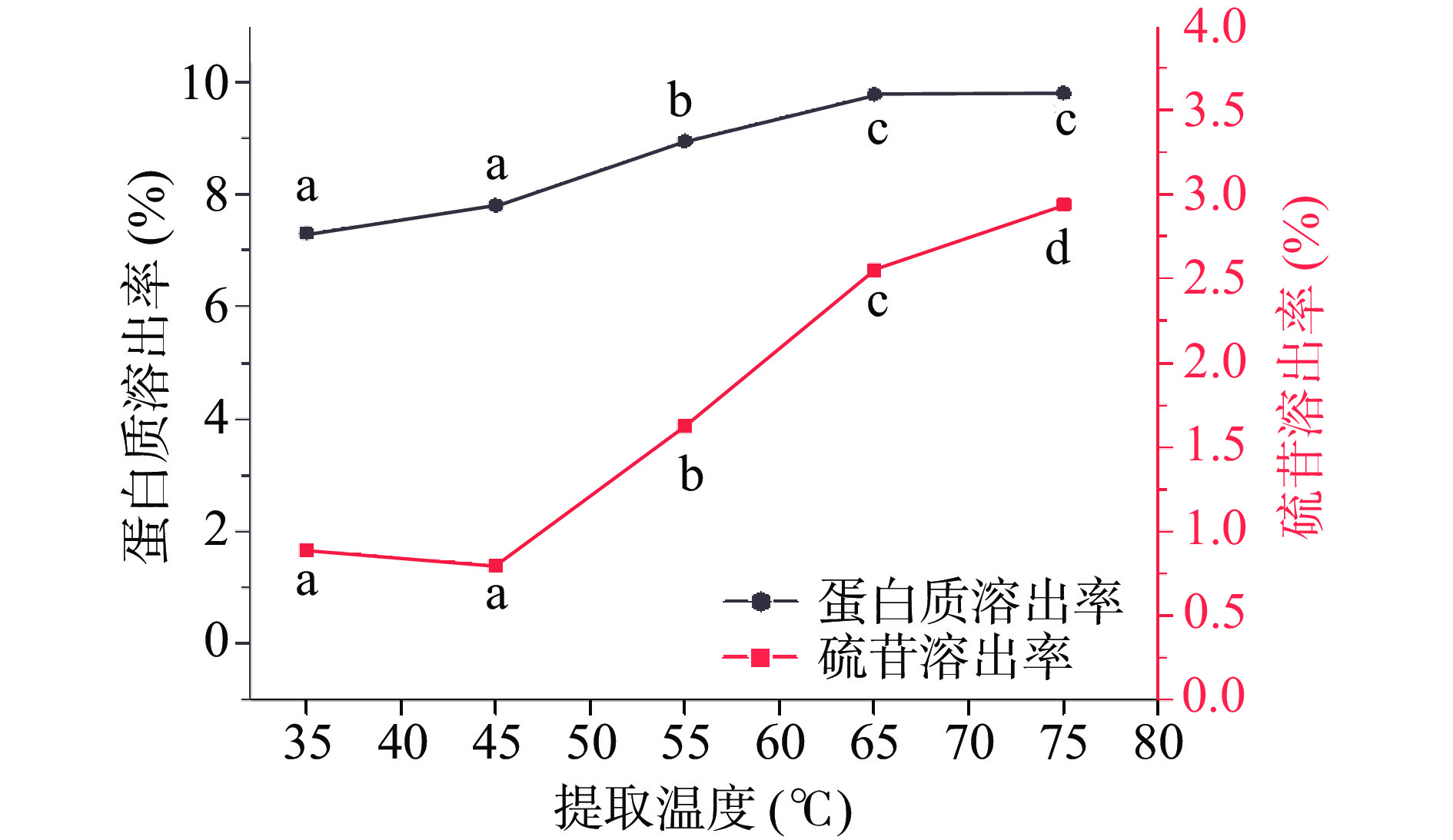
图3显示,碱溶浸提温度的提高有利于饼粕中蛋白质和硫苷的溶出,且对硫苷溶出的影响较大。其中,当浸提温度升高至65、75 ℃时蛋白质溶出率分别为(9.77%±0.01%)、(9.80%±0.01%),虽略有提高但已无显著性差异(P>0.05),而硫苷的溶出率则显著增加(P<0.05)。浸提温度有利于蛋白质溶出的这一现象与罗群等[20]的研究一致,但与FETZER等[17]研究发现的常温更有利于蛋白质溶出的现象有出入,这可能与实验中菜籽饼粕的制备方式有关。本实验基于最大化提高蛋白质提取效率的同时降低硫苷溶出的原则,优选55 ℃进行料液比单因素实验优选。
2.1.4 料液比对碱溶液中蛋白质和硫苷溶出率的影响
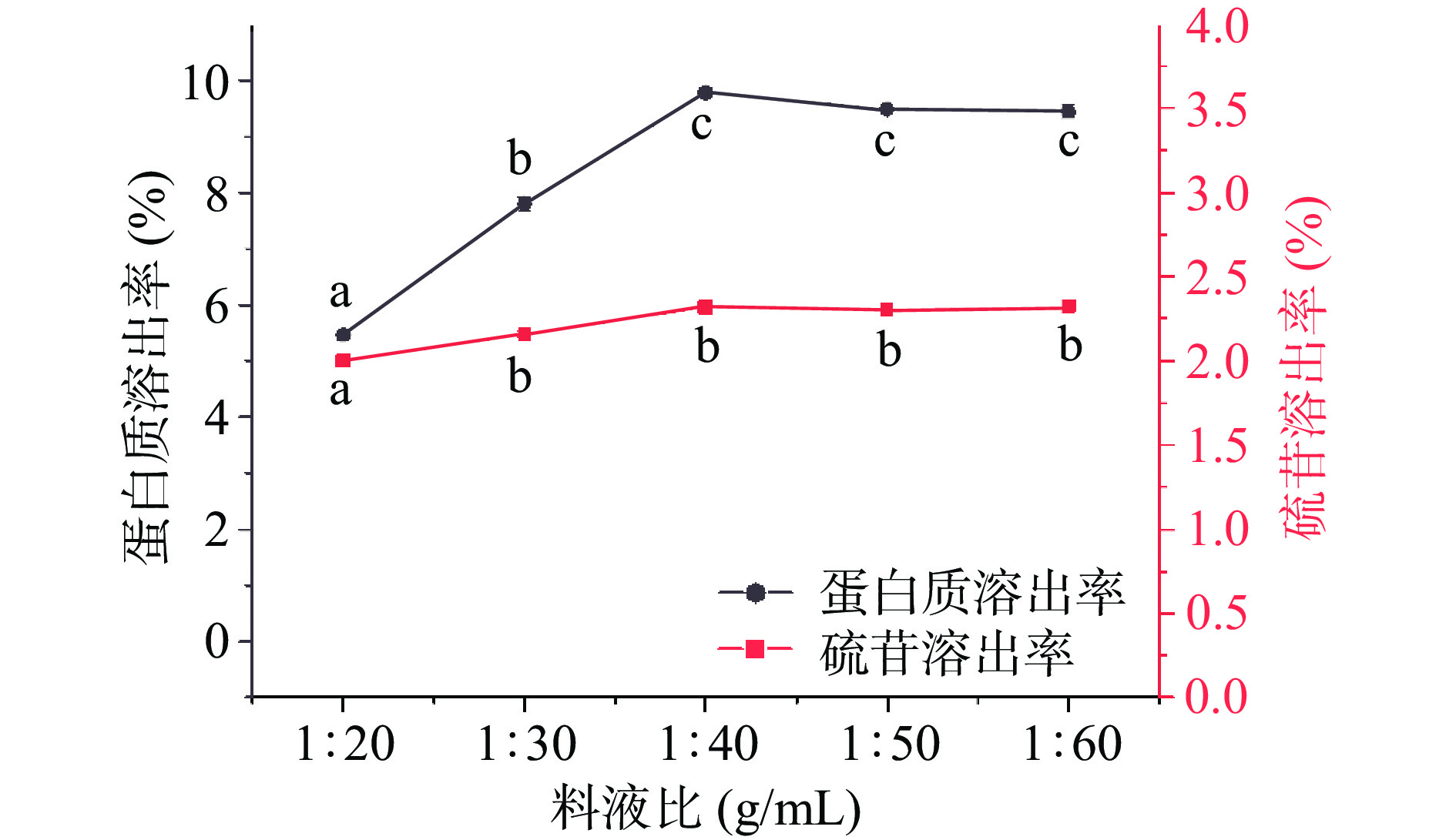
增大物料与溶剂的接触面积一定程度上有利于目标物质提取效率的提高。以往研究通常选用1:5~1:20的料液比(g/mL)进行研究,并发现料液比并不会显著提高蛋白质的提取效率[21,17],基于此,本研究以1:20为料液比起始值,料液比对菜籽饼粕碱溶条件下蛋白质和硫苷溶出率的影响如图4所示:当料液比在1:20~1:40 g/mL范围内时,随着料液比的增加,碱溶液中蛋白质的溶出率逐步增大并在1:40 g/mL达到最大(9.77%±0.01%),相比较而言,硫苷的溶出率受料液比的影响较小,整体趋势相对平缓;当料液比>1:40 g/mL后,料液比的增加对蛋白质和硫苷的溶出均无明显影响。综合实际生产节水,优选1:40 g/mL的料液比。
2.2 菜籽饼粕蛋白碱溶条件响应面试验结果分析
2.2.1 响应面试验设计与结果
在单因素实验结果的基础上确定料液比为1:40 g/mL,以pH(X1)、浸提时间(X2)和浸提温度(X3)3因素为自变量,以蛋白质溶出率为响应值(Y1)、硫苷溶出率为响应值(Y2),采用响应面法进行三因素三水平的试验设计,共包括17组试验方案。试验方案及结果见表2。
表 2 响应面试验设计与结果Table 2. Design and results of response surface experiment试验号 X1 pH X2 浸提时
间X3 浸提温
度Y1 蛋白质溶出
率 (%)Y2 硫苷溶出率
(%)1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17−1
1
0
−1
−1
1
0
0
0
0
1
−1
0
1
0
0
0−1
0
−1
0
0
−1
0
0
0
1
0
1
−1
1
0
0
10
−1
1
1
−1
0
0
0
0
1
1
0
−1
0
0
0
−14.59
9.32
8.44
5.26
3.67
9.46
8.17
8.09
8.28
8.90
9.54
5.08
7.24
9.54
8.24
8.14
7.983.46
3.03
2.14
3.81
3.38
3.22
1.79
1.67
1.84
2.39
3.56
3.78
1.29
3.45
1.75
1.68
1.522.2.2 模型建立与方差分析
利用Design Expert 8.0.6软件对结果进行方差分析(见表3,表4),对拟合回归方程进行方差分析和显著性检验,将数据进行多元回归拟合,得到蛋白质溶出率(Y1)与pH(X1)、浸提时间(X2)和浸提温度(X3)的二次响应面回归方程为:
表 3 蛋白质溶出率回归方程的方差分析Table 3. Analysis of variance for protein yield’s regression equation来源 平方和 自由度 均方 F值 P值 显著性 模型 54.46 9 6.05 326.63 <0.0001 ** X1 46.31 1 46.31 2499.55 <0.0001 ** X2 0.40 1 0.40 21.54 0.0024 ** X3 1.93 1 1.93 104.42 < 0.0001 ** X1X2 0.043 1 0.043 2.32 0.1715 X1X3 0.46 1 0.46 24.88 0.0016 ** X2X3 0.020 1 0.020 1.10 0.3299 X12 5.14 1 5.14 277.49 < 0.0001 ** X22 0.031 1 0.031 1.67 0.2377 X32 0.074 1 0.074 4.00 0.0855 残差 0.13 7 0.019 失拟项 0.11 3 0.036 6.56 0.0504 不显著 R2=0.9976 R2adj=0.9946 CV=1.78% 注:“*”表示差异显著(P<0.05);“**”表示差异极显著(P<0.01);表4同。 表 4 硫苷溶出率回归方程的方差分析Table 4. Analysis of variance for glucosinolate content’s regression equation来源 平方和 自由度 均方 F值 P值 显著性 模型 13.09 9 1.45 107.71 < 0.0001 ** X1 0.18 1 0.18 12.99 0.0087 ** X2 0.14 1 0.14 10.01 0.0158 * X3 0.89 1 0.89 65.78 < 0.0001 ** X1X2 1.845E-003 1 1.845E-003 0.14 0.7226 X1X3 2.545E-003 1 2.545E-003 0.19 0.6773 X2X3 3.296E-004 1 3.296E-004 0.024 0.8803 X12 11.72 1 11.72 868.33 < 0.0001 ** X22 0.016 1 0.016 1.19 0.3110 X32 3.456E-003 1 3.456E-003 0.26 0.6284 残差 0.095 7 0.014 失拟项 0.073 3 0.024 4.57 0.0882 不显著 R2=0.9928 R2adj=0.9836 CV=4.51% Y1=8.19+2.41X1+0.22X2+0.49X3−0.10X1X2−0.34X1X3−0.071X2X3−1.10X12+0.086X22−0.13X32
硫苷溶出率(Y2)与pH(X1)、浸提时间(X2)和浸提温度(X3)的二次响应面回归方程为:
Y2=1.75−0.15X1+0.13X2+0.33X3−0.021X1X2+0.025X1X3+0.00907X2X3+1.67X12+0.062X22+ 0.029X32
由表3、表4可知,两模型的P值均<0.0001,表明模型拟合效果显著,能很好地反映变量与响应变量之间的关系;两回归模型的失拟项分别为0.0504、0.0882,即失拟不显著, 并且多元决定系数分别为R2=0.9976、R2=0.9928,拟合效果较好。另外,回归方程一次项系数绝对值的大小,决定了各因素对响应值影响的主次顺序,可看出,浸提pH是影响菜籽饼粕碱溶蛋白质溶出的关键因素(P<0.0001),其次浸提时间(P=0.0024)与温度(P<0.0001);就硫苷溶出率而言,各因素的影响大小为浸提温度(P<0.0001)>浸提pH(P=0.0087)>浸提时间(P=0.0158)。
2.2.3 响应面分析
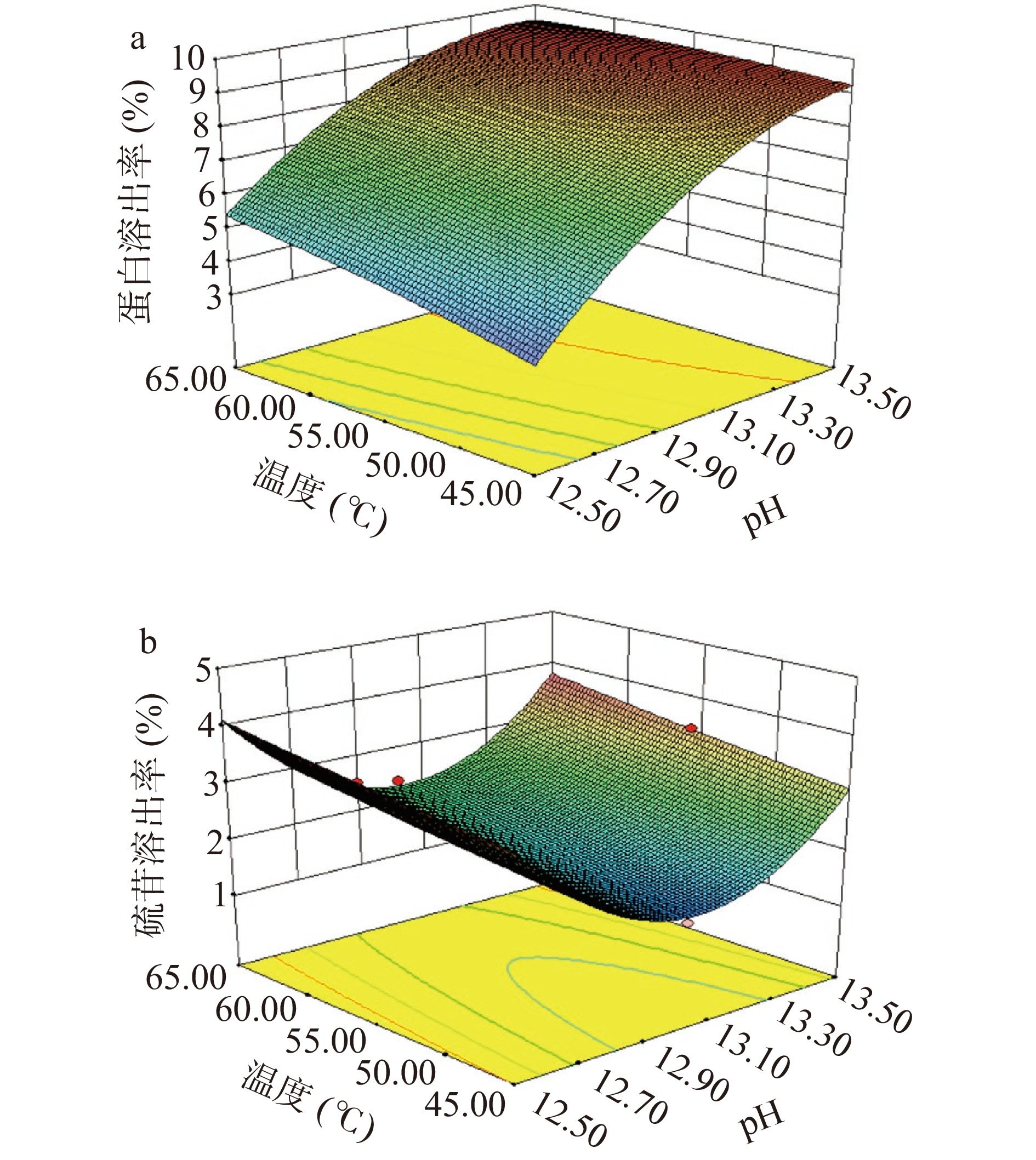
在模型分析的基础上,图5展示了交互因素对菜籽粕蛋白质碱溶浸提工艺的影响效果,结合拟合方程,碱性条件下的蛋白质与硫苷溶出率均受浸提pH与浸提温度的交互影响较大,其中,浸提pH与浸提温度的交互作用可显著影响蛋白质的溶出效果(P=0.0016)。以蛋白质溶出率最大且硫苷溶出率最低,分析优化得到脱脂菜籽饼粕蛋白质碱溶优化的提取条件为pH13.16,浸提时间82.07 min,浸提温度45.71 ℃,该条件下理论蛋白质溶出率为8.42%、硫苷溶出率为1.60%。经修正确定最终工艺参数为pH13.1,浸提时间82 min,浸提温度46 ℃,液料比1:40 g/mL,此条件下进行3次平行试验,得到蛋白质溶出率平均值为8.78%、硫苷溶出率平均值为1.65%,与理论值相比,实验值和预测值具有良好的相关性,说明该响应面模型和最优化条件是有效的。
2.3 菜籽饼粕蛋白酸沉最优条件
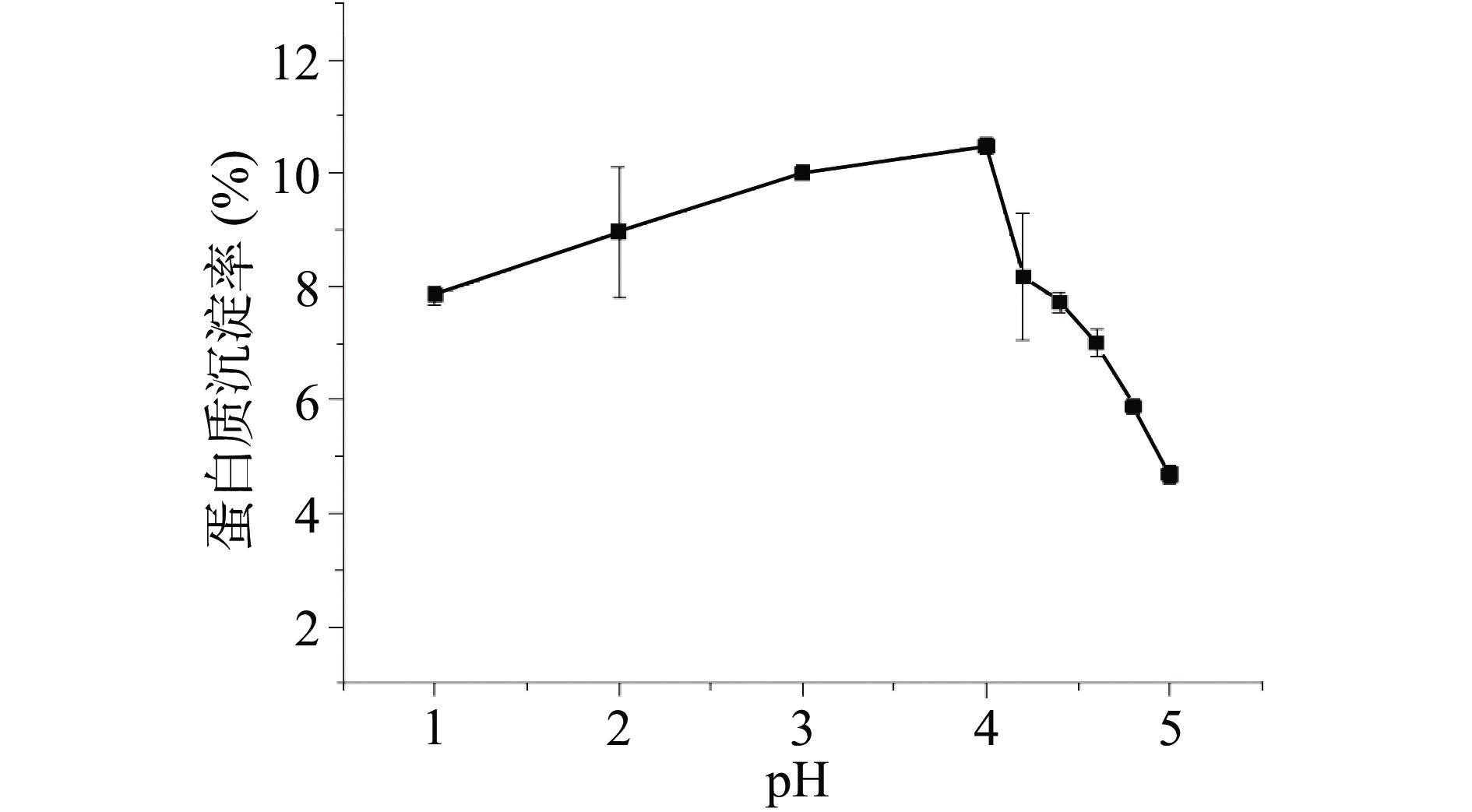
菜籽蛋白等电点宽泛,约为3~9[22],碱溶酸沉工艺中酸沉条件的选择会直接影响蛋白的回收率及其物化性质[2,23],前期有研究发现菜籽蛋白在pH4.5~5.5间回收率最高[23],AKBARI等[24]则表明pH4.0酸沉条件下获得的蛋白质与pH4.5酸沉条件下的蛋白质纯度更高。本实验在碱溶工艺条件优化的基础上,以酸沉蛋白得率最高为指标,对菜籽粕蛋白的最佳酸沉条件(pH条件设置1、2、3、4、4.2、4.4、4.6、4.8、5)进行筛选,结果如图6所示,碱溶液中的蛋白质的沉淀率在pH1~5的范围内随着pH的增大呈现先增大后减小的趋势,并在pH4时酸沉条件下沉淀率最大,约为10.48%,该变化趋势与ZHANG等的[9]研究结果相一致,这主要与菜籽蛋白的各组成成分不同的等电点值相关。
2.4 菜籽饼粕蛋白提取物SDS-PAGE分析
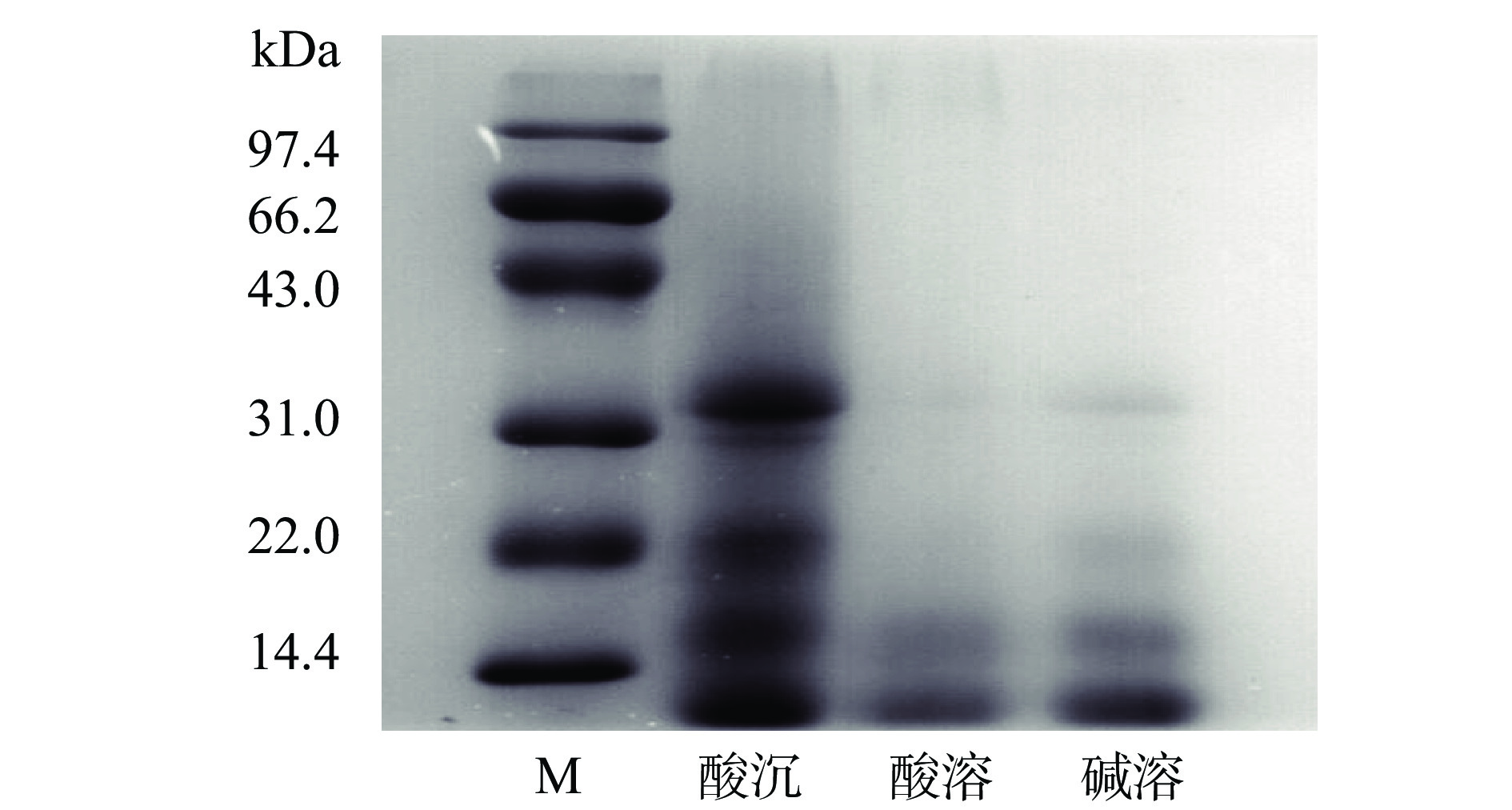
图7为菜籽饼粕碱溶液、菜籽饼粕酸沉蛋白和菜籽饼粕酸溶蛋白提取物的SDS-PAGE图。前期研究表明,菜籽蛋白主要包含有11/12S球蛋白,该蛋白可降解为6个亚基,每个亚基由α-(约30~40 kDa)和β-(约20 kDa)两条多肽链以二硫键链接组成;以及N1.7/2S白蛋白,其由两条不同分子量(10~12 kDa与3~6 kDa)的肽链组成[25-26]。从图7可以看出,碱溶液样品中的蛋白条带主要集中分布<41 kDa以下,其中,低分子量蛋白相对较多,这与其蛋白含量及一定程度的水解有关[27]。对比分析酸沉蛋白与酸溶蛋白提取物中的蛋白条带可发现,酸沉蛋白的条带在31 、14~22 及<14.4 kDa间均有分布,即含有一定的球蛋白及白蛋白,表示蛋白种类及水解物相对较多;相比而言,酸溶蛋白提取物则主要为白蛋白(14.4 kDa)及小分子水解物[28]。进一步分析,菜籽饼粕酸沉蛋白与酸溶蛋白提取物中的粗蛋白含量分别为(78.10%±0.53%)、(15.25%±0.17%)。
2.5 菜籽饼粕蛋白提取物的活性
2.5.1 菜籽饼粕蛋白清除ABTS自由基的活性
菜籽蛋白及其水解物已被报道具有一定的生物活性,如增强免疫、抗氧化活性及抑菌等[1]。实验选取ABTS阳离子自由基为对象,对菜籽饼粕蛋白提取物的体外抗氧化活性进行了测定,结果表明同等粗蛋白含量的菜籽粕酸溶蛋白提取物其自由基清除率与酸沉蛋白相比更高,两者的EC50值分别为0.438、1.372 mg/mL(如图8所示),推测一是主要与两者的蛋白组成种类有关,其中,酸溶蛋白中多为分子量较小的白蛋白与其蛋白质水解物,在自由基体系中暴露的疏水性基团较多,更易与ABTS接触发生氢原子转移[4,29];二是可能与提取物中其他组分如多糖等有关。
2.5.2 菜籽饼粕蛋白的抑菌能力
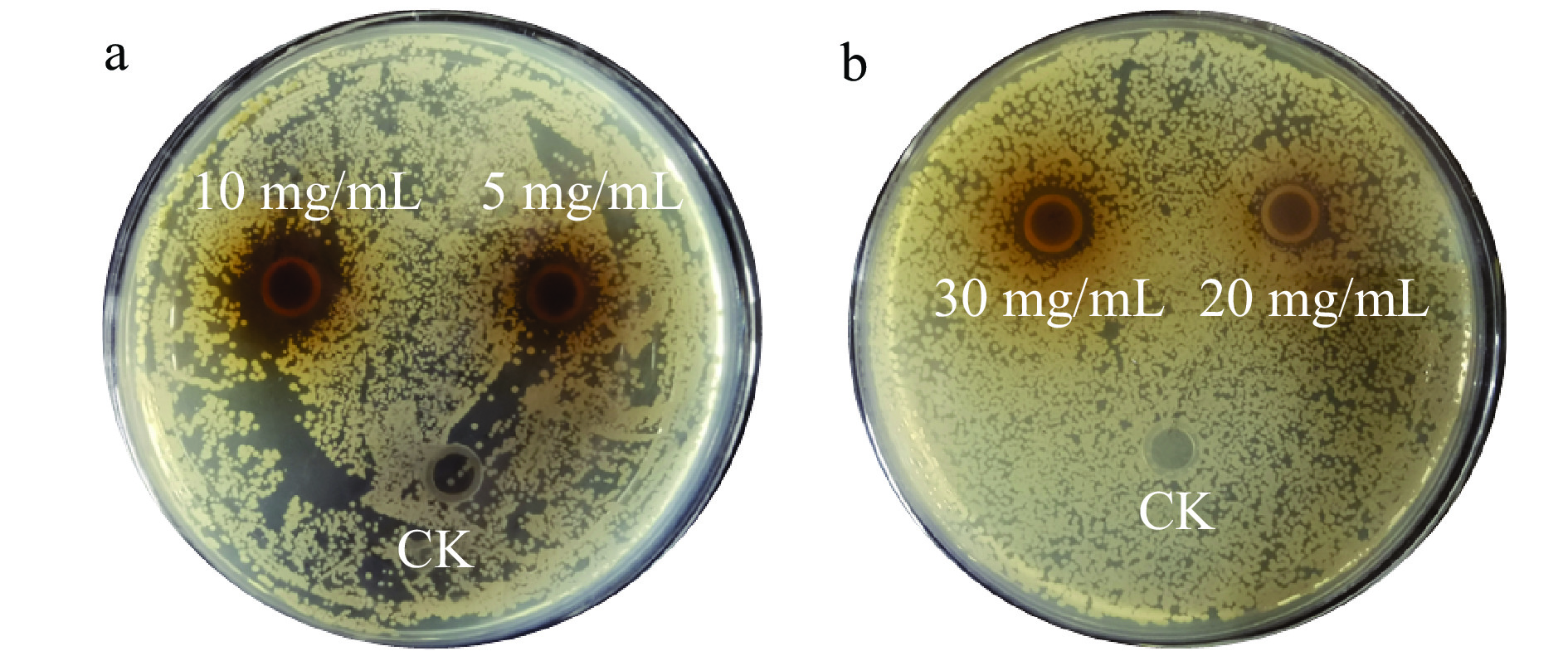
进一步对两种蛋白提取物的抑菌性进行了分析,其中,两者均表现出一定的抑制金黄色葡萄球菌生长的能力(图9),且酸沉淀蛋白发挥作用的浓度低于酸溶蛋白提取物,即酸沉蛋白具有较强的抑制金黄色葡萄球菌生长的能力,如图9a所示,10 mg/mL与5 mg/mL酸沉蛋白的抑菌圈直径分别约为15.23 mm与11.02 mm,这与DUAN等[30]发现菜籽球蛋白与菜籽白蛋白相比更易获得抗菌肽相一致;此外,两者对大肠杆菌及黄青霉的生长几乎无抑制能力。
3. 结论
菜籽饼粕富含蛋白质,本文对菜籽饼粕蛋白的碱溶酸沉工艺进行了系统优化,结果表明:菜籽饼粕经脱脂处理后,在pH13.1的条件下以1:40 g/mL的料液比、46 ℃条件下浸提82 min后,其蛋白质溶出率可达8.78%且硫苷溶出率相对较低为1.65%;进一步,调节菜籽饼粕蛋白碱提取液的pH至4.0,冷冻离心后,分别对其沉淀物及上清液进行冻干和喷雾干燥处理,可得到菜籽饼粕酸沉蛋白与酸溶蛋白提取物,SDS-PAGE结果显示:酸沉蛋白分子量在31、14~22及<14.4 kDa间均有分布,主要为菜籽球蛋白;菜籽饼粕酸溶蛋白提取物的分子量主要分布在<14.4 kDa左右,主要为菜籽白蛋白;且两种不同提取物的粗蛋白含量分别为(78.10%±0.53%)与(15.25%±0.17%)。此外,两者都表现出了一定的体外ABTS自由基清除及抑制金黄色葡萄球菌生长的能力。本实验为菜籽饼粕蛋白的开发利用提供了一定的理论支撑,进一步可对菜籽饼粕蛋白提取物的结构及其加工特性进行研究。
-
表 1 响应面试验设计因素与水平
Table 1 Factors and levels of Box-Behnken design
水平 因素 X1:pH X2:时间(min) X3:温度(℃) −1 12.5 60 45 0 13 80 55 1 13.5 100 65 表 2 响应面试验设计与结果
Table 2 Design and results of response surface experiment
试验号 X1 pH X2 浸提时
间X3 浸提温
度Y1 蛋白质溶出
率 (%)Y2 硫苷溶出率
(%)1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17−1
1
0
−1
−1
1
0
0
0
0
1
−1
0
1
0
0
0−1
0
−1
0
0
−1
0
0
0
1
0
1
−1
1
0
0
10
−1
1
1
−1
0
0
0
0
1
1
0
−1
0
0
0
−14.59
9.32
8.44
5.26
3.67
9.46
8.17
8.09
8.28
8.90
9.54
5.08
7.24
9.54
8.24
8.14
7.983.46
3.03
2.14
3.81
3.38
3.22
1.79
1.67
1.84
2.39
3.56
3.78
1.29
3.45
1.75
1.68
1.52表 3 蛋白质溶出率回归方程的方差分析
Table 3 Analysis of variance for protein yield’s regression equation
来源 平方和 自由度 均方 F值 P值 显著性 模型 54.46 9 6.05 326.63 <0.0001 ** X1 46.31 1 46.31 2499.55 <0.0001 ** X2 0.40 1 0.40 21.54 0.0024 ** X3 1.93 1 1.93 104.42 < 0.0001 ** X1X2 0.043 1 0.043 2.32 0.1715 X1X3 0.46 1 0.46 24.88 0.0016 ** X2X3 0.020 1 0.020 1.10 0.3299 X12 5.14 1 5.14 277.49 < 0.0001 ** X22 0.031 1 0.031 1.67 0.2377 X32 0.074 1 0.074 4.00 0.0855 残差 0.13 7 0.019 失拟项 0.11 3 0.036 6.56 0.0504 不显著 R2=0.9976 R2adj=0.9946 CV=1.78% 注:“*”表示差异显著(P<0.05);“**”表示差异极显著(P<0.01);表4同。 表 4 硫苷溶出率回归方程的方差分析
Table 4 Analysis of variance for glucosinolate content’s regression equation
来源 平方和 自由度 均方 F值 P值 显著性 模型 13.09 9 1.45 107.71 < 0.0001 ** X1 0.18 1 0.18 12.99 0.0087 ** X2 0.14 1 0.14 10.01 0.0158 * X3 0.89 1 0.89 65.78 < 0.0001 ** X1X2 1.845E-003 1 1.845E-003 0.14 0.7226 X1X3 2.545E-003 1 2.545E-003 0.19 0.6773 X2X3 3.296E-004 1 3.296E-004 0.024 0.8803 X12 11.72 1 11.72 868.33 < 0.0001 ** X22 0.016 1 0.016 1.19 0.3110 X32 3.456E-003 1 3.456E-003 0.26 0.6284 残差 0.095 7 0.014 失拟项 0.073 3 0.024 4.57 0.0882 不显著 R2=0.9928 R2adj=0.9836 CV=4.51% -
[1] CHMIELEWSKA A, KOZOWSKA M, RACHWA D, et al. Canola/rapeseed protein-nutritional value, functionality and food application: A review[J]. Critical Reviews in Food Science and Nutrition,2020(77):1−21.
[2] 翟晓娜, 师建芳, 赵慧凝, 等. 菜籽饼粕蛋白的提取、功能特性及其在食品中应用的研究进展[J]. 食品工业科技,2021,42(12):389−397. [ZHAI Xiaona, SHI Jianfang, ZHAO Huining, et al. Extraction, functional properties and food applications of rapeseed meal protein isolates[J]. Science and Technology of Food Industry,2021,42(12):389−397. [3] RAHMAN M, BROWNE J J, CRU GTR N J V, et al. In silico, molecular docking and in vitro antimicrobial activity of the major rapeseed seed storage proteins[J]. Frontiers in Pharmacology,2020,11:1−23. doi: 10.3389/fphar.2020.00001
[4] WONG F C, XIAO J B, WANG S Y, et al. Advances on the antioxidant peptides from edible plant sources[J]. Trends in Food Science & Technology,2020,99:44−57.
[5] WANASUNDARA J P D, MCINTOSH T C, PERERA S P, et al. Canola/rapeseed protein-functionality and nutrition[J]. Oilseeds & Fats Crops and Lipids,2016,23(4):D407.
[6] NADATHUR S R, WANASUNDARA J P D, SCANLIN L. Sustainable protein sources[M]. London: Academic Press, 2016: 285−304.
[7] SARI Y W, BRUINS M E, SANDERS J P M. Enzyme assisted protein extraction from rapeseed, soybean, and microalgae meals[J]. Industrial Crops & Products,2013,43:78−83.
[8] KDIDIA S, VACA-MEDINA G, PEYDECASTAING J, et al. Electrostatic separation for sustainable production of rapeseed oil cake protein concentrate: Effect of mechanical disruption on protein and lignocellulosic fiber separation[J]. Powder Technology,2019,344:10−16. doi: 10.1016/j.powtec.2018.11.107
[9] ZHANG Z Y, HE S D, LIU H Y, et al. Effect of pH regulation on the components and functional properties of proteins isolated from cold-pressed rapeseed meal through alkaline extraction and acid precipitation[J]. Food Chemistry,2020,327:126998. doi: 10.1016/j.foodchem.2020.126998
[10] 罗群. 考马斯亮蓝法快速测定菜籽粕中可溶性蛋白质的含量[J]. 成都大学学报(自然科学版),2014,33(2):125−126. [LUO Qun. Rapid determination of soluble protein content in rapeseed meal by Coomassie brilliant blue method[J]. Journal of Chengdu University (Natural Science Edition),2014,33(2):125−126. [11] 王宁惠. 油菜籽(饼粕)中硫代葡萄糖甙总量速测方法-氯化钯法[J]. 青海农林科技,2009(3):58−59. [WANG Ninghui. A quantitative analysis method of glucosinolates in rapeseed meal[J]. Science and Technology of Qinghai Agriculture and Forestry,2009(3):58−59. [12] 赵冬吉. 西兰花无麸质海绵蛋糕制备及其抗氧化性研究[J]. 食品研究与开发,2019,40(5):162−167. [ZHAO Dongji. Preparation and antioxidant activities of broccoli gluten-free sponge cake[J]. Food Research and Development,2019,40(5):162−167. doi: 10.3969/j.issn.1005-6521.2019.05.029 [13] FETZER A, HERGELLNER T, EISNER P. Rapeseed protein concentrates for non-food applications prepared from pre-pressed and cold-pressed press cake via acidic precipitation and ultrafiltration[J]. Industrial Crops & Products,2019,132:396−406.
[14] WANG Z G, ZHANG C, ZHANG T, et al. Effects of acylation and glycation treatments on physicochemical and gelation properties of rapeseed protein isolate[J]. RSC Advances,2018,8(70):40395−40406. doi: 10.1039/C8RA07912A
[15] 汪涛, 梁亮, 李旭锐, 等. 低共熔溶剂提取核桃青皮多酚工艺优化及其抑菌活性[J]. 农业工程学报,2021,37(5):317−323. [WANG Tao, LIANG Liang, LI Xurui, et al. Optimization of the technology for deep eutectic solvents extraction and antibacterial of walnut green husk polyphenols[J]. Transactions of the Chinese Society of Agricultural Engineering,2021,37(5):317−323. doi: 10.11975/j.issn.1002-6819.2021.05.037 [16] TZENG Y M, DISOSADY L L, RUBINL J. Production of canola protein materials by alkaline extraction, precipitation, and membrane processing[J]. Journal of Food Science,1990,55(4):1147−1151. doi: 10.1111/j.1365-2621.1990.tb01619.x
[17] FETZER A, HERFELLNER T, STÄBLER A, et al. Influence of process conditions during aqueous protein extraction upon yield from pre-pressed and cold-pressed rapeseed press cake[J]. Industrial Crops and Products,2018,112:236−246. doi: 10.1016/j.indcrop.2017.12.011
[18] TAN S H, MAILER R J, BLANCHARD C L, et al. Extraction and characterization of protein fractions from Australian canola meals[J]. Food Research International,2011,44(4):1075−1082. doi: 10.1016/j.foodres.2011.03.023
[19] ÖSTBRING K, TULLERG C, BURRI S, et al. Protein recovery from rapeseed press cake: Varietal and processing condition effects on yield, emulsifying capacity and antioxidant activity of the protein rich extract.[J]. Foods (Basel, Switzerland),2019,8(12):627.
[20] 罗群, 张宏. 菜籽蛋白提取工艺的优化及其对DPPH自由基的清除作用[J]. 北方园艺,2014(14):136−139. [LUO Qun, ZHANG Hong. Optimization of protein extraction process and scavenging function of DPPH radical from rapeseed meal[J]. Northern Horticulture,2014(14):136−139. [21] GERZHOVA A, MONDOR M, BENALI M, et al. Study of total dry matter and protein extraction from canola meal as affected by the pH, salt addition and use of zeta-potential/turbidimetry analysis to optimize the extraction conditions[J]. Food Chemistry,2016,201(15):243−252.
[22] WANASUNDARA J P D, ABETSEKARA S J, MCINTOSH T C, et al. Solubility differences of major storage proteins of Brassicaceae oilseeds[J]. Journal of the American Oil Chemists Society,2012,89(5):869−881. doi: 10.1007/s11746-011-1975-9
[23] GHODSVAI A, KHODAPARAST M H H, VOSOUGHI M, et al. Preparation of canola protein materials using membrane technology and evaluation of meals functional properties[J]. Food Research International,2005,38(2):223−231. doi: 10.1016/j.foodres.2004.10.007
[24] AKBARI A, WU J P. An integrated method of isolating napin and cruciferin from defatted canola meal[J]. LWT-Food Science and Technology,2015,64(1):308−315. doi: 10.1016/j.lwt.2015.05.046
[25] MORGANE C, JENNIFER R, CARRÉ P, et al. Value of hydroalcoholic treatment of rapeseed for oil extraction and protein enrichment[J]. Oilseeds & Fats Crops and Lipids, 2018, 26 (1).
[26] QU W, ZHANG X, HAN X, et al. Structure and functional characteristics of rapeseed protein isolate-dextran conjugates[J]. Food Hydrocolloids,2018,82:329−337. doi: 10.1016/j.foodhyd.2018.03.039
[27] KASPRZAK M M, HOUDIJK J G M, LIDDELL S, et al. Rapeseed napin and cruciferin are readily digested by poultry[J]. Journal of Animal Physiology & Animal Nutrition,2017,101(4):658−666.
[28] DANIELA V D H, MÜLLER K, BAFER-MITTERMAIER S, et al. Rapeseed proteins–production methods and possible application ranges[J]. OCL,2014,21(1):D104. doi: 10.1051/ocl/2013038
[29] 张文敏, 张健, 周浩纯, 等. 亚麻籽粕制备小分子抗氧化活性肽[J]. 食品科学,2020(8):36−44. [ZHANG Wenmin, ZHANG Jian, ZHOU Haochun, et al. Preparation of small molecular antioxidant peptides from flaxseed meal[J]. Food Science,2020(8):36−44. doi: 10.7506/spkx1002-6630-20181130-356 [30] DUAN X J, ZHANG M, CHEN F S. Prediction and analysis of antimicrobial peptides from rapeseed protein using in silico approach[J]. Journal of Food Biochemistry,2021(9):e13598.






 下载:
下载:
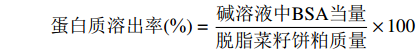
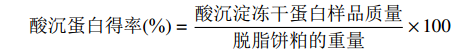
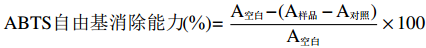

 下载:
下载:
