Antioxidant, Hypoglycemic Activities and Inhibitory Effect on Tyrosinase of Ethanol Extracts of Different Parts from Psidium guajava L.
-
摘要: 目的:比较研究番石榴不同部位(根、茎、叶、果实)乙醇提取物抗氧化、降血糖和抑制酪氨酸酶活性。方法:分别采用ABTS法和DPPH法、pNPG法和DNS法、L-DOPA法评价番石榴不同部位抗氧化活性、降血糖活性和酪氨酸酶抑制活性。结果:番石榴不同部位乙醇提取物均具有一定的体外抗氧化、降血糖和酪氨酸酶抑制活性,并呈现一定的量效关系。番石榴各部位中,番石榴根乙醇提取物的抗氧化、降血糖和抑制酪氨酸酶活性均强于其他部位。番石榴根对DPPH、ABTS+自由基清除能力与维生素C接近,清除能力IC50值分别为:(8.45±0.12)、(0.09±0.002) mg/mL,且其对α-淀粉酶和酵母菌来源α-葡萄糖苷酶的抑制活性强于阿卡波糖,抑制活性的IC50值分别为:(0.10±0.02)、(8.74±0.25) μg/mL;而对小鼠小肠来源α-葡萄糖苷酶的抑制活性弱于阿卡波糖;对酪氨酸酶抑制活性弱于维生素C。结论:番石榴根乙醇提取物的抗氧化、降血糖和酪氨酸酶抑制活性最强,表明番石榴根是潜在抗氧化剂和α-葡萄糖苷酶、α-淀粉酶和酪氨酸酶抑制剂的来源。Abstract: Objective: The antioxidant, hypoglycemic and tyrosinase inhibitory activities of ethanol extracts of different parts (root, stem, leave and fruit) from Psidium guajava L. were compared. Methods: The free radical scavenging were determined by DPPH and ABTS method. The hypoglycemic activities were determined by pNPG and DNS method. The inhibition of tyrosinase activity was determined by L-DOPA method. Results: The ethanol extracts of different parts from Psidium guajava L. had certain antioxidant, hypoglycemic activities and inhibitory effect on tyrosinase, and there were dose effect relationship. The ethanol extracts of the root from Psidium guajava L. had the strongest activity, and its free radical scavenging of ABTS+ and DPPH was close to VC, its IC50 values of the scavenging ability of ABTS+ and DPPH free radicals were (8.45±0.12), (0.09±0.002) mg/mL, and its inhibitory strength on yeast α-glucosidase and α-amylase was higher than that of positive control acarbose. And its IC50 values of the inhibitory activity on α-amylase and yeast α-glucosidase were: (0.10±0.02), (8.74±0.25) μg/mL, and the inhibitory activity of tyrosinase was weaker than VC. Conclusion: The ethanol extract of the root from Psidium guajava L. had the highest antioxidant, hypoglycemic activities and inhibitory effect on tyrosinase, which suggested that the root from Psidium guajava L. is a potential inhibitors resource of antioxidant, α-glucosidase, α-amylase and tyrosinase.
-
Keywords:
- Psidium guajava L. /
- antioxidant /
- hypoglycemic activities /
- tyrosinase
-
番石榴(Psidum guajava L.)为桃金娘科(Myrtaceae)番石榴属(Psidium )植物,又名鸡屎果、番桃等,在我国主要分布于广东、广西及福建等地[1]。番石榴各部位均可入药,根具收敛止涩、止痛敛疮功效,主治泻痢、脘腹疼痛、糖尿病;茎具收涩、止泻功效,主治湿毒、泻痢;叶具燥湿健脾、清热解毒功效,主治食积腹胀、湿疹;果实具健脾消积、涩肠止泻功效,主治疳积、痢疾[2]。现代研究表明番石榴富含黄酮、三萜、鞣质等活性成分[3-6],其果实、叶具有降糖降脂、抗肿瘤、抗氧化、抗菌等功效[7-10],但目前对番石榴的根和茎部位的研究较少,特别是番石榴不同部位在生物活性方面的比较研究未见报道。
据IDF(International Diabetes Federation,国际糖尿病联盟)和IARC(International Agency for Research on Cancer,世界卫生组织国际癌症研究机构)最新数据显示,中国糖尿病和肿瘤患者居世界首位,并呈逐年递增趋势[11-12]。在皮肤肿瘤类型中,黑色素瘤死亡率最高,中国每年新增黑色素瘤患者8000例以上[13]。α-葡萄糖苷酶位于小肠刷状缘,属于糖苷水解酶家族,催化双糖及寡糖水解为葡萄糖等单糖以利吸收,为控制餐后血糖的关键靶标。α-葡萄糖苷酶抑制剂被我国糖尿病防治指南推荐为一线药物,目前在临床运用于治疗2型糖尿病的α-葡萄糖苷酶抑制剂主要为阿卡波糖,但其对肠道中的α-淀粉酶的过度抑制导致腹胀、腹泄等副作用[14]。酪氨酸酶为黑色素代谢酶,在黑色素形成过程中发挥着至关重要的限速作用,但曲酸等酪氨酸酶抑制剂因易导致皮炎和皮肤癌已被禁止使用[15]。研究表明,黑色素瘤和糖尿病的发生发展过程与机体自由基的失衡有关,维持机体自由基产生与猝灭的平衡可一定程度预防糖尿病及黑色素瘤的形成[16-18]。因此,探索更安全有效的集抗氧化、α-葡萄糖苷酶和酪氨酸酶抑制多功效于一体的药物,有望补充或替代现有药物达到防治糖尿病和黑色素瘤的效果。中草药具有多成分、多靶点协调作用的特点,在针对多因素引起的疾病方面具有一定的优势,从中草药挖掘高效低毒的糖尿病和肿瘤治疗药物是创新药物研发的重点之一。
为全面比较番石榴不同部位在降血糖、抗氧化、抑制酪氨酸酶活性的作用差异,本研究以番石榴的根、茎、叶、果实4个部位的乙醇提取物为研究对象,对其体外α-葡萄糖苷酶、α-淀粉酶、酪氨酸酶抑制活性、体外抗氧化活性进行评价,为扩大番石榴药用部位及其资源的综合利用提供科学的依据,为番石榴在美白和降糖等功能性食品开发的部位选择提供实验基础。
1. 材料与方法
1.1 材料与仪器
番石榴的干燥根、茎、叶、成熟果实 于2018年采自广东省湛江市徐闻县,经嘉应学院医学院客家药用生物资源研究所张声源副教授鉴定为桃金娘科番石榴属植物番石榴(Psidum guajava L.)的根、茎、叶和果实,标本(20180612)现存于嘉应学院医学院客家药用生物资源研究所;α-淀粉酶(A3176-500kU)、α-葡萄糖苷酶(G5003-100U) Sigma公司;酪氨酸酶(T828256-25 kU) 上海麦克林生化科技有限公司;对硝基苯酚(pNP)、对-硝基苯基-α-D-吡喃葡萄糖苷(pNPG) 上海源叶科技有限公司;阿卡波糖 德国拜耳公司;3,5-二硝基水杨酸(DNS) 国药集团化学试剂有限公司;2,2-联氮基-双-(3-乙基苯并噻唑啉-6-磺)二氨盐(ABTS)、1,1-二苯基-2-三硝基苯肼(DPPH)、维生素C(Vit C)、亚硝酸钠 上海阿拉丁生化科技股份有限公司;乙腈、甲醇 色谱纯,Fisher Scientific 公司。
Alliance 2695型高效液相色谱仪、XBridge Peptide BEH C18色谱柱(250 mm× 4.6 mm,5 μm) 沃特世科技(上海)有限公司;UV-1800型紫外-可见分光光度计 日本岛津公司;SPARK型酶标仪 TECAN;PB-21型酸度计 北京赛多利斯科学仪器有限公司。
1.2 实验方法
1.2.1 番石榴不同部位乙醇提取物的制备
番石榴根、茎、叶、成熟果实分别于60 ℃烘干,粉碎,过50目筛,分别取各部位药材粉末1 kg,加95%乙醇4 L浸泡12 h,超声辅助提取30 min(40 ℃,200 W,40 kHz),过滤,重复三次,合并滤液,旋转蒸发减压浓缩除去乙醇,得到番石榴不同部位的乙醇提取物干燥样品,于冰箱4 ℃冷藏,备用。
1.2.2 抗氧化活性
1.2.2.1 清除DPPH自由基活性
参考文献[19-20]方法,分别精密移取 0.1 mL 不同质量浓度被试样品(番石榴根:25.0、12.5、6.25、3.125、1.56 μg/mL;茎:50.0、12.5、6.25、3.12、1.56 μg/mL;果实和叶:100.0、50.0、25.0、12.5、6.25 μg/mL;VC:17.0、12.0、8.0、6.0、4.0 μg/mL)于 10 mL 试管中,分别加入 1.0 mmoL/L DPPH 溶液 3.9 mL,室温避光静置 20 min,于波长 517 nm 处测定吸光度(Ai);同时测定 0.1 mL DPPH 溶液与 3.9 mL 甲醇混合后在波长 517 nm 处的吸光度(A0);测定 0.1 mL 甲醇与 3.9 mL 样品溶液在波长 517 nm 处的吸光度(Aj);每组平行测定3次。根据公式(1)计算出DPPH 自由基的清除率。
DPPH自由基清除率(%)=(1−Ai−AjA0)×100 (1) 1.2.2.2 清除ABTS+自由基活性
参考文献[21-22]方法,将7.0 mmoL/L 的 ABTS 溶液与2.45 mmoL/L 过硫酸钾溶液等体积混合,室温避光静置 12~16 h,制备 ABTS 自由基母液。10 mmoL/L(pH7.4)磷酸缓冲溶液将 ABTS 自由基母液稀释,使其在波长 734 nm 处吸光度达到 0.70±0.02。分别将 0.1 mL 不同质量浓度被试样品(番石榴根:0.2、0.1、0.05、0.025、0.0125 μg/mL;茎:0.6、0.3、0.15、0.075、0.0375 μg/mL;果实:0.8、0.4、0.2、0.1、0.05 μg/mL;叶:0.8、0.4、0.2、0.1、0.05 μg/mL;VC:0.15、0.12、0.09、0.05、0.04 μg/mL)加入 3.9 mL ABTS自由基溶液中,振荡 30 s 后室温静置 10 min,于波长 734 nm 处测量吸光度(Ai);同时测定 3.9 mL ABTS 自由基溶液与 0.1 mL 甲醇溶液混合后在波长 734 nm 处的吸光度(A0);测定 3.9 mL(10 mmoL/L,pH7.4)磷酸缓冲溶液与 1.0 mL 样品溶液在波长 734 nm 处的吸光度(Aj);每组平行测定 3 次。根据公式(2)计算出ABTS自由基的清除率。
ABTS+自由基清除率(%)=(1−Ai−AjA0)×100 (2) 1.2.3 体外降血糖活性
1.2.3.1 对酵母菌来源α-葡萄糖苷酶抑制活性
参考文献[23-24]方法,精密吸取0.067 mol/L(pH6.8)的磷酸盐缓冲溶液250 μL于试管中,加入被试样品50 μL(番石榴根:18.0、15.0、12.0、9.0、6.0 μg/mL;茎:40.0、35.0、30.0、25.0、20.0 μg/mL;果实:700.0、600.0、500.0、300.0、200.0 μg/mL;叶:70.0、60.0、50.0、40.0、30.0 μg/mL;阿卡波糖:4000.0、3000.0、2000.0、1000.0、500.0 μg/mL)、0.1 U/mL α-葡萄糖苷酶300 μL,混匀,37℃ 恒温水浴 20 min,加入4.0 mmol/L pNPG 200 uL,混匀,37 ℃恒温反应60 min,加入甲醇800 μL,0.45 μm微孔滤膜过滤,用HPLC检测pNP,每组平行三次。根据公式(3)计算酵母菌源α-葡萄糖苷酶的抑制率。
α-葡萄糖苷萄苷率(%)=(1−Ai−AjA0)×100 (3) 式中:A0为缓冲液+酶液+底物反应后的pNP 峰面积;Ai:样品+酶液+底物反应后的pNP 峰面积;Aj:样品+缓冲液+底物反应后的pNP 峰面积。
色谱条件:色谱柱为XBridge Peptide BEH C18柱(5 μm,4.6 mm×250 mm);流动相:乙腈(A液),0.1%甲酸水溶液(B液)。梯度洗脱条件为:0~8 min,20%~30% A液;8~13 min,30%~80% A液;13~15 min,80%~20% A液;15~25 min,20% A液;进样量:10 μL;流速:1.0 mL/min;柱温:35℃;检测波长:315 nm。
1.2.3.2 对小鼠小肠来源α-葡萄糖苷酶抑制活性
参考文献[25-26]方法,采用颈椎脱位的方法将实验小鼠处死,将小鼠小肠取出并纵向切开,先采用0.9% NaCl溶液冲洗肠内容物,再使用10 mmol/L的磷酸钠缓冲液(pH7.0)清洗肠道脂肪组织等内容物,滤纸吸干小肠水分,切碎,于10 mL离心管中用pH7.0,10 mmol/L磷酸钠缓冲液稀释,在冰浴中进行匀浆,在4 ℃下,转速为8000 r/min进行离心20 min,取出上清液,即得小鼠小肠来源α-葡萄糖苷酶,−20℃下贮存、备用。番石榴不同药用部位及阿卡波糖为对小鼠小肠来源α-葡萄糖苷酶抑制率的测定方法和检测方法同“1.2.3.1”项,被试样品溶液质量浓度分别为番石榴根:10.0、9.0、7.0、6.0、4.0 mg/mL;茎:20.0、16.0、12.0、10.0、6.0 mg/mL;果实:50.0、40.0、30.0、20.0、10.0 mg/mL;叶:13.5、10.5、9.0、6.0、4.5 mg/mL;阿卡波糖为:2.0、1.00.5、0.25、0.12 mg/mL。
1.2.3.3 对α-淀粉酶抑制活性
参考文献方法[27-28],精密吸取被试样品0.3 mL(番石榴根:0.25、0.125、0.062、0.031、0.015 mg/mL;茎:50.0、25.0、12.5、6.25、3.12 mg/mL;果实:30.0、25.0、20.0、15.0、10.0 mg/mL;叶:30.0、25.0、17.5、12.5、7.5 mg/mL;阿卡波糖为:0.3、0.15、0.075、0.037、0.018 mg/mL),加0.3 mL α-淀粉酶溶液,混匀,于37 ℃水浴孵育5 min,加入0.3 mL在 37 ℃水浴中同时预温5 min的1%可溶性淀粉溶液,混匀,反应15 min,立即加入0.5 mL DNS,煮沸5 min,随后于冰水中静置20 min,0.067 mol/L(pH6.8)磷酸缓冲溶液定容至5 mL,540 nm下测吸光值,每组平行三次。根据公式(4)计算α-淀粉酶抑制率。
α-淀粉酶抑制率(%)=(1−Ai−AjA0−Ab)×100 (4) 式中:A0为淀粉溶液+酶溶液+PBS溶液反应体系的吸光度值;Ab为酶溶液+PBS溶液反应体系的吸光度值;Ai为样品溶液+酶溶液+淀粉溶液反应体系的吸光度值;Aj为样品溶液+PBS+淀粉溶液反应体系的吸光度值。
1.2.4 酪氨酸酶抑制活性评价
参照文献[29]方法,精密吸取50 μL 0.18 mmol/L的 L-多巴溶液于96孔板,分别加入50 μL被试样品溶液(番石榴根、茎、叶、果实均为10.0、5.0、2.5、1.25、0.625 μg/mL;VC:0.5、0.25、0.125、0.062、0.031 μg/mL),37 ℃ 恒温孵育10 min,再分别加入100 μL 300 U/mL的酪氨酸酶溶液,混匀,37 ℃静置10 min,于475 nm处测定吸光度,每组平行三次。根据公式(5)计算α-淀粉酶抑制率。
酪氨氨酸抑制率(%)=(1−Ai−AjA0−Ab)×100 (5) 式中:A0为L-多巴溶液+酶溶液+PBS溶液反应体系的吸光度值;Ab为酶溶液+PBS溶液反应体系的吸光度值;Ai为样品溶液+酶溶液+L-多巴溶液反应体系的吸光度值;Aj为样品溶液+PBS+L-多巴溶液反应体系的吸光度值。
1.3 数据处理
实验重复3次,采用Origin 8.5 软件进行数据处理,结果以平均值±标准差(
ˉx ±s)表示。2. 结果与分析
2.1 抗氧化活性评价
2.1.1 对DPPH自由基清除作用
由图1可知,番石榴不同部位乙醇提取物对DPPH自由基均具有一定程度的清除作用,清除率随质量浓度的增大而增大,呈一定的量效关系。样品对DPPH自由基清除大小依次为维生素C>根>茎>叶>果实。表明番石榴不同部位中番石榴根对DPPH自由基的清除能力最强,在其质量浓度为25.0 μg/mL时清除率可达94.12%。在质量浓度为1.5~12.5 μg/mL范围内,番石榴根对DPPH自由基清除作用与维生素C接近,其IC50值为(8.45±0.12) μg/mL,接近于维生素C的(8.63±0.07) μg/mL(表1)。这可能与番石榴根含有酚酸类成分有关,陈圣加[30]等已从番石榴根分离鉴定出没食子酸、香草酸、原儿茶酸等酚酸类成分。其中没食子酸、香草酸含酚羟基,具有显著的抗氧化活性,两者均已被用作标准抗氧化剂[31]。
2.1.2 对ABTS+自由基清除作用
由图2可知,番石榴不同部位乙醇提取物对ABTS+自由基均具有一定程度的清除作用,清除率随质量浓度的增大而增大,呈一定的量效关系。当番石榴茎、叶的质量浓度分别高于0.3、0.4 mg/mL后,清除能力随质量浓度变化的趋势较小。整体上看,样品对ABTS+自由基清除大小依次为维生素C>根>茎>叶>果实。表明番石榴根对ABTS+自由基的清除能力最强,在其质量浓度为0.2 mg/mL时最高清除率可达 90.88%,其IC50值为(0.09±0.002) mg/mL,接近于维生素C的(0.08±0.001) mg/mL(表2)。番石榴果实对ABTS+自由基清除作用明显低于其余部位,在其质量浓度为0.8 mg/mL时,清除率仅38.10%,可能与其黄酮含量较低有关,张婉君等[32]研究显示,番石榴果实黄酮含量远低于叶、皮等部位。
表 2 样品对ABTS+自由基清除作用的IC50值Table 2. IC50 value of the scavenging effect of the samples on ABTS+ radical指标 根 茎 叶 果实 维生素C IC50
(mg/mL)0.09±0.002 0.18±0.02 0.26±0.03 − 0.08±0.001 2.2 体外降血糖活性
2.2.1 对酵母菌来源α-葡萄糖苷酶活性的抑制
图3可知,番石榴不同部位对酵母菌来源α-葡萄糖苷酶均具有一定程度的抑制作用,且在一定质量浓度范围内,随着质量浓度的增加,其抑制活性显著提高,呈一定的量效关系。样品对酵母菌来源α-葡萄糖苷酶活性抑制的强弱依次为根>茎>叶>果实>阿卡波糖。表明番石榴根抑制酵母菌来源α-葡萄糖苷酶活性最强,在质量浓度为18.0 μg/mL时抑制率可达98.76%,IC50值为(8.74±0.25) μg/mL(表3),其抑制活性强可能原因在于番石榴根含有大量糖苷类成分[30],该成分可能成为底物类似物影响α-葡萄糖苷酶催化底物的水解。其中,番石榴果实对酵母菌来源α-葡萄糖苷酶抑制活性所需的质量浓度较高,在其质量浓度为700 μg/mL时,抑制率仅为63.01%。
表 3 样品对酵母菌来源α-葡萄糖苷酶抑制作用的IC50值Table 3. IC50 value of the samples for inhibition on yeast α-glucosidase指标 根 茎 叶 果实 阿卡波糖 IC50(μg/mL) 8.74±0.25 22.21±0.37 44.65±1.21 650.60±3.14 2841.80±4.05 2.2.2 对小鼠小肠来源α-葡萄糖苷酶活性的抑制
由图4可知,与阿卡波糖相比,番石榴不同部位对小鼠小肠来源α-葡萄糖苷酶的抑制活性均弱于阿卡波糖,阿卡波糖的IC50值为(1.54±0.003) mg/mL(表4),该结果与抑制酵母菌来源α-葡萄糖苷酶不一致,提示应采取不同来源的α-葡萄糖苷酶对α-葡萄糖苷酶抑制剂进行体外筛选,避免假阳性。在番石榴不同部位中番石榴根的抑制活性最强,在番石榴根的质量浓度为10 mg/mL时抑制率可达50.01%,而番石榴叶对小鼠小肠来源α-葡萄糖苷酶抑制活性所需的质量浓度较高,在番石榴叶的质量浓度为10.5 mg/mL时抑制率仅34.53%。样品对小鼠小肠来源α-葡萄糖苷酶抑制活性强弱依次为阿卡波糖>根>茎>叶>果实。
表 4 样品对小鼠小肠来源α-葡萄糖苷酶抑制作用的IC50值Table 4. IC50 value of the samples for inhibition on α-glucosidase from small intestine in mice指标 根 茎 叶 果实 阿卡波糖 IC50(mg/mL) − − − − 1.54±0.003 2.2.3 对α-淀粉酶活性的抑制
由图5、表5可知,番石榴不同部位均具有α-淀粉酶抑制活性,样品对α-淀粉酶抑制活性强弱依次为根>阿卡波糖>叶>果实>茎,番石榴根IC50值为(0.10±0.02) mg/mL,表明番石榴根对α-淀粉酶抑制活性最强,且强于阿卡波糖,阿卡波糖IC50值为(0.15±0.01) mg/mL。在番石榴根的质量浓度为0.25 mg/mL时抑制率可达85.02%,而番石榴茎、叶、果实对α-淀粉酶抑制活性所需的质量浓度较高,在番石榴叶的质量浓度为10 mg/mL时抑制率仅21.41%,且茎、叶、果实抑制活性较为接近,且均弱于阿卡波糖,这与戴卫波等[33]对复方番石榴制剂的研究结果一致。
表 5 样品对α-淀粉酶抑制作用的IC50值Table 5. IC50 value of the samples for inhibition on α-amylase指标 根 茎 叶 果实 阿卡波糖 IC50(mg/mL) 0.10±0.02 21.09±0.42 18.34±0.38 19.25±0.23 0.15±0.01 2.3 酪氨酸酶抑制活性
由图6可知,番石榴不同部位均具有酪氨酸酶抑制活性,其中番石榴根和茎对酪氨酸酶抑制活性较为接近,当质量浓度超过5 mg/mL时,根的抑制活性强于茎,且在根的质量浓度为10 mg/mL时抑制率可达93.61%。在质量浓度为0.625~2.5 mg/mL范围内,番石榴果实和叶对酪氨酸酶抑制活性接近,当质量浓度超过5 mg/mL时,番石榴果实的抑制活性强于叶。整体上看,番石榴不同部位对酪氨酸酶抑制活性强弱依次为根>茎>果实>叶,表明番石榴根对酪氨酸酶抑制活性最强。其中番石榴叶对酪氨酸酶抑制活性较弱的结果与叶伟[34]对番石榴叶乙醇提取物对酪氨酸酶的抑制结果一致。
3. 结论
番石榴各部位均可入药,但关于番石榴抗氧化、降血糖、酪氨酸酶抑制活性的研究大都集中在番石榴叶、果实部位[35-36],关于根、茎部位的药理作用研究较少,对根、茎、叶、果实四个部位在抗氧化、降血糖、酪氨酸酶抑制活性的比较研究未见报道。本研究首次系统比较研究了番石榴根、茎、叶、果实4个部位乙醇提取物对DPPH、ABTS+自由基的清除能力以及对α-淀粉酶、α-葡萄糖苷酶和酪氨酸酶活性抑制作用。结果显示,番石榴不同部位乙醇提取物均具有一定的体外抗氧化、降血糖和酪氨酸酶抑制活性,呈现一定的量效关系。番石榴各部位中,番石榴根乙醇提取物的抗氧化、降血糖和抑制酪氨酸酶活性均强于其他部位。番石榴根对DPPH、ABTS+自由基清除能力与维生素C接近,清除能力IC50值分别为:(8.45±0.12) μg/mL、(0.09±0.002) mg/mL;对α-淀粉酶和酵母菌来源α-葡萄糖苷酶的抑制活性强于阿卡波糖,抑制活性的IC50值分别为:(0.10±0.02) mg/mL、(8.74±0.25) μg/mL;对小鼠小肠来源α-葡萄糖苷酶的抑制活性弱于阿卡波糖;对酪氨酸酶抑制活性弱于维生素C。
本研究结果表明,番石榴各部位中番石榴根具有较好的体外抗氧化、降血糖和酪氨酸酶抑制活性,在开发成辅助降血糖、抗肿瘤的保健食品或药品方面具有良好的潜力,丰富了石榴根药理活性研究,为新型降血糖、抗氧化、抗黑色素瘤活性先导化合物的发现提供了原料选择,但其具体活性成分、作用机制以及体内药效情况有待进一步研究。下一步可对番石榴根部位进行活性跟踪筛选,分离、纯化出活性成分。
-
表 1 样品对DPPH自由基清除作用的IC50值
Table 1 IC50 value of the scavenging effect of the samples on DPPH radical
表 2 样品对ABTS+自由基清除作用的IC50值
Table 2 IC50 value of the scavenging effect of the samples on ABTS+ radical
指标 根 茎 叶 果实 维生素C IC50
(mg/mL)0.09±0.002 0.18±0.02 0.26±0.03 − 0.08±0.001 表 3 样品对酵母菌来源α-葡萄糖苷酶抑制作用的IC50值
Table 3 IC50 value of the samples for inhibition on yeast α-glucosidase
指标 根 茎 叶 果实 阿卡波糖 IC50(μg/mL) 8.74±0.25 22.21±0.37 44.65±1.21 650.60±3.14 2841.80±4.05 表 4 样品对小鼠小肠来源α-葡萄糖苷酶抑制作用的IC50值
Table 4 IC50 value of the samples for inhibition on α-glucosidase from small intestine in mice
指标 根 茎 叶 果实 阿卡波糖 IC50(mg/mL) − − − − 1.54±0.003 表 5 样品对α-淀粉酶抑制作用的IC50值
Table 5 IC50 value of the samples for inhibition on α-amylase
指标 根 茎 叶 果实 阿卡波糖 IC50(mg/mL) 0.10±0.02 21.09±0.42 18.34±0.38 19.25±0.23 0.15±0.01 -
[1] 李坤, 张伊晗, 郭宇萱, 等. 番石榴叶的抗二型糖尿病活性成分研究进展[J]. 当代化工研究,2018(5):163−164. [LI K, ZHANG Y H, GUO Y X, et al. Research progress in the active components of Guava leaf against type diabetes mellitus[J]. Chenmical Intermediate,2018(5):163−164. doi: 10.3969/j.issn.1672-8114.2018.05.101 [2] 南京中医药大学. 中药大辞典[M]. 上海: 上海科学技术出版社, 2006: 3371-3373. Nanjing University of Chinese Medicine. Dictionary of traditional Chinese medicine [M]. Shanghai: Shanghai Science and Technology Press, 2006.
[3] 彭财英, 黄应正, 刘建群, 等. 番石榴根中一个新的三萜类成分[J]. 药学学报,2017,52(11):1731−1736. [PENG C Y, HUANG Y Z, LIU J Q, et al. A new triterpenoid from roots of Psidium guajava[J]. Acta Pharmaceutica Sinica,2017,52(11):1731−1736. [4] 方皓, 熊素琴, 燕娜娜, 等. 一测多评法测定番石榴叶中6种黄酮类成分的含量[J]. 天然产物研究与开发,2019,31(9):1559−1566. [FANG H, XIONG S Q, YAN N N, et al. Simultaneous determination of six flavonoids in Psidium guajava Linn. by QAMS[J]. Natural Product Research and Development,2019,31(9):1559−1566. [5] 汪梅花, 魏文浩, 吴振强. 番石榴叶的生物活性研究进展[J]. 中药材,2015,38(10):2215−2219. [WANG H H, WEI W H, WU Z Q. Research progress on bioactivity of Guava leaves[J]. Journal of Chinese Medicinal Materials,2015,38(10):2215−2219. [6] 郭莹, 熊阳, 宋忠诚, 等. 番石榴叶挥发油的提取、成分分析及抑菌活性研究[J]. 中华中医药杂志,2015,30(10):3754−3757. [GUO Y, XIONG Y, SONG Z C, et al. Study on extraction technology, components analysis and antibacterial activity of Psidium guajava L[J]. China Journal of Traditional Chinese Medicine and Pharmacy,2015,30(10):3754−3757. [7] 符春丽, 彭燕, 黎诗敏, 等. 番石榴叶乙酸乙酯萃取物的体外抗氧化活性及化学成分的分离鉴定[J]. 现代食品科技,2017,33(10):52−57. [FU C L, PENG Y, LI S M, et al. Isolation and identification of chemical constituents and in vitro antioxidant activity of ethyl acetate extracts from Psidium guajava Linn leaves[J]. Modern Food Science and Technology,2017,33(10):52−57. [8] 吕冰冰, 谢笔钧, 孙智达. 红肉番石榴果胶的理化特性及其体外降脂作用[J/OL]. 食品工业科技: 1−16 [2021-05-31]. https://doi.org/10.13386/j.issn1002-0306.2021010091. LV B B, XIE B J, SUN Z D. Physical and chemical properties of red-flesh guava pectin and its lipid-lowering effect in vitro[J/OL]. Science and Technology of Food Industry: 1−16 [2021-05-31].https://doi.org/10.13386/j.issn1002-0306.2021010091.
[9] 周浓, 莫日坚, 黄秋艳, 等. 番石榴多酚的提取纯化及其抑菌活性研究[J]. 食品与发酵工业,2020,46(14):182−188. [ZHOU N, MO R J, HUANGY Q, et al. Study on extraction and purification of guava polyphenols and its antibacterial activity[J]. Food and Fermentation Industries,2020,46(14):182−188. [10] 刘晓聪, 林冬梅, 刘敏, 等. 番石榴的化学成分及其抗肿瘤与抗真菌活性[J/OL]. 中国中药杂志: 1−10 [2021-05-31]. https://doi.org/10.19540/j.cnki.cjcmm.20210517.202. LIU X C, LIN D M, LIU M, et al. Chemical constituents of Psidium guajava and their antitumor and antifungal activities[J/OL]. China Journal of Chinese Materia Medica: 1−10[2021-05-31]. https://doi.org/10.19540/j.cnki.cjcmm.20210517.202.
[11] 世界卫生组织国际癌症研究机构[EB/OL]. https: //www. iarc. fr/faq/latest-global-cancer-data-2020-qa/. -data-2020-qa/. International Agency for Research on Cancer[EB/OL]. https: //www. iarc. fr/faq/latest-global-cancer-data-2020-qa/. -data-2020-qa/.
[12] International Diabetes Federation. IDF diabetes atlas, 9thed[EB/OL]. [2020-04-03]. http://www.diabetesatlas.org.
[13] CDC. Centers for Disease Cotrol and Prevention, CancerPrevention and Control, State of the Science on MelanomaPrevention and Screening[EB/OL].https://www.cdc.gov/cancer/dcpc/re- search/articles/melanoma-risehtm.
[14] 刘冉, 程霜, 王雷, 等. 不同品种甘薯叶提取物抗氧化及对 α-葡萄糖苷酶抑制活性的研究[J]. 食品工业科技, 2019, 40(23): 283−289. LIU R, CHENG S, WANG L, et al. Antioxidant activity and α-glucosidase inhibitory activity of sweet potato (Ipomoea batatas L. ) leaf extracts from different varieties[J]. Science and Technology of Food Industry, 2019, 40(23): 283−289.
[15] 毕云枫, 宋凤瑞, 刘志强. 天然酪氨酸酶抑制剂的种类及其对酪氨酸酶抑制作用的研究进展[J]. 吉林大学学报(医学版),2014,40(2):454−459. [BI Y F, SONG F R, LIU Z Q. Research progress on types of natural tyrosinase inhibitors and their inhibitory effects on tyrosinase[J]. Journal of Jilin University (Medicine Edition),2014,40(2):454−459. [16] IGHODARO O M. Molecular pathways associated with oxidative stress in diabetes mellitus[J]. Biomedicine & Pharmacotherapy,2018,108:656−662.
[17] 姚志仁, 李豫, 朱开梅, 等. 黄花倒水莲不同极性部位抗氧化和降血糖活性研究[J]. 食品工业科技,2020,41(7):55−59. [YAO Z R, LI Y, ZHU K M, et al. Antioxidant and hypoglycemic activities of different parts partitioned from the ethanol extract of Polygala fallax Hemsl [J]. Science and Technology of Food Industry,2020,41(7):55−59. [18] 成秋桂, 高丽群, 邓峰云, 等. 抗氧化在化妆品行业的应用进展[J]. 日用化学品科学,2019,42(2):32−38. [CHEN Q J, GAO L Q, DENG F Y, et al. Application of antioxidant in cosmetics industry[J]. Detergent & Cosmetics,2019,42(2):32−38. doi: 10.3969/j.issn.1006-7264.2019.02.010 [19] 李榕娣, 庄远杯, 魏爱红, 等. 不同蕨菜制品醇提取物体外抗氧化及降血糖活性研究[J]. 食品工业科技,2015,11(3):383−391. [LI R D, ZHUANG Y B, WEI A H, et al. Antioxidant and hypoglycemic activities of different processing products from ethanol extracts of Blechnum orientale L. in vitro[J]. Science and Technology of Food Industry,2015,11(3):383−391. [20] METROUH-AMIR H, DUARTE C M M, MAIZA F. Solvent effect on total phenolic contents, antioxidant, and antibacterial activities of Matricaria pubescens[J]. Industrial Crops and Products,2015,67:249−256. doi: 10.1016/j.indcrop.2015.01.049
[21] LI J, ZHANG Q, CUI J, et al. Characterization and antioxidant activity of flash-assistedextracted dihydroquercetin from wood sawdust of Larix gmelinii using a response surface methodology[J] . International Journal of Food Engineering, 2016, 12(6): 587-597.
[22] 丘建媚, 李菲菲, 温正辉, 等. 琴叶榕根提取物对α-葡萄糖苷酶、α-淀粉酶的抑制作用[J]. 中国民族民间医药,2019,28(14):26−29. [QIU J M, LI F F, WEN Z H, et al. Study on the on α-glycosidase and α-amylase inhibitory activities of extract from the Ficus pandurata root[J]. Chinese Journal of Ethnomedicine and Ethnopharmacy,2019,28(14):26−29. [23] 朱文佳, 寇自农, 张曦, 等. α-葡萄糖苷酶抑制剂体外筛选方法的研究[J]. 食品研究与开发,2012,33(8):171−175. [ZHU W J, KOU Z N, ZHANG X, et al. Study of screening method for α-glucosidase inhibitors in vitro[J]. Food Research and Development,2012,33(8):171−175. doi: 10.3969/j.issn.1005-6521.2012.08.052 [24] 张丙云, 苏丹, 郭涛, 等. 竹叶椒乙醇提取物对α-葡萄糖苷酶的抑制作用及其机理研究[J]. 食品工业科技,2015,36(21):345−348. [ZHANG B Y, SU D, GUO T, et al. Study on the inhibitory effect and inhibition mechanism on α-glycosidase of ethanol extract from Zanthoxylum armatum DC J]. Science and Technology of Food Industry,2015,36(21):345−348.
[25] 温正辉, 凌梅娣, 余思萍, 等. 蒲桃不同药用部位乙醇提取物对α-葡萄糖苷酶和α-淀粉酶活性的抑制作用研究[J]. 中国药房,2019,30(23):3246−3251. [WEN Z H, LIN M D, YU S P, et al. Study on inhibitory effects of ethanol extract of different medicinal parts from Syzygium jambos on the activities of α-glycosidase and α-amylase[J]. China Pharmacy,2019,30(23):3246−3251. [26] 丁华杰, 叶云, 安欢, 等. 虎杖白藜芦醇的提取及抑制α-淀粉酶和α-葡萄糖苷酶活性的研究[J]. 中国调味品,2020,45(2):176−181. [DING H J, YE Y, AN H, et al. Extractio of resveratrol from Polygoum cuspidatum and its inhibition of α-amylase and α-glucosidase activity[J]. CHINA Condiment,2020,45(2):176−181. doi: 10.3969/j.issn.1000-9973.2020.02.040 [27] MENG Y, SU A, YUAN S, et al. Evaluation of total flavonoids, myricetin, and quercetin from Hovenia dulcis Thunb. as inhibitors of α-amylase and α-glucosidase[J]. Plant Foods for Human Nutrition,2016,71(4):444−449. doi: 10.1007/s11130-016-0581-2
[28] 袁堂丰. 罗汉松化学成分分离及抑制酪氨酸酶活性研究[D]. 吉首: 吉首大学, 2019. YUAN T F. Isolation on chemical constituents from Podocarpus macrophllus and their tyrosinase inhibition activity[D]. Jishou: Jishou University, 2019.
[29] 孙熙浛, 齐欣, 崔承弼. 辐照红景天乙醇提取物的抗氧化作用及美白作用研究[J]. 食品工业科技,2020,41(23):325−331. [SUN X H, QI X, CUI C B. Antioxidant and whitening effects of ethanol extract from irradiated Rhodiola rosea[J]. Science and Technology of Food Industry,2020,41(23):325−331. [30] 陈圣加, 黄应正, 卢健, 等. 番石榴根中酚酸类化学成分分离鉴定[J]. 中国实验方剂学杂志,2019,25(2):169−174. [CHEN S J, HUANG Y Z, LU J, et al. Phenolic components from roots of Psidium guajava[J]. Chinese Journal of Experimental Traditional Medical Formulae,2019,25(2):169−174. [31] SIRIVIBULKOVIT K, NOUANTHAVONG S, SAMEENOI Y. Paper-based DPPH assay for antioxidant activity analysis[J]. Analytical Sciences, 2018, 34(7): 795−800.
[32] 张婉君, 冯彬, 谢笔钧, 等. 白肉番石榴总黄酮提取工艺优化及体外抗氧化活性分析[J]. 食品工业科技,2019,40(8):196−201. [ZHANG W J, FENG B, XIE B J, et al. Optimization of extraction process and in vitro antioxidant activity analysis of total flavonoids from white-flesh Guava (Psidium guajava L. cv. Pearl)[J]. Science and Technology of Food Industry,2019,40(8):196−201. [33] 戴卫波, 李乐愚, 梅全喜. 复方番石榴制剂对HepG2细胞胰岛素抵抗的改善及对α-淀粉酶和α-葡萄糖苷酶抑制作用[J]. 中药新药与临床药理,2016,27(5):655−660. [DAI W B, LI L Y, MEI Q X, et al. Improvement of insulin resistance in hepG2 cells and inhibition of α-amylase and α-glucosidase by compound Fructus psidii guajavae preparation[J]. Traditional Chinese Drug Research & Clinical Pharmacology,2016,27(5):655−660. [34] 叶伟. 番石榴叶有机溶剂提取物清除过氧自由基能力及抑制酪氨酸酶活力研究[J]. 安徽农业科学,2020,48(2):186−188. [YE W. Study on scavenging peroxy radical activity and inhibitory effect on tyrosinase of Guava leaves extract[J]. Journal of Anhui Agricultural Sciences,2020,48(2):186−188. doi: 10.3969/j.issn.0517-6611.2020.02.054 [35] 洪佳敏, 林宝妹, 张朝坤, 等. 番石榴醇提物抗氧化能力及α-葡萄糖苷酶抑制活性研究[J]. 西北农林科技大学学报(自然科学版),2019,47(1):139−146. [HONG J M, LIN B M, ZHANG C K, et al. Antioxidant capacity and α-glucosidase inhibitory activity of ethanol extracts from guava fruits[J]. Journal of Northwest A& F University(Nat. Sci. Ed),2019,47(1):139−146. [36] 欧阳文, 朱晓艾, 刘润南, 等. 番石榴叶具有α-葡萄糖苷酶抑制活性的倍半萜杂二醛分离与鉴定[J]. 湖南中医药大学学报,2014,34(8):17−20. [OU Y W, ZHU X A, LIU R N, et al. Sesquiterpenoids with α-glucosidase inhibitory activities from the leaves of Psidium guajava Linn[J]. Journal of Hunan University of Chinese Medicine,2014,34(8):17−20. doi: 10.3969/j.issn.1674-070X.2014.08.005.017.04





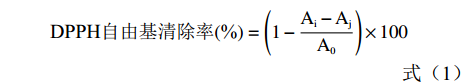
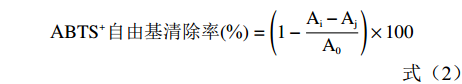
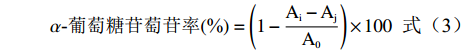
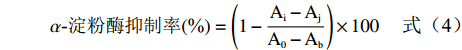
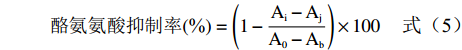

 下载:
下载:





 下载:
下载:
