Study on Ultrasonic-Assisted Enzymatic Hydrolysis of Distiller’s Grains Cellulose
-
摘要: 为促进我国酒糟资源的高值化开发和利用,本论文探究了基于超声波预处理的酒糟纤维素酶解工艺条件。首先通过单因素实验研究了超声工作参数(时间、温度、功率)及酶解工艺参数(时间、pH、温度、酶添加量、底物浓度)对酒糟纤维素酶解效果影响,在此基础之上进行了Plackett-Burman试验筛选出影响酶解反应的关键因素,再采用Box-Behnken试验对酶解工艺进行优化。Plackett-Burman试验结果表明,影响酒糟纤维素酶解的关键因素为:超声时间、酶解时间、酶解pH、酶添加量。Box-Behnken旋转中心组合试验优化得出最佳酶解工艺条件为:超声时间21 min、酶解时间140 min、酶解pH5.41、酶添加量990 U/g、超声温度60 ℃、超声功率200 W、酶解温度50 ℃、酶解底物浓度1:20 g/mL,在此条件下酒糟纤维素转化率为5.62%,较对照组(未经超声波处理)提高了35.4%,表明超声波预处理是提高酒糟纤维转化率的有效途径。Abstract: In order to promote the development and utilization of distiller’s grain resources in China, the present study explored the enzymatic hydrolysis conditions of distiller’s grains cellulose based on ultrasonic pretreatment. Firstly, the effects of ultrasound parameters (time, temperature, power) and enzymatic hydrolysis process parameters (time, pH, temperature, enzyme addition, substrate concentration) on the enzymatic hydrolysis of vinasse cellulose were studied through single-factor experiments. The Plackett-Burman test was carried out to screen out the key factors which affected the enzymatic hydrolysis reaction, and then the Box-Behnken test was used to optimize the enzymatic hydrolysis process. The Plackett-Burman test results showed that the key factors affecting the enzymatic hydrolysis of vinasse cellulose were ultrasound time, enzymatic hydrolysis time, enzymatic hydrolysis pH, and enzyme addition. The Box-Behnken results showed that the optimal enzymolysis process conditions were ultrasonic time 21 min, enzymolysis time 140 min, enzymatic hydrolysis pH5.41, enzyme addition 990 U/g, ultrasonic temperature 60 ℃, ultrasonic power 200 W, enzymolysis temperature 50 ℃, and the concentration of enzymatic hydrolysis substrate 1:20 g/mL. Under these conditions, the cellulose conversion rate of distiller’s grains were 5.62%, which was 35.4% higher than that of the control group. The results showed that ultrasonic pretreatment was an effective way to improve the cellulose conversion rate of distiller’s grains.
-
Keywords:
- distiller's grains /
- cellulose /
- enzymatic hydrolysis /
- ultrasound /
- response surface
-
白酒酒糟是以谷物为主要原料,采用传统的固态发酵和固态蒸馏工艺制得白酒后的副产物[1]。根据统计,2020年白酒产量740.73万千升,按照白酒与酒糟比例约1:8计算,每年白酒生产将产生近亿吨酒糟固废[2-3]。酒糟中的纤维素、半纤维素、木质素等成分较高,因此降解酒糟中的纤维素是高值化利用酒糟资源关键步骤,不仅可以减少环境污染,还能带来巨大的经济效益[4]。
纤维素水解主要有酸水解、碱水解、酶水解3种方法[5-6]。虽然纤维素酸水解和碱水解方法能进行大批量工业生产,但是酸水解会产生设备腐蚀、催化剂难以回收以及产生大量废水等[7]。酶法水解是一种温和、安全的降解方法,具有降解彻底、环境友好、副产物少等优点[8],但传统的酶解也存在严重不足,比如反应效率低、底物转化率低、产物得率低,其根本原因在于底物分子的结构特征,不易被酶接近[9]。有效的方法之一就是改善底物分子的空间构象和微观结构,增强底物对酶的敏感性。就此而言,国内外开展了热处理[10]、微波处理[11]、高压处理[12]、化学试剂处理[13]和超声波处理[14]等一系列底物预处理技术的研究,其中超声波作为集高效、绿色、操作简单等特点于一体的技术被广泛用于产品的改进加工、底物分子改性。超声波对底物的作用方式可以通过降低溶液黏度和表面张力来提高底物传质速率[15]。Zhang等[16]研究发现,超声能减小微晶纤维素的粒径、促进酶解反应的进行;Yu等[17]研究发现,超声可以破坏稻壳的表面结构从而提高酶解效率。
目前,国内外关于纤维素超声波辅助酶解虽有报道,但关于酒糟纤维素超声波辅助酶解的研究相对缺乏。本文以白酒酒糟为原料,研究了超声波工作参数(超声波处理时间、超声波处理温度、超声波功率)及酶解工艺参数(酶解时间、pH、温度、酶添加量、底物浓度)对酒糟纤维素酶解效果的影响,并采用响应面试验设计方法对超声波辅助酶解工艺进行了优化,以期为酒糟纤维素的利用提供新方法。
1. 材料与方法
1.1 材料与仪器
鲜酒糟(采用GB/T 5515-2008介质过滤法测得纤维素干基含量为31.06%) 四川沱牌集团有限公司;纤维素酶(50000 U/g) 上海易罗恩化学技术有限公司;葡萄糖、磷酸氢二钠、柠檬酸、3,5-二硝基水杨酸(DNS)、酒石酸钾钠、苯酚、亚硫酸钠、氢氧化钠等 均为分析纯,成都金山化学试剂有限公司。
多用途恒温超声波提取机 上海比朗仪器有限公司;HSJ系列恒温水浴搅拌器 江苏科析仪器公司;电子天平(分度值1 mg) 上海箐海仪器公司;UV-1800PC紫外可见分光光度计 翱艺仪器(上海)有限公司;FW100粉碎机 上海淀久中药机械制造有限公司;高速台式离心机Eppendorf Centrifuge 5804 R Eppendorf China Limited(艾本德中国有限公司)。
1.2 实验方法
1.2.1 酒糟预处理
在80 ℃干燥箱中干燥至恒重,冷却至室温后,用粉碎机粉碎,过24目筛,装入30×40 cm PE透明自封袋密封后置于室温贮藏。
1.2.2 工艺流程
鲜酒糟→预处理→添加磷酸氢二钠-柠檬酸缓冲溶液→超声波处理→纤维素酶解→沸水浴灭酶10 min→5000 r/min离心→清液定容→3,5-二硝基水杨酸法测定还原糖含量→计算纤维素转化率。
将鲜酒糟进行干燥、粉碎后,加入一定体积的柠檬酸缓冲溶液,并置于实验设定的温度和功率的多用途恒温超声波提取机内处理一定的时间。预处理完成后,样品纤维素在预设的酶解条件下进行酶解,沸水浴灭酶10 min,迅速冷却至室温,然后将酶解液在5000 r/min的离心机中进行离心10 min,取清液并定容至200 mL。采用3,5-二硝基水杨酸法测定还原糖含量,并计算纤维素转化率。
1.2.3 单因素实验设计
准确称取5.00 g酒糟样品,加入一定体积的磷酸氢二钠-柠檬酸缓冲液(pH依试验而定),在设定的温度下进行超声波处理,冷却或加热到酶解温度后分别以每克酒糟原料为单位基准加入一定量的纤维素酶,置于一定温度的恒温水浴搅拌器中进行酶解。酶解反应结束后,沸水浴灭酶10 min并迅速冷却,离心(5000 r/min、10 min)并收集清液,定容至200 mL,采用DNS比色法测定还原糖含量,计算酒糟纤维素转化率。每组试验重复3次。分别以酶解时间、酶解反应底物浓度、纤维素酶添加量、酶解pH、酶解温度、超声温度、超声功率、超声时间为单因素进行试验,考察各单因素对酒糟纤维素转化率的影响。
1.2.3.1 酶解时间对样品酒糟纤维素转化率的影响
固定超声波处理时间20 min、超声波功率200 W、超声波处理温度60 ℃、酶解反应底物浓度为1:10 g/mL、纤维素酶添加量600 U/g、酶解温度为30 ℃、酶解pH5.0,考察不同的酶解时间(30、60、90、105、120、150、180 min)对样品酒糟纤维素转化率的影响。
1.2.3.2 酶解反应底物浓度对样品酒糟纤维素转化率的影响
在1.2.3.1的结果上,固定超声波处理时间20 min、超声波功率200 W、超声波处理温度60 ℃、纤维素酶添加量600 U/g、酶解温度为30 ℃、酶解pH5.0,考察不同的酶解反应底物浓度(1:10、1:15、1:20、1:25、1:30 g/mL)对酒糟纤维素转化率的影响。
1.2.3.3 纤维素酶添加量对样品酒糟纤维素转化率的影响
在1.2.3.2的结果上,固定超声波处理时间20 min、超声波功率200 W、超声波处理温度60 ℃、酶解温度为30 ℃、酶解pH5.0、酶解时间120 min,考察不同的纤维素酶添加量(400、600、800、1000、1200 U/g)对酒糟纤维素转化率的影响。
1.2.3.4 酶解pH对样品酒糟纤维素转化率的影响
在1.2.3.3的结果上,固定超声波处理时间20 min、超声波功率200 W、超声波处理温度60 ℃、酶解温度30 ℃、酶解时间120 min、酶解反应底物浓度1:20 g/mL,考察不同的酶解pH(3.0、4.0、5.0、6.0、7.0)对酒糟纤维素转化率的影响。
1.2.3.5 酶解温度对样品酒糟纤维素转化率的影响
在1.2.3.4的结果上,固定超声波处理时间20 min、超声波功率200 W、超声波处理温度60 ℃、酶解时间120 min、酶解反应底物浓度1:20 g/mL、酶添加量800 U/g,考察不同的酶解温度(20、30、40、50、60 ℃)对酒糟纤维素转化率的影响。
1.2.3.6 超声波处理温度对样品酒糟纤维素转化率的影响
在1.2.3.5的结果上,固定超声波处理时间20 min、超声波功率200 W、酶解时间120 min、酶解反应底物浓度1:20 g/mL、酶添加量800 U/g、酶解pH6.0,考察不同的超声波处理温度(30、40、50、60、70 ℃)对酒糟纤维素转化率的影响;
1.2.3.7 超声波功率对样品酒糟纤维素转化率的影响
在1.2.3.6的结果上,固定超声波处理时间20 min、酶解时间120 min、酶解反应底物浓度1:20 g/mL、酶添加量800 U/g、酶解pH6.0、酶解温度50 ℃,考察不同的超声波功率(100、200、400、600、800 W)对酒糟纤维素转化率的影响;
1.2.3.8 超声波处理时间对样品酒糟纤维素转化率的影响
在1.2.3.7的结果上,固定酶解时间120 min、酶解反应底物浓度1:20 g/mL、酶添加量800 U/g、酶解pH6.0、酶解温度50 ℃、超声波处理温度60 ℃,考察不同的超声波处理时间 (5、10、15、20、25、30 min)对酒糟纤维素转化率的影响。
1.2.4 Plackett-Burman试验设计
基于酶解纤维素各个因素试验结果,将酒糟纤维素转化率作为Plackett-Burman试验结果的响应值。从超声波处理温度、超声波处理时间、超声波功率、纤维素酶解反应温度、纤维素酶解时间、纤维素酶解反应pH、纤维素酶添加量以及原料与缓冲液比例八个因素水平筛选出四个较大的主间效应因子,各个因素取高低水平,如表1。
表 1 Plackett-Burman试验设计的因素水平表Table 1. Factors and levels of Plackett-Burman experimental design因素 编码 低水平(−) 高水平(+) 酶解时间(min) X1 90 150 底物浓度(g/mL) X2 1:15 1:25 酶添加量(U/g) X3 600 1000 酶解pH X4 5 7 酶解温度(℃) X5 40 60 超声波处理温度(℃) X6 50 70 超声波功率(W) X7 100 300 超声波处理时间(min) X8 15 25 1.2.5 Box-Behnken响应面优化试验设计
采用Minitab18软件对Plackett-Burman试验数据进行处理,依据结果选择超声波处理时间、纤维素酶解时间、纤维素酶解反应pH以及纤维素酶添加量四个因素为响应面分析因素,酒糟纤维素转化率作为响应值,选用Box-Behnken中心组合优化酒糟纤维酶解参数,试验因素相关的水平如下表2。
表 2 Box-Behnken 试验设计相关因素水平表Table 2. Factors and levels of Box-Behnken experimental design水平 因素 X1(min) X3(U/g) X4 X8(min) −1 90 600 5.0 15 0 120 800 6.0 20 1 150 1000 7.0 25 1.2.6 指标测定
1.2.6.1 酒糟中总还原糖含量测定
采用DNS比色法测定酒糟纤维素酶解后还原糖当量[18]。
还原糖含量计算公式如下:
X=(A+0.1479)6.689×1000×V−0.0049×m (1) 式中:X为酒糟酶解样液中还原糖含量,g;A为样品酶解后离心液吸光度;0.1479为葡萄糖标准曲线函数常数;6.689为葡萄糖标准曲线函数斜率;V为上清液定容总体积,mL;系数0.0049为1 g酒糟未经酶解所含还原糖当量,g;m为酶解所加入的酒糟质量,g。
1.2.6.2 标准曲线的制作
取适量葡萄糖标准品于90 ℃烘干至恒重,准确称量0.100 g干燥恒重后的葡萄糖并用去离子水定容到100 mL,得到浓度为1 g/L葡萄糖标准溶液。分别向具塞刻度试管加入0.2、0.4、0.6、0.8、1.0、1.2 mL葡萄糖标准溶液,各添加2 mL 3,5-二硝基水杨酸溶液(DNS),后用去离子水补至10 mL,沸水浴5 min,用冰水迅速冷却至室温,后用分光光度计在540 nm波长处测得相应的吸光度。以横坐标为葡萄糖标准溶液浓度(mg/mL)、纵坐标为吸光值,经过作图计算得到相应的回归方程:
y=6.6842x−0.1479,R2=0.9952 。1.2.6.3 纤维素转化率的测定
纤维素转化率表示酒糟在酶解过程中,长链纤维素断键程度。其计算公式为:
转化率(%)=Xm×α×100 (2) 式中:X为酒糟酶解样液中还原糖含量,g;m为酶解所加入的酒糟质量,g;α为酒糟中粗纤维含量质量分数。
1.3 数据处理
每个实验重复3次,结果以“平均值±标准差”表示。使用Excel软件进行各个因素试验的数据分析以及作图,各因素水平的差异显著性(P<0.05)采用SPSS 22.0软件中的Tukey检验法,采用Minitab18软件进行Plackett-Burman试验数据分析,采用Design Expert10软件进行Box-Behnken试验数据分析。
2. 结果与分析
2.1 单因素实验结果
2.1.1 酶解时间对酒糟纤维转化率的影响
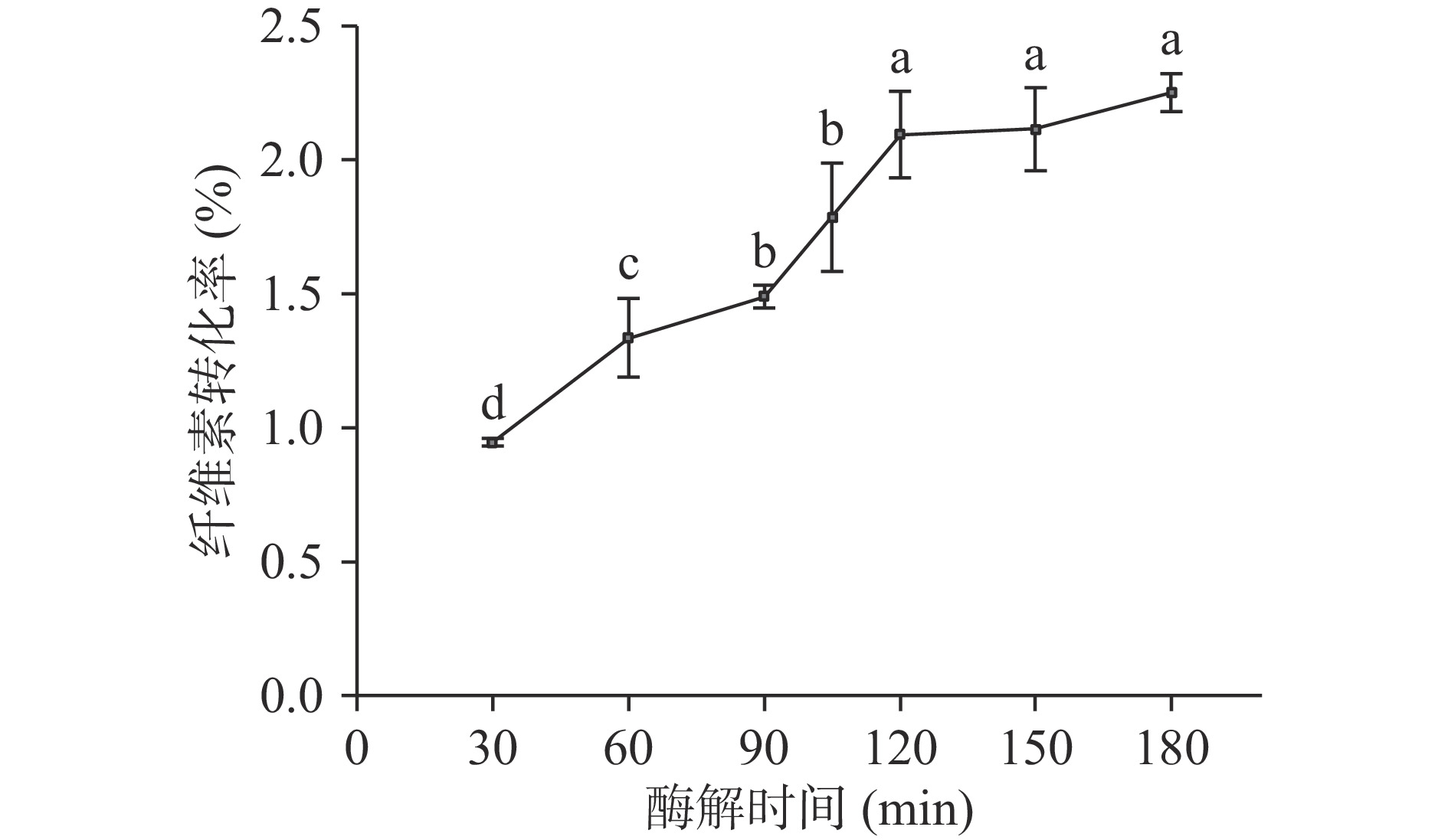
纤维素酶解反应时间对酒糟纤维转化率的影响如图1所示。
由图1可知,随着酶解时间的延长,酒糟纤维素转化率先快速上升后变化平稳,反应时间在120 min时,酒糟纤维素的转化率出现拐点;当时间大于120 min时,延长酶解反应时间,酒糟纤维素的转化率增加不显著(P>0.05),表明酶解120 min时酶解反应基本趋于平衡。值得注意的是,酶解时间从90 min延长至120 min时,纤维素转化率出现陡增(约增加了0.6%),表明在这个阶段酶解反应机理可能发生改变,这可能是在高酶负荷情况下,90 min时纤维素酶已占据纤维素表面大部分位置,随着时间延长,纤维素酶的结合能力增加,空间位阻可能降低;然而,当更多的纤维素酶被吸附在表面,可能会干扰自身的酶解能力[19]。
2.1.2 底物浓度对酒糟纤维转化率的影响
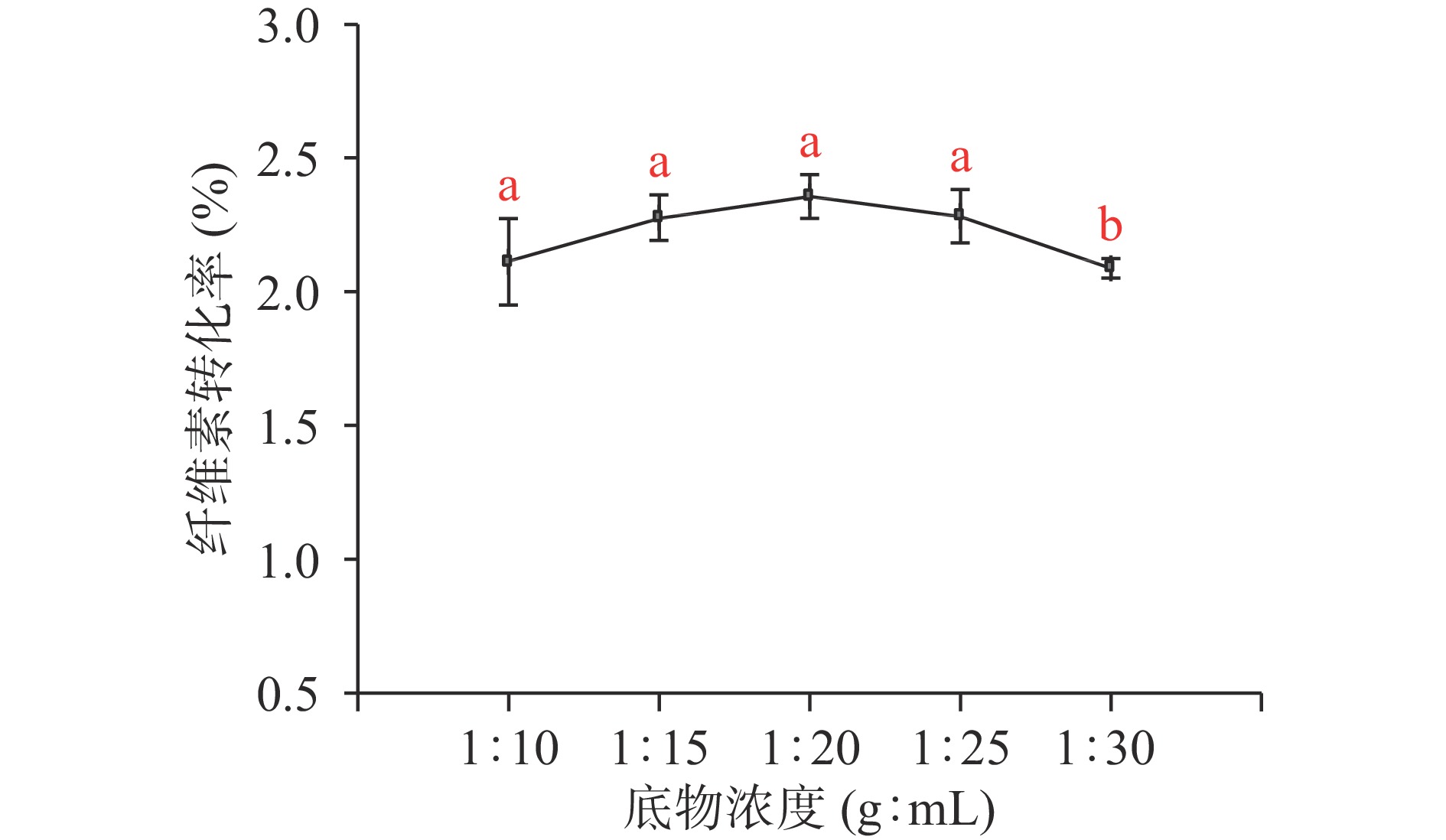
纤维素底物浓度对酒糟纤维转化率的影响如图2所示。
由图2可知,随着酶解时缓冲溶液体积的增大,总体而言,酒糟纤维素转化率先上升后下降,底物浓度为1:15、1:20、1:30 g/mL酒糟纤维素转化率无显著性差异(P>0.05),在1:20 g/mL趋于最大值。从1:10到1:20 g/mL范围,底物与酶的结合随着溶液的扩散,结合率越大,表现为促进作用,酶解作用增强;随着缓冲液添加量继续增大,纤维素酶以及酒糟原料的浓度逐渐被稀释,酒糟纤维素转化率受到底物浓度的抑制作用[20]。
2.1.3 加酶量对酒糟纤维素转化率的影响
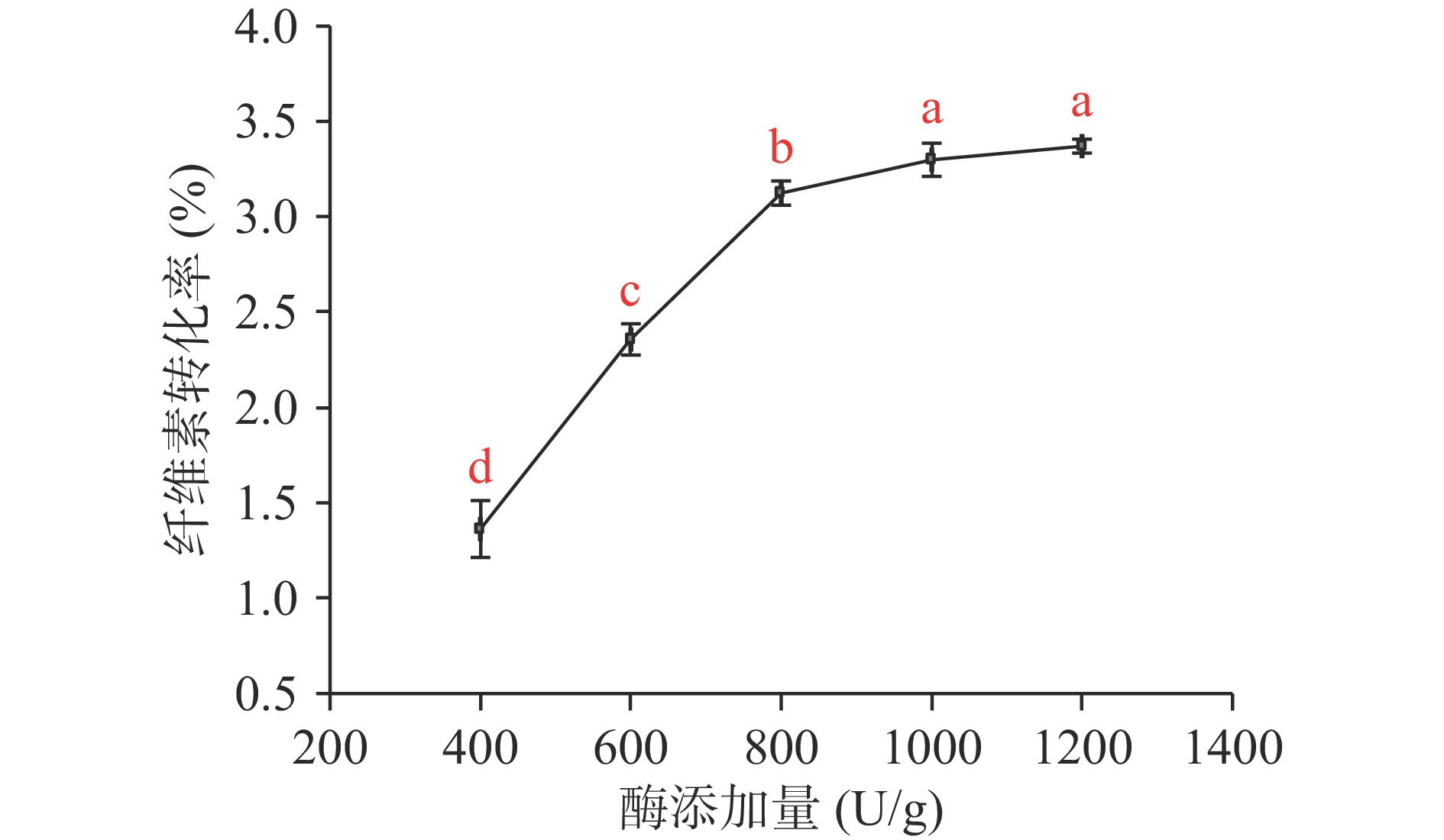
纤维素酶添加量对酒糟纤维素转化率的影响如图3所示。
由图3可知,随着酶添加量的增加,酒糟纤维素转化率先快速上升后缓慢上升。纤维素酶添加量在800、1000、1200 U/g时,纤维素转化率不显著(P>0.05)。这是因为在纤维素酶添加量为800 U/g时,纤维素酶与纤维素底物结合位点趋于饱和,酶添加量对纤维素转化增强作用降低[21]。考虑到纤维素酶解的经济性,选择800 U/g纤维素酶添加量进行实验。
2.1.4 酶解反应pH对酒糟纤维素转化率的影响
纤维素酶解反应pH对酒糟纤维素酶解的影响如图4所示。
由图4可知,随着酶解反应介质pH的增大,酒糟纤维素转化率先上升后下降,可能是因为溶液pH增加,酶的活性中心会受到酸碱离子影响,当反应pH偏离酶的最适pH时,酶解反应会受到不同程度的抑制。图4表明,纤维素转化率在pH5.0出现最大值,且与pH6.0的条件下的转化率无显著性差异(P>0.05),综合考虑成本、废水处理等问题,选取纤维素酶解反应pH6.0作为最佳值。
2.1.5 酶解反应温度对酒糟纤维素转化率的影响
酶解反应温度对酒糟纤维素转化率的影响如图5所示。
由图5可知,酶解反应温度逐渐升高,纤维素转化率先上升后下降,在温度为50 ℃出现最大值,这是因为温度升高,分子热运动加快,促进了酶与底物结合的速率,酒糟纤维素转化率不断提高,当温度超过纤维素酶的最适温度后,纤维素酶的催化活性会明显受到抑制,从而使得转化率降低。
2.1.6 超声波处理温度对酒糟纤维素转化率的影响
超声波处理温度对酒糟纤维素转化率的影响如图6所示。
由图6可知,超声温度逐渐增大,酒糟纤维素转化率先上升后下降,在温度为60 ℃出现最大值。温度对酒糟原料颗粒的溶胀有较大的影响,但是随着超声波预处理酒糟时的温度升高,空化阈值下降,超声所表现的空化效应减弱。超声波所产生的局部高温、高压环境会导致自由基的形成,这些自由基可能会破坏酶分子构象,酶活性受到抑制[15]。
2.1.7 超声波功率对酒糟纤维素转化率的影响
超声波功率对酒糟纤维素转化率的影响如图7所示。
由图7可知,超声功率对酒糟纤维素转化率影响总体呈上升趋势,但是在200 W时,超声工作功率对预处理后的酒糟纤维素酶解产生突跃现象,在超声功率400 W时下降后再次呈现上升趋势,因此超声波预处理功率200 W可以作为酒糟酶解最佳超声波预处理功率参数。随着超声波预处理酒糟的功率不断增大,空化效应增强,产生的羟自由基的量越多[22],这些自由基可使酶活性降低[15],从而降低纤维素的转化率;此外,相关研究表明,低功率超声波对纤维素晶体结构有明显破坏效果,但是当功率增大到400 W后,非结晶区和有结晶缺陷区域的纤维素自由度增加,在吸收超声波产生的能量后,纤维素产生链段运动,经过较高功率超声处理的纤维素非结晶区出现生长现象,从而在一定程度上降低纤维素酶与非结晶区域作用位点的结合[23-25]。
2.1.8 超声波处理时间对酒糟纤维素转化率的影响
超声时间对酒糟纤维素转化率的影响如图8所示。由图8可知,随着超声时间的延长,酒糟纤维素转化率先上升后下降,在超声处理20 min时效果达到最佳值,超声带来的声波震动、空化效应和机械剪切作用,对酒糟颗粒的破碎效果较强。但是较长时间的超声波处理,使得单糖分子与游离氨基酸发生美拉德反应,从而会引起单糖含量的减少[26]。
2.2 Plackett-Burman试验设计结果
Plackett-Burman试验设计及结果见表3,各因素酶解效应评价见表4。
表 3 Plackett-Burman试验设计及响应值Table 3. Experimental design and response values of Plackett-Burman test实验号 X1 X2 X3 X4 X5 X6 X7 X8 纤维素转化率(%) 1 1 −1 −1 1 1 1 −1 1 1.55 2 1 1 1 −1 −1 1 −1 −1 4.00 3 −1 −1 1 −1 −1 1 1 1 2.98 4 1 −1 −1 −1 1 1 1 −1 2.22 5 −1 1 1 1 1 1 1 −1 1.59 6 −1 1 −1 −1 1 −1 1 1 2.41 7 1 1 −1 1 −1 −1 1 −1 2.17 8 1 −1 1 1 −1 −1 1 1 3.78 9 −1 −1 1 1 1 −1 −1 −1 1.62 10 −1 1 −1 1 −1 1 −1 1 1.69 11 −1 −1 −1 −1 −1 −1 −1 −1 1.56 12 1 1 1 −1 1 −1 −1 1 4.30 表 4 Plackett-Burman试验设计及各因素效应评价Table 4. Evaluations of Plackett-Burman experiments因素 效应 系数 系数标准误 T值 P值 显著性 常量 2.4893 0.0782 31.83 0.000 X1 1.0283 0.5142 0.0782 6.58 0.007 ** X2 0.4083 0.2042 0.0782 2.61 0.080 X3 1.1117 0.5558 0.0782 7.11 0.006 ** X4 −0.8450 −0.4225 0.0782 −5.40 0.012 * X5 −0.4150 −0.2075 0.0782 −2.65 0.077 X6 −0.3017 −0.1508 0.0782 −1.93 0.149 X7 0.0717 0.0358 0.0782 0.46 0.678 X8 0.5917 0.2958 0.0782 3.78 0.032 * 注:P<0.05,差异显著,用*表示;P<0.01,差异极显著,用**表示,表6同。 从表4可以得出,各因素对酒糟纤维素酶解效应的影响大小排序依次为:X3(酶添加量)>X1(酶解时间)>X4(酶解pH)>X8(超声波处理时间)>X5(酶解温度)>X2(酶解底物浓度)>X6(超声波处理温度)>X7(超声波功率)。其中酶添加量和酶解时间对酒糟纤维素酶解效果影响极显著(P<0.01),酶解pH和超声波处理时间对酒糟纤维素酶解效果影响显著(P<0.05),酶解温度、底物浓度和超声波处理温度、超声波功率对酶解效果影响并不显著(P>0.05),因此选择酶解时间、超声波处理时间、酶解pH、酶添加量这四个因素进行下一步响应面优化试验,将酶解温度固定为50 ℃,酶解底物浓度固定为1:20 g/mL,超声波处理温度固定为60 ℃,超声波功率固定为200 W。
2.3 响应面分析优化
Box-Behnken试验设计与结果见表5。方差分析见表6。
表 5 Box-Behnken试验设计与结果Table 5. Design and results of Box-Behnken experiment实验号 X1 X3 X4 X8 纤维素转化率(%) 1 0 0 1 −1 1.52 2 −1 −1 0 0 2.78 3 −1 0 0 −1 3.17 4 1 0 1 0 2.09 5 −1 1 0 0 3.80 6 −1 0 1 0 2.12 7 0 1 0 1 4.83 8 0 −1 0 1 3.84 9 0 −1 −1 0 2.71 10 1 0 −1 0 4.10 11 −1 0 −1 0 3.13 12 0 0 −1 −1 2.97 13 0 −1 0 −1 2.79 14 1 −1 0 0 3.83 15 0 0 0 0 5.04 16 1 0 0 1 4.21 17 0 0 −1 1 3.74 18 0 0 0 0 5.43 19 0 0 0 0 5.56 20 0 −1 1 0 2.87 21 1 1 0 0 5.05 22 0 0 0 0 5.42 23 0 1 1 0 2.49 24 0 0 0 0 5.37 25 0 0 1 1 2.48 26 0 1 −1 0 4.96 27 1 0 0 −1 4.10 28 0 1 0 −1 4.87 29 −1 0 0 1 3.44 表 6 Box-Behnken 试验方差分析结果Table 6. Variance analysis results of Box-Behnken test方差来源 平方和 自由度 均方 F值 P值 显著性 X1 2.03 1 2.03 25.8 0.0002 ** X3 4.3 1 4.3 54.5 <0.0001 ** X4 5.39 1 5.39 68.34 <0.0001 ** X8 0.81 1 0.81 10.29 0.0063 ** X1X3 1.00E-02 1 1.00E-02 0.13 0.727 X1X4 0.25 1 0.25 3.17 0.0966 X3X4 1.73 1 1.73 21.94 0.0004 ** X1X8 6.40E-03 1 6.40E-03 0.081 0.7799 X4X8 9.03E-03 1 9.03E-03 0.11 0.7401 X3X8 0.3 1 0.3 3.77 0.0726 X21 4.87 1 4.87 61.8 <0.0001 ** X24 18.67 1 18.67 236.87 <0.0001 ** X23 1.57 1 1.57 19.89 0.0005 ** X28 4.68 1 4.68 59.33 <0.0001 ** 模型 36.85 14 2.63 33.39 <0.0001 ** 残差 1.1 14 0.079 失拟项 0.95 10 0.095 2.52 0.1929 不显著 纯误差 0.15 4 0.038 总和 37.95 28 运用Design Expert 10软件对试验数据进行分析处理,得到酒糟纤维素酶解工艺的二次多元回归方程:
纤维素转化率(%)=5.36+0.41X1+0.60X3−0.67X4+0.26X8+0.050X1X3−0.25X1X4−0.66X4X3−0.040X8X1−0.27X8X3+0.048X8X4−0.87X21−0.49X23−1.70X24−0.85X28 由表6可知,回归模型P<0.0001(极显著),失拟项P=0.1929>0.05(不显著),说明试验过程中非试验因素对结果影响不大。决定系数R2=0.9709,表明模型拟合效果较好。矫正后的决定系数R2adj=0.9418,与R2接近,预测值与实际值高度相关,表明该模型准确性和通用性较好,对酒糟纤维素超声辅助酶解工艺条件分析有较好的预测作用。从表4中还可以得出一次项X1、X3、X4、X8和二次项
X21 、X23 、X24 、X28 、交互项X3X4 对酶解反应影响极显著(P<0.01),其他因素均不显著(P˃0.05)。酶添加量和酶解反应pH交互作用的响应面3D图和等高线图如图9所示。
由表6与图9可知,各因素相互作用对酒糟纤维素转化率表现出不同的影响效果,酶添加量以及酶解pH交互作用对酶解反应影响极显著(P<0.01),而其他因素交互作用对酒糟酶解反应影响不显著(P˃0.05),其原因可能是pH的离子效应对酶活性中心具有促进或抑制作用,因此随着纤维素酶的用量增大,促进或抑制作用越明显。
2.4 最佳酶解工艺验证
根据Design Expert10软件进行数据分析得出,在优化试验基础之上最优酶解参数为超声时间21.01 min,酶解时间140.16 min,酶解pH5.41,酶添加量992.34 U/g,预测酒糟纤维素的转化率理论值为5.63%。根据预测参数,结合实际操作情况,最终选取的优化酶解参数:超声波工作参数(时间21 min,温度60 ℃,功率200 W)和酶解工艺条件(时间140 min,pH5.41,添加量990 U/g,温度50 ℃,底物浓度1:20 g/mL),并且根据最终选取酶解优化参数进行验证试验以及相同酶解条件无超声处理对照实验,得到最终选取酶解酒糟纤维素转化率为5.62%±0.02%,与预测值5.63%相比,误差仅为0.01%,实际值与预测值的纤维素转化率差异不显著,表明该模型具有较好的预测作用;相同酶解条件下,无超声处理的对照组实验酒糟纤维素转化率平均为4.15%。
3. 结论
以酒糟纤维素转化率为评价指标,在单因素实验结果分析基础之上,通过Plackett-Burman试验及Box-Behnken试验对酒糟纤维素酶解反应参数进行优化,得到修正后的最佳酶解工艺参数为:超声波处理时间21 min,酶解时间140 min,酶解pH5.41,酶添加量990 U/g,超声波处理温度60 ℃,超声波功率200 W,酶解温度50 ℃,酶解底物浓度1:20 g/mL,在此条件下酒糟纤维素转化率能达到5.62%,与相同酶解条件无超声处理的对照组相比提高了35.4%。酒糟纤维素的降解是酒糟资源综合利用、开发生物制糖等方面的第一步,本文的结果表明超声对酒糟纤维素酶解反应具有显著的促进作用,是一种有效的纤维素降解途径,能为酒糟资源的开发利用提供借鉴。
-
表 1 Plackett-Burman试验设计的因素水平表
Table 1 Factors and levels of Plackett-Burman experimental design
因素 编码 低水平(−) 高水平(+) 酶解时间(min) X1 90 150 底物浓度(g/mL) X2 1:15 1:25 酶添加量(U/g) X3 600 1000 酶解pH X4 5 7 酶解温度(℃) X5 40 60 超声波处理温度(℃) X6 50 70 超声波功率(W) X7 100 300 超声波处理时间(min) X8 15 25 表 2 Box-Behnken 试验设计相关因素水平表
Table 2 Factors and levels of Box-Behnken experimental design
水平 因素 X1(min) X3(U/g) X4 X8(min) −1 90 600 5.0 15 0 120 800 6.0 20 1 150 1000 7.0 25 表 3 Plackett-Burman试验设计及响应值
Table 3 Experimental design and response values of Plackett-Burman test
实验号 X1 X2 X3 X4 X5 X6 X7 X8 纤维素转化率(%) 1 1 −1 −1 1 1 1 −1 1 1.55 2 1 1 1 −1 −1 1 −1 −1 4.00 3 −1 −1 1 −1 −1 1 1 1 2.98 4 1 −1 −1 −1 1 1 1 −1 2.22 5 −1 1 1 1 1 1 1 −1 1.59 6 −1 1 −1 −1 1 −1 1 1 2.41 7 1 1 −1 1 −1 −1 1 −1 2.17 8 1 −1 1 1 −1 −1 1 1 3.78 9 −1 −1 1 1 1 −1 −1 −1 1.62 10 −1 1 −1 1 −1 1 −1 1 1.69 11 −1 −1 −1 −1 −1 −1 −1 −1 1.56 12 1 1 1 −1 1 −1 −1 1 4.30 表 4 Plackett-Burman试验设计及各因素效应评价
Table 4 Evaluations of Plackett-Burman experiments
因素 效应 系数 系数标准误 T值 P值 显著性 常量 2.4893 0.0782 31.83 0.000 X1 1.0283 0.5142 0.0782 6.58 0.007 ** X2 0.4083 0.2042 0.0782 2.61 0.080 X3 1.1117 0.5558 0.0782 7.11 0.006 ** X4 −0.8450 −0.4225 0.0782 −5.40 0.012 * X5 −0.4150 −0.2075 0.0782 −2.65 0.077 X6 −0.3017 −0.1508 0.0782 −1.93 0.149 X7 0.0717 0.0358 0.0782 0.46 0.678 X8 0.5917 0.2958 0.0782 3.78 0.032 * 注:P<0.05,差异显著,用*表示;P<0.01,差异极显著,用**表示,表6同。 表 5 Box-Behnken试验设计与结果
Table 5 Design and results of Box-Behnken experiment
实验号 X1 X3 X4 X8 纤维素转化率(%) 1 0 0 1 −1 1.52 2 −1 −1 0 0 2.78 3 −1 0 0 −1 3.17 4 1 0 1 0 2.09 5 −1 1 0 0 3.80 6 −1 0 1 0 2.12 7 0 1 0 1 4.83 8 0 −1 0 1 3.84 9 0 −1 −1 0 2.71 10 1 0 −1 0 4.10 11 −1 0 −1 0 3.13 12 0 0 −1 −1 2.97 13 0 −1 0 −1 2.79 14 1 −1 0 0 3.83 15 0 0 0 0 5.04 16 1 0 0 1 4.21 17 0 0 −1 1 3.74 18 0 0 0 0 5.43 19 0 0 0 0 5.56 20 0 −1 1 0 2.87 21 1 1 0 0 5.05 22 0 0 0 0 5.42 23 0 1 1 0 2.49 24 0 0 0 0 5.37 25 0 0 1 1 2.48 26 0 1 −1 0 4.96 27 1 0 0 −1 4.10 28 0 1 0 −1 4.87 29 −1 0 0 1 3.44 表 6 Box-Behnken 试验方差分析结果
Table 6 Variance analysis results of Box-Behnken test
方差来源 平方和 自由度 均方 F值 P值 显著性 X1 2.03 1 2.03 25.8 0.0002 ** X3 4.3 1 4.3 54.5 <0.0001 ** X4 5.39 1 5.39 68.34 <0.0001 ** X8 0.81 1 0.81 10.29 0.0063 ** X1X3 1.00E-02 1 1.00E-02 0.13 0.727 X1X4 0.25 1 0.25 3.17 0.0966 X3X4 1.73 1 1.73 21.94 0.0004 ** X1X8 6.40E-03 1 6.40E-03 0.081 0.7799 X4X8 9.03E-03 1 9.03E-03 0.11 0.7401 X3X8 0.3 1 0.3 3.77 0.0726 X21 4.87 1 4.87 61.8 <0.0001 ** X24 18.67 1 18.67 236.87 <0.0001 ** X23 1.57 1 1.57 19.89 0.0005 ** X28 4.68 1 4.68 59.33 <0.0001 ** 模型 36.85 14 2.63 33.39 <0.0001 ** 残差 1.1 14 0.079 失拟项 0.95 10 0.095 2.52 0.1929 不显著 纯误差 0.15 4 0.038 总和 37.95 28 -
[1] 刘志云, 钟晓霞, 姚焰础, 等. 白酒糟生物饲料及其在猪生产上的应用现状[J]. 动物营养学报,2020,32(1):15−20. [LIU Z Y, ZHONG X X, YAO Y C, et al. Biological feed of white distiller’s grains and its application status in swine production[J]. Chinese Journal of Animal Nutrition,2020,32(1):15−20. doi: 10.3969/j.issn.1006-267x.2020.01.003 [2] 晓文. 2020年度全国酿酒产业产量数据[J]. 酿酒科技,2021(2):96. [XIAO W. Output data of China alcoholic drinks industry in 2020[J]. Liquor-Making Science & Technology,2021(2):96. [3] 胡志强, 李存福, 张国顺, 等. 白酒酒糟综合利用技术研究进展[J]. 山东化工,2019,48(15):76−78. [HU Z Q, LI C F, ZHANG G S, et al. Research progress of comprehensive utilization technique of distiller’s grains[J]. Shandong Chemical Industry,2019,48(15):76−78. doi: 10.3969/j.issn.1008-021X.2019.15.031 [4] 兰小艳, 陈雪玲, 张敬慧, 等. 酒糟中纤维素的降解及再利用研究[J]. 畜牧与饲料科学,2018,39(4):21−22. [LAN X Y, CHEN X L, ZHANG J H, et al. Investigation on degradation and reuse of cellulose in distiller’s grains[J]. Animal Husbandry and Feed Science,2018,39(4):21−22. doi: 10.12160/j.issn.1672-5190.2018.04.006 [5] 张伟, 林燕, 刘妍, 等. 利用秸秆制备燃料乙醇的关键技术研究进展[J]. 化工进展,2011,30(11):2417−2423. [ZHANG W, LIN Y, LIU Y, et al. Research progress in the crucial techniques of fuel ethanol production from stalks[J]. Chemical Industry and Engineering Progress,2011,30(11):2417−2423. [6] WANG W, LIANG T, BAI H Y, et al. All cellulose composites based on cellulose diacetate and nanofibrillated cellulose prepared by alkali treatment[J]. Carbohydrate Polymers,2018,179:297−304. doi: 10.1016/j.carbpol.2017.09.098
[7] 赵博, 胡尚连, 龚道勇, 等. 固体酸催化纤维素水解转化葡萄糖的研究进展[J]. 化工进展,2017,36(2):555−567. [ZHAO B, HU S L, GONG D Y, et al. New advances on hydrolysis of cellulose to glucose by solid acid[J]. Chemical Industry and Engineering Progress,2017,36(2):555−567. [8] 马文鹏, 裴芳霞, 任海伟, 等. 双酶复合水解酒糟制备可发酵糖的工艺研究[J]. 酿酒科技,2016,262(4):89−92. [MA W P, PEI F X, REN H W, et al. The preparation of fermentable sugar through the hydrolysis of distillers grains by two enzymes[J]. Liquor-Making Science & Technology,2016,262(4):89−92. [9] QU W J, MA H L, LIU B, et al. Enzymolysis reaction kinetics and thermodynamics of defatted wheat germ protein with ultrasonic pretreatment[J]. Ultrasonics Sonochemistry,2013,20(6):1408−1413. doi: 10.1016/j.ultsonch.2013.04.012
[10] PAN A D, ZENG H Y, ALAIN G B F C, et al. Heat-pretreatment and enzymolysis behavior of the lotus seed protein[J]. Food Chemistry,2016,201:230−236. doi: 10.1016/j.foodchem.2016.01.069
[11] DÁVILA I, REMÓN J, GULLÓN P, et al. Production and characterization of lignin and cellulose fractions obtained from pretreated vine shoots by microwave assisted alkali treatment[J]. Bioresource Technology,2019,289:121726. doi: 10.1016/j.biortech.2019.121726
[12] ALVIRA P, NEGRO M J, BALLESTEROS I, et al. Steam explosion for wheat straw pretreatment for sugars production[J]. Bioethanol,2016,2(1):66−75.
[13] 任海伟, 徐娜, 李金平, 等. 化学预处理提高酒糟生物质酶解糖化效果[J]. 农业工程学报,2014,30(16):239−246. [REN H W, XU N, LI J P, et al. Chemical pretreatment improving effect of enzymatic saccharification of distillers grains biomass[J]. Transactions of the Chinese Society of Agricultural Engineering,2014,30(16):239−246. doi: 10.3969/j.issn.1002-6819.2014.16.031 [14] CHEN L, CHEN J S, REN J Y, et al. Effects of ultrasound pretreatment on the enzymatic hydrolysis of soy protein isolates and on the emulsifying properties of hydrolysates[J]. Journal of Agricultural and Food Chemistry,2011,59(6):2600−2609. doi: 10.1021/jf103771x
[15] 滕超, 查沛娜, 范园园, 等. 超声波在酶解制备技术中的应用进展[J]. 江苏农业科学,2014,42(6):13−16. [TENG C, ZHA P N, FAN Y Y, et al. Progress in application of ultrasonic in enzymatic hydrolysis[J]. Jiangsu Agricultural Sciences,2014,42(6):13−16. doi: 10.3969/j.issn.1002-1302.2014.06.005 [16] ZHANG Q H, BENOIT M, VIGIER K D O, et al. Pretreatment of microcrystalline cellulose by ultrasounds: Effect of particle size in the heterogeneously-catalyzed hydrolysis of cellulose to glucose[J]. Green Chemistry,2013,15(4):963−969. doi: 10.1039/c3gc36643j
[17] YU J, ZHANG J B, HE J, et al. Combinations of mild physical or chemical pretreatment with biological pretreatment for enzymatic hydrolysis of rice hull[J]. Bioresource Technology,2009,100(2):903−908. doi: 10.1016/j.biortech.2008.07.025
[18] 赵凯, 许鹏举, 谷广烨. 3, 5-二硝基水杨酸比色法测定还原糖含量的研究[J]. 食品科学,2008(8):534−536. [ZHAO K, XU P J, GU G Y. Study on determination of reducing sugar content using 3, 5-dinitrosalicylic acid method[J]. Food Science,2008(8):534−536. doi: 10.3321/j.issn:1002-6630.2008.08.127 [19] YANG B, WILLIES D M, WYMAN C E. Changes in the enzymatic hydrolysis rate of avicel cellulose with conversion[J]. Biotechnology and Bioengineering,2006,94(6):1122−1128. doi: 10.1002/bit.20942
[20] 史和娣, 邓明磊. 关于酶促反应的非线性回归模型的探讨[J]. 科学技术创新,2017(29):20−21. [SHI H D, DENG M L. Discussion on nonlinear regression model of enzymatic reaction[J]. Scientific and Technological Innovation,2017(29):20−21. doi: 10.3969/j.issn.1673-1328.2017.29.009 [21] 余婷婷, 薛亚军. 纤维素酶水酶法提取茶籽油的条件优化及茶籽油成品分析[J]. 四川理工学院学报(自然科学版),2019,32(5):1−7. [YU T T, XUE Y J. Optimization of conditions for the extraction of tea seed oil using cellulase and analysis of the tea seed oil[J]. Journal of Sichuan University of Science & Engineering (Natural Science Edition),2019,32(5):1−7. [22] 田甜, 朱晶晶, 何瑜, 等. 一种新的羟自由基生成方法及其在亚甲基蓝降解中的应用[J]. 湖北大学学报(自然科学版),2014,36(5):447−450. [TIAN T, ZHU J J, HE Y, et al. A new method for hydroxyl radical preparation and its application on the degradation of methylene blue[J]. Journal of Hubei University (Natural Science Edition),2014,36(5):447−450. [23] 李松晔, 刘晓非, 庄旭品, 等. 棉浆粕纤维素的超声波处理[J]. 应用化学,2003(11):1030−1034. [LI S Y, LIU X F, ZHUANG X P, et al. Ultrasonic treatment of cotton pulp cellulose[J]. Chinese Journal of Applied Chemistry,2003(11):1030−1034. doi: 10.3969/j.issn.1000-0518.2003.11.003 [24] 高奇瑞, 夏金兰, 单杨, 等. 超声波空化效应对纤维素酶降解秸秆影响的研究[J]. 山东农业大学学报(自然科学版),2014,45(2):237−242. [GAO Q R, XIA J L, SHAN Y, et al. Research on wheat straw degradation by cellulase under the effect of ultrasonic cavitation[J]. Journal of Shandong Agricultural University (Natural Science Edition),2014,45(2):237−242. [25] WANG D L, YAN L F, MA X B, et al. Ultrasound promotes enzymatic reactions by acting on different targets: Enzymes, substrates and enzymatic reaction systems[J]. International Journal of Biological Macromolecules,2018,119:453−461. doi: 10.1016/j.ijbiomac.2018.07.133
[26] 黄朝汤. 超声对小麦蛋白水解物美拉德反应进程的影响[J]. 食品研究与开发,2020,41(17):44−47. [HUANG C T. Effect of ultrasound on the Millard reaction process of wheat protein hydrolysates[J]. Food Research and Development,2020,41(17):44−47.





 下载:
下载:















 下载:
下载:
