Advances in the Utilization of Plant-based Alternative Protein
-
摘要: 未来食品对食品的营养健康属性和环境友好性都提出了更高的要求。在此背景下,以“植物肉”为代表的植物基食品引起了国内外的广泛关注。作为“植物肉”生产的主要原料,植物基替代蛋白的开发和利用对食品产业链上下游都有着重要的影响。本文首先介绍了植物基替代蛋白在“植物肉”中的应用现状,阐述了植物基替代蛋白新资源挖掘的必要性;然后总结了植物基替代蛋白的来源、制备手段和加工技术,重点分析了利用高水分挤压技术重构植物蛋白纤维化结构及其机理的研究进展和3D打印技术在蛋白质成型加工方面的研究现状;最后总结了植物基替代蛋白高效利用面临的机遇和挑战,为未来植物基食品的发展方向提供了参考。Abstract: For future foods, people are caring more and more about their health promoting properties and environmental friendliness. In this background, the plant-based foods, represented by ‘plant-based meat’, have attracted lots of attention worldwide. As the major source material of ‘plant-based meat’ production, the utilization of plant-based alternative protein has important influence on both the upstream and downstream food industry. In this paper, we firstly introduces the current application of plant-based alternative protein in producing ‘plant-based meat’, demonstrating the need for exploring new resources of plant-based protein. Secondly, we summarizes the preparation and manufacturing technologies of plant-based alternative proteins, emphasizing the research progress in reconstitution of plant protein into fibrous structure using high moisture extrusion and its underlying mechanism, and 3D printing of protein-based material. Finally, we summarizes the challenges and opportunities in the efficient utilization of plant-based alternative protein, providing references for the development of plant-based foods in the future.
-
Keywords:
- future foods /
- plant-based /
- alternative protein /
- high-moisture extrusion /
- 3D printing
-
不断增长的人口数量和社会的快速发展对食品的数量和品质都提出了新的要求。未来,我们需要用什么原料来生产食品,应该用什么样的方式制造食品,以及建议消费者用何种方式来享用食品,都是食品从业者尤其是科研工作人员需要认真思考的问题。毋庸置疑的是,现代食品的生产和加工方式对人类健康和地球环境都有深远的影响[1]。未来食品,应当在最大限度减少地球资源占有和环境负担的基础上,充分利用交叉学科的前沿技术,高效制造能够满足不同人群对安全、营养、感官等方面个性化需求的食品。一方面,随着生物技术、材料科学、人工智能、感知科学等领域的快速发展,食品制造业面临着前所未有的发展机遇[2]。而我国传统的食品加工业仍然局限于产品口味、包装和营销等层面,还未从根本上进行概念和技术变革,不能满足人们对营养健康和绿色环保方面的需求[3]。另一方面,未来食品加工关系到全产业链的发展,不但与下游的消费者息息相关,而且与上游的农作物育种和种植、土地资源利用、农产品采后流通等密不可分。对未来食品的探索和食品行业的革命,对于带动农业种质资源的开发、增加农产品附加值、提高土地资源利用效率、推动绿色农业发展具有重要的意义。
在对营养健康和绿色可持续的共同考量下,植物基食品因为其节约环境资源的属性和对人类健康的益处备受青睐。与动物的养殖相比,植物种植所占有的土地、消耗的水资源和产生的温室气体都大幅度减少[4]。如果饮食中摄入更多的植物基成分,可以大大减少肥胖、糖尿病等饮食相关健康问题的发生,对癌症、心血管疾病等也有积极的预防作用[5]。因此,植物基食品的开发具有广阔的前景。本文从以“植物肉”为代表的植物基食品的角度,分析阐述了植物基替代蛋白在“植物肉”中的应用和开发利用现状及其面临的机遇和挑战,为未来植物基食品的发展方向提供了参考。
1. 植物基食品与植物肉
美国植物基食品协会(Plant Based Food Association, PBFA)给出的植物基食品定义为:由从蔬菜、水果、谷物、坚果、种子和/或豆类等植物中获得的成分组成的食品成品。另外,尽管藻类和菌类从生物学分类上不属于植物,但是仍然计入植物基成分中。2018年,美国植物基食品协会和美国国家卫生基金会(NSF International)共同推出了第一个植物基食品认证项目和标志(图1),截至目前,全美超过60家企业对其生产的600多件产品进行了植物基食品认证,可见产业和市场对植物基食品的需求和认可。据估计,未来十到二十年,消费者对植物基食品的需求将持续增长。
植物基肉制品,俗称“植物肉”,是近年来植物基食品中发展势头迅猛和极具市场价值的产品。植物肉主要以植物蛋白为原料,通过高水分挤压、3D打印、静电纺丝等技术来生产具有类似肉类结构、口感和风味的动物肉替代品[7]。植物肉产业预计在2019~2026年间将以7.91%的复合年均增长率增长,其中亚太地区将成为增长最快的市场[6]。目前,西方国家的植物肉市场已经初具规模,2019年,美国植物肉销售额为9.39亿美元,增长了18.4%,而传统肉制品销售额仅仅增长了2.7%。相比而言,我国植物肉产业仍处于起步阶段,市场占有率低,关键技术体系尚未建立,亟需加大研发力度和扩大产业规模。
2. 植物基替代蛋白在植物肉中的应用
植物肉生产中植物蛋白被用来替代动物蛋白,因此称为植物基替代蛋白(plant-based alternative protein)。目前市售的植物肉产品中应用的植物替代蛋白以大豆蛋白、豌豆蛋白和小麦蛋白为主,其次还有马铃薯蛋白、大米蛋白、绿豆蛋白等(表1)。可以看出,豆类蛋白仍然是植物替代蛋白的主战场,而其他品类的蛋白则应用较少。从营养的角度,摄入单一品类的蛋白质往往在营养上不能满足人体的全部需求,例如豆类蛋白大多甲硫氨酸和半胱氨酸含量较低,而谷物蛋白中往往赖氨酸含量低[8]。从加工的角度,单一的蛋白组分生产的产品往往在加工品质(持水性、持油性、延展性等)方面也会有所欠缺,因此倾向于混合多种蛋白组分,例如大豆-豌豆、大豆-小麦、豌豆-绿豆等。由此可见,多品类的植物蛋白资源的挖掘有助于植物肉产品的结构与品质的改进。另外,大豆蛋白如果加工处理不当容易产生“豆腥味”,影响消费者的喜爱度。更多的优质植物蛋白质资源有待开发,以打破“大豆垄断”,缓解蛋白质资源短缺。
表 1 国内外部分市售植物肉产品中应用的植物基替代蛋白[9]Table 1. Plant-based alternative proteins used in some commercial plant-based meat[9]公司 产品 植物替代蛋白a Impossible Foods 植物肉汉堡 大豆浓缩蛋白、马铃薯蛋白、大豆分离蛋白 Beyond Meat 植物肉汉堡 豌豆蛋白、大米蛋白、绿豆蛋白 Gardein 植物肉丸 大豆蛋白浓缩物、大豆分离蛋白、豌豆蛋白 Lightlife 植物肉汉堡 豌豆蛋白 Omnipork 植物肉饼 大豆浓缩蛋白、大豆分离蛋白、香菇发酵的豌豆和米蛋白 Field Roast 植物肉汉堡 小麦分离蛋白 齐善食品 植物牛排 大豆分离蛋白、豌豆蛋白 金字火腿 植物肉饼 大豆蛋白、小麦蛋白 珍肉 植物肉月饼 豌豆蛋白、大豆蛋白 株肉 植物肉碎、肉糜 大豆蛋白 双塔 植物肉鸡块 豌豆组织蛋白、豌豆分离蛋白 注:a表示数据来自产品成分标签。 3. 植物基替代蛋白的开发
3.1 植物基替代蛋白的来源
从表1可以看出,目前市场上的植物基替代蛋白种类仍然较为单一,限制了植物基肉制品的多样化和个性化开发。除了大豆、豌豆、小麦等常见植物蛋白来源外,小米、燕麦、青稞等谷物[10-11],芝麻、亚麻、油菜等油料作物种子[12-13],南瓜、番茄等蔬菜籽以及螺旋藻、小球藻等微藻中都含有丰富的蛋白质[14-16]。同时,许多农产品加工的副产物,例如辣椒干制中产生的辣椒籽、花生榨油后残留的饼粕,都富含优质蛋白质,然而这些副产物仅作为饲料原料来利用,附加值低。挖掘这些蛋白质资源并将其应用于以植物肉为代表的植物基食品,将带来巨大的经济价值和社会效益。研究者针对各种植物品类进行了大量的植物蛋白制备的研究(表2),然而目前多数仍停留在实验室研究的阶段,还未达到商业化应用的条件。
表 2 植物蛋白主要来源a,bTable 2. Major sources of plant-based proteinsa,b分类 来源 豆类 大豆、豌豆、绿豆、鹰嘴豆、黑豆、蚕豆、芸豆、竹豆、红小豆等 果蔬/
花卉/
药材等南瓜籽、番茄籽、辣椒籽、甜椒籽、油菜籽、石榴籽、葡萄籽、苹果籽、西瓜籽、甜瓜籽、火龙果籽、沙棘籽、丝瓜籽、黄瓜籽、萝卜籽、韭菜籽、芹菜籽、花椒籽、亚麻籽、棉籽、火麻籽、胡麻籽、汉麻籽、火麻籽、牡丹籽、红菇娘籽、山茶籽、辣木籽、红花籽、柠条籽、黄腊果籽、番木瓜籽、紫苏籽、奇亚籽、元宝枫籽、马齿苋籽、油茶籽、秋葵籽、仙人掌果籽、打瓜籽、马铃薯、山药、龙须菜、羊栖菜等 坚果 花生、芝麻、杏仁、莲子、桃仁、榛子、核桃、葵花籽等 谷物 大米、小米、燕麦、小麦、荞麦、玉米、青稞、紫米、黑米等 食用菌 杏鲍菇、金针菇、双孢菇、鸡腿菇、平菇、滑子菇、猴头菇、白玉菇、大球盖菇、白灵菇、滑菇等 藻类 小球藻、螺旋藻、紫球藻等 其他 四翅滨藜、油莎豆、水飞蓟、欧李仁、苜蓿叶、长萼堇菜叶、金花菜叶等 注:a表示数据主要来自于中国知网;b表示依据PBFA的植物基食品定义和饮食习惯,此处将食用菌和藻类也列入了植物基蛋白的来源。 3.2 植物基替代蛋白的制备
3.2.1 化学法
传统的蛋白质提取采用化学法,主要包括水提、碱提、酸提和有机溶剂提取。水提法一般在水中加入盐(NaCl)或表面活性剂(SDS、Triton100等)提高蛋白质溶解度[17-18],碱提和酸提利用的是蛋白质在pH远离等电点的溶液中溶解度高(植物蛋白的等电点多在pH4.5左右)[19-20],有机溶剂法利用乙醇、甲醇等提取醇溶蛋白[21-22],或利用尿素、苯酚等变性剂使蛋白质变性析出[17,23]。尽管传统方法耗时耗能,但是由于工艺简单,方法成熟,碱溶酸沉仍然是工业上应用最广泛的植物蛋白提取方式,通常用NaOH或KOH使提取液的pH在9~12左右[19,24]。料液比、碱浓度、提取温度、提取时间等都是影响提取效率的因素。利用碱提酸沉法提取大豆等油料作物中蛋白质,回收率可以达到90%[25]。然而,碱液在提高蛋白质溶解度的同时,会对某些植物蛋白的结构造成不可逆的破坏,降低蛋白质的品质。同时,工业上利用碱溶酸沉法制备植物蛋白的过程中会产生大量含盐量高的废水,回收利用难度大,给环境带来了较大的负担。因此,研究者们也在不断寻找更加温和、高效、环保的提取方式。
3.2.2 酶辅助法
酶辅助法可以提高植物蛋白的提取效率和品质。植物细胞壁由纤维素、半纤维素、果胶等物质互相交联,组成致密的结构,是蛋白质溶出的主要阻碍。纤维素酶、半纤维素酶、木聚糖酶、阿拉伯聚糖酶、果胶酶等的加入可以破坏细胞壁完整性,促进植物蛋白的溶出。蛋白酶一方面可以将植物蛋白从糖蛋白、脂蛋白等复合物中解离,另一方面可以降低蛋白质的分子量,提高溶解性。Hanmoungjai等[26]发现米糠经木瓜蛋白酶处理后蛋白得率明显提高,而纤维素酶、果胶酶、木聚糖酶等无显著影响。Rommi等[27]利用果胶水解酶使得从油菜籽饼粕中提取蛋白的效率提高了1.7倍。酶辅助法不但可以提高植物蛋白的提取效率,而且由于其处理条件相对温和,对蛋白质的结构、理化特性和功能特性有一定的保护作用[28-30]。尽管由于加酶后的目标物存在产率不稳定等问题,酶法提取植物蛋白尚未工业化大规模应用,但其环境友好性和高蛋白产量还是使得酶法提取成为未来的发展方向之一。
3.2.3 物理辅助法
超声、微波、脉冲电场、高压等物理手段被用来辅助植物蛋白的提取,以提高提取效率和蛋白质的品质。超声波在溶液中产生大量气泡突然破灭带来的空化作用、微流和冲击波产生高剪切和机械力可以破坏细胞壁和细胞膜,使得溶剂更容易进入胞内,溶出蛋白质。超声频率、时长、间隔、温度等都是影响蛋白质提取效果的重要因素[31-32]。微波处理使细胞中的极性物质,尤其是水吸收热量迅速升温,促使植物细胞膨胀,破坏细胞壁。微波处理的强度和时间也是影响蛋白质提取效率的因素[33]。脉冲电场和高压提取是辅助蛋白质提取的两种非热处理方式,相对于超声和微波对蛋白质结构的影响更小。利用短时(μm-mm)、高强度(10~80 kV/cm)的电场处理物料,脉冲电场产生的磁场和电离作用使细胞膜通透性增加,细胞内容物流出[34-36]。高压处理使物料在100~1000 MPa的压力下保持,细胞壁破裂,溶剂的穿透率增加,从而提高蛋白质的提取效率[37-38]。
3.3 植物基替代蛋白的加工技术
以生产“植物肉”为目的的植物基替代蛋白加工技术主要有低水分挤压、高水分挤压、3D打印和其他技术,其中目前最具商业化前景的是高水分挤压技术,3D打印技术由于其数字化和定制化的优势也备受关注[9,39]。
3.3.1 低水分挤压
低水分挤压技术是指在物料水分含量20%~40%时对蛋白质进行挤压膨化的工艺,分为单螺杆挤压和双螺杆挤压。单螺杆挤压的混合、分散和均化效果差,物料温差大,只适用于简单的膨化处理,而双螺杆挤压的挤出物具类似肉类的有海绵状的外观、产品柔韧性强[9,40]。低水分挤压对原料的要求范围较宽,脱脂大豆粉、大豆浓缩蛋白、大豆分离蛋白等均可作为原料。虽然低水分双螺杆挤压的产品形成的纤维结构与真肉差异较大、使用前需要复水,但由于其技术成熟、设备成本低,仍然是目前应用较多的植物蛋白肉加工技术。
3.3.2 高水分挤压
高水分挤压是在低水分挤压技术上发展起来的新型植物肉加工技术,被挤压物料的含水量约在40%~80%,一般要求物料的蛋白质含量达到60%以上[41-43]。其生产的产品具有纤维化程度较高、弹性强、营养成分损失少、无需复水等优点。高水分挤压工艺虽然还未达到大规模工业化应用,但是其技术和市场日趋成熟,将是未来的发展方向。
3.3.2.1 高水分挤压蛋白质纤维化的原理
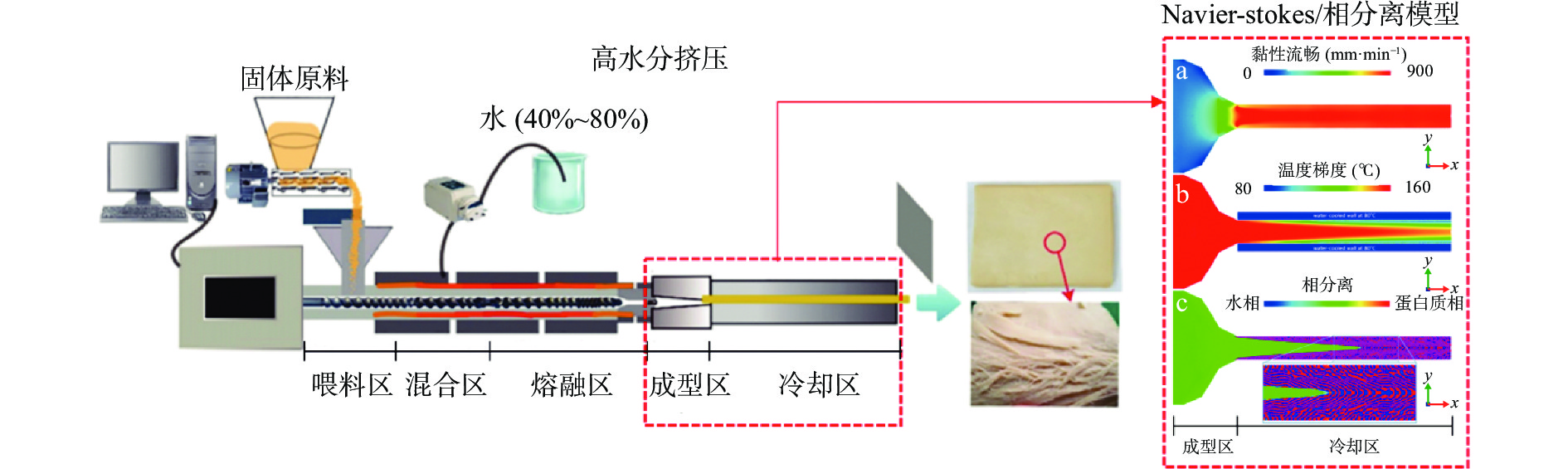
在高水分挤压过程中,植物蛋白在高温高剪切的作用下,维持蛋白结构的化学键(氢键、离子键、二硫键)和疏水作用力被破坏,蛋白质链解聚和变性,蛋白质分子链展开,团聚形成熔融体,而后发生聚集、交联和相分离,形成各向异性的取向结构,最终形成组织化蛋白[44]。蛋白质原料经高水分挤压形成组织化结构是一个复杂的过程,其中涉及了蛋白质构象转变、分子重排、亲疏水相分离等多个过程。研究表明,蛋白质相互作用力引起的分子重排主要发生在混合和蒸煮区[45-46],其中蛋白质原有的二硫键的破坏和新的二硫键的形成发挥着关键的作用[45,47-48]。而在成型和冷却区,蛋白质的基本分子排布已经形成,连续的蛋白质疏水相与水相的分离是形成纤维化结构的主要驱动力[49]。Sandoval等[50]利用Navier-Stokes/相分离模型模拟了在成型和冷却区,蛋白质熔融体在黏性流场(a)、温度梯度(b)和相分离动力学(c)的综合作用下,形成组织化蛋白的过程(图2)。
3.3.2.2 高水分挤压蛋白质纤维化的影响因素
植物蛋白的纤维化效果受到温度、水分含量、原料组成等各种因素的影响。温度对蛋白质纤维结构的形成至关重要。Patrick等比较了124和135 ℃挤压温度下的大豆蛋白纤维结构,发现135 ℃下的产品各向异性程度更高、纤维化片层更薄[49]。Pietsch等发现增加挤压温度没有影响蛋白质间的相互作用,推测温度是通过改变原料中多糖的结构来影响流变特特性和各向异性结构的形成[52]。水分含量在纤维化形成过程中也起着关键的作用,魏益民等[53]认为原料中的水分在高温下汽化形成“膜状气腔”,而后被压缩形成纤维结构。增加物料含水率有利于二硫键与氢键、二硫键与疏水作用之间协同作用的形成和蛋白质的伸展变性,从而提高蛋白质的组织化质量[54]。原料组成对纤维化结构的形成有着决定性的影响。Chiang等[55]研究表明,大豆浓缩蛋白中加入30%的小麦蛋白具有更好的组织化效果,并且与氢键的形成有关。Ning等[56]比较了大豆蛋白11S组分和7S组分对纤维化结构的影响,发现11S组分的提高使产品的延展性和保水性更好,而11S:7S比值为1.5:1时,产品的组织化结构最好。Zhang等[44]利用其构建的多尺度可视化平台,发现以花生蛋白为原料进行高水分挤压得到的植物肉纤维结构中,α-螺旋 > β-折叠 > β-转角 > 无规则卷曲;而如果利用转谷氨酰胺酶(TGase)改性后的花生蛋白为原料,得到的纤维结构中β-折叠 > α-螺旋 > β-转角 > 无规则卷曲,说明TGase改性能够调控产品的微观结构[57]。另外,该团队还发现在纤维化结构的形成中,花生球蛋白(arachin)比伴花生球蛋白(conarachin)起着更关键的作用,尤其是分子量为42、39和22 kDa的亚基[44]。同时,卡拉胶、海藻酸钠和淀粉都能够促进花生蛋白的α-螺旋向β-折叠和无规则卷曲的构象转变,促进纤维化结构的形成[58]。然而,原料的组成和结构究竟如何影响蛋白质整体构象、分子重排和亲疏水相分离等纤维化的各个过程,仍有待于探讨。
3.3.3 3D打印
3D打印又称为增材制造(additive manufacturing, AM),是基于计算机辅助设计和控制,按照预先设定的参数和路径进行层层打印,堆积成型的加工制造技术[59-60]。相较于传统制造方式,3D打印具有定制化、快速、工艺简化和形状基本不受限制等优点。目前在食品领域应用的3D打印技术有4种类型,分别是挤压式打印(extrusion)、选择性烧结(selective sintering)、粘合剂喷射(binder jetting)和喷墨打印(Inject printing)[59,61]。
3.3.3.1 挤压式3D打印与蛋白质成型
利用植物蛋白为原料进行素食加工主要应用的是挤压式3D打印。食品原料经挤压式3D打印成型主要有三种方式:一是软物质挤压,比如面团和肉泥等,通过形成能够自支撑的叠层来成型,这种方式对材料的粘度有严苛的要求;二是熔融挤压,用于巧克力、软糖等,通过材料挤出前后温度的控制达到定形的作用;三是水凝胶构建,利用化学、离子或者复合物诱导物料中的大分子交联形成水凝胶来定形,这种方式高度依赖物料的流变性能和成胶性能[62]。
3D打印技术已经应用于多种蛋白基物料的打印。蛋白质独有的在等电点附近聚集的特性使其可以通过形成颗粒或者水凝胶的方式成型,同时也可以利用蛋白质与多糖之间的结合,将其与明胶、海藻酸钠等多糖交替沉积来成型[63-64]。另外,外部的压力,包括温度、机械力、或化学干预(酸、碱、盐等)也可以诱导蛋白质的变性、聚集和成型[62]。这些技术有些已经应用在了蛋白基物料的3D打印中。Liu等[65]将浓缩乳蛋白与小麦分离蛋白以5:2的比例混合(总干物质含量35%),同时加入黄原胶和甘油,得到能够成功打印和定形的物料(图3)。将浓缩乳蛋白与酪蛋白酸钠混合,二者可以形成三维凝胶状结构,提高物料的打印后的自支撑性[66]。Liu等[67]在明胶、玉米淀粉和蔗糖体系中加入5%(w/w)的蛋清蛋白,提高了产品的硬度和弹性。大豆分离蛋白中加入黄原胶和NaCl,可以成功打印为预先设计的形状。在大豆分离蛋白中加入海藻酸钠和明胶没有增加大豆蛋白之间的交联,但是增加了产品的硬度和咀嚼性(图3)[64]。
3.3.3.2 3D打印植物肉的局限性
由于挤出式3D打印的叠层沉积方式,产品多为层状的各向异性结构,且各向异性结构的形成要依赖于挤出物在接收盘上的定向排列,因此3D打印的植物肉制品与真实肉制品的纤维状结构还存在一定差距。利用3D打印实现植物蛋白纤维化结构还需要更多的探索。3D打印过程中没有螺杆的强力挤压和剪切作用,因此需要采取附加手段来打开蛋白链和使蛋白质变性和解聚,比如化学或酶法辅助。同时,目前蛋白基物料的食品3D打印普遍在低温下进行(低于60 ℃),也是蛋白质无法解聚的原因之一,因此将超高温喷头(>100 ℃)和分段控温装置应用于食品3D打印是我们探索采用熔融挤压的方式对蛋白质进行结构重组的可能性的另一种方式。
3.3.4 其他技术
除低水分挤压、高水分挤压和3D打印技术外,许多其他加工技术也在逐步发展和应用到植物蛋白加工过程中。例如,双阶或多级挤压技术(Two-stage/multi-stage extrusion)将两台或多台挤压机的并联或串联,使得挤压机能量输入控制更精确,Wenger公司利用该技术制备了片状模拟肉。以超临界流体挤压技术(Supercritical fluid extrusion)为代表的的冷挤压技术,能够在相对低温度(<100 ℃)、低剪切(<100 r/min)的作用下重构浓缩乳清蛋白的结构,赋予其良好的热稳定性和水包油乳化性[68-69]。瓦赫宁根大学Atze Jan van der Goot教授团队发明的Shear cell技术,依靠稳定的剪切流场来重塑高分子结构,能耗较低,已经开发了第6代耐高温(>100 ℃)和实验室通用的设备,但尚未产业化[70]。
3.4 植物基替代蛋白利用的挑战和发展方向
尽管以植物肉为代表的植物基食品的市场前景广阔,植物替代蛋白的开发仍然面临着诸多挑战:
植物基替代蛋白的高效和绿色制备。植物替代蛋白的高效和低成本制备是其市场化应用的前提。这一方面取决于植物原料的低成本供应,另一方面依赖于成熟的产业化提取技术。低成本原料目前主要来自于农产品加工的副产物,如大豆粕、花生粕等,但这不能够满足未来对植物替代蛋白的多样化的需求。在多元化植物替代蛋白的需求牵引之下,发展定向育种、立体种植、水培种植等新型农业将是未来的发展方向。成熟的产业化提取技术不但要考虑提取效率和产量,同时需要兼顾能耗、环保等方面。目前产业上广泛应用的“碱提酸沉法”制备植物蛋白产生大量高电解质废水,给环境带来了极大的负担。如何通过物理、化学和酶法的有机结合,探索绿色、环保、可持续的制备体系也是植物替代蛋白利用的发展方向[25]。
植物基替代蛋白加工的精准调控。虽然通过高水分挤压等技术成功实现了植物蛋白的纤维化结构重组,但如何精密调控蛋白质结构仍是研究的难点。在原料层面,植物蛋白组成复杂、构象多样,受剪切力、温度、时间等加工参数的影响大[51]。在设备层面,对指标参数的感知、纤维化过程的数字化模拟和调控仍然具有极大的挑战。研发挤压-红外光谱仪、拉曼光谱仪等设备联用的在线检测系统,研发软件模拟系统和智能控制技术,构建挤压-3D打印联用的自动化和个性化加工系统[71],实现挤压过程的全程监控、精准控制、个性化设计,是今后植物替代蛋白加工的研发方向。
植物基替代蛋白的营养和安全性评价。动物蛋白长期以来为人类提供了全面的氨基酸供应和维生素等其他营养素。大多数动物源蛋白质的蛋白消化率校正后的氨基酸得分(PDCAAS)超过或接近于1.0,被认为是完全的蛋白质来源,而许多植物蛋白中往往缺乏一种或多种必需氨基酸,PDCAAS得分普遍较动物蛋白低[72]。因此,对植物基替代蛋白及其产品的营养学评价也不容忽视[73]。另外,花生、大豆等蛋白的致敏性问题也是关系到产品安全性的重要因素。
植物基替代蛋白的风味和口感调控。肉制品中的脂肪、血管等组织的存在赋予了肉类多汁、嫩滑的口感和饱满、独特的香气,相比之下植物替代蛋白产品往往风味单薄、多汁性差。目前多以加入香精、色素等方式调味,远远不能够还原肉类的特征风味。另外,某些植物蛋白如大豆蛋白处理不当容易产生“豆腥味”,虽然研究者们开发了酶解、氨改性等方法对大豆蛋白的风味进行改善,但是在呈味机制和安全高效改性方面还需深入的探讨。
4. 结语
未来食品在满足人类对数量和质量的要求的同时,将最大程度的减少对资源的占有和对环境的负担。以“植物肉”为代表的植物基食品受到越来越多的青睐,产业规模不断扩大,带动了植物替代蛋白的开发和利用。目前植物基替代蛋白的商业化面临着品种单一、加工技术瓶颈等问题。植物基替代蛋白新资源的挖掘对产品的多元化开发和农业种质资源利用具有重要的意义。利用高水分挤压重构植物替代蛋白的纤维化结构的技术相对成熟,而利用3D打印技术进行蛋白质成型加工还需要更多的探索,其他技术也得到逐步发展。综上,植物基替代蛋白在低成本高效制备、加工过程精准化控制、营养和安全性评价以及风味和口感调控等方面面临巨大的挑战,亟需更多的研究来加快推进其产业化应用。
-
表 1 国内外部分市售植物肉产品中应用的植物基替代蛋白[9]
Table 1 Plant-based alternative proteins used in some commercial plant-based meat[9]
公司 产品 植物替代蛋白a Impossible Foods 植物肉汉堡 大豆浓缩蛋白、马铃薯蛋白、大豆分离蛋白 Beyond Meat 植物肉汉堡 豌豆蛋白、大米蛋白、绿豆蛋白 Gardein 植物肉丸 大豆蛋白浓缩物、大豆分离蛋白、豌豆蛋白 Lightlife 植物肉汉堡 豌豆蛋白 Omnipork 植物肉饼 大豆浓缩蛋白、大豆分离蛋白、香菇发酵的豌豆和米蛋白 Field Roast 植物肉汉堡 小麦分离蛋白 齐善食品 植物牛排 大豆分离蛋白、豌豆蛋白 金字火腿 植物肉饼 大豆蛋白、小麦蛋白 珍肉 植物肉月饼 豌豆蛋白、大豆蛋白 株肉 植物肉碎、肉糜 大豆蛋白 双塔 植物肉鸡块 豌豆组织蛋白、豌豆分离蛋白 注:a表示数据来自产品成分标签。 表 2 植物蛋白主要来源a,b
Table 2 Major sources of plant-based proteinsa,b
分类 来源 豆类 大豆、豌豆、绿豆、鹰嘴豆、黑豆、蚕豆、芸豆、竹豆、红小豆等 果蔬/
花卉/
药材等南瓜籽、番茄籽、辣椒籽、甜椒籽、油菜籽、石榴籽、葡萄籽、苹果籽、西瓜籽、甜瓜籽、火龙果籽、沙棘籽、丝瓜籽、黄瓜籽、萝卜籽、韭菜籽、芹菜籽、花椒籽、亚麻籽、棉籽、火麻籽、胡麻籽、汉麻籽、火麻籽、牡丹籽、红菇娘籽、山茶籽、辣木籽、红花籽、柠条籽、黄腊果籽、番木瓜籽、紫苏籽、奇亚籽、元宝枫籽、马齿苋籽、油茶籽、秋葵籽、仙人掌果籽、打瓜籽、马铃薯、山药、龙须菜、羊栖菜等 坚果 花生、芝麻、杏仁、莲子、桃仁、榛子、核桃、葵花籽等 谷物 大米、小米、燕麦、小麦、荞麦、玉米、青稞、紫米、黑米等 食用菌 杏鲍菇、金针菇、双孢菇、鸡腿菇、平菇、滑子菇、猴头菇、白玉菇、大球盖菇、白灵菇、滑菇等 藻类 小球藻、螺旋藻、紫球藻等 其他 四翅滨藜、油莎豆、水飞蓟、欧李仁、苜蓿叶、长萼堇菜叶、金花菜叶等 注:a表示数据主要来自于中国知网;b表示依据PBFA的植物基食品定义和饮食习惯,此处将食用菌和藻类也列入了植物基蛋白的来源。 -
[1] McClements D J. Future foods: How modern science is transforming the way we eat[M]. Springer, 2019.
[2] 陈坚. 中国食品科技: 从2020到2035[J]. 中国食品学报,2020,19(12):1−5. [Chen J. Food science and technology in China: from 2020 to 2035[J]. Journal of Chinese Institute of Food Science and Technology,2020,19(12):1−5. [3] 周景文, 张国强, 赵鑫锐, 等. 未来食品的发展: 植物蛋白肉与细胞培养肉[J]. 食品与生物技术学报,2020,39(10):1−8. [Zhou J W, Zhang G Q, Zhao X R, et al. Future of food: Plant-based and cell-cultured meat[J]. Journal of Food Science and Biotechnology,2020,39(10):1−8. doi: 10.3969/j.issn.1673-1689.2020.10.001 [4] Pimentel D, Pimentel M. Sustainability of meat-based and plant-based diets and the environment[J]. American Journal of Clinical Nutrition,2003,78(3 SUPPL.):660−663.
[5] Song M, Fung T T, Hu F B, et al. Association of animal and plant protein intake with all-cause and cause-specific mortality[J]. JAMA Internal Medicine,2016,176(11):1728.
[6] Mordor Intelligence. Meat substitutes market–growth, trends, and forecast (2019-2026)[EB/OL]. https://www.valuemarketresearch.com/report/meat-substitutes-market.
[7] 江连洲, 张鑫, 窦薇, 等. 植物基肉制品研究进展与未来挑战[J]. 中国食品学报,2013,53(9):1689−1699. [Jiang L Z, Zhang X, Dou W, et al. Advance and challenges in plant-based meat[J]. Journal of Chinese Institute of Food Science and Technology,2013,53(9):1689−1699. [8] Young V R, Pellett P L. Plant proteins in relation to human protein and amino acid nutrition[J]. American Journal of Clinical Nutrition,1994,59(5 Suppl):1203S.
[9] 欧雨嘉, 郑明静, 曾红亮, 等. 植物蛋白肉研究进展[J]. 食品与发酵工业,2020,46(12):299−305. [Ou Y J, Zheng M J, Zeng H L, et al. Advance in plant-based meat reasearch[J]. Food and Fermentation Industries,2020,46(12):299−305. [10] 王妙玲, 张彩猛, 李兴飞, 等. 水媒法燕麦分离蛋白的制备工艺[J]. 食品与发酵工业,2021. [Wang M L, Zhang C M, Li X F, et al. Study on the preparation of oat protein isolate by aqueous extraction method[J]. Food and Fermentation Industries,2021. [11] 张凡, 李书田, 王显瑞, 等. 小米分离蛋白提取方法优化及对蛋白组成的影响[J]. 中国食品学报,2021,22(2):161−170. [Zhang F, Li S T, Wang X R, et al. Extraction method optimization of foxtail millet isolated protein and its effect on protein composition[J]. Journal of Chinese Institute of Food Science and Technology,2021,22(2):161−170. [12] 姚思含, 廖敏和, 康佳欣, 等. 优化酶辅助三相法提取亚麻籽油、亚麻籽蛋白和亚麻籽胶[J/OL]. 中国油脂: 1−12[2021-08-11]. https://doi.org/10.19902/j.cnki.zgyz.1003-7969.2021.05.102. Yao S, Liao M, Kang J, et al. The enzyme-assisted three-phase partitioning was optimized to extract flaxseed oil, flaxseed protein and flaxseed gum[J/OL]. China Oils and Fats:1−12[2021-08-11]. https://doi.org/10.19902/j.cnki.zgyz.1003-7969.2021.05.102.
[13] 翟晓娜, 师建芳, 赵慧凝, 等. 菜籽饼粕蛋白的提取、功能特性及其在食品中应用的研究进展[J]. 食品工业科技,2021,42(12):389−397. [Zhai X N, Shi J F, Zhao H N, et al. Extraction, functional properties and food applications of rapeseed meal protein isolates[J]. Science and Technology of Food Industry,2021,42(12):389−397. [14] 马燕, 孟伊娜, 邹淑萍, 等. 高压脱脂辣椒籽分离蛋白提取工艺优化及其功能特性研究[J]. 中国调味品,2020,45(8):54−60. [Ma Y, Meng Y N, Zou S P, et al. Study on extraction process optimization and functional properties of high-pressure degreased capsicum seed protein isolate[J]. China Condiment,2020,45(8):54−60. doi: 10.3969/j.issn.1000-9973.2020.08.012 [15] 孔凡, 何东平, 雷芬芬, 等. 不同程度水解对南瓜籽蛋白功能性质的影响[J]. 粮食与油脂,2020,33(10):91−94. [Kong F, He D P, Lei F F, et al. Effects of different degrees of hydrolysis on the functional properties of pumpkin seed protein[J]. Cereals & Oils,2020,33(10):91−94. doi: 10.3969/j.issn.1008-9578.2020.10.023 [16] 姜国庆, 闫秋丽, 李东, 等. 螺旋藻中藻蓝蛋白提取、纯化及稳态化研究进展[J]. 食品安全质量检测学报,2021,12(6):2333−2338. [Jiang G, Yan Q, Li D, et al. Research progress on separation, purification and stabilization of phycocyanin from Spirulina[J]. Journal of Food Safety and Quality,2021,12(6):2333−2338. [17] Chatterjee M, Gupta S, Bhar A, et al. Optimization of an efficient protein extraction protocol compatible with two-dimensional electrophoresis and mass spectrometry from recalcitrant phenolic rich roots of chickpea (Cicer arietinum L.)[J]. International Journal of Proteomics,2012,2012:1−10.
[18] Feyzi S, Varidi M, Zare F, et al. Fenugreek(Trigonella foenum Graecum) seed protein isolate: Extraction optimization, amino acid composition, thermo and functional properties[J]. Journal of the Science of Food and Agriculture,2015,95(15):3165−3176. doi: 10.1002/jsfa.7056
[19] Du M, Xie J, Gong B, et al. Extraction, physicochemical characteristics and functional properties of mung bean protein[J]. Food Hydrocolloids,2018,76:131−140. doi: 10.1016/j.foodhyd.2017.01.003
[20] Gerliani N, Hammami R, Aïder M. Assessment of the extractability of protein-carbohydrate concentrate from soybean meal under acidic and alkaline conditions[J]. Food Bioscience,2019,28:116−124. doi: 10.1016/j.fbio.2019.01.004
[21] Capellini M C, Giacomini V, Cuevas M S, et al. Rice bran oil extraction using alcoholic solvents: Physicochemical characterization of oil and protein fraction functionality[J]. Industrial Crops and Products,2017,104:133−143.
[22] Chen R, Wang X J, Zhang Y Y, et al. Simultaneous extraction and separation of oil, proteins, and glucosinolates from Moringa oleifera seeds[J]. Food Chemistry,2019,300:125162. doi: 10.1016/j.foodchem.2019.125162
[23] Bose U, Broadbent J A, Byrne K, et al. Optimisation of protein extraction for in-depth profiling of the cereal grain proteome[J]. Journal of Proteomics,2019,197:23−33. doi: 10.1016/j.jprot.2019.02.009
[24] Mechmeche M, Kachouri F, Chouabi M, et al. Optimization of extraction parameters of protein isolate from tomato seed using response surface methodology[J]. Food Analytical Methods,2017,10(3):809−819. doi: 10.1007/s12161-016-0644-x
[25] Kumar M, Tomar M, Potkule J, et al. Advances in the plant protein extraction: Mechanism and recommendations[J]. Food Hydrocolloids,2021,115(January):106595.
[26] Hanmoungjai P, Pyle D L, Niranjan K. Enzyme-assisted water-extraction of oil and protein from rice bran[J]. Journal of Chemical Technology and Biotechnology,2002,77(7):771−776. doi: 10.1002/jctb.635
[27] Rommi K, Hakala T K, Holopainen U, et al. Effect of enzyme-aided cell wall disintegration on protein extractability from intact and dehulled rapeseed(Brassica rapa L. and Brassica napus L.) press cakes[J]. Journal of Agricultural and Food Chemistry,2014,62(32):7989−7997. doi: 10.1021/jf501802e
[28] Görgüç A, Özer P, Yılmaz F M. Microwave-assisted enzymatic extraction of plant protein with antioxidant compounds from the food waste sesame bran: Comparative optimization study and identification of metabolomics using LC/Q-TOF/MS[J]. Journal of Food Processing and Preservation,2020,44(1):1−11.
[29] Ngoh Y Y, Gan C Y. Enzyme-assisted extraction and identification of antioxidative and α-amylase inhibitory peptides from Pinto beans (Phaseolus vulgaris cv. Pinto)[J]. Food Chemistry,2016,190:331−337. doi: 10.1016/j.foodchem.2015.05.120
[30] Tirgar M, Silcock P, Carne A, et al. Effect of extraction method on functional properties of flaxseed protein concentrates[J]. Food Chemistry,2017,215:417−424. doi: 10.1016/j.foodchem.2016.08.002
[31] Vernès L, Abert-Vian M, El Maâtaoui M, et al. Application of ultrasound for green extraction of proteins from Spirulina. Mechanism, optimization, modeling, and industrial prospects[J]. Ultrasonics Sonochemistry,2019,54(February):48−60.
[32] Zhang Y, Wang B, Zhang W, et al. Effects and mechanism of dilute acid soaking with ultrasound pretreatment on rice bran protein extraction[J]. Journal of Cereal Science,2019,87(December 2018):318−324.
[33] Khan S H, Butt M S, Sharif M K, et al. Functional properties of protein isolates extracted from stabilized rice bran by microwave, dry heat, and parboiling[J]. Journal of Agricultural and Food Chemistry,2011,59(6):2416−2420. doi: 10.1021/jf104177x
[34] Xue D, Farid M M. Pulsed electric field extraction of valuable compounds from white button mushroom (Agaricus bisporus)[J]. Innovative Food Science and Emerging Technologies,2015,29:178−186. doi: 10.1016/j.ifset.2015.03.012
[35] Yu X, Gouyo T, Grimi N, et al. Pulsed electric field pretreatment of rapeseed green biomass (stems) to enhance pressing and extractives recovery[J]. Bioresource Technology,2016,199:194−201.
[36] Zhou Y, He Q, Zhou D. Optimization extraction of protein from mussel by high-intensity pulsed electric fields[J]. Journal of Food Processing and Preservation,2017,41(3).
[37] Zhao J, Zhou T, Zhang Y, et al. Optimization of arachin extraction from defatted peanut (Arachis hypogaea) cakes and effects of ultra-high pressure (UHP) treatment on physiochemical properties of arachin[J]. Food and Bioproducts Processing,2015,95(17):38−46.
[38] Jung S, Mahfuz A A. Low temperature dry extrusion and high-pressure processing prior to enzyme-assisted aqueous extraction of full fat soybean flakes[J]. Food Chemistry,2009,114(3):947−954. doi: 10.1016/j.foodchem.2008.10.044
[39] Mattice K D, Marangoni A G. Comparing methods to produce fibrous material from zein[J]. Food Research International,2020:128.
[40] Chiang A. Protein-protein interaction of soybean protein from extrusion processing[J]. 2007(December): 105.
[41] Zhang J, Liu L, Zhu S, et al. Texturisation behaviour of peanut-soy bean/wheat protein mixtures during high moisture extrusion cooking[J]. International Journal of Food Science and Technology,2018,53(11):2535−2541. doi: 10.1111/ijfs.13847
[42] Akdogan H. High moisture food extrusion[J]. International Journal of Food Science and Technology,1999,34(3):195−207. doi: 10.1046/j.1365-2621.1999.00256.x
[43] 王强, 张金闯. 高水分挤压技术的研究现状、机遇及挑战[J]. 中国食品学报,2018,18(7):1−9. [Wang Q, Zhang J C. Research status, opportunities and challenges of high moisture extrusion technology[J]. Journal of Chinese Institute of Food Science and Technology,2018,18(7):1−9. [44] Zhang J, Liu L, Jiang Y, et al. Converting peanut protein biomass waste into《double Green》 meat substitutes using a high-moisture extrusion process: A multiscale method to explore a process forforming a meat-like fibrous structure[J]. Journal of Agricultural and Food Chemistry,2019,67(38):10713−10725. doi: 10.1021/acs.jafc.9b02711
[45] Liu K S, Hsieh F H. Protein-protein interactions in high moisture-extruded meat analogs and heat-induced soy protein gels[J]. JAOCS, Journal of the American Oil Chemists’ Society,2007,84(8):741−748. doi: 10.1007/s11746-007-1095-8
[46] Hong B, Xie T, Gao Y, et al. The effect of raw material system on fibrous structure for high moisture textured protein[J]. Journal of the Chinese Cereals and Oils Association,2016,31(2):23−27.
[47] Pietsch V L, Karbstein H P, Emin M A. Kinetics of wheat gluten polymerization at extrusion-like conditions relevant for the production of meat analog products[J]. Food Hydrocolloids,2018,85(June):102−109.
[48] Liu K S, Hsieh F H. Protein-protein interactions during high-moisture extrusion for fibrous meat analogues and comparison of protein solubility methods using different solvent systems[J]. Journal of Agricultural and Food Chemistry,2008,56(8):2681.
[49] Wittek P, Zeiler N, Karbstein H P, et al. High moisture extrusion of soy protein: investigations on the formation of anisotropic product structure[J]. Foods,2021,10(1):102. doi: 10.3390/foods10010102
[50] Sandoval Murillo J L, Osen R, Hiermaier S, et al. Towards understanding the mechanism of fibrous texture formation during high-moisture extrusion of meat substitutes[J]. Journal of Food Engineering,2019,242(August 2018):8−20.
[51] Zhang J, Liu L, Liu H, et al. Changes in conformation and quality of vegetable protein during texturization process by extrusion[J]. Critical Reviews in Food Science and Nutrition,2019,59(20):3267−3280. doi: 10.1080/10408398.2018.1487383
[52] Pietsch V L, Bühler J M, Karbstein H P, et al. High moisture extrusion of soy protein concentrate: Influence of thermomechanical treatment on protein-protein interactions and rheological properties[J]. Journal of Food Engineering,2019,251(December 2018):11−18.
[53] 魏益民, 赵多勇, 康立宁, 等. 高水分大豆蛋白组织化生产工艺和机理分析[J]. 农业工程学报,2006,22(10):193−197. [Wei Y M, Zhao D Y, Kang L N, et al. Processing and mechanism of high moisture textured soy protein[J]. Transactions of the Chinese Society of Agricultural,2006,22(10):193−197. doi: 10.3321/j.issn:1002-6819.2006.10.043 [54] 陈锋亮, 魏益民, 张波. 物料含水率对大豆蛋白挤压产品组织化质量的影响[J]. 中国农业科学,2010,43(4):805−811. [Chen F L, Wei Y M, Zhang B. Effect of moisture content on quality of texturization of product extruded from soy protein isolate[J]. Scientia Agricultura Sinica,2010,43(4):805−811. doi: 10.3864/j.issn.0578-1752.2010.04.018 [55] Chiang J H, Loveday S M, Hardacre A K, et al. Effects of soy protein to wheat gluten ratio on the physicochemical properties of extruded meat analogues[J]. Food Structure,2019:19.
[56] Ning L, Villota R. Influence of 7S and 11S globulins on the extrusion performance of soy protein concentrates[J]. Journal of Food Processing and Preservation,1994(18):421−436.
[57] Zhang J, Chen Q, Liu L, et al. High-moisture extrusion process of transglutaminase-modified peanut protein: Effect of transglutaminase on the mechanics of the process forming a fibrous structure[J]. Food Hydrocolloids,2021:112.
[58] Zhang J, Liu L, Jiang Y, et al. High-moisture extrusion of peanut protein-/carrageenan/sodium alginate/wheat starch mixtures: Effect of different exogenous polysaccharides on the process forming a fibrous structure[J]. Food Hydrocolloids,2020,99(July 2019):105311.
[59] Dankar I, Haddarah A, Omar F E L, et al. 3D printing technology: The new era for food customization and elaboration[J]. Trends in Food Science and Technology,2018,75(July 2017):231−242.
[60] Wong K V, Hernandez A. A review of additive manufacturing[J]. ISRN Mechanical Engineering,2012,2012:1−10.
[61] Liu Z, Zhang M, Bhandari B, et al. 3D printing: Printing precision and application in food sector[J]. Trends in Food Science and Technology,2017,69:83−94. doi: 10.1016/j.jpgs.2017.08.018
[62] Godoi F C, Prakash S, Bhandari B R. 3D printing technologies applied for food design: Status and prospects[J]. Journal of Food Engineering,2016,179:44−54. doi: 10.1016/j.jfoodeng.2016.01.025
[63] Chen Y, Zhang M, Phuhongsung P. 3D printing of protein-based composite fruit and vegetable gel system[J]. LWT,2021,141(September 2020):110978.
[64] Chen J, Mu T, Goffin D, et al. Application of soy protein isolate and hydrocolloids based mixtures as promising food material in 3D food printing[J]. Journal of Food Engineering,2019,261(April):76−86.
[65] Liu Y, Liu D, Wei G, et al. 3D printed milk protein food simulant: Improving the printing performance of milk protein concentration by incorporating whey protein isolate[J]. Innovative Food Science and Emerging Technologies,2018,49(July):116−126.
[66] Liu Y, Yu Y, Liu C, et al. Rheological and mechanical behavior of milk protein composite gel for extrusion-based 3D food printing[J]. LWT,2019,102(August 2018):338−346.
[67] Liu L, Meng Y, Dai X, et al. 3D printing complex egg white protein objects: Properties and optimization[J]. Food and Bioprocess Technology,2019,12(2):267−279. doi: 10.1007/s11947-018-2209-z
[68] Nor Afizah M, Rizvi S S H. Functional properties of whey protein concentrate texturized at acidic pH: Effect of extrusion temperature[J]. LWT-Food Science and Technology,2014,57(1):290−298. doi: 10.1016/j.lwt.2014.01.019
[69] Ruttarattanamongkol K, Nor Afizah M, Rizvi S S H. Stability and rheological properties of corn oil and butter oil emulsions stabilized with texturized whey proteins by supercritical fluid extrusion[J]. Journal of Food Engineering,2015,166:139−147. doi: 10.1016/j.jfoodeng.2015.06.005
[70] Steijn A C M Van, Steenbergen W C, Goot A J Van Der. A cell for making an anisotropic-structured product from a starting material when being subjected to a shear force and heated and a method[P]. 2021.
[71] Pietrzak K, Isreb A, Alhnan M A. A flexible-dose dispenser for immediate and extended release 3D printed tablets[J]. European Journal of Pharmaceutics and Biopharmaceutics,2015,96:380−387. doi: 10.1016/j.ejpb.2015.07.027
[72] Hertzler S R, Lieblein-Boff J C, Weiler M, et al. Plant proteins: Assessing their nutritional quality and effects on health and physical function[J]. Nutrients,2020,12(12):1−27.
[73] Estell M, Hughes J, Grafenauer S. Plant protein and plant-based meat alternatives: Consumer and nutrition professional attitudes and perceptions[J]. Sustainability (Switzerland),2021,13(3):1−18.






 下载:
下载:

 下载:
下载:
