Analysis of the Potential Molecular Mechanism of Donkey Bone Collagen Promoting Skin Wound Healing by High-throughput Sequencing
-
摘要: 探讨驴骨胶原蛋白对成纤维细胞(NHDFs细胞)增殖、迁移和I型胶原蛋白分泌的影响以及可能的作用通路。通过八肽胆囊收缩素(CCK-8)法、5-溴脱氧尿嘧啶核苷(BrdU)法和划痕实验,研究驴骨胶蛋白对成纤维细胞增殖和迁移的影响,并利用转录组测序技术(RNA-seq)分析驴骨胶原蛋白作用于成纤维细胞的差异表达基因。结果表明,驴骨胶原蛋白对NHDFs细胞无毒性,且在0.16~5.0 g/mL内对NHDFs细胞有一定的促生长作用。0.75~1.50 g/mL的驴骨胶原蛋白能够促进NHDFs细胞增殖,且驴骨胶原蛋白对NHDFs细胞增殖的影响呈现剂量依赖关系。1.50 g/mL的驴骨胶原蛋白可显著促进NHDFs细胞迁移和I型胶原蛋白的分泌。驴骨胶原蛋白作用于成纤维细胞后,共筛选出384个差异表达基因,其中172个基因上调,212个基因下调。GO功能富集分析结果表明,差异表达基因与中性粒细胞趋化性、中性粒细胞迁移、粒细胞趋化性等有关;KEGG通路富集分析表明,差异基因参与细胞因子-细胞因子受体相互作用、化学致癌、IL-17和TNF等重要生物学通路。推测,驴骨胶原蛋白可能通过IL-17和TNF-α介导CXCL趋化因子发挥促进皮肤伤口愈合的作用。本文明确了驴骨胶原蛋白促进伤口愈合的效果,填补驴骨胶原蛋白促进伤口愈合的研究空白,为驴骨胶原蛋白高值转化提供了思路。Abstract: To explore the effects of donkey bone collagen on the proliferation, migration and secretion of type I collagen of fibroblasts (NHDFs) and its possible signal pathways, the effects of donkey bone collagen on the proliferation and migration of fibroblasts were studied by CCK-8, BrdU and scratch test, and the differentially expressed genes of donkey bone collagen acting on fibroblasts were analyzed by RNA-seq. The results showed that donkey bone collagen had no toxicity to NHDFs cells, and could promote the growth of NHDFs cells within 0.16~5.0 g/mL. 0.75~1.50 g/mL donkey bone collagen could promote the proliferation of NHDFs cells, and the effect of donkey bone collagen on the proliferation of NHDFs cells showed a dose-dependent relationship. 1.50 g/mL donkey bone collagen could significantly promote the migration of NHDFs cells and the secretion of type I collagen. After donkey bone collagen acted on fibroblasts, 384 differentially expressed genes were screened out, of which 172 genes were up-regulated and 212 genes were down-regulated. The results of GO functional enrichment analysis showed that differentially expressed genes were related to neutrophil chemotaxis, neutrophil migration and granulocyte chemotaxis. Enrichment analysis of KEGG pathway showed that differential genes were involved in important biological pathways such as cytokine-cytokine receptor interaction, chemical carcinogenesis, IL-17 and TNF signaling pathway. It was speculated that donkey bone collagen may promote skin wound healing through IL-17 and TNF-α-mediated CXCL chemokines. It clarified the effect of donkey bone collagen in promoting wound healing, filled the gap in the research of donkey bone collagen in promoting wound healing, and would provide ideas for the high-value transformation of donkey bone collagen.
-
皮肤伤口愈合是一个复杂的过程,包括炎症、增殖和重塑等一系列连续和重叠的病理生理过程。这一过程涉及多种细胞、细胞因子、生长因子和细胞外基质间的相互作用[1]。据统计,2013年全世界约有2000万人受慢性伤口的困扰,且随着人口老龄化的加重、肥胖和糖尿病等人群的不断上升,遭受困扰的人群可能会继续增加[2]。因此,寻找安全有效的促进伤口愈合的功效成分成为了研究热点。现代研究表明,使用胶原蛋白等天然成分可有效改善伤口愈合过程。胶原蛋白发挥趋化作用,促进成纤维细胞黏附到伤口,并能有效促进成纤维细胞的增殖[3]。胶原蛋白还能激活巨噬细胞[4],诱导细胞因子和生长因子的表达,促进伤口愈合过程中的血管生成[5]。此外,胶原蛋白还能促进伤口组织中胶原沉积和组织重塑[6],进一步促进伤口愈合。据报道,牛骨胶原寡肽[7-8]、鹿茸胶原蛋白[9]、马胶原蛋白[10]、鱼皮胶原蛋白[11-13]、鱼鳞胶原蛋白[14]和鱼骨胶原蛋白[3]等均可有效促进伤口愈合。
胶原蛋白主要来源于猪、牛的皮和骨,渔业来源的胶原蛋白正在逐年增加。但因猪、牛来源的胶原蛋白存在疯牛病、口蹄疫及宗教原因的风险,渔业来源的胶原蛋白尤其冷水鱼胶原蛋白稳定差、流变性差[15],限制了猪、牛以及渔业来源胶原蛋白的广泛应用。马和驴几乎没有人畜共患病[16-17]和报道的免疫反应[18],使得马和驴胶原蛋白的开发逐渐成为研究热点。据Gallo等[19]报道,马腱胶原材料具有抗炎、镇痛、止血、刺激血管生成和成纤维细胞迁移的能力。但是,关于驴骨胶原蛋白促进伤口愈合的研究尚未报道。
因此,本研究拟通过驴骨胶原蛋白对成纤维细胞增殖、迁移以及I型胶原蛋白分泌量的影响,初步探究驴骨胶原蛋白促进伤口愈合的作用,并采用转录组学测序技术(RNA Sequencing,RNA-Seq)筛选驴骨胶原蛋白作用于成纤维细胞后的差异表达基因以及作用通路,揭示驴骨胶原蛋白促进伤口愈合的可能作用机制,以期为今后驴骨胶原蛋白的开发及应用提供科学依据。
1. 材料与方法
1.1 材料与仪器
驴骨 山东天龙驴产业研究院;胎牛血清(FBS)、PBS、青霉素/链霉素、DMEM培养基 Gibco公司;CCK-8试剂盒 上海碧云天生物技术有限公司;BrdU试剂盒 Roche公司;人I型胶原蛋白ELISA试剂盒 Cusabio公司;人皮肤成纤维细胞(NHDFs) ATCC细胞库;人成纤维细胞(FB细胞) 博溪生物科技有限公司。
MULTISKAN GO多功能酶标仪、371二氧化碳培养箱、NanoDrop 2000微量紫外分光光度计、ABI 7500荧光定量PCR仪 Thermos公司;2100 Bioanalyzer生物芯片分析系统 Agilent公司;JY600E电泳仪 北京君意东方电泳设备有限公司。
1.2 实验方法
1.2.1 驴骨胶原蛋白的制备
驴骨→解冻清洗→破粒→高温蒸煮提取(2倍纯净水,140 ℃,搅拌3 h)→出液→酶解(1倍纯净水,60 ℃加风味蛋白酶(酶活:1.52×104 U/g)酶解1 h→灭酶(140 ℃,1 h)→均质→浓缩→喷雾干燥→驴骨胶原蛋白粉[20]。
1.2.2 驴骨胶原蛋白促进伤口愈合效果的初步探究
1.2.2.1 驴骨胶原蛋白对NHDFs细胞存活率的影响
实验分为空白对照组、溶剂对照组、实验组。空白对照组和实验组将处于对数生长期的NHDFs细胞以密度8×104/mL接种于96孔板,每孔100 μL,空白对照组加入100 μL含10%胎牛血清的完全培养基,每组设3个平行复孔,培养24 h。实验组分别加入100 μL含不同浓度驴骨胶原蛋白(0.16、0.31、0.63、1.25、2.50和5 g/mL)的DMEM完全培养基。溶剂对照组和空白对照组分别加入100 μL完全培养基。在37 ℃、5% CO2、饱和湿度下培养48 h后,用200 μL预温的PBS清洗2次。去除清洗溶液,每孔准确加入100 μL CCK8工作液,于37 ℃、5% CO2培养箱培养1~3 h,在450 nm下测定吸光度。按照下式计算细胞存活率。
细胞存活率(\%)= 实验组 OD 值 − 溶剂对照组 OD 值 空白对照组 OD 值 − 溶剂对照组 OD 值 ×100 (1) 1.2.2.2 驴骨胶原蛋白对NHDFs细胞增殖的影响
实验分为溶剂对照组、实验组,各组均需要同时设置对应的背景组,背景组与对应组的所有操作一致,只是不添加BrdU试剂,用以扣除BrdU的背景。实验组将处于对数生长期的NHDFs细胞以密度8×103个/mL,接种于96孔板,每孔100 μL,常规培养(37 ℃,5% CO2)24 h。实验组与其对应的背景组换上100 μL含不同浓度驴骨胶原蛋白(0、0.02、0.05、0.09、0.19、0.38、0.75和1.5 g/mL)的DMEM完全培养基。溶剂对照组及其对应的背景组分别加入100 μL完全培养基。加药后在培养箱(37 ℃,5% CO2)中继续培养48 h,然后按照BrdU试剂盒说明书要求进行操作。按照下面公式计算细胞增殖率。
增殖率 (%)= 实验组 OD 值−实验组背景 OD 值 溶剂对照组 OD 值 − 溶剂对照背景 OD 值 ×100 (2) 1.2.2.3 驴骨胶原蛋白对NHDFs细胞迁移的影响
收集对数生长期NHDFs细胞,按照细胞密度为8×105个/孔接种至6孔板,每孔含培养液2 mL。在培养箱(37 ℃,5% CO2)中培养24 h后,使用无菌枪头划出划痕,用PBS冲洗2次以去除划痕区残留细胞。划痕后随机分为阳性对照组、空白对照组和实验组,每组设置3个平行。阳性对照组加入含2%胎牛血清的培养基,空白对照组加入不含胎牛血清的培养基,实验组加入驴骨胶原蛋白浓度为1.5 g/mL的不含胎牛血清的培养基。加药后在培养箱(37 ℃,5% CO2)中继续培养6 h后,于倒置显微镜下观察划痕区细胞的愈合情况并照相记录,使用Image-Pro Plus 6.0计算划痕区面积的平均值,按照下面公式计算划痕区迁移率。
迁移率(%)= 初试划痕面积 −6 h 后划痕面积 初试划痕面积 ×100 (3) 1.2.2.4 驴骨胶原蛋白对NHDFs细胞Col I蛋白表达的影响
将NHDFs细胞以5×105个/mL接种至24孔板,在培养箱(37 ℃,5% CO2)中培养24 h后,将生长接近融合的细胞进行同步化处理,即换用无血清DMEM培养基饥饿2 h。随机分为阳性对照组、空白对照组和实验组,每组设置3个平行。阳性对照组加入含15 μmol/L的抗坏血酸(VC)的培养基,实验组加入驴骨胶原蛋白浓度为1.5 g/mL的培养基,空白对照组加入等体积的培养基。加药后继续培养48 h,收集细胞培养上清液备用。按照胶原蛋白ELISA试剂盒说明书进行操作,用酶标仪测定波长450 nm处的吸光值,根据绘制的标准曲线计算NHDFs细胞外基质中胶原蛋白含量。
1.2.3 驴骨胶原蛋白对NHDFs细胞功能的初步探究
1.2.3.1 RNA-Seq检测差异表达的基因
将成纤维细胞以4×105个/mL接种至6孔板中, 37 ℃,5% CO2中孵育过夜。实验组加入含驴骨胶原蛋白的培养基,空白对照组加入等体积的培养基。继续培养24 h后,弃掉培养液,用PBS洗涤细胞3次。向细胞中加入1 mL Trizol,待融化成液体后转入Ep管中,收样备用。Trizol法提取模型总RNA,并进行质检。RNA样品检测合格后,用带有Oligo(dT)的磁珠富集mRNA。随后加入适量打断试剂将mRNA打断成短片段,以mRNA为模板合成cDNA。经过磁珠纯化、末端修复、加碱基A尾并连接测序接头,然后进行PCR富集得到最终的cDNA文库。用Agilent 2100 Bioanalyzer生物芯片分析系统和ABI 7500荧光定量PCR仪进行质量和产量检测。文库质控合格后,用Illumina HiSeqTM 2000进行测序,使用统计学方法对有效数据进行分析。
1.2.3.2 差异表达基因的基因本体论及通路分析
采用clusterProfiler软件对差异基因集进行GO功能富集分析和KEGG通路富集分析。比较处理组与空白对照组的RNAseq有效数据,差异倍数≥1且P<0.05视为差异表达基因。对于筛选的基因用基因本体论数据库(Gene Ontology)和注释、可视化和整合发现数据库(DAVID)进行GO和KEGG分析。用P值反应信号通路差异的显著性。
1.3 数据处理
应用SPSS26.0统计软件进行数据分析,实验重复3次,数据结果以“均数士标准差”(
ˉX ±SD)表示。多组数据差异比较采用方差分析,两组间差异比较采用t检验,P<0.05表示差异有统计学意义。*表示与空白对照组相比,P<0.05;**表示与空白对照组相比,P<0.01;#表示与阳性对照组相比,P<0.05;##表示与阳性对照组相比,P<0.01。2. 结果与分析
2.1 驴骨胶原蛋白促进伤口愈合效果的初步探究
2.1.1 驴骨胶原蛋白对NHDFs细胞存活率的影响
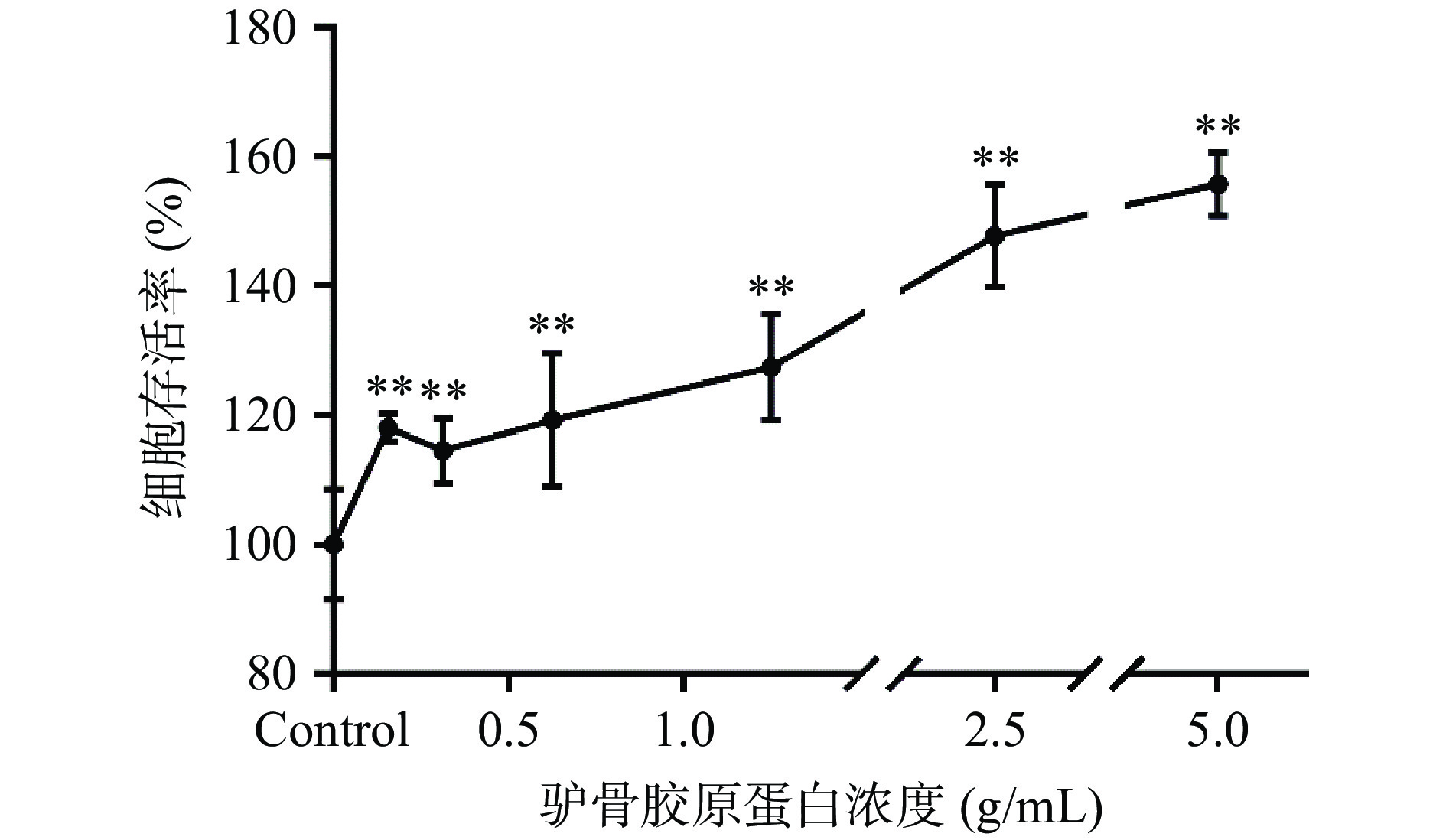
用CCK-8检测驴骨胶原蛋白对NHDFs细胞的毒性,结果显示(图1),驴骨胶原蛋白在浓度为0.16~5 g/mL对NHDFs细胞无毒性作用,甚至显示出一定的促进细胞生长的作用,细胞存活率可以提高18.14%~55.78%。
2.1.2 驴骨胶原蛋白对NHDFs细胞增殖的影响
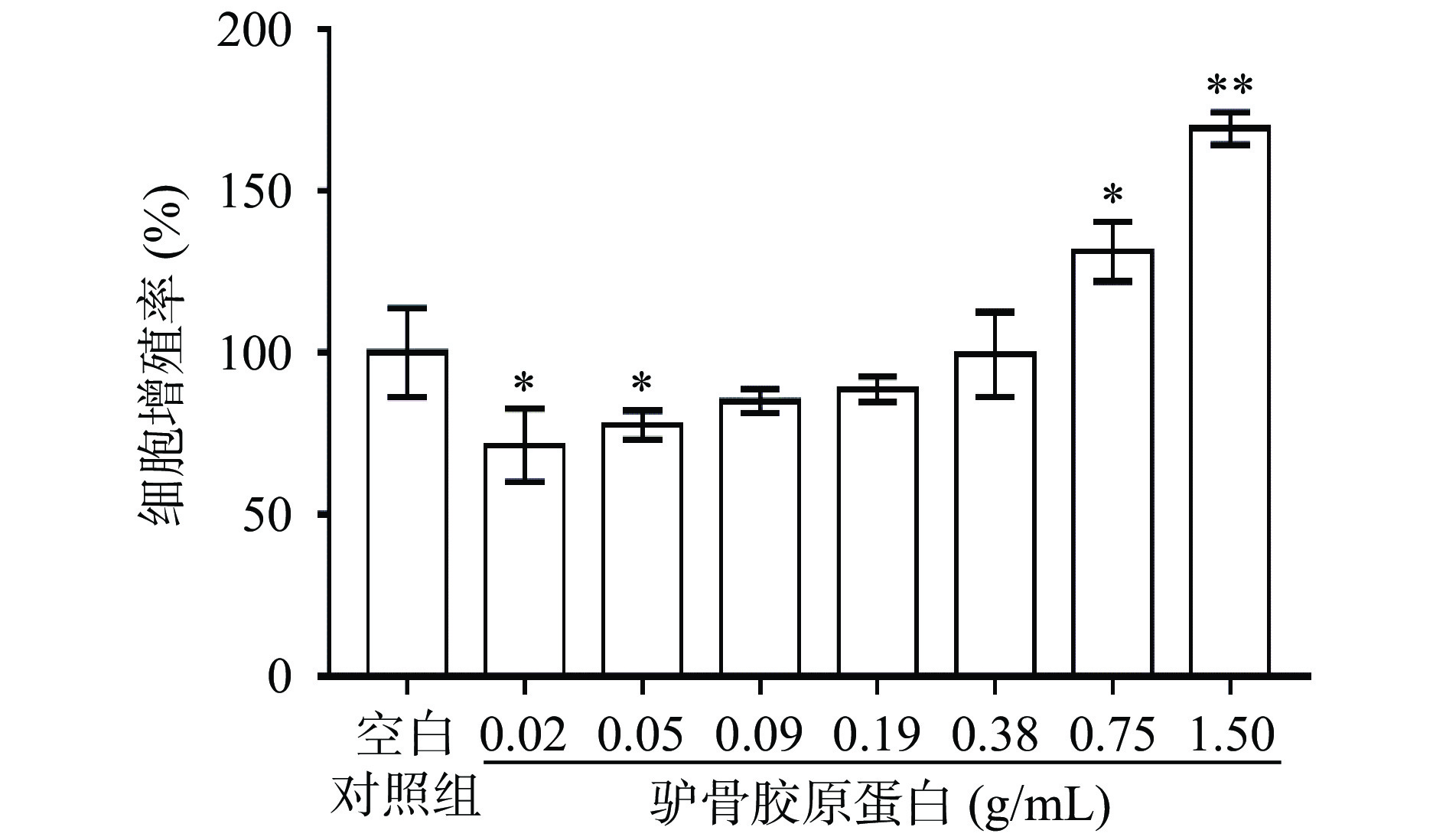
采用BrdU法研究驴骨胶原蛋白对NHDFs细胞增殖的影响,结果见图2。不同浓度的驴骨胶原蛋白作用NHDFs细胞24 h后,与空白对照组相比,在驴骨胶原蛋白浓度为0.75、1.50 g/mL时,驴骨胶原蛋白具有显著的促进NHDFs细胞增殖的作用(P<0.05),细胞增殖率分别为131.25%、169.30%。因此,后续选择浓度1.5 g/mL进行下一阶段实验。此外,驴骨胶原蛋白浓度在0.75~1.50 g/mL内,能够促进NHDFs细胞增殖,且驴骨胶原蛋白对NHDFs细胞增殖的影响呈现剂量依赖关系。
2.1.3 驴骨胶原蛋白对NHDFs细胞迁移的影响
采用细胞体外划痕实验,利用Image pro plus软件计算,比较0和6 h划痕面积的变化,探讨不同浓度驴骨胶原蛋白对NHDFs细胞迁移能力的影响,结果见图3。结果显示,与空白对照组相比,2%胎牛血清作用后,NHDFs细胞迁移率增加6.26%,差异具有统计学意义(P<0.05)。与刘磊等[21]报道的胎牛血清对成纤维细胞迁移率影响的效果一致,表明实验体系构建成功。与空白对照组相比,1.50 g/mL的驴骨胶原蛋白能显著增加NHDFs细胞迁移率(P<0.05),且与2%胎牛血清促进NHDFs细胞迁移的效果差异不具有统计学意义(P>0.05)。与狭鳕鱼皮胶原蛋白肽作用后成纤维细胞迁移率的提高效果一致[22]。可见,驴骨胶原蛋白能够显著促进NHDFs细胞的迁移融合,具有促进伤口愈合效果。
2.1.4 驴骨胶原蛋白对胶原蛋白合成的影响
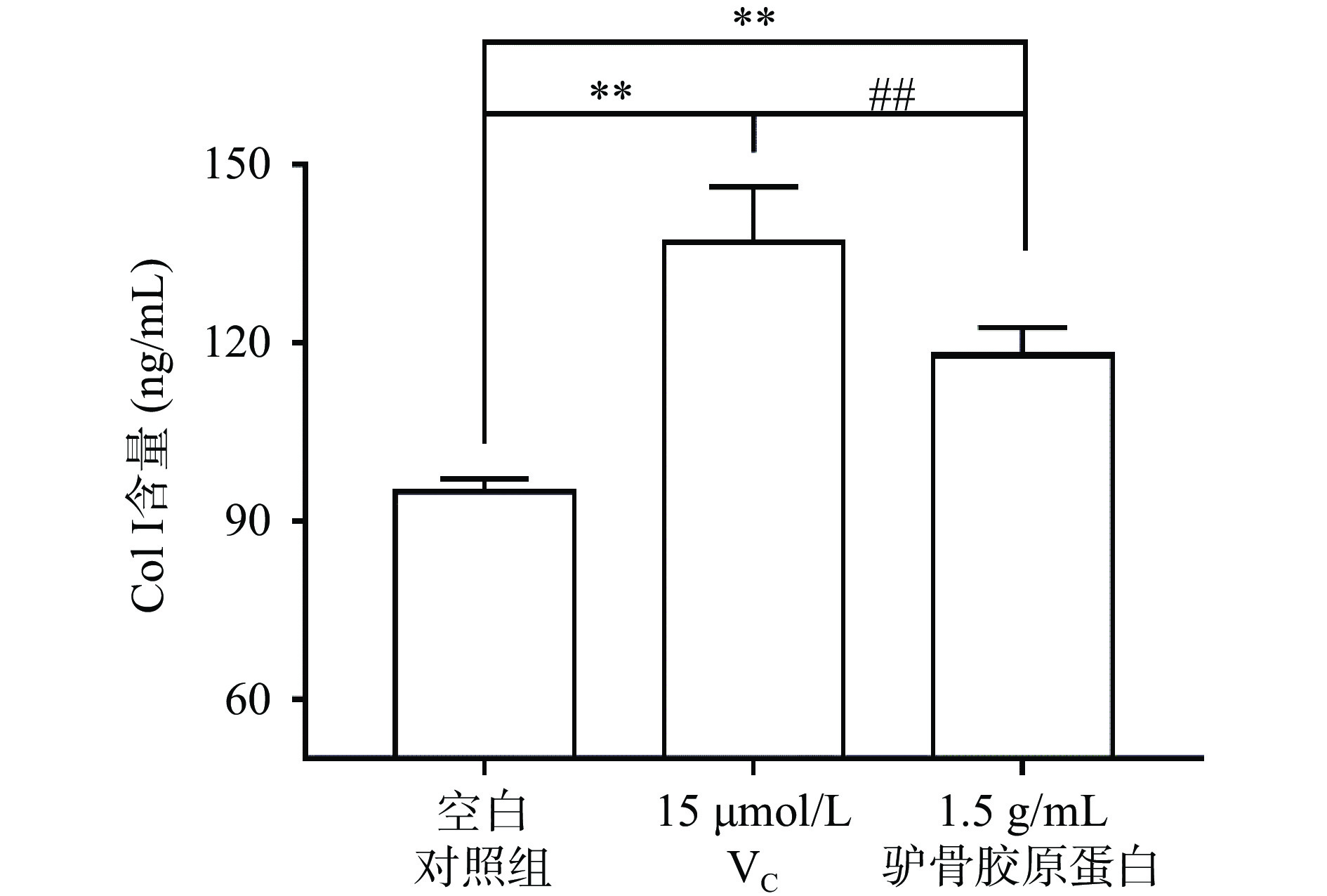
I型胶原蛋白(Collagen I,Col I)作为细胞组织间质的重要组成成分,在伤口愈合过程中发挥着重要的作用。据报道,狭鳕鱼皮胶原蛋白肽[22]、罗非鱼皮Ⅰ型酶溶性胶原蛋白[23]均能促进Col I的表达,有效控制伤口愈合过程。采用ELISA法检测驴骨胶原蛋白对NHDFs细胞外基质中的胶原蛋白的影响,结果见图4。因抗坏血酸在促进创面愈合和调节胶原蛋白生成中起重要作用[24],选择抗坏血酸作为阳性对照。结果显示,浓度为15 μmol/L的抗坏血酸(VC)能够明显促进Col I的表达(P<0.01)。与空白对照组相比,1.50 g/mL的驴骨胶原蛋白也能极显著促进Col I的表达(P<0.01),但效果弱于15 μmol/L的抗坏血酸,Col I含量相差18.99 ng/mL,差异具有统计学意义(P<0.01)。说明1.50 g/mL的驴骨胶原蛋白能够促进Col I含量增加,但效果弱于15 μmol/L的抗坏血酸。
2.2 驴骨胶原蛋白对NHDFs细胞功能的初步探究
2.2.1 驴骨胶原蛋白作用NHDFs细胞后主要差异表达基因
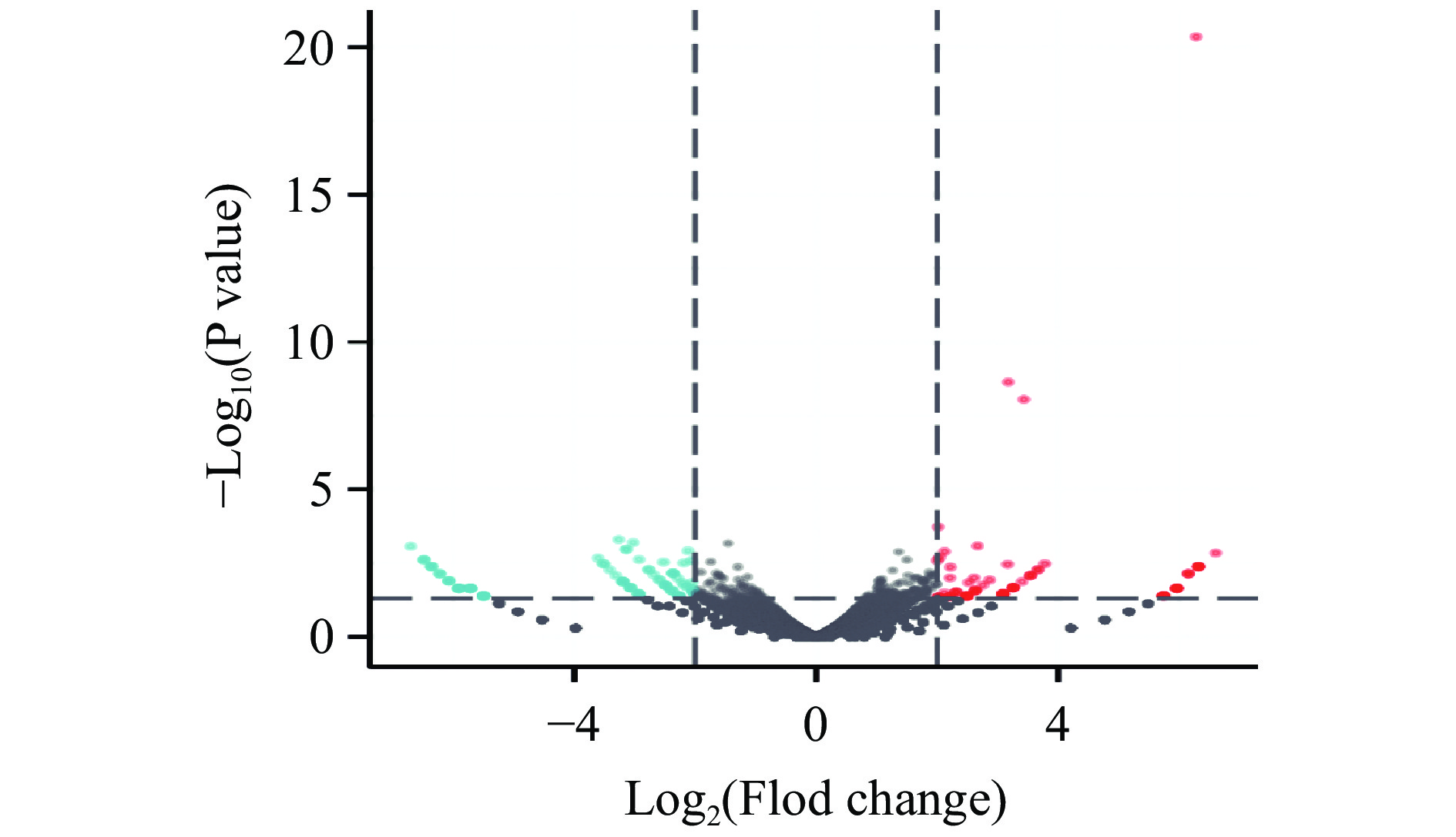
差异基因统计分析结果显示,与空白对照组相比,驴骨胶原蛋白作用NHDFs细胞后,差异表达基因火山图见图5,其中每一个点代表一个基因,蓝色点表示表达下调的基因,红色点表示表达上调的基因。基于P<0.05且|-Log2(Fold change)|>1筛选标准,共获得差异表达基因384个,其中上调基因172个,下调基因212个。
2.2.2 差异表达基因GO富集分析
为初步明确驴骨胶原蛋白在成纤维细胞中发挥的具体生物学功能,分别对已鉴定出的384个差异表达基因进行了GO富集分析。通过GO富集分析可将差异表达的基因按功能分为:生物过程(biological process,BP)、细胞组分(cellular component,CC)和分子功能(molecular function,MF)三类。GO功能富集结果显示(见图6),与空白对照组相比,驴骨胶原蛋白作用成纤维细胞后,差异表达基因参与的生物过程主要有中性粒细胞趋化性(neutrophil chemotaxis)、中性粒细胞迁移(neutrophil migration)、粒细胞趋化性(granulocyte chemotaxis),富集的分子功能主要包括细胞因子活性(cytokine activity)、趋化因子活性(chemokine activity)、受体配体活性(receptor ligand activity)、趋化因子受体结合(chemokine receptor binding)、G蛋白偶联受体结合(G protein-coupled receptor binding)、细胞因子受体结合(cytokine receptor binding),差异基因在细胞组分条目下的富集分析没有意义(经多重假设检验校正方法校正后的P值>0.05)。从GO富集结果推测,驴骨胶原蛋白参与成纤维细胞的免疫反应的调控。研究表明,与正常皮肤成纤维细胞相比,慢性病人伤口成纤维细胞的五种趋化因子CXCL(CXC chemokine ligand,CXC趋化因子配体;CXCL-1、-2、-3、-5和-6)基因表达降低两倍[25]。驴骨胶原蛋白作用于成纤维细胞的GO富集结果显示,CXCL-3、CXCL-5、CXCL-6三种趋化因子上调,据此推测驴骨胶原蛋白可能通过调控CXCL趋化因子发挥促进伤口愈合的作用。
2.2.3 差异表达基因KEGG富集分析
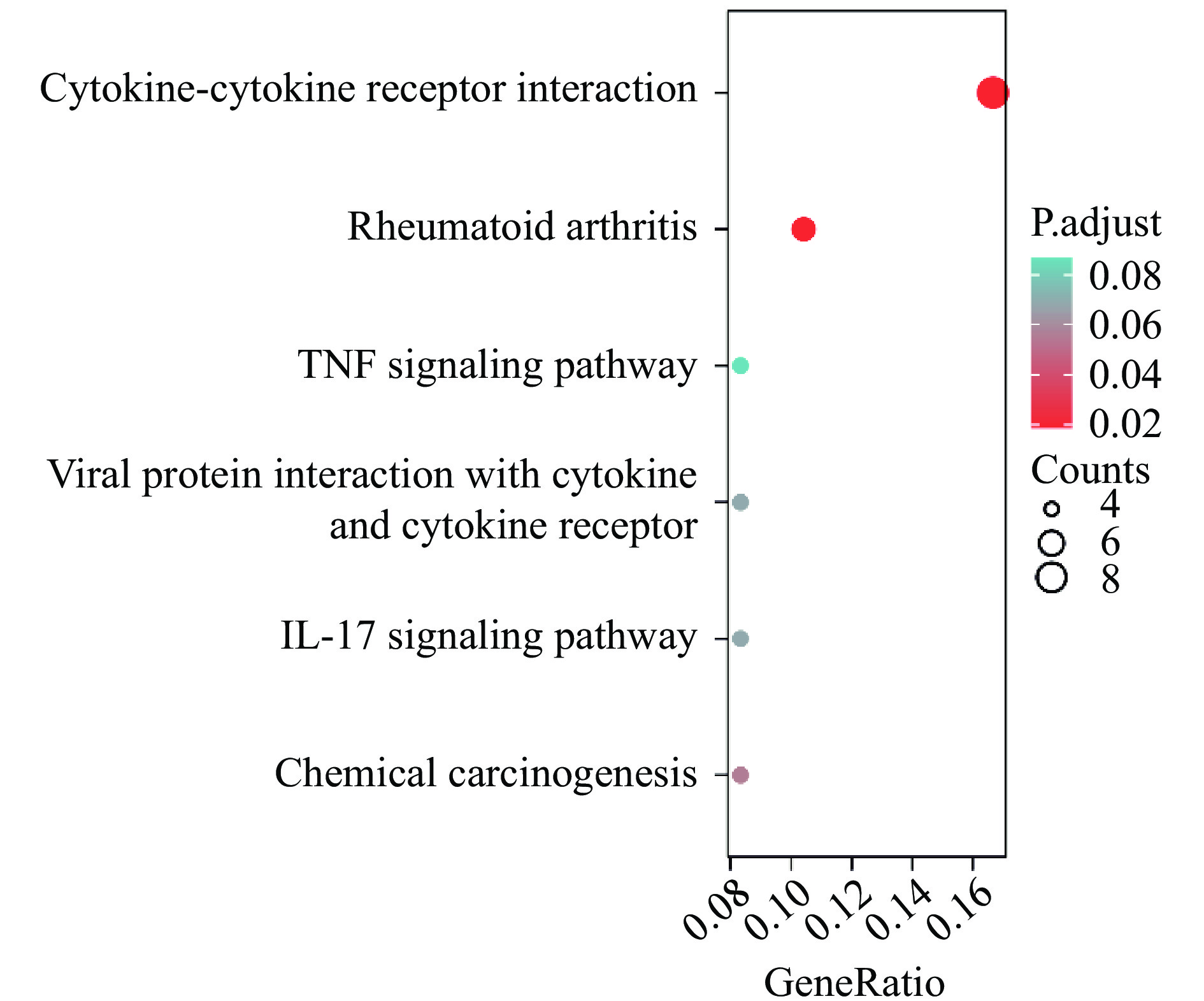
为进一步研究驴骨胶原蛋白作用成纤维细胞后差异表达基因参与的代谢通路,对所有差异基因进行了KEGG富集分析。图7为驴骨胶原蛋白作用于成纤维细胞涉及的信号通路的气泡图。结果显示,差异基因参与的信号通路包括类风湿关节炎(Rheumatoid arthritis)、细胞因子-细胞因子受体相互作用(Cytokine-cytokine receptor interaction)、化学致癌(Chemical carcinogenesis)、IL-17信号通路(IL-17 signaling pathway)、病毒蛋白与细胞因子和细胞因子受体的相互作用(Viral protein interaction with cytokine and cytokine receptor)和TNF信号通路(TNF signaling pathway)。
在皮肤损伤中,IL-17的主要来源于巨噬细胞,在伤口愈合的早期炎症阶段发挥作用[26]。有研究表明,IL-17A能够诱导促炎细胞因子的表达,包括CCL2(CC趋化因子配体2)、CXCL8、IL-Iβ和IL-6[27-28],这些细胞因子都与伤口愈合有关。缺乏IL-17可增强和加速皮肤组织的修复[29]。TNF蛋白超家族的典型成员TNF-α在炎症和随后的伤口愈合中起着关键作用[30],TNF-α信号传导介导炎症分子的产生,调节细胞存活、增殖和死亡,并影响上皮伤口愈合。此外,TNF-α信号传导还可介导上皮迁移,增强上皮细胞的存活和增殖,从而促进伤口愈合[31]。Wang等[32]报道,在伤口愈合过程中,炎性巨噬细胞(Ly6C+)分泌的细胞因子能够激活TNF和IL-17信号通路,TGF-β、HIF-1、NF-κB和Rap1信号通路与中性粒细胞分泌的细胞因子高度相关。因此,驴骨胶原蛋白促进成纤维细胞伤口愈合的机制与驴骨胶原蛋白刺激炎性巨噬细胞分泌细胞因子密切相关。KEGG通路富集结果显示,IL-17和TNF信号通路中的IL-1β、IL-32、CXCL3、CXCL5、CXCL6等基因在驴骨胶原蛋白作用于成纤维细胞中表达有显著差异,说明这些因子可能参与了驴骨胶原蛋白促进伤口愈合的过程,为进一步研究驴骨胶原蛋白促进伤口的分子机制奠定了基础。
3. 结论
本研究通过研究驴骨胶原蛋白对成纤维细胞增殖、迁移以及Col I分泌量的影响,初步探究驴骨胶原蛋白促进伤口愈合的效果。研究发现,驴骨胶原蛋白对NHDFs细胞没有毒性,且在浓度0.16~5.0 g/mL时使NHDFs细胞存活率提高18.14%~55.78%。驴骨胶原蛋白浓度在0.75~1.50 g/mL内对NHDFs细胞增殖的影响呈现剂量依赖关系。另外,1.50 g/mL的驴骨胶原蛋白能明显增加NHDFs细胞迁移率和促进Col I的表达。
采用转录组学技术筛选驴骨胶原蛋白作用于成纤维细胞后的差异表达基因,以揭示驴骨胶原蛋白对成纤维细胞可能的作用途径,为进一步研究驴骨胶蛋白促进皮肤伤口愈合的具体分子机制提供思路。结果表明,驴骨胶原蛋白作用NHDFs细胞后,共获得差异表达基因384个。GO功能富集结果显示,驴骨胶原蛋白参与的生物学过程主要有中性粒细胞趋化性、中性粒细胞迁移、粒细胞趋化性,参与的分子功能主要包括细胞因子活性、趋化因子活性、受体配体活性、趋化因子受体结合等。KEGG富集分析表明,驴骨胶原蛋白参与成纤维细胞的信号通路包括IL-17信号通路和TNF信号通路。推测,驴骨胶原蛋白可能通过IL-17和TNF-α介导CXCL趋化因子发挥促进皮肤伤口愈合的作用,后需进一步分子实验来探究驴骨胶原蛋白促进伤口愈合的具体分子机制。
-
-
[1] LI Jie, CHEN Yuan, KIRSNER Robert, et al. Pathophysiology of acute wound healing[J]. Clinics in Dermatology,2007,25(1):9−18. doi: 10.1016/j.clindermatol.2006.09.007
[2] KELLY B, MICHAEL A M. The ABC’ s of wound care[J]. Current Cardiology Reports,2013,15(4):346. doi: 10.1007/s11886-013-0346-6
[3] LAI Chingshu, TU Chunwei, KUO Hsing-Chun, et al. Type II collagen from cartilage of Acipenser baerii promotes wound healing in human dermal fibroblasts and in mouse skin[J]. Marine Drugs,2020,18(10):511. doi: 10.3390/md18100511
[4] AMITAVA D, MOTAZ A, NIRUPAM B, et al. A modified collagen dressing induces transition of inflammatory to reparative phenotype of wound macrophages[J]. Scientific Reports,2019,9(1):14293. doi: 10.1038/s41598-019-49435-z
[5] ZIZY I E, AYMAN A, AML A, et al. Collagen extract obtained from Nile tilapia
(Oreochromis niloticus L.) skin accelerates wound healing in rat model via up regulating VEGF, bFGF, and α-SMA genes expression[J]. BMC Veterinary Research,2020,16(1):352. doi: 10.1186/s12917-020-02566-2 [6] CHEN Jingjing, GAO Kaili, LIU Shu, et al. Fish collagen surgical compress repairing characteristics on wound healing process in vivo[J]. Marine Drugs,2019,17(1):33. doi: 10.3390/md17010033
[7] LI Di, REN Jinwei, XU Teng, et al. Effect of bovine bone collagen oligopeptides on wound healing in mice[J]. Aging,2021,13(6):9028−9042. doi: 10.18632/aging.202750
[8] 刘一秀. 牛胶原蛋白膜应用于兔皮肤缺损的实验研究[D]. 泸州: 西南医科大学, 2014. LIU Yixiu. Experimental study of bovine collagen membrane applied to rabbit skin defect[D]. Luzhou: Southwest Medical University, 2014.
[9] 车爽, 程然, 蒋薇, 等. 鹿茸胶原蛋白对创伤愈合作用的试验研究[J]. 吉林农业,2017,17(13):62−63. [CHE Shuang, CHENG Ran, JIANG Wei, et al. Experimental study of deer antler collagen on wound healing[J]. Agriculture of Jilin,2017,17(13):62−63. [10] ALESSANDRO L, GIOVANNI TO, GIOVANNI L, et al. Socket preservation using enzyme-treated equine bone granules and an equine collagen matrix: A case report with histological and histomorphometrical assessment[J]. Journal of Contemporary Dental Practice,2016,17(11):890−896. doi: 10.5005/jp-journals-10024-1949
[11] MEI Fengfeng, LIU Jingjie, WU Jintao, et al. Collagen peptides isolated from salmo salar and tilapia nilotica skin accelerate wound healing by altering cutaneous microbiome colonization via upregulated NOD2 and BD14[J]. Journal of Agricultural and Food Chemistry,2020,68(6):1621−1633. doi: 10.1021/acs.jafc.9b08002
[12] SHEN Xianrong, CHEN Xiuli, XIE Haixia, et al. Beneficial effects of a novel shark-skin collagen dressing for the promotion of seawater immersion wound healing[J]. Military Medical Research,2017,4(1):33. doi: 10.1186/s40779-017-0143-4
[13] GE Baosheng, WANG Haonan, LI Jie, et al. Comprehensive assessment of nile tilapia skin (Oreochromis niloticus) collagen hydrogels for wound dressings[J]. Marine Drugs,2020,18(4):178. doi: 10.3390/md18040178
[14] 朱伟, 张晓莉, 刘洋, 等. 鱼鳞胶原蛋白对免疫低下小鼠皮肤伤口愈合的影响[J]. 哈尔滨医科大学学报,2014,48(3):177−181. [ZHU Wei, ZHANG Xiaoli, LIU Yang, et al. Effect of fish scale collagen on wound healing in immunosuppressive mice[J]. Journal of Harbin Medical University,2014,48(3):177−181. [15] GÓMEZ-GUILLÉN M C, GIMÉNEZ B, LÓPEZ-CABALLERO M E, et al. Functional and bioactive properties of collagen and gelatin from alternative sources: A review[J]. Food Hydrocolloids,2011,25(8):1813−1827. doi: 10.1016/j.foodhyd.2011.02.007
[16] SILVERSTEIN R M, WEBSTER F X, KIEMLE D J, et al. Spectrometric identification of organic compounds[M]. 8th Ed. Hoboken, NJ, USA: John Wiley & Sons, 2014.
[17] 刘宪斌, 王仁虎, 姜桂苗, 等. 规模驴场主要传染性疫病的流行特点及风险分析[J]. 黑龙江畜牧兽医,2018(4):99−104. [LIU Xianbin, WANG Renhu, JIANG Guimiao, et al. The development and innovating of a storage-type of combination table for smears dyeing apparatus[J]. Heilongjiang Animal Science and Veterinary Medicine,2018(4):99−104. [18] SPARAVIGNA A, TATEO A, INSELVINI E, et al. Anti-age activity and tolerance evaluation of collagen micro-injection treatment associated to topical application of a cosmetic formulation[J]. Journal of Clinical & Experimental Dermatology Research,2017,8(3):1000391.
[19] NUNZIA G, MARIA LUCIA N, ALESSANDRO S, et al. An overview of the use of equine collagen as emerging material for biomedical applications[J]. Journal of Functional Biomaterials,2020,11(4):79. doi: 10.3390/jfb11040079
[20] 樊雨梅, 史传超, 帖航, 等. 驴骨胶原蛋白成分分析及促进皮肤修复活性的研究[J]. 食品工业科技, 2021, 42(23): 341−349 FAN Yumei, SHI Chuanchao, TIE Hang, et al. Study on the nutritional ingredients and the effect on the repair of damaged skin barrier function of donkey bone collagen[J]. Science and Technology of Food Industry, 2021, 42(23): 341−349.
[21] 刘磊, 狄海萍, 郭海娜, 等. 低温冷冻干燥后富血小板纤维蛋白生物学性状的变化[J]. 中国组织工程研究,2021,25(31):4995−4999. [LIU Lei, DI Haiping, GUO Haina, et al. Changes in biological characteristics of platelet-rich fibrin by freeze-drying technology[J]. Chinese Journal of Tissue Engineering Research,2021,25(31):4995−4999. doi: 10.12307/2021.142 [22] 苏威. 狭鳕鱼皮胶原蛋白肽对人皮肤成纤维细胞生物学特性的影响[D]. 青岛: 青岛大学, 2017. SU Wei. Effects of collagen peptides from walleye pollock on biological characteristics of human skin fibroblasts[D]. Qingdao: Qingdao University, 2017.
[23] 张静怡. 罗非鱼胶原蛋白与生物组织相互作用关系的研究[D]. 上海: 上海海洋大学, 2019. ZHANG Jingyi. Study on the interactions between biological tissues and Tilapia[D]. Shanghai: Shanghai Ocean University, 2019.
[24] 王仙凤, 梁楠, 张晓. 维生素C治疗伤口愈合的临床应用进展[J]. 西南军医,2007,9(2):79−80. [WANG Fengxian, LIANG Nan, ZHANG Xiao. The clinical development of vitamin C in wound healing[J]. Journal of Military Surgeon in Southwest China,2007,9(2):79−80. doi: 10.3969/j.issn.1672-7193.2007.02.057 [25] 何秀娟, 马慧可, 刘青武, 等. 细胞因子在创面修复中的研究进展[J]. 中国临床药理学与治疗学,2021,26(5):570−585. [HE Xiujuan, MA Huike, LIU Qingwu, et al. Research progress of cytokines in wound healing[J]. Chinese Journal of Clinical Pharmacology and Therapeutics,2021,26(5):570−585. [26] LEONIE B, ANASTASIOS D G, NICOLA G, et al. Regulation of TH17 cells and associated cytokines in wound healing, tissue regeneration, and carcinogenesis[J]. International Journal of Molecular Sciences,2017,18(5):1033. doi: 10.3390/ijms18051033
[27] BREMBILLA N C, MONTANARI E, TRUCHETET M E, et al. Th17 cells favor inflammatory responses while inhibiting type I collagen deposition by dermal fibroblasts: Differential effects in healthy and systemic sclerosis fibroblasts[J]. Arthritis Research & Therapy,2013,15(5):R151.
[28] VETTORI S, BARRA G, RUSSO B, et al. T-cell proapoptotic and antifibrotic activity against autologous skin fibroblasts in vitro is associated with il-17a axis upregulation in systemic sclerosis[J]. Frontiers in Immunology,2020,11:220. doi: 10.3389/fimmu.2020.00220
[29] MATHIEU P R, SAMANTHA S H, BRETT H, et al. Reduced Il17a expression distinguishes a Ly6c(lo)MHCII(hi) macrophage population promoting wound healing[J]. Journal of Investigative Dermatology,2013,13(3):783−792.
[30] MASAE R, KAZUYOSHI K, EMI K, et al. Critical role of tumor necrosis factor-α in the early process of wound healing in skin[J]. Journal of Dermatology & Dermatologic Surgery,2017,21(1):14−19.
[31] EMIKO M, ATSUSHI M, HIDETOSHI T, et al. Role of tumor necrosis factor receptor 2 (TNFR2) in colonic epithelial hyperplasia and chronic intestinal inflammation in mice[J]. Gastroenterology,2002,122(1):134−144. doi: 10.1053/gast.2002.30347
[32] WANG Jingwen, WANG Xusheng, CHEN Haiyan, et al. Distinctively expressed cytokines by three different inflammation cells and their interaction with keratinocytes in wound healing[J]. Inflammation, 2017, 40(6): 2151-2162.





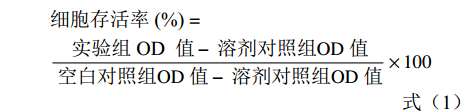



 下载:
下载:


 下载:
下载:
