Study on Purification Process and Antioxidative Activity and α-Glucosidas Inhibitory Activity of Proanthocyanidins from Tetrastigma hemsleyanum
-
摘要: 为了探索三叶青中原花青素的纯化工艺及其生物活性作用,制备经济高效的原花青素,比较5种大孔吸附树脂对三叶青原花青素静态吸附及解吸附能力,并对树脂的动态吸附及解吸附条件进行优化。同时,探讨乙醇洗脱对原花青素纯度及生物活性影响。结果表明,AB-8型树脂可用于三叶青中原花青素纯化,纯化三叶青原花青素的最适条件为:上样质量浓度6.00 mg/mL,上样流速2 BV/h,上样体积11 BV,洗脱流速1.5 BV/h,洗脱剂用量2 BV,70%乙醇吸附效果最好,纯化后的三叶青原花青素纯度达到97.31%±0.96%,比粗提物提高了2.2倍,1,1-二苯基-2-三硝基苯肼(DPPH)自由基清除活性、ABTS+自由基清除活性及α-葡萄糖苷酶抑制活性得到了显著增强(P<0.05),并且与原花青素含量之间存在极显著相关性(P<0.01)。因此,AB-8树脂纯化法简单、高效,且三叶青原花青素具有较强的体外抗氧化活性以及α-葡萄糖苷酶抑制活性,为综合开发利用三叶青原花青素提供科学参考。
-
关键词:
- 三叶青原花青素 /
- AB-8型树脂 /
- 抗氧化活性 /
- α-葡萄糖苷酶抑制活性
Abstract: In this paper, the purification process and biological activity of proanthocyanidins isolated from Tetrastigma hemsleyanum were explored to prepare economical and efficient proanthocyanidins. The static adsorption and desorption capacity of proanthocyanidins on five kinds of resins were compared. The dynamic adsorption and desorption conditions of resins were optimized. The effects of ethanol elution on the purity and biological activity of proanthocyanidins were evaluated. The results showed that AB-8 resin was chosen as the better sorbent for the purification of proanthocyanidins from Tetrastigma hemsleyanum. The optimal conditions for purifying proanthocyanidins were as follows: Sample concentration 6.00 mg/mL, loading rate 2 BV/h, loading amount 11 BV, eluent flow rate 1.5 BV/h, and eluent volume 2 BV. 70% ethnol had the best effect for the purification of proanthocyanidins, and the purification of proanthocyanidins were 97.31%±0.96%, 2.2 times the purification of crude extract. The DPPH scavenging activity, ABTS+ scavenging activity and α-glucosidase inhibitory activity were also increased dramatically and there was a significant positive correlation between these activities and content of proanthocyanidins(P<0.01). Therefore, the AB-8 resin purification method was simple and efficient, and the Tetrastigma hemsleyanum proanthocyanidin had strong in vitro antioxidant activity and α-glucosidase inhibitory activity. It would provide a scientific reference for the comprehensive development and utilization of proanthocyanidins in Tetrastigma hemsleyanum. -
三叶青(Tetrastigma hemsleyanum Diels et Gilg)又名三叶崖爬藤、蛇附子、金线吊葫芦等,为葡萄科崖爬藤属植物[1],在广西广泛种植。原花青素(Proanthocyanidins,PC)是一类由多羟基黄烷-3-醇结构单元缩合而成的多酚类化合物[2-3],具有抗氧化[4]、保护心血管系统[5]、预防动脉粥样硬化[6]、预防老年痴呆[7]等药理活性功能。
原花青素的提取纯化工艺一直是影响其质量优劣的关键工艺。目前,常见的原花青素提取方法有:水提法[8]、有机溶剂提取法[9]、微波提取法[10]、高压提取法[11]、萃取法[12]等,这几种提取方法各有优劣,为了提高提取效率,通常会联合使用几种提取方法,但提取后的原花青素为粗提物,内部含有大量的多糖、蛋白质等杂质[13-15]。如若不采取适当的方法进行分离纯化,原花青素则易分解、粘稠、吸潮,影响其生物活性[16-17]。常用于原花青素纯化的工艺包括膜分离法、纸层析法、高效液相色谱法、离子交换法等,这几种方法虽然纯化效率高,可纯化成本也较高,不适宜实际加工生产。大孔吸附树脂具有吸附纯化工艺简单、纯化效率高、生产成本低廉等优点,广泛应用于黄酮类、多酚类和色素等植物化学物质的纯化。赵文娟等[18]通过101型树脂对黑枸杞原花青素进行分离纯化,纯化后的原花青素含量是原来的2.17倍。褚仕超等[19]通过AB-8型树脂对蚕豆中原花青素进行纯化,纯化后的原花青素含量高达94.33%。滕飞等[20]通过DM130 型树脂纯化黑果腺肋花楸原花青素,所得原花青素的纯度为78.4%。但大孔树脂纯化三叶青原花青素还未见报道。
为探索三叶青中原花青素的纯化工艺及其活性,采用大孔吸附树脂法纯化三叶青原花青素,以不同类型树脂吸附量和解吸附率为指标,筛选最佳树脂类型,并对三叶青粗提物和纯化后的纯度、体外抗氧化活性以及葡萄糖苷酶抑制活性进行综合测定,以期为三叶青原花青素的深入研究提供参考依据。
1. 材料与方法
1.1 材料与仪器
三叶青 采自广西天峨县菠结乡常里村,经西北农林科技大学生命科学学院、中药指纹图谱与天然产物国家地方联合工程研究中心董娟娥教授鉴定为葡萄科崖爬藤属植物三叶青(T. hemsleyanum)的干燥块根。样品用去离子水洗净,45 ℃烘干,将样品粉碎后过60目筛;D-101、X-5、AB-8、HPD-100、HPD-300型大孔吸附树脂 安徽三星树脂科技有限公司;α-葡萄糖苷酶、DPPH、ABTS、对硝基苯-α-D-吡喃葡萄糖苷PNPG、L-抗坏血酸、阿卡波糖 美国Sigma-Aldrich公司;葡萄籽原花青素 标准品,纯度≥98.5%,南京狄尔格医药科技有限公司;其余试剂 均为国产分析纯;水 去离子水。
FW-100D高速万能粉碎机 天津鑫博得仪器有限公司;UV-1700紫外-可见分光光度计 日本株式会社岛津制作所;1510全波长多功能酶标仪 赛默飞世尔科技有限公司;SB25-12DTDN型超声波清洗机 宁波新芝;N-1300D-W旋转蒸发仪 东京理化器械株式会社;BSA224电子天平 赛多利斯科学仪器有限公司。
1.2 实验方法
1.2.1 原花青素粗提物制备及含量测定
采用体积分数为50%乙醇溶液结合超声波辅助法提取原花青素:超声功率100 W,超声温度为40 ℃,超声时间为5 min,料液比为1:20,浸提温度为40 ℃,浸提时间为20 min,提取后5000 r/min离心5 min,取上清液,旋蒸浓缩,冻干。并根据下列方法计算原花青素含量。
用香草醛-盐酸法测定原花青素的含量,参照本课题组建立的方法[21],配制工作液(1 g/100 mL香草醛-甲醛溶液与1 mol/L盐酸-甲醇溶液,体积比1:1),称取原花青素标准品,以甲醇为溶剂,在容量瓶中制备0.0、3.0、6.0、9.0、12.0、15.0 μg/mL的标准溶液,在不同浓度的标准液中分别加入10 mL工作液,充分摇匀,置于室温下30 min显色,用甲醇作空白对照,在500 nm波长处测定溶液吸光值,对三叶青原花青素含量进行初步定量分析。绘制吸光值(Y)与原花青素标准品质量浓度(X)的标准曲线,得标准曲线方程为:Y=1.6771X−0.0002(R2=0.9925)
1.2.2 大孔吸附树脂型号的筛选
1.2.2.1 大孔吸附树脂处理
参照文献[22]对D101、X-5、HPD-100、HPD-300、AB-8型大孔吸附树脂进行处理。所有树脂首先在无水乙醇中处理24 h,然后用去离子水洗涤以完全去除乙醇,在5% (m/m)的氢氧化钠中浸泡6 h,用去离子水洗涤直到滤液pH=7,在5% (v/v)的盐酸中浸泡6 h,然后依次用去离子水洗涤直到滤液pH=7。最后,所有的树脂在60 ℃干燥。以不同类型树脂的饱和吸附量、解吸附量、解吸附率为主要指标,筛选出最优的树脂类型。
1.2.2.2 吸附量测定
参照文献[23]精密称取上述经处理的大孔吸附树脂各2 g,置于250 mL的具塞三角瓶中,分别加入质量浓度为6 mg/mL的三叶青粗提物溶液定容至100 mL密封后置于摇床中,25 ℃转速60 r/min摇24 h,测定吸附后溶液原花青素质量浓度R0,按照式(1)计算大孔树脂对原花青素的饱和吸附量。
树脂饱和吸附量(mg/g)=6−R0×1002 (1) 1.2.2.3 解吸附量测定
称取吸附饱和后的预处理树脂各1 g,置于250 mL锥形瓶中,加入体积分数为70%的乙醇溶液100 mL充分摇匀,过滤并测定解吸附后的原花青素质量浓度R1,按照式(2)计算大孔树脂对原花青素的解吸附量。
树脂解吸附量(mg/g)=R1×1001 (2) 树脂解吸附率(%)=树脂解吸附量树脂饱和吸附量×100 (3) 1.2.3 动态吸附实验
湿法装柱(15 cm×1.3 cm),平衡,然后将含有原花青素为 6 mg/mL的三叶青粗提物以1、2、3、4、5 BV/h的流速分别进行上样吸附,流出液以1 BV为单位,持续收集24份,用酶标仪测定每份流出液中三叶青原花青素质量浓度。当含有三叶青原花青素的流出液质量浓度是上样质量浓度的10%时视为泄露点。此时停止加样,以此确定上样质量浓度和流速。
1.2.4 洗脱流速及洗脱剂用量考察
依据1.2.3中确定的上样流速和上样质量浓度,制备5份吸附饱和的树脂柱,去离子水充分平衡,70% 浓度乙醇作洗脱溶剂,设5个梯度流速分别进行洗脱,持续收集25份流出液(0.1 BV/份),分别检测每一份流出液中三叶青原花青素的质量浓度,通过绘制的洗脱曲线图来确定洗脱剂用量和洗脱流速。
1.2.5 洗脱剂浓度考察
参照1.2.4确定的洗脱剂用量和洗脱流速,按照1 BV/h的流速依次用50%、60%、70%、80%、90%的乙醇溶液对饱和树脂进行充分洗脱,并收集洗脱液,检测5种不同体积分数的乙醇洗脱剂对三叶青原花青素洗脱能力的影响。
1.2.6 三叶青原花青素粗提物纯化
经预处理的AB-8型树脂分3份进行湿法装柱,并以去离子水平衡。首先,将三叶青提取物溶液(原花青素质量浓度为6.00 mg/mL),以流速2 BV/h上样10 BV,完全饱和吸附后,除去杂质。然后以1 BV/h流速分别用50%、70%、90%的体积分数乙醇进行解吸附,并收集洗脱液,旋蒸浓缩冻干,得到不同纯度的三叶青原花青素纯化物。
1.2.7 DPPH自由基清除活性测定
将1,1-二苯基-2-三硝基苯肼(DPPH)配成100 μmol/L的工作液100 mL。3种三叶青纯化物、粗提物分别配成0、20、40、60、80、100、120 μg/mL的溶液。以L-抗坏血酸作阳性对照,参照文献[24]进行测定并计算DPPH自由基清除率,样品及L-抗坏血酸清除DPPH自由基的能力以对DPPH自由基的半数抑制浓度(Half maximal inhibitory concentration,IC50)表示。
DPPH自由基清除率(%)=A0−AiA0×100 (4) 式中:A0为空白样品,Ai为各样品。
1.2.8 ABTS+自由基的清除活性测定
以ABTS(7 mmol/L)母液与K2S2O8(2.6 mmol/L)的溶液按1:1的体积比混合,避光条件下静置过夜,使用前用无水乙醇稀释成工作液,要求其在734 nm波长下的吸光度为0.70±0.2。将3种三叶青纯化物、粗提物分别配成0、20、40、60、80、100、120 μg/mL的溶液。以L-抗坏血酸作阳性对照,参照文献[24]测定并计算ABTS+自由基清除率,样品及L-抗坏血酸清除ABTS+自由基的能力以对ABTS+自由基的半数抑制浓度(IC50)表示。
ABTS+自由基清除率(%)=A0−AiA0×100 (5) 式中:A0为空白样品,Ai为各样品。
1.2.9 α-葡萄糖苷酶抑制活性测定
三叶青粗提物及3种不同梯度纯化物用10 %二甲基亚砜(dimethyl sulfoxide,DMSO)进行注溶,配成0、2、4、6、8、10、12 μg/mL的溶液。以阿卡波糖作为阳性对照,参照文献[23]测定并计算α-葡萄糖苷酶的抑制率,抑制活性以对α-葡萄糖苷酶的半数抑制浓度(IC50)表示。
α−葡萄糖苷酶的抑制率(%)=ΔA0−ΔAiA0×100 (6) 式中:∆A0为空白样品的增量,∆Ai为样品的增量,A0为空白样品。
1.3 数据处理
所有试验均以三份重复进行,结果以三份平行测量的均数±标准差表示。使用SPSS 22.0软件得到半数抑制率IC50值并进行单因素方差分析,Excel 2010进行统计分析与整理。相关性分析采用 Pearson 相关,P<0.05表示具有显著性。
2. 结果与分析
2.1 大孔吸附树脂的筛选
考察AB-8、HPD-100、X-5、HPD-300以及D101共5种树脂对三叶青原花青素的吸附及解吸附能力。如表1所示,五种树脂均表现出较强的吸附能力,从统计学上分析吸附量来看,AB-8和HPD-100最好,分别可达到 132.61和137.68 mg/g;从解吸附率试验结果来看,树脂AB-8与树脂D101的解吸附率显著优于其他类型树脂(P<0.05),分析认为原花青素分子中的苯环易与树脂形成疏水作用,而比面积较小的树脂AB-8与D101较易洗脱[25]。因此,基于吸附和解吸附的能力,综合考虑选用AB-8型大孔吸附树脂纯化三叶青原花青素[26-27]。
表 1 大孔吸附树脂对三叶青原花青素的吸附及解吸附能力Table 1. Adsorption and desorption capacity of macroporous resins for proanthocyanidins from T. hemsleyanum树脂型号 极性 孔径(nm) 比表面积(m2/g) 饱和吸附量(mg·g−1) 解吸附量(mg·g−1) 解吸附率(%) X-5 弱极性 29~30 500~600 119.85±1.88b 86.46±2.73c 72.15±2.50c D101 非极性 9~10 500~550 113.03±0.64c 90.40±1.17bc 80.20±1.28b AB-8 弱极性 12~16 480~520 132.61±3.50a 124.83±4.08a 94.12±1.12a HPD-100 非极性 8.5~9 650~700 137.68±3.62a 93.2±2.63b 67.72±2.41d HPD-300 弱极性 5~5.5 800~870 122.39±3.44b 73.05±2.03d 59.68±0.21e 注:同列小写字母不同表示差异性显著(P<0.05)。 2.2 上样量及上样流速对AB-8型吸附树脂纯化三叶青原花青素的影响
上样流速对树脂吸附效果的影响如图1所示。原花青素上样质量浓度为6.0 mg/mL 时,在1~5 BV/h 流速范围内,上样流速越快,AB-8型号树脂吸附能力越受影响,泄漏点越早出现。通过图1可知,在3 BV/h后流出花青素质量浓度逐渐升高,吸附效果较差,分析认为在流速加快的情况下,三叶青原花青素不能完全被AB-8型树脂吸附,易造成溶液浪费;相反,流动速率过慢,生产效率就会受到严重影响。综合时间成本及纯化效率考虑,三叶青原花青素纯化最佳上样质量浓度为6.0 mg/mL,最佳上样流速2 BV/h、最佳上样体积11 BV。与鸡血藤、密蒙花最佳流速是2 BV/h,上样体积为分别为10、20 BV[23,28]相近。
2.3 洗脱流速及洗脱剂用量对AB-8型吸附树脂纯化三叶青原花青素的影响
以三叶青原花青素吸附量和解吸附率为考察指标。如图2所示,在0.5~1.5 BV/h三个梯度低流速洗脱时,峰面积大,解吸附率高;相反在2.0和2.5 BV/h高流速洗脱时,峰形降低,解吸附率较差,出现拖尾现象。这种情况下有可能洗脱流速到达一定的数值时,洗脱溶剂与AB-8型树脂触及的时间过短,解吸附不充分,从而导致解吸附效率降低。当洗脱剂用量在2.0 BV之后时,流出液中原花青素含量非常低,因此,选择洗脱剂用量以2.0 BV、洗脱流速以1.5 BV/h为最佳。
2.4 乙醇体积分数对AB-8树脂纯化三叶青原花青素的影响
据文献报道,原花青素中的多羟基结构与吸附树脂充分结合后形成氢键作用,易被含水的有机溶剂洗脱,因此,植物中原花青素提取纯化通常用乙醇进行洗脱[29]。选用乙醇对AB-8树脂中吸附的三叶青原花青素进行洗脱。如表2所示,在5个不同梯度范围内,随着乙醇浓度的增加,AB-8型树脂对三叶青原花青素的解吸附量和解吸附率呈现先增后减的趋势。当乙醇体积分数增大到70%时解吸附量和解吸附率达到最高,这可能与三叶青原花青素的极性有关[23]。研究表明,70%的乙醇对三叶青原花青素表现出较好的提取效果,因此,优选70%乙醇作为最佳洗脱溶剂。
表 2 乙醇浓度对AB-8型树脂解吸附能力的影响Table 2. Effects of ethanol concentration on AB-8 resin desorption capability乙醇体积分数(%) 解吸附率(%) 解吸附量(mg·mL−1) 50 71.23 82.65 60 83.45 91.43 70 96.86 115.67 80 85.21 92.62 90 82.17 89.12 2.5 乙醇洗脱体积分数对原花青素纯度及生物活性影响
在选用不同体积分数的乙醇洗脱剂时,优选对三叶青原花青素解吸附能力强、对杂质解吸附能力弱的洗脱剂,从而提升三叶青原花青素纯度。用50%、70%、90%等不同体积分数的乙醇对吸附在AB-8树脂上的原花青素进行洗脱。利用1.2.1节所述方法对各样品原花青素纯度进行分析,结果如表3,三叶青粗提物中的原花青素纯度为44.77%±0.88%,与李彦等[23]研究相近,且V70样品中的原花青素纯度达到97.31%±0.96%,约为粗提取物的2.2倍,在所有样品中最高(P<0.05)。50%和90%体积分数乙醇溶解杂质的能力强于70%的乙醇,造成V50和V90纯化物中含有一定量的杂质,纯度分别为82.43%±0.67%和87.04%±1.03%,表明70%体积分数酒精较适宜洗脱,并提高了对DPPH自由基、ABTS+自由基及α-葡萄糖苷酶的清除能力。其中V70对DPPH自由基、ABTS+自由基清除率的IC50分别为71.59与37.97 μg/mL,显著低于其他试验组及阳性对照组(P < 0.05)。
表 3 不同样品原花青素纯度及生物活性Table 3. Purities and biological activities of proanthocyanidin from different samplesL-抗坏血酸 阿卡波糖 CE(粗提物) V50 V70 V90 原花青素纯度(%) − − 44.77±0.88d 82.43±0.67c 97.31±0.96a 87.04±1.03b 对DPPH自由基清除率的IC50(μg/mL) 97.95±0.69a − 91.26±1.43b 81.06±0.23d 71.59±0.99e 85.28±1.06c 对ABTS+自由基清除率的IC50(μg/mL) 41.74±0.43bc − 94.72±0.21a 48.10±1.3b 37.97±0.25c 50.04±1.25b 对α-葡萄糖苷酶抑制率的IC50(μg/mL) − 572.01±9.85a 13.76±0.16b 4.64±0.13c 3.84±0.09c 5.56±0.23c 注:V50、V70、V90分别为50%、70%、90%乙醇洗脱的三叶青原花青素纯化物。同行数据后小写字母表示差异显著(P<0.05)。 2.5.1 DPPH自由基清除活性
1,1-二苯基-2-三硝基苯肼(DPPH)是一种稳定的自由基,分子结构简单,已大量用于天然产物体外抗氧化活性评价[30]。本文主要研究三叶青原花青素不同质量浓度下对DPPH自由基的清除活性,以此评价AB-8型树脂的纯化工艺效果。图3可知,在0~100 μg/mL的质量浓度区间内,随样品浓度增加,DPPH抗氧化活性增强,呈浓度依赖性(P<0.05)。当浓度大于100 μg/mL时,DPPH自由基清除能力逐渐趋于平缓(P>0.05)。相同浓度条件下,对DPPH自由基的清除活性依次为:V70>V50>V90>L-抗坏血酸>CE,V50与V90相近,V70抗氧化活性约为L-抗坏血酸的1.37 倍,约为CE的1.27 倍,由2.5节可知V70样品中的原花青素纯度约为粗提取物的2.2 倍,表明经AB-8大孔吸附树脂纯化再经70%乙醇洗脱后的三叶青原花青素,抗氧化活性得到进一步提升,也再次印证了70%体积分数乙醇较适宜洗脱。据文献报道,经AB-8树脂纯化的黑果枸杞、白刺果中的原花青素抗氧化活性明显强于L-抗坏血酸[31-32],经X-5大孔树脂纯化得到的鸡血藤、蒙密花原花青素抗氧化活性明显强于L-抗坏血酸[23,28]。综上,采用AB-8型树脂纯化的三叶青原花青素(OPC)抗氧化活性与上述文献报道基本一致,较纯化前抗氧化活性显著增强。
2.5.2 ABTS+自由基清除活性
ABTS+自由基脱色试验是一种用于评价生物样品抗氧化活性的常用方法,具有操作便捷且良好的重复性等优点。由图4可知,L-抗坏血酸、原花青素粗提物、V50、V70、V90对ABTS+自由基都有明显的清除作用,经纯化与洗脱后,原花青素的抗氧化能力得到明显的提高。随着样品质量浓度的增加,ABTS+自由基的清除率也逐渐的增加(P<0.05),当样品质量浓度高于100 μg/mL,ABTS+自由基清除率逐渐接近于100%(P<0.05)。这与DPPH自由基清除率的变化趋势一致,说明原花青素浓度越大,抗氧化能力越强。同一浓度条件下,V70对ABTS+自由基的清除活性最高(P<0.05),比L-抗坏血酸的效果略好,比原花青素粗提物、V50与V90作用效果具有显著的差异(P<0.05);而V50与V90作用效果较为接近。但在相同浓度条件下,原花青素对ABTS+自由基清除率整体上比其对DPPH自由基的清除率高,两者清除率相差明显,说明三叶青原花青素能够更好地清除ABTS+自由基。
2.5.3 α-葡萄糖苷酶(α-Glucosidase)抑制活性
临床上常见的α-葡萄糖苷酶抑制剂阿卡波糖对α-葡萄糖苷酶具有很强的抑制作用,降低多糖分解为葡萄糖的速率,延缓碳水化合物的消化和吸收,减低餐后血糖水平,减少糖尿病并发症的发生,是少数可干预糖耐量受损的口服降糖药之一[33]。法国海岸松(Pinus pinaster)树皮中碧萝芷低聚原花青素、鸡血藤中的原花青素可有效抑制α-葡萄糖苷酶[23,34]。因此,研究不同质量浓度下,不同纯度三叶青原花青素对α-葡萄糖苷酶的抑制活性。由图5可知,随着三叶青原花青素质量浓度不断增加,对α-葡萄糖苷酶的抑制活性不断增强(P<0.05)。V70在12 μg/mL时抑制率最高,达到了89.05%;从图6中可以看出阿卡波糖(阳性对照)对α-葡萄糖苷酶的抑制活性也是随质量浓度增加而增强,在2800 μg/mL时达到最大抑制率为83.76%,因此,三叶青原花青素及三叶青粗提物对α-葡萄糖苷酶的抑制活性均高于阿卡波糖。
不同质量浓度样品对α-葡萄糖苷酶半抑制浓度(IC50)评价对α-葡萄糖苷酶抑制活性结果如表3所示:阿卡波糖的IC50(阳性对照) 为:572.01 μg/mL、V50的IC50为:4.64 μg/mL、V70的IC50为:3.84 μg/mL、V90的IC50为:5.56 μg/mL,抑制活性的顺序依次为:V70>V50>V90>CE,其中,三叶青粗提物(CE)的抑制活性为对照组的41.57倍;而纯化后的样品V70与对照相比,抑制活性提高了148.96倍。通过上述结果,可以明确说明三叶青粗提物自身对α-葡萄糖苷酶的IC50抑制活性较强,而通过AB-8树脂纯化后,抑制活性提升为粗提物3倍以上。
2.6 抗氧化活性与α-葡萄糖苷酶抑制活性之间的相关性
不同纯度的三叶青原花青素与DPPH自由基的清除活性、ABTS+自由基的清除活性及α-葡萄糖苷酶抑制活性之间的相关性分析表明(表4):三叶青原花青素的纯度与DPPH自由基清除活性、ABTS+自由基的清除活性及α-葡萄糖苷酶抑制活性均具有极显著正相关性(P<0.01),各活性指标间也具有极显著正相关性(P<0.01),表明三叶青原花青素对其抗氧化活性有明显作用,与上述结果一致。
表 4 三叶青原花青素纯度与抗氧化指标的相关性Table 4. Correlation between the purity of the T. hemsleyanum Gilg proanthocyanidins and antioxidative activities抗氧化指标 原花青素纯度 DPPH自由基的清除活性 ABTS+自由基的清除活性 α-葡萄糖苷酶抑制活性 DPPH自由基的清除活性 0.881** 1 ABTS+自由基的清除活性 0.865** 0.945** 1 α-葡萄糖苷酶抑制活性 0.718** 0.958** 0.926** 1 注: ** 表示在 0.01 水平上呈极显著相关, * 表示在 0.05 水平上呈显著相关。 3. 结论
选用了D-101、X-5、AB-8、HPD-100、HPD-300共5种不同极性的大孔吸附树脂纯化三叶青原花青素。纯化工艺的最优条件为:选用AB-8型树脂用于三叶青原花青素纯化,上样质量浓度为6.00 mg/mL,上样流速2 BV/h、上样体积11 BV,洗脱流速1.5 BV/h,洗脱剂用量2 BV,70%乙醇体积分数进行洗脱。在此条件下,三叶青中原花青素含量由44.77%上升到97.31%。
对三叶青原花青素纯化前后的DPPH和ABTS+自由基清除活性以及α-葡萄糖苷酶抑制能力进行了考察。结果表明:三叶青粗提物经70%乙醇纯化后的原花青素(V70)纯度最高,约为粗提取物的2.2倍。V70对DPPH自由基、ABTS自由基清除率的IC50分别为71.59 μg/mL与37.97 μg/mL,显著低于其他试验组及阳性对照组(P<0.05),V70对α-葡萄糖苷酶的IC50为3.84 μg/mL,与对照相比,抑制活性提高了148.96 倍。通过相关性分析发现,原花青素纯度与自由基清除率及α-葡萄糖苷酶抑制活性呈显著正相关,更加印证了三叶青中的原花青素具有抗氧化活性以及α-葡萄糖苷酶抑制活性。但原花青素是否为三叶青抗氧化及抑制α-葡萄糖苷酶的主要活性成分需进一步研究。本研究可为三叶青原花青素开发药品、功能性食品、食品添加剂等相关领域提供理论研究基础,促进三叶青资源的可持续开发利用。
-
表 1 大孔吸附树脂对三叶青原花青素的吸附及解吸附能力
Table 1 Adsorption and desorption capacity of macroporous resins for proanthocyanidins from T. hemsleyanum
树脂型号 极性 孔径(nm) 比表面积(m2/g) 饱和吸附量(mg·g−1) 解吸附量(mg·g−1) 解吸附率(%) X-5 弱极性 29~30 500~600 119.85±1.88b 86.46±2.73c 72.15±2.50c D101 非极性 9~10 500~550 113.03±0.64c 90.40±1.17bc 80.20±1.28b AB-8 弱极性 12~16 480~520 132.61±3.50a 124.83±4.08a 94.12±1.12a HPD-100 非极性 8.5~9 650~700 137.68±3.62a 93.2±2.63b 67.72±2.41d HPD-300 弱极性 5~5.5 800~870 122.39±3.44b 73.05±2.03d 59.68±0.21e 注:同列小写字母不同表示差异性显著(P<0.05)。 表 2 乙醇浓度对AB-8型树脂解吸附能力的影响
Table 2 Effects of ethanol concentration on AB-8 resin desorption capability
乙醇体积分数(%) 解吸附率(%) 解吸附量(mg·mL−1) 50 71.23 82.65 60 83.45 91.43 70 96.86 115.67 80 85.21 92.62 90 82.17 89.12 表 3 不同样品原花青素纯度及生物活性
Table 3 Purities and biological activities of proanthocyanidin from different samples
L-抗坏血酸 阿卡波糖 CE(粗提物) V50 V70 V90 原花青素纯度(%) − − 44.77±0.88d 82.43±0.67c 97.31±0.96a 87.04±1.03b 对DPPH自由基清除率的IC50(μg/mL) 97.95±0.69a − 91.26±1.43b 81.06±0.23d 71.59±0.99e 85.28±1.06c 对ABTS+自由基清除率的IC50(μg/mL) 41.74±0.43bc − 94.72±0.21a 48.10±1.3b 37.97±0.25c 50.04±1.25b 对α-葡萄糖苷酶抑制率的IC50(μg/mL) − 572.01±9.85a 13.76±0.16b 4.64±0.13c 3.84±0.09c 5.56±0.23c 注:V50、V70、V90分别为50%、70%、90%乙醇洗脱的三叶青原花青素纯化物。同行数据后小写字母表示差异显著(P<0.05)。 表 4 三叶青原花青素纯度与抗氧化指标的相关性
Table 4 Correlation between the purity of the T. hemsleyanum Gilg proanthocyanidins and antioxidative activities
抗氧化指标 原花青素纯度 DPPH自由基的清除活性 ABTS+自由基的清除活性 α-葡萄糖苷酶抑制活性 DPPH自由基的清除活性 0.881** 1 ABTS+自由基的清除活性 0.865** 0.945** 1 α-葡萄糖苷酶抑制活性 0.718** 0.958** 0.926** 1 注: ** 表示在 0.01 水平上呈极显著相关, * 表示在 0.05 水平上呈显著相关。 -
[1] 范世明, 徐惠龙, 谢心月, 等. 三叶青叶指纹图谱研究及8种酚类成分含量测定[J]. 中国中药杂志,2016,41(21):3975−3981. [FAN S M, XU H L, XIE X Y, et al. Study on UHPLC fingerprint and determination of eight phenolic components of Tetrastigma hemsleyanum leaves[J]. Chinese Journal of Chinese Materia Media,2016,41(21):3975−3981. [2] 王满生, 杨晶, 王延周. 莲房原花青素提取纯化及其抗氧化活性研究进展[J]. 食品科技,2020,45(8):174−179. [WANG M S, YANG J, WANG Y Z. Research progress on extraction, purification and antioxidant activities of lotus seedpod procyanidins[J]. Food Science and Technology,2020,45(8):174−179. [3] DOWNING L E, FERGUSON B S, RODRIGUEZ K, et al. A grape seed procyanidin extract inhibits HDAC activity leading to increased Pparα phosphorylation and target-gene expression[J]. Molecular Nutrition & Food Research,2017,61(2):1600347.
[4] 郝小燕, 牟春堂, 乔栋, 等. 葡萄籽原花青素对羔羊瘤胃发酵、血清炎症及抗氧化指标的影响[J]. 中国农业科学,2021,54(10):2239−2248. [HAO X Y, MU C T, QIAO D, et al. Effects of high-concentrate diet supplemented with grape seed proanthocyanidins on rumen fermentation, inflammatory and antioxidant indicators of rumen and serum in lambs[J]. Scientia Agricultura Sinica,2021,54(10):2239−2248. doi: 10.3864/j.issn.0578-1752.2021.10.019 [5] VALLS R M, LLAURADÓ E, FERNÁNDEZ-CASTILLEJO S, et al. Effects of low molecular weight procyanidin rich extract from french maritime pine bark on cardiovascular disease risk factors in stage-1 hypertensive subjects: Randomized, double-blind, crossover, placebo-controlled intervention trial[J]. Phytomedicine: International Journal of Phytotherapy and Phytopharmacology,2016,23(12):1451−1461. doi: 10.1016/j.phymed.2016.08.007
[6] RONG S, HU X, ZHAO S, et al. Procyanidins extracted from the litchi pericarp ameliorate atherosclerosis in ApoE knockout mice: their effects on nitric oxide bioavailability and oxidative stress[J]. Food & Function, 2017, 8(11):4210-4216.
[7] 谢海, 战同霞, 钟明强. 原花青素对老年痴呆患者脑功能的影响[J]. 中国误诊学杂志,2008,8(24):5866−5867. [XIE H, ZHAN T X, ZHONG M Q. The effect of proanthocyanidins on brain function of patients with senile dementia[J]. Chinese Journal of Misdiagnostics,2008,8(24):5866−5867. doi: 10.3969/j.issn.1009-6647.2008.24.061 [8] HELLSTROM J K, TORRONEN A R, MATTILA P H. Proanthocyanidins in common food products of plant origin[J]. Journal of Agricultural & Food Chemistry,2009,57(17):7899−7906.
[9] 张朝, 唐志书, 刘红波. 沙棘原花青素的提取、纯化及药理学研究进展[J]. 中南药学,2017,15(7):943−946. [ZHANG Z, TANG Z S, LIU H B. Extraction, purification and pharmacology progress of proanthocyanidins from Hippophae rhamnoidos Linn[J]. Central South Pharmacy,2017,15(7):943−946. doi: 10.7539/j.issn.1672-2981.2017.07.020 [10] ZHANG B B, YANG H F, CHEN M S, et al. Microwave and enzyme-assisted extraction of grape seed procyanidins and study of their antibacterial activity[J]. Modern Food ence and Technology,2017,33(8):146−154.
[11] ZHOU H C, TAN N F, LIN Y M, et al. Relationships between degree of polymerization and antioxidant activities: A Study on proanthocyanidins from the leaves of a medicinal mangrove plant Ceriops tagal[J]. PLoS One,2014,9(10):e107606. doi: 10.1371/journal.pone.0107606
[12] BODOIRA R, ROSSI Y, MONTENEGRO M, et al. Extraction of antioxidant polyphenolic compounds from peanut skin using water-ethanol at high pressure and temperature conditions[J]. Journal of Supercritical Fluids,2017:57−65.
[13] Cyboran-Mikołajczyk S, Csonka Ákos, Molnar J, et al. In vitro studies of anti-hemolytic and cytotoxic activity of procyanidin-rich extract from the leaves of Actinidia arguta[J]. Polish Journal of Food and Nutrition Sciences,2017,68(2):171−177.
[14] LIU D D, CAO G, HAN L K, et al. Flavonoids from Radix Tetrastigmae inhibit TLR4/MD-2 mediated JNK and NF-kappaB pathway with anti-inflammatory properties[J]. Cytokine,2016,84:29−36. doi: 10.1016/j.cyto.2015.08.003
[15] SUN Y, LI H Y, HU J, et al. Qualitative and quantitative analysis of phenolics in Tetrastigma hemsleyanum and their antioxidant and antiproliferative activities[J]. Journal of Agricultural Food Chemistry,2013,61(44):10507−10515. doi: 10.1021/jf4037547
[16] 许文, 傅志勤, 林婧, 等. HPLC-Q-TOF-MS和UPLC-QqQ-MS的三叶青主要成分定性与定量研究[J]. 中国中药杂志,2014,39(22):4365. [XU W, BO Z Q, LIN J, et al. Qualitative and quantitative analysis of major constituents in Tetrastigma hemsleyanum by HPLC-Q-TOF-MS and UPLC-QqQ-MS[J]. Chinese Journal of Chinese Materia Media,2014,39(22):4365. [17] 李鑫, 刘景玲, 李彦, 等. 三叶青原花青素结构分析[J]. 食品科学,2018,39(16):247−255. [LI X, LIU J L, LI Y, et al. Structural analysis of proanthocyanidins from Tetrastigma hemsleyanum Diels et Gilg[J]. Food Science,2018,39(16):247−255. doi: 10.7506/spkx1002-6630-201816036 [18] 赵文娟, 宋扬, 杨洪江. 大孔吸附树脂纯化黑果枸杞中的原花青素[J]. 食品工业科技,2017,38(22):189−194. [ZHAO W J, SONG Y, YANG H J. Purification of the proanthocyanidins from Lycium ruthenicum Murr. by macroporous resin[J]. Science and Technology of Food Industry,2017,38(22):189−194. [19] 褚仕超, 张宏, 邓莉, 等. 蚕豆皮原花青素纯化工艺优化[J]. 食品科技,2013,38(9):174−178,184. [CHU S C, ZHANG H, DENG L, et al. Optimization purifi cation of proanthocyanidins from Faba bean episperm[J]. Food Science and Technology,2013,38(9):174−178,184. [20] 滕飞, 李丽, 皮子凤. 黑果腺肋花楸原花青素分离纯化工艺研究[J]. 长春师范大学学报,2019,38(4):67−72. [TENG F, LI L, PI Z F. Study on extraction process and purification conditions of proanthocyanidins from Aronia melanocarpa Elliot[J]. Journal of Changchun Normal University,2019,38(4):67−72. [21] 何志贵, 聂相珍, 惠小涵, 等. 超声波辅助法提取三叶青原花青素工艺的研究[J]. 西北林学院学报,2019,34(3):207−211. [HE Z G, NIE X Z, HUI X H, et al. Ultrasonic-assisted extraction of proanthocyanidins from Tetrastigma hemsleyanum[J]. Journal of Northwest Forestry University,2019,34(3):207−211. doi: 10.3969/j.issn.1001-7461.2019.03.33 [22] DONG Y, ZHAO M, SUN-WATERHOUSE D, et al. Absorption and desorption behaviour of the flavonoids from Glycyrrhiza glabra L. leaf on macroporous adsorption resins[J]. Food Chemistry,2015,168:538−545. doi: 10.1016/j.foodchem.2014.07.109
[23] 李彦, 李鑫, 刘景玲, 等. 鸡血藤原花青素的纯化及活性评价[J]. 食品科学,2016,37(17):45−51. [LI Y, LI X, LIU J L, et al. Purification and bioactivity evaluation of proanthocyanidins from Spatholobi Caulis[J]. Food Science,2016,37(17):45−51. doi: 10.7506/spkx1002-6630-201617008 [24] LÓPEZ-ANGULO G, MONTES-AVILA J, SÁNCHEZ-XIMELLO L, et al. Anthocyanins of Pithecellobium dulce (Roxb.) Benth. fruit associated with high antioxidant and α-glucosidase inhibitory activities[J]. Plant Foods for Human Nutrition,2018(73):308−313.
[25] 赵平, 张月萍, 任鹏. AB-8大孔树脂对葡萄籽原花青素的吸附过程[J]. 化工学报,2013,64(3):980−985. [ZHAO P, ZHANG Y P, REN P. Adsorption process of proanthocyanidins in AB-8 macroporous resin[J]. CIESC Journa,2013,64(3):980−985. doi: 10.3969/j.issn.0438-1157.2013.03.027 [26] 马小琴, 王晓敏, 周凡. 大孔吸附树脂法分离纯化葡萄籽中原花青素[J]. 食品研究与开发,2017,38(16):54−57. [MA X Q, WANG X M, ZHOU F. Separation and purification of procyanidins in grape seed with macroporous adsorption resin[J]. Food Research and Development,2017,38(16):54−57. doi: 10.3969/j.issn.1005-6521.2017.16.012 [27] 蒋德旗, 李慧斌, 蓝雪叶, 等. AB-8树脂吸附分离苹果原花青素的研究[J]. 饲料工业,2014,35(3):18−20. [JIANG D Q, LI H B, LAN X Y, et al. Study on the adsorption and separation of procyanidins from apple with macroporous resin AB-8[J]. Feed Industry,2014,35(3):18−20. [28] 刘景玲, 李匡元, 陈惜燕, 等. 密蒙花黄酮的纯化及抗氧化活性研究[J]. 食品研究与开发,2018,39(7):52−59. [LIU J L, LI K Y, CHEN X Y, et al. Purification and antioxidant ability evaluation of flavonoids from Buddleiae flos[J]. Food Research and Development,2018,39(7):52−59. doi: 10.3969/j.issn.1005-6521.2018.07.009 [29] 杨志娟, 曾真, 吴晓萍. 火龙果皮原花青素提取纯化及定性分析[J]. 食品科学,2015(2):75−79. [YANG Z J, ZENG Z, WU X P. Extraction, purification and qualitative analysis of proanthocyanidins from pitaya peel[J]. Food Science,2015(2):75−79. doi: 10.7506/spkx1002-6630-201502014 [30] 熊双丽, 卢飞, 史敏娟, 等. DPPH自由基清除活性评价方法在抗氧化剂筛选中的研究进展[J]. 食品工业科技,2012,33(8):380−383. [XIONG S L, LU F, SHI M J, et al. Advanement of evaluation methods about DPPH radical scavenging activity in screening antioxidant[J]. Science and Technology of Food Industry,2012,33(8):380−383. [31] 李三省, 许丹丹, 张富粟, 等. AB-8大孔树脂纯化黑果枸杞原花青素及其稳定性研究[J]. 中国食品添加剂,2018(3):106−114. [LI S X, X D D, ZHANG F L, et al. Purification of proanthocyanidins from Lycium ruthenicum Murr. by AB-8 macroporous resin and its stability[J]. China Food Additives,2018(3):106−114. doi: 10.3969/j.issn.1006-2513.2018.03.009 [32] 浦娜娜. 白刺果原花青素的提取、纯化及抗氧化活性研究[D]. 济南: 齐鲁工业大学, 2019. PU N N. Study of Extraction, purification and antioxidant activity of proanthocyanidins from Nitraria[D]. Jinan: Qilu University of Technology, 2019.
[33] DONG H Q, LI M, ZHU F, et al. Inhibitory potential of trilobatin from Lithocarpus polystachyus Rehd against α-glucosidase and α-amylase linked to type 2 diabetes[J]. Food Chemistry,2012,130(2):261−266. doi: 10.1016/j.foodchem.2011.07.030
[34] SCHFER A, HGGER P. Oligomeric procyanidins of French maritime pine bark extract (Pycnogenol) effectively inhibit α-glucosidase[J]. Diabetes Research and Clinical Practice,2007,77(1):41−46. doi: 10.1016/j.diabres.2006.10.011





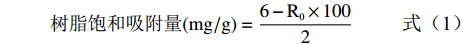
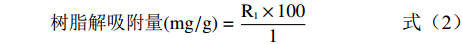
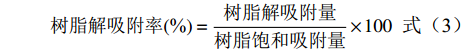
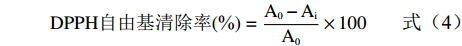
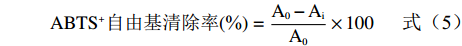
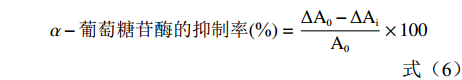
 下载:
下载:






 下载:
下载:
