Research on the Improvement Effects of Collagen Peptides and Tremella fuciformis Polysaccharides on the Skin Texture of Aging Mice and Its Mechanism
-
摘要: 目的:比较胶原蛋白肽和银耳多糖对衰老皮肤改善效果及探究作用机理。方法:以120 mg/kg D-半乳糖腹腔注射构建衰老小鼠模型,分为模型组、胶原蛋白肽组、银耳多糖组,同时分别灌胃生理盐水、胶原蛋白肽830 mg/kg·BW和银耳多糖100 mg/kg·BW,连续8周,正常小鼠作为对照组。实验结束后取小鼠背部皮肤检测羟脯氨酸和透明质酸含量,取组织测定超氧化物歧化酶(Superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-Px)活性及丙二醛(Malondialdehyde,MDA)浓度,以及检测炎性细胞因子水平及肠道中短链脂肪酸(short chain fatty acids,SCFAs)浓度。结果:在试验剂量下,胶原蛋白肽和银耳多糖都能极显著提升衰老皮肤中羟脯氨酸和透明质酸含量(P<0.01),且银耳多糖优于胶原蛋白肽。进一步检测发现胶原蛋白肽和银耳多糖极显著提高了血清、肝脏和心脏部位GSH-Px、SOD活性并降低MDA浓度(P<0.01),两者作用效果无差异,但银耳多糖降低血清中IL-1β、TNF-α的效果比胶原蛋白肽更好(P<0.01)。对肠道中6种SCFAs检测表明,胶原蛋白肽对衰老小鼠结肠部位总SCFAs无明显影响,但增加了乙酸、丙酸浓度,而银耳多糖则逆转了D-半乳糖所致结肠部位SCFAs浓度的改变。结论:胶原蛋白肽和银耳多糖对小鼠衰老皮肤的改善作用可能是通过提高机体抗氧化酶活性和抗炎作用而实现。Abstract: Objective: To compare the improvement effects of collagen peptides and Tremella fuciformis polysaccharides (TFP) on aging skin texture and explore the underlying mechanism of the action. Method: Aging mice models were established by intraperitoneal injection of D-galactose at a dosage of 120 mg/kg, which were randomly divided into three groups: Model (given saline), collagen (given collagen peptides 830 mg/kg·BW), and TFP (given TFP 100 mg/kg·BW). Adult mice were set as normal group (Normal). The experiments lasted for 8 weeks. All mice were killed at the end of the experiment. The contents of hydroxyproline and hyaluronic acid in the skin, the activities of glutathione peroxidase (GSH-Px), superoxide dismutase (SOD) and concentrations of malondialdehyde (MDA) in several tissues, the levels of inflammatory cytokines in serum, and the concentrations of intestinal short chain fatty acids (SCFAs) were measured. Results: Collagen peptides and TFP significantly increased the contents of hydroxyproline and hyaluronic acid in aging skin in mice (P<0.01), and the improving effects of TFP were better than that of collagen peptides. Further, both of collagen peptides and TFP significantly improved the activities of GSH-Px and SOD, and reduced the concentrations of MDA (P<0.01) in serum, liver, and heart, but there was no difference between Collagen group and TFP group. Interestingly, TFP showed a better inhibitory effect on the concentrations of IL-1β and TNF-α in serum compared with collagen peptide (P<0.01), though both of them exhibited anti-inflammation activity in aging mice. In addition, the detections of SCFAs in the intestine showed that collagen peptides had no obvious effect on the total SCFAs but increased the concentrations of acetic acid and propionic acid in the colon of aging mice, whereas TFP reversed the alterations in the concentrations of SCFAs in the colon induced by the treatment of D-galactose. Conclusion: Collagen peptides and TFP might improve the aging skin texture by increasing antioxidant activities and anti-inflammatory effects in ageing mice.
-
胶原蛋白是机体胞外基质的主要结构蛋白,迄今为止已报道有29种胶原蛋白,它们分布在不同的组织中,例如I型在真皮、骨骼、角膜、韧带和肌腱,II型分布在玻璃体和软骨中,III型在肺、血管壁、脾脏和肝脏的网状纤维中,IV型在基底膜中而V型常与I型(如角膜)共存[1]。由于其优异的生物相容性、凝胶和表面特性,使得胶原蛋白在食品、生物医药、化妆品工业具有广泛应用[2]。胶原蛋白肽(Collagen peptides)是胶原蛋白利用化学法或生物酶法降解得到的产物,进一步提高了胶原蛋白的水溶性和生物活性[3]。国内外研究表明,胶原蛋白肽具有抗氧化、抗衰老、免疫调节、促进组织/伤口修复、抑制血管紧张素-I转化酶、抗肿瘤、抗凝、抗菌等活性[1,4]。在随机双盲安慰剂对照实验中,年龄较大人群(>35岁)补充胶原蛋白肽能减少皮肤皱纹、增加弹性、提高皮肤胶原蛋白原和弹性蛋白含量[5-6]。胶原蛋白肽所具有的物理及生物活性使其成为在美容功能食品中热门的功能原料[7-8]。
银耳(Tremella fuciformis Berk.)在分类学上属担子菌纲银耳科(Tremellaeeae)银耳属(Tremella)。中医认为银耳具有滋阴润肺作用,是具有悠久食用历史、大众熟知美容养颜药食同源食材[9]。银耳多糖(Tremella fuciformis polysaccharides, TFP)是银耳子实体中最主要的功效成分。近几十年来研究发现,银耳多糖具有免疫调节、抗肿瘤、抗氧化、抗衰老、降血糖、降胆固醇、修复记忆损伤等生理功能[10]。同时,银耳多糖作为一类大分子有机物,具有良好的流变和凝胶特性[11],使得银耳多糖在食品、医药、化妆品等多个领域也具有巨大的市场潜力[12]。
由于胶原蛋白肽和银耳多糖均属于天然来源大分子物质,且具有良好的物理加工特性和生物活性,作为功能原料被广泛应用于美容功能食品中。小鼠实验发现银耳多糖在100~400 mg/kg·BW剂量可通过提高衰老机体抗氧化能力而增加衰老皮肤中胶原蛋白含量[13];安慰剂对照的人体临床试验表明,2.5 g/d胶原蛋白肽连续服用8周,可以增加皮肤中胶原蛋白原和弹性蛋白的含量[6],可见两者抗皮肤衰老作用明显。众所周知,衰老与抗衰老研究一直是学术研究热点[14],除自由基理论外[15],近年来研究提出慢性炎症、肠道菌群也与机体衰老进程紧密相关[16-17]。为给功能食品研发人员提供两者抗皮肤老化效果差异、可能机理和经济性选择时作参考,本文选择商品化胶原蛋白肽和银耳多糖,考察它们对衰老动物模型皮肤中羟脯氨酸和透明质酸含量影响,从调节体内抗氧化酶活性、炎症因子水平和肠道SCFAs产生角度探讨可能作用机理。
1. 材料与方法
1.1 材料与仪器
SPF级昆明雄性小鼠(18±2 g) 4周龄,实验动物合格证号SCXK(粤)(2018-0002),购自广东省医学实验动物中心;GELITA胶原蛋白肽-PEPTIPLUS XB 分子量<10 kDa,嘉莉达明胶有限公司;Dr. BETA银耳多糖 Mw 500 kDa,多糖含量≥85%,多糖博士生物科技(广州)有限公司;D-半乳糖 99%分析纯,上海麦克林公司;丙二醛(MDA)试剂盒、总超氧化物歧化酶(SOD)测定试剂盒、谷胱甘肽过氧化物酶(GSH-Px)试剂盒 南京建成生物科技有限公司;小鼠IL-1β ELISA试剂盒、小鼠TNF-α ELISA试剂盒、小鼠透明质酸ELISA试剂盒、小鼠羟脯氨酸ELISA试剂盒 江苏酶免实业有限公司;PBS缓冲液 Gibco公司;BCA蛋白定量试剂盒、RIPA裂解液、蛋白酶抑制剂、磷酸酶抑制剂 北京康为世纪生物科技有限公司;其他化学试剂 均为国产分析纯。
SIGMA3-18K高速冷冻离心机 德国Sigma公司;ELx800酶标仪 美国BioTek公司;TissueLyser LT中低通量组织研磨器 德国Qiagen;恒温水浴箱 富华仪器有限公司;BS224S电子天平 赛多利斯科学仪器(北京)有限公司;2010PLUSSAF气相色谱仪 岛津仪器公司;毛细管色谱柱DB-FATWAX 安捷伦仪器公司;pH计 瑞士梅特勒Five Easy Plus。
1.2 实验方法
1.2.1 动物实验方法
动物饲养于SPF级动物房(广州中医药大学实验动物中心),许可证编号为SYXK(粤)(2018-0085)。动物房环境温度为20~26 ℃,日温差不超过4 ℃,相对湿度40%~70%,最小换气次数15 次/h,12 h照明/12 h黑暗明暗交替,工作照度不小于200 Lx,动物照度15~20 Lx,环境符合GB 14925-2010屏障环境技术要求,实验伦理由广州中医药大学实验动物伦理委员会审查批准。动物自由摄食饮水,动物适应两周后按体重随机分四组(n=8):正常对照组(Normal)、模型对照组(Model)、胶原蛋白肽组(Collagen,剂量830 mg/kg·BW)、银耳多糖组(TFP,剂量100 mg/kg·BW)。按文献[13]报道衰老小鼠造模方法,正常对照组腹腔注射生理盐水,其余各组每天腹腔注射D-半乳糖120 mg/kg,同时实验组灌胃上述剂量样品(按0.1 mL/10 g体积),模型组及对照组灌胃同体积生理盐水,每周称重,连续8周。
1.2.2 组织中氧化应激指标和细胞因子浓度检测
末次给药后,小鼠禁食不禁水。第2 d,麻醉后眼眶静脉丛取血,3500 r/min、4 ℃分离血清后按试剂盒操作说明测定血清中SOD、GSH-Px活性和MDA、IL-1β、TNF-α浓度。脱颈椎处死小鼠,分别收集小肠和结肠的内容物,标记后迅速放入液氮中速冻,−80 ℃保存待测。
1.2.3 皮肤中羟脯氨酸、透明质酸含量测定
取各组小鼠背部脱毛后皮肤约1 cm2,用丙酮-乙醚(1:1)脱脂,切碎晾干后精密称取20 mg,加PBS匀浆后按试剂盒操作说明检测。
1.2.4 SOD、GSH-Px活性和MDA浓度检测
取小鼠心、肝组织用预冷PBS漂洗去除血液,加PBS制备成10%匀浆液,离心5000 r/min、5 min,取上清。先用BCA试剂盒进行蛋白定量,再测定各组SOD、GSH-Px活性和MDA含量。
1.2.5 小肠、结肠内容物pH检测
分别取小肠、结肠内容物用超纯水以1:1稀释后[18],用pH计测定稀释液pH。
1.2.6 小肠、结肠内容物中短链脂肪酸测定
肠内容物按文献报道方法依次稀释、酸化和乙醚萃取后离心3000 r/min、5 min,取上清液,用0.22 μm滤膜过滤后进样[19]。气相色谱条件:DB-FATWAX毛细管柱(30 m),初始温度120 ℃保持2 min,5 ℃/min升至140 ℃、保持3 min,10 ℃/min升至170 ℃、保持5 min,进样口温度250 ℃,检测器温度250 ℃,分流比为25:1,高纯氦气(99.99%)柱流量为1.8 mL/min。准确称取乙酸、丙酸、正丁酸、异丁酸、正戊酸、异戊酸标准品,用超纯水分别稀释定容制备标准品溶液,同法测定。
1.3 数据处理
所有数据均以Mean±SD形式表示,SPSS20.0软件进行统计分析。各组进行组间比较之前先进行正态分布和方差齐性检验,组间比较采用one-way ANOVA进行统计检验,P<0.05代表有显著性差异。
2. 结果与分析
2.1 小鼠体征情况
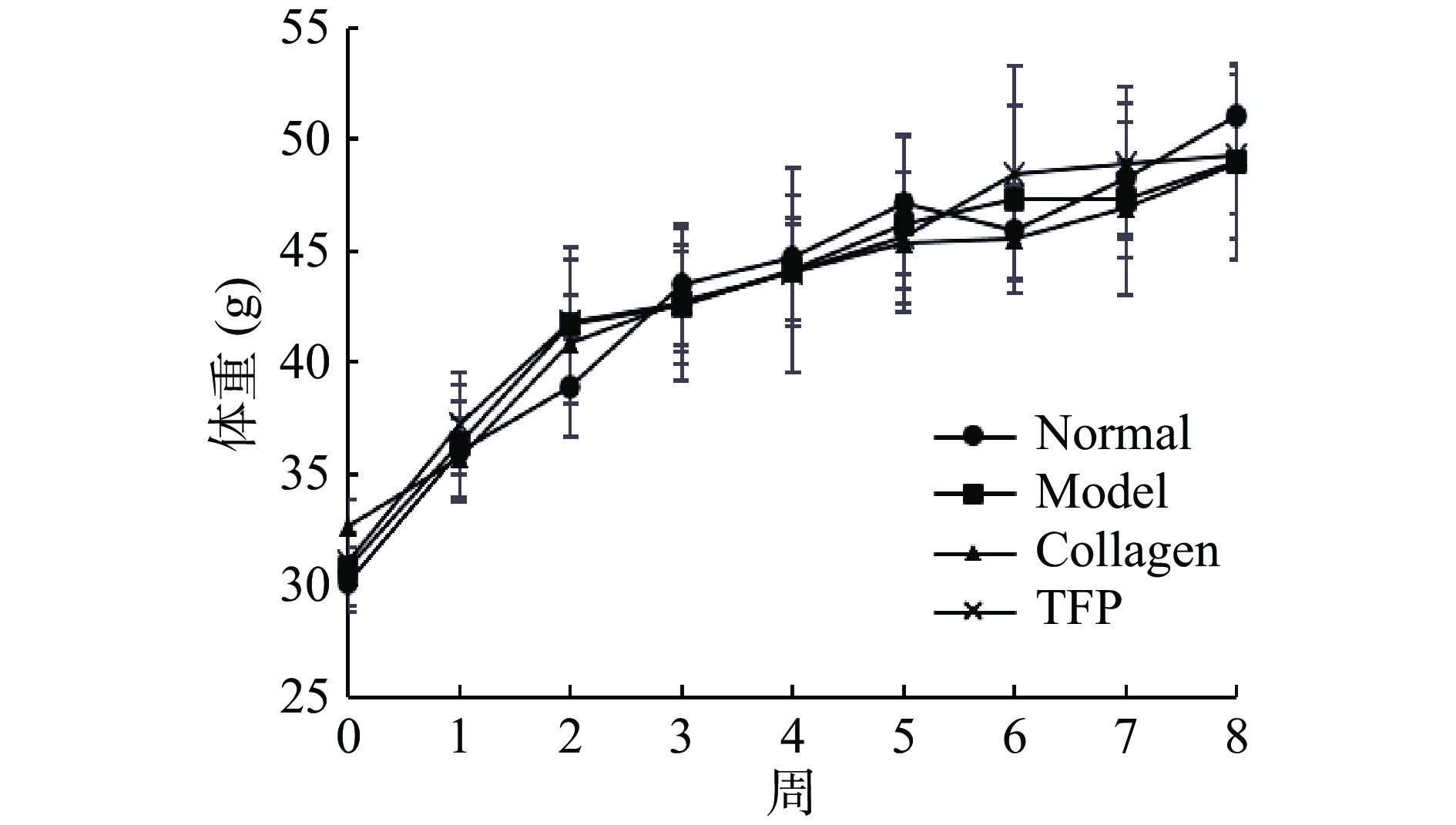
八周实验过程中,Normal组小鼠毛色光亮,行为正常;Model组小鼠则毛色松散缺乏光泽,并逐渐产生精神萎靡、活动迟缓等衰老体征,而其他给予胶原蛋白肽(Collagen组)及银耳多糖(TFP组)的两组小鼠,其一般体征情况与模型组对比,衰老体征有所改善。小鼠体重增长情况是反应生命体征的一个重要指标,实验过程中各组小鼠体重缓慢增长,各组间体重并无明显差异(图1),表明胶原蛋白肽、银耳多糖对小鼠生长发育无不良影响。
2.2 小鼠皮肤中羟脯氨酸和透明质酸含量变化
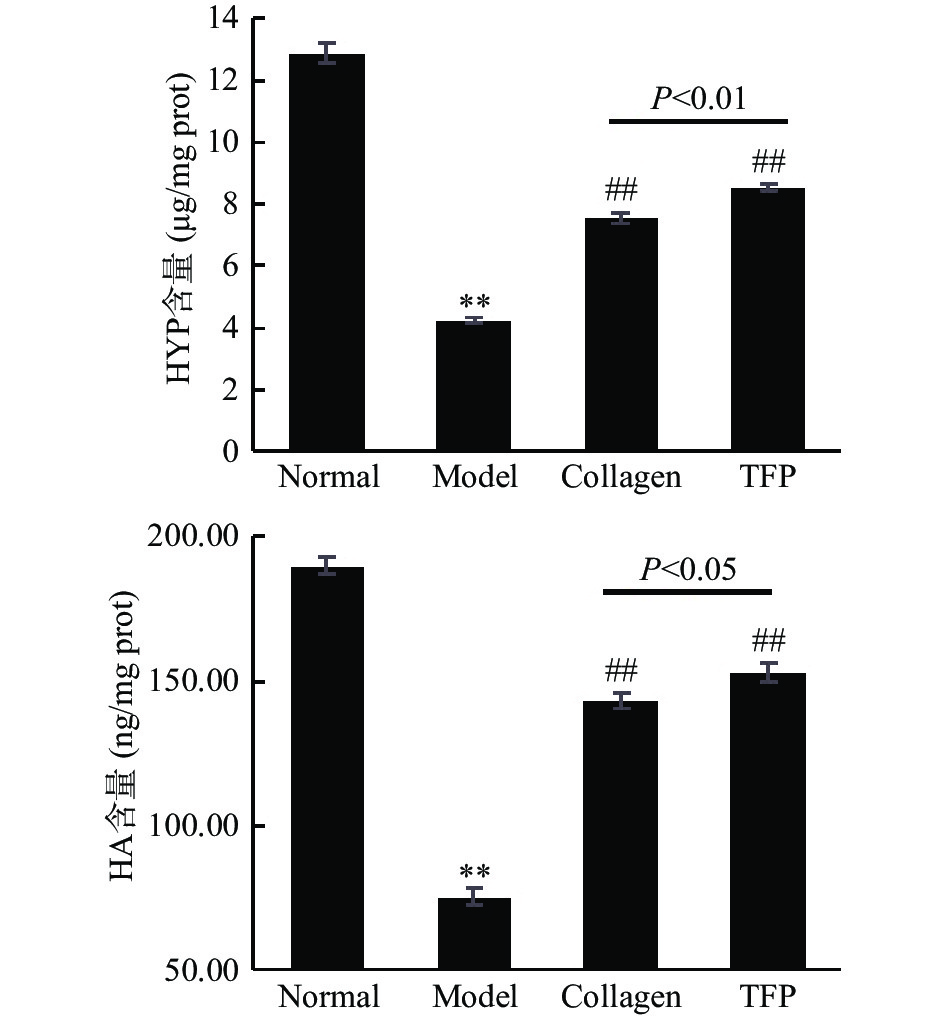
羟脯氨酸是胶原蛋白的特征性氨基酸。据报道,人体衰老过程皮肤中胶原蛋白和透明质酸含量下降[20-21]。因此,皮肤中羟脯氨酸、透明质酸的含量反映了皮肤衰老的程度。如图2所示,D-半乳糖连续8周导致Model组小鼠皮肤中羟脯氨酸和透明质酸含量极显著下降(与Normal组比较,P<0.01),形成皮肤衰老模型,而胶原蛋白肽、银耳多糖可以极显著提升衰老皮肤中羟脯氨酸和透明质酸含量(Collagen vs Model,TFP vs Model,P<0.01)。这些结果与此文献[13,22]报道相似,但胶原蛋白肽比胶原蛋白的起效剂量更低。此外,TFP组中羟脯氨酸含量极显著高于Collagen组(8.52±0.13 vs 7.55±0.18 μg/mg prot,P<0.01),TFP组中透明质酸含量明显高于Collagen组(153.06±3.11 vs 143.36±2.66 ng/mg prot,P<0.05),表明在试验剂量下,银耳多糖对衰老皮肤中羟脯氨酸和透明质酸含量的改善作用优于胶原蛋白肽(图2)。
2.3 体内GSH-Px、SOD活性和MDA含量变化
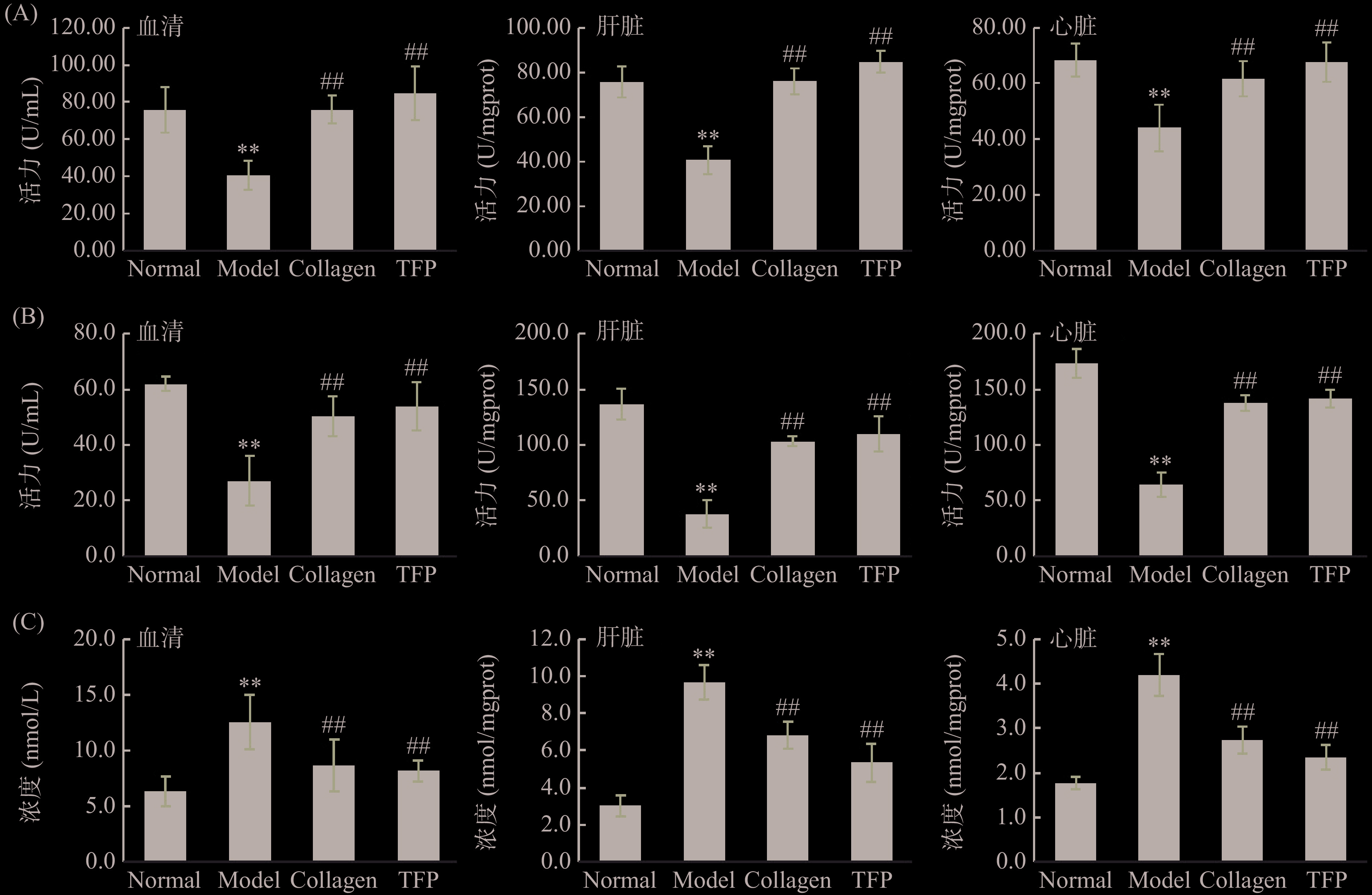
GSH-Px、SOD是机体内清除自由基的抗氧化酶,MDA浓度反映了脂质被氧化的程度,都是衡量机体衰老程度的生化指标。D-半乳糖处理后,Model组小鼠血清、肝脏、心脏部位的GSH-Px、SOD活性极显著下降而MDA浓度极显著上升(P<0.01)(见图3),表明衰老小鼠造模成功。自由基衰老理论指出,在衰老过程中机体内SOD、GSH-Px和CAT等抗氧化酶活性降低,清除自由基能力减弱,使得自由基过量积累导致细胞内氧化应激增加,损伤细胞器结构和功能完整性,进而加速衰老[15]。因此,提高机体抗氧化酶活性减少氧化应激具有抗衰老作用。在本试验中,胶原蛋白肽和银耳多糖可以显著提高衰老小鼠血液、肝脏、心脏组织中GSH-Px和SOD活性(与Model比较,P<0.01),但两者提高效果无显著性差异(P>0.05,图3A~图3B)。对MDA浓度检测表明,胶原蛋白肽和银耳多糖均能降低各组织中MDA浓度(P<0.01),尽管TFP组相比Collagen组在血清、肝脏、心脏部位MDA浓度有更低趋势(8.18±0.95 vs 8.66±2.36 nmol/L,5.34±1.04 vs 6.82±0.72 nmol/L,2.34±0.27 vs 2.73±0.31 nmol/L),但两者无显著性差异(图3C,P>0.05)。由此表明在试验剂量下,胶原蛋白肽和银耳多糖对衰老机体抗氧化酶活力具有明显提升作用,但两者效果无明显差异。根据自由基衰老理论,当皮肤中自由基产生和清除的平衡被打破,氧化应激压力增加会导致皮肤衰老[23],因此提高衰老模型小鼠皮肤组织中SOD酶活、降低MDA浓度与增加皮肤中羟脯氨酸和透明质酸含量直接相关[22,24]。然而,在本实验中,胶原蛋白肽与银耳多糖对衰老小鼠体内抗氧化酶活力提高程度相当,但银耳多糖对衰老皮肤中羟脯氨酸、透明质酸含量的改善程度却优于胶原蛋白肽,提示提高抗氧化酶活性并非抗皮肤衰老的唯一途径。
2.4 血清中IL-1β和TNF-α浓度的变化
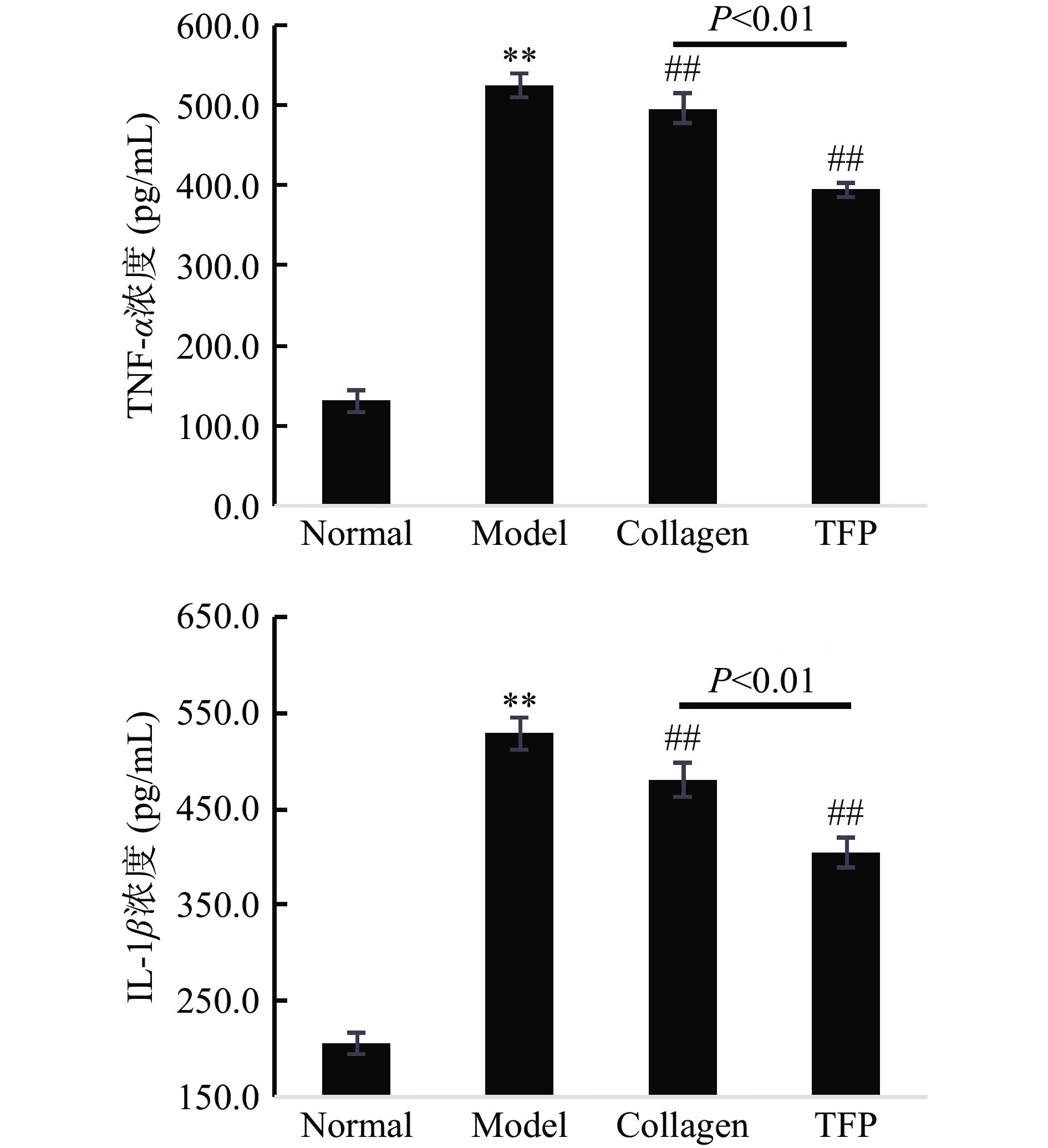
近年来研究提出,慢性进行性发炎性细胞因子水平增高也是加速衰老的原因之一,称为炎性衰老,表现为血液中炎症反应标志物如TNF-α、IL-1β、C-反应蛋白的明显增加[16]。为此,测定各组小鼠血清中发炎性细胞因子TNF-α、IL-1β水平。如图4所示,与Normal组相比,Model组小鼠血清炎性细胞因子TNF-α、IL-1β极显著升高(P<0.01),表明衰老小鼠处于炎症状态。与Model组比较,Collagen组和TFP组血清中TNF-α、IL-1β水平极显著下降(P<0.01),表明胶原蛋白肽、银耳多糖具有良好的抗炎作用,与文献[4,12]报道相一致;此外,TFP组的TNF-α、IL-1β浓度比Collagen组更低(395.0±8.3 vs 496.4±19.1 pg/mL,404.1±15.6 vs 480.0±17.4 pg/mL,P<0.01),说明在试验剂量下,银耳多糖对衰老小鼠炎性因子分泌的抑制作用比胶原蛋白肽强(图4)。机体在炎症状态下,能促进基质金属蛋白酶(Matrix metalloproteinases,MMPs)的表达和活性增加,MMPs是一类调控细胞外基质降解与重塑的重要蛋白酶,能降解细胞外基质的所有成分如胶原、纤维粘连蛋白等[25]。因此,降低衰老模型的炎性因子水平可降低MMPs表达和活性,从而减少胶原蛋白和透明质酸降解延缓皮肤衰老。据报道,胶原蛋白肽的抗炎作用与其抑制NF-κB转录因子有关[4,26],而银耳多糖可通过抑制Akt、p38MAPK、NF-κB多条胞内信号通路降低LPS处理的免疫细胞内活性氧水平和抑制炎性细胞因子分泌[27]。由此提示,与胶原蛋白肽相比,银耳多糖能通过多途径发挥抗皮肤衰老作用,从而更有效改善衰老皮肤中羟脯氨酸和透明质酸含量。
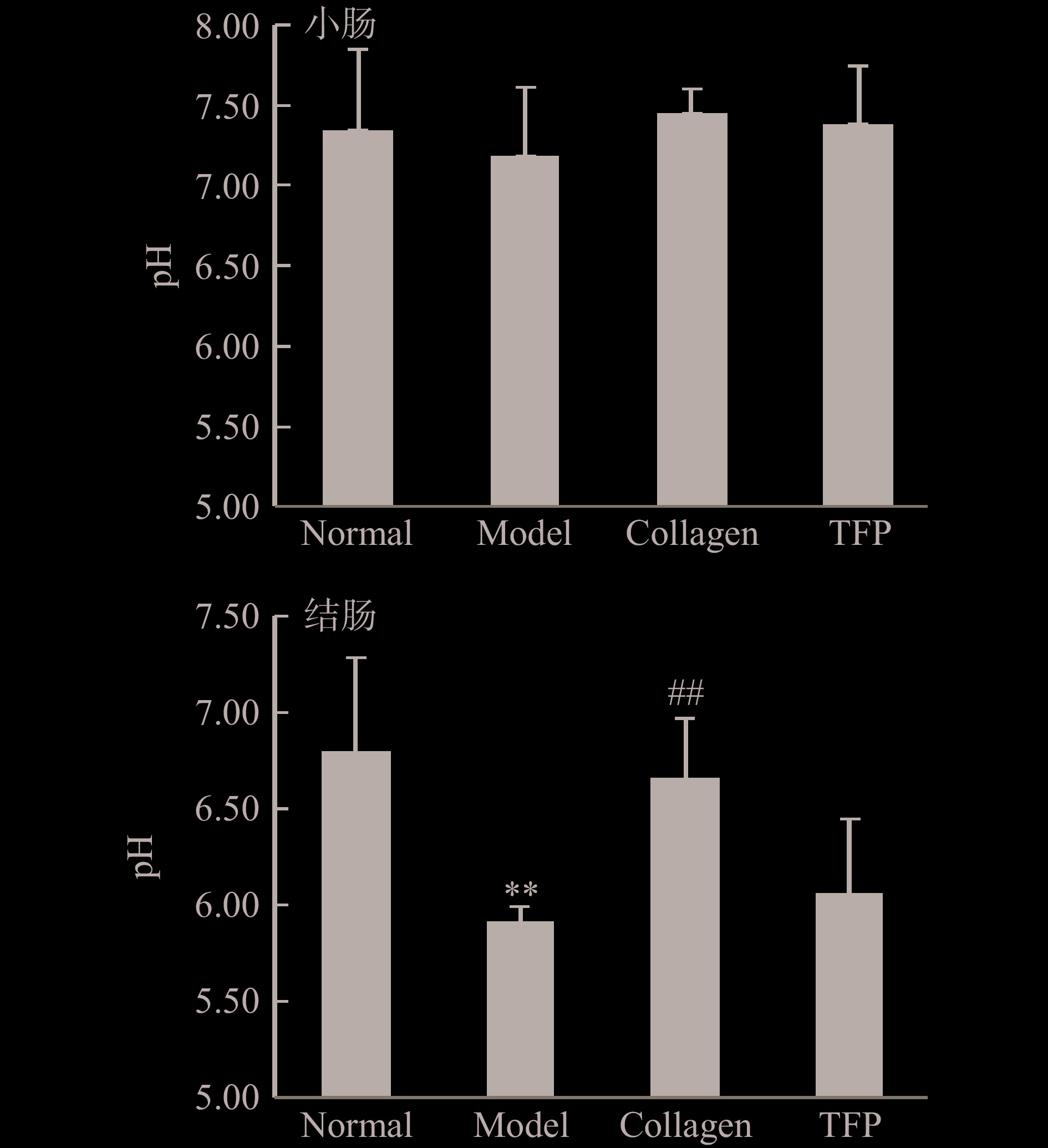
2.5 小鼠肠道pH和SCFAs浓度的变化
肠道内容物中包括食物消化残渣、消化酶、肠道菌群及代谢物。近年来许多研究揭示,肠道菌群组成和变化与宿主衰老紧密相关[17]。研究显示,小鼠肠道菌群组成和分布呈现空间特异性,结肠部位菌群多样性和丰度明显高于小肠菌群[28-29]。非消化性多糖(如菇类多糖)经肠道菌群代谢产生SCFAs,包括乙酸、丙酸、丁酸等[30]。因此,肠道中pH和SCFAs浓度变化可反映肠道内环境、菌群组成及代谢物的差异。由图5可知,小鼠小肠内pH在6.5~8.0,各组小鼠的小肠环境内pH无明显差异;在结肠内,Model组pH极显著低于Normal组(5.92±0.08 vs 6.80±0.08,P<0.01);Collagen组的pH(6.66±0.31)相比Model组极显著增加(P<0.01),但TFP组的pH(6.37±0.39)与Model组相比增加了,但无统计学差异(P>0.05)。结果提示,各组小鼠肠道内环境特别是结肠部位存在差异。
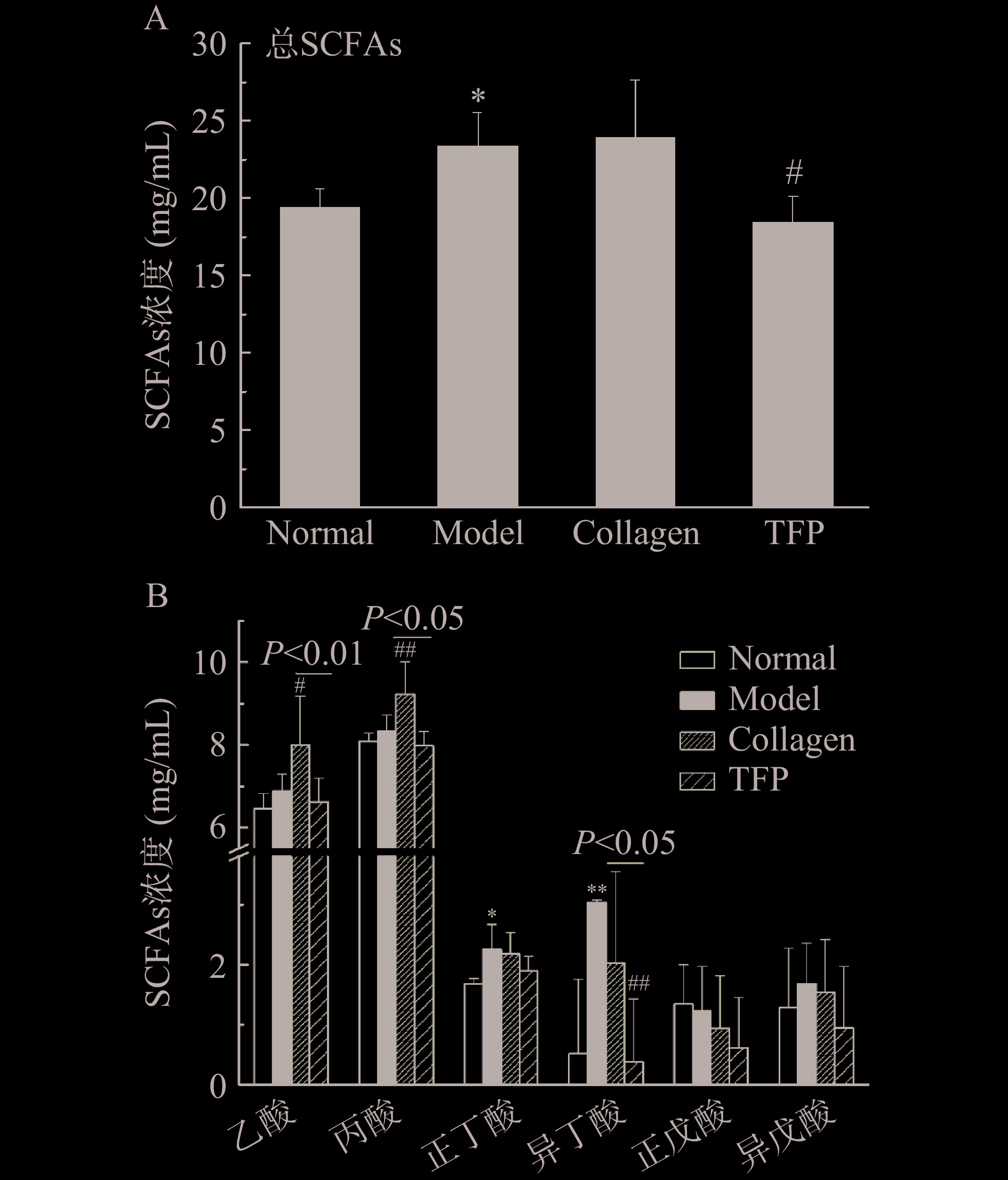
进一步检测小鼠肠道中6种SCFAs含量(乙酸、丙酸、正丁酸、异丁酸、正戊酸、异戊酸)。在小肠内容物中没有检测出SCFAs。在结肠部位,乙酸和丙酸是主要的SCFAs,其次是正丁酸,而异丁酸、正戊酸、异戊酸浓度均很低。与Normal组比较,Model组总SCFAs浓度显著升高(P<0.05)。验证了此前报道D-半乳糖造衰老模型可导致结肠菌群组成变化[31]。有研究表明,衰老小鼠肠道中SCFAs浓度比青年小鼠低[32],提示D-半乳糖所致衰老动物模型并不能完全模拟自然衰老状态。与Model组比较,Collagen组总SCFAs浓度无明显变化,但TFP组总SCFAs浓度反而降低了(P<0.05)(图6A)。
进一步分析SCFAs组成变化。与Normal组比较,Model组正丁酸和异丁酸含量均显著升高(P<0.05,P<0.01);与Model组比较,Collagen组结肠内乙酸、丙酸浓度显著增加(P<0.05,P<0.01),其余4种SCFAs浓度有降低趋势但无统计学差异(P>0.05);而TFP组中6种SCFAs均有降低趋势,特别是异丁酸含量几乎是微量(3.04±0.03 vs 0.37±1.06 mg/mL,P<0.01)。总体上,TFP组的SCFAs组成与Normal组具有相似性(图6B),提示银耳多糖具有逆转D-半乳糖所致小鼠结肠部位SCFAs浓度的异常改变。此外,TFP组的乙酸、丙酸、异丁酸浓度均显著低于Collagen组(6.63±0.57 vs 8.00±1.18 mg/mL,7.98±0.35 vs 9.23±0.77 mg/mL,0.37±1.06 vs 2.03±1.52 mg/mL,P<0.05,图6B),反映了银耳多糖与胶原蛋白肽对小鼠结肠部位菌群的调节效果不同。有学者报道以2 g/kg·BW胶原蛋白肽灌胃大鼠,提高了大鼠粪便中乙酸、丙酸浓度,同时增加结肠部位Lactobacillus,Unidentified-Prevotellaceae,Allobaculum和Parasutterella的比例[33]。菇类多糖作为一种非消化性多糖,具有增强免疫功能、调节肠道菌群结构和促进SCFAs产生的作用[30]。SCFAs能调控免疫细胞发育、分化和调节宿主免疫功能响应,特别是SCFAs能抑制组蛋白脱乙酰酶(HDAC)活性[34],表明SCFAs具有广泛的生理调节作用。然而在本试验中,银耳多糖没有增加衰老小鼠结肠的SCFAs浓度,反而降低了衰老小鼠结肠总SCFAs浓度,使得SCFAs浓度和组成与正常小鼠相似,扭转了D-半乳糖导致结肠内SCFAs的变化。最近报道,在DSS(dextran sodium sulfate)诱导的小鼠溃疡性结肠炎模型中,银耳多糖(TFP)表现出良好的抗炎和调节肠道菌群作用[35-36],由于肠道菌群与宿主免疫系统存在互作机制[34]。本试验中观察到银耳多糖扭转SCFAs变化的现象,一方面提示肠道中SCFAs可能有正常生理浓度范围,银耳多糖通过作用于肠道菌群扭转了D-半乳糖所致的SCFAs异常升高;另一方面,银耳多糖也有可能直接作用于肠粘膜免疫系统发挥抗炎作用,随后激活的肠粘膜免疫系统再反过来调节肠道菌群进而降低了SCFAs浓度。然而,肠道菌群及代谢物浓度的改变在炎症症状改善过程中的因果关系未知。因此,未来有必要深入研究肠道菌群及代谢物在银耳多糖抗炎、抗衰老活性发挥中的地位和角色。
3. 结论
通过D-半乳糖腹腔注射连续8周成功构建衰老小鼠模型,表明以830 mg/kg·BW胶原蛋白肽、100 mg/kg·BW银耳多糖分别灌胃能提高衰老小鼠皮肤中羟脯氨酸和透明质酸含量,且银耳多糖效果优于胶原蛋白肽。在试验剂量下,胶原蛋白肽、银耳多糖对衰老小鼠机体抗氧化酶活力提高效果相当,但银耳多糖对衰老小鼠血液中发炎性细胞因子分泌的抑制活性优于胶原蛋白肽,并且银耳多糖可逆转D-半乳糖所致小鼠结肠SCFAs浓度与组成的改变。综合分析显示,胶原蛋白肽和银耳多糖对衰老皮肤的改善作用可能是通过提高机体抗氧化酶活性和抗炎作用而实现。
-
-
[1] AHED M, VERMA A K, PATEL R. Collagen extraction and recent biological activities of collagen peptides derived from sea-food waste: A review[J]. Sustainable Chemistry and Pharmacy,2020,18:100315. doi: 10.1016/j.scp.2020.100315
[2] PERES D D A, HUBNER A, OLIVEIRA A C, et al. Hydrolyzed collagen interferes with in vitro photoprotective effectiveness of sunscreens[J]. Journal of Pharmaceutical Sciences,2017,53:1−7.
[3] HAJFATHALIAN M, GHELICHI S, GARCIA M P J, et al. Peptides: Production, bioactivity, functionality, and applications[J]. Critical Review in Food Science and Nutrition,2018,58:3097−3129. doi: 10.1080/10408398.2017.1352564
[4] 胡佳妮, 李勇. 海洋胶原肽活性及其应用研究进展[J]. 食品工业科技,2021,42(18):407−412. [HU J N, LI Y. Research progress of peptide activity and application of marine collagen peptides[J]. Science and Technology of Food Industry,2021,42(18):407−412. [5] PROKSCH E, SEGGER D, DEGWERT J, et al. Oral supplementation of specific collagen peptides has beneficial effects on human skin physiology: A double-blind, placebo-controlled study[J]. Skin Pharmacology and Physiology,2014,27:47−55. doi: 10.1159/000351376
[6] PROKSCH E, SCHUNCK M, ZAGUE V, et al. Oral intake of specific bioactive collagen peptides reduces skin wrinkles and increases dermal matrix synthesis[J]. Skin Pharmacology and Physiology,2014,27:113−119. doi: 10.1159/000355523
[7] 初鑫, 宋韶乾, 司磊磊, 等. 鳕鱼皮胶原蛋白肽果汁饮料抗紫外线照射引起的皮肤光老化[J]. 食品工业科技,2018,39(22):287−292. [CHU X, SONG S Q, SI L L, et al. Effect of fruit juice drink containing collagen polypeptides from pacific cod (Gadus macrocephalus) skin on UV irradiation-induced skin photoaging[J]. Science and Technology of Food Industry,2018,39(22):287−292. [8] 查圣华, 张兴龙, 王俊亮, 等. 透明质酸胶原蛋白冰糖燕窝饮品安全性及有效性评价[J]. 食品安全质量检测学报,2019,10(20):6886−6892. [ZHA S H, ZHANG X L, WANG J L, et al. Safety and effectiveness evaluation of hyaluronic acid collagen rock candy bird’s nest drink[J]. Journal of Food Safety and Quality,2019,10(20):6886−6892. [9] 南京中医药大学. 中药大辞典[M]. 上海: 上海科学技术出版社, 2006: 3024−3025. Nanjing University of Chinese Medicine. The dictionary of Chinese herbal medicine[M]. Shanghai: Shanghai Scientific & Technical Publishers, 2006: 3024−3025.
[10] WU Y J, WEI Z X, ZHANG F M, et al. Structure, bioactivities and applications of the polysaccharides from Tremella fuciformis mushroom: A review[J]. International Journal of Biological Macromolecules,2019,121:1005−1010. doi: 10.1016/j.ijbiomac.2018.10.117
[11] 杨嘉丹, 刘婷婷, 张闪闪, 等. 微波辅助提取银耳多糖工艺优化及其流变、凝胶特性[J]. 食品科学,2019,40(14):289−295. [YANG J D, LIU T T, ZHANG S S, et al. Optimization of microwave-assisted extraction and rheological and gelling properties of polysaccharide from Tremella fuciformis[J]. Food Science,2019,40(14):289−295. doi: 10.7506/spkx1002-6630-20190104-059 [12] 高磊, 张帆, 王毅飞, 等. 银耳多糖研究进展[J]. 安徽农业科学,2020,48(24):13−16,19. [GAO L, ZHANG F, WANG Y F, et al. Research advances of Tremella fuciformis polysaccharides[J]. Journal of Anhui Agricultural Sciences,2020,48(24):13−16,19. doi: 10.3969/j.issn.0517-6611.2020.24.004 [13] 张泽生, 孙东, 徐梦莹, 等. 银耳多糖抗氧化作用的研究[J]. 食品研究与开发,2014,35(18):10−15. [ZHANG Z S, SUN D, XU M Y, et al. Study on the antioxidation effect of Tremella polysaccharide[J]. Food Research and Development,2014,35(18):10−15. doi: 10.3969/j.issn.1005-6521.2014.18.004 [14] LOPEZ-OTIN C, BLASCO M A, PARTRIDGE L, et al. The hallmarks of aging[J]. Cell,2013,153(6):1194−1217. doi: 10.1016/j.cell.2013.05.039
[15] 李萌茹, 周玉枝, 杜冠华, 等. 中药黄酮类化合物抗衰老作用及其机制研究进展[J]. 药学学报,2019,54(8):1382−1391. [LI M R, ZHOU Y Z, DU G H, et al. Research progress about the anti-aging effect and mechanism of flavonoids from traditional Chinese medicine[J]. Acta Pharmaceutica Sinica,2019,54(8):1382−1391. [16] LUCA L, FABRIZIO M, JEAN-CLAUDE T, et al. Inflamm-ageing: The role of inflammation in age-dependent cardiovascular disease[J]. European Heart Journal,2020(31):31.
[17] HARRIS J R, KOROLCHUK V I. Biochemistry and cell biology of ageing: Part I biomedical science[M]. Singapore: Springer, 2018: 351−371.
[18] 李海珊, 刘丽乔, 聂少平. 茶多糖对小鼠肠道健康及免疫调节功能的影响[J]. 食品科学,2017,38(7):187−192. [LI H S, LIU L Q, NIE S P. Effects of green tea polysaccharides on intestinal health and immune regulation in mice[J]. Food Science,2017,38(7):187−192. doi: 10.7506/spkx1002-6630-201707030 [19] 邵鑫. 人体胃肠道微生态消化模拟系统的构建及其稳定性评估[D]. 广州: 暨南大学, 2016. SHAO X. Development of the in vitro human gastrointestinal microbial ecosystem and its stability evaluation[D]. Guangzhou: Jinan University, 2016.
[20] CASTELO-BRANCO C, PONSB F, GRATACOS E, et al. Relationship between skin collagen and bone changes during aging[J]. Maturitas,1994,18(3):199−206. doi: 10.1016/0378-5122(94)90126-0
[21] 康尔恂, 陈宏泉, 吕全兴, 等. 女性皮肤透明质酸含量及角质层含水量与年龄的关系[J]. 中国麻风皮肤病杂志,2010,6:449−450. [KANG E X, CHEN H Q, LV Q X, et al. The relationship between the contents of hyaluronic acid in skin and water in stratum corneum and age in female[J]. China Journal of Leprosy and Skin Diseases,2010,6:449−450. doi: 10.3969/j.issn.1009-1157.2010.06.040 [22] 徐卫东, 王林, 王晴, 等. 胶原蛋白延缓D-半乳糖致衰老小鼠皮肤衰老作用研究[J]. 中国食品学报,2016,16(11):49−54. [XU W D, WANG L, WANG Q, et al. Effect of collagen on delaying skin ageing of D-galactose-induced ageing mice[J]. Journal of Chinese Institute of Food Science and Technology,2016,16(11):49−54. [23] POLJSAK B, DAHMANE R G, GODIC A. Intrinsic skin aging: The role of oxidative stress[J]. Acta Dermatovenerologica Alpina Panonica Et Adriatica,2012,21(2):33−36.
[24] 刘思彤, 尹日凤, 韦玥吟, 等. 刺梨预防D-半乳糖诱发小鼠皮肤衰老的作用研究[J]. 食品研究与开发,2020,41(9):1−5. [LIU S T, YIN R F, WEI Y Y, et al. Study on the effect of Rosa roxburghii Tratt on preventing skin aging induced by D-galactose in mice[J]. Food Research and Development,2020,41(9):1−5. doi: 10.12161/j.issn.1005-6521.2020.09.001 [25] 刘明明, 李爱玲, 修瑞娟. 基质金属蛋白酶的研究进展[J]. 中国病理生理杂志,2018,34(10):1914−1920. [LIU M M, LI A L, XIU R J. Research progress on matrix metalloproteinases[J]. Chinese Journal of Pathophysiology,2018,34(10):1914−1920. doi: 10.3969/j.issn.1000-4718.2018.10.029 [26] LIU F, WANG W C, XIA Y Q, et al. Protection by collagen peptides from walleye pollock skin on bone formation via inhibition of oxidative stress[J]. Journal of King Saud University-Science,2020,32:2527−2533. doi: 10.1016/j.jksus.2020.03.006
[27] RUAN Y, LI H, PU L M, et al. Tremella fuciformis polysaccharides attenuate oxidative stress and inflammation in macrophages through miR-155[J]. Analytical Cellular Pathology,2018,2018:5762371.
[28] 赵文静, 刘书云, 丁金梅, 等. 小鼠不同肠道段内容物和粪便中微生物的宏基因组测序和比较分析[J]. 上海交通大学学报(农业科学版),2016,34(3):15−21. [ZHAO W J, LIU S Y, DING J M, et al. Metagenomic sequencing of gut microbiota along the intestinal tracts and feces in mice[J]. Journal of Shanghai Jiaotong University (Agricultural Science),2016,34(3):15−21. [29] XU X F, ZHANG X W. Lentinula edodes-derived polysaccharide alters the spatial structure of gut microbiota in mice[J]. PLoS One,2015,10(1):e0115037. doi: 10.1371/journal.pone.0115037
[30] LI M Y, YU L L, ZHAO J X, et al. Role of dietary edible mushrooms in the modulation of gut microbiota[J]. Journal of Functional Foods,2021,83:104538. doi: 10.1016/j.jff.2021.104538
[31] ZHANG J, ZHAO X, JIANG Y, et al. Antioxidant status and gut microbiota change in an aging mouse model as influenced by exopolysaccharide produced by Lactobacillus plantarum YW11 isolated from Tibetan kefir[J]. Journal of Dairy Science,2017,100:6025−6041. doi: 10.3168/jds.2016-12480
[32] SPYCHALA M S, VENNA V R, JANDZINSKI M, et al. Age-related changes in the gut microbiota influence systemic inflammation and stroke outcome[J]. Annals of Neurology,2018,83:23−36.
[33] MEI F F, DUAN Z W, CHEN M X, et al. Effect of a high-collagen peptide diet on the gut microbiota and short-chain fatty acid metabolism[J]. Journal of Functional Foods,2020,75:104278. doi: 10.1016/j.jff.2020.104278
[34] KAYAMA H, OKUMURA R, TAKEDA K. Interaction between the microbiota, epithelia, and immune cells in the intestine[J]. Annual Review of Immunology,2020,38(1):23−48. doi: 10.1146/annurev-immunol-070119-115104
[35] XIAO H Y, LI H L, WEN Y F, et al. Tremella fuciformis polysaccharides ameliorated ulcerative colitis via inhibiting inflammation and enhancing intestinal epithelial barrier function[J]. International Journal of Biological Macromolecules,2021,180:633−642. doi: 10.1016/j.ijbiomac.2021.03.083
[36] XU Y, XIE L, ZHANG Z, et al. Tremella fuciformis polysaccharides inhibited colonic inflammation in dextran sulfate sodium-treated mice via Foxp3+ T cells, gut microbiota, and bacterial metabolites[J]. Frontiers in Immunology,2021,12:648162. doi: 10.3389/fimmu.2021.648162





 下载:
下载:
 下载:
下载:
