Correlation between Meat Quality and Muscle Fiber Types of Tibetan and Large White Pigs
-
摘要: 为了探究不同地区猪肉品质差异及形成原因,本研究选取不同地区(西藏林芝、甘肃甘南、四川阿坝)自然放养下的藏猪与平原大白猪为研究对象,测定其背最长肌的食用品质(pH、颜色、蒸煮损失、剪切力)、肌红蛋白含量、羟脯氨酸含量、不同的肌球蛋白重链(MyHC)mRNA相对表达量,并对各指标进行相关性分析。结果表明,藏猪的pH3 h处于5.7~5.8,显著低于大白猪(6.05±0.20,P<0.05),藏猪的红度值(a*)和肌红蛋白含量显著高于大白猪(白猪为2.12±0.87、0.004 μmol/g),其中,阿坝藏猪的a*最高(8.10±0.99)(P<0.05);藏猪的剪切力和羟脯氨酸含量显著高于大白猪(41.81±0.83、5.92%±0.52%)(P<0.05);藏猪的IIa型肌纤维比例显著高于大白猪而IIb型肌纤维比例显著低于大白猪(P<0.05);相关性分析表明,a*与L*、IIb型肌纤维呈极显著负相关(P<0.01),与肌红蛋白含量、I型和IIa型肌纤维呈极显著正相关(P<0.01),剪切力与羟脯氨酸含量呈现极显著正相关(P<0.01)。综上所述,藏猪大白猪肉的食用品质差异很大,藏猪比大白猪的肉色更红、嫩度更差,不同地区藏猪肉色也存在一定差异,这与它们的肌肉纤维类型有很大相关性。Abstract: This research was designed to explore the differences of meat quality and their causes of pigs in different regions. In this study, natural raised Tibetan pigs in different regions (Linzhi of Tibet, Gannan of Gansu, and Aba of Sichuan) and large white pigs were selected, the meat quality of their longissimus muscle (pH, color, cooking loss, shear force), myoglobin concentration, hydroxyproline content, relative expression of different Myosin Heavy Chain (MyHC) mRNA were determined, and correlation analysis were adopted. The results showed that the pH3 h of Tibetan pigs was significantly lower than that of large white pigs 6.0 (P<0.05), and there was no significant difference among different regions (5.7~5.8). The redness value (a*) and myoglobin content of Tibetan pigs were significantly higher than those of large white pigs (2.12±0.87, 0.004 μmol/g). Among them, Aba Tibetan pigs had the highest a* (8.10±0.99). The shear force and hydroxyproline content of Tibetan pigs were significantly higher than those of large white pigs (41.81±0.83, 5.92%±0.52%) (P<0.05), the proportion of type IIa muscle fibers in Tibetan pigs was significantly higher and the proportion of type IIb muscle fibers was significantly lower than their of large white pigs (P<0.05). Correlation analysis showed that a* was significantly negatively correlated with L* and type IIb muscle fibers (P<0.01), and significantly positively correlated with myoglobin content, type I and type IIa muscle fibers (P<0.01). Shear force and hydroxyproline content were extremely significantly correlated (P<0.01). In conclusion, the color of Tibetan pig is redder and the tenderness was worse than that of large white pig, the great differences between Tibetan pigs and large white pigs and the differences among Tibetan pigs from different regions in meat quality would be highly related to their muscle fiber type.
-
Keywords:
- Tibetan pig /
- meat quality /
- muscle fiber type /
- myoglobin /
- connective tissue
-
藏猪作为我国特有的高原型地方猪种,主要分布于西藏的林芝、昌都地区,四川的甘孜、阿坝藏族自治州,甘肃甘南藏族自治州等地。藏猪因长期放养在高寒、低压、低氧的高原环境中,形成了其生长缓慢、放养周期长、耐粗饲、抗病能力强的特点[1],在此天然生长环境下其形成的食用品质特性得到肉品科学家们越来越多的关注。
肌纤维作为骨骼肌的基本组成单位,其组成类型与产肉动物的产肉量及其肉品质量密切相关[2-3]。根据肌球蛋白重链(MHC)的类型可以将肌纤维划分为四种类型:慢速氧化型(I型)、快速氧化型(IIa)、中间型(IIx型)和快速糖酵解型(IIb型),不同的肌纤维类型具有不同的代谢活性,从I型到IIb型氧化能力逐渐降低,酵解能力逐渐增强[4]。研究表明,年龄、品种、部位和运动等因素会改变肌肉的肌纤维类型组成以及组织结构,从而影响宰后的肉质。门小明[5]比较了不同杂交组合猪种的肌纤维类型组成与肉质特性,发现肌肉中氧化型纤维比例与a*、肌内脂肪含量、剪切力值呈显著正相关。Shen等[6]比较了三个不同海拔的猪种:藏猪(高海拔)、梁山猪(中海拔)和三元猪(平原猪),发现高海拔品种藏猪和梁山猪比三元猪的pH更高、肉色更红、剪切力更低,差异归因于高原猪具有较高的氧化型肌纤维比例,降低了宰后糖酵解进程,从而具有较好的肉质。另外,肌内结缔组织也是肌肉组织的重要组成部分,一般来说,年龄越大、运动越多、负荷越大的部位因其具有强壮致密的结缔组织支撑,肌肉剪切力越大,嫩度越差[7]。张盼等[8]测定了林芝藏猪在放牧与舍饲两种不同饲养方式下的屠宰性能和肉品质,发现舍饲可增加藏猪的个体体重和胴体重量,提高肌内脂肪含量和大理石纹评分,改善肌肉嫩度。纯正的藏猪常年放养于高原地区,因其生长缓慢体型偏小,出栏期一般在一年以上,而市售的平原大白猪集中圈养且生长速度快,一般8~10月龄即可进行屠宰。目前关于藏猪食用品质的研究普遍是将藏猪与平原猪置于相同饲养条件下、饲养相同日龄进行比较[6,9],并不能客观反映出天然放养状态下藏猪的肉质,而且主要针对单个地区藏猪的研究,并不能反映出不同产地藏猪的差异性及特色。
为了研究高原藏猪的食用品质特性,并从结合实际饲养条件和生长状况探究其肉质形成原因,本研究以不同地区(西藏林芝、甘肃甘南、四川阿坝)自然放养下的藏猪与普通圈养大白猪为研究对象,测定其食用品质(pH、颜色、蒸煮损失、剪切力)、肌红蛋白含量、羟脯氨酸含量以及不同的MyHC mRNA相对表达量,揭示高原藏猪肌肉纤维类型组成的品种差异及与肉质性状的相关性,并结合藏猪的实际生产现状,为藏猪产业的实际生产提供理论指导。
1. 材料与方法
1.1 材料与仪器
正常发育公猪(已去势) 1岁龄的林芝藏猪10头,海拔3000 m自然放牧条件下,西藏林芝巴宜区八一镇提供;甘南藏猪 9头 甘肃省甘南夏河县博友蕨麻猪养殖农民专业合作社提供;阿坝藏 猪10头,四川阿坝小金县绿野养殖专业合作社提供;去势三元公猪 10头,10月龄,江苏省食品集团有限公司;此处的1岁龄和10月龄选择是依据实际市售白猪和藏猪的年龄。宰杀后采集背最长肌各1 kg肉样(从宰杀到完成肉样采集约耗时3 h),经液氮速冻后真空包装、干冰运输至实验室,于−18 ℃保存,待测食用品质,同时取10 g肉样于冻存管中−80 ℃保存,待测基因表达量;因采样条件受限,林芝藏猪肉样统一采集于50 mL离心管中,−80 ℃保存;氯化钾、碘乙酸钠、磷酸二氢钾、磷酸氢二钾、硫酸、一水柠檬酸、氢氧化钠、无水乙酸钠、氯胺T、对二氨基苯甲醛、高氯酸、异丙醇均为国产分析纯;TRizol 北京索莱宝科技有限公司;RNA提取试剂盒 南京迈博生物科技有限公司;反转录试剂盒、RT-PCR试剂盒 日本Takara公司。
Fiveeasy台式pH计 瑞士Mettler Toledo公司;PD500-TP匀浆机 英国PRIMA 公司;CR-300色差仪 日本柯尼卡美能达公司;DGG-9240A电热恒温鼓风干燥箱 上海森信实验仪器有限公司;Avanti J-C高速冷冻离心机 美国Beckman Coulter公司;TW20水浴锅 德国Julabo公司;涡旋仪 上海泸西分析仪器有限公司;纯水机、QuantStudio 6 Flex实时荧光定量PCR仪 美国Thermo 公司;AUY120电子分析天平 日本岛津公司;组织破碎仪 法国Bertin公司;C-LM3B数显式肌肉嫩度仪 东北农业大学工程学院;Synergy-2酶标仪 美国Biotek公司。
1.2 实验方法
1.2.1 食用品质测定
1.2.1.1 pH
参照中华人民共和国农业行业标准NY/T 2793-2015《肉的食用品质客观评价方法》[10]。称取1 g肉样绞碎,加入9 mL 5 mmol/L氯化钾、碘乙酸钠溶液(pH7.0),4 ℃、6000 r/min匀浆30 s,过滤,搅拌的同时将已校准的电极插入匀浆液中,待读数稳定后记录pH,每个样品测三次取平均值。
1.2.1.2 肉的颜色
参照NY/T 2793-2015的方法,将冻肉置于4 ℃环境下解冻,将解冻后的肉样垂直肌纤维方向切成5 cm×4 cm×2 cm大小的肉块,将肉样平放在红色塑料板或托盘上,新切面朝上,避光静置 30 min。将色差仪的镜头垂直置于肉面上,记录亮度(L*)、红色度(a*)、黄色度(b*),每个样品测三次取平均值。
1.2.1.3 蒸煮损失
参照NY/T 2793-2015的方法,稍作修改。将冻肉置于4 ℃环境下解冻,擦去表面汁液,垂直肌纤维方向切成5 cm×4 cm×2 cm大小的肉块,称重(m1),将肉块置于蒸煮袋内,将温度计插入肉的中心部位,78 ℃水浴加热肉块至中心温度75 ℃,流水冷却30 min后取出肉块,表面汁液用滤纸吸干,称重(m2),蒸煮损失率(%)计算公式为:
X=m1−m2m1×100 式中:X表示蒸煮损失率,%;m1表示水煮前肉块的质量,g;m2表示水煮擦干后肉块的质量,g。
1.2.1.4 剪切力
用测完蒸煮损失的肉块去测剪切力,具体操作为:用双片刀沿肌纤维方向分切成多个1.0 cm厚的肉柱,用嫩度仪垂直于肌纤维方向测量剪切力,测试速度为1.0 mm/s,每个样品测3次取平均值。
1.2.2 肌红蛋白测定
参照Krzywicki等[11]方法,取肉样1 g,加入5 mL磷酸钠缓冲液(0.04 mol/L,pH6.8),用组织破碎仪10000 r/min均质25 s,置均质液于4 ℃环境中静置1 h,然后4500×g、4 ℃离心20 min。将上清液用0.45 μm水系滤膜过滤,滤液用酶标仪分别在525、545、565和572 nm处测其吸光值。计算公式如下:
总肌红蛋白(μmol/g)=−0.166A572+0.086A565+0.088A545+0.099A525
P1(%)=(0.369R1+1.140R2−0.941R3+0.015)×100
P2(%)=(0.882R1−1.267R2+0.809R3−0.361)×100
P3(%)=(−2.541R1+0.777R2+0.800R3+1.098)×100
式中:P1、P2、P3分别为肌红蛋白、氧合肌红蛋白、高铁肌红蛋白的质量分数(%);R1、R2、R3分别式吸光度比值A572/A525、A565/A525、A545/A525。
1.2.3 羟脯氨酸含量测定
参考GB/T 9695.23-2008《肉与肉制品 羟脯氨酸含量测定》[12],取4 g 肉加30 mL硫酸在105 ℃烘箱中消解16 h,滤纸过滤后定容待测。
1.2.4 基因相对表达量测定
参照杨玉莹等[13]的方法,按照RNA提取试剂盒说明书提取总RNA,用微量核酸蛋白测定仪分析测定OD260 nm/OD280 nm并反转录成cDNA,反应体系30 μL,反应程序为37 ℃ 15 min、85 ℃ 5 s、4 ℃保温,将cDNA于−20 ℃保存,用于实时荧光定量PCR实验。本实验选取甘油醛-3-磷酸脱氢酶基因(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参基因,MYH7、MYH2、MYH4、MYH1
为目的基因,分别编码肌球蛋白重链MyHC I、MyHC IIa、MyHC IIb和MyHC IIx,实时荧光定量PCR引物由南京金斯瑞生物科技有限公司设计合成,引物序列如表1。 表 1 引物序列Table 1. Primer sequences基因 引物 MYH1 F:TTGACTGGGCTGCCATCAAT R:GCCTCAATGCGCTCCTTTTC MYH2 F:TGGAGCGGATGAAGAAGAACA R:GCTTCTGCTCACTCTCTACCTCTC MYH4 F:AGTGCTATCCCAGAGGGTCAGT R:AGCTTTTCATCTCGCATCTCCT MYH7 F:CGTGGACTACAACATCATAGGC R:CTTTGCCCTTCTCAACAGGT GAPDH F:ACACTGAGGACCAGGTTGTG R:GACGAAGTGGTCGTTGAGGG 实时荧光定量PCR反应体系20 μL,按照试剂盒要求进行PCR反应液的配制,每个反应设置3个平行。采用2−∆∆Ct法作为相对基因表达量的分析方法,标准曲线通常被用来确定实时荧光定量PCR反应的扩增效率,目的基因相对于内参基因的表达为∆Ct,∆Ct=Ct(目的基因)−Ct(GAPDH),∆∆Ct=∆Ct(其他样本)−∆Ct(对照样本)。
1.3 数据处理
所有指标每组至少进行8个生物学重复,使用SAS9.1.2统计分析软件进行数据分析,各组间的差异显著性采用Duncan’s Multiple Comparison,P<0.05为差异显著。各指标相关性分析采用Person相关系数,以双侧方式验证显著性;使用Graphpad Prism7.0软件进行图表绘制。
2. 结果与分析
2.1 pH和色泽
pH是反映宰后肉质优劣的重要指标,从表2可以看出,三个地区藏猪肉pH3 h(5.71~5.78)均处于正常范围,且显著低于大白猪的pH3 h(6.05±0.20)(P<0.05),可能是藏猪因为长期的高原低氧应激,体内能量代谢较快,导致宰后pH快速下降[14-16]。
表 2 不同地区猪pH3 h和色泽比较Table 2. Comparison of pH3 h and color of pig from different regions项目 三元猪 阿坝藏猪 甘南藏猪 林芝藏猪 pH3 h 6.05±0.20a 5.71±0.12b 5.78±0.22b 5.71±0.23b L* 44.65±2.33a 37.58±1.36b 43.39±1.40a 44.09±2.51a a* 2.12±0.87c 8.10±0.99a 6.35±1.28b 5.38±0.96b b* −0.18±0.85b −0.36±0.48b 1.72±1.56a −0.03±1.05b 注:小写字母的不同表示不同地区差异显著(P<0.05),此处3 h是指从屠宰到样品冻结的时间。 肉的色泽是影响消费者购买欲最直观的因素,不同地区猪肉颜色比较见表2,与大白猪相比,三个地区藏猪总体呈现出低L*、高a*的特点(P<0.05),这与Gan等[17]的研究结果一致,其中,阿坝藏猪的a*为8.10,显著高于甘南藏猪和林芝藏猪(P<0.05),说明阿坝藏猪比其他两个地区的肉色更红,可能是因为四川藏猪的肌肉中含有更多的肌红蛋白,下一步将进行测定。
2.2 肌红蛋白含量
肉色是由肌红蛋白和血红蛋白的数量决定的,二者的含量决定肉色的深浅。动物经过充分放血之后,其颜色深浅主要由肌红蛋白含量决定。从图1可以看出,藏猪的肌红蛋白含量显著高于大白猪(P<0.05),且不同地区藏猪肉的肌红蛋白含量存在显著差异,总体表现为阿坝藏猪(0.09 μmol/g)>甘南藏猪(0.08 μmol/g)>林芝藏猪(0.06 μmol/g)>大白猪(0.04 μmol/g),这也解释了前面阿坝藏猪肉色最红的结果,这是其对缺氧的适应性体现。藏猪常年放养于高寒、低压、低氧的环境,其体内需要充足的肌红蛋白来增强与氧的亲和力,提高有氧代谢产能,从而维持正常的生命活动[18]。早在2013年,Li等[19]对藏猪和家猪进行全基因组测序对比分析,发现与其他低海拔哺乳动物中发现的12个铁蛋白基因相比,藏猪的铁蛋白家族中27个基因出现扩增,对藏猪的高原低氧适应性起着重要的作用。
2.3 蒸煮损失和剪切力
生肉在加热时蛋白质受热变性,使得肌原纤维发生紧缩,从而失去水分。从图2A可以看出,阿坝藏猪和甘南藏猪的蒸煮损失率(25.08%、23.70%)均高于大白猪(22.28%),表明藏猪的系水力较差,可能与藏猪较低的pH有关,宰后pH下降较快的肌肉往往会伴随有较大的汁液渗出,从而会导致其在热加工过程中损失较多水分[20]。如图2B所示,阿坝藏猪和甘南藏猪的剪切力分别为57.69和64.01 N,差异不显著(P>0.05),均显著高于大白猪41.81(P<0.05),表明藏猪肉嫩度较差,这与前人发现藏猪肉细嫩多汁的结果相悖[6,11],可能是因为其比较的是相同圈养条件下藏猪与大白猪的肉质,而本实验研究的是天然放养的藏猪,运动量较大,肌肉更加紧实有力,导致肉的嫩度变差,因而需要的剪切力更大(因高原采样条件特殊,林芝藏猪的样品不够做蒸煮损失和剪切力的实验,疫情原因无法进行再次前往西藏采样,故此处只比较了阿坝藏猪和甘南藏猪)。
2.4 结缔组织
肌内结缔组织是肌肉组织的重要组成部分,对肉的质地和品质具有重要影响。胶原蛋白是结缔组织的主要成分,对维持肌肉的弹性具有重要作用。羟脯氨酸作为结缔组织中胶原蛋白的主要成分之一,在胶原蛋白中组成恒定(占总氨基酸的12%~14%),其含量可以侧面反映出肌肉中结缔组织的含量[21]。
由表3可以看出,藏猪的羟脯氨酸含量(6.95%~7.49%)显著高于大白猪5.92%(P<0.05),说明藏猪肉中结缔组织含量较高,可能是因为藏猪比大白猪出栏期更长,运动量更大,研究表明,年龄越大、运动越多、负荷越大的部位因具有强壮致密的结缔组织支撑[7],并且随着年龄的增加,结缔组织中的成熟交联(赖氨酸吡啶和羟赖氨酸吡啶)呈现上升趋势,胶原蛋白的溶解性降低,导致肌肉剪切力越大,嫩度越差[22]。结合前面藏猪肉剪切力更大的结果,说明较高的结缔组织含量可能是导致藏猪肉嫩度差的一个重要原因。
表 3 不同地区猪羟脯氨酸含量比较Table 3. Comparison of hydroxyproline content of pig in different regions指标 大白猪 阿坝藏猪 甘南藏猪 林芝藏猪 羟脯氨酸(%) 0.0592±0.0052b 0.0740±0.0068a 0.0695±0.0072a 0.0749±0.0095a 注:表中所有数据表示为平均值±标准差,小写字母的不同地区差异显著(P<0.05)。 2.5 实时定量PCR检测肌纤维类型
图3A结果显示了不同地区猪肌球蛋白重链的4种亚型,即MyHC I、MyHC IIa、MyHC IIb和MyHC IIx,可以看出三个地区藏猪的IIa型肌纤维含量显著高于大白猪(P<0.05)和IIx型肌纤维含量显著低于大白猪(P<0.05),甘南藏猪和林芝藏猪的I型、IIb型肌纤维含量显著低于阿坝藏猪和大白猪(P<0.05)。
图3B为mRNA相对表达量所占比例,可以看出四个地区背最长肌均以酵解型肌纤维为主,整体呈现出MyHC IIb>MyHC IIx>MyHC I>MyHC IIa,不同的是,大白猪以IIb型肌纤维为主(71.29%),其次是IIx型(22.17%)、I型(7.82%)、IIa型(0.94%),而三个地区藏猪均以IIb和IIx型肌纤维为主,其次是I型和IIa型,比例分别为阿坝藏猪(36.94%、32.98%、23.03%、7.05%)、甘南藏猪(32.0%、26.09%、25.74%、15.77%)、林芝藏猪(41.41%、38.64%、9.58%、8.14%),藏猪的I型和IIa型肌纤维比例显著(P<0.05)高于大白猪,这是因为藏猪长期生活在高寒缺氧环境中,需要通过提高有氧代谢产生更多的能量来维持机体的生命活动[14]。另一方面,藏猪较高的氧化型肌纤维比例可能与其独特的生活环境和放养方式有关,大白猪常年圈养运动量少,而藏猪普遍放养于海拔3000 m的高寒环境,善于奔跑运动量大,有研究表明,长期处于寒冷、运动的情况下可能会导致IIb型肌纤维的转变成I型和IIa型肌纤维[23-24]。
2.6 不同指标间的相关性分析
各指标间相关性分析结果如表4所示,L*与a*呈极显著负相关(P<0.01),a*与肌红蛋白含量、I型和IIa型肌纤维呈极显著正相关(P<0.01),与IIb型肌纤维呈负相关,这是因为氧化型肌纤维比酵解型肌纤维含有更多肌红蛋白[25],从而导致较红的肉色;IIa型肌纤维与剪切力、羟脯氨酸含量呈显著正相关(P<0.05),说明IIa型肌纤维比例越高,羟脯氨酸含量越高,可能是导致藏猪肉剪切力大、嫩度差的原因。以上结果表明,藏猪与大白猪肉质存在显著差异,这与其肌纤维类型组成有很大关系。
表 4 肌肉品质与肌纤维类型相关性分析Table 4. Correlation analysis between meat quality and muscle fiber type指标 pH L* a* b* 蒸煮
损失剪切力 肌红
蛋白羟脯
氨酸MyHCI MyHC
IIaMyHC
IIxL* −0.10 a* 0.00 −0.64** b* −0.12 0.18 0.09 蒸煮损失 −0.02 −0.34 0.33 0.00 剪切力 0.04 −0.21 0.32 0.45* 0.32 肌红蛋白 −0.15 −0.29 0.71** 0.22 0.18 0.85** 羟脯氨酸 −0.15 −0.27 0.60** −0.28 0.43 0.73** 043 MyHCI 0.07 −0.74* 0.65** −0.08 0.49* 0.25 0.28 0.23 MyHCIIa −0.23 0.04 0.48** 0.28 0.43* 0.70** 0.58** 0.50* 0.05 MyHCIIx −0.02 −0.12 0.29 −0.15 0.55** 0.48* 0.48** 0.28 0.01 0.48** MyHCIIb 0.05 0.44* −0.62** 0.06 −0.65** −0.63** −0.60** −0.45* −046* −0.65** −0.86** 注:*表示各指标之间显著相关(P<0.05),**表示各指标之间极显著相关(P<0.01)。 3. 结论
本研究通过比较不同地区的高原藏猪与平原猪(大白猪)肉的食用品质,发现不同地区藏猪肉与平原猪肉的食用品质存在一定差异,并从肌纤维类型角度解释了不同地区肉质的形成原因,为藏猪的实际生产提供了一定的理论指导。主要结论如下:与大白猪相比,藏猪的pH3 h更低(处于5.7~6.1之间)、肉色更红、剪切力更大。不同地区藏猪相比,阿坝藏猪的肉色最红(a* 为8.10)。同时,藏猪特有的生活习性导致其肌肉中含有更多的肌红蛋白、结缔组织和氧化型肌纤维。相关性分析表明,a*与肌红蛋白含量、I型和IIa型肌纤维呈极显著正相关(P<0.01),IIa型肌纤维与剪切力、羟脯氨酸含量呈正相关,说明较高的氧化型肌纤维比例与肌红蛋白含量是藏猪肉色红的原因,同时,放养周期长以及运动量大,导致藏猪肌肉中含有有较多的羟脯氨酸,可能是导致藏猪肉嫩度差的一个重要原因,建议通过适当圈养、缩短育肥期来改善藏猪肉的嫩度。
此外,藏区因地形偏远,屠宰条件相对落后,很多影响宰后肉质的因素(如驱赶方式、卫生条件等)并没有得到重视,若能将现代肉品科学研究成果应用于高原地区的畜牧业,可为提高畜产品品质,促进高原畜牧业的发展创造基础。
-
表 1 引物序列
Table 1 Primer sequences
基因 引物 MYH1 F:TTGACTGGGCTGCCATCAAT R:GCCTCAATGCGCTCCTTTTC MYH2 F:TGGAGCGGATGAAGAAGAACA R:GCTTCTGCTCACTCTCTACCTCTC MYH4 F:AGTGCTATCCCAGAGGGTCAGT R:AGCTTTTCATCTCGCATCTCCT MYH7 F:CGTGGACTACAACATCATAGGC R:CTTTGCCCTTCTCAACAGGT GAPDH F:ACACTGAGGACCAGGTTGTG R:GACGAAGTGGTCGTTGAGGG 表 2 不同地区猪pH3 h和色泽比较
Table 2 Comparison of pH3 h and color of pig from different regions
项目 三元猪 阿坝藏猪 甘南藏猪 林芝藏猪 pH3 h 6.05±0.20a 5.71±0.12b 5.78±0.22b 5.71±0.23b L* 44.65±2.33a 37.58±1.36b 43.39±1.40a 44.09±2.51a a* 2.12±0.87c 8.10±0.99a 6.35±1.28b 5.38±0.96b b* −0.18±0.85b −0.36±0.48b 1.72±1.56a −0.03±1.05b 注:小写字母的不同表示不同地区差异显著(P<0.05),此处3 h是指从屠宰到样品冻结的时间。 表 3 不同地区猪羟脯氨酸含量比较
Table 3 Comparison of hydroxyproline content of pig in different regions
指标 大白猪 阿坝藏猪 甘南藏猪 林芝藏猪 羟脯氨酸(%) 0.0592±0.0052b 0.0740±0.0068a 0.0695±0.0072a 0.0749±0.0095a 注:表中所有数据表示为平均值±标准差,小写字母的不同地区差异显著(P<0.05)。 表 4 肌肉品质与肌纤维类型相关性分析
Table 4 Correlation analysis between meat quality and muscle fiber type
指标 pH L* a* b* 蒸煮
损失剪切力 肌红
蛋白羟脯
氨酸MyHCI MyHC
IIaMyHC
IIxL* −0.10 a* 0.00 −0.64** b* −0.12 0.18 0.09 蒸煮损失 −0.02 −0.34 0.33 0.00 剪切力 0.04 −0.21 0.32 0.45* 0.32 肌红蛋白 −0.15 −0.29 0.71** 0.22 0.18 0.85** 羟脯氨酸 −0.15 −0.27 0.60** −0.28 0.43 0.73** 043 MyHCI 0.07 −0.74* 0.65** −0.08 0.49* 0.25 0.28 0.23 MyHCIIa −0.23 0.04 0.48** 0.28 0.43* 0.70** 0.58** 0.50* 0.05 MyHCIIx −0.02 −0.12 0.29 −0.15 0.55** 0.48* 0.48** 0.28 0.01 0.48** MyHCIIb 0.05 0.44* −0.62** 0.06 −0.65** −0.63** −0.60** −0.45* −046* −0.65** −0.86** 注:*表示各指标之间显著相关(P<0.05),**表示各指标之间极显著相关(P<0.01)。 -
[1] 张剑搏, 丁学智, ANUM A A, 等. 高原土著动物适应性进化的研究进展[J]. 畜牧兽医学报,2019,50(9):1723−1736. [ZHANG J B, DING X Z, ANUM A A, et al. Research progress on adaptive evolution of plateau indigenous animals[J]. Journal of Animal Husbandry and Veterinary Medicine,2019,50(9):1723−1736. [2] ŞIRIN E, AKSOY Y, UGURLU M, et al. The relationship between muscle fiber characteristics and some meat quality parameters in Turkish native sheep breeds[J]. Small Ruminant Research,2017,150(10):46−51.
[3] 刘露露, 宋阳, 苏丁丁. 猪肌纤维发育及其对肉品质的影响[J]. 湖南畜牧兽医,2017(2):36−38. [LIU L L, SONG Y, SU D D. Pig muscle fiber development and its effect on meat quality[J]. Hunan Animal Husbandry and Veterinary Medicine,2017(2):36−38. [4] 王莉. 牦牛肉肌纤维类型组成及其代谢酶活力差异对宰后肉嫩度的影响[D]. 兰州: 甘肃农业大学, 2016. WANG L. Effects of muscle fiber type composition and metabolic enzyme activities on meat tenderness after slaughter in yak [D]. Lanzhou: Gansu Agricultural University, 2016.
[5] 门小明. 肌肉纤维类型组成对猪肉品质的影响及其机理研究[D]. 无锡: 江南大学, 2012. MEN X M. Study on the effect of muscle fiber type composition on pork quality and its mechanism [D]. Wuxi: Jiangnan University, 2012.
[6] SHEN L Y, LUO J, LEI H G, et al. Effects of muscle fiber type on glycolytic potential and meat quality traits in different Tibetan pig muscles and their association with glycolysis-related gene expression[J]. Genetics and Molecular Research: GMR,2015,14(4):14366−14378. doi: 10.4238/2015.November.13.22
[7] 李春保. 牛肉肌内结缔组织变化对其嫩度影响的研究[D]. 南京: 南京农业大学, 2006. LI C B. Study on the effect of chan-ges of connective tissue in beef muscle on its tenderness [D]. Nanjing: Nanjing Agricultural University, 2006.
[8] 张盼, 商鹏, 张博, 等. 舍饲与放牧条件下藏猪的屠宰性能和肉品质比较[J]. 中国畜牧杂志,2019,55(3):107−109. [ZHANG P, SHANG P, ZHANG B, et al. Comparison of slaughter performance and meat quality of Tibetan pigs under house feeding and grazing conditions[J]. Chinese Journal of Animal Husbandry,2019,55(3):107−109. [9] 周琳, 王蜀金. 藏猪生理学研究进展[J]. 家畜生态学报,2019,35(7):7−12. [ZHOU L, WANG S J. Research progress of Tibetan pig physiology[J]. Journal of Livestock Ecology,2019,35(7):7−12. [10] 中华人民共和国农业部. NY/T 2793-2015 肉的食用品质客观评价方法[S]. 北京: 中国农业出版社, 2015. Ministry of Agriculture of the People’s Republic of China. NY/T 2793-2015 Objective evaluation method of meat eating quality[S]. Beijing: China Agricultural Press, 2015.
[11] KRZYWICKI K L. The determination of haem pigments in meat[J]. Meat Science,1982,7(1):29−36.
[12] 中华人民共和国国家质量监督检验检疫管理总局. GB/T 9695.23-2008肉与肉制品羟脯氨酸含量测定[S]. 北京: 中国标准出版社, 2008. General Administration of Quality Supervision, Inspection and Quarantine of the People’s Republic of China. GB/T 9695.23-2008 Determination of Hydroxyproline in Meat and Meat Products [S]. Beijing: China Standards Press, 2008.
[13] 杨玉莹, 张一敏, 毛衍伟, 等. 不同部位牦牛肉肌纤维特性与肉品质差异[J]. 食品科学,2019,40(21):72−77. [YANG Y Y, ZHANG Y M, MAO Y W, et al. Differences in muscle fiber characteristics and meat quality of yak meat in different parts[J]. Food Science,2019,40(21):72−77. doi: 10.7506/spkx1002-6630-20181025-296 [14] SHEN L Y, LEI H, ZHANG S, et al. Comparison of energy metabolism and meat quality among three pig breeds[J]. Animal Science Journal,2014,85(7):770−779. doi: 10.1111/asj.12207
[15] 邹波, 李春保. 乙酰化、能量代谢与肉品品质的关联[J]. 肉类研究,2019,33(8):58−64. [ZOU B, LI C B. Relationship between acetylation, energy metabolism and meat quality[J]. Meat Research,2019,33(8):58−64. [16] 邹波, 何广捷, 赵迪, 等. 蛋白质组学揭示宰前温和驱赶改善猪肉品质的潜在机制[J]. 食品科学,2020,41(13):29−37. [ZOU B, HE G J, ZHAO DI, et al. Protein omics reveals the potential mechanism of improving pork quality by mild driving before slaughter[J]. Food Science,2020,41(13):29−37. doi: 10.7506/spkx1002-6630-20190625-318 [17] GAN M L, SHEN L Y, FAN Y, et al. High altitude adaptability and meat quality in Tibetan pigs: A reference for local pork processing and genetic improvement[J]. Animals,2019,9(12):1080−1092.
[18] 马兰. 肌红蛋白在藏羚羊心肌和骨骼肌低氧适应中的作用[D]. 青海: 青海大学, 2014. MA L. The role of myoglobin in myocardial and skeletal muscle hypoxia adaptation in Tibetan antelopes [D]. Qinghai: Qinghai University, 2014.
[19] LI M, TIAN S, JIN L, et al. Genomic analyses identify distinct patterns of selection in domesticated pigs and Tibetan wild boars[J]. Nature genetics, 2013, 45(12): 1431−1438.
[20] REMY J, VAN DE VEN, KELLY L, et al. Post-mortem modelling of pH and temperature in related lamb carcases[J]. Meat Science,2014,96(2):1034−1039. doi: 10.1016/j.meatsci.2012.10.001
[21] 汪洋, 王稳航. 肌内结缔组织与肉的嫩度的关联机制及相关肉嫩化技术的研究进展[J]. 食品科学,2021,42(11):332−340. doi: 10.7506/spkx1002-6630-20200427-354 [22] WANG Y, WANG W H. Correlation mechanism between intramuscular connective tissue and meat tenderness and research progress of meat tenderization technology[J]. Food Science,2021,42(11):332−340.
[23] 王复龙. 组织蛋白酶L与苹果酸对牛背最长肌肌内结缔组织特性与剪切力的影响[D]. 南京: 南京农业大学, 2015. WANG F L. Effects of cathepsin L and malic acid on the characteristics and shear force of intramuscular connective tissue of longissimus dorsi [D]. Nanjing: Nanjing Agricultural University, 2015.
[24] RÖCKL K S C, HIRSHMAN M F, BRANDAUER J, et al. Skeletal muscle adaptation to exercise training: AMP-activated protein kinase mediates muscle fiber type shift.[J]. Diabetes,2007,56(8):2062−2069. doi: 10.2337/db07-0255
[25] BEE G. Effect of early gestation feeding, birth weight, and gender of progeny on muscle fiber characteristics of pigs at slaughter[J]. Journal of Animal Science,2004,82(3):826−836. doi: 10.2527/2004.823826x





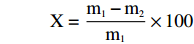
 下载:
下载:



 下载:
下载:
