Coupled Oxidative Degradation of Blueberry Anthocyanins Induced by Catechol
-
摘要: 为了明确蓝莓花色苷在贮藏及加工过程中的降解途径,本文系统地研究了花色苷-多酚氧化酶(Polyphenol Oxidase,PPO)-邻苯二酚的偶合氧化反应机制,探讨了三者之间的量效反应关系。结果表明,邻苯二酚的酶促氧化生成醌类物质和花色苷与醌类物质的氧化反应是偶合氧化体系中主要的两类反应;花色苷的偶合氧化降解符合一级反应动力学模型;当体系中花色苷浓度为54 mg/L时,虽然花色苷的降解速率会随着邻苯二酚浓度的增加而增加,但当邻苯二酚浓度高于1.33 mmol/L时,邻苯二酚浓度的变化对花色苷降解速率影响逐渐变小;花色苷初始浓度越高,邻苯二酚氧化的速率越低,花色苷的降解速率也越低;而酶浓度的增加会导致花色苷的降解速率线性增加。本文结果可推断,在蓝莓贮藏及加工过程中,其组织中的PPO会与其酚类底物结合,产生相应的醌类物质,而这些物质再通过耦合氧化反应导致蓝莓花色苷降解,从而最终导致果实或者相关产品的褐变。且其褐变速率与组织中酶的活性、酚类底物以及花色苷含量都有密切的关系。Abstract: In order to clarify the degradation pathway of anthocyanins in blueberry during storage and processing, the mechanism of coupled oxidation of anthocyanins-polyphenol oxidase-catechol was systematically studied, and the dose-response relationship among them was discussed. The enzymatic oxidation of catechol to quinones and the oxidation of anthocyanins with quinones were two main reactions in the coupled oxidation system. The coupled oxidation of anthocyanins degradation followed the first-order reaction kinetic model. Moreover, although the degradation rate of anthocyanins increased with the increasing of catechol concentration, when catechol concentration was higher than 1.33 mmol/L, the effect of catechol concentration on the degradation rate of anthocyanins decreased. The higher the initial concentration of anthocyanins, the lower the oxidation rate of catechol and the degradation rate of anthocyanins. The degradation rate of anthocyanins increased linearly with the increasing of enzyme concentration. It could be inferred that during the storage and processing of blueberry, PPO in the tissue would combine with its phenolic substrates to produce corresponding quinones, which would lead to the degradation of anthocyanins in blueberry through coupled oxidation reaction, and eventually lead to browning of fruit or related products. The browning rate was closely related to enzyme activity, phenolic substrate and anthocyanin content.
-
Keywords:
- blueberry /
- anthocyanins /
- catechol /
- polyphenol oxidase /
- coupled oxidation
-
蓝莓酸甜可口,营养丰富,富含花色苷、类黄酮等多种功能活性成分[1-4]。随着人们对健康生活需求的日益增长,蓝莓因其具有明目、护肝、抗癌、抗衰老等多种功效而逐渐受到消费者的青睐[5-9]。但是蓝莓因采后易腐烂和发生褐变而导致其花色苷等功能活性成分降解,严重影响了其加工制品的品质,制约了蓝莓产业的健康发展。
花色苷非常不稳定,易受pH、温度、氧、酶、金属离子和糖等因素的影响而发生降解[10-13]。虽然花色苷不能直接被多酚氧化酶(Polyphenol Oxidase,PPO)氧化,但是花色苷在有多酚类底物和PPO同时存在的情况下会迅速降解,因此,PPO被认为在花色苷的降解中扮演着重要的角色[14-15]。然而,有关蓝莓花色苷稳定性的研究主要集中在热处理、超高压处理等对其稳定性的影响上[16-19],而关于蓝莓花色苷耦合氧化降解的报道相对较少,仅Karder对蓝莓PPO耦合氧化降解矢车菊素-3-葡萄糖进行了报道,他认为矢车菊素-3-葡萄糖是通过耦合氧化机制与绿原酸或咖啡酸酶促氧化产生的醌形成降解产物而降解[20-22]。但有关花色苷、PPO、底物三者之间的反应量效关系尚待进一步研究。
针对以上问题,本文拟对蓝莓花色苷的偶合氧化降解途径进行研究,阐明花色苷偶合氧化降解过程中的量效反应规律,为进一步探寻蓝莓在贮藏及加工过程中花色苷降解的调控措施提供理论依据和技术支撑。
1. 材料与方法
1.1 材料与仪器
蓝莓 品种园蓝,选择新鲜、无机械损伤的蓝莓,贮藏于−18 ℃下备用;乙醇、丙酮、乙酸乙酯、盐酸、磷酸二氢钾、磷酸氢二钾、柠檬酸、柠檬酸三钠、邻苯二酚、无水硫酸铵、PVPP 分析纯,国药集团化学试剂有限公司;苯基-琼脂糖凝胶CL-4B(Phenyl- Sepharose CL-4B) Pharmacia公司。
JJ-2高速组织捣碎机 金坛市淮诚实验器材厂;UV-1700 SPC紫外可见分光光度计 SHIMADZU公司;90-3型磁力搅拌器 上海沪西分析仪器厂有限公司;5804R冷冻离心机 Eppendorf公司。
1.2 实验方法
1.2.1 蓝莓花色苷的提取分离
参照荔枝表皮花色苷的提取方法[23]。将冰冻的蓝莓与丙酮以1:5的固液比进行混合,置于打浆机中打浆。在4 ℃下静置提取4 h后过滤,滤液通过旋转蒸发除去丙酮,所得浓缩液用大孔树脂柱层析分离纯化,收集40%乙醇洗脱组分,再旋转蒸发除去乙醇。所得旋蒸液用乙酸乙酯萃取,收集水相并再次旋转蒸发浓缩,即得蓝莓花色苷提取物,置于4 ℃的贮存备用。
1.2.2 花色苷浓度的测定
采用pH示差法[24]。2.0 mL花色苷提取液用pH1.0的缓冲液稀释至25 mL,另取2.0 mL花色苷提取液用pH4.5的缓冲液稀释至25 mL,510 nm处测定吸光值A。按下面公式计算含量:
式中,484.82是氯化矢车菊素-3-葡萄糖苷的分子量;24825是氯化矢车菊素-3-葡萄糖苷的摩尔吸光系数;DF为稀释度。
1.2.3 蓝莓PPO提取、分离纯化
参照本实验室提取水蜜桃PPO的方法[25]。在获得蓝莓PPO粗提液后,用Phenyl- Sepharose CL-4B(2 cm×20 cm)柱进行分离纯化。上样液(NH4)2SO4饱和度为35%,流速为2 mL/min,收集50 mmol/L磷酸缓冲液(pH6.8)洗脱下柱液中有酶活的组分,并在此缓冲溶液中透析过夜后备用。
1.2.4 PPO活性测定
采用分光光度法[25],分别加入1.8 mL磷酸缓冲液(50 mmol/L,pH 6.0)、1 mL 10 mmol/L邻苯二酚,调零后快速加入0.2 mL酶液,并开始计时,每隔30 s记录400 nm吸光度值,计时3 min,平行测定3次。以每分钟吸光值增加0.001为一个酶活性单位。
1.2.5 不同邻苯二酚浓度对偶合氧化反应的影响
在比色皿中分别加入0.2 mL的花色苷溶液(反应体系中的终浓度为54 mg/L)和不同体积的20 mmol/L邻苯二酚,邻苯二酚在体系中的终浓度分别为0.67、1、1.33、1.67、2、2.67、3.33 mmol/L,加柠檬酸-柠檬酸钠缓冲液(pH3.5)至2.8 mL,再加入0.2 mL的PPO混合均匀(总反应体系3 mL,15 ℃),在350~600 nm下,以2 min为一个间隔,对反应体系进行扫描,记录峰值变化。
1.2.6 不同花色苷浓度对偶合氧化反应的影响
在比色皿中加入0.1 mL 20 mmol/L的邻苯二酚和不同体积的花色苷,花色苷的在体系中的终浓度分别为18、27、40.5、54、81、108、135 mg/L,用柠檬酸-柠檬酸钠缓冲液(pH3.5)至2.8 mL,再加入0.2 mL的PPO混合均匀(总反应体系3 mL,反应体系在520 nm处的吸光值在0.15~1.5之间,15 ℃),在350~600 nm下,以2 min为一个间隔,对反应体系进行扫描,记录峰值变化。
1.2.7 PPO浓度对偶合氧化反应的影响
在比色皿中加入0.2 mL花色苷(反应体系中的终浓度为54 mg/L),0.1 mL 20 mmol/L邻苯二酚和柠檬酸-柠檬酸钠缓冲液(pH3.5),加入不同体积的蓝莓PPO混合均匀(总反应体系3 mL,15 ℃),PPO在体系中的终酶浓度分别为7.5、15、22.5、30、37.5、45 U/mL,在350~600 nm下,以2 min为一个间隔,对反应体系进行扫描,记录峰值变化。
1.3 数据处理
数据采用Excel进行统计分析,并计算标准偏差。
2. 结果与分析
2.1 花色苷-PPO-邻苯二酚之间的相互作用
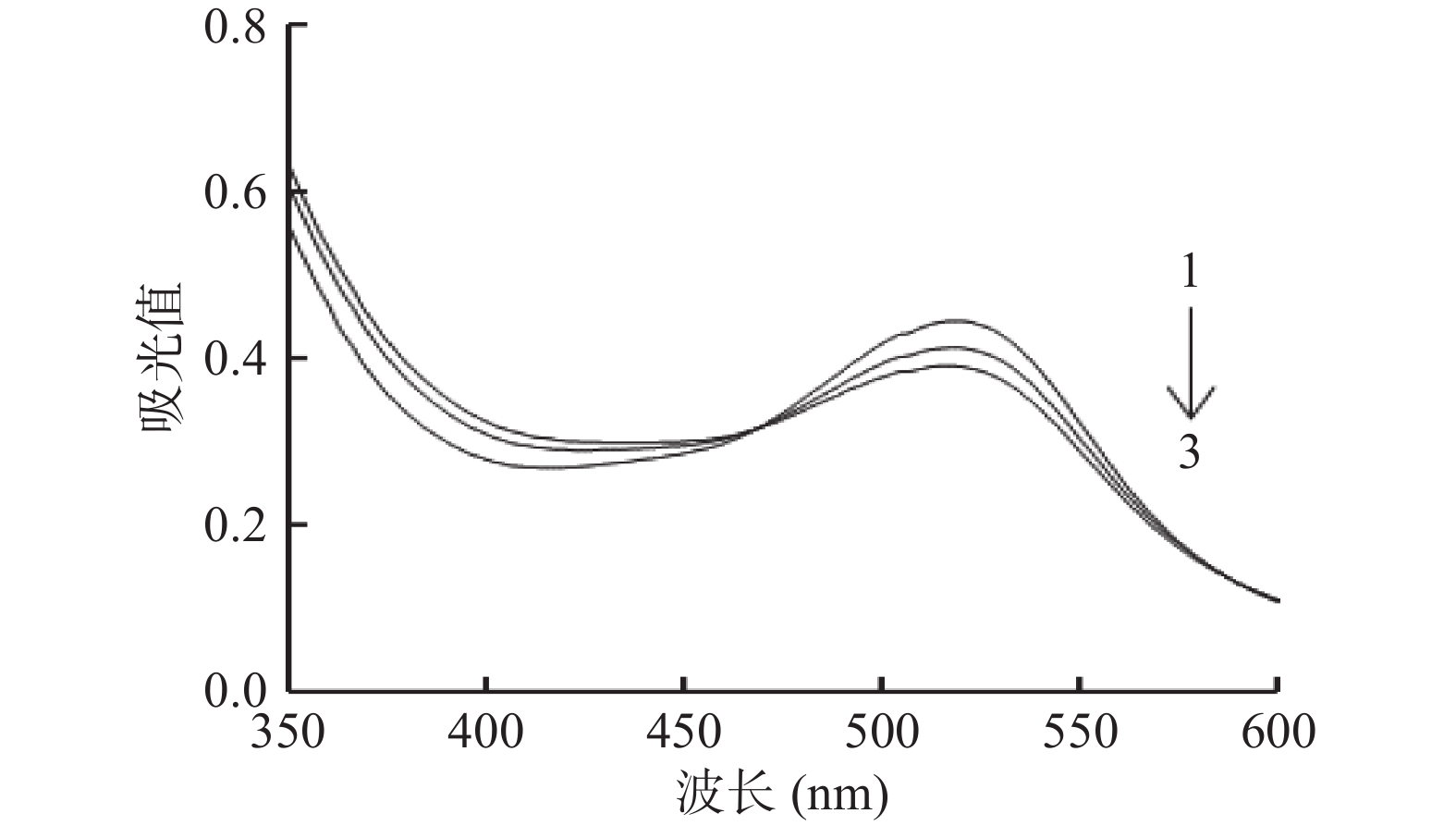
结果表明,在仅有蓝莓PPO或邻苯二酚存在的情况下,蓝莓花色苷在1 h内并没有发生明显降解。但在邻苯二酚与蓝莓PPO同时存在时,花色苷开始逐渐降解。花色苷-PPO-邻苯二酚反应体系在不同波长下的吸光值变化如图1所示,随着反应的进行,该反应体系在花色苷的特征吸收峰(520 nm)附近的吸光值逐渐降低,说明在邻苯二酚存在的条件下,PPO与花色苷之间发生了偶合氧化反应。偶合氧化反应先是由PPO将邻苯二酚氧化成苯醌,苯醌再与花色苷反应生成无色物质[26]。基于上述理论,在蓝莓花色苷的偶合氧化体系中应有两类主要的反应,一是邻苯二酚的酶促氧化反应,该反应产物的特征吸收峰在400 nm附近,会导致反应体系在400 nm附近的吸光值不断增加;二是花色苷与醌类物质的氧化反应,该反应最终导致花色苷不断被氧化降解。
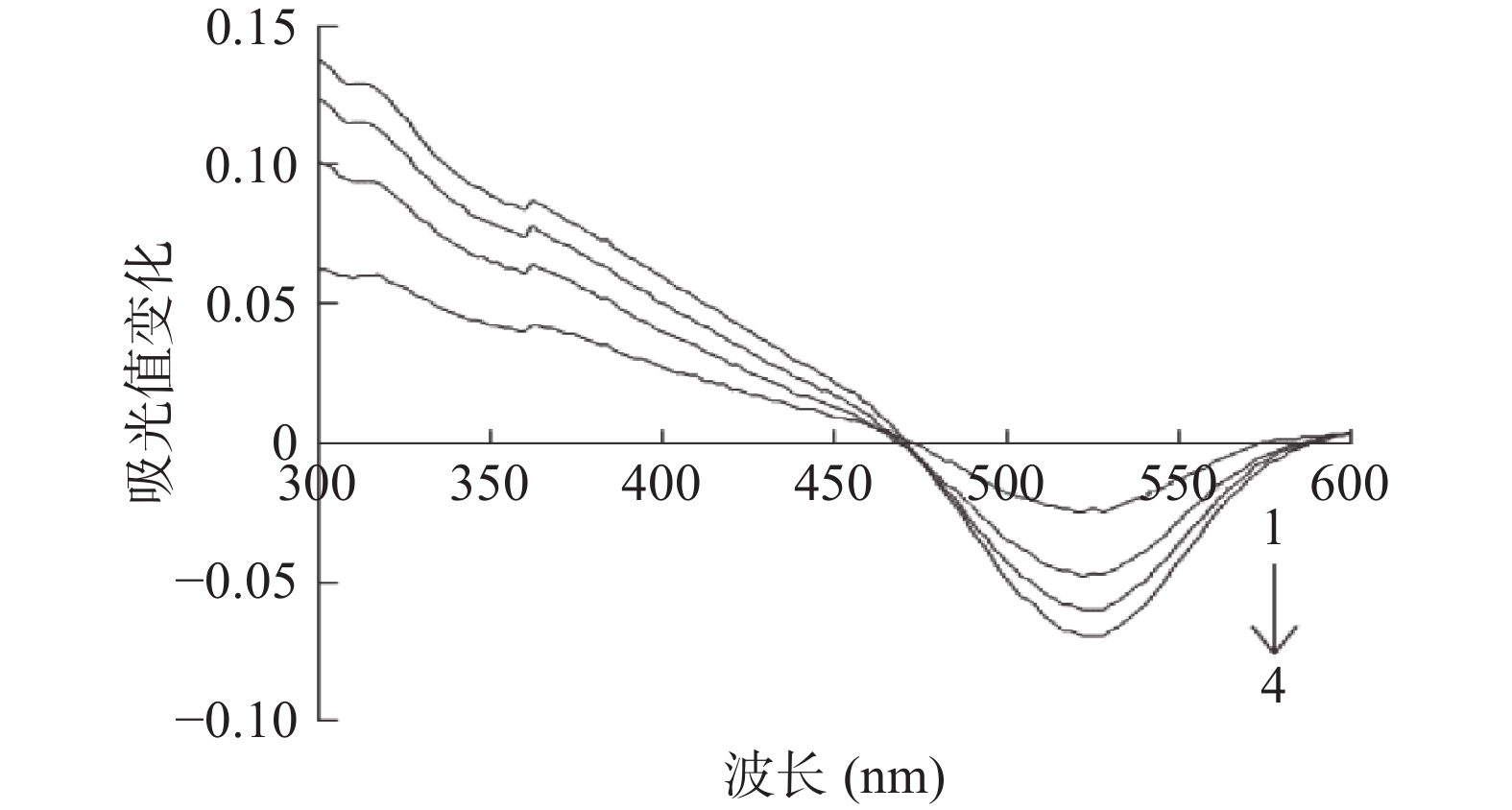
蓝莓花色苷-PPO-邻苯二酚偶合氧化反应体系在不同波长下吸光值变化研究结果显示(图2),反应体系在520 nm处的吸光值降低最快,并形成一个倒峰,此变化由花色苷与醌类物质的氧化反应所致。然而,400 nm处的吸光值虽然在不断增加,但并没有在400 nm处观察到一个正增长的吸光值变化峰,这与前期研究荔枝花色苷的偶合氧化降解反应时所得结果不一致[23]。这可能是由于本研究所用蓝莓花色苷为粗提物,是含有多种花色苷以及其他酚类物质的混合物,而在荔枝花色苷的研究中用的是经过纯化的单一花色苷。
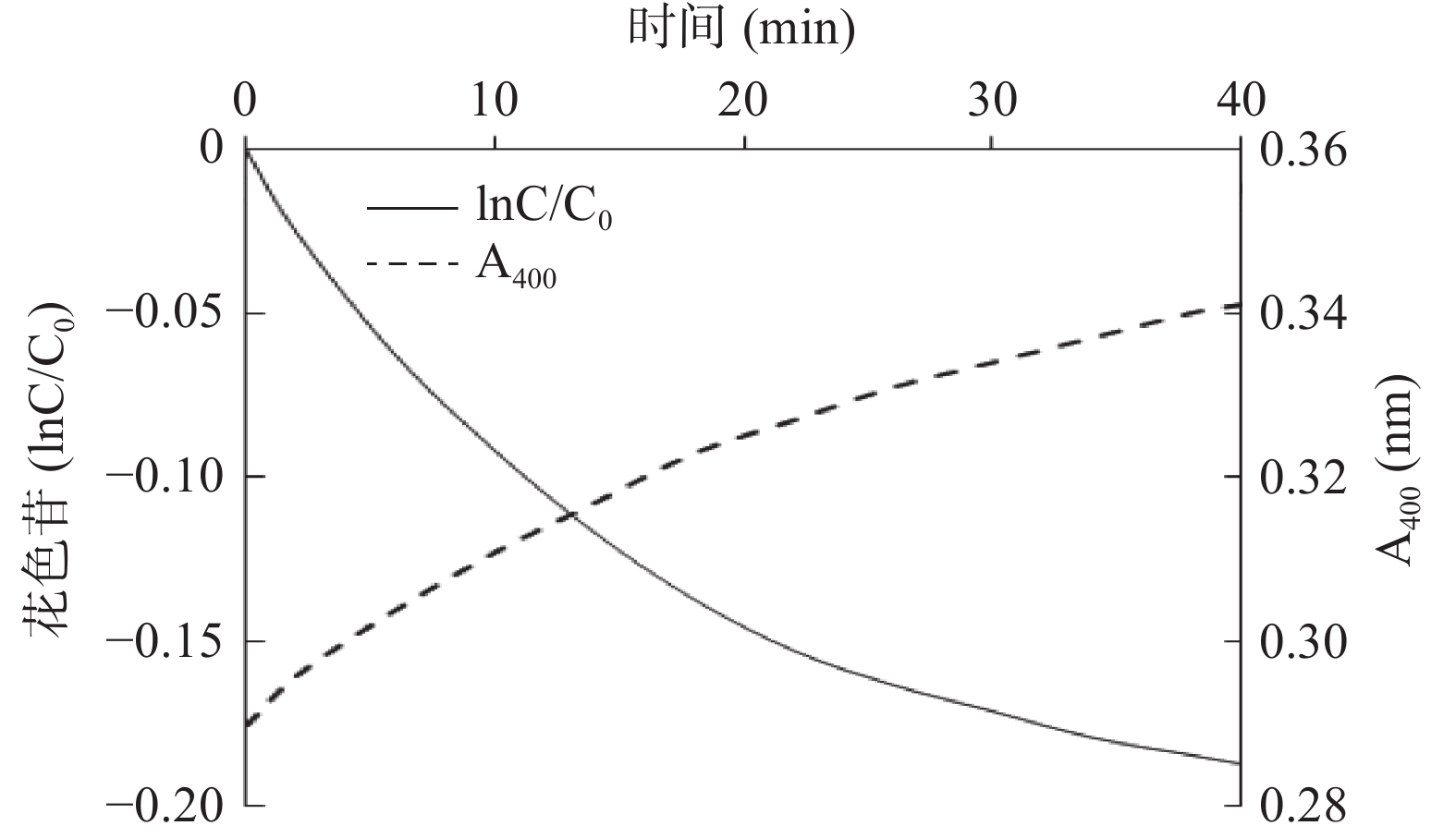
在蓝莓花色苷的耦合氧化降解反应的前20 min内,花色苷的lnC/C0降解曲线为一条直线,说明在这段时间内,花色苷的偶合氧化降解符合一级反应动力学模型。但20 min后,其降解速率大大降低(图3)。同时,在400 nm处的吸光值的变化在前20 min线性增加,但20 min后,其变化速率略有降低。该结果可能是由于随着花色苷大量的被耦合氧化降解,花色苷浓度下降,邻苯二酚与花色苷分子间的碰撞概率下降,导致降解速率逐渐减小所致[23]。
2.2 邻苯二酚浓度对偶合氧化反应的影响
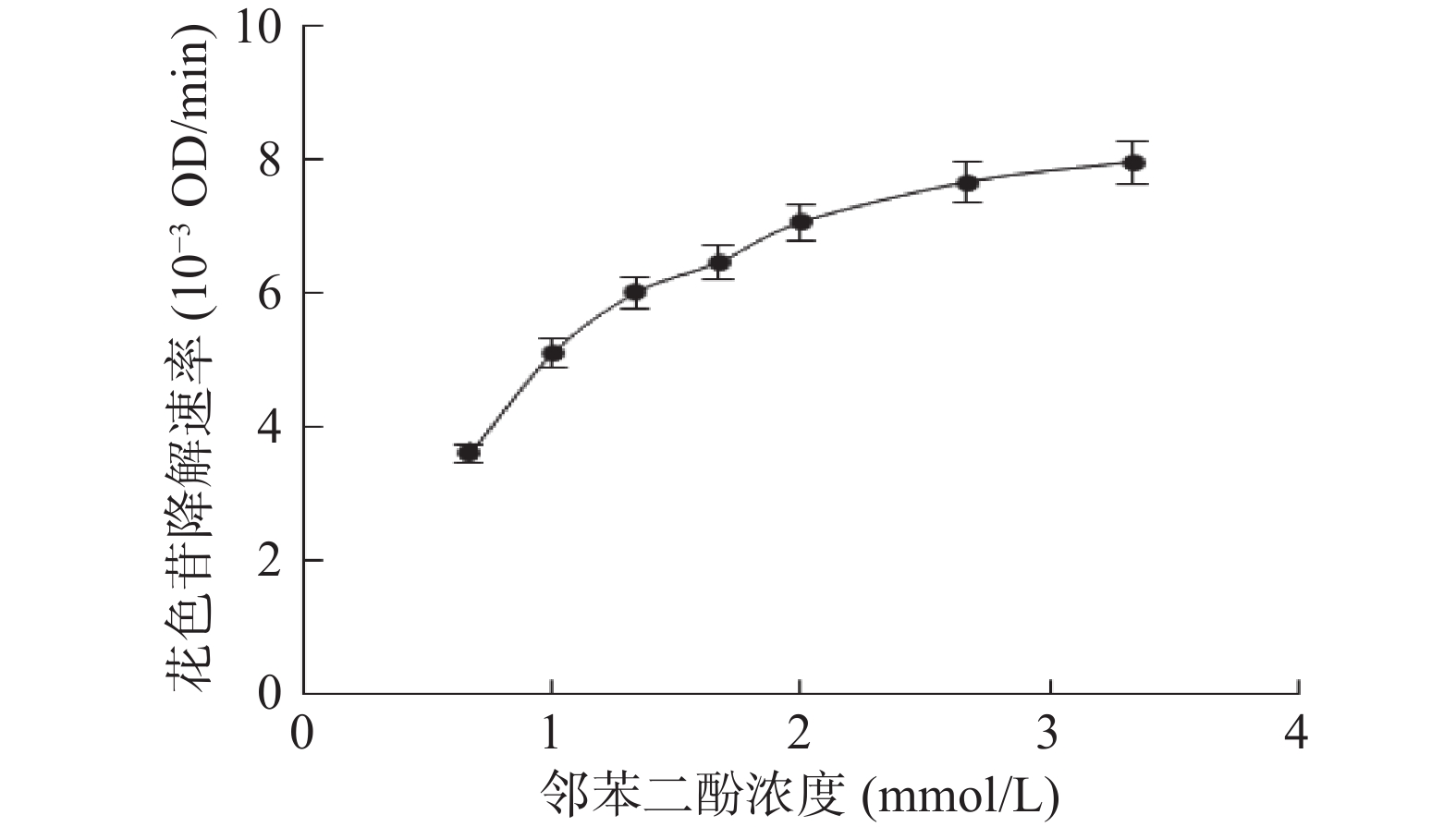
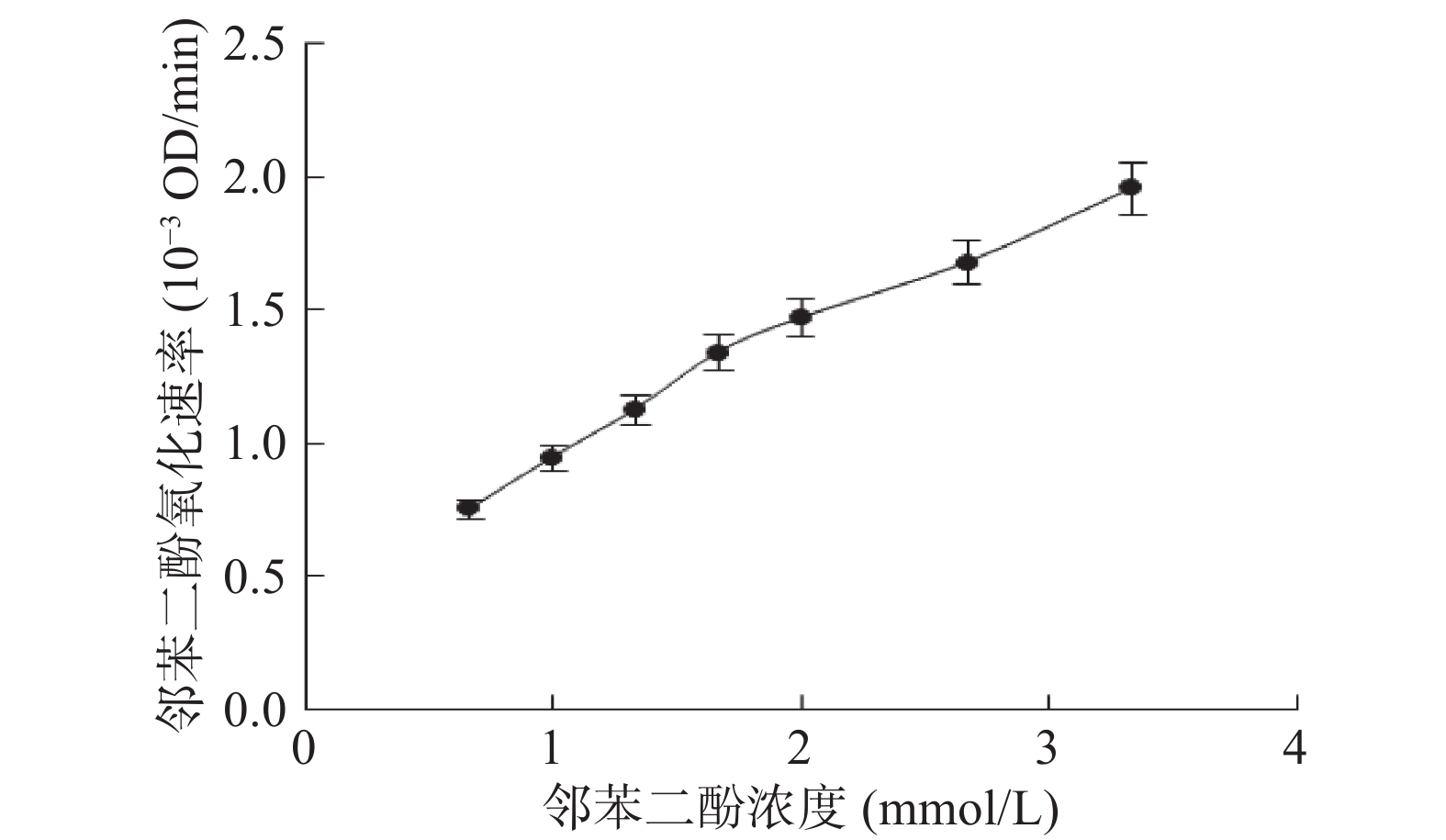
邻苯二酚浓度对偶合氧化降解体系中花色苷降解速率的影响如图4所示。邻苯二酚浓度的增加会导致花色苷的降解速率的增加。当邻苯二酚浓度低于于1.33 mmol/L时,花色苷的降解速率随着邻苯二酚浓度的增加而迅速增加;而当邻苯二酚浓度高于1.33 mmol/L时,邻苯二酚浓度的变化对花色苷降解速率的影响逐渐变小。
与此同时,邻苯二酚氧化速率在所选择的所有浓度范围内均随着邻苯二酚浓度的增加而线性增加(图5)。这说明在蓝莓花色苷的偶合氧化反应体系中,增加邻苯二酚浓度会导致苯醌生成速率的增加,但这些生成的苯醌并没有进一步与花色苷发生反应。其原因可能是:增加邻苯二酚浓度可能使得邻苯二酚会与苯醌的反应机率增加,使体系中邻苯二酚和花色苷会相互竞争与苯醌发生反应[22]。
2.3 花色苷浓度对对偶合氧化反应的影响
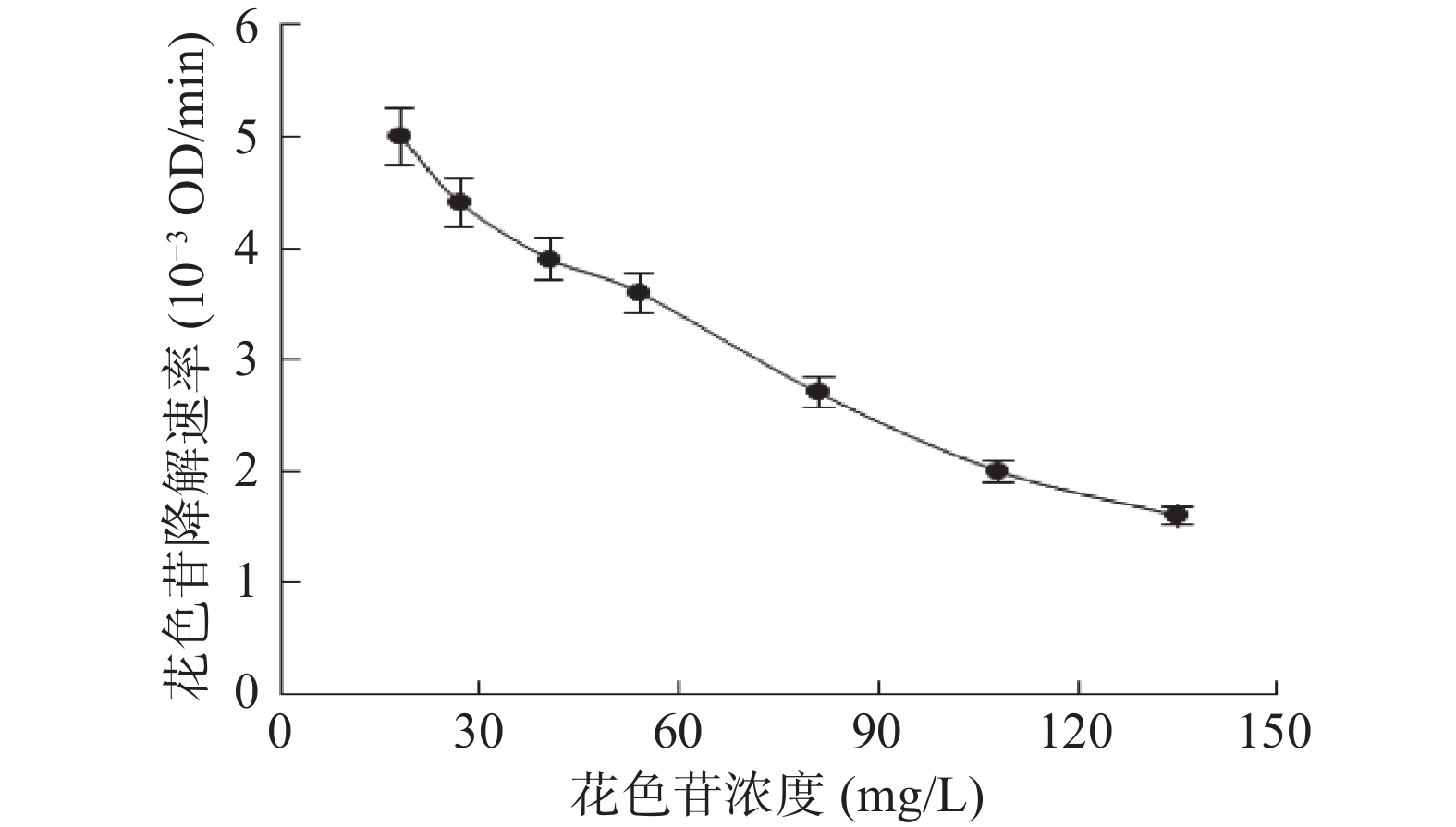
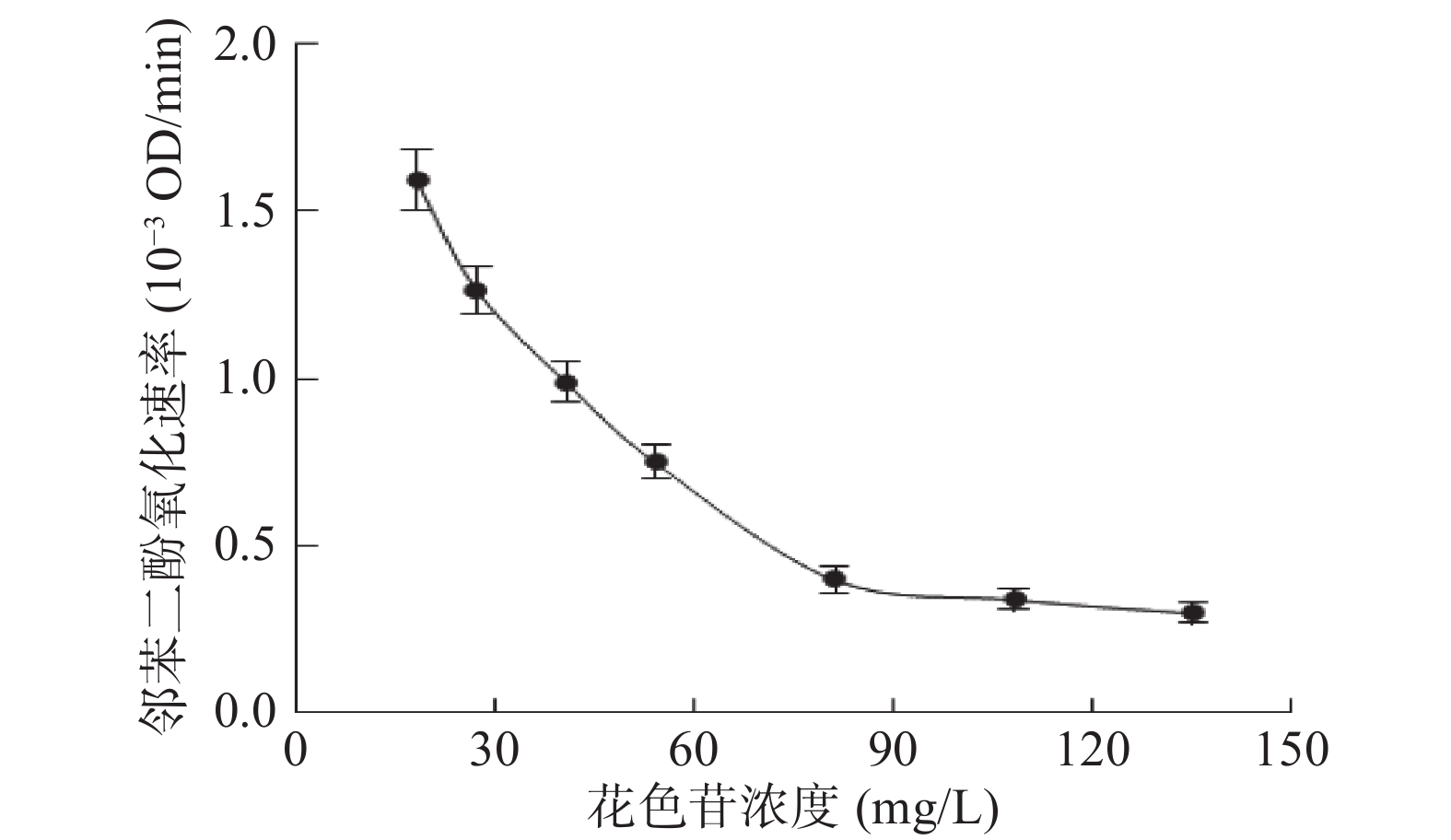
当邻苯二酚浓度不变时,花色苷浓度对对偶合氧化降解体系中花色苷降解速率的影响如图6所示。随着体系中初始花色苷浓度的增加,体系中花色苷的降解速率不断降低。同时,邻苯二酚的氧化速率随着花色苷浓度的增加而降低(图7)。Hemachandran等[27]的研究表明,花色苷可以抑制苹果PPO的活性,且这种抑制属于非竞争性抑制模式。本研究中花色苷浓度的增加可能导致蓝莓PPO活性被抑制,导致苯醌的生成速率变小,从而导致花色苷降解速率逐渐降低。
当花色苷浓度大于81 mg/L时,其浓度的增加不再导致邻苯二酚氧化速率的降低,此时的邻苯二酚氧化速率趋近与0。这说明在此条件下,体系中所有产生的苯醌几乎全都与花色苷发生了偶合氧化反应,所以再进一步增加花色苷浓度,并不会导致降解的花色苷增多,但花色苷浓度的增加使得体系中降解花色苷的相对量变小,所以体系中花色苷的降解速率仍然在降低。
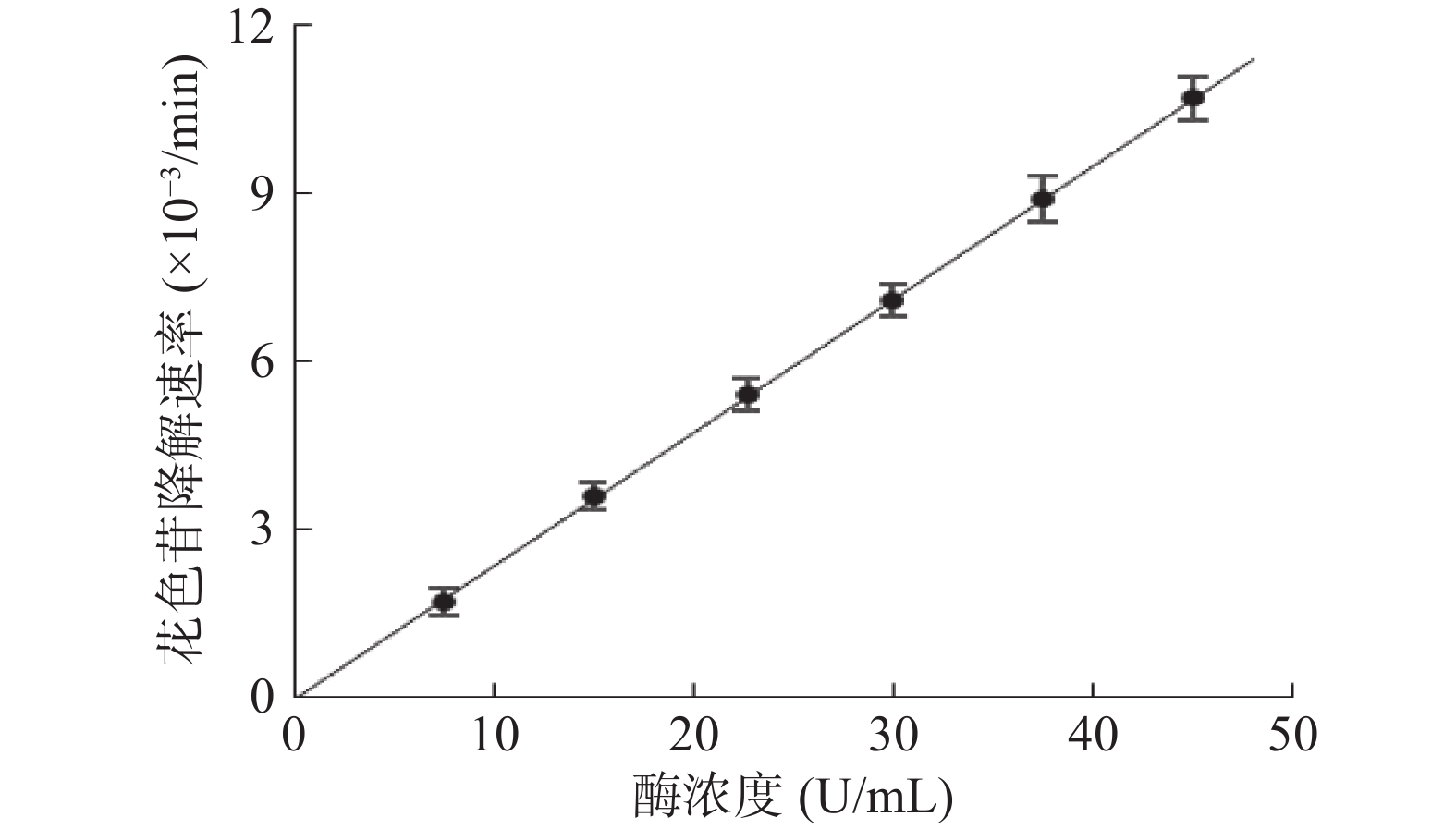
2.4 PPO浓度对偶合氧化反应的影响
如图8所示,蓝莓花色苷偶合氧化降解速率随着酶浓度的增加而加快,且花色苷降解速率和PPO浓度呈现良好的线性关系。这说明酶浓度的增加导致苯醌的生成量增加,使得能有更多的氧化产物与花色苷发生偶合氧化反应,从而加快花色苷降解速率。文献[20,22]分别研究了绿原酸和咖啡酸醌降解花色苷的反应机制,其研究表明当花色苷与底物等摩尔量反应时,反应体系中花色苷的降解速率与绿原酸或咖啡酸的氧化速率之比均为2。这说明当花色苷与底物浓度不变时,花色苷的偶合氧化降解速率与底物的氧化速率成正比,而当酶浓度增加时,底物的酶促氧化速率会线性增加,从而导致了花色苷降解速率的线性增加[23]。
3. 结论
本文分别从蓝莓中分离提取得到花色苷和PPO,研究了花色苷-PPO-邻苯二酚的偶合氧化反应机制,邻苯二酚的酶促氧化生成醌类物质和花色苷与醌类物质的氧化反应是偶合氧化体系中主要的两类反应。且花色苷的偶合氧化降解符合一级反应动力学模型。同时,本文还探讨了花色苷-PPO-邻苯二酚三者之间的量效反应关系。研究结果表明,在偶合氧化降解体系中,邻苯二酚、花色苷和PPO浓度均会影响花色苷的降解速率。虽然花色苷的降解速率会随着邻苯二酚浓度的增加而增加,但随着邻苯二酚浓度的增加,其花色苷的降解速率的增幅却在逐渐减小。花色苷初始浓度越高,其降解速率越低,两种呈现出较为线性的负相关,而酶浓度的增加会导致花色苷的降解速率线性增加。
根据实验结果可以进一步推断,在蓝莓贮藏及加工过程中,蓝莓中的PPO会与其组织中的酚类底物结合,产生相应的醌类物质,而这些物质再通过耦合氧化机制导致蓝莓花色苷降解,从而最终导致果实或者相关产品的褐变。且其褐变速率与组织中酶的活性、酚类底物以及花色苷含量都有密切的关系。本研究结果有利于进一步揭示蓝莓花色苷的降解机制,并为探寻蓝莓在贮藏及加工过程中花色苷降解的调控措施提供理论依据。当然,在后续的研究中,应进一步利用色谱、液质联用以及核磁共振分析等技术手段对耦合氧化产物的结构进行鉴定,从而更深入地阐明蓝莓花色苷的降解机制。
-
-
[1] LEE J, WROLSTAD R E. Extraction of anthocyanins and polyphenolics from blueberry processing waste[J]. J Food Sci,2004,69(7):564−573.
[2] SKREDE G, WROLSTAD R E, DURST R W. Changes in anthocyanins and polyphenolics during juice processing of highbush blueberries (Vaccinium corymbosum L.)[J]. J Food Sci,2000,65(2):357−364. doi: 10.1111/j.1365-2621.2000.tb16007.x
[3] CHORFA N, SAVARD S, BELKACEMI K. An efficient method for high-purity anthocyanin isomers isolation from wild blueberries and their radical scavenging activity[J]. Food Chem,2016,197:1226−1234. doi: 10.1016/j.foodchem.2015.11.076
[4] HE B, ZHANG L, YUE X, et al. Optimization of ultrasound-assisted extraction of phenolic compounds and anthocyanins from blueberry (Vaccinium ashei) wine pomace[J]. Food Chem,2016,204:70−76. doi: 10.1016/j.foodchem.2016.02.094
[5] 姚佳宇, 李志坚. 蓝莓花青素在眼科疾病的研究进展[J]. 国际眼科杂志,2016,16(12):2234−2236. [YAO Jiayu, LI Zhijian. Research progress in blueberry anthocyanin in eye disease[J]. Int Eye Sci,2016,16(12):2234−2236. doi: 10.3980/j.issn.1672-5123.2016.12.15 [6] 孙倩怡, 鲁宝君, 张晶. 蓝莓花青素的研究进展[J]. 食品工业科技,2016,37(20):381−384. [SUN Qianyi, LU Baojun, ZHANG Jing. Research progress of blueberry anthocyanin[J]. Sci Tech Food Ind,2016,37(20):381−384. [7] 李亚巍, 昌盛, 王黎明, 等. 蓝莓花色苷对2型糖尿病小鼠氧化损伤的保护作用 [J]. 食品研究与开发, 2016, 37(8): 5−8 LI Yawei, CHANG Sheng, WANG Liming, et al. Protective effect of blueberry anthocyanins on oxidative damage in type 2 diabetes mice [J]. Food Res Dev, 2016, 37(8): 5−8
[8] 陈柯斐, 王鸿飞, 王春辛, 等. 蓝莓皮渣花色苷抑菌活性及抑制癌细胞增殖作用研究[J]. 食品工业科技,2017,38(11):348−351. [CHEN Kefei, WANG Hongfei, WANG Chunxing, et al. Study on tumor suppression and antibacterial effect of anthocyanin from blueberry pomace[J]. Sci Tech Food Ind,2017,38(11):348−351. [9] 田密霞, 李亚东, 胡文忠, 等. 蓝莓花色苷对实验性糖尿病小白鼠肝脏抗氧化功能的影响[J]. 食品科学,2017,38(1):210−213. [TIAN Mixia, LI Yadong, HU Wenzhong, et al. Effect of blueberry anthocyanins on antioxidant function in the liver of experimental diabetic rats[J]. Food Sci,2017,38(1):210−213. doi: 10.7506/spkx1002-6630-201701035 [10] BORDIGNON M T, GAUCHE C, GRIS E F, et al. Colour stability of anthocyanins from Isabel grapes (Vitis labrusca L.) in model systems[J]. LWT-Food Sci Tech,2007,40:594−599. doi: 10.1016/j.lwt.2006.02.022
[11] 赵昶灵, 李云, 陈中坚, 等. 花色苷的酶降解[J]. 热带亚热带植物学报,2011,19(6):576−584. [ZHAO Changling, LI Yun, CHEN Zhongjian. Enzymatic degradation of anthocyanins[J]. J Tropl Subtrop Bot,2011,19(6):576−584. doi: 10.3969/j.issn.1005-3395.2011.06.016 [12] LI A, XIAO R, HE S, et al. Research advances of purple sweet potato anthocyanins: Extraction, identification, stability, bioactivity, application, and biotransformation[J]. Molecules,2019,24(21):3816. doi: 10.3390/molecules24213816
[13] 罗晓玲, 徐嘉红, 杨武斌, 等. 蓝莓花色苷抗氧化功能及稳定性研究进展[J]. 食品工业科技,2018,39(4):312−317. [LUO Xiaoling, XU Jiahong, YANG Wubin, et al. Research progress in antioxidant function and stability of blueberry anthocyanins[J]. Sci Tech Food Ind,2018,39(4):312−317. [14] FANG Z, ZHANG M, SUN Y, et al. Polyphenol oxidase from bayberry (Myrica rubra Sieb. et Zucc.) and its role in anthocyanin degradation[J]. Food Chem,2007,103:268−273. doi: 10.1016/j.foodchem.2006.07.044
[15] RUENROENGKLIN N, SUN J, SHI J, et al. Role of endogenous and exogenous phenolics in litchi anthocyanin degradation caused by polyphenol oxidase[J]. Food Chem,2009,115:1253−1256. doi: 10.1016/j.foodchem.2009.01.040
[16] 谢国芳, 王瑞, 周笑犁, 等. 蓝莓花色苷稳定性研究进展[J]. 北方园艺,2016(7):190−194. [XIE Guofang, WANG Rui, ZHOU Xiaoli, et al. Research progress on the stability of blueberry anthocyanins[J]. Nor Hort,2016(7):190−194. [17] 吴越, 李怡青, 杨艺琳, 等. 绿茶多酚提取物对蓝莓汁花色苷热降解动力学及色泽的影响[J]. 扬州大学学报(农业与生命科学版),2016,37(1):91−96. [WU Yue, LI Yiqing, YANG Yilin, et al. Influence of green tea polyphenols extracts on the degradation kinetics of anthocyanins and color in blueberry juice[J]. J Y Univ (Agric Life Sci Ed),2016,37(1):91−96. [18] 周笑犁, 夏雪冰, 王瑞, 等. 不同条件对蓝莓皮渣花色苷稳定性的影响[J]. 食品与发酵工业,2017,43(4):192−196. [ZHOU Xiaoli, XIA Xuebing, WANG Rui, et al. Effects of different processing and storage conditions on the stability of anthocyanin extracted from blueberry peel[J]. Food Ferment Ind,2017,43(4):192−196. [19] 姜彦光, 王殿夫, 朱金艳, 等. 超高压处理对蓝莓花色苷稳定性的影响[J]. 食品工业科技,2018,39(18):83−86. [JIANG Yanguang, WANG Dianfu, ZHU Jinyan, et al. The effect of high pressure processing treatment on the stability of anthocyanin in blueberry[J]. Sci Tech Food Ind,2018,39(18):83−86. [20] KADER F, IRMOULI M, ZITOUNI N, NICOLAS J P, METCHE M. Degradation of cyanidin 3-glucoside by caffeic acid o-quinone. Determination of the stoichiometry and characterization of the degradation products[J]. J Agric Food Chem,1999,47:4625−4630. doi: 10.1021/jf981400x
[21] KADER F, ROVEL B, GIRARDIN M, METCHE M. Mechanism of browning in fresh highbush blueberry fruit (Vaccinium corymbosm L). Role of blueberry Polyphenol oxidase, chlorogenic acid and anthocyanins[J]. J Sci Food Agric,1997,74:31−34. doi: 10.1002/(SICI)1097-0010(199705)74:1<31::AID-JSFA764>3.0.CO;2-9
[22] KADER F H, NICOLAS J P, METCHE M. Degradation of cyanidin 3-glucoside by blueberry polyphenol oxidase: Kinetic studies and mechanisms[J]. J Agric Food Chem,1998,46:3060−3065. doi: 10.1021/jf970926z
[23] LIU L, CAO S Q, XIE B J, et al. Degradation of cyanidin-3-rutinoside in the presence of (-)-epicatechin and litchi pericarp polyphenol oxidase[J]. J Agric Food Chem,2007,55:9074−9078. doi: 10.1021/jf071931y
[24] RAPISARDA P, FANELLA F, MACCARONE E. Reliability of analytical methods for determining anthocyanins in blood orange juice[J]. J Agric Food Chem,2000,48:2249−2252. doi: 10.1021/jf991157h
[25] LIU L, CAO SQ, YANG H, QI XY. Pectin plays an important role on the kinetics properties of polyphenol oxidase from honeydew peach[J]. Food Chem,2015,168:14−20. doi: 10.1016/j.foodchem.2014.07.064
[26] PENG C Y, MRAKAKIS P. Effect of phenolase on anthocyanins[J]. Nature,1963,199:597−598. doi: 10.1038/199597a0
[27] HEMACHANDRAN H, ANANTHARAMAN A, MOHAN S, et al. Unraveling the inhibition mechanism of cyanidin-3-sophoroside on polyphenol oxidase and its effect on enzymatic browning of apples[J]. Food Chem,2017,227:102−110. doi: 10.1016/j.foodchem.2017.01.041





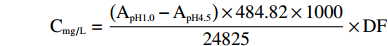
 下载:
下载:
 下载:
下载:
