Optimization of Enzymatic-assisted Thermal Water Extraction of Rosa roxburghii Polysaccharide and Its Antitumor Activity
-
摘要: 以刺梨干果为原材料,研究酶法辅助热水浸提刺梨多糖的提取工艺及其抗肿瘤活性。通过单因素实验结合响应面法优化刺梨多糖的提取工艺,并通过建立S180实体瘤模型对最优条件下提取的刺梨多糖进行抗肿瘤活性研究。结果表明,酶法辅助热水浸提刺梨多糖的最优工艺条件为:酶解pH6.2,酶解时间4 h,酶解温度41 ℃,酶添加浓度1.62%,液料比30:1 mL/g,酶解反应完成后90 ℃热水浸提3 h。在此工艺条件下,刺梨多糖得率为6.32%±0.12%。抗肿瘤活性研究表明,在灌胃剂量为200 mg/kg时,酶法辅助热水浸提刺梨多糖对S180肿瘤小鼠的抑瘤率为52.13%±1.84%,具有明显的抗肿瘤活性,并能显著(P<0.05)提高肿瘤小鼠的白细胞数量、胸腺指数和脾脏指数,说明在此工艺条件下提取的刺梨多糖,具有一定的提升肿瘤小鼠免疫能力和抗肿瘤的作用,可作为潜在的功能性食品添加或天然抗肿瘤药物来源。Abstract: In the present study, extraction process and antitumor activity of polysaccharide extracted from the Rosa roxbunghii Tratt (RRT) dried fruit were studied. The extraction technology of Rosa roxbunghii Tratt polysaccharide (RRTP) was optimized by mono-factor experiments and response surface methodology, and the antitumor activities of RRTP were studied by the model of S180 solid tumor. The results showed that the optimum extraction conditions for RRTP as follows: Enzymatic hydrolysis pH6.2, enzymatic hydrolysis time 4 h, enzymatic hydrolysis temperature 41 ℃, enzyme dosage 1.62%, liquid-solid ratio 30:1 mL/g, and then extracted at 90 ℃ hot water for 3 h after enzymatic hydrolysis completed. The yield of RRTP was 6.32%±0.12% on average under the optimum processing conditions. Furthermore, antitumor activity analysis showed that RRTP had obvious antitumor activity and could significantly (P<0.05) increase leukocyte count, thymus index and spleen index in S180 solid tumor mice. And the result indicated RRTP had a tumor inhibitory rate of 52.13%±1.84% in S180 solid tumor mice with gastric irrigation dose at 200 mg/kg. It was concluded that RRTP could improve the immune function and antitumor of S180 solid tumor mice, and could be used as a potential functional food supplements or natural substances of antitumor drugs.
-
刺梨(Rosa roxbunghii Tratt,RRT),为蔷薇科蔷薇属落叶灌木植物,主要分布于我国西南省份海拔1000~1600 m的山区[1]。2019年初,刺梨被贵州省列为12个农业特色优势产业之一,并得到快速发展,种植面积和加工能力逐年上升。据统计,至2020年底,贵州省刺梨种植面积突破200万亩,全省刺梨鲜果产量超10万吨,同比增长51%,全省35家刺梨重点加工企业年鲜果加工能力达14万吨,刺梨产业在贵州省呈现出蓬勃生机。
现代研究表明,刺梨富含多种营养元素和功能成分,包括多糖、多酚、维生素C、超氧化物歧化酶、黄酮、维生素B以及多种矿物质元素[2-6],具有抗氧化[2,7]、抗肿瘤[8]、抗炎[9]、防辐射[9-10]、抗动脉粥样硬化[11]、促进胃肠道消化[12]等多种药用功效,在功能性食品及药品的开发上均具有广阔的应用前景。
天然植物多糖由于具有抗氧化、抗肿瘤、乳化、增稠、起泡、胶凝等多种特性,且相较于人工合成药物或添加剂,具有作用效果好、毒副作用小和安全系数高等优点,一直以来都是研究的热点[13-14]。其中,刺梨多糖(Rosa roxbunghii Tratt polysaccharide,RRTP)作为刺梨中的主要功能性成分,对刺梨产品的开发和研究均具有重要影响。因此,对刺梨多糖的提取方法及其功能特性进行系统研究将具有重要理论和现实意义。
本研究考虑到传统溶剂或热水提取刺梨多糖需要大量的化学溶剂,萃取时间长,提取效率低、加工温度高,会对刺梨多糖的生物活性和安全性产生不利影响,拟从追求绿色提取工艺的角度出发,建立一种新的酶法辅助热水浸提刺梨多糖工艺并对其抗肿瘤活性进行评价,获得一种提高刺梨多糖的提取效率和生物活性的绿色提取工艺,以期为刺梨多糖的进一步开发和综合应用奠定良好的理论基础。
1. 材料与方法
1.1 材料与仪器
刺梨干果 贵州省贵阳市万东桥药材市场;昆明种小鼠(雌雄各半,共60只,体重20±2 g) 由贵州医科大学试验动物中心提供;S180瘤株 由贵州大学杨再昌教授惠赠并由贵州省中国科学院天然产物化学重点实验室妥善传代并保存;无水乙醇、浓硫酸 重庆川东化工有限公司;纤维素酶(≥15000 U/g)、苯酚、冰醋酸、亚甲蓝、羧甲基纤维素钠、生理盐水 国药集团化学试剂有限公司;葡萄糖 天津市致远化学试剂有限公司;环磷酰胺 江苏恒瑞医药股份有限公司。
DK-98-11型水浴锅 天津泰斯特仪器有限公司;MD spectra MAX-190型连续波长酶标仪 美国MD公司;HP-8435型紫外可见分光光度计 美国惠普公司;AL204型梅特勒电子分析天平 梅特勒·托利多仪器(上海)有限公司;DZF-6021型真空干燥箱 上海精宏实验设备有限公司;FW型高速万能粉碎 天津泰斯特仪器有限公司;PH100生物显微镜 凤凰光学集团有限公司。
1.2 实验方法
1.2.1 刺梨多糖提取工艺优化
1.2.1.1 刺梨干果预处理
采用60 ℃真空干燥刺梨干果至恒重,高速万能粉碎机粉碎(1 min),过40目筛,用80%乙醇加热回流提取8次,初步除去生物碱、甙类等醇溶性物质(每次2 h),抽滤得刺梨粉末,于60 ℃真空干燥至恒重后制得预处理样品。
1.2.1.2 刺梨多糖酶法辅助热水浸提工艺
取预处理样品5 g,加入500 mL圆底烧瓶中,按照设定液料比添加0.1 mol/L的提前配制的固定pH柠檬酸-柠檬酸钠缓冲液,并按设定酶添加浓度添加纤维素酶,混匀后放入水浴锅中,在设置的提取温度和提取时间条件下进行酶解,酶解反应结束后,将温度提升至90 ℃进行灭酶并浸提3 h,抽滤后得滤液。滤液进行减压浓缩后,置于截留分子量>14000 Da的透析袋中,以流动蒸馏水进行透析除去小分子杂质后,减压浓缩至一定体积,并根据体积计算加入适量无水乙醇,使样品中乙醇浓度达到80%,样品搅拌均匀后,置于4 ℃冰箱中静置12 h。将样品取出,抽滤并用无水乙醇洗涤析出絮凝物2~3次,将絮凝物在60 ℃真空干燥至恒重后得刺梨粗多糖。
1.2.1.3 刺梨多糖酶法辅助热水浸提单因素实验
本研究选用酶解pH、酶解时间、酶解温度以及酶添加浓度四个影响因素,考察影响因素对酶法辅助热水浸提刺梨多糖得率的影响。固定液料比30:1 mL/g,酶解pH5.8,酶解时间4 h,酶解温度50 ℃,酶添加浓度1.5%,提取1次的基本条件,分别改变酶解pH(4.2、4.6、5.0、5.4、5.8、6.2)、酶解时间(1、2、3、4、5、6、7 h)、酶解温度(30、40、50、60、70、80 ℃)、酶添加浓度(0.5%、1.0%、1.5%、2.0%、2.5%、3.0%、3.5%)四个因素的条件,考察其对酶法辅助热水浸提刺梨多糖得率的影响。
1.2.1.4 刺梨多糖酶法辅助热水浸提响应面优化试验
根据单因素实验结果,结合Box-Benhnken中心组合试验(BBD)设计原理,在液料比30 mL/g,提取1次的原则下,选取酶解pH、酶解时间、酶解温度和酶添加浓度作为自变量,刺梨多糖得率为响应值,利用软件Design-Expert.V8.0.6进行试验设计及结果分析。试验因素及水平如表1所示。
表 1 响应面试验因素及水平设计Table 1. Factors and levels of response surface methodology水平 因素 A(酶解pH) B(酶解时间,h) C(酶解温度,℃) D(酶添加浓度,%) -1 5.4 3.0 30 1.0 0 5.8 4.0 40 1.5 1 6.2 5.0 50 2.0 1.2.1.5 刺梨多糖含量测定和多糖得率的计算
参考唐健波等[15]的方法,采用苯酚-硫酸法进行刺梨多糖含量测定。以蒸馏水为空白对照,以葡萄糖为标准品,吸光度为横坐标,葡萄糖质量为纵坐标,制作标准曲线Y=0.0057X+0.0202,R2=0.9981。根据多糖含量计算刺梨多糖得率。
刺梨多糖得率(%)=m×ωM×100 式中:m为刺梨粗多糖的质量(g);ω为粗多糖中多糖的含量(%);M为预处理样品的质量(g)。
1.2.2 刺梨多糖抗肿瘤试验
1.2.2.1 S180实体瘤模型的建立
参考Zong等[16]的方法并适当进行修改。将保存于液氮罐中的S180瘤株进行复苏,用医用酒精对小鼠腹部进行消毒后,取0.2 mL复苏的肿瘤液接种于小鼠腹腔中,然后让接种后的小鼠在标准动物试验室(温度为23±2 ℃,湿度为55%±5%,白天黑夜各为12 h)中进行自由饮水和进食。接种7 d后,用无菌注射器从小鼠腹腔抽取肿瘤液,按照以上方法进行第二次传代,经台盼蓝染色计数,活细胞数目>95%时,方可进行下步肿瘤接种。采用无菌注射器抽取第二次传代小鼠腹腔中的肿瘤液,用生理盐水稀释3倍制成细胞悬液,将细胞悬液按每只小鼠0.2 mL的剂量皮下接种于小鼠右腋下。整个实验过程中,如果出现空白组小鼠肿瘤平均瘤重<1 g、20%小鼠瘤重<0.49 g或小鼠死亡数>20%中的任意情况,则判定试验失败。
1.2.2.2 动物分组及实验过程
参考并部分修改Cai等[17]的方法。将昆明种小鼠在标准动物试验室进行适应性饲养2 d,挑选生长状态良好的健康小鼠60只,雌雄各半,按照1.2.2.1中的方法进行肿瘤接种,建立S180实体瘤模型。小鼠接种24 h后,将小鼠随机分为5组(n=12):空白对照组(CT),环磷酰胺组(CTX),多糖高剂量组(H-PS)、中剂量组(M-PS)、低剂量组(L-PS),每组小鼠12只,雌雄各半。用生理盐水配制3.5 mg/mL的环磷酰胺溶液(现配现用)作为CTX组药剂,用0.5%的羧甲基纤维素钠溶液配制不同剂量的多糖药剂,以0.5%的羧甲基纤维素钠溶液作为空白组药剂。其中:CT组,灌胃0.5%羧甲基纤维素钠0.1 mL/10 g,1 d 1次;CTX组,根据前期实验基础,选择腹腔注射环磷酰胺溶液0.1 mL/kg(即剂量为35 mg/kg),第1次注射后,间隔3 d注射一次,一共注射3次;H-PS组,灌胃刺梨多糖400 mg/kg,1 d 1次;M-PS组,灌胃刺梨多糖200 mg/kg,1 d 1次;L-PS组,灌胃刺梨多糖100 mg/kg,1 d 1次。连续10 d。
1.2.2.3 抑瘤率的计算
参考贾福怀等[18]的方法,在最后一次灌胃后,小鼠禁食12 h,将小鼠以脊椎脱臼法处死,剥离出小鼠右腋下肿瘤,称重,计算抑瘤率。
抑瘤率(%)=(1−mM)×100 式中:m为给药组平均肿瘤质量(g),M为空白组平均肿瘤质量(g)。
1.2.2.4 外周血白细胞计数
参考姚佳等[19]的方法。在最后一次灌胃后,小鼠禁食12 h后,用毛细管(0.9 mm×100 mm)进行眼眶取血,然后进行外周血白细胞计数。具体方法为:在试管中加入白细胞稀释液(冰醋酸2 mL、蒸馏水98 mL、10 g/mL的亚甲蓝溶液3~5滴)0.38 mL,然后加入小鼠眼眶新鲜血液20 μL,将试管轻微震荡2 min混匀后立即吸取10 μL悬液充入血球计数板计数池内,静置2~3 min后在显微镜低倍镜下对四角的4个大方格内白细胞总数计数,并计算白细胞总数。
白细胞数(个/L)=(大方格内白细胞总数4)×10×20×106 1.2.2.5 胸腺指数和脾脏指数的测定
参考姚佳等[19]的方法。在最后一次灌胃后,小鼠禁食12 h后,小鼠称重后以脊椎脱臼法处死,分别去除小鼠的胸腺和脾脏,擦干周边血迹后进行称重,并按下列公式计算胸腺指数和脾脏指数。
胸腺指数=胸腺质量(mg)小鼠质量(g) 脾脏指数=脾脏质量(mg)小鼠质量(g) 1.3 数据处理
用SPSS 20.0进行单因素方差分析和多重比较(P<0.05为显著差异),数据以平均值±标准偏差表示(
¯x ±s);采用Design-Expert V 8.0.6进行响应面设计及参数优化和统计分析;采用OriginPro 2018对试验数据进行绘图,图或表中的小写字母表示差异显著(P<0.05);所有工艺优化试验均重复3次。2. 结果与分析
2.1 酶法辅助热水浸提刺梨多糖单因素实验结果
2.1.1 酶解pH对刺梨多糖得率的影响
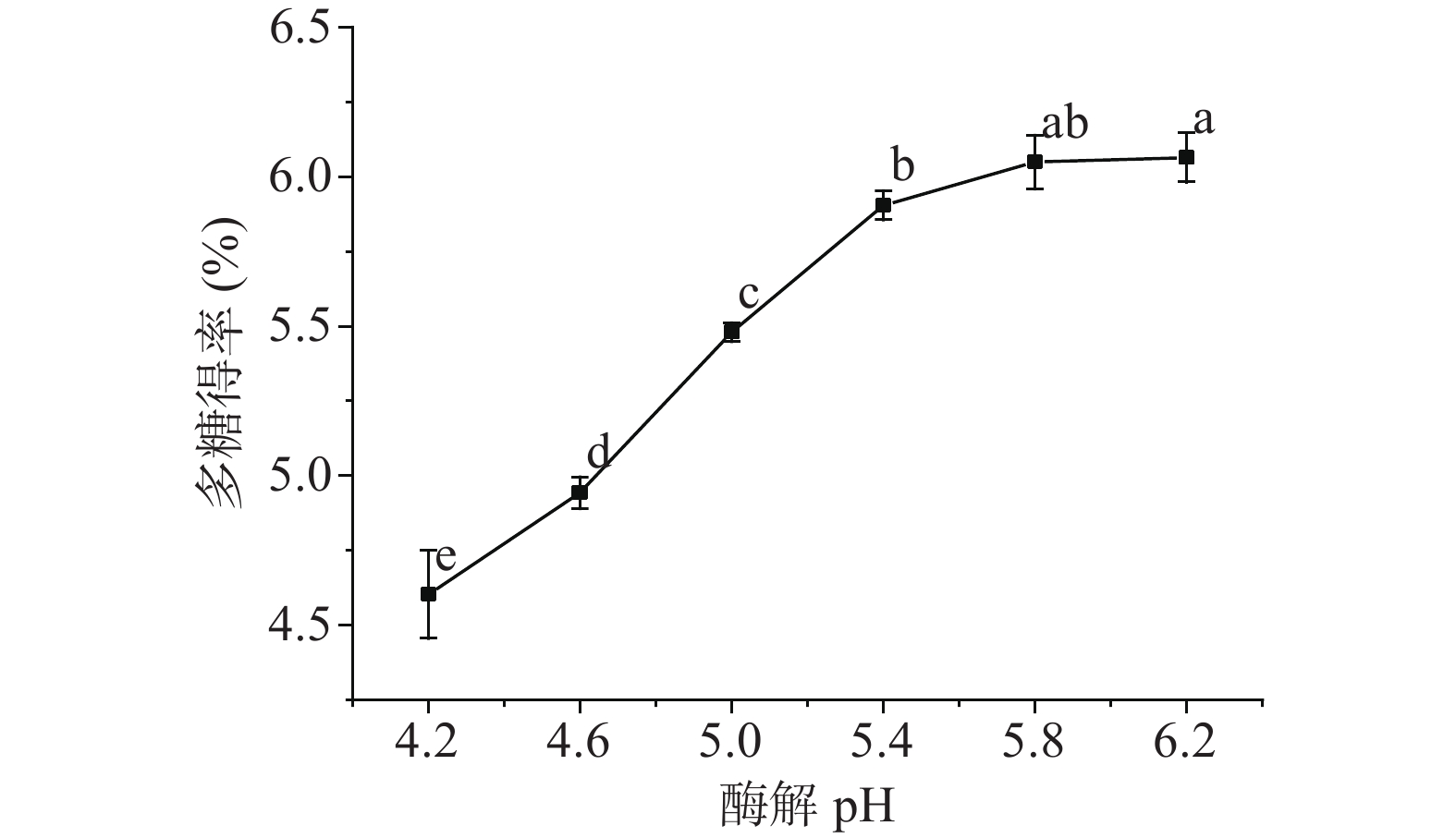
如图1所示,随着酶解pH的升高,刺梨多糖得率呈现明显的上升趋势,当pH达到5.4时,多糖得率上升趋势明显变缓。其中pH在5.4和5.8时,多糖得率不存在显著差异(P>0.05);pH在5.8和6.2之间时,同样不存在显著差异(P>0.05)。这可能是因为以刺梨预处理样品作为反应底物时,纤维素酶在pH5.8附近时呈现出较好的酶解反应活性,促进了刺梨多糖的溶出。同时考虑到,pH是通过酶活性中心上必需基团的解离水平调节影响酶分子对底物的结合及催化,酶反应速度直接受到适宜pH的调控,且酶的空间结构在不同的pH下会发生变化,从而改变酶的构象和活性,影响到刺梨多糖的得率,这与高涛等[20]的研究结果基本一致。因此,综合考虑,选择酶解pH5.4、5.8、6.2这三个水平进行响应面试验。
2.1.2 酶解时间对刺梨多糖得率的影响
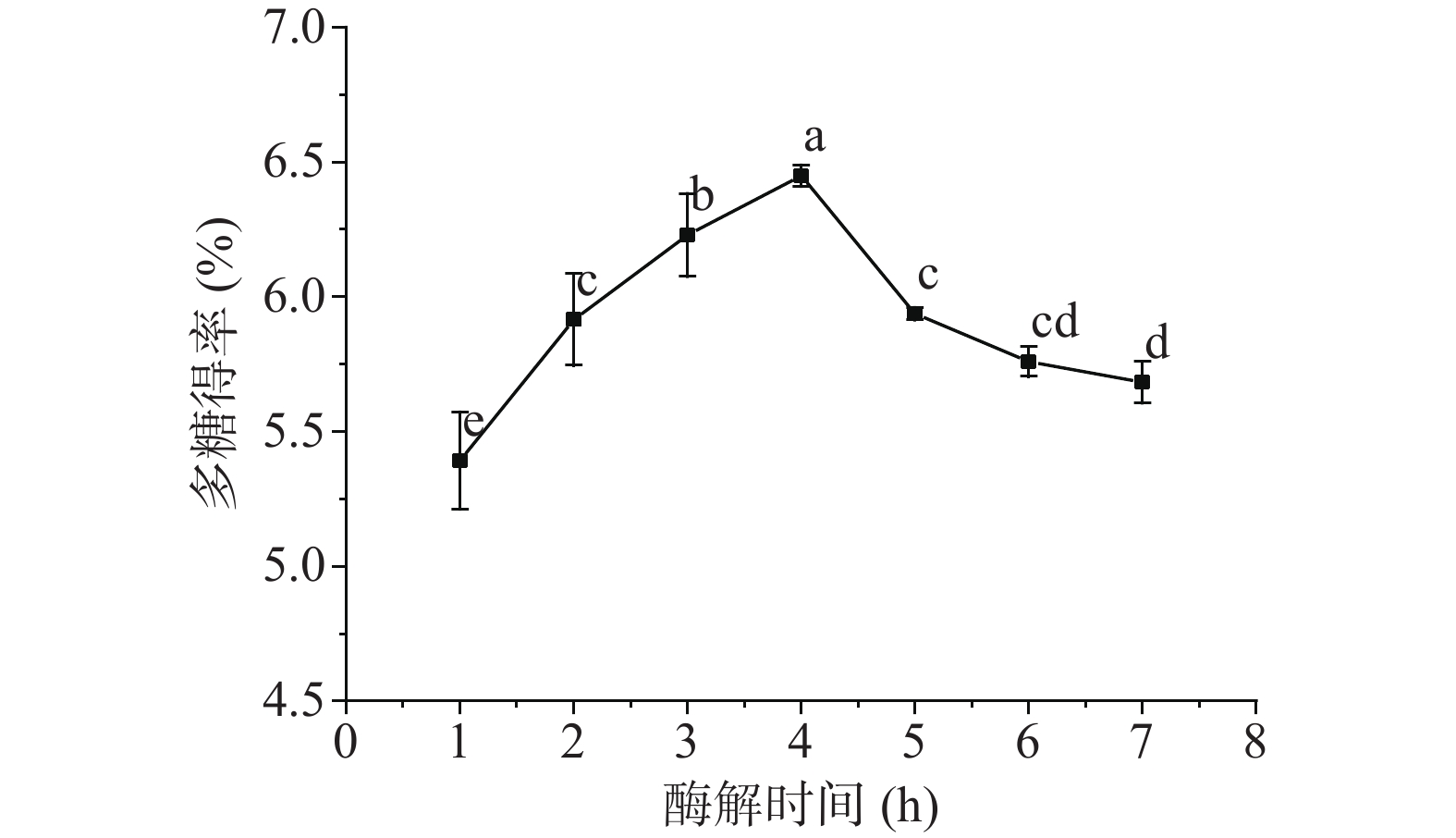
由图2所示,随着酶解时间的增加,刺梨多糖得率呈现先上升后下降的抛物线形式呈现。在1~4 h内,随着酶解时间的延长,刺梨多糖得率显著性升高(P<0.05),在酶解时间达到4 h时,刺梨多糖得率达到最高点。之后,随着酶解时间的继续延长,刺梨多糖得率开始显著性降低(P<0.05),这可能是由于随着酶解时间的延长,刺梨多糖受酶作用的影响发生部分水解从而导致得率降低,这与Guo等[21]的研究结果一致。因此,综合考虑后选择采用酶解时间为3、4、5 h三个水平进行响应面试验。
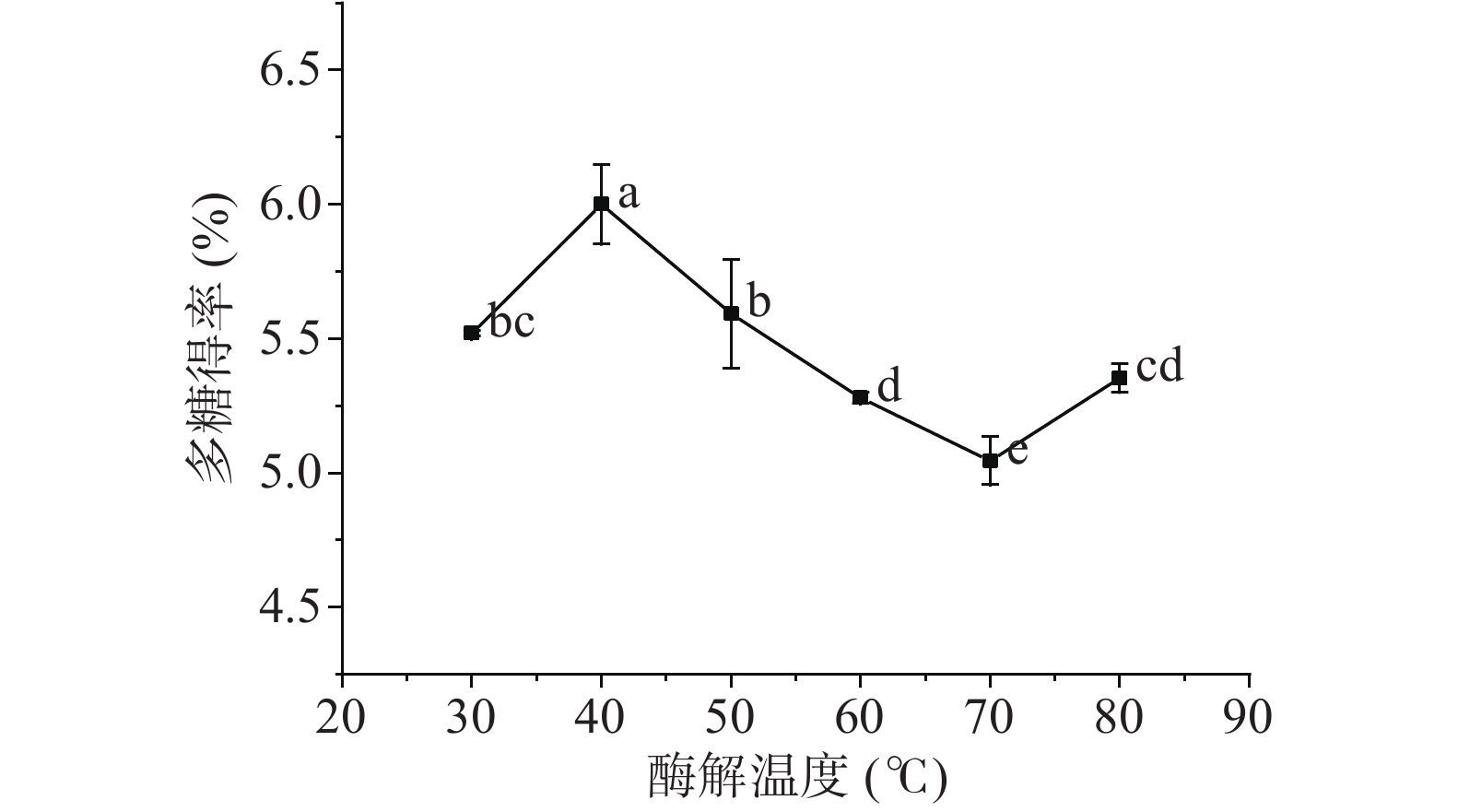
2.1.3 酶解温度对刺梨多糖得率的影响
由图3所示,随着酶解温度的上升,刺梨多糖得率先逐步上升,当温度达到40 ℃时,刺梨多糖得率达到最高点,然后随着温度的继续上升(40~70 ℃),多糖得率呈显著性降低(P<0.05)。这一研究结果与吕长鑫[22]等一致,这说明试验所选用的纤维素酶在40 ℃左右时具有最佳的作用温度,此时酶的活性最大,有利于酶解反应的进行。当温度过高时,纤维素酶中心位点因为受热失去原有的活性而导致催化能力下降;温度过低时,酶活性同样也会因为受到抑制而很难发挥较好的水解作用。其中,当温度由70 ℃上升到80 ℃时,刺梨多糖得率有一个显著性的提高过程,这可能是由于80 ℃是热水浸提工艺中较适宜的一个浸提温度的原因,这也与我们前期的试验结果吻合。因此,在接下来的响应面试验中,选择酶解温度30、40、50 ℃三个水平进行试验。
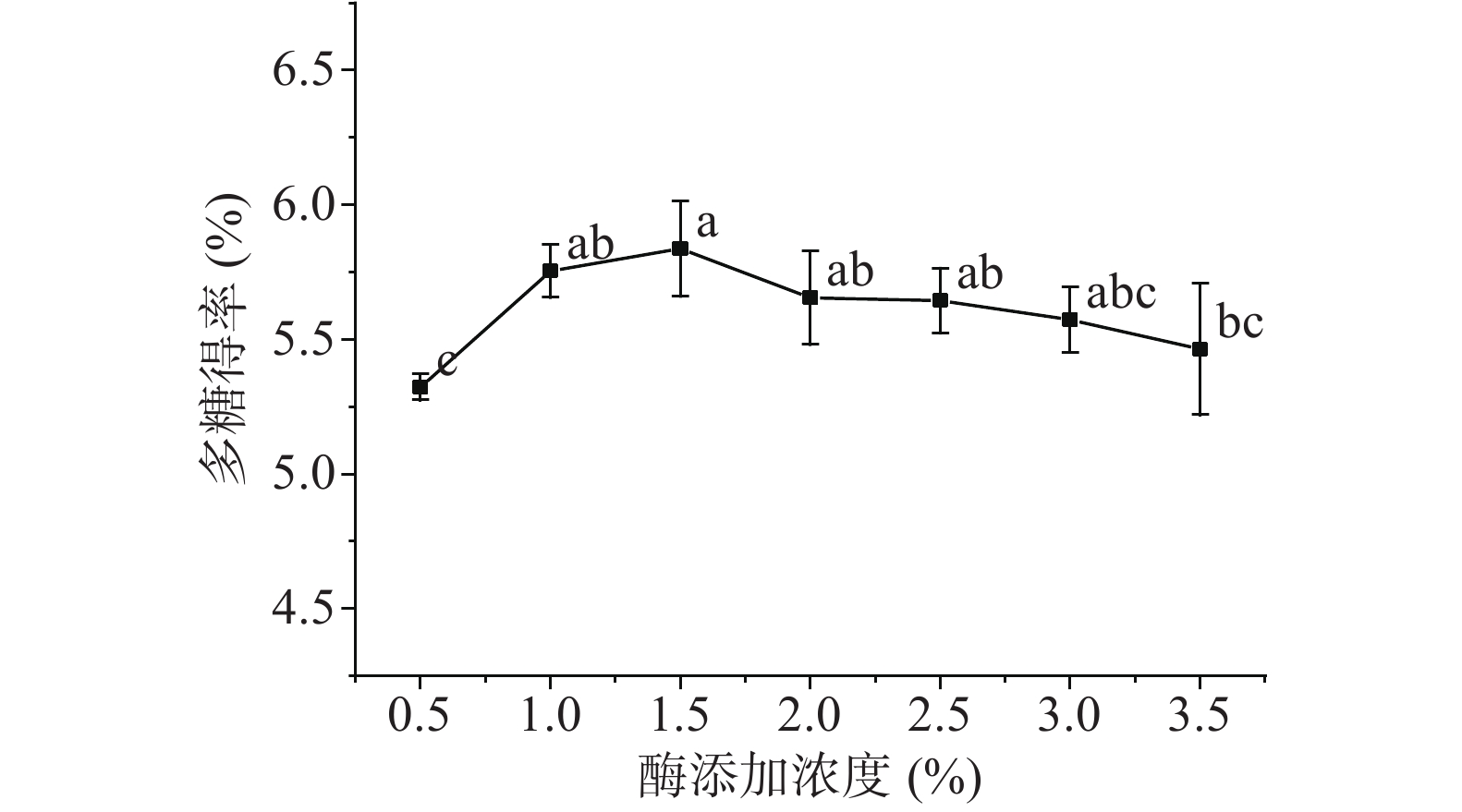
2.1.4 酶添加浓度对刺梨多糖得率的影响
由图4所示。随着酶用量的增加,刺梨多糖得率先显著提高(P<0.05),后略有下降,在酶添加浓度为1.5%时,刺梨多糖得率达到最高5.84%。这可能是因为随着纤维素酶用量的增加,酶接触底物的机会相应地增加,酶对细胞壁的水解作用促进了多糖的溶出,从而提高多糖的产量,这与Hu等[23]的研究一致。当酶用量足够与底物进行反应时,进一步增加酶用量不仅不能提高多糖得率,反而过量的酶会在造成提取成本升高的同时可能造成多糖的部分水解,进而导致刺梨多糖得率降低。因此,在接下来的响应面试验中,选择酶添加浓度1.0%、1.5%、2.0%三个水平进行试验。
2.2 酶法辅助热水浸提刺梨多糖响应面优化试验结果
2.2.1 刺梨多糖得率预测模型及方差分析
根据前面的单因素实验结果,按照表1中的设计因素和水平,利用Design-Expert V8.0.6软件,根据BBD试验设计四因素三水平的响应面试验。BBD试验的变量值与相应的刺梨多糖得率试验结果见表2。经回归拟合,四个提取变量(A、B、C、D)与刺梨多糖得率的关系可表示为如下的二次多项式方程:
表 2 响应面试验设计及结果Table 2. Design and results of Box-Benhnken experiment实验号 A B C D 刺梨多糖得率(%) 1 0 0 0 0 6.15 2 0 0 −1 1 5.52 3 0 −1 −1 0 5.23 4 1 0 0 −1 5.85 5 0 1 1 0 5.11 6 0 −1 0 1 5.54 7 −1 0 −1 0 5.41 8 0 0 0 0 6.09 9 0 0 −1 −1 5.37 10 −1 1 0 0 5.26 11 −1 0 1 0 5.24 12 0 0 0 0 6.11 13 0 1 −1 0 5.45 14 1 0 −1 0 5.91 15 0 0 0 0 5.99 16 0 1 0 −1 5.45 17 1 0 0 1 6.19 18 −1 0 0 −1 5.55 19 1 1 0 0 6.05 20 1 −1 0 0 6.09 21 0 −1 1 0 5.55 22 0 0 1 −1 5.49 23 0 0 1 1 5.45 24 −1 0 0 1 5.50 25 0 −1 0 −1 5.67 26 1 0 1 0 6.06 27 0 1 0 1 5.50 28 −1 −1 0 0 5.47 29 0 0 0 0 6.14 Y=6.10+0.31A−0.061B+8.333E−004C+0.027D+0.043AB+0.080AC+0.098AD−0.16BC+0.045BD−0.047CD−0.055A2−0.33B2−0.40C2−0.24D2
表3为对上述方程进行方差分析的结果。
表 3 响应面模型方差分析Table 3. ANOVA for response surface quadratic model方差来源 平方和 自由度 均方 F值 P值 显著性 模型 3.05 14 0.22 45.32 <0.0001 *** A 1.15 1 1.15 239.79 <0.0001 *** B 0.044 1 0.044 9.23 0.0088 ** C 8.333E-006 1 8.333E-006 1.733E-003 0.9674 D 8.533E-003 1 8.533E-003 1.77 0.2041 AB 7.225E-003 1 7.225E-003 1.50 0.2405 AC 0.026 1 0.026 5.32 0.0368 * AD 0.038 1 0.038 7.91 0.0139 * BC 0.11 1 0.11 22.64 0.0003 ** BD 8.100E-003 1 8.100E-003 1.68 0.2153 CD 9.025E-003 1 9.025E-003 1.88 0.1923 A2 0.020 1 0.020 4.09 0.0626 B2 0.71 1 0.71 148.07 <0.0001 *** C2 1.06 1 1.06 219.96 <0.0001 *** D2 0.38 1 0.38 79.37 <0.0001 *** 残差 0.067 14 4.809E-003 失拟项 0.051 10 5.101E-003 1.25 0.4479 纯误差 0.016 4 4.050E-003 总离差 3.12 28 注:*:表示差异显著(P<0.05);**:表示差异高度显著(P<0.01);***:表示差异极其显著(P<0.001)。 由表3的分析结果可知,模型具有较大的F值(F=45.32),同时具有非常低的P值(P<0.0001),说明该预测模型差异极显著,以上二次多项式方程与实际情况拟合很好,能够较好的反应刺梨多糖得率与所选实验因素之间的相互关系。失拟项的F=1.25,P=0.4479>0.05,差异不显著,说明模型与所选试验因素之间具有很好的拟合度。同时,模型决定系数R2=0.9784,变异系数C.V.=1.22%,精密度=21.988>4,表明此模型能够预测97.84%的刺梨多糖得率的变化,仅存在1.22%的变异,模型精密度高,试验结果可靠性较好,可以用此模型来分析和预测酶法辅助热水浸提刺梨多糖的提取工艺。模型结果显示,试验因素酶解pH对刺梨多糖得率影响极其显著(P<0.001),酶解时间高度显著(P<0.01),影响酶法辅助热水浸提刺梨多糖得率的因素大小顺序为:酶解pH(A)>酶解时间(B)>酶添加浓度(D)>酶解温度(C)。交互项AC、AD对刺梨多糖得率影响均显著(P<0.05),BC高度显著(P<0.01),二次项B2、C2、D2极其显著(P<0.001),表明各影响因素之间存在着明显的共同作用,影响着刺梨多糖的最终得率。
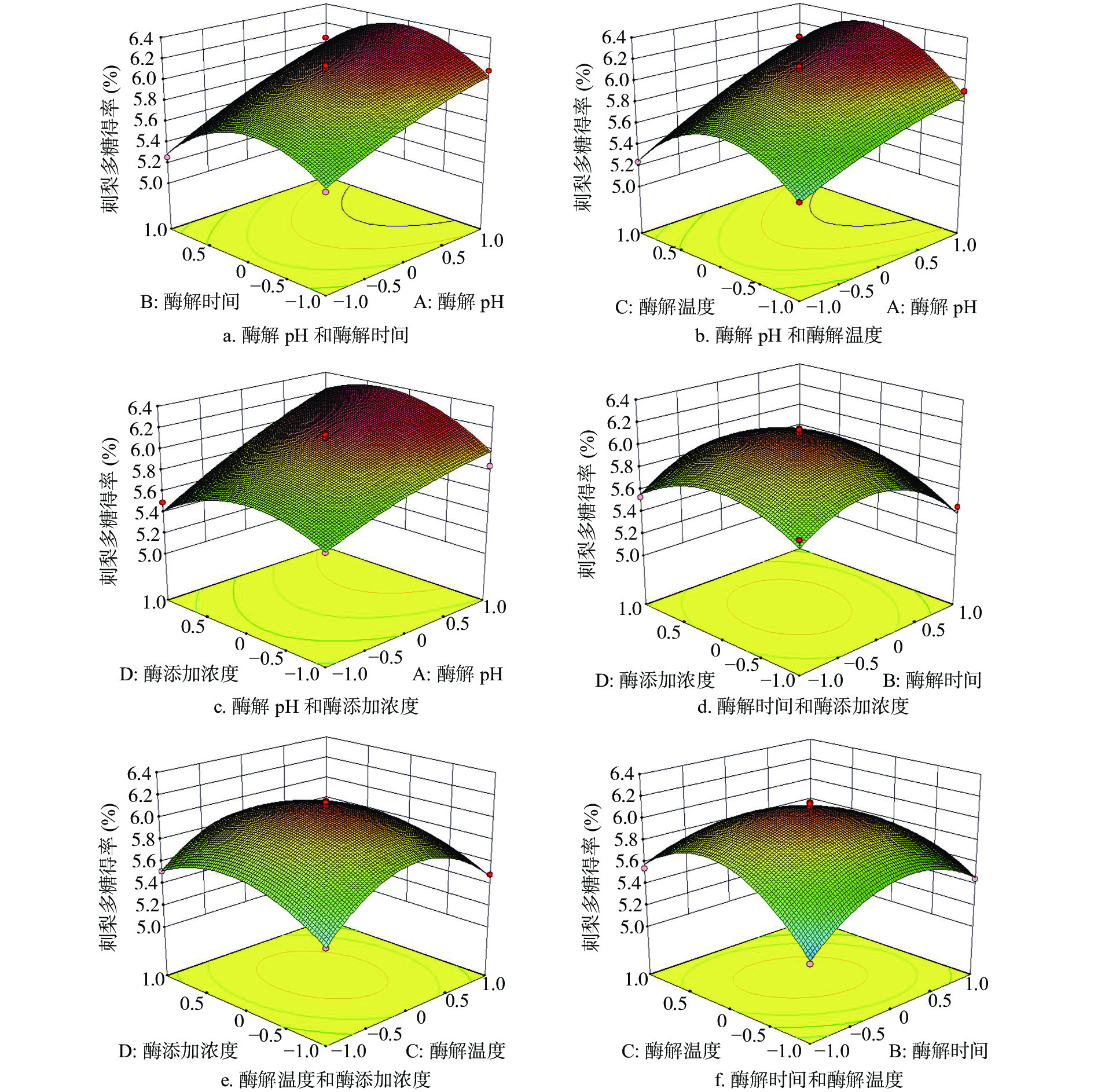
2.2.2 响应面曲面及因素交互作用分析
如图5所示,三维响应面图可以非常直观的反映酶解pH、酶解时间、酶解温度和酶添加浓度等影响因素及其相互作用对于响应值刺梨多糖得率的影响,即当其中两个影响因素在试验范围内逐步变化时,将另外两个因素固定在中心点,刺梨多糖得率将随着这两个影响因素的变化而变化将直观地展示在三维立体图中。从图5中三维立体图可以看出,图5b、图5c、图5f的三维曲面图相对于其他几个图更为陡峭,且图中的等高线形状为椭圆形,表明图形对应的两组影响因子交互作用更为明显,其对刺梨多糖得率的影响更显著,而图5a、图5d、图5f投影的等高线形状为圆形,说明图中对应的两组影响因子交互作用不显著,这一结果与表3中的方差分析结果一致。
2.2.3 回归模型优化
根据回归模型计算,在酶解pH6.2,酶解时间3.97 h,酶解温度40.93 ℃,酶添加浓度1.62%,酶解反应完成后90 ℃热水浸提3 h的工艺条件下,预测刺梨多糖得率为6.37%。为验证预测模型可信度,同时考虑便于实际操作的需要,将提取工艺参数设置为:酶解pH6.2,酶解时间4 h,酶解温度41 ℃,酶添加浓度1.62%。经信度符合性检验,验证试验中刺梨多糖得率为6.32%±0.12%(n=3),与模型预测的刺梨多糖得率契合度为99.22%,这一结果中,刺梨多糖得率几乎达到超声提取[15]的3倍。因此,确定该回归模型可用于预测刺梨多糖的提取,同时该提取方法对刺梨多糖的提取具有提取效率高、环保绿色等优点。
2.3 刺梨多糖抗肿瘤试验结果
由表4的试验结果可知,酶法辅助热水浸提的刺梨多糖在一定剂量下具有较好的抗肿瘤效果,当采用中等剂量治疗时,对肿瘤小鼠的抑瘤效果最好。其中,刺梨多糖试验组与CTX组相比,白细胞、胸腺指数和脾脏指数显著升高(P<0.01),表现出更优的肿瘤小鼠免疫能力提升作用。前人研究表明,CTX是在临床上广泛应用的广谱抗肿瘤药物,可对肿瘤产生细胞毒素作用,对抑制肿瘤生长具有较好的效果[24]。然而,CTX在应用过程中同时也存在着诸多毒副作用,如导致白细胞减少[25],肝功能障碍[26]以及尿血或排尿困难[27]等。从CTX组与CT组的对比数据可知,CTX组的白细胞数量显著减少(P<0.01),胸腺指数(P<0.05)和脾脏指数(P<0.01)也显著下降,这一结果与前人的研究基本一致。从抑制肿瘤的效果来看,M-PS组的抑瘤率达52.13%,达到了CTX组的83.65%,同时M-PS组的白细胞数相对于CT显著升高(P<0.01),而胸腺指数和脾脏指数基本接近,分析原因可能是M-PS组在提升肿瘤小鼠免疫能力的同时,对胸腺和脾脏等免疫器官的毒副作用相对较小,而L-PS组的药力效果相对较小,从而最终造成M-PS组的抑瘤率大于H-PS组和L-PS组。
表 4 刺梨多糖对荷S180小鼠抑瘤作用、外周血白细胞及其脏器的影响Table 4. Effect of PPRT on tumor inhibition, peripheral blood leucocyte and viscera index on S180 tumor-bearing mice分组 剂量(mg/kg) 抑瘤率(%) 白细胞数(×109/L) 胸腺指数 脾脏指数 CT组 0 − 16.89±1.70 2.30±0.35 7.11±0.42 CTX组 35 62.32±1.09a 10.40±1.34** 1.97±0.30* 5.54±0.32** H-PS组 400 27.36±1.38d 19.31±1.64**## 2.72±0.33**## 7.79±0.36**## M-PS组 200 52.13±1.84b 20.23±1.13**## 2.41±0.24## 7.46±0.49## L-PS组 100 44.20±2.03c 24.53±1.74**## 2.29±0.32 7.67±0.69*## 注:*:表示与CT组比较,P<0.05;**:表示与CT组比较,P<0.01;#:表示与CTX组比较,P<0.05;##:表示与CTX组比较,P<0.01。 3. 结论
本文采用响应面法对酶法辅助热水浸提刺梨多糖提取工艺进行研究,得到最优工艺参数:酶解pH6.2,酶解时间4 h,酶解温度41 ℃,酶添加浓度1.62%,液料比30:1 mL/g,酶解反应完成后90 ℃热水浸提3 h。此工艺条件下,预测刺梨多糖得率为6.37%。经实验验证刺梨多糖得率为6.32%±0.12%,与模型预测得率契合度为99.22%,结果表明回归模型准确可靠。抗肿瘤活性研究表明,在灌胃剂量为200 mg/kg时,酶法辅助热水浸提刺梨多糖对S180肿瘤小鼠的抑瘤率为52.13%±1.84%,具有明显的抗肿瘤活性和一定提升肿瘤小鼠免疫能力的作用,具有作为功能性食品添加或天然抗肿瘤药物来源的潜力。同时,该工艺尚存在着后期处理过程中浸提时间过长的问题,以微波或超声辅助提取来改进提取工艺将是未来的研究方向,但也应关注工艺的变化对多糖活性造成的影响。
-
表 1 响应面试验因素及水平设计
Table 1 Factors and levels of response surface methodology
水平 因素 A(酶解pH) B(酶解时间,h) C(酶解温度,℃) D(酶添加浓度,%) -1 5.4 3.0 30 1.0 0 5.8 4.0 40 1.5 1 6.2 5.0 50 2.0 表 2 响应面试验设计及结果
Table 2 Design and results of Box-Benhnken experiment
实验号 A B C D 刺梨多糖得率(%) 1 0 0 0 0 6.15 2 0 0 −1 1 5.52 3 0 −1 −1 0 5.23 4 1 0 0 −1 5.85 5 0 1 1 0 5.11 6 0 −1 0 1 5.54 7 −1 0 −1 0 5.41 8 0 0 0 0 6.09 9 0 0 −1 −1 5.37 10 −1 1 0 0 5.26 11 −1 0 1 0 5.24 12 0 0 0 0 6.11 13 0 1 −1 0 5.45 14 1 0 −1 0 5.91 15 0 0 0 0 5.99 16 0 1 0 −1 5.45 17 1 0 0 1 6.19 18 −1 0 0 −1 5.55 19 1 1 0 0 6.05 20 1 −1 0 0 6.09 21 0 −1 1 0 5.55 22 0 0 1 −1 5.49 23 0 0 1 1 5.45 24 −1 0 0 1 5.50 25 0 −1 0 −1 5.67 26 1 0 1 0 6.06 27 0 1 0 1 5.50 28 −1 −1 0 0 5.47 29 0 0 0 0 6.14 表 3 响应面模型方差分析
Table 3 ANOVA for response surface quadratic model
方差来源 平方和 自由度 均方 F值 P值 显著性 模型 3.05 14 0.22 45.32 <0.0001 *** A 1.15 1 1.15 239.79 <0.0001 *** B 0.044 1 0.044 9.23 0.0088 ** C 8.333E-006 1 8.333E-006 1.733E-003 0.9674 D 8.533E-003 1 8.533E-003 1.77 0.2041 AB 7.225E-003 1 7.225E-003 1.50 0.2405 AC 0.026 1 0.026 5.32 0.0368 * AD 0.038 1 0.038 7.91 0.0139 * BC 0.11 1 0.11 22.64 0.0003 ** BD 8.100E-003 1 8.100E-003 1.68 0.2153 CD 9.025E-003 1 9.025E-003 1.88 0.1923 A2 0.020 1 0.020 4.09 0.0626 B2 0.71 1 0.71 148.07 <0.0001 *** C2 1.06 1 1.06 219.96 <0.0001 *** D2 0.38 1 0.38 79.37 <0.0001 *** 残差 0.067 14 4.809E-003 失拟项 0.051 10 5.101E-003 1.25 0.4479 纯误差 0.016 4 4.050E-003 总离差 3.12 28 注:*:表示差异显著(P<0.05);**:表示差异高度显著(P<0.01);***:表示差异极其显著(P<0.001)。 表 4 刺梨多糖对荷S180小鼠抑瘤作用、外周血白细胞及其脏器的影响
Table 4 Effect of PPRT on tumor inhibition, peripheral blood leucocyte and viscera index on S180 tumor-bearing mice
分组 剂量(mg/kg) 抑瘤率(%) 白细胞数(×109/L) 胸腺指数 脾脏指数 CT组 0 − 16.89±1.70 2.30±0.35 7.11±0.42 CTX组 35 62.32±1.09a 10.40±1.34** 1.97±0.30* 5.54±0.32** H-PS组 400 27.36±1.38d 19.31±1.64**## 2.72±0.33**## 7.79±0.36**## M-PS组 200 52.13±1.84b 20.23±1.13**## 2.41±0.24## 7.46±0.49## L-PS组 100 44.20±2.03c 24.53±1.74**## 2.29±0.32 7.67±0.69*## 注:*:表示与CT组比较,P<0.05;**:表示与CT组比较,P<0.01;#:表示与CTX组比较,P<0.05;##:表示与CTX组比较,P<0.01。 -
[1] Xu J W, Vidyarthi S K, Bai W B, et al. Nutritional constituents, health benefits and processing of Rosa roxburghii: A review[J]. Journal of Functional Foods,2019,60:103456. doi: 10.1016/j.jff.2019.103456
[2] Chen G J, Kan J Q. Characterization of a novel polysaccharide isolated from Rosa roxburghii Tratt fruit and assessment of its antioxidant in vitro and in vivo[J]. International Journal of Biological Macromolecules,2018,107:166−174. doi: 10.1016/j.ijbiomac.2017.08.160
[3] 周宏炫, 黄颖, 谭书明, 等. 刺梨多酚对急性酒精中毒大鼠的解酒护肝作用[J/OL]. 食品科学, 2020, doi: 10.7506/spkx1002-6630-20200 828-384. Zhou H X, Huang Y, Tan S M, et al. Anti-alcoholic and hepatoprotective effects of polyphenols from Rosa roxburghii Tratt in acute alcoholism rats[J/OL]. Food Science, 2020, doi: 10.7506/spkx1002-6630-20200 828-384.
[4] 夏仕青, 张爱华. 刺梨的营养保健功能及其开发利用研究进展[J]. 贵州医科大学学报,2018,43(10):1129−1132, 1153. [Xia S Q, Zhang A H. Research progress on nutrition and health function and exploitation of Rosa roxburghii Tratt[J]. Journal of Guizhou Medical University,2018,43(10):1129−1132, 1153. [5] 杨宗玲, 李晗, 范方宇, 等. 超声辅助酶法提取无籽刺梨果渣中黄酮的工艺优化及其抗氧化活性[J/OL]. 食品工业科技, 2021, doi: 10.13386/j.issn1002-0306.2020090273. Yang Z L, Li H, Fan F Y, et al. Ultrasound-assisted enzymatic extraction of flavonoids from Rosa sterilis’pomace and its antioxidant[J/OL]. Science and Technology of Food Industry, 2021, doi: 10.13386/j.issn1002-0306.2020090273.
[6] 李跃红, 冉茂乾, 徐孟怀, 等. 不同产地刺梨果实品质分析与模糊综合评判[J]. 安徽农业科学,2020,48(17):202−205. [Li Y H, Ran M Q, Xu M H, et al. Analysis of fruit quality and fuzzy comprehensive evaluation ofRosa roxburghii Tratt from different habitats[J]. Journal of Anhui Agricultural Sciences,2020,48(17):202−205. doi: 10.3969/j.issn.0517-6611.2020.17.052 [7] He J Y, Zhang Y H, Ma N, et al. Comparative analysis of multiple ingredients in Rosa roxburghii and R. sterilis fruits and their antioxidant activities[J]. Journal of Functional Foods,2016,27:29−41. doi: 10.1016/j.jff.2016.08.058
[8] Chen Y, Liu Z J, Liu J, et al. Inhibition of metastasis and invasion of ovarian cancer cells by crude polysaccharides fromRosa roxburghii t
ratt in vitro[J]. Asian Pacific Journal of Cancer Prevention,2014,15(23):10351−10354. [9] Xu S J, Zhang F, Wang L J, et al. Flavonoids of Rosa roxburghii Tratt offers protection against radiation induced apoptosis and inflammation in mouse thymus[J]. Apoptosisi,2018,23:470−483. doi: 10.1007/s10495-018-1466-7
[10] Xu P, Cai X H, Zhang W B, et al. Flavonoids ofRosa roxburghii Tratt exhibit radioprotection and anti-apoptosis properties via the Bcl-2(Ca2+)/Caspase-3/PARP-1 pathway[J]. Apoptpsis,2016,21:1125−1143. doi: 10.1007/s10495-016-1270-1
[11] 简崇东, 唐雄林, 黄晓华, 等. 脑梗死患者口服刺梨汁抗动脉粥样硬化临床研究[J]. 亚太传统医药,2017,13(3):136−137. [Jian C D, Tang X L, Huang X H, et al. Clinical research of anti-atherosclerosis by oral Rosa roxburghii Tratt juice in patients with acute cerebral infarction[J]. Asia-Pacific Traditional Medicine,2017,13(3):136−137. [12] 涂永丽, 谭书明, 周宏炫, 等. 刺梨口服液对消化不良小鼠胃肠动力的促进作用[J]. 现代食品科技,2021,37(1):17−23. [Tu Y L, Tan S M, Zhou H X, et al. Effect of Rosa roxburghii Tratt oral liquid on gastrointestinal motility in dyspepsia mice[J]. Modern Food Science and Technology,2021,37(1):17−23. [13] 邹胜, 徐溢, 张庆. 天然植物多糖分离纯化技术研究现状和进展[J]. 天然产物研究与开发,2015,27(8):1501−1509. [Zou S, Xu Y, Zhang Q. Review on extraction and purification technology of polysaccharides from natural plants[J]. Natural Product Research and Development,2015,27(8):1501−1509. [14] 李秀秀, 尚静, 杨曦, 等. 多糖的增稠、胶凝及乳化特性研究进展[J/OL]. 食品科学, 2021, doi: 10.7506/spkx1002-6630-20200617-239. Li X X, Shang J, Yang X, et al. Rheology of food polysaccharides-thickening, gelling and emulsifying properties[J/OL]. Food Science, 2021, doi: 10.7506/spkx1002-6630-20200617-239.
[15] 唐健波, 肖雄, 杨娟, 等. 响应面优化超声辅助提取刺梨多糖工艺研究[J]. 天然产物研究与开发,2015,27(2):314−320. [Tang J B, Xiao X, Yang J, et al. Optimization of ultrasonic-assisted extraction of polysaccharides from Rosa roxburghii Tratt using response surface methodology[J]. Natural Product Research and Development,2015,27(2):314−320. [16] Zong S, Li J L, Ye Z Y, et al. Lachnum polysaccharide suppresses S180 sarcoma by boosting anti-tumor immune responses and skewing tumor-associated macrophages toward M1 phenotype[J]. International Journal of Biological Macromolecules,2020,144:1022−1033. doi: 10.1016/j.ijbiomac.2019.09.179
[17] Cai B C, Pan J Y, Chen H, et al. Oyster polysaccharides ameliorate intestinal mucositis and improve metabolism in 5-fluorouracil- treated S180 tumour-bearing mice[J]. Carbohydrate Polymers,2021,256:117545. doi: 10.1016/j.carbpol.2020.117545
[18] 贾福怀, 涂宏建, 王俊, 等. 超声-闪式协同提取白及须根多糖工艺优化及其抗肿瘤活性[J]. 食品工业科技,2019,40(20):188−195, 208. [Jia F H, Tu H J, Wang J, et al. Optimization of ultrasonic-flash synergistic extraction and antitumor activity of polysaccharide from fibrous root of Bletilla striata[J]. Science and Technology of Food Industry,2019,40(20):188−195, 208. [19] 姚佳, 彭梅, 肖雄, 等. 仙茅多糖对小鼠S180实体瘤的顺铂增敏作用及其机制[J]. 华西药学杂志,2014,29(2):132−134. [Yao J, Peng M, Xiao X, et al. Efficacy enhancing effect and mechanisms of Curculigo orchioides polysaccharide on S180 tumor-bearing mice treated by Cisplatin[J]. West China Journal of Pharmaceutical Sciences,2014,29(2):132−134. [20] 高涛, 罗振宇, 罗黄洋, 等. 川明参多糖的超声辅助酶法提取及其体外抗氧化活性[J]. 食品研究与开发,2020,41(23):86−92. [Gao T, Luo Z Y, Luo H Y, et al. Ultrasound-assisted enzymatic extraction of polysaccharides from chuanminshen violaceum and its antioxidant acticity in virto[J]. Food Research and Development,2020,41(23):86−92. [21] Guo Y, Shang H M, Zhao J C, et al. Enzyme-assisted extraction of a cup plant (Silphium perfoliatum L.) polysaccharide and its antioxidant and hypoglycemic activities[J]. Process Biochemistry,2020,92:17−28. doi: 10.1016/j.procbio.2020.03.005
[22] 吕长鑫, 李萌萌, 徐晓明, 等. 响应面分析法优化纤维素酶提取紫苏多糖工艺[J]. 食品科学,2013,34(2):6−10. [Lü C X, Li M M, Xu X M, et al. Optimization of enzymatic extraction conditions for crude polysaccharides from perilla leaves by response surface methodology[J]. Food Science,2013,34(2):6−10. [23] Hu H G, Zhao Q L, Xie H J, et al. Polysaccharides from pineapple pomace: new insight into ultrasonic-cellulase synergistic extraction and hypoglycemic activities[J]. International Journal of Biological Macromolecules,2019,121:1213−1226. doi: 10.1016/j.ijbiomac.2018.10.054
[24] Madondo M T, Quinn M, Plebanski M. Low dose cyclophosphamide: Mechanisms of T cell modulation[J]. Cancer Treatment Reviews,2016,42:3−9. doi: 10.1016/j.ctrv.2015.11.005
[25] Strati P, Wierda W, Burger J, et al. Myelosuppression after frontline fludarabine, cyclophosphamide, and rituximab in patients with chronic lymphocytic leukemia: analysis of persistent and new-onset cytopenia[J]. Cancer,2013,119(21):3805−3811. doi: 10.1002/cncr.28318
[26] Molodykh O P, Sorokina I V, Vinogradova E V, et al. Ultrastructure of the liver in response to cyclophosphamide and triterpenoids[J]. Bulletin of Experimental Biology and Medicine,2020,160:400−405.
[27] Nevine R T, Amin H A, Sultan A A. The protective effect of Moringa oleifera leaves against cyclophosphamide-induced urinary bladder toxicity in rats[J]. Tissue and Cell,2015,47(1):94−104. doi: 10.1016/j.tice.2014.12.002





 下载:
下载:
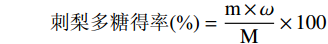
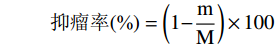
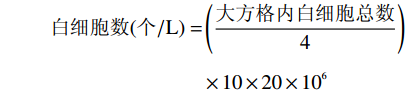
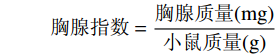
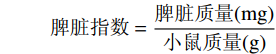
 下载:
下载:
