Protective Effects of Fermented Wheat Bran Polysaccharides against Oxidative Stress Induced by Diquat of Spleen in Weaned Rats
-
摘要: 本试验旨在研究发酵麦麸多糖(fermented wheat bran polysaccharides,FWBPs)的体外抗氧化能力,并探究其对敌草快诱导的大鼠脾脏氧化应激是否有缓解作用。体外试验测定还原力、DPPH自由基及羟基自由基清除率。体内试验选取断奶雄性大鼠48只,按照随机分组原则,分为正常对照组(生理盐水)、氧化应激模型组(生理盐水)、FWBPs低剂量组(100 mg/kg BW)、FWBPs中剂量组(200 mg/kg BW)、FWBPs高剂量组(400 mg/kg BW)和阳性对照组(100 mg/kg BW VC),每组8只,持续灌胃14 d。最后一次灌胃2 h后,除正常对照组外,其它五组腹腔注射敌草快(0.1 mmol/kg BW)建立氧化应激模型。24 h后屠宰,采集脾脏组织,测定脾脏组织抗氧化相关指标,利用RT-PCR技术分析抗氧化相关基因的mRNA表达量。结果表明:4 mg/mL FWBPs对DPPH自由基及羟基自由基的饱和清除率分别为92.35%和33.30%;敌草快攻毒会显著降低大鼠脾脏谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-Px)活力(P<0.05),显著增加总抗氧化能力(Total antioxitant capacity,T-AOC)、谷氨酸-半胱氨酸连接酶调节亚基(Glutamate cysteine ligase modifiersubunit,GCLM)的mRNA表达水平及8-羟基脱氧鸟苷(8-hydroxy deoxyguanosine,8-OHdG)的含量(P<0.05)。与氧化应激模型组相比,低、中剂量组大鼠脾脏中GSH-Px活性显著增加(P<0.05);低剂量组大鼠脾脏中谷胱甘肽(Glutathione,GSH)含量显著增加(P<0.05);中剂量组大鼠脾脏中醌氧化还原酶1(NAD(P)-Hquinoneoxidoreductase 1,NQO1)和核因子E2相关因子2(Nuclear factor E2-related factor 2,Nrf2)的mRNA表达量显著增加(P<0.05);而中、高剂量组和阳性对照组中8-OHdG含量显著降低(P<0.05)。FWBPs有较强的抗氧化能力,并可缓解大鼠脾脏组织氧化应激。Abstract: This study was conducted to measure antioxidant capacity of fermented wheat bran polysaccharides(FWBPs) in vitro and its antioxidative potential against diquat-induced oxidative stress of spleen of rats. The reducing power, DPPH radical and hydroxyl radical scavenging rate of FWBPs were determined. Forty-eight healthy weaned Wistar rats were randomly assigned to six groups with 8 rats in each group. The rats in low dose group, middle dose group and high dose group were orally treated with FWBPs at 100, 200 and 400 mg/kg BW, respectively, in positive control group were orally treated with vitamin C at 100 mg/kg BW, in normal group and toxic group were orally treated with equal volume saline for 14 days. After the last gavage for 2 hours, except the normal control group, the other five groups were intraperitoneally injected with diquat(0.1 mmol/kg BW) to establish the oxidative stress model. After challenged 24 h, the spleen tissues were collected to measure antioxidant indices by ELISA kits. The mRNA expression of antioxidant related genes was determined using RT-PCR. The results showed that the saturation scavenging rates of FWBPs to DPPH radical and hydroxylradical reached 92.35% and 33.30%, respectively. Diquat treatment significantly decreased the activities of glutathione peroxidase(GSH-Px)(P<0.05), while increased total antioxidative capacity(T-AOC), 8-hydroxy deoxyguanosine (8-OHdG) contents, and the mRNA expression of glutamate cysteine ligase modifiersubunit(GCLM) in the spleen tissues of rats(P<0.05). Under the oxidative stress, the activities of GSH-Px increased in the low and middle dose group(P<0.05); the glutathione(GSH) contents increased in the low dose group(P<0.05); the mRNA expression of NAD(P)-Hquinoneoxidoreductase 1(NQO1) and nuclear factor E2-related factor 2(Nrf2) increased in the middle dose group(P<0.05); while 8-OHdG contents decreased in the middle, high dose group and positive group(P<0.05). In summary, FWBPs exerted strong antioxidant effect against oxidative stress induced by diquat of spleen in rats.
-
氧化应激是指机体在受到刺激时,活性氧和活性氮产生量大于清除量,氧化系统和抗氧化系统失衡,导致其在体内大量积累引发氧化损伤的过程[1]。如果这种氧化损伤不能及时修复就会诱导其他疾病的发生。研究发现,氧化应激易引发自身免疫疾病,如系统性红斑狼疮、类风湿关节炎和Ⅰ型糖尿病等[2]。脾脏作为外周免疫器官,含有大量的淋巴细胞和其他免疫细胞,具有储血、滤血、内分泌调节以及免疫应答等功能。免疫细胞因细胞膜中含有不饱和脂肪酸,所以对氧化应激十分敏感,在受到自由基攻击后,会影响免疫功能[3]。因此,通过使用抗氧化剂缓解脾脏氧化应激,改善机体健康状况意义重大。
多糖是一类从天然植物中提取的生物活性物质,具有抗氧化、调节免疫、抑菌及抗肿瘤等作用[4]。小麦麸皮中约含有46%左右的非淀粉多糖(果胶多糖、纤维素多糖及非纤维素多糖),且含有一定量的酚酸类物质[5]。多项研究表明,小麦麸皮经过微生物发酵处理会增加生物活性物质的含量,进而提高其抗氧化能力[6-7]。Zhang等[8]研究发现麦麸阿魏酰低聚糖可以缓解由AAPH诱导的氧化应激,提高氧化应激大鼠心脏、肝脏和肾脏组织中过氧化氢酶(Catalase,CAT)、谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-Px)、超氧化物岐化酶(Superoxide dismutase,SOD)活性以及谷胱甘肽(Glutathione,GSH)含量。然而,关于发酵麦麸多糖(Fermentedwheat bran polysaccharides,FWBPs)在缓解脾脏氧化应激方面的报道还不多见。因此,本试验通过体外抗氧化指标评价FWBPs的抗氧化活性,并进一步以腹腔注射敌草快(Diquat)建立大鼠氧化应激模型,研究FWBPs对氧化应激大鼠脾脏的保护作用,以期为FWBPs应用于抗氧化方面保健产品的开发利用提供理论支撑。
1. 材料与方法
1.1 材料与仪器
SPF级雄性SD大鼠 48只,20~22日龄,体重40~50 g,由内蒙古医科大学试验动物中心提供,合格证号SCXK(蒙)2015-0001,大鼠每天给予充足的水和饲料,3 d后开始试验;麦麸、豆粕粉、玉米粉 市场;DPPH(二苯基-2-三硝基苯肼)、丁基羟基茴香醚(BHA)、维生素C(VC) 美国Sigma公司;酿酒酵母(Saccharomyces cerevisiae)CGMCC 2.119、枯草芽孢杆菌(Bacillus subtilis)CGMCC 1.0892 内蒙古自治区草食家畜饲料工程技术研究中心保存;无水乙醇、六氰合铁酸钾、三氯乙酸、三氯化铁、硫酸亚铁、双氧水、水杨酸 国药集团化学试剂有限公司;氯仿(分析纯)、异丙醇 上海阿拉丁生化科技股份有限公司;总抗氧化能力(Total antioxitant capacity,T-AOC)、SOD、CAT测试盒 南京建成生物工程研究所;GSH-Px、GSH和8-羟基脱氧鸟苷(8-hydroxy deoxyguanosine,8-OHdG)试剂盒 武汉基因美生物科技有限公司;BCA蛋白浓度测定试剂盒 北京索莱宝科技有限公司;Invitrogen TRIzol试剂 美国赛默飞世尔科技公司;FastQant RT Kit(with gDNase)、SuperReal PreMix Plus(SYBR Green)试剂盒 北京天根生化试剂有限公司;大鼠基础饲粮 江苏协同医药生物工程有限公司。
HVA-85型压力灭菌器 日本Hirayama公司;SW-CJ 超净工作台 上海新苗医疗器械;QYC-200恒温培养摇床 上海福玛实验设备有限公司;LRH-250F生化培养箱 上海一恒科学仪器有限公司;TDL-5-A型台式高速离心机 上海安亭科学仪器厂;Epoch2 型微孔板分光光度计 美国Bio-Rad公司。
1.2 实验方法
1.2.1 FWBPs的制备
试验所用FWBPs制备方法参照李暄[9]。先将麦麸、豆粕和玉米粉碎,过40目筛,以麦麸、豆粕粉和玉米粉(质量比=80.46:9.32:10.22)为基质,按照10%接种量接入以混合种子液,混合种子液由比例为酿酒酵母和枯草芽孢杆菌6.7:3.3组成,料水比1:1,35.4 °C发酵48 h。发酵结束后,将发酵基质于45 °C烘干48 h,粉碎后与蒸馏水1∶20混合,80 °C水浴浸提30 min,上清液加入4倍体积的95%乙醇溶液,静置过夜,离心收集沉淀,经过酶处理与Sevag法相结合法去除蛋白质后,获得FWBPs,多糖含量为633.58 mg/g,该多糖由甘露糖、鼠李糖、葡萄糖、半乳糖、木糖、阿拉伯糖组成,摩尔比为5:4:46:9:67:46。
1.2.2 FWBPs体外抗氧化活性评价
1.2.2.1 还原力的测定
还原力的测定方法参照Jia等[10], 分别取不同浓度(0、0.5、1、2、4 mg/mL)的FWBPs溶液0.75 mL,依次各加入0.75 mL的磷酸盐缓冲液(0.2 mol/L,pH6.6)及0.75 mL的六氰合铁酸钾溶液(1%),混匀,50 ℃水浴20 min,冷却,再加入0.75 mL的10%三氯乙酸终止反应,3000 r/min离心10 min,取1.5 mL上清液,加入1.5 mL蒸馏水和400 μL 0.1% 三氯化铁,室温反应10 min,700 nm处测定吸光度值A1,空白对照以蒸馏水代替FWBPs溶液测得吸光度值A0,还原力=A1−A0。以BHA作为阳性对照,测定方法同上。
1.2.2.2 DPPH自由基清除率的测定
DPPH自由基清除率的测定参照Zhang等[11]方法,取2 mL不同浓度(0、0.5、1、2、4 mg/mL)的FWBPs溶液和2 mL DPPH溶液(0.2 mmol/L,95%乙醇溶液)混匀,室温黑暗条件下反应30 min,517 nm测定吸光度值A。以BHA作为阳性对照,测定方法同上。计算公式:
DPPH自由基的清除率(%)=[1−(A0−A1)/A2]×100 (1) 式中:A0:样品吸光度;A1:乙醇代替DPPH溶液吸光度;A2:蒸馏水代替样品吸光度。
1.2.2.3 羟基自由基清除率的测定
羟基自由基清除率的测定参照Zhang等[11]的方法,取0.5 mL浓度为(0、0.5、1、2、4 mg/mL)的FWBPs与0.5 mL硫酸亚铁溶液(9.0 mmol/L)和0.5 mL双氧水溶液(8.8 mmol/L)混合,室温反应10 min,再加入0.5 mL水杨酸-乙醇溶液(9 mmol/L),室温反应30 min,510 nm测定得吸光度A。以BHA作为阳性对照,测定方法同上。计算公式:
羟基自由基的清除率(%)=[1−(A0−A1)/A2]×100 (2) 式中:A0:样品吸光度;A1:蒸馏水代替硫酸亚铁溶液吸光度;A2:蒸馏水代替样品吸光度。
1.2.3 FWBPs对氧化应激大鼠脾脏保护作用评价
1.2.3.1 动物分组及造模给药处理
将48只健康断奶雄性Wistar大鼠随机分为6个组,每组8只,动物分组及造模给药处理如表1。FWBPs(低、中、高)组和阳性对照组大鼠持续灌胃14 d,每日1次,正常对照组和氧化应激模型组大鼠灌胃给予等量的生理盐水。最后一次灌胃2 h后,除正常对照组外,其它五组腹腔注射敌草快(0.1 mmol/kg BW)建立氧化应激模型。24 h后,乙醚致晕,剖开腹腔,收集脾脏组织,液氮速冻,存于−80 ℃冰箱中待测。试验在内蒙古农业大学动物科学学院进行,常规饲养管理,自由采食、饮水。
表 1 试验动物分组设计Table 1. Experimental design and animal grouping分组 腹腔注射试剂及剂量 灌胃试剂及剂量 正常对照组 生理盐水 生理盐水 氧化应激模型组 敌草快(0.1 mmol/kg BW) 生理盐水 FWBPs低剂量组 敌草快(0.1 mmol/kg BW) FWBPs(100 mg/kg BW) FWBPs中剂量组 敌草快(0.1 mmol/kg BW) FWBPs(200 mg/kg BW) FWBPs高剂量组 敌草快(0.1 mmol/kg BW) FWBPs(400 mg/kg BW) 阳性对照组 敌草快(0.1 mmol/kg BW) VC(100 mg/kg BW) 1.2.3.2 抗氧化相关指标的测定
取适量脾脏组织,加磷酸缓冲液(0.01 mol/L,pH7.4)制备10%(w/w)组织匀浆,3000 r/min离心10 min,取上清液用于总蛋白、T-AOC、SOD、CAT、GSH-Px、GSH和8-OHdG的测定,所有操作均按试剂盒说明书进行。
1.2.3.3 抗氧化相关基因表达水平分析
采用Trizol法提取大鼠脾脏组织总RNA。经微孔板分光光度计测得A260 nm和A280 nm比值在1.8~2.0之间,琼脂糖凝胶电泳法评价RNA质量。参照FastQant RT Kit(with gDNase)说明书分别将各样品的总RNA进行逆转录合成cDNA,并以此为模板,使用表2所列的引物,按照SuperRealPreMix Plus(SYBR Green)说明书进行Real-time PCR检测。以β-肌动蛋白(β-actin)为内参,谷氨酸-半胱氨酸连接酶催化亚基(Glutamate cysteine ligase catalytic subunit,GCLC)、谷氨酸-半胱氨酸连接酶调节亚基(Glutamate cysteine ligase modifiersubunit,GCLM)、醌氧化还原酶1(NAD(P)Hquinoneoxidoreductase 1,NQO1)、血红素氧合酶(heme oxygenase-1,HO-1)及核因子E2相关因子2(Nuclear factor E2-related factor 2,Nrf2)的相对表达量采用2-△△Ct法进行计算。引物由上海生工生物有限公司合成,详细信息见表2。
表 2 抗氧化基因的引物序列Table 2. Primer sequences of antioxidant genes基因名称 上下游引物序列 片段大小 基因序列号 β-actin F CCTAAGGCCAACCGTGAAAA
R CAGAGGCATACAGGGACAACAC103 NM_031144.2 Nrf2 F TTGGCAGAGACATTCCCATTTGTA
R GAGCTATCGAGTGACTGAGCCTGA116 NM_031789.2 GCLC F GTGGACACCCGATGCAGTATTC
R CATCCACCTGGCAACAGTCATTAG87 NM_012815.2 GCLM F AGACCGGGAACCTGCTCAAC
R GATTTGGGAGCTCCATTCATTCA113 NM_017305.2 HO-1 F AGGTGCACATCCGTGCAGAG
R CTTCCAGGGCCGTATAGATATGGTA120 NM_012580.2 NQO1 F TGGAAGCTGCAGACCTGGTG
R CCCTTGTCATACATGGTGGCATAC133 NM_017000.3 1.3 数据处理
试验数据采用SAS 9.2进行统计分析,其中正常对照组和氧化应激组进行t检验,低、中、高剂量组与阳性对照组进行单因素方差分析,并用Duncan’s检验进行多重比较。试验结果均以平均值和标准差表示,P<0.05表示差异显著。
2. 结果与分析
2.1 FWBPs体外抗氧化活性
2.1.1 还原力
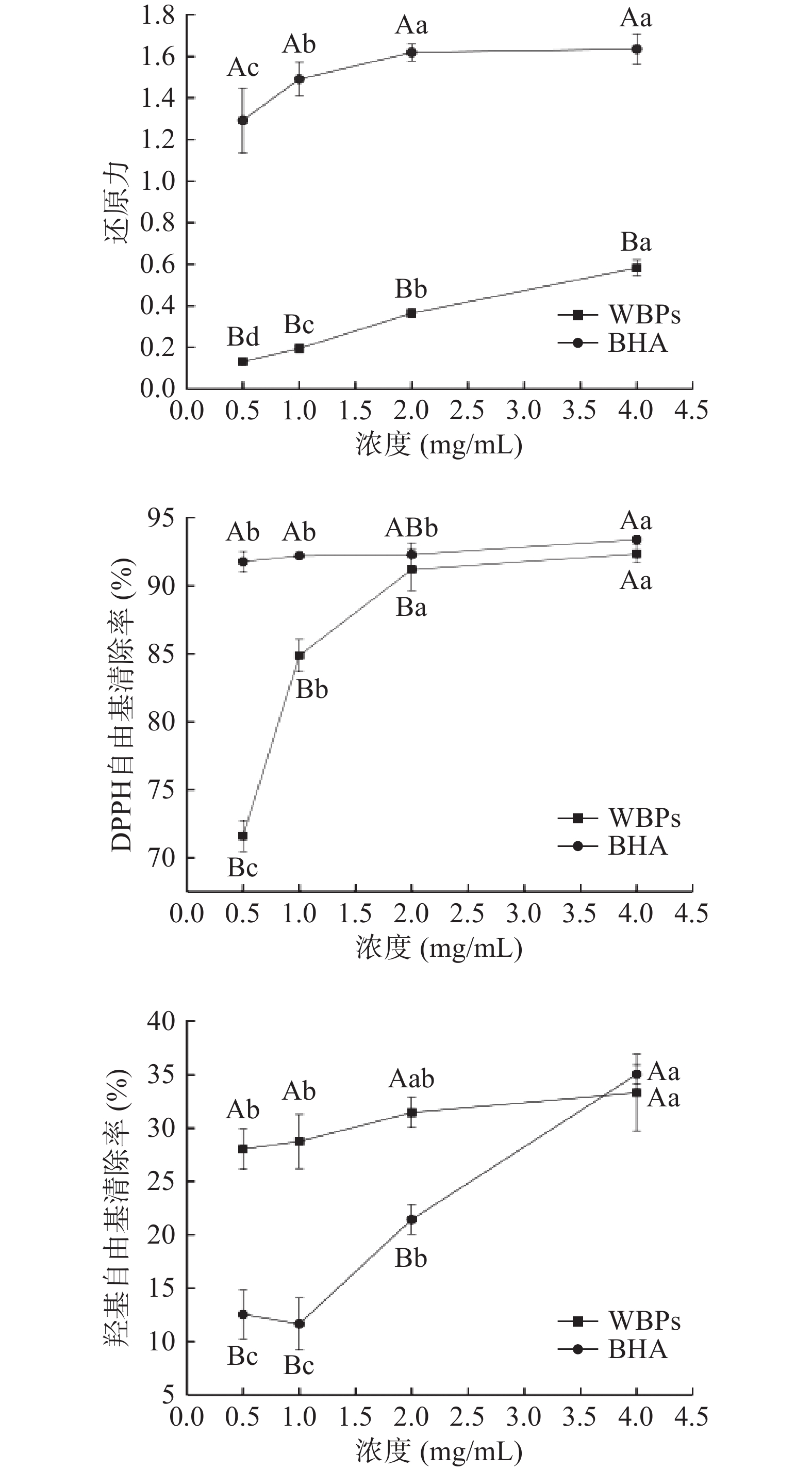
还原力是评价抗氧化能力的一个重要指标[12],还原力越强,表明其抗氧化能力越高。由图1所示,随着FWBPs溶液浓度的增加,其还原力也逐渐增加;当FWBPs溶液浓度达到4 mg/mL时,其还原力显著提高(P<0.05),但仍显著低于阳性对照BHA(P<0.05)。与上述研究结果相似,杜涓等[13]研究结果显示,当样品浓度达到4 mg/mL时,四种不同组分的FWBPs(吸光值分别为0.24、0.58、0.67、0.61)的还原力增加,但不如BHA的还原力强。FWBPs是一种混合物,其中含有的低聚糖基团和阿魏酰基团可能会影响氧化还原电位,影响其还原力[14]。由此推测,FWBPs的抗氧化作用可能是由于其含有低聚糖和酚酸类物质。研究发现,低聚糖在抗氧化方面有良好作用[15],而阿魏酸是一种公认的抗氧化剂,被广泛应用于食品工业领域[16]。
2.1.2 DPPH自由基清除率
过量的DPPH自由基会破坏机体细胞结构,造成其功能障碍甚至死亡[17]。由图1所示,当FWBPs浓度在0.5~2 mg/mL范围内时,DPPH自由基清除能力显著提高(P<0.05),4 mg/mL时DPPH自由基清除率最高,可达92.35%,且与阳性对照BHA的清除能力相当。此结果与杜涓等[13]研究结果相似,四种不同组分的FWBPs均有较强的DPPH自由基清除能力,4 mg/mL的清除率可达80%。此结果表明,FWBPs对DPPH自由基有较强的清除作用。
2.1.3 羟基自由基清除率
羟基自由基是一种极具危害的自由基,具有很强的氧化活性,可以直接损伤核酸、蛋白质、脂质等生物大分子,进而影响机体健康[12]。由图1所知,当FWBPs浓度在0.5~2 mg/mL范围内时,其羟基自由基清除率显著高于同浓度的阳性对照BHA(P<0.05);当浓度在4 mg/mL时,BHA的羟基自由基清除率与FWBPs相当。与上述结果相似,吕青青[18]研究发现,小麦麸皮多糖有较强羟基自由基清除能力,可达30%。
2.2 FWBPs对氧化应激大鼠脾脏保护作用
2.2.1 FWBPs对氧化应激大鼠脾脏抗氧化相关指标的影响
动物机体可以通过抗氧化体系来清除过量自由基,进而缓解氧化应激。抗氧化体系包括由GSH-Px、CAT及SOD等抗氧化酶组成的酶体系和由GSH、维生素C、维生素E、类胡萝卜素、类黄酮、胆红素及微量元素硒等物质组成的非酶体系[19-21]。8-OHdG是一种有害氧化代谢产物,是目前研究公认的评价氧化应激损伤的指标[22]。如表3所示,敌草快攻毒会导致大鼠脾脏GSH-Px活性显著下降(P<0.05),T-AOC和8-OHdG的含量显著增加(P<0.05),这说明敌草快攻毒导致抗氧化酶活性降低,而氧化代谢产物8-OHdG含量增加,大鼠脾脏氧化应激模型构建成功。有趣的是,敌草快攻毒提高了T-AOC,这可能与攻毒条件下抗氧化体系被激活有关,具体原因有待进一步研究。与氧化应激模型组相比,低和中剂量组中GSH-Px活性显著增加(P<0.05);低剂量组中GSH含量显著增加(P<0.05);而中、高剂量组和阳性对照组中8-OHdG的含量显著降低(P<0.05)。多项研究发现,FWBPs可提高大鼠组织中SOD、CAT及GSH-Px等抗氧化酶的活力及mRNA表达水平[23-24]。与本试验结果相似,壳聚糖可通过增加敌草快攻毒仔猪血清中GSH-Px、CAT及SOD的活性,进而缓解氧化应激[25]。此结果表明,FWBPs可通过增加GSH-Px活力、GSH含量,降低8-OHdG的含量缓解敌草快攻毒所致的脾脏氧化应激。
表 3 FWBPs对氧化应激大鼠脾脏抗氧化相关指标的影响Table 3. Effects of FWBPs supplementation on antioxidant indices in spleen of oxidative stress rats项目 正常对照组 氧化应激模型组 阳性对照组 FWBPs低剂量组 FWBPs中剂量组 FWBPs高剂量组 总抗氧化能力
T-AOC (U/mg prot)0.88±0.16B 1.19±0.19Aa 1.43±0.34a 0.89±0.23a 1.63±0.57a 1.24±0.33a 过氧化氢酶
CAT (U/mg prot)1.78±0.29A 2.10±0.70A 2.05±0.72a 1.94±0.66a 2.97±1.62a 2.19±0.53a 超氧化物岐酶
SOD (U/mg prot)0.37±0.05A 0.38±0.08A 0.69±0.39a 0.48±0.16a 0.34±0.08a 0.45±0.16a 谷胱甘肽过氧化物酶
GSH-Px (pg/mg)24.75±4.19A 8.43±3.85Bbc 17.42±12.62ab 19.16±3.55a 24.59±9.36a 6.99±5.66c 谷胱甘肽
GSH (ng/mg)48.05±8.83A 56.89±26.77Ab 37.38±10.69b 218.76±62.21a 17.67±14.69b 37.26±14.21b 8-羟基鸟苷
8-OHdG (ng/mg)389.01±100.65B 554.44±205.03Aa 239.60±20.70b 400.81±174.29ab 258.29±24.28b 329.39±39.01b 注:大写字母不同表示正常对照组和氧化应激组相比差异显著(P<0.05);小写字母不同表示氧化应激组与低、中、高剂量组及阳性对照组相比差异显著(P<0.05);同行无字母或数据肩标相同字母表示差异不显著(P>0.05);表4同。 2.2.2 FWBPs对氧化应激大鼠脾脏抗氧化相关基因表达的影响
为了进一步探讨FWBPs对大鼠脾脏氧化应激缓解作用的可能分子机制,本试验测定了脾脏抗氧化相关基因的相对表达量。由表4所示,敌草快攻毒会导致大鼠脾脏GCLM的mRNA表达水平显著增加(P<0.05)。与氧化应激模型组相比,中剂量组大鼠脾脏中NQO1和Nrf2的mRNA表达量显著增加(P<0.05)。核因子E2相关因子2(Nrf2)信号通路是目前研究发现的最经典的内源性抗氧化应激通路之一[26]。在氧化应激发生后,Nrf2会被活化,与kelch样ECH相关蛋白1(kelchlike ECH associated protein1,Keap1)解离,进入细胞核与抗氧化反应元件(Antioxidant response element,ARE)结合,促进HO-1、NQO1、GCLC和GCLM的转录和表达,诱导CAT、SOD和GSH-Px等抗氧化酶的转录和表达,进而缓解氧化应激[27]。HO-1可通过与金属离子螯合、修饰蛋白巯基及清除自由基等方式防御氧化应激[28]。醌类可被NQO1直接被还原成氢醌,进而减少醌类转化产生的氧自由基,从而缓解醌类物质代谢引起氧化应激损伤[29]。谷氨酸-半胱氨酸连接酶是由催化亚基GCLC和调节亚基GCLM组成的二聚体,它可以调控GSH的合成[30]。由此结果推测,FWBPs可通过激活Nrf2,增加NQO1的mRNA表达量,进而缓解敌草快攻毒所致的脾脏氧化应激。
表 4 FWBPs对氧化应激大鼠脾脏抗氧化相关基因表达的影响Table 4. Effects of FWBPs supplementation on the mRNA expression level of antioxidant-related genes in spleen of oxidative stress rats项目 正常对照组 氧化应激模型组 阳性对照组 FWBPs低剂量组 FWBPs中剂量组 FWBPs高剂量组 谷氨酸半胱氨酸连接酶催化亚基GCLC 1.00±0.13A 1.30±0.58A 2.52±2.17a 1.16±0.39a 2.80±0.50a 0.94±0.22a 谷氨酸半胱氨酸连接酶修饰亚基GCLM 1.03±0.30B 1.86±0.38A 1.23±0.21a 0.90±0.04a 2.38±0.64a 1.47±0.19a 血红素氧合酶-1
HO-11.00±0.05A 0.91±0.33A 1.20±0.49a 1.19±0.58a 0.92±0.23a 1.66±0.21a 醌氧化还原酶1
NQO11.03±0.21A 1.22±0.24Ab 0.84±0.48bc 1.16±0.20bc 1.95±0.27a 0.67±0.34c 核因子E2 相关因子2
Nrf21.02±0.32A 1.33±0.49Ab 1.15±0.33b 1.19±0.39b 2.17±0.88a 1.14±0.43b 3. 讨论与结论
研究发现,氧化应激与肥胖、糖尿病、帕金森病及心脑血管疾病等慢性疾病的发病机制密切相关[31]。一般通过摄食抗氧化类物质来提高机体抗氧化能力,缓解氧化应激。动物机体主要通过抗氧酶和抗氧化物质抵抗氧化应激。本试验发现,氧化应激模型组大鼠脾脏GSH-Px活力下降,而FWBPs预处理可增加氧化应激大鼠脾脏GSH-Px活力、GSH含量及NQO1和Nrf2的mRNA表达量,并可降低8-OHdG的含量。由此推测,FWBPs的抗氧化作用可能是通过激活Nrf2,促进NQO1的转录和表达,诱导GSH-Px的表达和GSH的分泌,进而缓解敌草快攻毒所致的脾脏氧化应激,保护脾脏健康。FWBPs的抗氧化作用机制可能是多途径的,后续有待深入研究脾脏组织中抗氧化信号通路相关蛋白表达情况,以探明FWBPs的靶向作用机制。
体外试验结果显示,4 mg/kg BW FWBPs对DPPH自由基和羟基自由基都有较强的清除作用,且与阳性对照BHA作用相当,这证明FWBPs有较强的体外抗氧化作用。体内试验发现,FWBPs预处理可增加氧化应激大鼠脾脏GSH-Px活力、GSH含量及NQO1和Nrf2的mRNA表达量,并可降低8-OHdG的含量。综上所述,FWBPs具有较好的体外、体内抗氧化能力及氧化应激修复作用,可作为一种天然抗氧化剂应用于食品工业领域,本试验也为FWBPs的开发利用提供了理论参考。
-
表 1 试验动物分组设计
Table 1 Experimental design and animal grouping
分组 腹腔注射试剂及剂量 灌胃试剂及剂量 正常对照组 生理盐水 生理盐水 氧化应激模型组 敌草快(0.1 mmol/kg BW) 生理盐水 FWBPs低剂量组 敌草快(0.1 mmol/kg BW) FWBPs(100 mg/kg BW) FWBPs中剂量组 敌草快(0.1 mmol/kg BW) FWBPs(200 mg/kg BW) FWBPs高剂量组 敌草快(0.1 mmol/kg BW) FWBPs(400 mg/kg BW) 阳性对照组 敌草快(0.1 mmol/kg BW) VC(100 mg/kg BW) 表 2 抗氧化基因的引物序列
Table 2 Primer sequences of antioxidant genes
基因名称 上下游引物序列 片段大小 基因序列号 β-actin F CCTAAGGCCAACCGTGAAAA
R CAGAGGCATACAGGGACAACAC103 NM_031144.2 Nrf2 F TTGGCAGAGACATTCCCATTTGTA
R GAGCTATCGAGTGACTGAGCCTGA116 NM_031789.2 GCLC F GTGGACACCCGATGCAGTATTC
R CATCCACCTGGCAACAGTCATTAG87 NM_012815.2 GCLM F AGACCGGGAACCTGCTCAAC
R GATTTGGGAGCTCCATTCATTCA113 NM_017305.2 HO-1 F AGGTGCACATCCGTGCAGAG
R CTTCCAGGGCCGTATAGATATGGTA120 NM_012580.2 NQO1 F TGGAAGCTGCAGACCTGGTG
R CCCTTGTCATACATGGTGGCATAC133 NM_017000.3 表 3 FWBPs对氧化应激大鼠脾脏抗氧化相关指标的影响
Table 3 Effects of FWBPs supplementation on antioxidant indices in spleen of oxidative stress rats
项目 正常对照组 氧化应激模型组 阳性对照组 FWBPs低剂量组 FWBPs中剂量组 FWBPs高剂量组 总抗氧化能力
T-AOC (U/mg prot)0.88±0.16B 1.19±0.19Aa 1.43±0.34a 0.89±0.23a 1.63±0.57a 1.24±0.33a 过氧化氢酶
CAT (U/mg prot)1.78±0.29A 2.10±0.70A 2.05±0.72a 1.94±0.66a 2.97±1.62a 2.19±0.53a 超氧化物岐酶
SOD (U/mg prot)0.37±0.05A 0.38±0.08A 0.69±0.39a 0.48±0.16a 0.34±0.08a 0.45±0.16a 谷胱甘肽过氧化物酶
GSH-Px (pg/mg)24.75±4.19A 8.43±3.85Bbc 17.42±12.62ab 19.16±3.55a 24.59±9.36a 6.99±5.66c 谷胱甘肽
GSH (ng/mg)48.05±8.83A 56.89±26.77Ab 37.38±10.69b 218.76±62.21a 17.67±14.69b 37.26±14.21b 8-羟基鸟苷
8-OHdG (ng/mg)389.01±100.65B 554.44±205.03Aa 239.60±20.70b 400.81±174.29ab 258.29±24.28b 329.39±39.01b 注:大写字母不同表示正常对照组和氧化应激组相比差异显著(P<0.05);小写字母不同表示氧化应激组与低、中、高剂量组及阳性对照组相比差异显著(P<0.05);同行无字母或数据肩标相同字母表示差异不显著(P>0.05);表4同。 表 4 FWBPs对氧化应激大鼠脾脏抗氧化相关基因表达的影响
Table 4 Effects of FWBPs supplementation on the mRNA expression level of antioxidant-related genes in spleen of oxidative stress rats
项目 正常对照组 氧化应激模型组 阳性对照组 FWBPs低剂量组 FWBPs中剂量组 FWBPs高剂量组 谷氨酸半胱氨酸连接酶催化亚基GCLC 1.00±0.13A 1.30±0.58A 2.52±2.17a 1.16±0.39a 2.80±0.50a 0.94±0.22a 谷氨酸半胱氨酸连接酶修饰亚基GCLM 1.03±0.30B 1.86±0.38A 1.23±0.21a 0.90±0.04a 2.38±0.64a 1.47±0.19a 血红素氧合酶-1
HO-11.00±0.05A 0.91±0.33A 1.20±0.49a 1.19±0.58a 0.92±0.23a 1.66±0.21a 醌氧化还原酶1
NQO11.03±0.21A 1.22±0.24Ab 0.84±0.48bc 1.16±0.20bc 1.95±0.27a 0.67±0.34c 核因子E2 相关因子2
Nrf21.02±0.32A 1.33±0.49Ab 1.15±0.33b 1.19±0.39b 2.17±0.88a 1.14±0.43b -
[1] SOHAL R S, ALLEN R G. Oxidative stress as a causal factor in differentiation and aging: A unifying hypothesis[J]. Experimental Gerontology,1990,25(6):499−525. doi: 10.1016/0531-5565(90)90017-V
[2] KURIEN B T, HENSLEY K, BACHMANN M, et al. Oxidatively modified autoantigens in autoimmune diseases[J]. Free Radical Biology & Medicine,2006,41(4):549−556.
[3] FUENTE M D L. Effects of antioxidants on immune system ageing[J]. European Journal of Clinical Nutrition,2002,56(3):S5−S8.
[4] 孟庆龙, 金莎, 刘雅婧, 等. 植物多糖药理功效研究进展[J]. 食品工业科技,2020,41(11):335−341. [MENG Q L, JIN S, LIU Y J, et al. Research progress in pharmacological efficacy of plant polysaccharides[J]. Science and Technology of Food Industry,2020,41(11):335−341. [5] 蔺艳君, 刘丽娅, 钟葵, 等. 不同来源小麦麸皮营养成分及酚类物质含量的比较[J]. 现代食品科技,2014,30(12):194−200. [LIN Y J, LIU L Y, ZHONG K, et al. Comparison of nutritional and phenolic content of wheat bran obtained from different sources[J]. Modern Food Science and Technology,2014,30(12):194−200. [6] JUNYI Y, MALDONADO GÓMEZ MARÍA X, HUTKINS ROBERT W, et al. Production and in vitro fermentation of soluble, non-digestible, feruloylatedoligo- and polysaccharides from maize and wheat brans[J]. Journal of Agricultural and Food Chemistry,2014,62(1):159−166. doi: 10.1021/jf404305y
[7] 王园, 史俊祥, 段元霄, 等. 麸皮多糖微生物发酵工艺优化及其抗炎活性[J]. 食品科学,2018,39(14):192−198. [WANG Y, SHI J X, DUAN Y X, et al. Optimization of fermentation conditions for improved production of polysaccharides from wheat bran and anti-inflammatory effects of the extracted polysaccharides[J]. Food Science,2018,39(14):192−198. doi: 10.7506/spkx1002-6630-201814029 [8] ZHANG H, ZHANG S, WANG J, et al. Wheat bran feruloyl oligosaccharides protect against AAPH-induced oxidative injury via p38MAPK/PI3K-Nrf2/Keap1-MafK pathway[J]. Journal of Functional Foods,2017,29:53−59. doi: 10.1016/j.jff.2016.12.009
[9] 李暄. 发酵麦麸多糖提取、分离纯化及生物活性分析[D]. 呼和浩特: 内蒙古农业大学, 2019. LI X. Extraction, separation, purification, and biological activity analysis of fermented wheat bran polysaccharide[D]. Hohhot: Inner Mongolia Agricultural University, 2019.
[10] JIA X J, DING C B, YUAN S, et al. Extraction, purification andcharacterization of polysaccharides form hawk tea[J]. Carbohydrate Polymers,2014,99:319−324. doi: 10.1016/j.carbpol.2013.07.090
[11] ZHANG Z, WANG X, ZHANG J, et al. Potential antioxidant activities in vitro of polysaccharides extracted from ginger(Zingiber officinale)[J]. Carbohydrate Polymers,2011,86(2):448−452. doi: 10.1016/j.carbpol.2011.04.062
[12] XU Y Q, CAI F, YU Z Y, et al. Optimisation of pressurised water extraction of polysaccharides from blackcurrant and its antioxidant activity[J]. Food Chemistry,2016,194(194):650−658.
[13] 杜涓, 安晓萍, 刘娜, 等. 分级醇沉发酵麸皮多糖的成分分析与抗氧化活性研究[J]. 食品工业科技,2020,41(5):58−62. [DU J, AN X P, LIU N, et al. Studies on composition analysis and antioxidant activities of bran polysaccharides by fractional alcohol submerged fermentation[J]. Science and Technology of Food Industry,2020,41(5):58−62. [14] RAGURAMAN V, ABRAHAM L S, JYOTSNA J, et al. Sulfated polysaccharide from Sargassum tenerrimum attenuates oxidative stress induced reactive oxygen species production in in vitro and in zebrafish model[J]. Carbohydrate Polymers,2019,203(203):441−449.
[15] 雷钊, 尹达菲, 袁建敏. 阿拉伯木聚糖和阿拉伯低聚木糖的益生功能研究进展[J]. 动物营养学报,2017,29(2):365−373. [LEI Z, YIN D F, YUAN J M. Research progress on prebiotic effects of arabinoxylan and arabinoxylan oligosaccharides[J]. Chinese Journal of Animal Nutrition,2017,29(2):365−373. doi: 10.3969/j.issn.1006-267x.2017.02.001 [16] 姚艳艳. 小麦麸皮中阿魏酸提取与纯化工艺研究[D]. 雅安: 四川农业大学, 2011. YAO Y Y. Extraction and purification of ferulic acid from wheat bran[D]. Ya’an: Sichuan Agricultural University, 2011.
[17] SAMIR Z, ISMAIL D, RANDA G, et al. In vitro and molecular docking studies of DPPH with Phoenix dactylifera L. (Deglet-Nour) crude fruits extracts and evaluation of their antioxidant activity[J]. Asian Journal of Research in Chemistry,2020,13(1):52−59. doi: 10.5958/0974-4150.2020.00012.7
[18] 吕青青. 小麦麸皮多糖的结构表征、硒化改性及生理活性研究[D]. 合肥: 合肥工业大学, 2020. LV Q Q. Structural characterization, selenylation and physiological activities of polysaccharides from wheat bran[D]. Hefei: Hefei University of Technology, 2020.
[19] APEL K. Reactive oxygen species: Metabolism, oxidative stress, and signal transduction[J]. Annu Annual Review of Plant Biology,2004,55:373−399. doi: 10.1146/annurev.arplant.55.031903.141701
[20] VALKO M, RHODES C J, MONCOL J, et al. Free radicals, metals and antioxidants in oxidative stress-induced cancer[J]. Chemico-biological Interactions,2006,160(1):1−40. doi: 10.1016/j.cbi.2005.12.009
[21] ESPINOSA DIEZ C, MIGUEL V, MENNERICH D, et al. Antioxidant responses and cellular adjustments to oxidative stress[J]. Redox Biology,2015,6:183−197. doi: 10.1016/j.redox.2015.07.008
[22] 于晨, 董超然, 张照辉, 等. 8-羟基脱氧鸟嘌呤作为DNA氧化损伤标志物的研究现状[J]. 中国临床药理学杂志,2017,33(13):1267−1270. [YU C, DONG C R, ZHANG Z H, et al. Review of the research on 8-hydroxy-2-deoxyguanosine as a DNA oxidative damage marker[J]. The Chinese Journal of Clinical Pharmacology,2017,33(13):1267−1270. [23] 段元霄. 麦麸阿魏酰聚糖对大鼠抗氧化功能的影响及其作用机制[D]. 呼和浩特: 内蒙古农业大学, 2018. DUAN Y X. Effects of feruloylated saccharides on antioxidative capacity in wistar rats and the its regulation mechanism[D]. Hohhot: Inner Mongolia Agricultural University, 2018.
[24] 史俊祥. 麸皮多糖微生物发酵制备及其粗制品抗氧化活性的研究[D]. 呼和浩特: 内蒙古农业大学, 2017. SHI J X. Re-search on the microbial fermentation of wheat bran polysaccharides and antioxidant activity of crude polysaccharide[D]. Hohhot: Inner Mongolia Agricultural University, 2017.
[25] 徐元庆. 壳聚糖对断奶仔猪氧化应激的缓解作用及其机理研究[D]. 呼和浩特: 内蒙古农业大学, 2018. XU Y Q. Study on the mitigation action of chitosan on oxidative stress of weaned piglets and underlying mechanism[D]. Hohhot: Inner Mongolia Agricultural University, 2018.
[26] SZKLARZ G. Role of Nrf2 in oxidative stress and toxicity[J]. Annual Review of Pharmacology and Toxicology,2013,53(1):401. doi: 10.1146/annurev-pharmtox-011112-140320
[27] CHEN Q, TAO J, XIE X. Astaxanthin promotes Nrf2/ARE signaling to inhibit HG-induced renalfibrosis in GMCs[J]. Mar Drugs,2018,16(4):E117. doi: 10.3390/md16040117
[28] 孙健乐, 夏振炜, 张雪洪, 等. 保护基因HO在组织细胞中的作用及其机制研究进展[J]. 生命科学,2003,15(4):220−223. [SUN J L, XIA Z W, ZHANG X H, et al. The advances on the protective action and mechanism of heme oxygenase gene in tissues and cells[J]. Chinese Bulletin of Life Sciences,2003,15(4):220−223. doi: 10.3969/j.issn.1004-0374.2003.04.007 [29] ENOMOTO A, ITOH K, NAGAYOSHI E, et al. High sensitivity of Nrf2 knockout mice to acetaminophen hepatotoxicity associated with decreased expression of ARE-regulated drug metabolizing enzymes and antioxidant genes[J]. Toxicological Sciences,2001,59(1):169−177. doi: 10.1093/toxsci/59.1.169
[30] WILD A C, MULCAHY R T. Regulation of γ-glutamylcysteine synthetase subunit gene expression: Insights into transcriptional control of antioxidant defenses[J]. Free Radical Research,2000,32(4):281−301. doi: 10.1080/10715760000300291
[31] CERIELLO A, MOTZ E. Is oxidative stress the pathogenic mechanism underlying insulin resistance, diabetes, and cardiovascular disease? The common soil hypothesis revisited[J]. Arterioscler Thromb Vasc Biol,2004,24:816−823. doi: 10.1161/01.ATV.0000122852.22604.78





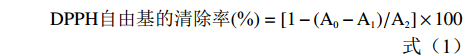
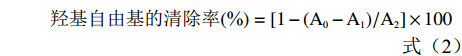
 下载:
下载:
 下载:
下载:
