Optimization and Analysis of Corn Resistant Starch Prepared by Cross-linking Method and Its Physical and Chemical Properties
-
摘要: 以玉米淀粉为原料,采用交联法制备抗性淀粉,通过单因素实验和中心组合法优化了玉米抗性淀粉制备工艺参数,并对制备出来的交联淀粉与酯化淀粉和原淀粉进行透明度、溶解度、膨胀度和冻融稳定性等性质的比较。结果表明,交联法得到最优改性反应条件如下:反应时间是3.5 h、交联剂浓度是11.5%、底物浓度是0.71 g/mL、反应温度是60 ℃。试验模型与实际拟合度良好, 制得的抗性淀粉含量为60.76%,通过红外光谱证实了交联反应的发生,交联后抗性淀粉溶解度升高,膨润度和冻融稳定性下降,并在扫描电镜观察下淀粉颗粒的形状和大小与原淀粉没有显著差异,为玉米抗性淀粉的工业化生产提供了参考。Abstract: In this paper, corn starch was used as raw material to prepare resistant starch by cross-linking method. The preparation process parameters of corn resistant starch were optimized through single factor experiment and center combination. The physicochemical properties of the prepared crosslinked starch were compared with esterified starch and original starch. It compared the properties of transparency, solubility, degree of swelling and freeze-thaw stability. The optimal modification reaction conditions obtained by the cross-linking method were as follows: The reaction time was 3.5 h, the cross-linking agent concentration was 11.5%, the substrate concentration was 0.71 g/mL, and the reaction temperature was 60 ℃. The model and the experiment fitted well. The prepared resistant starch content was 60.76%. It was confirmed by infrared spectroscopy that the cross-linking reaction occurred, the solubility of the cross-linked resistant starch increased, and the swelling degree and freeze-thaw stability decreased. Finally, observed by scanning electron microscope, this study found that the shape and size of starch granules are not significantly different from original starch. The study provides a reference for the industrial production of corn resistant starch.
-
抗性淀粉(Resistant Starch,RS)为膳食纤维的组成成分之一,不能被健康人体小肠利用提供葡萄糖,但能由大肠中肠道微生物发酵产生短链脂肪酸,有利于有益菌群生长、人体健康[1]。国内外研究发现RS可优化肠道菌群组成[2]、作为糖尿病人的食品基料[3]、减缓慢性肾脏疾病[4]、在结肠健康方面起关键作用[5],同时具有降低胆固醇[6]和Ⅱ型糖尿病患病的风险[7]等生理功能,被广大学者所关注,日益成为食品领域研究热点。然而国内商业化生产RS技术并不成熟,我国目前RS的供给大多数来自国外且费用偏高,吉林省作为玉米淀粉出产大省,对玉米抗性淀粉的研究,具有重要的实际应用价值。
化学法制备RS多采用交联法和酯化法。相比于物理法和酶法,化学法在处理过程中引入化学试剂,不适宜制备可食用的食品。本实验选取的三偏磷酸钠是一种无有害副产物且合成条件温和的交联剂[8],可使一种或多种淀粉粒子间发生交联作用而呈多维立体的空间“网络”状态,进而增大分子量,增强淀粉颗粒之间的联合作用,使结构变得紧密,淀粉性质发生改变[9-10]。使用复合交联剂制备出的交联淀粉含量高于单一交联剂,热稳定性与抗剪切稳定性等功能优于原淀粉[11-12],但目前采取复合交联剂制备RS的研究较少。
基于上述情况,本文以普通玉米淀粉为原料,结合复合交联剂制备RS的单因素试验结果,利用响应面优化获得交联淀粉制备的最佳工艺条件;在此基础上,将交联淀粉的理化特性与酯化淀粉和原淀粉进行对比分析,为玉米抗性淀粉工业化生产及功能食品开发提供了理论基础,同时为玉米精深加工的创新发展提供了新的思路。
1. 材料及方法
1.1 材料与仪器
玉米淀粉 吉林省杞参食品有限公司;三偏磷酸钠、柠檬酸、三聚磷酸钠 分析纯,上海阿拉丁生化科技股份有限公司;耐高温α-淀粉酶(45000 U/mL)和葡萄糖淀粉酶(45000 U/mL) Sigma公司;中温α-淀粉酶(3700 U/g) 食品级,北京奥博星生物技术有限责任公司。
ZD-2自动电位滴定仪 上海仪电科学仪器股份有限公司;WFJ 2100可见分光光度计 尤尼柯(上海)仪器有限公司;71403372-17场发射扫描电子显微镜 PHENOM公司;AL-204电子分析天平 梅特勒-托利多仪器(上海)有限公司;IR-Prestuge-21傅里叶红外光谱 日本岛津;Z36HK高速冷冻离心机 HERMLE公司。
1.2 实验方法
1.2.1 抗性淀粉制备方法
1.2.1.1 交联法制备抗性淀粉
参照KAHRAMAN等[13]的方法,稍作修改,将一定质量比的复合交联剂(三偏磷酸钠:三聚磷酸钠=99:1)、10%无水硫酸钠和玉米淀粉分散在70 mL蒸馏水中(添加剂的重量均基于玉米淀粉的质量)。将淀粉乳pH调整至12.0,一定温度下水浴加热,反应一定时间后,再将pH调整到6.5,以终止改性反应;用蒸馏水(洗7次)洗涤,4000 r/min离心5 min,将沉淀物置于50 ℃烘箱去除水分。干燥后的样品研磨后过100目筛,获得的筛下物即为待测样品。
1.2.1.2 柠檬酸酯化法制备抗性淀粉
参照REMYA等[14]的方法,稍作修改;称取一定质量柠檬酸溶于蒸馏水中,搅拌均匀,配置质量分数为50%柠檬酸溶液。用10 mol/L NaOH,调pH为3.3,加水稀释至25 mL,再与25 g淀粉混合放到平皿中,室温静置16 h。静置结束后于50 ℃干燥箱中干燥至水分含量5%~10%,研磨过60目筛后放入干净平皿中,在146 ℃烘箱中反应6 h后室温冷却,用蒸馏水(洗7次)洗涤,4000 r/min离心5 min。将制得的湿样品45 ℃干燥,烘干后粉碎过100目筛,得到样品。
1.2.2 单因素实验设计
1.2.2.1 反应时间对抗性淀粉含量的影响
固定12%交联剂、0.71 g/mL底物浓度和70 ℃水浴加热,研究分别反应2、2.5、3、3.5、4 h对抗性淀粉含量的影响。
1.2.2.2 交联剂浓度对抗性淀粉含量的影响
固定0.71 g/mL底物浓度、70 ℃水浴加热和反应3 h,研究分别加入8%、10%、12%、14%、16%交联剂对抗性淀粉含量的影响。
1.2.2.3 底物浓度对抗性淀粉含量的影响
固定12%交联剂、70 ℃水浴加热和反应3 h,研究0.57、0.64、0.71、0.79、0.86 g/mL底物浓度对抗性淀粉含量的影响。
1.2.2.4 温度对抗性淀粉含量的影响
固定12%交联剂、0.71 g/mL底物浓度和反应3 h,研究分别采取40、50、60、70、80 ℃水浴加热对抗性淀粉含量的影响。
1.2.3 响应面中心组合实验设计
在单因素实验的基础上,以交联剂浓度(A)、底物浓度(B)和反应温度(C)作变量,利用响应面优化获得交联淀粉制备的最佳工艺条件,具体设计见表1。
表 1 三因素三水平响应面中心组合实验设计Table 1. Three-factor three-level response surface center combination experiment design水平 因素 交联剂浓度(%) 底物浓度(g/mL) 反应温度(℃) −1 8 0.64 60 0 10 0.71 70 1 12 0.79 80 1.2.4 还原糖含量测定
测定还原糖含量的方法主要参考3,5-二硝基水杨酸法[15-16],移取0.5 mL样品于试管中,再加入0.5 mL水杨酸,混匀,沸水浴5 min,立即冷却至室温,再加4 mL去离子水,混匀,测540 nm下样品吸光度,代入葡萄糖标准曲线(y=3.4831x−0.0556)计算得还原糖含量。
1.2.5 玉米抗性淀粉含量测定
参照GONI等[17]的方法,并稍作修改;称取1.00 g样品抗性淀粉,溶于20 mL(pH为 6.0)磷酸氢二钠缓冲溶液,混匀后加入10 μL α-淀粉酶,在150 r/min的振动频率下,将待测样品溶液置于离心管中并放入90 ℃恒振荡器中振荡30 min,随即在3000 r/min转速下离心分离10 min,弃除上清;再向样品溶液中加入20 mL乙酸-乙酸钠缓冲溶液(pH为4.5)后混匀,再移取0.1 mL葡萄糖淀粉酶加入并再次混匀,在60 ℃恒温水浴振荡30 min,之后在3000 r/min转速下离心15 min后弃除上清液,再水洗两次去上清;再添加20 mL 4 mol/L KOH溶液充分溶解,冰浴振荡20 min后调pH至6.0~7.0,加入0.1 mL耐高温α-淀粉酶,在85~90 ℃水浴振荡30 min后立即冷却至室温,调pH至4.5,再向该待测液中添加0.1 mL葡萄糖淀粉酶 ,混合均匀后放置在60 ℃恒温水浴振荡1 h;取出样品立即冷却至室温后在3000 r/min转速下离心15 min再进行离心,水洗3次,收集上清液并定容至100 mL,最后测定溶液pH,再用水杨酸法测定还原糖。
抗淀粉含量(%)=还原糖含量(%)×0.9 1.2.6 理化性质分析
1.2.6.1 透明度
参照郭泽镔等[18]方法,稍作修改,称取3种不同的淀粉样品,加适量蒸馏水配成质量分数为1.0%溶液,90 ℃水浴加热30 min。在620 nm处用分光光度计测定淀粉糊吸光度,用吸光度表示透明度。
1.2.6.2 冻融稳定性
称取样品置于离心管中,配制成5%淀粉乳溶液,95 ℃水浴30 min,取出冷却至室温,于−20 ℃下冷藏24 h,室温溶解,3500 r/min离心20 min,根据沉淀物质量计算析水率[19]。
析水率(%)=m1−m2m1×100 式中:m1表示淀粉糊质量,g;m2表示沉淀质量,g。
1.2.6.3 溶解度和膨胀度
参照MERAL等[20]方法,取1.0 g样品加蒸馏水20 mL,沸水浴30 min,冷却至室温,4000 r/min,离心15 min,上清液烘干至恒重分别称取溶出物质量和管中沉淀物质量。
溶解度=m1×100% 膨胀度=m21−溶解度 式中:m1表示上清液溶出物质量,g;m2表示离心后沉淀质量,g。
1.2.6.4 持水力
参照马丽萍等[21]方法,将100 mg淀粉样品分散于10 mL水中,置于45、55、65、75、85 ℃水浴1 h,冷却至室温后,6000 r/min离心15 min,弃掉上清液,称沉淀质量,计算持水力。
持水力(%)=m1m2×100 式中:m1表示沉淀质量,g;m2表示样品质量,g。
1.2.6.5 淀粉颗粒表面形态分析
测试电压5 kV,喷金后使用电镜观察并拍摄颗粒形貌[22]。
1.2.6.6 红外光谱分析
样品和溴化钾按1:100的比例进行压片,在400~4000 cm−1波段进行扫描[23]。
1.3 数据处理
做3次平行实验,采用 Origin 8.5作图、DPS进行显著性分析(t检验)和Design Expert 8.0.6进行响应面优化处理。
2. 结果与分析
2.1 单因素实验
如图1a所示,当改性反应的交联剂浓度为10%时,玉米抗性淀粉的含量达到最大峰值,显著高于其它点(P<0.05),为47.32%,故选择本条件做后续响应面优化指标。因为交联剂的作用使玉米抗性淀粉分子间作用力增强,在此作用下抗性淀粉的含量得到了进一步的提高,促进了反应进行。继续添加交联剂,会使浓度变高会进而导致产物取代度提高,随着取代度的提高, 破损的淀粉颗粒变得越来越多,对抗性淀粉的生成产生了抑制作用[24]。
如图1b所示,当改性反应的底物浓度为0.71 g/mL时,玉米抗性淀粉的含量达到最大峰值,显著高于其它点(P<0.05),为44.24%,随后呈现下降趋势,故选择本条件做后续响应面优化指标。底物浓度高或低,抗性淀粉的含量都会相应下降,一方面是因为淀粉糊浓度低,黏度也低,淀粉分子相互分离;另一方面,淀粉糊浓度太高,流动性变差,且水分子进入淀粉的结晶区比较困难,抑制了反应进行[25]。
如图1c所示,当改性反应的温度处于70 ℃时,玉米抗性淀粉的含量达到最大峰值,显著高于其它点(P<0.05),为42.93%,随后呈现下降趋势,故选择本条件做后续响应面优化指标。适宜的反应温度会使淀粉分子扩散的速度加快进而会提高交联剂的交联效率,当反应温度超越了临界温度后,交联剂与淀粉间的有效碰撞在一定限度上会被削弱,导致交联度下降,另有一部分淀粉会产生糊化反应,进而会抑制反应进行[26]。
如图1d所示,当改性反应时间为3.5 h时,玉米抗性淀粉的含量达到最大峰值,为44.44%,显著高于其它点(P<0.05),随后呈现下降趋势,但是显著性较低,同时从能耗方面考虑,故选择本条件作为固定的指标。随着反应的时间延长可以提高淀粉分子与交联剂的接触,二者充分接触后,玉米抗性淀粉的含量会加大;然而时间过长会招致交联剂分子间彼此发生作用及水分的大批蒸发,导致淀粉糊化进而对抗性淀粉的生成产生了抑制作用[27]。
2.2 响应面试验
2.2.1 响应面优化结果分析
根据单因素实验结果分析选择反应时间(3.5 h)为确定值。再以交联剂浓度(A)、底物浓度(B)和反应温度(C)作变量进一步进行响应面分析优化出最优的试验指标,响应面试验的结果见表2。
表 2 三因素三水平响应面中心组合实验结果Table 2. The result of three-factor three-level response surface center combination experiment试验号 交联剂浓度(%) 底物浓度(g/mL) 温度(℃) 抗性淀粉含量(%) 1 −1 −1 0 9.97 2 1 −1 0 12.12 3 −1 0 0 17.81 4 1 0 0 31.55 5 −1 0 −1 32.02 6 1 0 −1 60.28 7 −1 0 1 10.83 8 1 0 1 21.01 9 0 −1 −1 26.70 10 0 1 −1 47.73 11 0 −1 1 8.25 12 10 −1 1 10.16 13 0 0 0 42.05 14 0 0 0 41.27 15 0 0 0 42.34 16 0 0 0 47.47 16 0 0 0 49.64 用Design Expert软件的8.0.6版本对表2中的数据回归解析,获得回归模型是: Y=44.55+6.67A+6.28B−14.69C+2.90AB−4.77AC−4.78BC−9.56A2−17.13B2−4.21C2;通过方差分析对所得的Y方程进行剖析见下表3。
表 3 回归模型方差分析Table 3. Analysis of variance of regression model方差
来源平方和 自由度 均方 F P 显著性 模型
A4447.07
355.519
1494.12
355.5128.72
20.670.0001
0.0026**
**B 315.13 1 315.13 18.32 0.0037 ** C 1725.19 1 1725.19 100.29 <0.0001 ** AB 33.58 1 33.58 1.95 0.2051 AC 91.01 1 91.01 5.29 0.0550 BC 91.39 1 91.39 5.31 0.0546 A2 384.67 1 384.67 22.36 0.0021 ** B2 1235.99 1 1235.99 71.85 <0.0001 ** C2 74.65 1 74.65 4.34 0.0757 残差 120.42 7 17.20 失拟 64.09 3 21.36 1.52 0.3393 不显著 误差 56.33 4 14.08 合计 4567.49 16 注:*表示影响显著,P<0.05;**表示影响极显著,P<0.01。 Y方程模型的P<0.01,说明此模型达到了极显著水平,失拟项P为0.3393,失拟项的影响不明显[28],同时也意味着非试验因素对本试验结果的影响不是很大,决定系数R2=0.9877,表明本次建造的模型与实际实验拟合度很好。因此,能够运用上述Y方程来描述各变量与抗性淀粉含量之间的关系,进而来测评各变量对玉米抗性淀粉含量影响的显著性。交互项中,AB、AC和BC项P>0.05,影响程度不显著,交互项影响均较小。依据表3中的回归方程的系数,可知影响玉米抗性淀粉的含量因素的顺序为C(温度)>A(交联剂浓度)>B(底物浓度)。
2.2.2 响应面分析
根据上述回归拟合方程,将3个因素中的任意一个因素固定在不变值(即0水平面),绘制等高线和响应面曲线,得到另外2个因素彼此作用的结果,去研究相关变量之间的相互作用,并获得最优坐标点。且等高线图中的椭圆形意味着两因素彼此交互作用明显,而圆形则表示两个因素之间交互作用不是很明显[29]。
由图2b、图2d和图2f可知,在某一因素作为中心点固定不变时,其余两因素彼此交互作用都不显著。
2.2.3 验证实验
用Design Expert软件(V8.0.6)响应面分析知,应用玉米淀粉制备抗性淀粉的最佳改性条件是: 反应时间3.5 h、底物浓度0.71 g/mL、交联剂浓度11.31%、反应温度60 ℃。在上述优化条件下,最高的含量可达60.87%。实际操作将条件调整为:反应时间3.5 h、交联剂浓度11.5%、底物浓度0.71 g/mL、反应温度60 ℃。之后进行了3次验证实验,含量平均值为(60.76%±0.45%),该值与分析得到的预测值比较贴合, 表明本次实验运用响应面优化而得到的最佳参数是可靠的。
2.3 理化性质分析
2.3.1 透明度分析
淀粉的糊透明度是食品应用中非常重要的参数,由于淀粉的分子结构中无生色基团,因此以吸光度的值表示淀粉糊的透明度[30]。交联淀粉的吸光度为1.246,显著低于其余二者( P <0.05),这可能是由于交联键数目的增加导致淀粉颗粒的致密性和分子量的增加,因为淀粉分子与交联剂充分反应后,分子之间更加紧密牢固[31],进而使光线不容易透过淀粉乳,导致吸光度下降,与杨帆[32]和HU[33]等结果相一致。因此本法制取的交联淀粉更适用在透明度低的饮料中,如高纤维饮料[28]中用来增加饮料的不透明度(图3)。
2.3.2 冻融稳定性分析
样品的冻融稳定性是由析水率反映出来的,析水率与冻融稳定性成反比,好的冻融稳定性可以赋予食品良好的膨化度和良好的质地。交联法制得的抗性淀粉析水率为88.08%,显著高于酯化淀粉和原淀粉(P<0.05),可能是由于分子间亲水力增强,减弱分子间氢键强度,减小脱水缩合作用,降低淀粉冷冻后的稳定性[34](图4)。
2.3.3 溶解度和膨胀度分析
如图5a可见,普通玉米淀粉经交联后,溶解度由10.02%提高至13.01%,显著高于原淀粉(P<0.05)。因为在制备抗性淀粉的过程中它的结晶结构会在加热条件下被破坏,进而导致直链淀粉从结晶结构中解离并且分散于水中,随着温度的提高,淀粉分子微晶束也变得松弛,淀粉也会不断溶解[35]。
而膨胀度是淀粉颗粒完整性的一个指标。如图5b所示,在沸水浴的条件下,导致原淀粉糊化成淀粉糊的同时大量吸水,由于氢键被破坏,与羟基结合的水分子被释放,颗粒膨胀,因此玉米淀粉的膨胀度急速升高[36];交联淀粉的膨胀度408.02%显著低于原淀粉1009.00%,可能是由于交联反应增强了淀粉链之间的键合,从而抑制了淀粉颗粒的溶胀[37] ,可以更好的应用于热加工食品中。
2.3.4 持水力分析
在65 ℃之后原淀粉的持水力显著高于两种抗性淀粉(P<0.05),可能是在沸水浴的条件下,高于普通玉米淀粉的糊化温度,导致原淀粉糊化成淀粉糊的同时大量吸水,因此玉米淀粉的析水率急速升高[37]。在制备抗性淀粉的过程中,柠檬酸与淀粉分子生成柠檬酸酐,而交联剂与淀粉分子生成磷酸酯基,因此酯化淀粉持水力优于交联淀粉,本实验制备出的交联淀粉持水力较稳定,与牛博文等[38]研究结果相一致,可以更好地适用于食品工业中(图6)。
2.3.5 淀粉颗粒表面形态分析
玉米淀粉颗粒表面较为平滑,大小不一,颗粒呈椭球形或者多边形。发生交联反应后,淀粉颗粒的形状和大小没有显著差异。结果表明,玉米抗性淀粉交联后,有轻微的凹陷,淀粉分子变成不规则多面体,分子表面变得不平滑,是由于复合交联剂与淀粉分子发生化学反应从而腐蚀了淀粉分子表面[39];柠檬酸酯化后的淀粉原有颗粒形貌显著被破坏,颗粒表面凹凸不平,说明淀粉分子表面和内部结构因乙酰基的加入而被破坏了颗粒表面[14](图7)。
2.3.6 红外光谱分析
傅里叶红外光谱仪可以在一定范围检测内淀粉分子的结构,尤其是分子链之间的构象和双螺旋结构间的不同[40]。红外光谱图中在1200、1086和1026 cm−1附近的吸收峰是C-O键的伸缩,3400 cm−1附近的宽峰归属于-OH键的伸缩振动,在1700 cm−1附近对应的是C=O酯键的特征峰[41]。如图8所示,在1700 cm−1处与玉米淀粉相比酯化淀粉发生了伸缩振动,柠檬酸的确和淀粉发生了酯化反应。在3400 cm−1处的-OH伸缩振动峰与玉米淀粉相比变宽,这说明-OH被交联键取代,伸缩振动减少,随着交联反应的进行,交联淀粉引入的新的磷酸基团和玉米淀粉分子中天然存在的磷酸基团对应的特征峰距离较小,互相重叠,因此峰值的增加是因为引入了磷酸基团引起的,反映出了交联反应的发生。1022 cm−1和995 cm−1的值可反映出淀粉颗粒双螺旋结构的程度,从图8中可以看到,与原料玉米淀粉相比,交联淀粉和酯化淀粉峰值都有所下降,结合前文电镜分析,可能是制备抗性淀粉的过程中玉米淀粉原有的结构遭到了破坏,所以峰值与玉米淀粉比较之下相对较小。
3. 结论
优化得到的玉米交联抗性淀粉的改性条件为:反应时间3.5 h、交联剂浓度11.50%、底物浓度0.71 g/mL、反应温度60 ℃。在此最优改性条件下可制出RS含量为60.76%、膨胀度为408.02%、和溶解性为13.01%的交联淀粉。通过红外光谱证实了交联反应的发生,扫描电镜结果表明交联淀粉颗粒的形状和大小与原淀粉对比没有显著差异,但是交联法改性制取的RS冻融稳定性不如原淀粉,有待日后进一步研究。
-
表 1 三因素三水平响应面中心组合实验设计
Table 1 Three-factor three-level response surface center combination experiment design
水平 因素 交联剂浓度(%) 底物浓度(g/mL) 反应温度(℃) −1 8 0.64 60 0 10 0.71 70 1 12 0.79 80 表 2 三因素三水平响应面中心组合实验结果
Table 2 The result of three-factor three-level response surface center combination experiment
试验号 交联剂浓度(%) 底物浓度(g/mL) 温度(℃) 抗性淀粉含量(%) 1 −1 −1 0 9.97 2 1 −1 0 12.12 3 −1 0 0 17.81 4 1 0 0 31.55 5 −1 0 −1 32.02 6 1 0 −1 60.28 7 −1 0 1 10.83 8 1 0 1 21.01 9 0 −1 −1 26.70 10 0 1 −1 47.73 11 0 −1 1 8.25 12 10 −1 1 10.16 13 0 0 0 42.05 14 0 0 0 41.27 15 0 0 0 42.34 16 0 0 0 47.47 16 0 0 0 49.64 表 3 回归模型方差分析
Table 3 Analysis of variance of regression model
方差
来源平方和 自由度 均方 F P 显著性 模型
A4447.07
355.519
1494.12
355.5128.72
20.670.0001
0.0026**
**B 315.13 1 315.13 18.32 0.0037 ** C 1725.19 1 1725.19 100.29 <0.0001 ** AB 33.58 1 33.58 1.95 0.2051 AC 91.01 1 91.01 5.29 0.0550 BC 91.39 1 91.39 5.31 0.0546 A2 384.67 1 384.67 22.36 0.0021 ** B2 1235.99 1 1235.99 71.85 <0.0001 ** C2 74.65 1 74.65 4.34 0.0757 残差 120.42 7 17.20 失拟 64.09 3 21.36 1.52 0.3393 不显著 误差 56.33 4 14.08 合计 4567.49 16 注:*表示影响显著,P<0.05;**表示影响极显著,P<0.01。 -
[1] DEMARTINO P, COCKBURN D W. Resistant starch: Impact on the gut microbiome and health[J]. Current Opinion in Biotechnology,2019,61(C):66−71.
[2] ZHOU Y, ZHAO S, JIANG Y, et al. Regulatory function of buckwheatin esistant starch supplementation on lipid profile and gut microbiota in mice fed with a high-fat diet[J]. Journal of Food Science,2019,84(4):2674−2681.
[3] 宋彦显, 闵玉涛, 马庆一. 具有α-淀粉酶抑制活性基团的新型抗性淀粉的制备及其体外降糖活性研究[J]. 食品与发酵工业,2019,45(9):107−111. [SONG Y X, MIN Y T, MA Q Y. Preparation of new resistant starch with α-amylase inhibitory activity group and its in vitro hypoglycemic activity[J]. Food and Fermentation Industries,2019,45(9):107−111. [4] MATTHEW S, KELLOW N J, OUGHLAN M T. Modulation of the gut microbiota by resistant starch as a treatment of chronic kidney diseases: Evidence of efficacy and mechanistic insights[J]. Advances in Nutrition. 2019, 10(2): 303−320.
[5] MA Z, HU X, BOYE J I. Research advances on the formation mechanism of resistant starch type III: A review[J]. C R C Critical Reviews in Food Technology,2020,60(2):276−297.
[6] YUAN H C, MENG Y, BAI H, et al. Meta-analysis indicates that resistant starch lowers serum total cholesterol and low-density cholesterol[J]. Nutrition Research,2018,54(2):1−11.
[7] ZHANG C, MA S S, WU J H, et al. A specific gut microbiota and metabolomic profiles shifts related to antidiabetic action: The similar and complementary antidiabetic properties of type 3 resistant starch from Canna edulis and metformin[J]. Pharmacological Research,2020,159(9):1−13.
[8] 徐忠, 周美琴, 杨成. 交联淀粉的制备工艺研究[J]. 食品科学,2008,29(8):194−196. [XU Z, ZHOU M Q, YANG C. Study on the preparation technology of cross-linked starch[J]. Food Science,2008,29(8):194−196. [9] MEHBOOB S, ALI T M, SHEIKH M, et al. Effects of cross linking and/or acetylation on sorghum starch and film characteristics[J]. International Journal of Biological Macromolecules,2020,155(7):786−794.
[10] 郭丽, 邬应龙. 响应面试验优化交联马铃薯淀粉制备工艺及体外消化性质研究[J]. 食品科学,2013,34(8):76−81. [GUO L, WU Y L. Optimization of the preparation process and in vitro digestibility of cross-linked potato starch by response surface test[J]. Food Science,2013,34(8):76−81. [11] 张佳艳, 熊建文, 秦战军, 等. 复合交联剂对微波辅助制备马铃薯交联淀粉性质的影响[J]. 食品与机械,2018,34(1):13−16. [ZHANG J Y, XIONG J W, QIN Z J, et al. Effect of compound crosslinking agent on the properties of microwave-assisted preparation of potato crosslinked starch[J]. Food and Machinery,2018,34(1):13−16. [12] JYOTHY A N, MOORTHY S N, RAJASEKHARAN K N. Effect of cross-linking with epichlorohydrin on the properties of cassava (Manihot esculenta Crantz
) Starch[J]. Starch - Strke,2006,58(6):292−299. [13] KAHRAMAN K, KOKSEL H. Optimisation of the reaction conditions for the production of cross-linked starch with high resistant starch content[J]. Food Chemistry,2015,174(5):173−179.
[14] REMYA R, JYOTHI A N, SREEKUMAR J. Morphological, structural and digestibility properties of RS4 enriched octenyl succinylated sweet potato, banana and lentil starches[J]. Food Hydrocolloids,2018,82(9):219−229.
[15] 赵凯, 许鹏举, 谷广烨. 3, 5-二硝基水杨酸比色法测定还原糖含量的研究[J]. 食品科学,2008,29(8):534−536. [ZHAO K, XU P J, GU G Y. 3, 5-Dinitrosalicylic acid colorimetric method for the determination of reducing sugar content[J]. Food Science,2008,29(8):534−536. [16] 杨泉女, 周权驹, 吴松健, 等. 3, 5-二硝基水杨酸法与酶法测定甜玉米还原糖和蔗糖含量的比较[J]. 中国农业科技导报,2017,19(11):125−131. [YANG Q N, ZHOU Q J, WU S J, et al. Comparison of 3, 5-dinitrosalicylic acid method and enzymatic method for the determination of reducing sugar and sucrose content in sweet corn[J]. China Agricultural Science and Technology Review,2017,19(11):125−131. [17] GONI I, GARCIA-DIZ L, MANAS E, et al. Analysis of resistant starch: A method for foods and food products[J]. Food Chemistry,1996,56(4):445−449.
[18] 郭泽镔, 曾绍校, 郑宝东. 超高压处理对莲子淀粉理化特性的影响[J]. 中国食品学报,2014,14(11):118−123. [GUO Z P, ZENG S J, ZHENG B D. The effect of ultra-high pressure treatment on the physical and chemical properties of lotus seed starch[J]. Chinese Journal of Food Science,2014,14(11):118−123. [19] 刘淑婷, 王颖, 王志辉, 等. 不同品种芸豆淀粉及其抗性淀粉结构和物化特性比较[J]. 中国食品学报,2020,20(4):49−56. [LIU S T, WANG Y, WANG Z H, et al. Comparison of structure and physicochemical properties of different varieties of kidney bean starch and its resistant starch[J]. Chinese Journal of Food Science,2020,20(4):49−56. [20] YILDIRIM-YALCIN M, SEKER M, SADIKOGLU H. Development and characterization of edible films based on modified corn starch and grape juice[J]. Food Chemistry,2019,292(9):6−13.
[21] 马丽苹, 焦昆鹏, 罗磊, 等. 怀山药抗性淀粉理化性质及体外消化性研究[J]. 食品与机械,2017,33(11):41−46. [MA L P, JIAO K P, LUO L, et al. Study on physicochemical properties and digestibility of the resistant starch from Dioscorea opposite Thunb. cv. Huaiqing[J]. Food & Machinery,2017,33(11):41−46. [22] LI X, CHEN W, QING C, et al. Structural and physicochemical properties of ginger (Rhizoma curcumae longae) starch and resistant starch: A comparative study[J].International Journal of Biological Macromolecules, 2020, 144(2): 67−75.
[23] HICHEM B, KADDOUR G. Etherification and cross-linking effect on physicochemical properties of zea mays starch executed at different sequences in 1-butyl-3-methylimidazolium chloride [BMIM]Cl ionic liquid media[J].International Journal of Biological Macromolecules,2019, 125(3): 1118−1127.
[24] XIE Y, ZHANG B, LI M A, et al. Effects of cross-linking with sodium trimetaphosphate on structural and adsorptive properties of porous wheat starches[J]. Food Chemistry,2019,289(6):187−194.
[25] 张国权. 荞麦淀粉理化特性及改性研究[D]. 杨凌: 西北农林科技大学, 2007. ZHANG G Q. Study on physicochemical properties and modification of buckwheat starch[D]. Yangling: Northwest Sci-tech University of Agriculture and Forestry, 2007.
[26] 张丽芳, 宋洪波, 安凤平, 等. 淮山药淀粉及其抗性淀粉理化性质的比较[J]. 中国粮油学报,2014,29(3):24−29. [ZHANG L F, SONG H B, AN F P, et al. Comparison of physicochemical properties of yam starch and its resistant starch[J]. Journal of the Chinese Cereals and Oils Association,2014,29(3):24−29. [27] 刘燕, 王璐颖, 郑晓卫, 等. 山药交联淀粉的制备与表征[J]. 食品研究与开发,2020,41(16):22−30. [LIU Y, WANG L Y, ZHENG X W, et al. Preparation and characterization of cross-linked yam starch[J]. Food Research and Development,2020,41(16):22−30. [28] 欧阳梦云, 王燕, 吴卫国, 等. 响应面试验优化晶种诱导-双酶复合法制备RS3型籼米抗性淀粉工艺[J]. 食品科学,2017,38(18):244−250. [OUYANG M Y, WANG Y, WU W G, et al. Response surface methodology for optimization of preparation process for RS3 type resistant Indica rice starch by seed crystal induction combined with dual-enzymatic hydrolysis[J]. Food Science,2017,38(18):244−250. [29] 刘淑婷, 王颖, 王志辉, 等. 超声-微波协同酶法制备芸豆抗性淀粉工艺优化及结构分析[J]. 中国食品学报,2020,20(5):193−201. [LIU S T, WANG Y, WANG Z H, et al. Process optimization and structure analysis of kidney bean resistant starch prepared by ultrasonic-microwave synergistic enzymatic method[J]. Chinese Journal of Food Science,2020,20(5):193−201. [30] 杜先锋, 许时婴, 王璋. 淀粉糊的透明度及其影响因素的研究[J]. 农业工程学报,2002(1):129−131,4. [DU X F, XU S Y, WANG Z. Study on the transparency of starch paste and its influencing factors[J]. Transactions of the Chinese Society of Agricultural Engineering,2002(1):129−131,4. [31] RAINA C S. Some characteristics of acetylated, cross-linked and dual modified Indian rice starches[J]. European Food Research and Technology,2006,223(4):561−570.
[32] 杨帆, 肖华西, 林亲录, 等. 超声波-湿热法结合酸水解制备大米抗性淀粉及其理化性质研究[J]. 中国粮油学报,2018,33(7):43−50. [YANG F, XIAO H X, LIN Q L, et al. Preparation of rice resistant starch and its physical and chemical properties by ultrasonic-moist heat combined with acid hydrolysis[J]. Journal of the Chinese Cereals and Oils Association,2018,33(7):43−50. [33] XIU T, GUO B Z. Modification of potato starch by using superheated steam[J]. Carbohydrate Polymers:Entific and Technological Aspects of Industrially Important Polysaccharides,2018,198(10):375−384.
[34] 李丽, 邓海燕, 游向荣, 等. 香蕉抗性淀粉的制备及理化特性研究[J]. 中国食品添加剂,2011(6):148−152. [LI L, DENG H Y, YOU X R, et al. Preparation and physical and chemical properties of banana resistant starch[J]. China Food Additives,2011(6):148−152. [35] 郑妍, 曹珏, 方泽栋, 等. 不同方法制备的马铃薯抗性淀粉物化特性研究[J]. 农产品加工,2020(14):10−12,18. [ZHENG Y, CAO J, FANG Z D, et al. Study on physicochemical properties of potato resistant starch prepared by different methods[J]. Agricultural Products Processing,2020(14):10−12,18. [36] ONBIT J, SHIN M, Preparation and stability of resistant starch nanoparticles, using acid hydrolysis and cross-linking of waxy rice starch[J]. Food Chemistry, 2018, 256(8): 77−84.
[37] GUNARATNE A, CORKE H. Functional properties of hydroxypropylated, cross-linked, and hydroxypropylated cross-linked tuber and root starches[J]. Cereal Chemistry,2007,84(1):30−37.
[38] 牛博文, 徐薇, 张彧. 不同化学方法制备的抗性淀粉理化性质及表征研究[J]. 食品工业科技,2020,41(17):19−23,31. [NIU B W, XU W, ZHANG Y. Physical and chemical properties and characterization of resistant starch prepared by different chemical methods[J]. Science and Technology of Food Industry,2020,41(17):19−23,31. [39] CHEN B, DANG L, ZHANG X, et al. Physicochemical properties and micro-structural characteristics in starch from kudzu root as affected by cross-linking[J]. Food Chemistry,2017,219(3):93−101.
[40] MA Z, BOYE J. Research advances on structural characterization of resistant starch and its structure-physiological function relationship: A Review[J]. Critical Reviews in Food Science & Nutrition,2016,58(2):1059−1083.
[41] 杨小玲, 陈佑宁, 赵维, 等. 红薯抗性淀粉的结构表征及性质测定[J]. 中国食品添加剂,2017(10):152−156. [YANG X L, CHEN Y N, ZHAO W, et al. Structural characterization and property determination of sweet potato resistant starch[J]. China Food Additives,2017(10):152−156.





 下载:
下载:
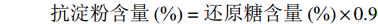
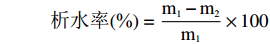


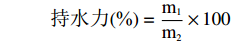








 下载:
下载:
