Research Progress in the Application of Electrospinning Technology in the Protection of Active Ingredients and Probiotics
-
摘要: 随着近几十年来不同纳米技术的迅速发展,将生物活性成分捕获到高分子基质中进行控释已成为一个热门的研究领域。将生物活性成分加入到不同的封装基质中是一种独特的方法,它可以保护这些有价值的成分在不利的体外或体内环境中不致失活,最大限度的提高其稳定性和生物利用率。与传统封装技术相比,静电纺丝技术具有许多优势,如所产纤维的孔隙率高、表面体积比高、结构上与细胞外基质相似以及对生物活性化合物具有高包封率等,这些结构和功能上的优势使得静电纺丝技术在保护生物活性成分方面成为一种更好的选择。本文主要综述了静电纺丝的基本工作原理、纳米纤维聚合物的选择、影响纳米纤维特性的参数,分析了静电纺丝纳米纤维的优势,并探讨了静电纺丝技术在包封不同类型生物活性化合物中的应用,为该技术在食品加工中的深入研究及应用以及相关创新食品的开发提供了参考。Abstract: With the rapid development of different nanotechnologies in recent decades, the capture of bioactive ingredients into polymeric matrices for controlled release has become a popular area of research. Incorporation of bioactive components into different encapsulated matrices is a unique approach to protect these valuable components from inactivation in unfavorable in vitro or in vivo environments, maximizing their stability and bioavailability. Compared with conventional encapsulation techniques, electrospinning technology has many advantages, such as high porosity, high surface volume ratio, structural similarity to the extracellular matrix, and high envelope rate for bioactive compounds, and these structural and functional advantages make electrospinning technology a better choice in protecting bioactive components. This paper reviews the basic working principles of electrostatic spinning, the selection of nanofiber polymers, and the parameters affecting the properties of nanofibers. The advantages of electrostatic spinning nanofibers are analyzed, and the application of electrostatic spinning technology in encapsulating different types of bioactive compounds is discussed, and this paper would provide a reference for the further research and application of this technology in food processing and the development of related innovative foods.
-
Keywords:
- electrostatic spinning /
- active ingredients /
- probiotics /
- protective effect /
- food processing
-
近年来,随着人们对通过饮食改善健康或预防疾病需求的不断增加,生物活性化合物如多酚、维生素、核酸、脂肪酸、生物活性蛋白或肽、益生菌等,在医药、保健品和功能食品领域的潜在应用得到了深入研究[1]。然而,生物活性化合物在加工和储存过程中的不稳定性,以及暴露在上消化道条件下时的低生物利用率或化学不稳定性极大地损害了预期效益,从而限制了其应用[2]。对生物活性物质进行封装可能是克服这个问题较为合适的解决方案[3]。纳米纤维是最有前途的。纳米纤维具有较大的表面积、体积比和优越的机械性能等独特特性,这使得它在构建纳米科学、纳米器件和纳米膜方面有着广泛的应用。
目前利用静电纺丝技术制备纳米纤维在生物活性化合物包封方面具有喜人的优势和潜在的应用前景[4]。静电纺丝技术是一种简单、独特、成本低廉的技术,非常适合大规模生产纳米纤维。静电纺丝纳米纤维的制造技术与传统方法完全不同,在电纺过程中,分散的纤维是在电荷的影响下自组装的,而后者主要取决于机械力和几何条件[5-6]。该技术具有灵活的特点,有多种变体,到目前为止,已有许多方法来制备纳米纤维,如拉伸、相分离、自组装、溶剂热合成、反气相色谱和静电纺丝等,此外,静电纺丝纳米纤维的直径易于控制,且纤维具有连续性以及该技术可生产三维纤维结构,这对材料功能性能在各方面的应用中起着至关重要的作用,可以提高生物活性分子的稳定性和生物利用度,提高益生菌的生存能力等,这对于开发新型功能性食品至关重要。因此,对静电纺丝技术在保护生物活性成分上的开发应用十分必要。本文主要论述了静电纺丝技术的相关内容及其在保护活性成分上的一些应用。
1. 静电纺丝技术
1.1 静电纺丝技术基本原理
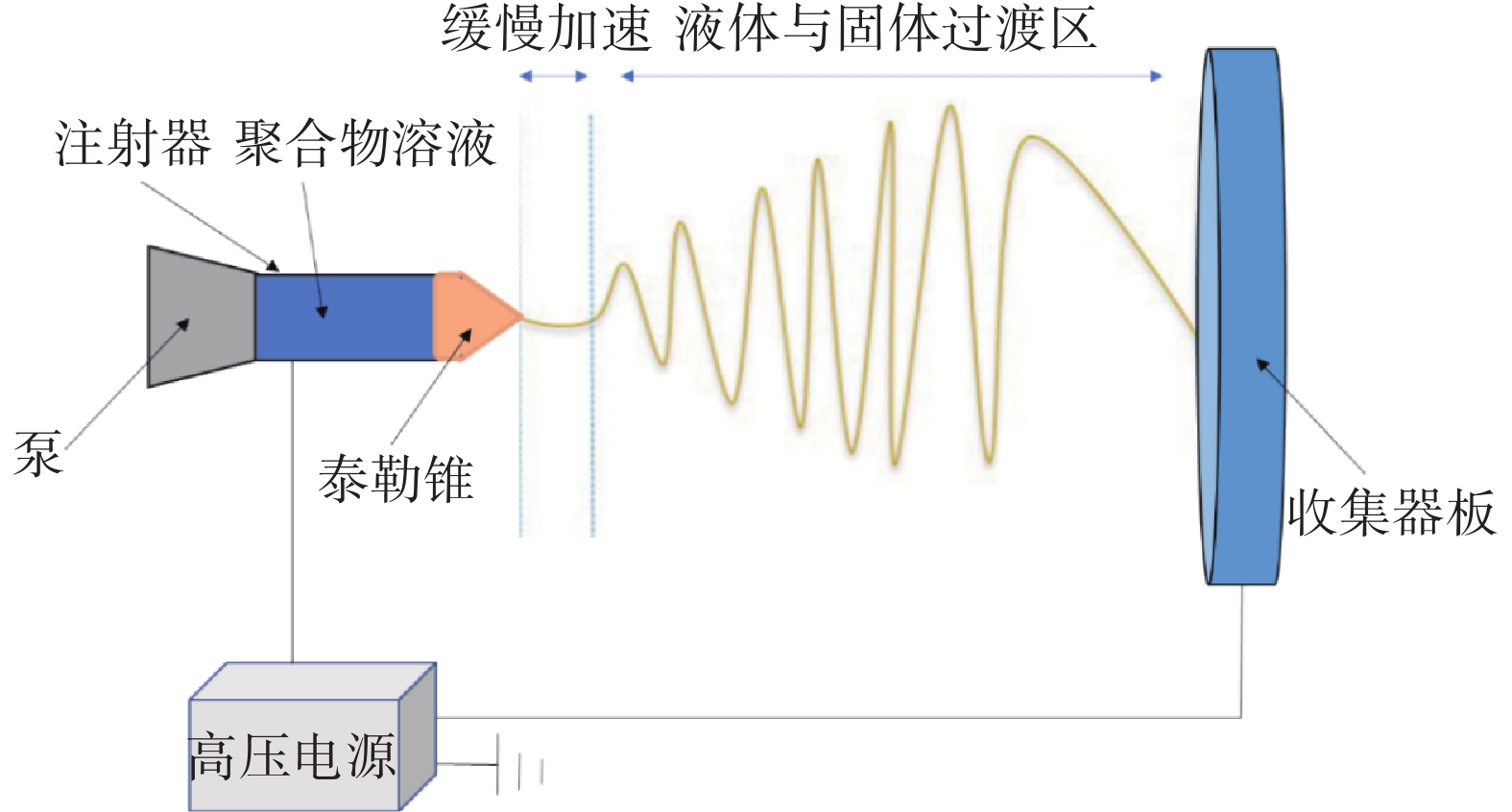
静电纺丝技术起源于19世纪早期,来生产用于纺织和过滤的纳米纤维。从那时起,静电纺丝技术取得了飞速的发展,并使它作为一种可行的纳米纤维制备技术得到了广泛的认可。静电纺丝是一种在强电场作用下,通过导电喷丝板挤出聚合物溶液或熔体,制造纳米级的连续纤维的技术[7]。聚合物和溶剂是这种纳米纤维的基本成分。静电纺丝典型的装置主要包括高压电源、注射泵、由导电材料制成的喷丝板和由接地金属板组成的集电极[8],如图1所示。高压电源的两极分别连接到喷射聚合物溶液的喷嘴和集电极。一旦对喷丝口施加电场,聚合物溶液在电场作用下被拉向集电极。聚合物溶液从针头流出时,在喷丝口附近产生静电荷,积聚的电荷使液滴变形为“泰勒锥”的锥形结构[9]。“泰勒锥”可以描述为聚合物溶液在喷射前表面张力和粘弹性应力作用下附着在孔上的液滴的形状。
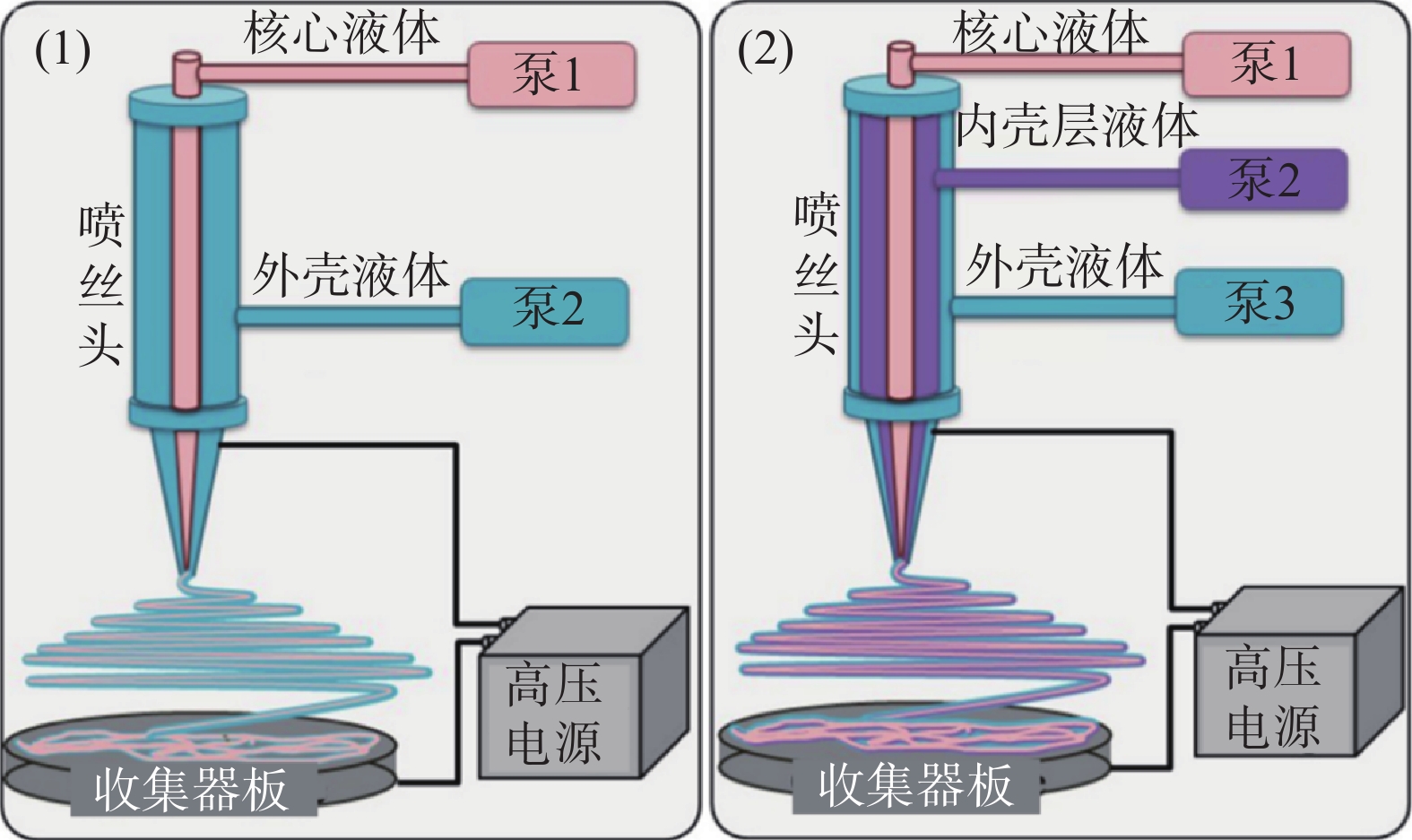
静电纺丝的成功需要形成稳定的“泰勒锥”,“泰勒锥”将使射流变形为连续均匀分布的窄纤维。施加的电场力抵消了聚合物溶液的表面张力,聚合物射流从“泰勒锥”的顶点喷射出来,由于沿射流长度方向存在的排斥性电荷,聚合物射流发生振荡。当溶剂从射流表面蒸发时,射流拉伸停止,纤维变细,集电极收集纤维[10]。此外,使用不同类型的喷丝板和集电极,可以得到许多具有不同性能的纳米纤维[11]。根据喷丝板的不同可分为单轴电纺[12]、同轴电纺[13]和多轴电纺[9],如图2所示。
1.2 纳米纤维聚合物的选择
一方面,从聚合物本身来讲,在存在适当溶剂的情况下,各种各样的天然或合成聚合物均可用于静电纺丝,如聚ε-己内酯(poly(ε-caprolactone),PCL)[14]、聚乳酸(polylactic acid,PLA)[15]、聚乙二醇(polyethylene glycol,PEG)和聚乳酸-羟基乙酸共聚物(poly(lactide-co-glycolide),PLGA)[16]等。这类合成聚合物可直接静电纺丝成超薄纤维结构,用于生物活性成分的传递。但并非所有聚合物都可用于电纺。此外,还有不同的生物活性化合物,如蛋白质、类胡萝卜素、酚类物质和核酸等,可以封装在纤维内或固定在纤维体表面,用于各种食品或生物医学应用。通常情况下,仅应用单一聚合物基体不能充分有效地提供适当的机械特征和降解方式,以实现成功的纺丝。因此,根据聚合物间的生物相容性、可降解性和机械性能等选择适当的合成聚合物与其他生物聚合物基质形成共混纤维基质是一种有效的途径[17]。此外,也有相关文献提供了另一种新思路,即将两种或以上天然聚合物作为共混纤维基质。Mohammadi等[18]将乳清分离蛋白(whey protein isolate,WPI)与瓜尔胶(guar gum,GG)复合,不仅可以增强蛋白质的电纺性,而且有效地提供了一个生物基网络,促进控制生物活性的释放。另一方面,需要根据生物活性成分的理化特性和特定用途来选择不同的聚合物进行组合,以获得适当的降解特性和释放性能[10]。
1.3 影响电纺纤维特性的参数
在静电纺丝过程中,纤维的形态和取向很大程度上取决于溶液的性质和操作条件。
1.3.1 溶液参数
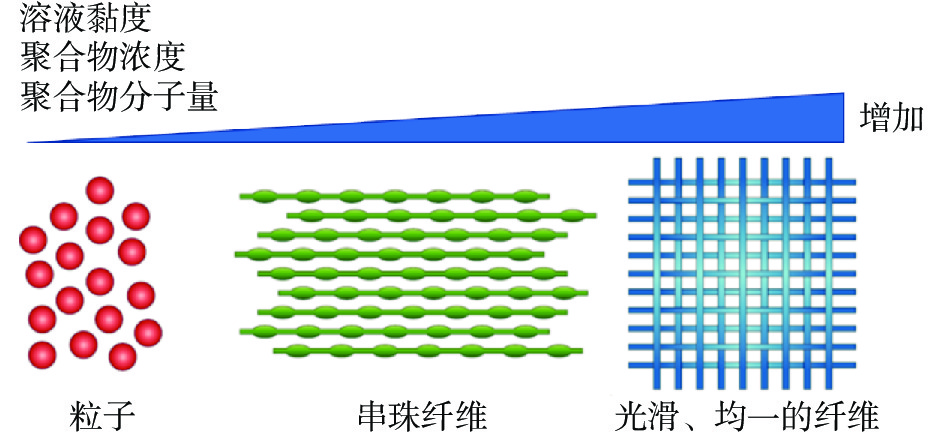
静电纺丝过程中,聚合物溶液的流变性对纤维的形成过程至关重要,溶液的性质如聚合物的分子量、聚合物的浓度、溶液的黏度和聚合物溶液的电导率等直接影响纤维的性能[19],如图3所示。溶液粘度是影响纤维特性和产品质量的重要参数,它与溶质分子量和聚合物浓度有关。一般情况下,静电纺丝纳米纤维通常由高摩尔质量(或粘性)聚合物溶液组成。低浓度聚合物溶液在电纺过程中更倾向于形成纳米液滴而非纳米纤维;中等浓度的聚合物溶液中,分子链相互重叠,但并不能形成足够的纠缠度;对于高浓度的聚合物溶液,分子链的纠缠度足够高,能够形成结构良好的静电纺丝纤维[20]。通常情况下,用于生产纳米纤维的理想溶剂应具有适当的挥发性、互溶性和沸点[19]。当溶剂挥发性低时,不会迅速造成溶剂损失,并形成湿纤维。另一方面,如果溶剂挥发度太高,纤维就不会形成,因为出针后聚合物射流会固化。Rieger等[21]发现,对于含有不同含量肉桂醛的壳聚糖/聚环氧乙烷(PEO)溶液,聚合物浓度的提高使其从珠串形态转变为圆柱形纳米纤维形态,从而证明了聚合物浓度对纳米纤维的影响。此外,随着溶液电导率的增加,纤维直径减小[22]。
1.3.2 加工参数
在静电纺丝过程中,有较多的工艺参数会影响到形成纤维的特性,如聚合物溶液喷射的流速,两个电极间的电压,喷丝口和集电极板之间的距离等[23],如图4所示。电纺电压对纤维形态具有重要影响,纺丝电压较低时,由于电场力较小难以克服溶液自身的表面张力,阻碍了溶液的牵伸和分裂,从而形成的纤维直径较大,反之,电场强度越大,聚合物溶液的射流越容易发生拉伸和分裂,形成直径较小的纳米纤维。Xin等[24]通过改变电纺电压来控制带电聚合物射流的分支和弯曲,以形成“花环”。也有其他研究发现,用静电纺丝可以形成扁平的缎带而非圆形纤维[25]。静电纺丝过程中,纺丝速率由推进注射器的速度决定,纺丝速率的快慢直接影响纤维直径的大小,一般来讲,较低的流速产生的纤维直径较小,高流速生产的纤维直径较大,甚至导致珠状纤维的形成。此外,喷丝口和收集器间的距离直接影响电场的强度和溶剂的挥发,从而影响纤维直径。
1.3.3 环境参数
温度、湿度和气流等环境参数也会影响静电纺丝纤维的特性。温度通过两种对立的影响改变纳米纤维的直径:a.增加溶剂的蒸发率;b.降低溶液的黏度。随着温度的升高,纤维直径降低。另外,低相对湿度是理想的电纺条件,而在高相对湿度时,电纺难以保持和生产连续纤维,纤维上易形成圆形孔隙[26]。
2. 静电纺丝对生物活性成分及益生菌的保护
2.1 多肽和蛋白质
多肽和蛋白质被认为是功能最多的生物分子,它可作为生化反应的催化剂,驱动炎症反应,调节细胞增殖、分化,调节代谢及信号通路等,在制药和医学领域等具有广泛的应用前景。近几十年来,人们将多肽和蛋白质作为生物制剂的兴趣急剧增加。早在1982年,重组胰岛素被美国食品药品监督管理局(food and drug administration,FDA)批准,成为第一个进入市场的重组蛋白类治疗药物[27]。自那时起,超过60种蛋白质药物被FDA批准商业化,还有更多在进行临床试验评估[28]。然而,肽和蛋白质在临床上的应用受到许多阻碍,如易被消化酶降解、生物利用率低、透过生物膜的能力差、半衰期短、不易在血液中发挥作用及结构易发生改变导致活性丧失等[29-30]。这些限制会导致蛋白质应用剂量和给药频率的增加,增加出现有害副作用的可能性。因此,需要一种新的包封和传递系统,既能保持蛋白质的生物活性,又能保护其不被降解。基于此背景,众多研究者作出了相关研究。
2.1.1 抗菌肽
抗菌肽(Antimicrobial Peptides,AMPs)对细菌、病毒和真菌具有广泛的抗菌活性,相比于抗生素需要作用于特定的蛋白质发挥作用而言,抗菌肽可粘附在细菌细胞膜上,嵌入细胞膜,导致细胞破裂及死亡。抗菌肽克服了抗生素的耐药性这一缺陷,近年来被广泛研究作为传统抗生素的替代品用于医药领域[31-32]。
在食品工业中,抗菌肽也被用作食品防腐剂及保鲜剂等,在肉制品、乳制品、饮料及米面制品中均有所应用,然而食品中的物质组成和物理环境均十分复杂,容易影响抗菌肽发挥作用[33]。目前静电纺丝技术在减少抗菌肽与食品成分的相互作用,保持其活性方面以有所应用,Soto等[34]以紫红化蛋白和普鲁兰(pullulan,PUL)作为纳米纤维基质,通过静电纺丝技术将乳酸链球菌素包被在内,加入纤维后,乳酸链球菌素在肉汤和琼脂中对肠膜明串珠菌的抗微生物活性得以维持。此外,Wang等[35]利用静电纺丝技术将抗菌肽Ple加入到超细聚乙烯醇纤维中,并测定了静电纺丝纳米纤维的形态和聚乙烯醇的释放规律。同时,以苹果酒为研究对象,考察了所得纤维在食品系统中的应用潜力。结果表明,在4 ℃条件下14 d内,添加抗菌纳米纤维的苹果酒中的细菌数相比于添加游离的Ple抗菌肽的苹果酒减少了2.5 log10 CFU/mL,表明该静电纺丝纳米纤维能够有效地保持其抗菌活性。由此可见,静电纺丝纳米纤维在有效预防食品的食源性病原体污染和延长其货架期方面具有很大的潜力。
2.1.2 酶
酶在不同温度和pH条件下不稳定,会发生酶变性和催化活性的丧失。为了保持其活性,可以利用电纺丝作为酶的保护性载体,如图5,在需要时将酶快速释放,也可以将酶固定化,即限制在一定区域内。与膜载体相比,电纺丝具有高表面积的优势。已有研究者通过静电纺丝技术合成聚乙烯醇(polyvinyl alcohol,PVOH)膜和多层膜体系(PCL/PVOH/PCL),并将葡萄糖氧化酶封装在PVOH亲水膜内,该亲水膜又被两个疏水的PCL膜保护,结果表明,经静电纺丝处理的膜具有良好的机械性能和抗菌活性,且处理后的酶活性不会降低,适合于酶的固定化[36]。近期,也有研究者通过静电纺丝将α-淀粉酶和辣根过氧化物酶(HRP)作为两种不同的酶进行双重固定化,并比较了它们与单独固定化形式和自由固定化形式的性能,发现并没有对酶的活性产生反向抑制作用,证明了两种或两种以上的酶可以分别与不同的聚合物混合并同时进行静电纺丝[37],这可能会促进多酶系统的应用。
虽然利用纳米纤维固定酶会使酶具有较高的活性,但由于纳米纤维与酶之间的非特异相互作用,酶的高级结构与微环境也会发生变化,使得酶与底物之间的传质阻力增加,导致固定化酶的酶活性降低[38]。因此,先对电纺纤维膜进行修饰再进行酶的固定化是目前静电纺丝纳米纤维膜固定化酶研究中的主要方向之一。
2.1.3 生长因子
生长因子是细胞分泌的可溶性蛋白,具有调节多种细胞过程和组织再生的能力。然而,由于其稳定性低、半衰期短且失活快,临床应用上的生物利用率非常低[39]。为了最大限度提高其有效性和生物适用性,人们将注意力集中在通过物理封装将活性成分封装在三维聚合物基质中。Wang等[40]将载生长因子(Nell-1)的壳聚糖纳米颗粒加入到静电纺丝纳米纤维中,显著延长了Nell-1的释放时间,同时提高了释放的Nell-1的生物活性,这种正向影响是这些分子能更广泛应用于临床的关键。
静电纺丝技术在神经生长因子(nerve growth factor, NGF)对周围神经损伤的修复这一研究领域中同样有所应用,主要体现在利用静电纺丝技术制作神经导管以保证神经生长因子的生物活性以及释放的持续性。在此技术中最初用于NGF递送的材料多为聚己内酯等,但其存在着包埋率低、初始阶段易发生NGF的突然释放及降解期长等缺点,因此针对于NGF递送的新型材料正不断被开发出来[41]。Valmikinathan等[42]在聚己内酯的基础上添加了20%~30%的牛血清白蛋白制成纳米纤维,防止极性溶剂对NGF的破坏,研究结果表明,与聚己内酯纳米纤维相比,添加了牛血清白蛋白制得的纳米纤维对NGF的包封率由26.3%±1.4%上升至88.6%±4.7%,且并未出现NGF的初期突释。由此可知,静电纺丝技术中新型纳米纤维材料的开发是十分重要的一项研究内容,尤其是蛋白质、多糖等天然聚合物材料,由于其具有生物相容性以及安全性、易得性等优点,在静电纺丝技术中有着极大的应用潜力,在食品、环境及医药等领域均有广阔的应用前景。
2.2 脂肪酸
ω-3不饱和脂肪酸是从鱼油中提取出来的活性物质,特别是二十二碳六烯酸(DHA)和二十二碳五烯酸(EPA)对人体预防心血管疾病、改善炎症反应和促进大脑发育等有重要影响。有效保护这些多不饱和脂肪酸免受氧化是十分必要的。据报道,Yang等[43]采用同轴电纺法制备了负载鱼油的芯壳电纺纤维,与单轴电纺相比,同轴电纺明显提高了包被鱼油的抗氧化稳定性,同轴纳米纤维包被鱼油的保质期比单轴纳米纤维长65 d,表明同轴电纺是包被鱼油的有效途径。Xie等[44]采用单轴静电纺丝技术制备了一种新型稳定的脂肪酸(棕榈酸甲酯-月桂酸)共晶/聚丙烯腈(PAN)/纳米铜粉(CNPs)无机相变复合材料(PCM),通过电镜扫描发现,纤维的三维结构完全稳定了液态脂肪酸,且复合材料间的相容性良好。因此,通过静电纺丝包被脂肪酸是一种有效的保护途径。
在食品工业中,静电纺丝技术对ω-3脂肪酸的保护主要体现在减缓其氧化速率方面,但同时也存在其他方面需要注意,如应兼顾ω-3脂肪酸生物利用度与其不利感官属性之间的平衡,以提高消费者的接受度等,因此,还需要开发更多可改善或保护脂肪酸有益特性的技术[45]。
2.3 多酚
姜黄素是一种从姜科植物中提取出来的多酚类物质,具有抑制炎症反应、抗氧化等药理价值。然而,由于姜黄素自身含有多个酚基和双键,对酸、光、热非常敏感,导致其较低的生物利用率,需要合适的载体来实现这种活性成分的控释。已有研究利用壳聚糖和磷脂作为纳米复合纤维基质,来实现姜黄素的递送[46]。除了姜黄素这类脂溶性多酚物质外,也有利用电纺保护水溶性多酚成分的相关报道。Wang等[47]研究发现通过静电纺丝,将原花青素包被在玉米醇溶蛋白纤维中,结果表现出接近100%的高包覆率,且包覆后的原花青素在纤维中保留了抗氧化能力。白藜芦醇因其溶解度低,稳定性差而难以发挥其对人体的健康价值,有研究者采用静电纺丝技术将白藜芦醇包埋在食用性玉米醇溶蛋白纳米纤维中,在模拟胃肠道环境下发现,纳米纤维对白藜芦醇具有有效的保护作用,且包膜的白藜芦醇与天然白藜芦醇生物可及性相比高出19.5%[48],证明电纺确实对提高其生物利用率有重要作用。在食品工业中,多酚类化合物作为天然抗氧化剂添加到食品中时易在热处理的条件下与食品的复杂组分发生反应,使其活性损失,并可能导致风味、色泽发生变化,因此食品热加工体系中如何利用静电纺丝技术保护多酚物质的热稳定性是非常值得关注与研究的问题。姚飞等[49]利用静电纺丝技术制备负载茶多酚的花生分离蛋白-聚乳酸复合纳米纤维薄膜,并通过热重分析比较包封前后的茶多酚活性,结果表明,当温度升至150 ℃左右,茶多酚的质量开始明显下降;当温度升至200 ℃左右时,负载茶多酚的纳米纤维膜质量开始出现下降的趋势,即纳米纤维膜能够有效提高茶多酚的热稳定性,在作为包埋多酚等活性物质的载体方面具有一定的应用前景。
2.4 维生素
维生素是人体必需的微量营养素,在体内具有许多生化功能。然而,它们在加工、储存以及被胃肠道吸收前很容易发生降解。因此,需要对其进行有效封装,以保持其稳定性。α-生育酚是维生素E中生物活性最强的一种。Fabra等[50]通过研究发现,将α-生育酚分别添加到乳清分离蛋白、大豆分离蛋白和玉米醇溶蛋白三种胶体基质中进行电纺,均能提高α-生育酚的稳定性,其中,以玉米醇溶蛋白为外壳材料时,α-生育酚的封装率最高。同样地,Aytac等[51]将α-生育酚封装到β-糊精中形成包合物,然后再用聚己内酯进行电纺,结果表明,掺杂包合物的电纺纤维与未掺杂的相比更具抗氧化性,对α-生育酚抗氧化分子的控释效果更好。此外,也有研究表明,通过静电纺丝将维生素A和维生素E结合到明胶中,维生素A和维生素E的释放可以超过60 h,证明电纺纤维的封装可以减少维生素释放过程中的降解[52]。叶酸在光照和酸性条件下易降解,基于这种限制,已有研究将苋菜分离蛋白质作为包封基质材料,这种封装结构增加了叶酸的热稳定性,包封率超过95%[53],这对食品的加工十分有益。
以上研究表明将维生素通过静电纺丝技术制成纳米纤维可以提高维生素的生物利用率,同时也有表明维生素可以使纳米纤维具有抗氧化等功能特性,因此利用静电纺丝技术不仅可以实现对维生素的保护,也可以制备具有抗氧化性能及抗菌特性的包装材料,进一步保证了被包装食品的质量。
2.5 核酸
核酸(如DNA、RNA)被认为在治疗神经退行性疾病、癌症和免疫疾病等方面有很大潜力,但由于它们在生物环境中的不稳定性、免疫原性和毒性,在临床应用上仍具有挑战[54]。Nguyen等[55]设计了一种由对齐的聚ε-己内酯-共乙基磷酸乙酯(PCLEEP)静电纺丝纳米纤维组成的支架,以三维构型分布在胶原水凝胶中。并通过静电纺丝技术将NT-3和miR-222加入到该支架中。结果发现在第一个月内总共释放了27.1% 的miRNA,随后2个月稳定释放,植入后10 d,miRNA的递送可支持小鼠轴突再生。Li等[56]通过将可生物降解的聚阳离子电纺丝与基于迭代溶液的多层涂层相结合,创建了用于基因传递的可生物降解的聚电解质表面和一种新的DNA释放系统。实验结果表明,这种系统可在24 h内持续释放DNA,并使其在原代恶性胶质瘤细胞中高效表达。因此,静电纺丝制备的纳米纤维因其作为核酸包封和控释载体的潜力而受到特别关注。近年来,DNA或RNA的二维和三维纳米结构已被成功合成,然而,有关基因修饰的机制还需要进行更多的研究,且肿瘤形成、心血管和神经元障碍的靶基因和相关信号通路的识别也是一个很大的挑战,相信随着技术的不断成熟,静电纺丝技术与纳米载体很可能会被批准用于临床中疾病的诊断治疗。
2.6 其他成分及益生菌
除上述列举的活性成分外,还有一些其他成分及益生菌也可通过静电纺丝得以实现最大效用。例如:槲皮素因其暴露在胃肠道环境条件下的化学不稳定性限制了潜在的健康价值,而阿魏酸由于自身对光和氧气的敏感性在添加到功能性食品的过程中利用率很低;针对以上两个问题,有研究者利用静电纺丝技术将槲皮素和阿魏酸封装在PUL超薄纤维中,在体外消化过程中观察到槲皮素和阿魏酸从PUL静电纺纤维中持续释放,与游离化合物相比,有助于提高其抗氧化能力[57]。因此,研究开发的静电纺结构在生物活性保护方面的应用在功能食品中具有广阔的应用前景。
益生菌及其制品在加工和口服过程中受胃肠道环境的影响容易造成活性损失,使其无法得到更广泛的应用[58],静电纺丝技术可以很好的改善这一问题。有研究者发现将阿拉伯胶(gum arabic,GA)与PUL结合通过电纺包被乳酸菌,与天然阿拉伯胶基纤维相比,GA/PUL复合纳米纤维具有更好的热稳定性,且这种电纺纤维与冷冻干燥相比,乳酸菌存活率更高[59]。Katija等[60]发现通过静电纺丝合成的复合纳米纤维中的植物乳杆菌细胞在低温下可在24周内保持稳定,从而达到与冻干产品相当的稳定性。Feng等[61]通过同轴静电纺丝制备了一种新型的双层包封载体,并将益生菌成功包被在内,研究发现,在纤维毡中的益生菌表现出对模拟胃肠液环境和热处理更强的耐受性,其活性也没有显著下降。以上研究不仅证明了通过静电纺丝包封益生菌的有效性,更是进一步预测了静电纺丝技术在食品工业领域的广阔应用前景。
3. 结语
静电纺丝是一种很有前途的包裹生物活性化合物的方法,它不需要任何苛刻的温度、压力或化学物质条件。同时,它也是制备微纳米级纤维最简单、最通用、最经济的技术之一,在食品工业中有很好的应用前景。但静电纺丝技术在规模化生产过程中纤维生产速率较慢,因此仍需要不断改进技术,开发更多类型的电纺以提高生产效率。此外,目前的纺丝材料多为合成聚合物,以多糖和蛋白质等物质为代表的天然聚合物作为材料的纺丝技术仍需进一步研究。最后,随着各学科之间的交叉融合以及食品工业的创新发展,将静电纺丝技术与其他技术结合而产生的新技术将会拥有更广的应用范围,静电纺丝技术会因更多新材料、新设备的产生而日趋完善,必将为开发安全、稳定、高品质的新型食品提供新的发展契机,在未来纳米封装领域中,静电纺丝技术会有更加出色的表现。
-
-
[1] DIAS M I, FERREIRA I C F R, BARREIRO M F. Microencapsulation of bioactives for food applications[J]. Food & Function,2015,6(4):1035−1052.
[2] WEN P, ZONG M H, LINHARDT R J, et al. Electrospinning: A novel nano-encapsulation approach for bioactive compounds[J]. Trends in Food Science & Technology,2017,70:56−68.
[3] ZAHRA, AKBARBAGLU, SEID, et al. Influence of spray drying encapsulation on the retention of antioxidant properties and microstructure of flaxseed protein hydrolysates[J]. Colloids & Surfaces B Biointerfaces,2019,178:421−429.
[4] TORKAMANI A E, ABIDIN S Z, HANI N M, et al. Encapsulation of polyphenolic antioxidants obtained from Momordica charantia fruit within zein/gelatin shell core fibers via coaxial electrospinning[J]. Food Bioscience,2018,21:60−71. doi: 10.1016/j.fbio.2017.12.001
[5] RENEKER D H, YARIN A L, FONG H, et al. Bending instability of electrically charged liquid jets of polymer solutions in electrospinning[J]. Journal of Applied Physics,2000,87(9):4531−4547. doi: 10.1063/1.373532
[6] WONG S C, BAJI A, LENG S. Effect of fiber diameter on tensile properties of electrospun poly(ɛ-caprolactone)[J]. Polymer,2008,49(21):4713−4722. doi: 10.1016/j.polymer.2008.08.022
[7] ANABELA M, DAN L, LESLEY O, et al. Protein encapsulation by electrospinning and electrospraying[J]. Journal of Controlled Release,2020,329:1172−1197.
[8] SAJEDEH, KHORSHIDI, ATEFEH, et al. A review of key challenges of electrospun scaffolds for tissue-engineering applications[J]. Journal of Tissue Engineering & Regenerative,2016,10(9):715−738.
[9] KHALF A, MADIHALLY S V. Recent advances in multiaxial electrospinning for drug delivery[J]. European Journal of Pharmaceutics and Biopharmaceutics,2016,112:1−17.
[10] ROSTAMABADI H, ASSADPOUR E, SHAHIRITABARESTANI H, et al. Electrospinning approach for nanoencapsulation of bioactive compounds; recent advances and innovations[J]. Trends in Food Science & Technology,2020,100:190−209.
[11] CHEN Z, CHEN Z, ZHANG A, et al. Electrospun nanofibers for cancer diagnosis and therapy[J]. Biomaterials Science,2016,4(6):922−932. doi: 10.1039/C6BM00070C
[12] ISIK B S, ALTAY F, CAPANOGLU E. The uniaxial and coaxial encapsulations of sour cherry(Prunus cerasus L. ) concentrate by electrospinning and their in vitro bioaccessibility[J]. Food Chemistry,2018,265:260−273. doi: 10.1016/j.foodchem.2018.05.064
[13] VYSLOUŽILOVÁ L, BUZGO M, POKORNÝ P, et al. Needleless coaxial electrospinning: A novel approach to mass production of coaxial nanofibers[J]. 2017, 516(1-2): 293-300.
[14] RAFIEI M, JOOYBAR E, ABDEKHODAIE M J, et al. Construction of 3D fibrous PCL scaffolds by coaxial electrospinning for protein delivery[J]. Materials Science and Engineering C,2020,113:110913. doi: 10.1016/j.msec.2020.110913
[15] ALHARBI H F, LUQMAN M, FOUAD H, et al. Viscoelastic behavior of core-shell structured nanofibers of PLA and PVA produced by coaxial electrospinning[J]. Polymer Testing,2018,67:136−143. doi: 10.1016/j.polymertesting.2018.02.026
[16] LUU Y K, KIM K, HSIAO B S, et al. Development of a nanostructured DNA delivery scaffold via electrospinning of PLGA and PLA-PEG block copolymers[J]. Journal of Controlled Release,2003,89(2):341−353. doi: 10.1016/S0168-3659(03)00097-X
[17] JAIN R, SHETTY S, YADAV K S. Unfolding the electrospinning potential of biopolymers for preparation of nanofibers[J]. Journal of Drug Delivery Science and Technology,2020,57:101604. doi: 10.1016/j.jddst.2020.101604
[18] MOHAMMADI M A, RAMAZANI S, ROSTAMI M, et al. Fabrication of food-grade nanofibers of whey protein isolate-guar gum using the electrospinning method[J]. Food Hydrocolloids,2019,90:99−104. doi: 10.1016/j.foodhyd.2018.12.010
[19] AHMED F E, LALIA B S, HASHAIKEH R. A review on electrospinning for membrane fabrication: Challenges and applications[J]. Desalination,2015,356:15−30. doi: 10.1016/j.desal.2014.09.033
[20] HMI A, AK B. A review on electrospun polymeric nanofibers: Production parameters and potential applications[J]. Polymer Testing,2020,90:106647. doi: 10.1016/j.polymertesting.2020.106647
[21] RIEGER K A, BIRCH N P, SCHIFFMAN J D. Electrospinning chitosan/poly(ethylene oxide) solutions with essential oils: Correlating solution rheology to nanofiber formation[J]. Carbohydr Polym,2016,139:131−138. doi: 10.1016/j.carbpol.2015.11.073
[22] HAIDER A, HAIDER S, KANG I K. A comprehensive review summarizing the effect of electrospinning parameters and potential applications of nanofibers in biomedical and biotechnology[J]. Arabian Journal of Chemistry,2018,11(8):1165−1188. doi: 10.1016/j.arabjc.2015.11.015
[23] ROSTAMI M R, YOUSEFI M, KHEZERLOU A, et al. Application of different biopolymers for nanoencapsulation of antioxidants via electrohydrodynamic processes[J]. Food Hydrocolloids,2019,97:105170. doi: 10.1016/j.foodhyd.2019.06.015
[24] XIN Y, RENEKER D H. Garland formation process in electrospinning[J]. Polymer,2012,53(16):3629−3635. doi: 10.1016/j.polymer.2012.05.060
[25] QING D, DR HARDING, Y HONG, et al. Helical peanut-shaped poly(vinyl pyrrolidone) ribbons generated by electrospinning[J]. Polymer,2013,54(25):6752−6759. doi: 10.1016/j.polymer.2013.10.029
[26] YAZGAN G, POPA A M, ROSSI R M, et al. Tunable release of hydrophilic compounds from hydrophobic nanostructured fibers prepared by emulsion electrospinning[J]. Polymer,2015,66:268−276. doi: 10.1016/j.polymer.2015.04.045
[27] CLARK A L, KNIGHT G, WILES P, et al. Biosynthetic human insulin in the treatment of diabetes. A double-blind crossover trial in established diabetic patients[J]. Lancet,1982,320(8294):354−357. doi: 10.1016/S0140-6736(82)90548-7
[28] LEE C L, HARRIS J L, KHANNA K K, et al. A comprehensive review on current advances in peptide drug development and design[J]. International Journal of Molecular Sciences,2019,20(10):2383. doi: 10.3390/ijms20102383
[29] LWA B , TJB A , CAPA B. Oral delivery of protein-based therapeutics: Gastroprotective strategies, physiological barriers and in vitro permeability prediction-ScienceDirect[J]. International Journal of Pharmaceutics, 585: 119448.
[30] PARDRIDGE W M. Blood-brain barrier and delivery of protein and gene therapeutics to brain[J]. Frontiers in Aging Neuroscience,2020,11:373. doi: 10.3389/fnagi.2019.00373
[31] DEWANGAN R P, BISHT G S, SINGH V P, et al. Design and synthesis of cell selective α/β-diastereomeric peptidomimetic with potent in vivo antibacterial activity against methicillin resistant S. aureus[J]. Bioorganic Chemistry,2017:538−547.
[32] NGUYEN L T, HANEY E F, VOGEL H J. The expanding scope of antimicrobial peptide structures and their modes of action[J]. Trends in Biotechnology,2011,29(9):464−472. doi: 10.1016/j.tibtech.2011.05.001
[33] 孟德梅, 孙雪晴, 石林玥, 等. 抗菌肽应用于食品中的研究现状及面临的挑战[J]. 食品研究与开发,2020,41(8):218−224. [MENG D M, SUN X Q, SHI L Y, et al. Research progresses and challenges of antimicrobial peptides for application in food filed[J]. Food Research and Development,2020,41(8):218−224. doi: 10.12161/j.issn.1005-6521.2020.08.036 [34] SOTO K M, HERNÁNDEZ-ITURRIAGA M, LOARCA-PIN˜A G, et al. Stable nisin food-grade electrospun fibers[J]. Journal of Food Science & Technology,2016,53(10):3787−3794.
[35] WANG X, YUE T, LEE T C. Development of pleurocidin-poly(vinyl alcohol) electrospun antimicrobial nanofibers to retain antimicrobial activity in food system application[J]. Food Control,2015,54:150−157. doi: 10.1016/j.foodcont.2015.02.001
[36] ALONSO-GONZÁLEZ M, CORRAL-GONZÁLEZ A, FELIX M, et al. Developing active poly(vinyl alcohol)-based membranes with encapsulated antimicrobial enzymes via electrospinning for food packaging[J]. International Journal of Biological Macromolecules,2020,162:913−921. doi: 10.1016/j.ijbiomac.2020.06.217
[37] EL-SHISHTAWY R M, ALDHAHRI M, ALMULAIKY Y Q. Dual immobilization of α-amylase and horseradish peroxidase via electrospinning: A proof of concept study[J]. International Journal of Biological Macromolecules,2020,163:1353−1360. doi: 10.1016/j.ijbiomac.2020.07.278
[38] 代云容, 牛军峰, 殷立峰, 等. 静电纺丝纳米纤维膜固定化酶及其应用[J]. 化学进展,2010,22(9):1808−1818. [DAI Y R, NIU J F, YIN L F, et al. Electrospun nanofiber membranes as supports for enzyme immobilization and its application[J]. Progress in Chemistry,2010,22(9):1808−1818. [39] WANG Z, WANG Z, WILLIAM, et al. Novel biomaterial strategies for controlled growth factor delivery for biomedical applications[J]. NPG Asia Materials,2017,9(10):e435. doi: 10.1038/am.2017.171
[40] WANG C, HOU W, GUO X, et al. Two-phase electrospinning to incorporate growth factors loaded chitosan nanoparticles into electrospun fibrous scaffolds for bioactivity retention and cartilage regeneration[J]. Mater Sci Eng C Mater Biol Appl,2017,79:507−515. doi: 10.1016/j.msec.2017.05.075
[41] SCHNELL E, KLINKHAMMER K, BALZER S, et al. Guidance of glial cell migration and axonal growth on electrospun nanofibers of poly-epsilon-caprolactone and a collagen/poly-epsilon-caprolactone blend[J]. Biomaterials Science,2007,28(19):3012−3025. doi: 10.1016/j.biomaterials.2007.03.009
[42] VALMIKINATHAN C M, DEFRODA S, YU X. Polycaprolactone and bovine serum albumin based nanofibers for controlled release of nerve growth factor[J]. Biomacromolecules,2009,10(5):1084−1089. doi: 10.1021/bm8012499
[43] YANG H, WEN P, FENG K, et al. Encapsulation of fish oil in a coaxial electrospun nanofibrous mat and its properties[J]. RSC Advances,2017,7(24):14939−14946. doi: 10.1039/C7RA00051K
[44] XIE N, NIU J, GAO X, et al. Fabrication and characterization of electrospun fatty acid form: Table phase change materials in the presence of copper nanoparticles[J]. International Journal of Energy Research,2020,44(11):8567−8577. doi: 10.1002/er.5543
[45] 张昭, 徐珍霞, 董绪燕, 等. ω-3脂肪酸微胶囊制备方法的研究进展[J]. 中国食物与营养,2020,26(2):41−45. [ZHANG Z, XV Z X, DONG X Y, et al. Research progress on preparation methods of ω-3 fatty acid microcapsules[J]. Food and Nutrition in China,2020,26(2):41−45. doi: 10.3969/j.issn.1006-9577.2020.02.009 [46] MENDES A C, GORZELANNY C, HALTER N, et al. Hybrid electrospun chitosan-phospholipids nanofibers for transdermal drug delivery[J]. Int J Pharm,2016:48−56.
[47] WANG H, HAO L, NIU B, et al. Kinetics and antioxidant capacity of proanthocyanidins encapsulated in zein electrospun fibers by cyclic voltammetry[J]. Journal of Agricultural,2016,64(15):3083−3090.
[48] LEENA M M, YOHA K S, MOSES J A, et al. Edible coating with resveratrol loaded electrospun zein nanofibers with enhanced bioaccessibility[J]. Food Bioscience,2020,36:100669. doi: 10.1016/j.fbio.2020.100669
[49] 姚飞, 陈复生, 郝明飞. 负载茶多酚的花生分离蛋白-聚乳酸纳米纤维膜的制备及抗菌性能研究[J]. 食品工业科技,2021,42(13):6. [YAO F, CHEN F S, HAO M F. Preparation and antibacterial properties of peanut protein isolate-polylactic acid nanofiber membrane loaded with tea polyphenols[J]. Science and Technology of Food Industry,2021,42(13):6. [50] FABRA M J, LÓPEZ-RUBIO A, LAGARON J M. Use of the electrohydrodynamic process to develop active/bioactive bilayer films for food packaging applications-ScienceDirect[J]. Food Hydrocolloids,2016,55:11−18. doi: 10.1016/j.foodhyd.2015.10.026
[51] AYTAC Z, UYAR T. Antioxidant activity and photostability of α-tocopherol/β-cyclodextrin inclusion complex encapsulated electrospun polycaprolactone nanofibers[J]. European Polymer Journal,2016,79:140−149. doi: 10.1016/j.eurpolymj.2016.04.029
[52] LI H, LI H, WANG M, et al. Electrospun gelatin nanofibers loaded with vitamins A and E as antibacterial wound dressing materials[J]. RSC Advances,2016,6(55):50267−50277. doi: 10.1039/C6RA05092A
[53] ACEITUNO-MEDINA M, MENDOZA S, LAGARON J M, et al. Photoprotection of folic acid upon encapsulation in food-grade amaranth(Amaranthus hypochondriacus L. ) protein isolate-pullulan electrospun fibers[J]. LWT-Food Science and Technology,2015,62(2):970−975. doi: 10.1016/j.lwt.2015.02.025
[54] SRIDHARAN K, GOGTAY N J. Therapeutic nucleic acids: Current clinical status[J]. British Journal of Clinical Pharmacology,2016,82(3):659−672. doi: 10.1111/bcp.12987
[55] NGUYEN L H, GAO M, LIN J, et al. Three-dimensional aligned nanofibers-hydrogel scaffold for controlled non-viral drug/gene delivery to direct axon regeneration in spinal cord injury treatment[J]. Scientific Reports,2017,7(1):1−12. doi: 10.1038/s41598-016-0028-x
[56] LI C, TZENG S Y, TELLIER L E, et al. (3-Aminopropyl)-4-methylpiperazine end-capped poly(1, 4-butanediol diacrylate-co-4-amino-1-butanol)-based multi layer films for gene delivery[J]. ACS Applied Materials & Interfaces,2013,5(13):5947−5953.
[57] ACEITUNO-MEDINA M, MENDOZA S, RODRÍGUEZ B A, et al. Improved antioxidant capacity of quercetin and ferulic acid during in-vitro digestion through encapsulation within food-grade electrospun fibers[J]. Journal of Functional Foods,2015,12:332−341. doi: 10.1016/j.jff.2014.11.028
[58] STOJANOV S, BERLEC A. Electrospun nanofibers as carriers of microorganisms, stem cells, proteins, and nucleic acids in therapeutic and other applications[J]. Frontiers in Bioengineering and Biotechnology,2020,8:130. doi: 10.3389/fbioe.2020.00130
[59] MA J, XU C, YU H, et al. Electro-encapsulation of probiotics in gum arabic-pullulan blend nanofibres using electrospinning technology[J]. Food Hydrocolloids,2021,111:106381. doi: 10.1016/j.foodhyd.2020.106381
[60] KATJA ŠKRLEC, ŠPELA ZUPANČIČ, SONJA PRPAR MIHEVC, et al. Development of electrospun nanofibers that enable high loading and long-term viability of probiotics[J]. European Journal of Pharmaceutics and Biopharmaceutics,2019,136:108−119. doi: 10.1016/j.ejpb.2019.01.013
[61] FENG K, HUANG R M, WU R Q, et al. A novel route for double-layered encapsulation of probiotics with improved viability under adverse conditions[J]. Food Chemistry,2019,310:125977.





 下载:
下载:


 下载:
下载:
