Research Progress of Selenium Detection in Human Body and Development of Selenium-rich Food
-
摘要: 硒元素在抗氧化和疾病预防中发挥着不可忽视的作用,近些年来有关硒与人体健康的关系研究越来越多,尤其是硒的生理功能与疾病之间的相关性。因此,通过适当的硒检测技术精准测定人体内硒含量,进而反映人体内硒水平对指导精准化补硒具有重要意义。由于人体所需的硒不能由自身合成,需要通过外界摄入,日常补硒方式中,膳食补硒较硒营养补充剂更为合适。富硒食品作为膳食补硒的主要来源,开发富硒食品对膳食补硒具有重要意义。本文详细阐述了硒在人体的吸收代谢途径,介绍了有机硒和无机硒在人体内的吸收方式及转运途径。同时阐述了用于精确表征人体硒水平的硒生物标记物,包括传统硒生物标记物和新兴标记物。此外,结合标记物对传统硒检测技术进行了分析,并针对分析出的不足,从新型硒检测技术中检测前预处理优化、技术联用及技术创新等方面出发,开展了相关论述。富硒食品的开发对膳食补硒具有重要的价值,概述了天然和人工富硒食品,并重点介绍了生物转化方式和纳米技术在人工富硒食品开发中的应用。Abstract: Selenium plays an important role in anti-oxidation and disease prevention. In recent years, more and more studies have been conducted on the relationship between Selenium and human health, especially the correlation between the physiological functions of Selenium and diseases. Therefore, the characterization of Selenium levels in the human body requires appropriate Selenium detection technology to accurately determine the Selenium content in the human body, which is of great significance for guiding accurate selenium supplementation. Since the Selenium needed by the human body cannot be synthesized by itself and needs to be taken in from the outside, dietary Selenium supplementation is more suitable as a daily Selenium supplementation method than Selenium nutritional supplements. As the main source of dietary Selenium, its development is of great significance to dietary Selenium. This review describes the absorption and metabolism pathways of organic and inorganic Selenium in the human body in detail, and introduces their absorption methods and transport pathways. At the same time, the Selenium biomarkers used to accurately characterize the human Selenium level are described, including traditional Selenium biomarkers and emerging markers. In addition, the traditional Selenium detection technology is analyzed in combination with markers. Regarding the shortcomings in the traditional technology, the new Selenium detection technology is described with the optimization of pre-detection pre-treatment, technical combination and technological innovation as the main content. The development of Selenium-enriched food has important value for dietary Selenium supplementation. Natural and artificial Selenium-enriched foods are described, and the application of biotransformation methods and nanotechnology in the development of artificial Selenium-enriched foods is highlighted.
-
硒是人体必需的微量元素之一,具有化学预防、抗炎和抗病毒等特性,同时其抗氧化活性可以减少自由基对机体的毒害[1],对维持人体健康起到了重要作用。众多研究表明,大骨节病和克山病[2-3]是典型的体内缺硒引起的疾病,随着硒对人体作用的不断研究,人们发现缺硒还会引起代谢紊乱[4-5]。人体内的硒水平分为三种情况[6]:痕量硒浓度维持机体正常生长发育;中等硒浓度维持功能稳定;过高的硒浓度则会引发毒害作用,如指甲的非正常脱落、皮肤病变及神经系统受损等。由于硒在人体内的安全浓度范围很小[7],所以准确测定人体内硒含量,对避免盲目补硒至关重要。目前,针对原有硒水平检测技术的局限和缺点,已经出现了很多优化或者新建立的新型硒检测技术[8]。
膳食是人体补充硒的主要形式,若人体硒水平检测结果显示体内缺乏硒元素,则需要通过摄入优质富硒食品补充硒元素。食物中的硒元素一般是通过从土壤到植物或者从植物到动物转移得到的,所以食品中硒元素含量与土壤中硒元素含量有密切关系[9],富硒地区和低硒地区的动植物食品中硒含量有显著差异。由于我国约51%的土壤处于低硒状态,仅仅依靠日常饮食远远不能满足世界卫生组织建议的30~40 μg/d硒摄入量[10]。因此,富硒食品的开发利用对补充硒和维持合理硒水平有重要作用,目前,已发现多种可供人类安全食用的富硒食品,世界上也有很多科研人员致力于研究开发新的富硒食品,从而实现精准补硒。
有关硒与人体健康的关系日益受到重视,详细阐述硒在人体内的吸收与代谢途径,以及能够精准测定人体内硒含量的硒检测技术,对指导精准化补硒的建立是必要的。在补硒方式的选择上,由于人体所需的硒不能由自身合成,需要通过外界摄入,日常中膳食补硒是重要的补硒方式。因此,富硒食品的开发利用对补充硒和维持合理硒水平有重要应用价值。
1. 硒在人体的吸收与代谢
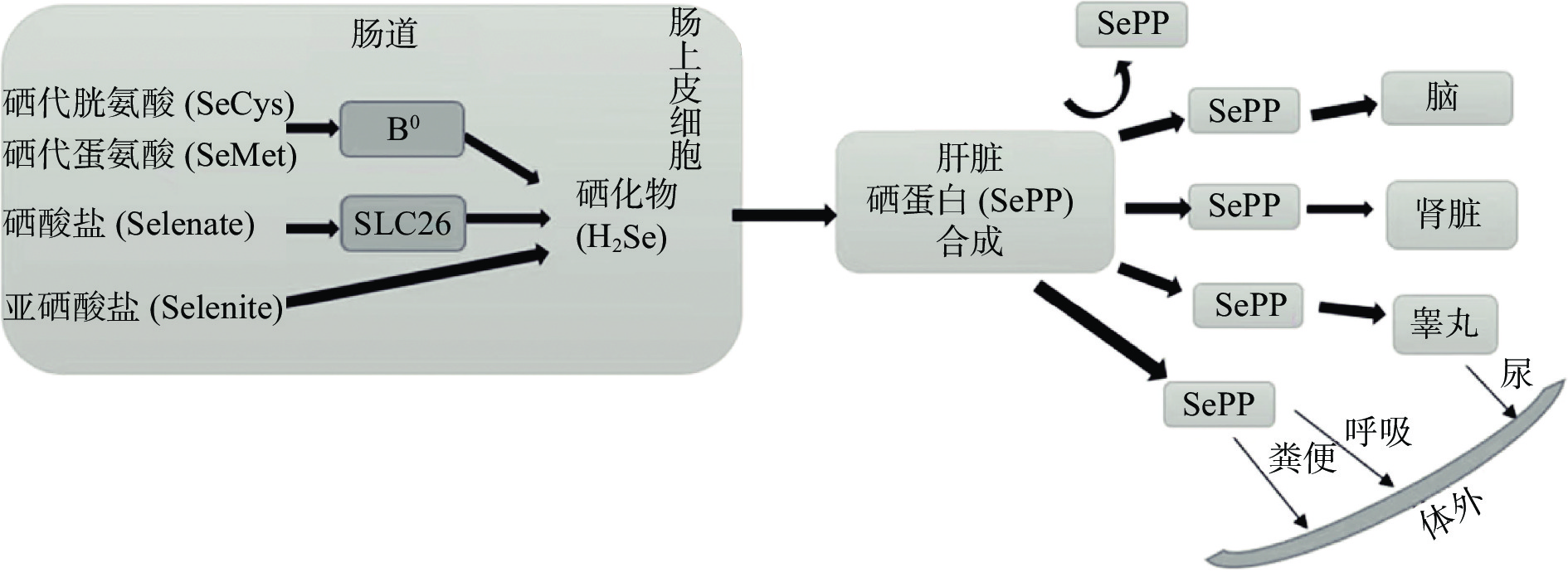
如图1所示,食物中的硒一般通过肠道被吸收进入体内[11]。其中,硒的有机形式主要是硒代氨基酸,包括硒代蛋氨酸、甲基硒代半胱氨酸和硒代半胱氨酸,与吸收硫氨基酸的方式相同,其通过活性钠依赖系统被肠道吸收[12]。无机硒则主要以硒酸盐和亚硒酸盐的形式存在。与吸收硫酸盐的方式相同,硒酸盐和亚硒酸盐穿过肠刷状边界膜后,在膜上利用钠促进和能量依赖方式被吸收[13]。硒的吸收效率与硒的形态有关,吸收率由高到低依次为硒代蛋氨酸>甲基硒代半胱氨酸>硒酸盐>亚硒酸盐[13]。摄入的硒经过肠道吸收后,以小分子形式从门静脉释放到肝脏中进行转运。在肝脏中,硒代氨基酸的整体转运主要由B0和b0+rBAT系统主导,硒酸盐的转运通过被动运输实现,需要依赖于SLC26转运蛋白家族[14]。
硒化物(H2Se)是有机硒和无机硒化合物代谢相互转化的中间体[15]。其中,硒代蛋氨酸可以借助肠道细菌蛋氨酸酶的催化释放硒化物[16]。甲基硒半胱氨酸是由胱硫醚-γ-裂合酶催化为甲基硒醇(CH3SeH),再脱甲基形成硒化物[17]。亚硒酸盐还原为硒化物,一是由硫氧还蛋白还原酶(TXNRD)和硫氧还蛋白直接作用;二是与谷胱甘肽反应生成亚硒二谷胱甘肽,还原为谷氨硫醇后再与谷胱甘肽反应生成硒化物[18]。从肠道内腔吸收的硒被转化为硒化物后,可以作为硒源掺入硒蛋白中,由血液运输至全身各个组织和器官,已知硒进入脑、肾脏和睾丸的机制为受体介导过程,并且在肾脏和睾丸中硒具有更高的保留率[19]。低摄入量硒被利用和代谢后通过尿液排泄,高摄入量的硒在体内转化为硒化物后,通过甲基转移酶依次添加甲基转化为甲基硒醇、二甲基硒化物,由呼吸和粪便排出,二甲基硒化物再甲基化为三甲基硒,由尿液排出[15]。
2. 人体内硒的测定
硒在人体内的安全浓度范围非常窄,缺乏和过度摄入都将影响人体健康。精确表征人体硒水平需要通过测定硒生物标记物来实现,由于不同标记物之间存在差异,在对硒标记物的预处理及检测方法的选择上往往会有不同。随着检测技术的不断创新和人们对体内硒标记物的不断了解,新的检测技术及硒标记物被开发出来。技术的发展为新标记物的发现提供了基础,而新标记物会对检测技术提出更高的需求,从而促进技术的进一步发展,两者共同推进了测定人体内硒的研究。因此,确定合适的硒生物标记物和快速有效的硒检测技术一直是研究的重点内容,以便高精度地确定人体硒状态。
2.1 硒生物标记物
生物标记物指能反映生物体与环境因素相互作用引起的生理、生化、免疫和遗传等多方面的分子水平改变的物质。通过检测合适的硒生物标记物能准确反映体内的硒水平,从而评估硒过量或缺乏可能导致的不良反应的风险。
2.1.1 传统硒生物标记物
血液(包括全血、血浆、血清或红细胞)、头发、脚趾甲和尿液中的硒含量一般作为反映人体硒水平的传统硒生物标记物。血液中的硒一般可以反映几天内的人体硒水平。据报道,一般认为人体中全血硒的标准值是0.1~0.5 mg/kg,低于0.1 mg/kg就会引起缺硒症,同时也将硒缺乏定义为血清硒浓度低于85 μg/L[20-21]。由于血浆或血清硒与缺硒人群的硒摄入量成正相关,且相对于全血其基质简单、样品稳定性好,是国际中比较认可的优选指标[22]。
尿液及粪便作为排出体外的生物标志物可用于检测人体排出的硒含量,通过摄入的硒含量与尿液和粪便中硒含量的总和之间的差来确定硒在体内的保留[23],一般反映近期体内的硒情况。毛发、趾甲等标志物多用于检测体内保留硒,毛发硒一般可以反映人体几周或几个月的硒水平,趾甲硒可以反映人体一年甚至更久的硒摄入量[24-25]。
上述传统硒生物标记物中,均存在一定的局限性。血浆或血清硒对短期摄入硒敏感性强,摄入量微小的变化即会导致测值的迅速改变,不易于准确判定人体内硒水平;收集24 h全部的尿液和粪便相对困难;头发和指甲常暴露在日常环境中,易受污染等。相比较而言,硒蛋白P、谷胱甘肽过氧化物酶和硫氧还蛋白还原酶是目前新兴起的更精准、直接的硒水平生物标志物。硒是这些蛋白的主要活性成分,所以当硒含量发生变化时,会导致硒蛋白的活力以及表达程度随之改变,故能更可靠的反映出人体硒状态。
2.1.2 血浆硒蛋白P(SePP)
人体硒蛋白P是含有366个氨基酸的糖基化蛋白,大约三分之二的分子被折叠成包含一个硒代半胱氨酸残基的N端结构域,而较小的C端结构域包括九个硒代半胱氨酸。这种特殊的结构赋予了人体硒蛋白P将硒从肝脏输送到其他组织的转运能力[26],进而影响着硒的代谢分布和稳态调节。此外,硒蛋白P的结构中含有硫氧还蛋白样折叠和CxxSec氧化还原折叠[27],该结构使硒蛋白P具有高效的抗氧化功能。通过表达硒蛋白P可以有效减少细胞对过氧化氢攻击的敏感性[28]。在血浆中约60%的硒都以硒蛋白P的形式存在,因此,硒蛋白P的含量和活性对饮食中硒暴露水平的变化反映灵敏,在膳食硒缺乏的条件下SePP的合成大幅减少。有研究通过比较硒蛋白P与其他血中生物标记物的使用效果发现,血中硒蛋白P浓度是评价全硒蛋白表达效果和人体硒水平的最优指标[29]。
以硒蛋白P作为硒水平生物标记物,需要从受试者体内以一定量和频率获取样品,一般以免疫分析法测定。Yang等[30]首次用单克隆抗体亲和层析法纯化了硒蛋白P,通过防射免疫法检测其含量。随后,越来越多的新检测技术可用于精准地检测人体硒蛋白P[31-33],例如Yim等[34]建立了一种通过体外和体内利用放射性75Se进行代谢标记分析硒蛋白P的方法,改善了非特异性的75Se插入率低的缺陷,同时提高了检测的灵敏度和特异性。又如,Heitland等[35]将亲和色谱与电感耦合等离子体质谱联用来检测硒蛋白P,该技术缩短了分析时间、简化了操作过程以及降低了敏感性,实现了血浆硒蛋白P的高通量分析和精准检测。
2.1.3 谷胱甘肽过氧化物酶(GPx)
硒蛋白中共包括胞质GPx1、胃肠道特异性GPx2、血浆GPx3和磷脂氢过氧化物GPx4这四种谷胱甘肽过氧化物酶,均是人体抗氧化防御系统特征明确的主要硒酶[36]。其中,GPx1和GPx2具有良好的抗氧化性,还与胰岛素分泌和胰岛素抵抗有关,有研究表明,缺少这两种GPx的小鼠对氧化性刺激的敏感性更高[37];GPx3是血浆中的关键抗氧化酶;而GPx4能直接还原磷脂和胆固醇氢过氧化物。由此,GPx与总硒浓度密切相关,能准确反映可用于功能性硒蛋白的硒含量。GPx的酶活通常与谷胱甘肽还原酶偶联的动力学分光光度法测定,其活性正常范围是每克血红蛋白中27.5~73.6 U [38]。在许多研究中,GPx活性和表达已用作评估人体硒状态的生物标志物[39-41]。
利用GPx水平来反映人体硒状态有两个主要优点。一是更新较慢,可以反映硒物质在体内的储存信息和摄入硒补充剂的效果[42];二是相比于血浆而言,GPx浓度受瞬态变化的干扰小[43],对体内硒水平的反映更加可靠。但当血清硒浓度在70~90 ng/mL后,GPx活性达到最大,不再随硒摄入的增加而上升,无法真实反映人体内硒水平,阻碍了其广泛应用[41]。谷胱甘肽过氧化物酶可以作为高效的人体硒含量指标,但不是最优指标。
2.1.4 硫氧还蛋白还原酶(TXNRD)
硫氧还蛋白还原酶(TXNRD)是一种二聚体硒酶,它通过控制硫氧还蛋白(Trx)活性和氧化还原状态,参与调节细胞增殖、炎症和凋亡,在抗氧化应激的生物反应中发挥关键作用,同时具有谷胱甘肽还原酶活性[44]。在人体中,已经发现三种TXNRD,分别是胞质与细胞核中的TXNRD1,线粒体中的TXNRD2,以及睾丸中的TXNRD[45]。其中,TXNRD2可以调控大量氧化还原信号传导途径,其活性中心的重要结构是硒代胱氨酸。所以,当人体缺乏硒时,会促使体内的硒代胱氨酸合成减少,进而导致TXNRD2的含量减少和活性降低,TXNRD2被认为是人体硒含量评估的新指标[46]。
2.2 硒生物标记物的传统检测技术
高效精准的检测技术在评估人体含硒状态并指导合理补硒过程中发挥了重要的作用。目前国标测硒方法中,可用于检测血液、尿液、毛发和趾甲等硒生物标记物中硒含量的成熟技术主要有:荧光分光光度法、氢化物发生-原子吸收光谱法、石墨炉原子吸收光谱法、氢化物发生-原子荧光光谱法等。
荧光分光光度计法是通过2,3-二氨基萘(DAN)与四价硒反应形成荧光Se-DAN络合物来进行检测,其优点是灵敏度高和精确度好。Sheehan等利用荧光检测法单管试验测定了成人和儿科患者血液和尿液中的总硒状态,此方法在络合期间无需控制pH且能保护DAN免受光照[47]。在保留传统原子吸收光谱法灵敏度高、操作简便快速和高自动化等优点的基础上,氢化物发生和石墨炉原子吸收光谱法被开发利用,降低了仪器和检测的成本、减少了硒的损失和背景干扰,在很大程度上取代了比色法、荧光分光光度法。郭鹤鸣等[48]通过氢化物原子吸收光谱法,对人体毛发中的硒含量进行测定,回收率高达95.8%±1.9%~100.8%±1.3%。另外,氢化物发生-原子荧光光谱法是应用较多的一种方法,其原理是把样品中硒消化还原为氢化物形态,经原子化后,根据特征荧光强度测定硒含量。该方法成本低、灵敏度高、毒性小,陈晓霞等[49]利用氢化物发生-原子荧光光谱法测定血清中硒,检出限低至0.004 μg/L。
虽然传统检测技术为测定人体内硒含量找到了行之有效的方法,但各自仍存在一定不足。如荧光分光光度法中使用的DAN和氢化物发生和石墨炉原子吸收光谱法中的使用改良剂,均存在有机试剂毒性高、成本高、用量大以及环境污染的问题。氢化物发生-原子荧光光谱法中的消化反应以及荧光分光光度法中形成荧光Se-DAN络合物的过程操作繁琐复杂、自动化程度不高。另外,在石墨炉原子吸收光谱法检测硒含量时,硒会在灰化中挥发造成含量损失。总体而言,传统检测技术需要对硒生物标记物进行繁琐的预处理后才能进行检测。如红细胞需要消化处理,毛发、趾甲需要去除含硫化硒的洗护剂,再加上大多数硒生物标记物需经有机试剂萃取和预浓缩等处理,不仅使检测不够简便、耗能高,还存在因处理不完全而造成基质、试剂干扰和样品损失的缺陷。面对传统技术所存在的问题,科学家开发了检测硒生物标记物中硒含量的新技术,这对推进人体硒状态的评估有着重要的现实意义。
2.3 硒生物标记物的新型检测技术
近几年,针对硒生物标记物的检测技术开发主要在减少干扰、简化操作、提高自动化、降低成本、环境友好这些方面进行研究。因不同形态的硒在人体内的生物利用度差别很大,所以除了人体总硒含量外,还需对硒生物标记物中不同形态硒含量进行检测,这样才能更准确地评估人体硒状态。目前,新型硒检测方法的建立主要为优化预处理、多种技术联用、技术创新三种形式。
2.3.1 检测前预处理过程优化
尽管硒检测技术的灵敏度不断提高,但由于生物标记物基质复杂且硒痕量,因此检测前对硒的分离和浓缩等预处理必不可少。分离过程中,不同的吸附剂和萃取剂会影响过程的繁简和吸附效果,同时也会影响后续检测技术的灵敏度和检测限。因此,在开发新预处理技术的思路中,高吸附容量、高萃取效率以及高吸附选择性的吸附剂和萃取剂是必要的,同时简单易得、成本低廉、环境友好的性质也是重要的考虑因素。近期已经有多种符合条件的新型材料和试剂成功应用于预处理技术,如磁性萃取剂、纳米材料、天然深共熔溶剂、光学材料等。其中,磁性萃取剂可通过钕磁铁与样品的基质分离,节省了对样品的过滤等分离步骤。Acikkapi等[50]首次制备了一种磁性共聚体PoleS-PEG吸附剂,通过与电热原子吸收光谱法结合使用,能够迅速准确地测出复杂基质中的总硒。纳米材料、天然深共熔溶剂优势在于对无机硒的萃取率高,Llaver等[51]制备并使用离子液体纳米二氧化硅杂化物,建立了用于检测总无机硒和四价硒的新型分散固相微萃取方法,使提取率达到100%。Elik等[52]利用天然深共熔溶剂(NADES)建立了新型超声波辅助微萃取法,使后续四价硒的检测效果显著提高。此外,光学材料也因使用便捷,无需有毒试剂等优点被应用于新预处理技术的开发,如Gavrilenko等[53]使用聚甲基丙烯酸甲酯作为新型固相萃取剂,有利于固相分光光度法对硒亚硝酸盐光信号的检测。这些优化预处理的新技术简化预处理过程,提高了从复杂基质中分离硒的效率,减少基质对测定的干扰,提升了测定的准确性。其中,在固相微萃取中使用纳米材料可以仅用几微克分散固相快速、高效完成硒的预浓缩,大大减少了洗脱剂用量。NADES价格便宜、绿色环保且易于制备。另外,光学材料增强了分光光度法的分析信号等。这些预处理的优化方法改善了传统硒检测技术的部分缺陷。
预处理设备上的创新是开发新型预处理技术的另一重要思路,主要针对装置大型化、需氧量大、试剂消耗大等问题。很多科学家通过改进设备缺陷来提高样品中硒的提取纯化效果。例如,为了改进氧气瓶燃烧(OFC)技术中耗氧量大的缺点,Ma等[54]使用外部涂有甘油的化学惰性有机材料石英纤维布代替原点火装置中的滤纸,有效解决了上述问题。另外Asiabi等[55]通过在管内固相微萃取装置的毛细管内表面增加一种新型纳米结构PPy-EGDMA复合涂层,提高了对硒化物的选择性和萃取效率,建立了更优的小型化无机硒萃取技术。新设备通过改换预处理装置的部件或增加涂层后,改善了传统检测技术耗能、耗时的问题,并且提高了硒的萃取效率。
除以上萃取剂和萃取设备的创新外,新型硒预处理方法的开发也包括一些方法的创新和改进。例如,Shishov等[56]开发的新型自动连续均相液-液微萃取法,该方法基于流的技术实现了对肝脏样品中痕量硒进行高效、自动化的预处理。Wang等[57]建立的新双浊点萃取法,有效解决了表面活性剂易产生大量泡沫导致硒与氢无法完全反应的问题,增强了信号稳定性。另外该方法通过在预处理过程引入适当的电化学技术,大幅提高萃取效率[55]。目前小型化、低成本、高灵敏度和自动化等内容都是痕量硒预处理手段的重要研发方向。
2.3.2 检测技术联用
近年来,技术联用逐渐成为新型硒检测方法的开发热点,多种技术的联用能弥补单一技术的不足,可以将各个技术的优点充分集于一体,目前已有很多成功的实例。
电感耦合等离子体质谱技术(ICP-MS)灵敏度高、特异性高、重现性好,是生物样品中痕量硒的主要检测技术[58],但仍存在基质干扰、多原子干扰和质谱干扰等问题。很多研究者将该质谱技术与色谱技术联用,利用色谱技术的高分离能力开发出更优的硒检测法。在Donner等[59]的研究中,他们将离子色谱仪与配备氢反应池的四极杆电感耦合等离子体质谱仪联用,该新技术在测定生物组织样品中四价硒和六价硒时表现出了高灵敏度和准确性。Vacchina等[60]通过把二维液相色谱技术与电感耦合等离子体质谱技术在线耦合,该联用技术能够高效检测血浆等复杂基质的生物标记物中硒蛋氨酸和硒代半胱氨酸的含量。此外还有一些技术和质谱技术的联用也使硒的检测更加完善。例如,同位素稀释氢化物发生技术与电感耦合等离子体质谱法的联用[61],以及电感耦合等离子体技术与动态反应池技术联用[62]等,均有效解决了ICP-MS的干扰问题,并且明显提高血清硒检测的准确性。
通过质谱技术与色谱技术的联用,避免了对生物标记物进行除萃取外的任何化学处理,样品可由色谱分离后直接输入质谱进行检测,简化了操作步骤,改善了试剂毒性大和样品损失的缺陷。而且对ICP-MS配备碰撞反应池,也打破了原ICP-MS技术中等离子体产生的多原子干扰,体现了质谱技术联用的优点。
2.3.3 检测技术创新
在改进分子光谱等硒检测方法的研究中,针对检测技术所用试剂紫外干扰大、需加热或结合表面活性剂来辅助检测,以及设备能耗高、样品损失多等问题,除了在测定方法上进行了创新,还开发出一些新型试剂和设备。
比如,Peng等[63]以微型等离子体作原子吸收光谱法的替代辐射源,建立了新型氢化物发生-原子吸收光谱法。该方法通过限制两个电极间的空间和增加辉光放电电流,显著提高了测值的稳定性和辐射源的激发效率,同时大大降低原技术的能源、气体及成本消耗,并且被证实能准确、高灵敏地检测血样中的硒含量。在传统检测方法中,尿液和肝脏样品通常需要加酸等预处理过程,这增加了样品的损失和污染风险,为了解决该问题,陈金丽等[64]开发了直接进样原子荧光技术,达到降低取样量、缩短分析时间、减少硒损失和样品污染的效果。还有一些新型试剂已成功应用于硒检测技术,如Barache等[65]开发了一种新型生色试剂CBIMMT,这种新试剂无需辅助,就可以立即与四价硒生成特定的橙色络合物,在用分光光度法检测毛发中痕量四价硒时更加精准快速。Santarossa等[66]开发的铬天青S(CAS)荧光染料通过与四价硒的猝灭效应,有效解决了荧光光谱法测定体液时所需的传统染料成本高和环境污染等问题。另外,装置也对开发新硒检测技术起着重要的作用,Martínez等[67]开发的微波辅助消解-针阱装置,针阱装置中充满了氧化的多壁碳纳米管用于富集氢化硒。相比传统氢化物截留方法,该方法能够更加简单、快速的对硒进行分析,解决了样品损失和污染及检测连续性差的问题。
廉价的CBIMMT生色试剂、CAS荧光染料等新型试剂的开发,一定程度上减少了环境污染、背景干扰以及试剂成本,针阱装置和直接进样技术的应用,有效解决了传统技术中试剂消耗大、样品损失严重等问题,这些创新共同推动了硒生物标记物检测技术的发展。
此外,因为检测技术对标准品的依赖性高,现存检测手段还不能满足样品中硒元素的全面检测分析,所以开发对标准品依赖性低的分析手段也是新硒检测技术的热点研究方向,如同位素稀释法等。
3. 富硒食品的开发
人体自身不能合成硒,需要从外界摄入。日常补硒方式主要以服用硒营养补充剂和膳食补硒为主。由于硒在人体内的安全浓度范围很小,使用营养补充剂进行补硒时,若用量不当容易造成硒的过量摄入并对人体造成损害。此外,虽然有机硒补剂较无机硒补剂而言具有更高的生物利用度,易于人体吸收转化,但仍存在生物毒性相对较大、生物安全性较低、生物蓄积毒性较强的缺陷[68-69]。相比之下,膳食补硒的主要来源是富硒食品,食品相对补剂毒性低,更为安全。富硒食品作为日常饮食也不会对人体增加额外的负担,并且食物中本身富含的多种低分子蛋白质和维生素(主要是维生素B、C和D),能够促进人体对硒的吸收[70],更适合作为日常补硒的方式。因此,富硒食品的开发对膳食补硒具有重要意义。
富硒食品是指利用机体内自然存在硒元素的动物、植物、微生物为原料生产加工的符合富硒指标要求的食品,并区别于人工添加硒元素生产加工的补充剂。关于富硒食品的定量标准,目前国家还没有制定统一的执行标准,但已有部分企业和地方政府推出了相关规定。例如,DB61/T 556-2018《陕西省地方标准富硒含硒食品与相关产品硒含量标准》[71]规定富硒植物类一般硒含量需大于等于0.02 mg/kg,富硒肉类标准为硒含量大于等于0.1 mg/kg,富硒蛋类的硒含量需大于等于0.15 mg/kg等。理想的富硒食品强调人体对硒元素的可利用度和吸收的有效性,这与食物中硒物质的组成形态、性质及含量相关,同时也取决于富硒食物的生长条件、自身硒积累能力和加工过程等[72]。在这些相关因素中,硒的形态与硒生物利用度的关系最密切,一般硒与氨基酸结合的有机形态比无机硒盐的生物利用度高[73]。目前已发现的天然富硒食品及开发创造的新型富硒功能性食品种类繁多,能有效为人体补充硒元素[74]。
3.1 天然富硒食品
目前天然富硒食品主要为动物和植物两类,人体膳食硒更多是来自动物源富硒食品。动物类富硒食品中的主要硒形态包括硒半胱氨酸、硒代蛋氨酸和亚硒酸盐,能满足70%左右的人体硒元素需求[75]。牛、猪等红肉类,海洋动物,蛋类和家禽内脏是典型的富硒食品。植物源富硒食品一般没有良好的硒积累能力,其含硒量低于动物源富硒食品,能满足25%左右的人体硒元素需求[9]。但植物能够将吸收的无机硒转化为人体更容易利用的硒半胱氨酸、硒代蛋氨酸和甲基硒代半胱氨酸等有机硒,而且植物还具有代谢有毒硒化合物的能力,因此植物源富硒食品比动物源富硒食品具有高的硒生物利用度及安全性。目前报道了很多理想的植物富硒食品,如蘑菇、蒜类、坚果和西兰花等,它们具有良好的吸收和储存硒的能力[76],同时硒对这些植物的生长毒性也较小。
各研究数据显示,天然富硒食品中硒含量由高到低为:海洋动物>红肉>蛋类>菌类>坚果>豆制品>奶及其乳制品>谷类>植物食品[77]。富硒食品中硒物质的形式和比例的不同,导致了食物的生物利用度不同。一般有机硒占比高的食物更容易被人体吸收,同时更易发挥抗氧化和抗癌等功效。
3.2 人工富硒食品
天然富硒食品来源广泛、容易获得,但在食品加工过程容易造成硒损失,而且食品中的硒物质并非都具有高效的生物可利用性和良好的品质,还存在积累有毒有害金属的风险。因此,仅仅依靠天然富硒食品不能有效达到膳食补硒的目的,开发硒含量适中、人体利用率高、安全无毒和便捷的人工富硒食品是十分必要的。
人工富硒食品一般通过两类方式开发生产:一是通过转化手段,将生物体系统内的无机硒转化为有机硒而得到的新富硒食品;二是利用新型科技手段,研发出高硒含量和高生物利用率的食品;在人工富硒食品的开发中,不仅需要考虑硒含量的多少,还需评估其安全性、生物可利用度以及成本等。
3.2.1 生物转化人工富硒食品
生物转化富硒食品是指利用生物自身转化机制,将原料中的无机硒转化为毒性小且更易吸收利用的有机硒,再经过后续加工得到满足消费者需求的富硒食品。一般生物转化的人工富硒食品可分为植物、动物、微生物转化这三种形式。其中植物转化法最为常见,植物富集硒的开发机制主要有在植物生长的土壤或培养液中加入富硒肥料或者富硒营养液、对植物叶片表面施加含硒喷雾剂以及培育高硒浓度浸泡处理的种子等。上述植物转化法已经成功提高了各种作物可食用部分的总硒和有机硒含量,如谷物[78]、土豆[79]、微型蔬菜[80]等。相比较而言,由于叶面施硒可以避免土壤中化学物质和微生物的干扰,从而最大程度地提高植物可食用部位的有机硒含量,因此是更安全、有效的转化方式。
动物转化法是通过在动物的饲料和水源中加硒,得到的肉、蛋、奶等产物中硒的含量与加入的硒含量成正比,同时饲料中加入有机硒能转化得到更高生物利用度的富硒产物[81]。在动物饲料中补充硒,同时注意补充形态、浓度和方式,为开发动物转化人工富硒食品提供了思路。
微生物转化法通常在含有无机硒的培养基中培养单一或混合食用菌,从而提高天然食用菌的有机硒含量,制造高硒食用菌及其后续发酵食品。目前较为常用的富硒载体有富硒酵母和富硒益生菌等。例如,Dai等[82]的研究表明,富硒小球藻可以将培养基中亚硒酸盐转化为硒代半胱氨酸、甲基硒代半胱氨酸和硒代蛋氨酸,甚至转化效果优于富硒酵母。微生物转化法因成本和技术难度低而应用广泛。但随着硒浓度的增加,微生物中汞等重金属也逐渐积累[83],故在其发酵食品的生产加工过程中,应避免重金属污染。
3.2.2 纳米富硒食品
纳米技术等新型科技手段是人工富硒食品开发的研究热点,这些新方法的原料来源更广泛,获得的产品毒性更低,具有很好的成本效益和巨大的药理学潜力。
通过纳米技术获得的硒纳米粒子是一种能增强免疫力的高硒密度单质硒制剂[84]。与其他形态的硒相比,纳米形态硒的安全剂量范围更宽,大大降低了摄入过量硒给人体带来的危害。而且硒纳米粒子的粒径小且表面积大,有利于增加粘膜通透性和增强肠道吸收,提高了生物利用度[85]。此外,硒纳米粒子经过壳聚糖包埋后,能够在模拟的胃、肠和体液环境中硒缓慢释放,增强了纳米硒在消化酶环境中的稳定性,有助于提高纳米富硒食品在体内的生物活性和保留率[86]。因此,用纳米硒生产的富硒食品能表现出很高的生物可利用度和良好的缓释效果。目前,国内外已有很多研究证实了使用硒纳米粒子开发富硒食品的优势,如硒纳米粒子在绵羊和大鼠等动物体内表现为低毒性和高生物利用率[87]。Hu等[88]分别用含不同硒物质的饲料喂养肉鸡,测定结果显示硒纳米粒子从肠道到体内的转运高于亚硒酸盐,同时纳米硒在全身和肝脏组织中的百分比远高于亚硒酸盐,说明纳米硒具有更高的保留率和生物利用度。综合来看,与其他形式硒相比,纳米硒具有更好的抗氧化效果和生物活性,能更有效地上调硒酶并清除自由基,对优化膳食补硒起到了积极作用。
4. 总结与展望
硒是人体必需微量元素之一, 通过参与调节多种生理活动来影响着人类健康。硒物质通过肠道吸收和肾脏重吸收的氨基酸转运系统实现转运,与蛋白质结合为硒蛋白后由血液运输至人体各个部位发挥作用,主要排出方式有呼吸、粪便和尿液等。现有的硒水平生物标志物和硒检测技术种类繁多且各有其优缺点,生物标志物中血清硒和血浆硒是目前应用最广泛的生物标志物,硒蛋白是目前更准确的生物标志物。测定人体硒水平时,应根据检测目的和所追求的效果,选择合适的硒生物标记物以及硒检测技术来评估人体硒水平。由于硒在体内不能自主合成,而膳食补硒又作为日常补硒的主要方式,因此通过生物转化、纳米技术等手段开发的人工富硒食品对膳食补硒提供了良好途径。
测定单一的硒生物标记物并不能充分反映出人体硒健康水平,而且当硒蛋白的生物合成达到上限时,其合成水平与血液中总硒水平的变化对人体硒状态的反映将不再精准和充分,所以仅依靠单一的生物标记物反映体内硒状态是远远不够的。今后,进一步研究如何联合利用生物标志物来评定人体硒水平十分必要。针对现有人体硒检测技术仍存在背景干扰、环境污染和对标准品依赖性高等局限性。在未来研究中,多种吸附材料的组合及绿色廉价生物材料的利用,以及联用多种方法来充分发挥各技术优势是日后研究的重点。同时,进一步研究硒在体内的循环代谢机制,寻找对人体更安全和更高利用率的硒形态,为开发理想富硒食品提供新思路。
综上,优化建立新硒检测方法、探索新硒生物标记物、开发更理想的富硒食品和其加工方式,都将成为未来人体硒状态评估的重要发展方向,对人类疾病的诊断和指导人们科学、个性化补硒意义重大。
-
[1] MOHAMED H Z, RAGAB I K, GHAFEER H H. A histological study on the possible protective effect of selenium against chromium-induced thyrotoxicity in adult male albino rats[J]. The Egyptian Journal of Histology,2016,39(1):1−11. doi: 10.1097/01.EHX.0000481747.20806.2d
[2] ZHANG Y, GLADYSHEV V N. Comparative genomics of trace elements: Emerging dynamic view of trace element utilization and function[J]. Chemical Reviews,2009,109(10):4828−4861. doi: 10.1021/cr800557s
[3] RAYMAN M P. The argument for increasing selenium intake[J]. Proceedings of the Nutrition Society,2002,61(2):203−215. doi: 10.1079/PNS2002153
[4] RAYMAN M P. The importance of selenium to human health[J]. The Lancet,2000,356(9225):233−241. doi: 10.1016/S0140-6736(00)02490-9
[5] DINH Q T, CUI Z, HUANG J, et al. Selenium distribution in the Chinese environment and its relationship with human health: A review[J]. Environment International,2018,112:294−309. doi: 10.1016/j.envint.2017.12.035
[6] GUDMUNDSDOTTIR E Y, GUNNARSDOTTIR I, THORLACIUS A, et al. Blood selenium levels and contribution of food groups to selenium intake in adolescent girls in Iceland[J]. Food & Nutrition Research,2012,56(1):18476.
[7] AGARWAL P, SHARMA S, AGARWAL U S. Selenium toxicity: A rare diagnosis[J]. Indian Journal of Dermatology, Venereology, and Leprology,2016,82(6):690−693. doi: 10.4103/0378-6323.186476
[8] VINCETI M, FILIPPINI T, WISE L A. Environmental selenium and human health: An update[J]. Current Environmental Health Reports,2018,5(4):464−485. doi: 10.1007/s40572-018-0213-0
[9] DINH Q T, WANG M, TRAN T A T, et al. Bioavailability of selenium in soil-plant system and a regulatory approach[J]. Critical Reviews in Environmental Science and Technology,2019,49(6):443−517. doi: 10.1080/10643389.2018.1550987
[10] TAPIERO H, TOWNSEND D M, TEW K D. The antioxidant role of selenium and seleno-compounds[J]. Biomedicine & Pharmacotherapy,2003,57(3-4):134−144.
[11] WOLFFRAM S, FRANCO A, SCHARRER E. In vivo intestinal absorption of selenate and selenite by rats[J]. Journal of Nutrition,1985,115(4):454−459. doi: 10.1093/jn/115.4.454
[12] SCHRAUZER, GERHARD N. Selenomethionine: A review of its nutritional significance, metabolism and toxicity[J]. Journal of Nutrition,2000,130(7):1653−1656. doi: 10.1093/jn/130.7.1653
[13] THIRY C, RUTTENS A, PUSSEMIER L, et al. An in vitro investigation of species-dependent intestinal transport of selenium and the impact of this process on selenium bioavailability[J]. British Journal of Nutrition,2013,109(12):2126−2134. doi: 10.1017/S0007114512004412
[14] NICKEL A, KOTTRA G, SCHMIDT G, et al. Characteristics of transport of selenoamino acids by epithelial amino acid transporters[J]. Chemico-Biological Interactions,2009,177(3):234−241. doi: 10.1016/j.cbi.2008.09.008
[15] OHTA Y, SUZUKI K T. Methylation and demethylation of intermediates selenide and methylselenol in the metabolism of selenium[J]. Toxicol Appl Pharmacol,2008,226(2):169−177. doi: 10.1016/j.taap.2007.09.011
[16] DRAKE E N. Cancer chemoprevention: Selenium as a prooxidant, not an antioxidant[J]. Medical Hypotheses,2006,67(2):318−322. doi: 10.1016/j.mehy.2006.01.058
[17] SUZUKI K T, KURASAKI K, SUZUKI N. Selenocysteine β-lyase and methylselenol demethylase in the metabolism of se-methylated selenocompounds into selenide[J]. BBA - General Subjects,2007,1770(7):1053−1061. doi: 10.1016/j.bbagen.2007.03.007
[18] LU J, BERNDT C, HOLMGREN A. Metabolism of selenium compounds catalyzed by the mammalian selenoprotein thioredoxin reductase[J]. Biochimica Et Biophysica Acta,2009,1790(11):1513−1519. doi: 10.1016/j.bbagen.2009.04.013
[19] OLSON G E, WINFREY V P, HILL K E, et al. Megalin mediates selenoprotein P uptake by kidney proximal tubule epithelial cells[J]. Journal of Biological Chemistry,2008,283(11):6854−6860. doi: 10.1074/jbc.M709945200
[20] HOFFMAN D J, RATTNER B A, JR G, et al. Handbook of ecotoxicology, second edition[M]. 2nd ed. Boca Raton, FL: Lewis Publishers, 2003.
[21] SHIVAKOTI R, GUPTE N, YANG W T, et al. Pre-antiretroviral therapy serum selenium concentrations predict who stages 3, 4 or death but not virologic failure post-antiretroviral therapy[J]. Nutrients,2014,6(11):5061−5078. doi: 10.3390/nu6115061
[22] ZHONG Q, LIN R X, NONG Q J. Adiposity and serum selenium in U. S. adults[J]. Nutrients,2018,10(6):727. doi: 10.3390/nu10060727
[23] GERALD F C. Biomarkers of selenium status[J]. Nutrients, 2015, 7(4): 2209−2236.
[24] FATHY G, DIAB H M, MOSTAFA M S, et al. Validity of hair selenium analysis as a biomarker of selenium concentration among egyptian patients with psoriasis vulgaris[J]. Journal of the Egyptian Women's Dermatologic Society,2017,14(1):61−65. doi: 10.1097/01.EWX.0000489878.06725.21
[25] SATIA J A, KING I B, MORRIS J S, et al. Toenail and plasma levels as biomarkers of selenium exposure[J]. Annals of Epidemiology,2006,16(1):53−58. doi: 10.1016/j.annepidem.2005.02.011
[26] BURK R F, HILL K E. Selenoprotein P-expression, functions, and roles in mammals[J]. Biochimica Et Biophysica Acta,2009,1790(11):1441−1447. doi: 10.1016/j.bbagen.2009.03.026
[27] AACHMANN F L, FOMENKO D E, SORAGNI A, et al. Solution structure of selenoprotein W and NMR analysis of its interaction with 14-3-3 proteins[J]. Journal of Biological Chemistry,2007,282(51):37036−37044. doi: 10.1074/jbc.M705410200
[28] BELLINGER F, RAMAN A, REEVES M, et al. Regulation and function of selenoproteins in human disease[J]. Biochemical Journal,2009,422(1):11−22. doi: 10.1042/BJ20090219
[29] XIA Y M, HILL K E, LI P, et al. Optimization of selenoprotein P and other plasma selenium biomarkers for the assessment of the selenium nutritional requirement: A placebo-controlled, double-blind study of selenomethionine supplementation in selenium-deficient Chinese subjects[J]. The American Journal of Clinical Nutrition,2010,92(3):525−531. doi: 10.3945/ajcn.2010.29642
[30] YANG J G, MORRISON-PLUMMER J, BURK R F. Purification and quantitation of a rat plasma selenoprotein distinct from glutathione peroxidase using monoclonal antibodies[J]. Journal of Biological Chemistry,1987,262(27):13372−13375. doi: 10.1016/S0021-9258(18)45211-8
[31] BURK R F, NORSWORTHY B K, HILL K E, et al. Effects of chemical form of selenium on plasma biomarkers in a high-dose human supplementation trial[J]. Cancer Epidemiology and Prevention Biomarkers,2006,15(4):804−810. doi: 10.1158/1055-9965.EPI-05-0950
[32] 夏弈明, HILL K E, 李平, 等. 中国成人硒需要量研究[J]. 营养学报,2011,33(2):109−113. [XIA Y M, HILL K E, LI P, et al. Study on the selenium requirement for Chinese[J]. Acta Nutrimenta Sinica,2011,33(2):109−113. [33] BALLIHAUT G, KILPATRICK L E, KILPATRICK E L, et al. Multiple forms of selenoprotein P in a candidate human plasma standard reference material[J]. Metallomics,2012,4(6):533−538. doi: 10.1039/c2mt20059g
[34] YIM S H, TOBE R, TURANOV A A, et al. Radioactive 75 Se labeling and detection of selenoproteins[M]. New York: Selenoproteins. Humana Press, 2018: 177-192.
[35] HEITLAND P, KSTER H D. Biomonitoring of selenoprotein P in human serum by fast affinity chromatography coupled to ICP-MS[J]. International Journal of Hygiene and Environmental Health,2018,221(3):564−568. doi: 10.1016/j.ijheh.2018.02.006
[36] LU J, HOLMGREN A. Selenoproteins[J]. Journal of Biological Chemistry,2009,284(2):723−727. doi: 10.1074/jbc.R800045200
[37] CHU F F, ESWORTHY R S, CHU P G, et al. Bacteria-induced intestinal cancer in mice with disrupted Gpx1 and Gpx2 genes[J]. Cancer Research,2004,64(3):962−968. doi: 10.1158/0008-5472.CAN-03-2272
[38] LAWRENCE R A, BURK R F. Glutathione peroxidase activity in selenium-deficient rat liver[J]. Biochem Biophys Res Commun,2012,425(3):503−509. doi: 10.1016/j.bbrc.2012.08.016
[39] SUNDE R A. mRNA transcripts as molecular biomarkers in medicine and nutrition[J]. Journal of Nutritional Biochemistry,2010,21(8):665−670. doi: 10.1016/j.jnutbio.2009.11.012
[40] ELSOM R, SANDERSON P, HESKETH J E, et al. Functional markers of selenium status: UK Food Standards Agency workshop report[J]. Br J Nutr,2006,96(5):980−984. doi: 10.1017/BJN20061893
[41] XIA Y M, HILL K E, BYRNE D W, et al. Effectiveness of selenium supplements in a low-selenium area of China[J]. The American Journal of Clinical Nutrition,2005,81(4):829−834. doi: 10.1093/ajcn/81.4.829
[42] KILINC M, KASTAL C, OKUR E, et al. Evaluation of serum selenium and erythrocyte glutathione peroxidase levels in patients with recurrent tonsillitis[J]. Indian Journal of Otolaryngology and Head and Neck Surgery, 2017, 71(Suppl 1): 188-191.
[43] KOHLER L N, FLOREA A, KELLEY C P, et al. Higher plasma selenium concentrations are associated with increased odds of prevalent type 2 diabetes[J]. The Journal of Nutrition,2018,148(8):1333−1340. doi: 10.1093/jn/nxy099
[44] PAPP L V, JUN L U, HOLMGREN A, et al. From selenium to selenoproteins: Synthesis, identity, and their role in human health[J]. Antioxidants & Redox Signaling,2007,9(7):775−806.
[45] ARNÉR E S J, HOLMGREN A. Physiological functions of thioredoxin and thioredoxin reductase[J]. Eur J Biochem,2010,267(20):6102−6109.
[46] GANDIN V, FERNANDES A P, RIGOBELLO M P, et al. Cancer cell death induced by phosphine gold(I) compounds targeting thioredoxin reductase[J]. Biochemical Pharmacology,2010,79(2):90−101. doi: 10.1016/j.bcp.2009.07.023
[47] SHEEHAN T M, GAO M. Simplified fluorometric assay of total selenium in plasma and urine[J]. Clinical Chemistry,1990,36(12):2124−2126. doi: 10.1093/clinchem/36.12.2124
[48] 郭鹤鸣, 孙利群. 微波溶样-氢化物发生-原子吸收光谱法测定人发中微量硒的方法研究[J]. 卫生研究,2000,29(6):411−412. [GUO H M, SUN L Q. Determination of trace selenium in human hair by microwave sample dissolving hydride generation atomic absorption spectrometry[J]. Health Research,2000,29(6):411−412. doi: 10.3969/j.issn.1000-8020.2000.06.026 [49] 陈晓霞, 赵叶. 氢化物发生-原子荧光光谱法测定血清中硒含量研究[J]. 中国测试,2016,42(7):43−46. [CHEN X X, ZHAO Y. Determination of selenium in serum by HG-AFS[J]. China Measurement & Test,2016,42(7):43−46. doi: 10.11857/j.issn.1674-5124.2016.07.009 [50] ACIKKAPI A N, TUZEN M, HAZER B. A newly synthesized graft copolymer for magnetic solid phase microextraction of total selenium and its electrothermal atomic absorption spectrometric determination in food and water samples[J]. Food Chemistry,2019,284:1−7. doi: 10.1016/j.foodchem.2019.01.091
[51] LLAVER M, CORONADO E A, WUILLOUD R G. High performance preconcentration of inorganic Se species by dispersive micro-solid phase extraction with a nanosilica-ionic liquid hybrid material[J]. Spectrochimica Acta Part B:Atomic Spectroscopy,2017,138:23−30. doi: 10.1016/j.sab.2017.10.003
[52] ELIK A, DEMIRBAS A, ALTUNAY N. Developing a new and simple natural deep eutectic solvent based ultrasonic-assisted microextraction procedure for determination and preconcentration of As and Se from rice samples[J]. Analytical Methods,2019,11(27):3429−3438. doi: 10.1039/C9AY00916G
[53] GAVRILENKO N A, SARANCHINA N V, FEDAN D A, et al. Solid-phase spectrophotometric iodometric determination of nitrite and selenium (IV) using a polymethacrylate matrix[J]. Journal of Analytical Chemistry,2017,72(5):546−550. doi: 10.1134/S1061934817030054
[54] MA Y Y, ZENG K, DUAN T C. Fast and clean determination of total selenium in biological materials by an improved oxygen flask combustion method combined with hydride generation atomic fluorescence spectrometry[J]. Microchemical Journal,2019,148:743−747. doi: 10.1016/j.microc.2019.04.064
[55] ASIABI H, YAMINI Y, SEIDI S, et al. On-line electrochemically controlled in-tube solid phase microextraction of inorganic selenium followed by hydride generation atomic absorption spectrometry[J]. Analytica Chimica Acta,2016,922:37−47. doi: 10.1016/j.aca.2016.04.001
[56] SHISHOV A, WIECZOREK M, KOCIELNIAK P, et al. An automated continuous homogeneous microextraction for the determination of selenium and arsenic by hydride generation atomic fluorescence spectrometry[J]. Talanta,2018,181:359−365. doi: 10.1016/j.talanta.2018.01.033
[57] WANG M, ZHONG Y, QIN J, et al. Determination of total selenium in food samples by d-CPE and HG-AFS[J]. Food Chemistry,2017,227:329−334. doi: 10.1016/j.foodchem.2016.11.096
[58] VACCHINA V, JEAN D. Total selenium quantification in biological samples by inductively coupled plasma mass spectrometry (ICP-MS)[M]. New York: Selenoproteins. Humana Press, 2018: 145-152.
[59] DONNER M W, SIDDIQUE T. A rapid and sensitive IC-ICP-MS method for determining selenium speciation in natural waters[J]. Canadian Journal of Chemistry,2018,96(8):795−802. doi: 10.1139/cjc-2017-0637
[60] VACCHINA V, BIERLA K, SZPUNAR J, et al. Quantification of SeMet and SeCys in biological fluids and tissues by liquid chromatography coupled to inductively coupled plasma mass spectrometry (HPLC-ICP MS) [M]. New York: Selenoproteins. Humana Press, 2018: 153-162.
[61] KLECKNER A E, KAKOUROS E, STEWART A R. A practical method for the determination of total selenium in environmental samples using isotope dilution-hydride generation-inductively coupled plasma-mass spectrometry[J]. Limnology and Oceanography: Methods,2017,15(4):363−371. doi: 10.1002/lom3.10164
[62] VERNI E R, MOYANO F, MARTINEZ L D, et al. Handling spectral interferences and matrix effects in DRC-ICPMS to assess the elemental profile in human serum samples after dissolution with formic acid[J]. Journal of Analytical Atomic Spectrometry,2013,28(10):1655−1659. doi: 10.1039/c3ja50191d
[63] PENG X X, WANG Z. Ultrasensitive determination of selenium and arsenic by modified helium atmospheric pressure glow discharge optical emission spectrometry coupled with hydride generation[J]. Analytical Chemistry,2019,91(15):10073−10080. doi: 10.1021/acs.analchem.9b02006
[64] 陈金丽, 冯礼, 戚仓, 等. 直接进样原子荧光法对小鼠肝脏和尿硒含量测定[J]. 中华地方病学杂志,2018,37(2):149−151. [CHEN J L, FENG L, QI C, et al. Determination of selenium content in mouse liver and urine by direct injection atomic fluorescence spectrometry[J]. Chinese Journal of Endemiology,2018,37(2):149−151. doi: 10.3760/cma.j.issn.2095-4255.2018.02.015 [65] BARACHE U B, SHAIKH A B, LOKHANDE T N, et al. Acid switched efficient, cost effective, selective separation and determination of selenium (IV)[J]. Journal of Environmental Chemical Engineering,2017,5(5):4828−4840. doi: 10.1016/j.jece.2017.09.021
[66] SANTAROSSA D G, FERNÁNDEZ L P. Development of on-line spectrofluorimetric methodology for selenium monitoring in foods and biological fluids using Chrome azurol S quenching[J]. Talanta,2017,172:31−36. doi: 10.1016/j.talanta.2017.05.013
[67] MARTINEZ A M, VAZQUEZ S, LARA R, et al. Selenium analysis by an integrated microwave digestion-needle trap device with hydride sorption on carbon nanotubes and electrothermal atomic absorption spectrometry determination[J]. Spectrochimica Acta Part B:Atomic Spectroscopy,2018,140:22−28. doi: 10.1016/j.sab.2017.12.001
[68] 强佳丽, 陈旭. 富有机硒产品的急性毒性试验[J]. 毒理学杂志,2013,27(4):319−320. [QIANG J L, CHEN X. Acute toxicity test of organic selenium - rich products[J]. Journal of Toxicology,2013,27(4):319−320. [69] RAYMAN M P, GOENAGA I H, MIKE S. Food-chain selenium and human health: Spotlight on speciation[J]. British Journal of Nutrition,2008,100(2):238−253. doi: 10.1017/S0007114508922522
[70] KIELISZEK M, BŁAZEJAK S. Selenium: Significance, and outlook for supplementation[J]. Nutrition,2013,29(5):713−718. doi: 10.1016/j.nut.2012.11.012
[71] 陕西省质量技术监督局. DB61/T 556-2018 富硒含硒食品与相关产品硒含量标准[S]. 陕西: 陕西省质量技术监督局, 2018. Shaanxi Provincial Bureau of Quality and Technical Supervision. DB61/T 556-2018 Standard for selenium content in selenium-enriched/selenium-containing foods and related products[S]. Shaanxi: Shaanxi Bureau of Quality and Technical Supervision, 2018.
[72] PÉREZ M B, MANIERO M Á, LONDONIO A, et al. Effects of common cooking heat treatments on selenium content and speciation in garlic[J]. Journal of Food Composition and Analysis,2018,70:54−62. doi: 10.1016/j.jfca.2018.04.004
[73] RAYMAN M P. Selenium and human health[J]. The Lancet,2012,379(9822):1256−1268. doi: 10.1016/S0140-6736(11)61452-9
[74] SCHOMBURG L. Selenium, selenoproteins and the thyroid gland: Interactions in health and disease[J]. Nature Reviews Endocrinology,2011,8(3):160−171.
[75] ANKE M, DROBNER C, RÖHRIG, et al. The selenium content of the flora and plant and animal foodstuffs in Germany[J]. Ernä Hrungsforschung,2002,47(2):67−79.
[76] 张煜. 青海高原富硒区土壤硒含量对蔬菜营养品质的影响[J]. 黑龙江农业科学,2018(2):37−44. [ZHANG Y. Effects of soil crash content on vegetable nutrient quality in qinghai plateau rich crash area[J]. Heilongjiang Agricultural Sciences,2018(2):37−44. [77] 陈树娣, 汤璐, 张贵伟, 等. 深圳居民膳食中硒的测定及其摄入量评估[J]. 食品工业,2017,38(2):298−301. [CHEN S D, TANG L, ZHANG G W, et al. Determination of selenium and assessment of dietary selenium intake in shenzhen residents[J]. The Food Industry,2017,38(2):298−301. [78] RADAWIEC A, SZULC W, RUTKOWSKA B. Selenium biofortification of wheat as a strategy to improve human nutrition[J]. Agriculture,2021,11(2):144. doi: 10.3390/agriculture11020144
[79] ZHANG H, ZHAO Z, ZHANG X, et al. Effects of foliar application of selenate and selenite at different growth stages on selenium accumulation and speciation in potato (Solatium tuberosum L)[J]. Food Chemistry,2019,286(15):550−556.
[80] PUCCINELLI M, MALORGIO F, ROSELLINI I, et al. Production of selenium-biofortified microgreens from selenium-enriched seeds of basil[J]. Journal of the Science of Food and Agriculture,2019,99(12):5601−5605. doi: 10.1002/jsfa.9826
[81] BENES S E, ROBINSON P H, CUN G S. Depletion of selenium in blood, liver and muscle from beef heifers previously fed forages containing high levels of selenium[J]. Science of the Total Environment,2015,536:603−608. doi: 10.1016/j.scitotenv.2015.07.096
[82] DAI L V, KUMAR S, MYKOLA M, et al. In vitro bioaccessibility of selenoamino acids from selenium (Se)-enriched Chlorella vulgaris biomass in comparison to selenized yeast; a Se-enriched food supplement; and Se-rich foods[J]. Food Chemistry,2019,279:12−19. doi: 10.1016/j.foodchem.2018.12.004
[83] EFSA Panel on Additives and Products or Substances used in Animal Feed (FEEDAP). Scientific opinion on safety and efficacy of Sel-Plex®(organic form of selenium produced by Saccharomyces cerevisiae CNCM I-3060) for all species[J]. EFSA Journal,2011,9(4):2110. doi: 10.2903/j.efsa.2011.2110
[84] ELAHIAN F, REIISI S, SHAHIDI A, et al. High-throughput bioaccumulation, biotransformation, and production of silver and selenium nanoparticles using genetically engineered Pichia pastoris[J]. Nanomedicine: Nanotechnology, Biology and Medicine,2017,13(3):853−861. doi: 10.1016/j.nano.2016.10.009
[85] ZHOU W, MIAO S, ZHU M, et al. Effect of glycine nano-selenium supplementation on production performance, egg quality, serum biochemistry, oxidative status, and the intestinal morphology and absorption of laying hens[J]. Biological Trace Element Research, 2021.
[86] ZHAI X N, ZHANG C Y, ZHAO G H, et al. Antioxidant capacities of the selenium nanoparticles stabilized by chitosan[J]. Journal of Nanobiotechnology,2017,15(1):4. doi: 10.1186/s12951-016-0243-4
[87] 石薇, 赵兴财, 任有蛇. 纳米硒对绵羊精饲料营养物质瘤胃降解率的影响[J]. 山西农业科学,2011,39(12):1313−1315. [SHI W, ZHAO X C, REN Y S. Impact of nano-selenium on sheep rumen degradabilityrate of concentrates nutrition[J]. Journal of Shanxi Agricultural Sciences,2011,39(12):1313−1315. doi: 10.3969/j.issn.1002-2481.2011.12.24 [88] HU C H, LI Y L, XIONG L, et al. Comparative effects of nano elemental selenium and sodium selenite on selenium retention in broiler chickens[J]. Animal Feed Science and Technology,2012,177(3-4):204−210. doi: 10.1016/j.anifeedsci.2012.08.010





 下载:
下载:
 下载:
下载:
