Research Progress in Analytical Methods for Structures of Phytogenic Polysaccharides
-
摘要: 植物多糖是一类广泛存在于植物细胞中的天然大分子,具有抗肿瘤、抗氧化、免疫调节等多种生物活性,而多糖的结构是影响其生物活性的关键因素。由于多糖分子量大,结构复杂,使得多糖的深入研究受到限制。本文介绍了植物多糖初级结构解析方法如气相色谱法、液相色谱法、红外光谱法、核磁共振波谱法、质谱法等,以及高级结构解析方法如原子力显微镜法、X射线衍射法、圆二色谱法等,并对植物多糖多维指纹图谱和分子模型的构建进行归纳总结,为研究多糖结构提供了新的思路,为多糖的开发和利用奠定了基础。Abstract: Phytogenic polysaccharide, a kind of natural macromolecule, is wide spread occurrence in phytogenic cells and has many kinds of biological activities, such as anti-tumor, anti-oxidation, immunomodulation, and etc. The structure of polysaccharide is a key factor affecting its biological activity. Due to the large molecular weight and complex structure of polysaccharide, the in-depth study of polysaccharide is limited. Therefore, this paper introduces the research methods of the primary structure, such as gas chromatography, liquid chromatography, infrared spectroscopy, nuclear magnetic resonance spectroscopy and mass spectrometry, as well as advanced structural analysis methods such as atomic force microscopy, X ray diffraction and circular dichrois, and summarizes the construction of multidimensional fingerprint and molecular model of phytogenic polysaccharides, which provides a new idea for the study of polysaccharide structure and lays a foundation for the development and utilization of polysaccharides.
-
Keywords:
- phytogenic polysaccharides /
- structural /
- analytical method
-
多糖(Polysaccharide)是由10个以上的单糖分子通过脱水形成糖苷键连接而成的高分子聚合物[1]。大量研究表明植物多糖具有多种生物活性,如调节免疫、抗肿瘤、降血糖、抗氧化、调节肠道菌群等[2-3]。由于多糖来源广泛、生物活性强、安全性高、毒副作用小等特点,已成为当前食品、保健品、医药等领域的研究热点。
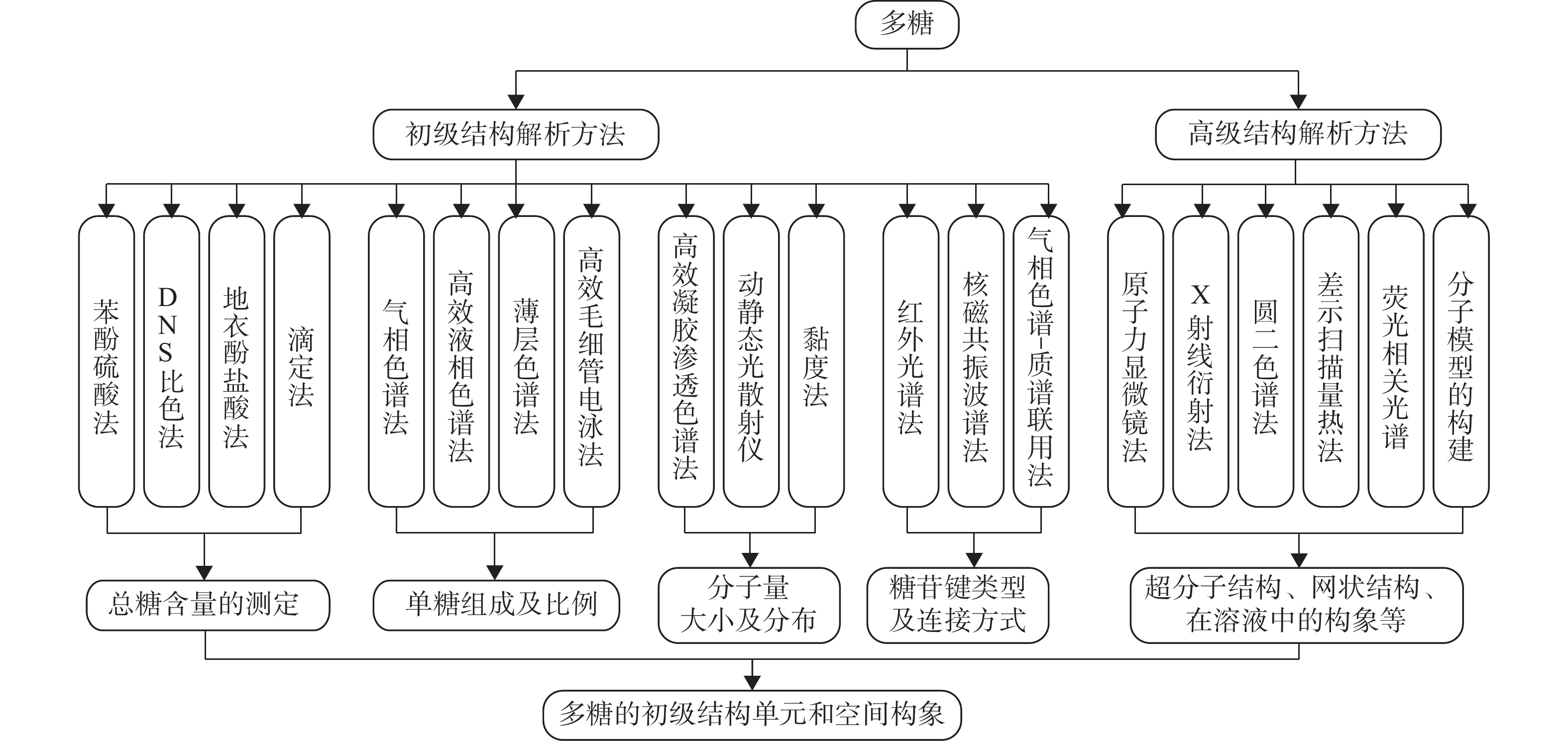
多糖丰富的生物活性与其复杂的结构密不可分。多糖结构分为一级、二级、三级和四级结构,一级结构包含分子量大小及分布、单糖组成及摩尔比、糖苷键连接方式、重复结构单元和分支度等;二级、三级和四级结构统称为高级结构,主要是多糖的构象[4]。如此多变性的多糖结构增加了其研究难度,并且目前多糖的结构解析仍处于探索阶段,存在诸多不足,如多糖本身分子量大、不具备紫外吸收能力、提纯后直接检测较为困难、缺乏用于定性定量分析的多糖对照品、结构鉴定重复性差、检测手段达不到自动化、标准化和微量化等[5-7],这大大制约了多糖类产品的研发和应用。因此,亟需建立和完善多糖的结构分析方法体系[8]。该文基于近年来植物多糖结构解析方法的相关研究进展,对植物多糖总糖含量、单糖组成、糖苷键类型、分子量大小及其分布、高级结构等方面的问题进行阐述和归纳,列举了不同的测定方法,分析了常用方法的优势和弊端,并且对一些结构分析的新兴技术进行分析对比,以期为多糖的综合利用和深入研究提供多元的思路和方法。植物多糖结构解析常用方法如图1所示。
1. 植物多糖初级结构解析方法
1.1 植物多糖中总糖含量的测定
植物多糖总糖含量的测定方法有苯酚-硫酸法、蒽酮-硫酸法、3,5-二硝基水杨酸(DNS)比色法、地衣酚-盐酸法和滴定法等,其中,滴定法又包括斐林滴定法和碘量法等。植物多糖总糖含量测定方法的原理及优缺点比较如表1所示。多糖的总糖含量与多糖纯度相关,是多糖质量控制的基本问题。张妍等[12]研究比较了苯酚-硫酸和蒽酮-硫酸法对麦冬多糖总糖含量测定的影响,发现两种方法均具备操作简单、快速、准确和条件易于控制等优点,但是苯酚-硫酸法在测定时线性关系、精密度、重复性和加样回收率等指标均优于蒽酮-硫酸法,因此,苯酚-硫酸法更加适用于麦冬多糖含量的测定。张小贝等[13]采用DNS比色法测得徐菜薯1号、鄂菜薯1号、莆薯53三种菜用甘薯叶片中多糖总糖分别为20.68、22.17、22.72 mg/g。该法具有测定值稳定,显色反应后吸光值稳定等优点,还能高效准确的测定还原糖和多糖含量。陈立江等[14]采用间接碘量法和苯酚-硫酸法分别测定同一批样品南瓜多糖的含量,其中,间接碘量法测定南瓜多糖的总糖含量平均值为53.14%,苯酚-硫酸法测定南瓜多糖的总糖含量平均值为52.86%,同时发现间接碘量法不仅能测出总糖含量,还能用于单糖含量的测定。在《中国药典》2020年版中,玉竹、霍山石斛、金樱子、枸杞、铁皮石斛等的多糖含量均采用苯酚-硫酸法测定,百合、灵芝、昆布、海藻、黄精等的多糖含量采用蒽酮-硫酸法测定,由此可知,苯酚-硫酸法和蒽酮-硫酸法是目前学者较为认可的多糖含量测定方法[15]。
表 1 植物多糖总糖含量测定方法的原理及优缺点比较Table 1. Principles, advantages and disadvantages of determination methods of total sugar content of phytogenic polysaccharides测定方法 原理 优点 缺点 苯酚-硫酸法 浓硫酸作用下,多糖水解成单糖,并脱水生成糠醛衍生物,与苯酚缩合成有色化合物,比色法确定含量 操作简单、重复性较好,显色后稳定性较好,蛋白质等物质不干扰测定[9] 苯酚易氧化,对于不同的多糖需要不同的优化 蒽酮-硫酸法 多糖在浓硫酸作用下水解、脱水,再与蒽酮结合成有色化合物,比色法确定含量 可测还原糖和总糖含量,简便、快速,适用于大量样品的测定 受蛋白质干扰,试剂需现配 3,5-二硝基水
杨酸比色法多糖在酸作用下水解产生还原糖,DNS与还原糖发生氧化还原反应,生成3-氨基-5-硝基水杨酸,产物在煮沸条件下显棕红色,且在一定浓度范围内颜色深浅与还原糖含量成比例关系 操作简便、快速,适合批量测定 不适用于自带颜色样品的检测[10] 地衣酚-盐酸法 多糖在盐酸中水解成糠醛及其衍生物,再与地衣酚反应,由吸光度根据标准曲线计算戊聚糖含量 操作简便,结果准确,重现性较好,回收率高 用单波长测定戊糖含量时,己糖存在着一定的干扰,而且当己糖的浓度为戊糖浓度的5倍以上时有必要除去体系中的己糖再进行测定[11] 斐林滴定法 多糖在酸作用下水解产生还原糖,还原糖可以将斐林试剂的Cu2+还原成Cu+,根据一定量的斐林试剂完全还原所需的还原糖量,计算样品中还原糖的含量 准确度高,重现性好,不需要精密仪器 该法需在沸腾状态下滴定,操作较繁琐 间接碘量法 多糖在酸作用下水解,加入适量碘-碘化钾发生氧化还原反应,用硫代硫酸钠进行滴定 定量测定快速,不需要精密仪器 测定结果易受滴定速度的影响,碘的挥发也会产生误差 1.2 植物多糖的单糖组成及比例的测定
植物多糖的单糖组成分析一般先进行酸水解,使多糖的糖苷键完全断裂,水解后有些需要经过中和、过滤、衍生化等处理,再利用化学、仪器分析技术进行测定。多糖中单糖组成的测定方法有气相色谱法(Gas Chromatography,GC)、高效液相色谱法(High Performance Liquid Chromatography,HPLC)、纸色谱法(Paper Chromatography,PC)、薄层色谱法(Thin-Layer Chromatography,TLC)、高效毛细管电泳法(High Performance Capillary Electrophoresis,HPCE)等。植物多糖单糖组成的测定方法、优缺点及应用见表2。进行测定后与标准图谱对比分析,能够同时分离和检测样品中存在的化合物,也显示出了化合物的色谱模式和样品的化学特性,灵敏度好,选择性好,已被广泛应用于多糖的真伪鉴别、质量评价、保证植物及其相关产品的一致性和稳定性等方面。
表 2 植物多糖单糖组成的测定方法Table 2. Determination method of monosaccharide composition of phytogenic polysaccharides测定方法 优点 缺点 举例 参考文献 GC 可同时分析超过10种单糖,准确度高;所需样品量小,能检测到含量很低的单糖 操作繁琐,必须经过较长时间的衍生过程,且衍生易产生副产物,经常1种单糖出现2个或2个以上的异构峰,不利于快速分析 金银花多糖的质量控制 [16-17] HPLC 操作较为简单,没有异构峰产生,分析速度快 灵敏度比GC法低 怀牛膝多糖的质量评价,枸杞多糖的真伪鉴别,猪苓多糖的质量评价,海藻多糖的品种鉴别 [18-21] PC 仪器设备非常简单,操作简单易行 灵敏度较差,无法进行定量分析 糙苏多糖的单糖组成 [22] TLC 仪器设备简单,操作简单易行 灵敏度较差 玉屏风复合多糖,虫草多糖的质量控制,灵芝多糖的品种鉴别 [23-25] HPCE 灵敏度高 仪器设备要求较高,操作相对复杂 洋甘菊多糖的单糖组成,金樱子多糖的单糖组成 [26-27] 1.3 植物多糖分子量大小及分布的测定
植物多糖分子量是研究多糖结构特征的基础,也是质量控制的重要指标之一。不同来源的多糖分子量分布范围不同,常用的测定方法有凝胶渗透色谱法(Gel Permeation Chromatography,GPC)、高效凝胶渗透色谱法(High Performance Gel Permeation Chromatography,HPGPC)、动静态光散射仪、黏度法等,其分子量大小常用重均分子量、数均分子量和粘均分子量等表示。
1.3.1 凝胶渗透色谱法
GPC是根据在凝胶柱上不同相对分子质量的多糖与洗脱量成一定关系的特性测定相对分子质量的方法。该法具有操作简单便捷、准确等优点,已广泛应用于实验室中多糖样品的相对分子质量测定[28]。ZHAO等[29]研究了来自粳稻的三种均一多糖SJP1-1、SJP2-1和SJP3-1,结果显示,它们的相对平均分子量分别为1.87×105、1.04×105和1.36×104 Da。王巧娥等[30]对10批北京产地和10个不同产地的库拉索芦荟凝胶多糖进行GPC分析,根据得到的GPC图谱,确定共有峰并导入“中药色谱指纹图谱相似度评价系统”,建立了库拉索芦荟凝胶多糖的GPC指纹图谱,并进行市售芦荟产品的质量评价以及常见掺假物检测,发现库拉索芦荟凝胶产品同一产地的批间一致性和不同产地的产地间一致性均较好,市售的3种芦荟产品均含有芦荟凝胶多糖,但制作工艺不同,并有效鉴别出了β-环糊精、麦芽糖、蔗糖、葡萄糖4种常见掺假物。表明该方法可以用于不同批次、不同产地的库拉索芦荟凝胶制品的内在质量控制和真伪鉴别。由此可知,建立GPC多糖指纹图谱,操作简单,且重复性良好,为辨别产品的真伪和品质评价提供了参考方法。
1.3.2 高效凝胶渗透色谱法
HPGPC是GPC和HPLC结合的产物,根据在凝胶柱上不同相对分子质量的多糖与洗脱保留时间成一定关系的特性,先用各种已知相对分子质量的多糖制成标准曲线,然后由样品的保留时间从曲线中求得相对分子质量。和GPC相比,HPGPC分析时间更短,操作更加方便,重复性更好,结果可信度更高,但对仪器设备要求也就更高。邓樑钧等[31]对短葶山麦冬多糖相对分子质量分布及多糖含量、方法的准确性、精密度、稳定性和专属性等进行了研究,发现该方法简单、快速、准确、重现性好、灵敏度较高且具有一定的专属性,可作为短葶山麦冬多糖质量控制的快速检测方法。但是当以水做流动相测定多糖分子量时,糖链过度伸展,易造成吸附,使分子量检测值过大[32],因此闫光玲等[33]以NaNO3溶液为流动相测定金银花多糖分子量,发现金银花多糖组分LTP1、LTP4的图谱峰型较宽,表明多糖组分纯度不够,需进一步纯化,该实验为金银花多糖的深入研究奠定了基础。XU等[34]以不同分子量的葡聚糖作为对照品制作标准曲线测定铁皮石斛多糖相对分子量,将10批铁皮石斛多糖提取物溶解后直接进样,建立HPGPC特征指纹图谱,结果表明10批样品图谱相似,具有同一主要特征峰,同时10批同属其他样品,图谱差别巨大,不具有主要特征峰,可用于铁皮石斛的鉴别和质量控制。由此可见,HPGPC指纹图谱是一种高效、稳定、方便的多糖指纹图谱的方法,可推广到其他多糖类药物的指纹图谱中,在多糖指纹图谱的构建中具有较大潜力。
1.3.3 其他方法
除了以上常用的分子量测定方法,还有黏度法、超离心法、光散射法、渗透压法等。黏度法是由于高聚物的相对分子质量与特性黏度之间存在一定关系,即Mark-Houwink关系式。该法操作时将高聚物溶于某溶剂中,使用乌氏黏度计测定特性黏度值,再根据公式即可获得平均相对分子质量[35]。目前,分子量的测定方法均存在一定的不足,如:GPC法流速比较慢,而且每次缓冲液及流速均需一致,样品黏度不宜太高,样品需要过滤不能含有颗粒,否则可能会堵塞等;HPGPC法中对照品与样品多糖结构之间的差异,凝胶柱对多糖等大分子可能产生的吸附、扩散作用,多糖的浓度、黏度、测试的温度等均会引起误差;黏度法精准度差等[36]。而联用技术不需用对照品作对照即可测定,是目前测定多糖相对分子质量及分布较理想的方法之一。HPLC-静态光散射技术可以依据高分子溶液光散射性质与分子质量、尺寸及浓度等相关特性,通过计算获取绝对分子质量、分子质量分布、回转半径及构象等多种结构信息[37]。凝胶渗透色谱-多角度激光散射是用于测定聚合物、多糖、蛋白质、核酸等生物大分子绝对分子质量的新技术,无需标准物质校正,可同时获得样品分子质量分布和样品构象信息。胡卫珍等[38]采用凝胶渗透色谱-多角度激光散射联用技术研究铁皮石斛多糖的分子量及其分布,并对不同种源间多糖分子质量及其分布进行了分析比较,发现不同种源的铁皮石斛多糖分子质量及分布有所差异。结果表明,该法可为铁皮石斛种源优选、质量评价提供一定的参考。蒸发光散射检测器是一种通用型质量分析检测器,具有稳定性好、特异性强、灵敏度高等优点,流动相可以进行梯度洗脱,尤其适用于复杂多组分的分析[39]。张鑫等[40]通过高效凝胶色谱法与蒸发光散射检测器联用的分析方法建立的枸杞多糖分子量分布特征图谱稳定可靠,可以相对准确地表征枸杞多糖的分子量分布信息。
1.4 植物多糖的糖苷键类型及连接方式的测定
糖苷键是一种特定类型的化学键,连接糖苷分子中的苷元与糖基或糖基与糖基。测定糖苷键类型的方法主要有红外光谱法(Infrared Spectroscopy,IR)、核磁共振波谱法(Nuclear Magnetic Resonnce Spectrometry,NMR)、气相色谱-质谱联用法(Gas Chromatography-Mass Spectrometry,GC-MS)等仪器分析法,结合化学分析法还可以测定糖苷键连接位点、连接方式、糖苷的糖环形式以及不同糖苷键的构成比例。多糖糖苷键的测定方法与其解决的问题如表3所示。
表 3 植物多糖糖苷键的常用测定方法Table 3. Common determination methods of glycosidic bonds of phytogenic polysaccharides测定指标 化学方法 仪器方法 糖苷的糖环形式(吡喃环或呋喃环) — IR、NMR等 单糖残基的的异头异构形式(α-或β-) 糖苷酶水解 IR、NMR等 糖苷键的连接顺序 部分酸水解、糖苷酶顺序水解 NMR等 糖苷键的连接位点 甲基化分析、高碘酸氧化、Smith降解 GC-MS、MSn(ESI-MS、Maldi-Tof)、NMR、离子淌度-质谱联用等 1.4.1 红外光谱法
红外光谱是由分子的振动-转动能级跃迁产生的,多糖中不同类型的糖苷键,在红外光谱图上的特征峰位置不同,因此,可以使用IR识别多糖中的各种官能团并确定多糖中各种单糖的糖苷键类型及糖构型。JIA等[41]采用溴化钾压片法对玉米须多糖(CSP)进行傅里叶变换红外光谱测定,图谱显示,在3400 cm−1处的宽带对应于羟基的O-H伸缩振动峰,在2930 cm−1处的峰值是CH2基团的C-H伸缩振动的特征。在约1600、1410 cm−1处的谱带分别对应于酯基或羧基中C=O和CO-的伸缩振动,这表明它们都含有糖醛酸,组分CSP20在798.4 cm−1处有峰,可能是由于α-吡喃糖的存在而产生的。ABUDUWAILI等[42]采用红外光谱法对小果白刺果多糖进行结构测定,图谱显示吸收带大约在3400、2920 cm−1处为O-H和C-H键的伸缩振动,在1750 cm−1附近出现一个峰表明存在糖醛酸,此外,小果白刺果多糖组分NSP-1、NSP-3在870、900 cm−1的吸收峰表明它们分别存在α-吡喃糖、β-吡喃糖。由此可知,3200~2800、1400~1200 cm−1是初步判断该化合物是不是糖类化合物的关键峰,960~730 cm−1为多糖的特征吸收峰,是鉴定多糖糖苷键的关键峰。
1.4.2 核磁共振波谱法
核磁共振波谱是由于处于强磁场的原子核吸收射频辐射产生的,它是对各种有机、无机物成分、结构进行定性分析的强有力工具之一。该法不破坏多糖样品,能准确反映出多糖的真实结构,且能对多糖进行回收,具有高度的重现性和特征性,可用来表征多糖结构中糖苷键的类型。NMR的特点及在多糖结构研究中的应用如表4所示。在1D-NMR中,使用较多的是1H和13C-NMR。在1H-NMR中,多糖的异头氢出现在4.3~6.0 ppm之间,其中,4.3~4.8 ppm为β构型,而5.0 ppm以上为α构型。对于13C-NMR,95~105 ppm为异头碳信号,其中,β构型异头碳会出现在101 ppm以上,而α构型出现在95~103 ppm之间。研究发现竹荪多糖的异头氢信号大于5.0 ppm,异头碳信号在91.8~100.0 ppm之间,为α构型[43],霍山石斛多糖的异头氢信号在4.45~4.89 ppm之间,异头碳信号在99.2~102.6 ppm之间,为β构型[44]。
表 4 NMR的特点及在多糖结构研究中的应用Table 4. Characteristics of NMR and its application in polysaccharide structure study类型 特点 应用 举例 1H-NMR 1H信号集中于3~6 ppm,且重叠严重,分辨困难 根据4.5~5.5 ppm的异头质子信号确定单糖种类;还可以判断糖环类型(4.3~4.8 ppm为β构型,5.0 ppm以上为α构型);H2-H6信号(3.2~4.5 ppm)集中,很难逐一归属;有甲基(1.0 ppm附近)、乙酰基(2.0 ppm附近)、硫酸根和磷酸根基团取代时,1H化学位移通常向下偏移约0.2~0.5 ppm 竹荪多糖为α构型[43];霍山石斛多糖为β构型[44] 13C-NMR 化学位移范围较1H-NMR广,分布在60~110 ppm,分辨率好,谱线很少重叠,但样品需求量较大 根据95~105 ppm的异头碳信号确定单糖组成;判断糖环的构型(101 ppm以上为β构型异头碳,95~103 ppm之间为α构型);判断取代基团:78~85 ppm是C2-C5中取代位置上的碳信号,65~80 ppm区域为未被取代的碳信号,61 ppm附近为未被取代的C6信号,而被取代的C6信号则往低场移至69 ppm附近,甲基、乙酰基、硫酸根和磷酸根基团取代的多糖,13C的化学位移通常向下偏移6~7 ppm 玫瑰花废弃物果胶多糖包括α构型和β构型[45] H-H COSY 提供分子内质子间耦合关系 确定异头质子的构型及羟基氢原子与氢原子之间的耦合与否,从而确定取代基的位置 麻黄茎多糖中质子间的耦合关系[46] TOCSY 结合COSY谱可克服质子信号重叠无法解析的困难 判断糖残基的类型;TOCSY辅助COSY解析鉴定属于该耦合链的所有氢信号,即H1-H2→H1-H3→H1-H4→H1-H5→H1-H6 芦苇多糖中残基的氢信号[47] NOSEY 外观与COSY相似,其差别在于交叉峰表示的不是耦合关系,而是NOE关系 作为COSY的补充以识别谱峰,可确定糖残基间的连接方式和连接顺序,评估多糖二级结构相关参数 结合COSY、NOESY、HSQC确定龙葵中性多糖中糖残基的糖苷键[48] HMQC 反映直接相连的1H、13C核之间的耦合关系(1JCH),作用相当于H,C-COSY 用H,HCOSY等将氢质子的化学位移进行归属后,结合HSQC可对碳核的化学位移进行归属 绿茶中性多糖中的碳/质子交叉峰[49] HSQC 所得信息与HMQC相同,只是检测技术不同 区分异头质子和非异头质子、异头碳和非异头碳信号,得到糖残基的精确数量 灵芝多糖中异头氢和异头碳的耦合信号[50] HMBC 把1H核与长程耦合的13C核关联起来,灵敏度较高,数据收集时间较长 可获得多糖跨越糖苷键的远程H和C相关信息,即异头氢(碳)与另一糖残基相连位碳(氢)的耦合,确定糖残基之间的连接位置和连接顺序 山楂多糖组分HAW1-2中以1, 4-α-D-Glcp 为主链,部分被1, 4, 6-α-D-Glcp取代[51] 多糖中相同原子的化学位移差别不大,尤其是C2-C5和H2-H5的信号集中区,在1D-NMR中会有严重的信号重叠,因此,需要借助2D-NMR技术对难以辨认的信号进行归属,获取更多多糖分子的结构信息。2D-NMR信息是不同糖残基中C和H化学位移归属和糖连接顺序推断的主要依据,常用的2D-NMR有H-H化学位移相关谱(H-H COSY,Heteronuclear,Heteronuclear-Correlation Spectroscopy)、总相关能谱法(TOCSY,Total Correlation Spectroscopy)、二维核奥弗豪泽增强谱(NOESY,Nuclear Overhauser Effect Spectroscopy)等同核化学位移相关技术,以及异核多量子关系(HMQC,Heteronuclear Multiple Quantum Coherence)、异核单量子相干(HSQC,Heteronuclear Single Quantum Coherence)、异核多键相关(HMBC,Heteronuclear Multiple Bond Coherence)等异核化学位移相关技术[52]。XIA等[46]采用1D-NMR和2D-NMR技术测定麻黄茎多糖结构,获得1H-NMR、13C-NMR、1H-1H COSY、HSQC以及HMBC图谱及相关数据,提出了麻黄茎多糖的初步结构。然而,NMR分析仍存在一定的局限性,如测试温度和内标不统一,NMR数据需要甲基化和其他结果的支持,以及不能单独完整分析出具有复杂结构或高粘度的多糖的结构。因此,需要探索和开发具有更好分辨力和灵敏性的NMR技术,使得其能更大程度的阐明大分子物质结构。
1.4.3 气相色谱-质谱联用法
GC-MS法可鉴定多糖糖苷键结构,一般先通过碘甲烷甲基化多糖的游离羟基,之后水解、还原、乙酰化甲基化产物,使其衍生为部分甲基化的糖醛酸乙酸酯,之后再通过GC-MS分离鉴定。GC-MS因具有GC的高分辨率和MS的高灵敏度,此法快速、高效,广泛应用于多糖的分离和鉴定。郑恒光等[53]采用GC-MS分析杏鲍菇菇头多糖的糖苷键连接方式,研究发现其主要连接方式为1, 3-糖苷键和1, 6-糖苷键。CHOUANA等[54]采用GC-MS分析黄芪多糖,结果表明其是由β-(1, 4)-D-甘露吡喃糖基残基的骨架组成,并且在O-6位被单个α-半乳糖吡喃糖残基取代。HUANG等[55]采用1H NMR和13C NMR光谱结合GC-MS技术分析灵芝多糖,结果显示该多糖的主链为1, 4-二取代-葡萄糖基吡喃糖和1, 4, 6-三取代-葡萄糖基吡喃糖基,而支链主要是由1, 6-二取代-葡萄吡喃糖基和1, 4-二取代-半乳糖吡喃糖基残基组成。由此可知,GC-MS可以分析糖苷键类型、多糖的单糖组成,但是,当多糖中存在羧基和硫酸根等酸性基团时,会影响其在甲基化溶剂中的溶解,且糖醛酸中羧基的存在会导致酸性多糖不易气化和水解,限制了GC-MS进行结构分析[56]。
2. 植物多糖高级结构解析方法
植物多糖的空间结构十分复杂,提取方法、药材部位或是来源产地不同,其空间结构也会有所差异。对多糖空间结构的研究既有助于阐释构效关系,同时也可以完成多糖的质量控制。多糖高级结构的研究方法主要有原子力显微镜法(Atomic Force Microscopy,AFM)、X-射线衍射法(X-Ray Diffraction,XRD)和圆二色谱法(Circular Dichroismspectrum,CD)等,同时还可以利用计算机模拟多糖的空间构象,构建多糖的立体结构。
2.1 原子力显微镜法
原子力显微镜法是研究大分子在诱导条件下结构和动力学方面的构象转变,分析表面分子的拓扑结构,观察分子结构取向和空间分布的结构分析方法,其原理是使弹性悬臂形变但量不变,样品表面的起伏带动末端探针上下移动,记录针尖的移动轨迹,从而获得样品的表面形貌,该方法分析结果准确并且不会破坏样品[57]。JI等[58]采用AFM测定木枣中分离得到的酸性多糖组分PZMP2-2,结果显示PZMP2-2主要由带有一些球形聚集体的随机线性链组成,具有整体球形结构。此外,AFM还可用于研究多糖形成的凝胶网络结构。KAVITAKE等[59]通过AFM结合其他分析技术对印度传统谷物-豆类发酵品中的多糖进行结构分析,结果表明其为许多高度为39 nm的球形以及不规则形状的团块密集填充形成的网状结构。近年来,随着AFM探针技术的改进,使其操作方法愈加简便,所获得的图像分辨率也有所提高,分析结果更加可靠。因此,AFM广泛应用于分析多糖的空间结构。
2.2 X-射线衍射法
X-射线衍射法是用X射线照射晶体,引起晶体中原子的电子振动,射线出现干涉现象,从而获得衍射图谱[60]。通过衍射图谱可以获得物质晶型、分子构型及空间构象等信息。PARHAT等[61]采用XRD分析三种甘草种子多糖,结果显示,三种甘草种子多糖均同时具有晶体结构和非晶体结构。REN等[62]采用XRD分析藜麦多糖(QP)及其分离纯化得到的多糖组分的构象,研究发现QP未经进一步分离纯化就不能形成单晶,而是以无定形形式存在,QPI-I和QPI-I-I在2θ为28.4°和40.6°附近可以形成稳定的晶体结构,同时证明了分离纯化过程可以促进稳定晶体结构的形成。根据衍射图谱的差异,可以鉴别不同种类的多糖,从而达到控制多糖质量的目的。但应注意多糖通常不能结晶,需要在适宜的环境下通过外界诱导产生微晶态,才可使用X-射线衍射法进行分析。
2.3 圆二色谱法
圆二色谱法是用于糖类、蛋白质等化合物空间结构分析的一种常规手段,可以根据化合物分子中生色团的极化性和取向性来分析多糖的空间结构及构象转变。ZHANG等[63]采用CD在190~300 nm范围内分析以不同提取方法提取的肉苁蓉多糖空间结构,结果显示,不同提取方法的多糖具有不同的CD光谱,其中,超声纤维素酶辅助提取的多糖推测主要以有序结构存在,局部形成螺旋结构。XIA等[64]采用CD测定刺五加叶中获得的两种多糖组分ASP-B2和ASP-B3,结果显示,两者均呈无规则卷曲构象,且无三螺旋构象。由此可知,CD能够为多糖提供可靠的三维结构信息,因此,成为了解析多糖高级结构必不可少的工具。但由于中性多糖缺少特征紫外吸收基团,所以使用此法时通常需先对多糖进行结构修饰或与刚果红络合后再进行测定。
2.4 分子模型的构建
分子模型的构建是通过分子动力学模拟、分子对接、自由能计算等方法,模拟大分子的空间构象及分子间的相互作用关系,达到结构预测以及探讨机理的目的。但是,由于组成多糖的单糖种类多、结合方式不同、构象灵活且难以结晶等问题,将该法应用于多糖的报道较少。目前,可用的软件包括SWEET-II、GLYCAM碳水化合物构建器以及两个独立的软件包POLYS和CarbBuilder。POLYS软件可以用于多糖三维结构构建,首先,输入多糖的初级结构,以及X-射线衍射、NMR等实验数据的补充,然后软件可通过优化糖苷键的几何构型构建可靠的多糖立体结构[65]。KUTTEL等[66]报道了CarbBuilder 2.0版本,该版本支持哺乳动物和细菌来源的单糖,以及用于衍生单个糖残基的一系列取代基,还可以探索特定碳水化合物分子的可能构象范围。由CarbBuilder产生的分子模型可用于解释实验现象,或作为更复杂分子模拟的起点。
3. 植物多糖结构解析方法在质量控制中的应用
随着科学技术和仪器分析的发展,植物多糖的研究取得了较大的进展,在食品、药品、保健品等领域具有广泛的应用前景,多糖的质量是保证其应用的根本,因此,对多糖的质量进展控制至关重要。建立基于结构特征的指纹图谱,是保证其质量的有效方法。指纹图谱技术是基于样品的某种结构特性,采用色谱或光谱等结构分析方法得到能够代表该样品特征的色谱、光谱以及其它图谱数据资料,从而进行成分鉴定及质量控制的一种可量化手段,具有快速、灵敏、方便等优点[67]。通过使用指纹图谱分析,会得出复杂的色谱图与大量的数据。化学计量学通过使用多元分析处理数据,包括主成分分析(Principal Component Analysis,PCA)、层次聚类分析(Hierarchical Cluster Method,HCA)、偏最小二乘判别分析(Partial Least Squares-Discriiminate Analysis,PLS-DA)和相似性分析(Similarity Analysis,SA)等,可以为样本开发一个识别和鉴别模型。将指纹图谱与多元分析相结合,可以用于产品的质量评价、真伪鉴别及品种鉴别[68]。因此,指纹图谱结合化学计量学方法是一种有效的中药多糖质量控制方法。YANG等[69]建立了用高效液相色谱指纹图谱结合主成分分析(PCA)鉴定11批可可粉样品中多糖的方法,能够鉴别出掺假的可可粉。曾贞等[70]采集不同采收时间的铁皮石斛多糖的红外光谱信息,并对数据进行预处理,建立偏最小二乘回归模型预测铁皮石斛中总多糖含量,结果表明该模型可用于总多糖含量的快速预测,为铁皮石斛质量评价提供快速、有效的方法。但是,由于多糖结构的多样性和复杂性,仅靠单一分析方法或检测技术获得指纹图谱难以完整表征其化学指纹全貌,常常是在一个侧面上描述和表征多糖的部分结构,难以实现对结构的完整认知,而多维指纹图谱则能很好地解决这一问题。多维指纹图谱的概念是2000年罗国安教授提出的,即将多种分析仪器串联起来建立指纹图谱[71]。多维指纹图谱具有显著优点,可以在实现色谱技术分离的同时,进行光谱检测,其分析结果准确可靠,常用于解析多糖结构,为多糖质量控制提供依据。多维指纹图谱的建立及应用见表5。
表 5 多维指纹图谱的建立及应用Table 5. Establishment and application of multidimensional fingerprint应用 多糖 原料差异 构建方法 参考文献 质量控制 茶多糖 不同批次 HPGPC、UV、IR、IC [72] 决明子多糖 不同产地 FT-IR、HPLC、GC [73] 草珊瑚多糖 不同地区 HPSEC、HPLC、FT-IR [74] 太子参非淀粉多糖 不同产地 HPSEC-MALLS-RID、PACE-HPTLC [75] 黄芪多糖 不同品种 GC-MS、ESI--QTOF、HILIC-HPLC-ELSD [76] 品种鉴别 黄芪多糖 不同品种 FT-IR、NMR、UPLC/Q-TOF-MS [77] 枸杞多糖 不同地区 UV、HPSEC、FT-IR、HPLC [78] 金针菇多糖 不同品种 SEM、FT-IR、HPLC [79] 人参多糖 不同品种 GC-MS、HILIC-HPLC-ELSD、 HILIC-UHPLC-ESI--MS/MS [80] 莲藕多糖 不同品种 UV、FT-IR、HPLC、HPSEC [81] 4. 总结与展望
近年来,植物多糖因具有多种生物活性,成为了医药和食品开发领域的研究热点。本文从植物多糖的总糖含量、单糖组成、相对分子量及分布、糖苷键类型、空间结构等方面进行总结,为植物多糖的结构解析和质量控制提供一定的参考依据。但是,由于多糖结构的复杂性和研究手段的局限性,使得多糖的研究始终滞后于蛋白质和核酸的研究。目前,植物多糖的结构研究多集中在一级结构上,更高级结构的研究较难,并且没有一种方法能单独用于多糖高级结构的全面解析,对多糖高级结构与其活性关系的研究仍不够深入,这不仅仅因为多糖自身结构的复杂性及其空间结构的多态性,更主要的是由于缺乏表征其高级结构动态变化的技术手段,因此,单一的分析技术已不再适用。综上所述,探索植物多糖高级结构解析技术,研究结构及生物活性之间的关系,是未来研究多糖的重点。随着分析技术的发展,可以联用多种方法提高多糖结构表征的准确性,计算机辅助液态核磁图谱解析技术、计算机分子对接及分子动力学模拟技术预测多糖的结构;此外,还可在多糖结构层次上开展构效关系的研究,利用3D等新兴技术,对多糖结构进行修饰,增强其生物活性,使多糖作为新型和高附加值活性的天然产物在制药、生物医学、食品和化妆品等行业广泛应用。
-
表 1 植物多糖总糖含量测定方法的原理及优缺点比较
Table 1 Principles, advantages and disadvantages of determination methods of total sugar content of phytogenic polysaccharides
测定方法 原理 优点 缺点 苯酚-硫酸法 浓硫酸作用下,多糖水解成单糖,并脱水生成糠醛衍生物,与苯酚缩合成有色化合物,比色法确定含量 操作简单、重复性较好,显色后稳定性较好,蛋白质等物质不干扰测定[9] 苯酚易氧化,对于不同的多糖需要不同的优化 蒽酮-硫酸法 多糖在浓硫酸作用下水解、脱水,再与蒽酮结合成有色化合物,比色法确定含量 可测还原糖和总糖含量,简便、快速,适用于大量样品的测定 受蛋白质干扰,试剂需现配 3,5-二硝基水
杨酸比色法多糖在酸作用下水解产生还原糖,DNS与还原糖发生氧化还原反应,生成3-氨基-5-硝基水杨酸,产物在煮沸条件下显棕红色,且在一定浓度范围内颜色深浅与还原糖含量成比例关系 操作简便、快速,适合批量测定 不适用于自带颜色样品的检测[10] 地衣酚-盐酸法 多糖在盐酸中水解成糠醛及其衍生物,再与地衣酚反应,由吸光度根据标准曲线计算戊聚糖含量 操作简便,结果准确,重现性较好,回收率高 用单波长测定戊糖含量时,己糖存在着一定的干扰,而且当己糖的浓度为戊糖浓度的5倍以上时有必要除去体系中的己糖再进行测定[11] 斐林滴定法 多糖在酸作用下水解产生还原糖,还原糖可以将斐林试剂的Cu2+还原成Cu+,根据一定量的斐林试剂完全还原所需的还原糖量,计算样品中还原糖的含量 准确度高,重现性好,不需要精密仪器 该法需在沸腾状态下滴定,操作较繁琐 间接碘量法 多糖在酸作用下水解,加入适量碘-碘化钾发生氧化还原反应,用硫代硫酸钠进行滴定 定量测定快速,不需要精密仪器 测定结果易受滴定速度的影响,碘的挥发也会产生误差 表 2 植物多糖单糖组成的测定方法
Table 2 Determination method of monosaccharide composition of phytogenic polysaccharides
测定方法 优点 缺点 举例 参考文献 GC 可同时分析超过10种单糖,准确度高;所需样品量小,能检测到含量很低的单糖 操作繁琐,必须经过较长时间的衍生过程,且衍生易产生副产物,经常1种单糖出现2个或2个以上的异构峰,不利于快速分析 金银花多糖的质量控制 [16-17] HPLC 操作较为简单,没有异构峰产生,分析速度快 灵敏度比GC法低 怀牛膝多糖的质量评价,枸杞多糖的真伪鉴别,猪苓多糖的质量评价,海藻多糖的品种鉴别 [18-21] PC 仪器设备非常简单,操作简单易行 灵敏度较差,无法进行定量分析 糙苏多糖的单糖组成 [22] TLC 仪器设备简单,操作简单易行 灵敏度较差 玉屏风复合多糖,虫草多糖的质量控制,灵芝多糖的品种鉴别 [23-25] HPCE 灵敏度高 仪器设备要求较高,操作相对复杂 洋甘菊多糖的单糖组成,金樱子多糖的单糖组成 [26-27] 表 3 植物多糖糖苷键的常用测定方法
Table 3 Common determination methods of glycosidic bonds of phytogenic polysaccharides
测定指标 化学方法 仪器方法 糖苷的糖环形式(吡喃环或呋喃环) — IR、NMR等 单糖残基的的异头异构形式(α-或β-) 糖苷酶水解 IR、NMR等 糖苷键的连接顺序 部分酸水解、糖苷酶顺序水解 NMR等 糖苷键的连接位点 甲基化分析、高碘酸氧化、Smith降解 GC-MS、MSn(ESI-MS、Maldi-Tof)、NMR、离子淌度-质谱联用等 表 4 NMR的特点及在多糖结构研究中的应用
Table 4 Characteristics of NMR and its application in polysaccharide structure study
类型 特点 应用 举例 1H-NMR 1H信号集中于3~6 ppm,且重叠严重,分辨困难 根据4.5~5.5 ppm的异头质子信号确定单糖种类;还可以判断糖环类型(4.3~4.8 ppm为β构型,5.0 ppm以上为α构型);H2-H6信号(3.2~4.5 ppm)集中,很难逐一归属;有甲基(1.0 ppm附近)、乙酰基(2.0 ppm附近)、硫酸根和磷酸根基团取代时,1H化学位移通常向下偏移约0.2~0.5 ppm 竹荪多糖为α构型[43];霍山石斛多糖为β构型[44] 13C-NMR 化学位移范围较1H-NMR广,分布在60~110 ppm,分辨率好,谱线很少重叠,但样品需求量较大 根据95~105 ppm的异头碳信号确定单糖组成;判断糖环的构型(101 ppm以上为β构型异头碳,95~103 ppm之间为α构型);判断取代基团:78~85 ppm是C2-C5中取代位置上的碳信号,65~80 ppm区域为未被取代的碳信号,61 ppm附近为未被取代的C6信号,而被取代的C6信号则往低场移至69 ppm附近,甲基、乙酰基、硫酸根和磷酸根基团取代的多糖,13C的化学位移通常向下偏移6~7 ppm 玫瑰花废弃物果胶多糖包括α构型和β构型[45] H-H COSY 提供分子内质子间耦合关系 确定异头质子的构型及羟基氢原子与氢原子之间的耦合与否,从而确定取代基的位置 麻黄茎多糖中质子间的耦合关系[46] TOCSY 结合COSY谱可克服质子信号重叠无法解析的困难 判断糖残基的类型;TOCSY辅助COSY解析鉴定属于该耦合链的所有氢信号,即H1-H2→H1-H3→H1-H4→H1-H5→H1-H6 芦苇多糖中残基的氢信号[47] NOSEY 外观与COSY相似,其差别在于交叉峰表示的不是耦合关系,而是NOE关系 作为COSY的补充以识别谱峰,可确定糖残基间的连接方式和连接顺序,评估多糖二级结构相关参数 结合COSY、NOESY、HSQC确定龙葵中性多糖中糖残基的糖苷键[48] HMQC 反映直接相连的1H、13C核之间的耦合关系(1JCH),作用相当于H,C-COSY 用H,HCOSY等将氢质子的化学位移进行归属后,结合HSQC可对碳核的化学位移进行归属 绿茶中性多糖中的碳/质子交叉峰[49] HSQC 所得信息与HMQC相同,只是检测技术不同 区分异头质子和非异头质子、异头碳和非异头碳信号,得到糖残基的精确数量 灵芝多糖中异头氢和异头碳的耦合信号[50] HMBC 把1H核与长程耦合的13C核关联起来,灵敏度较高,数据收集时间较长 可获得多糖跨越糖苷键的远程H和C相关信息,即异头氢(碳)与另一糖残基相连位碳(氢)的耦合,确定糖残基之间的连接位置和连接顺序 山楂多糖组分HAW1-2中以1, 4-α-D-Glcp 为主链,部分被1, 4, 6-α-D-Glcp取代[51] 表 5 多维指纹图谱的建立及应用
Table 5 Establishment and application of multidimensional fingerprint
应用 多糖 原料差异 构建方法 参考文献 质量控制 茶多糖 不同批次 HPGPC、UV、IR、IC [72] 决明子多糖 不同产地 FT-IR、HPLC、GC [73] 草珊瑚多糖 不同地区 HPSEC、HPLC、FT-IR [74] 太子参非淀粉多糖 不同产地 HPSEC-MALLS-RID、PACE-HPTLC [75] 黄芪多糖 不同品种 GC-MS、ESI--QTOF、HILIC-HPLC-ELSD [76] 品种鉴别 黄芪多糖 不同品种 FT-IR、NMR、UPLC/Q-TOF-MS [77] 枸杞多糖 不同地区 UV、HPSEC、FT-IR、HPLC [78] 金针菇多糖 不同品种 SEM、FT-IR、HPLC [79] 人参多糖 不同品种 GC-MS、HILIC-HPLC-ELSD、 HILIC-UHPLC-ESI--MS/MS [80] 莲藕多糖 不同品种 UV、FT-IR、HPLC、HPSEC [81] -
[1] 边亮, 陈华国, 周欣. 植物多糖的抗肿瘤活性研究进展[J]. 食品科学,2020,41(7):275−282. [BIAN L, CHEN H G, ZHOU X. Recent advances in understanding the antitumor activity of polysaccharides from plants[J]. Food Science,2020,41(7):275−282. doi: 10.7506/spkx1002-6630-20190330-392 [2] 吴梦琪, 夏玮, 徐志珍, 等. 植物多糖的分离纯化、结构解析及生物活性研究进展[J]. 化学世界,2019,60(11):737−747. [WU M Q, XIA W, XU Z Z, et al. Review on isolation and purification, structural elucidation and biological activity of botanical polysaccharides[J]. Chemical World,2019,60(11):737−747. [3] 唐圆, 谢果珍. 多糖与肠道菌群的相互作用研究进展[J]. 现代农业科技,2020(9):225−227. [TANG Y, XIE G Z. Research progress on interaction between polysaccharide and gut microbiota[J]. Modern Agricultural Science and Technology,2020(9):225−227. doi: 10.3969/j.issn.1007-5739.2020.09.135 [4] 张蕊馨, 张彦华, 周迎春, 等. 中药多糖化学结构及药理作用研究进展[J]. 黑龙江中医药,2018,47(1):88−89. [ZHANG R X, ZHANG Y H, ZHOU Y C, et al. Research progress on the chemical structure and pharmacological effects of polysaccharides from traditional Chinese medicine[J]. Heilongjiang Journal of Traditional Chinese Medicine,2018,47(1):88−89. [5] 张永文. 中药多糖成分的质控及评价要点[J]. 中国新药杂志,2015,24(3):260−263, 280. [ZHANG Y W. Quality control and evaluation of polysaccharide compositions in Chinese herbal medicines[J]. Chinese Journal of New Drugs,2015,24(3):260−263, 280. [6] 高怡婷, 柳文媛. 多糖的制备工艺与质量控制研究进展[J]. 药学进展,2016,40(3):205−211. [GAO Y T, LIU W Y. Advances in research on preparation technique and quality control of polysaccharides[J]. Progress in Pharmaceutical Sciences,2016,40(3):205−211. [7] HAN Q B. Critical problems stalling progress in natural bioactive polysaccharide research and development[J]. Journal of Agricultural and Food Chemistry,2018,66(18):4581−4583. doi: 10.1021/acs.jafc.8b00493
[8] 谭西, 周欣, 陈华国. 植物多糖构效关系研究进展[J]. 中国中药杂志,2017,42(21):4104−4109. [TAN X, ZHOU X, CHEN H G. Structure-activity relationship of plant polysaccharides[J]. China Journal of Chinese Materia Medica,2017,42(21):4104−4109. [9] 肖作奇. 中药多糖质量控制研究进展[J]. 中国医药导报,2015,12(4):159−164. [XIAO Z Q. Studies advances on quality control of polysaccharide from traditional Chinese medicine[J]. China Medical Herald,2015,12(4):159−164. [10] 张学英, 黄忠意, 章发盛, 等. 两种检测还原糖方法的比较[J]. 食品与机械,2017,33(2):66−69. [ZHANG X Y, HUANG Z Y, ZHANG F S, et al. Comparative study on two methods for sugar detection in Jerusalem Artichoke[J]. Food & Machinery,2017,33(2):66−69. [11] 段永忠, 唐湘华, 慕跃林, 等. 双波长法测定二元混合体系中戊糖的含量[J]. 生物技术,2009,19(1):44−46. [DUAN Y Z, TANG X H, MU Y L, et al. Quantitative determination of pentose in duplex mixture system using double-wavelength method[J]. Biotechnology,2009,19(1):44−46. [12] 张妍, 刘太林. 苯酚-硫酸法与蒽酮-硫酸法测定麦冬中麦冬多糖含量的比较研究[J]. 现代食品,2018(18):95−102. [ZHANG Y, LIU T L. Comparison of phenol-sulfuric and anthrone-sulfuric acid methods for determination of polysaccharide in Radix Ophiopogonis[J]. Modern Food,2018(18):95−102. [13] 张小贝, 朱国鹏, 祝志欣, 等. 利用3, 5-二硝基水杨酸法测定菜用甘薯叶中的多糖含量[J]. 热带生物学报,2017,8(3):359−363,377. [ZHANG X B, ZHU G P, ZHU Z X, et al. Determination of the polysaccharide content of sweet potato leaves by using 3'5'-dinitrosalicylic acid (DNS)[J]. Journal of Tropical Biology,2017,8(3):359−363,377. [14] 陈立江, 王菁, 刘宇, 等. 南瓜多糖含量测定方法比较[J]. 辽宁大学学报(自然科学版),2014,41(1):76−81. [CHEN L J, WANG J, LIU Y, et al. The content of pumpkin polysaccharide determination comparison[J]. Journal of Liaoning University(Natural Science Edition),2014,41(1):76−81. [15] 国家药典委员会. 中华人民共和国药典: 一部[S]. 2020年版. 北京: 中国医药科技出版社, 2020: 86−320. Chinese Pharmacopoeia Commission. Pharmacopoeia of the People’s Republic of China (in Chinese): Vol. 1[S]. 2020 Edition. Beijing: China Medical Science Press, 2020: 76−81.
[16] 司雄元, 牛子牛, 储思琴, 等. 气相色谱法测定多糖样品中单糖的含量[J]. 理化检验(化学分册),2018,54(10):1198−1201. [SI X Y, NIU Z N, CHU S Q, et al. GC determination of monosaccharides in polysaccharides samples[J]. Physical Testing and Chemical Analysis (Part B: Chemical Analysis),2018,54(10):1198−1201. [17] 丁洁, 闫光玲, 杨培, 等. 金银花多糖的指纹图谱及体外抗病毒活性研究[J]. 中国药房,2020,31(9):1061−1067. [DING J, YAN G L, YANG P, et al. Study on fingerprint and in vitro antiviral activity of Lonicera japonica polysaccharide[J]. China Pharmacy,2020,31(9):1061−1067. doi: 10.6039/j.issn.1001-0408.2020.09.08 [18] 王小燕, 郭常润, 常军民, 等. 怀牛膝多糖的柱前衍生化-HPLC指纹图谱建立及单糖成分含量测定[J]. 中国药房,2021,32(3):294−300. [WANG X Y, GUO C R, CHANG J M, et al. Establishment of pre-column derivatization-HPLC fingerprint and content determination of monosaccharide composition from Achyranthes bidentata polysaccharides[J]. China Pharmacy,2021,32(3):294−300. doi: 10.6039/j.issn.1001-0408.2021.03.08 [19] 席璟睿, 张懿琳, 吴梦琪, 等. 基于化学计量学的枸杞多糖部分酸水解产物PMP-HPLC指纹图谱[J/OL]. 食品工业科技, 2021: 1−12 (2021-03-18). XI J R, ZHANG Y L, WU M Q, et al. PMP-HPLC fingerprint of partial acid hydrolysate of Lycium barbarum polysaccharides based on the chemometric methods[J/OL]. Science and Technology of Food Industry, 2021: 1−12 (2021-03-18).
[20] 赖戈娜, 贾文玉, 罗思婉, 等. 猪苓多糖的PMP柱前衍生化-HPLC指纹图谱研究[J]. 中国药房,2020,31(7):788−793. [LAI G N, JIA W Y, LUO S W, et al. Study on PMP pre-column derivatization-HPLC fingerprint of Polyporus polysaccharide[J]. China Pharmacy,2020,31(7):788−793. doi: 10.6039/j.issn.1001-0408.2020.07.05 [21] LONG H L, ZHANG J X, GUO J L, et al. Development of specific and quantitative methods for the quality control of the polysaccharides from sea-tangle and sargassum[J]. Chinese Journal of Natural Medicines,2016,14(12):954−960. doi: 10.1016/S1875-5364(17)30022-5
[22] 田光辉, 刘存芳, 危冲, 等. 中药糙苏中的多糖研究[J]. 食品科技,2009,34(6):206−209. [TIAN G H, LIU C F, WEI C, et al. Study on the polysaccharide obtained from medicinal herb Phlomis umbrosa[J]. Food Science and Technology,2009,34(6):206−209. [23] 王少杰, 巴娟, 张勇军, 等. 玉屏风复合多糖的质量控制研究[J]. 动物医学进展,2019,40(11):68−72. [WANG S J, BA J, ZHANG Y J, et al. Study on quality control of Yupingfeng polysaccharides[J]. Progress in Veterinary Medicine,2019,40(11):68−72. [24] 邓勇, 张杰良, 王兰英, 等. 薄层色谱法分析不同虫草多糖的单糖组成[J]. 药物分析杂志,2018,38(1):13−21. [DENG Y, ZHANG J L, WANG L Y, et al. Analysis of monosaccharide composition in polysaccharides of Cordyceps spp. by TLC[J]. Chinese Journal of Pharmaceutical Analysis,2018,38(1):13−21. [25] DI X, CHAN K K C, LEUNG H W, et al. Fingerprint profiling of acid hydrolyzates of polysaccharides extracted from the fruiting bodies and spores of Lingzhi by high-performance thin-layer chromatography[J]. Journal of Chromatography A,2003,1018(1):85−95. doi: 10.1016/j.chroma.2003.07.015
[26] 陈蕾, 何新苗, 孟磊, 等. 洋甘菊多糖中单糖组分的高效液相色谱及高效毛细管电泳测定比较[J]. 食品与药品,2019,21(5):347−351. [CHEN L, HE X M, MENG L, et al. Comparison of monosaccharide composition analysis of polysaccharide from Matricaria Chamomilla L. by HPLC and HPCE[J]. Food and Drug,2019,21(5):347−351. doi: 10.3969/j.issn.1672-979X.2019.05.003 [27] 陈传平, 吴剑峰, 方士英, 等. 柱前衍生-高效毛细管电泳法分析金樱子多糖中单糖组成[J]. 黄山学院学报,2018,20(3):60−64. [CHEN C P, WU J F, FANG S Y, et al. An analysis on the monosaccharide composition of polysaccharide in Rosa laevigata by pre-column derivatization and high performance capillary electrophoresis[J]. Journal of Huangshan University,2018,20(3):60−64. doi: 10.3969/j.issn.1672-447X.2018.03.016 [28] 赵颖, 宋新波, 张丽娟, 等. 高效凝胶色谱法测定甘草多糖分子量及其分子量分布[J]. 天津中医药,2015,32(1):46−48. [ZHAO Y, SONG X B, ZHANG L J, et al. Determination of molecular weight and weight distribution in Licorice polysaccharide by HPGPC[J]. Tianjin Journal of Traditional Chinese Medicine,2015,32(1):46−48. [29] ZHAO S J, HAN Z M, YANG L M, et al. Extraction, characterization and antioxidant activity evaluation of polysaccharides from Smilacina japonica[J]. International Journal of Biological Macromolecules,2020,151:576−583. doi: 10.1016/j.ijbiomac.2020.02.015
[30] 王巧娥, 谢丹, 钱洁, 等. 库拉索芦荟凝胶多糖的GPC指纹图谱研究[J]. 中药材,2015,38(10):2070−2075. [WANG Q E, XIE D, QIAN J, et al. GPC fingerprint chromatograms of Aloe vera leaf gel polysaccharides[J]. Journal of Chinese Medicinal Materials,2015,38(10):2070−2075. [31] 邓樑钧, 张维, 邱飞. 短葶山麦冬多糖质量控制方法研究[J]. 海峡药学,2017,29(6):32−35. [DENG L J, ZHANG W, QIU F. Studies on the method of quality control of Liriope Muscari (Decne) Baily polysaccharides[J]. Strait Pharmaceutical Journal,2017,29(6):32−35. doi: 10.3969/j.issn.1006-3765.2017.06.014 [32] 侯重文, 朱梓昂, 张金华, 等. 高效凝胶色谱法测定贻贝多糖含量及分子量[J]. 中国生化药物杂志,2016,36(11):9−12. [HOU Z W, ZHU Z A, ZHANG J H, et al. Determination of the content and the molecular weight of Mussel polysaccharide by GPC[J]. Chinese Journal of Biochemical and Pharmaceuticals,2016,36(11):9−12. [33] 闫光玲, 张锋, 金娟, 等. 金银花多糖分子量及单糖组成研究[J]. 中国中医药信息杂志,2019,26(2):97−101. [YAN G L, ZHANG F, JIN J, et al. Study on molecular weight and monosaccharide composition of polysaccharide from Lonicerae Japonicae Flos[J]. Chinese Journal of Information on Traditional Chinese Medicine,2019,26(2):97−101. doi: 10.3969/j.issn.1005-5304.2019.02.021 [34] XU J, LI S L, YUE R Q, et al. A novel and rapid HPGPC-based strategy for quality control of saccharide-dominant herbal materials: Dendrobium officinale, a case study[J]. Analytical & Bioanalytical Chemistry,2014,406(25):6409−6417.
[35] 赵珊, 许加超, 付晓婷, 等. 褐藻寡糖分子量测定方法的研究[J]. 食品工业科技,2011,32(12):486−488. [ZHAO S, XU J C, FU X T, et al. Study on the determination method of molecular weight of alginate oligosaccharide[J]. Science and Technology of Food Industry,2011,32(12):486−488. [36] 秦建鲜, 黄锁义. 中药多糖相对分子质量测定方法的概述[J]. 中国实验方剂学杂志,2015,21(14):226−229. [QIN J X, HUANG S Y. Determination methods of molecular weight of polysaccharides in traditional Chinese medicine[J]. Chinese Journal of Experimental Traditional Medical Formulae,2015,21(14):226−229. [37] XU S Q, XU X J, ZHANG L N, et al. Effect of heating on chain conformation of branched β-Glucan in water[J]. Journal of Physical Chemistry B,2013,117(28):8370−8377. doi: 10.1021/jp403202u
[38] 胡卫珍, 齐振宇, 陈晓芳, 等. 凝胶渗透色谱联用多角度激光光散射测定铁皮石斛多糖分子量及其分布[J]. 浙江农业科学,2020,61(6):1166−1167,1175. [HU W Z, QI Z Y, CHEN X F, et al. Determination of molecular weight and distribution of polysaccharides in Dendrobium officinale by size exclusion chromatography-multi angle laser light scattering[J]. Journal of Zhejiang Agricultural Sciences,2020,61(6):1166−1167,1175. [39] 王川, 张燕, 李楠, 等. HPSEC-ELSD法同时测定白及多糖的分子量和含量[J]. 中国药房,2018,29(9):1198−1201. [WANG C, ZHANG Y, LI N, et al. Determination of molecular weight and content of Bletilla striata polysaccharide by HPSEC-ELSD[J]. China Pharmacy,2018,29(9):1198−1201. doi: 10.6039/j.issn.1001-0408.2018.09.11 [40] 张鑫, 刘洋, 程亚茹, 等. 枸杞多糖分子量分布测定与抗炎活性关联研究[J]. 北京中医药大学学报,2020,43(11):959−964. [ZHANG X, LIU Y, CHENG Y R, et al. Molecular weight distribution of Lycium barbarum polysaccharides and its relation with anti-inflammatory activity[J]. Journal of Beijing University of Traditional Chinese Medicine,2020,43(11):959−964. doi: 10.3969/j.issn.1006-2157.2020.11.011 [41] JIA Y A, XUE Z H, WANG Y J, et al. Chemical structure and inhibition on α-glucosidase of polysaccharides from corn silk by fractional precipitation[J]. Carbohydrate Polymers,2021,252(3):117185.
[42] ABUDUWAILI A, MUTAILIFU P, NUERXIATI R, et al. Structure and biological activity of polysaccharides from Nitraria sibirica pall fruit[J]. Food Bioscience,2021,40(83):100903.
[43] SHI X D, LI O Y, YIN J Y, et al. Structure identification of α-glucans from Dictyophora echinovolvata by methylation and 1D/2D NMR spectroscopy[J]. Food Chemistry,2019,271:338−344. doi: 10.1016/j.foodchem.2018.07.160
[44] DENG Y, CHEN L X, HAN B X, et al. Qualitative and quantitative analysis of specific polysaccharides in Dendrobium huoshanense by using saccharide mapping and chromatographic methods[J]. Journal of Pharmaceutical and Biomedical Analysis,2016,129:163−171. doi: 10.1016/j.jpba.2016.06.051
[45] WU M Q, LI W, ZHANG Y L, et al. Structure characteristics, hypoglycemic and immunomodulatory activities of pectic polysaccharides from Rosa setate x Rosa rugosa waste[J]. Carbohydrate polymers,2021,253:117190. doi: 10.1016/j.carbpol.2020.117190
[46] XIA Y G, LIANG J, YANG B Y, et al. Structural studies of an arabinan from the stems of Ephedra sinica by methylation analysis and 1D and 2D NMR spectroscopy[J]. Carbohydrate Polymers,2015,121:449−456.
[47] ZHOU R M, CUI M X, WANG Y, et al. Isolation, structure identification and anti-inflammatory activity of a polysaccharide from Phragmites rhizoma[J]. International Journal of Biological Macromolecules,2020,161:810−817. doi: 10.1016/j.ijbiomac.2020.06.124
[48] YUE H, XU Q Q, BIAN G Y, et al. Structure characterization and immunomodulatory activity of a new neutral polysaccharide SMP-0b from Solanum muricatum[J]. International Journal of Biological Macromolecules,2020,155:853−860. doi: 10.1016/j.ijbiomac.2019.11.071
[49] YIN L, FU S S, WU R J, et al. A neutral polysaccharide from green tea: Structure, effect on α-amylase activity and hydrolysis property[J]. Archives of Biochemistry and Biophysics,2020,687:108369. doi: 10.1016/j.abb.2020.108369
[50] 顾菲菲, 李佳, 杨晨东, 等. 碱提灵芝多糖的分离纯化、结构表征及免疫活性评价[J]. 中草药,2018,49(10):2359−2364. [GU F F, LI J, YANG C D, et al. Fractionation, structural characterization, and immunomodulatory activity of polysaccharide isolated from Ganoderma lucidum[J]. Chinese Traditional and Herbal Drugs,2018,49(10):2359−2364. [51] GUO C L, ZHANG S H, WANG Y Q, et al. Isolation and structure characterization of a polysaccharide from Crataegus pinnatifida and its bioactivity on gut microbiota[J]. International Journal of Biological Macromolecules,2020,154:82−91. doi: 10.1016/j.ijbiomac.2020.03.058
[52] 刘文娟, 郝晓伟, 靖会, 等. 植物多糖的高级结构解析技术进展[J]. 西北药学杂志,2017,32(6):810−813. [LIU W J, HAO X W, JING H, et al. Review of the analytical techniques for advanced structures of botanical polysaccharides[J]. Northwest Pharmaceutical Journal,2017,32(6):810−813. doi: 10.3969/j.issn.1004-2407.2017.06.037 [53] 郑恒光, 沈恒胜, 杨道富, 等. 杏鲍菇菇头多糖的结构鉴定及生物活性评价[J]. 食品科学,2019,40(22):7−13. [ZHENG H G, SHEN H S, YANG D F, et al. Structural characterization and antitumor activity of crude polysaccharide extracted from the stalk residue of Pleurotus eryngii[J]. Food Science,2019,40(22):7−13. doi: 10.7506/spkx1002-6630-20181126-292 [54] CHOUANA T, PIERRE G, VIAL C, et al. Structural characterization and rheological properties of a galactomannan from Astragalus gombo Bunge seeds harvested in Algerian Sahara[J]. Carbohydrate Polymers,2017,175:387−394. doi: 10.1016/j.carbpol.2017.08.003
[55] HUANG S Q, LI J W, LI Y Q, et al. Purification and structural characterization of a new water-soluble neutral polysaccharide GLP-F1-1 from Ganoderma lucidum[J]. International Journal of Biological Macromolecules,2011,48(1):165−169. doi: 10.1016/j.ijbiomac.2010.10.015
[56] 刘丽丽. 酸性多糖甲基化分析方法的改进[D]. 青岛: 中国海洋大学, 2014. LIU L L. Improvement of methods for methylation analysis of acidic polysaccharides[D]. Qingdao: Ocean University China, 2014.
[57] 徐航, 朱锐, 刘玮, 等. 多糖高级结构解析方法的研究进展[J]. 药学进展,2015,39(5):364−369. [XU H, ZHU R, LIU W, et al. Research progress in analytical methods for advanced structures of polysaccharides[J]. Progress in Pharmaceutical Sciences,2015,39(5):364−369. [58] JI X L, ZHANG F, ZHANG R, et al. An acidic polysaccharide from Ziziphus Jujuba cv. Muzao: Purification and structural characterization[J]. Food Chemistry,2019,274:494−499. doi: 10.1016/j.foodchem.2018.09.037
[59] KAVITAKE D, DEVI P B, SINGH S P, et al. Characterization of a novel galactan produced by Weissella confuse KR780676 from an acidic fermented food[J]. International Journal of Biological Macromolecules,2016,86:681−689. doi: 10.1016/j.ijbiomac.2016.01.099
[60] 刘贺, 张红运, 杨立娜, 等. 多糖化学结构解析研究进展[J]. 渤海大学学报(自然科学版),2018,39(2):97−106. [LIU H, ZHANG H Y, YANG L N, et al. A review about the research of polysaccharide chemical structure analysis[J]. Journal of Bohai University(Natural Science Edition),2018,39(2):97−106. [61] PARHAT R, AYTURSUN A, MA S J, et al. Isolations, characterizations and bioactivities of polysaccharides from the seeds of three species Glycyrrhiza[J]. International Journal of Biological Macromolecules,2020,145:364−371. doi: 10.1016/j.ijbiomac.2019.12.107
[62] REN Y P, LIU S X. Effects of separation and purification on structural characteristics of polysaccharide from quinoa (Chenopodium quinoa willd)[J]. Biochemical and biophysical research communications,2020,522(2):286−291. doi: 10.1016/j.bbrc.2019.10.030
[63] ZHANG W J, HUANG J, WANG W, et al. Extraction, purification, characterization and antioxidant activities of polysaccharides from Cistanche tubulosa[J]. International Journal of Biological Macromolecules,2016,93:448−458. doi: 10.1016/j.ijbiomac.2016.08.079
[64] XIA Y G, HUANG Y X, LIANG J, et al. Comparable studies of two polysaccharides from leaves of Acanthopanax senticosus: Structure and antioxidation[J]. International Journal of Biological Macromolecules,2020,147:350−362. doi: 10.1016/j.ijbiomac.2019.12.244
[65] ENGELSEN S B, HANSEN P I, PEREZ S. POLYS 2.0: An open source software package for building three-dimensional structures of polysaccharides[J]. Biopolymers,2014,101(7):733−743. doi: 10.1002/bip.22449
[66] KUTTEL M M, STAHLE J, WIDMALM G. Carb Builder: Software for building molecular models of complex oligo- and polysaccharide structures[J]. Journal of Computational Chemistry,2016,37(22):1−8.
[67] 郑振佳, 朱文卿, 梁浩, 等. 指纹图谱在食品分析中的应用研究进展[J/OL]. 食品工业科技, 2021: 1−20 (2021-03-18). ZHENG Z J, ZHU W Q, LIANG H, et al. Advances in application of fingerprint technology in food analysis[J/OL]. Science and Technology of Food Industry, 2021: 1−20 (2021-03-18).
[68] ARYANI S, MOHAMAD R, LATIFAH KDA. Discrimination of red and white rice bran from Indonesia using HPLC fingerprint analysis combined with chemometrics[J]. Food Chemistry,2017,221:1717−1722. doi: 10.1016/j.foodchem.2016.10.114
[69] YANG W L, HU M H, CHEN S W, et al. Identification of adulterated cocoa powder using chromatographic fingerprints of polysaccharides coupled with principal component analysis[J]. Food Analytical Methods,2015,8(9):2360−2367. doi: 10.1007/s12161-015-0126-6
[70] 曾贞, 孙恒, 陈骏飞, 等. FTIR结合化学计量学快速预测铁皮石斛中总多糖含量[J]. 江西农业学报,2018,30(1):117−121. [ZENG Z, SUN H, CHEN J F, et al. Rapid forecast of total polysaccharide content in Dendrobium officinale by FTIR combined with chemometrics[J]. Acta Agriculturae Jiangxi,2018,30(1):117−121. [71] 曹玲, 董辉, 孙晖, 等. 多维指纹图谱在中药分析中的应用[C]. 中华中医药学会. 中华中医药学会第七次中药分析学术交流会会议论文集. 中华中医药学会: 中华中医药学会, 2014: 509−511. CAO L, DOGN H, SUN H, et al. The application of multi-dimensional fingerprints on TCM quality evaluation[C]. The Chinese Society of Traditional Chinese Medicine. Proce edings of the Seventh TCM Analysis Academic Exchange Conference of the Chinese Society of Traditional Chinese Medicine. Chinese Society of Traditional Chinese Medicine: Chinese Society of TCM, 2014: 509−511.
[72] WANG Y F, XIAN J H, XI X G, et al. Multi-fingerprint and quality control analysis of tea polysaccharides[J]. Carbohydrate Polymers,2013,92(1):583−590. doi: 10.1016/j.carbpol.2012.09.004
[73] CHENG J, HE S Y, WAN Q, et al. Multiple fingerprinting analyses in quality control of Cassiae Semen polysaccharides[J]. Journal of Chromatography B,2018,1077-1078:22−27. doi: 10.1016/j.jchromb.2018.01.032
[74] LI H, GONG X Q, WANG Z C, et al. Multiple fingerprint profiles and chemometrics analysis of polysaccharides from Sarcandra glabra[J]. International Journal of Biological Macromolecules,2019,123:957−967. doi: 10.1016/j.ijbiomac.2018.11.103
[75] DENG Y, HAN B X, HU D J, et al. Qualitation and quantification of water soluble non-starch polysaccharides from Pseudostellaria heterophylla in China using saccharide mapping and multiple chromatographic methods[J]. Carbohydrate Polymers,2018,199:619−627. doi: 10.1016/j.carbpol.2018.06.063
[76] XIA Y G, YU S M, LIANG J, et al. Chemical fingerprinting techniques for the differentiation of polysaccharides from genus Astragalus[J]. Journal of Pharmaceutical and Biomedical Analysis,2020,178:112898. doi: 10.1016/j.jpba.2019.112898
[77] LI C Y, CHEN H Y, LIU W P, et al. Multi-fingerprint profiling combined with chemometric methods for investigating the quality of Astragalus polysaccharides[J]. International Journal of Biological Macromolecules,2019,123:766−774. doi: 10.1016/j.ijbiomac.2018.11.037
[78] LIU W, XU J N, ZHU R, et al. Fingerprinting profile of polysaccharides from Lycium barbarum using multiplex approaches and chemometrics[J]. International Journal of Biological Macromolecules,2015,78:230−237. doi: 10.1016/j.ijbiomac.2015.03.062
[79] DONG Y T, PEI F, SU A X, et al. Multiple fingerprint and fingerprint-activity relationship for quality assessment of polysaccharides from Flammulina velutipes[J]. Food and Chemical Toxicology,2020,135:110944. doi: 10.1016/j.fct.2019.110944
[80] XIA Y G, LI X, YU L S, et al. Structural-fingerprinting of polysaccharides to discern Panax species by means of gas-liquid chromatography and mass spectrometry[J]. International Journal of Biological Macromolecules,2020,151:932−943. doi: 10.1016/j.ijbiomac.2020.02.194
[81] WANG H X, YI Y, SUN J, et al. Fingerprint profiling of polysaccharides from different parts of lotus root varieties[J]. Rsc Advances,2018,8(30):16574−16584. doi: 10.1039/C8RA01104D





 下载:
下载:
 下载:
下载:
