Study on Anti-osteoporosis Substance and Mechanism of Action of Spatholobi Caulis Based on Network Pharmacology and Molecular Docking
-
摘要: 目的:探讨中草药鸡血藤抗骨质疏松的药效物质及作用机制。方法:通过TCMSP数据库筛选化合物,应用PharmMapper数据库获得靶标,通过Cytoscape 3.7.2软件对化合物-靶点网络进行ClueGo注释和KEGG富集分析,确定鸡血藤抗骨质疏松作用的关键通路,并通过CytoNCA插件计算节点的介数、接近中心性和子网络中心性。通过叠加三个指标的前10%节点,筛选出分子对接分析的关键靶点。结果:该研究筛选出鸡血藤14个化合物,涉及221个骨质疏松靶点,应用ClueGo插件获得其生物靶点网络(456个节点,5723条边)和KEGG通路网络(124个节点,365条边)。结合CytoNCA插件的三个指标综合筛选出酪氨酸蛋白激酶(SRC)和组织蛋白酶K(CTSK)两个关键蛋白。分子对接结果表明,鸡血藤主要成分JXT-13和JXT-06与SRC和CTSK的平均结合能分别为−6.32和−5.47 kcal/mol,与原配体在蛋白质中构象稳定、强结合能相近。结论:鸡血藤中的两个有效成分通过抑制SRC和CTSK蛋白发挥抗骨质疏松的作用。因此,通过识别成分或靶点来阐明中草药的作用机制是一种有效的综合策略。Abstract: Objective: To investigate the anti-osteoporotic substances and mechanism of action of the Chinese herbal medicine Spatholobi Caulis. Methods: The active ingredients were acquired with TCMSP, and the targets were obtained with PharmMapper. The common targets were used for the construction of an “ingredient-target” network by Cytoscape 3.7.2, ClueGo and KEGG enrichment analysis were carried out to determine the key pathway of the anti-osteoporosis effect of Spatholobi Caulis. The betweenness, closeness and subnetwork centrality of the nodes were calculated by the CytoNCA. The first 10% nodes of the three indicators were overlaid to screen the key targets for molecular docking analysis. Results: Fourteen active ingredients of Spatholobi Caulis were screened out, involving 221 osteoporotic targets. Its biological target network (456 nodes, 5723 edges) and KEGG pathway network (124 nodes, 365 edges) were obtained by using ClueGo. Two key proteins, SRC and CTSK, were comprehensively screened out by combining the three indicators of the CytoNCA. The results of molecular docking showed that the average binding energy of components JXT-13 and JXT-06 of Spatholobi Caulis to SRC and CTSK were −6.32 and −5.47 kcal/mol, respectively. This result was similar to the original ligand with stable conformation and strong binding energy in protein. Conclusion: The two active components of Spatholobi Caulis play an anti-osteoporosis role by inhibiting SRC and CTSK proteins. Therefore, elucidating the mechanism of action of Chinese herbal medicine by identifying components or targets is an effective and comprehensive strategy.
-
Keywords:
- Spatholobi Caulis /
- osteoporosis /
- network pharmacology /
- molecular docking /
- material basis
-
随着人口老龄化发展,骨质疏松症(osteoporosis,OP)已成为世界上第七大常见疾病[1],给医疗和社会造成严重的负担[2]。研究表明骨质疏松的发生发展和饮食息息相关[3],采用药膳食疗法改善骨质疏松症越来越受到认可。Tseng等报道异黄酮具有抗氧化、抗肿瘤、抗骨质疏松等作用[4-5],异黄酮可提高骨密度,提高血清骨形成指标水平,促进骨质疏松大鼠骨形成[6]。作为纯天然的植物提取物,异黄酮具有活性好、安全性高、来源广泛、毒性低等特点,在药品、保健品、功能食品及化妆品行业具有重要的用途[7]。
鸡血藤为豆科植物密花豆(Spatholobus suberectus Dunn)的干燥茎藤,主要来源于广东、广西等省,被广泛用作茶、酒和汤的食品添加剂[8],具有行血补血、通经活络、强壮筋骨之功效[9],在传统医学治疗骨质疏松中有着悠久的历史[10]。研究表明,鸡血藤中含有大量的异黄酮[11],具有促进成骨细胞合成和分泌碱性磷酸酶的作用[12],其提取物对胎鼠尺骨和挠骨的生长有促进作用[13]。曹辉等[14]报道以鸡血藤为君药的藤黄健骨胶囊具有治疗骨质疏松的作用,能够抑制骨质吸收、促进成骨细胞形成和骨的重建。但鸡血藤治疗骨质疏松症的机制尚不明确,因此,研究鸡血藤活性成分治疗骨质疏松的分子机制具有重要意义。以往的研究表明,植物来源有效成分中大多数研究集中在单一成分与抗骨质疏松活性的关系上,而揭示天然产物与细胞蛋白之间复杂的相互作用以及对人体功能的影响未见报道。本研究基于网络药理学构建“成分-靶点-通路”网络模型,并应用分子对接验证分析,筛选出鸡血藤抗骨质疏松的有效成分与关键靶点,为寻找植物来源的天然化合物抗骨质疏松的保健食品开发提供快速、高效筛选的方法参考。
1. 资料与方法
1.1 数据准备
从TCMSP(http://tcmspw.com/tcmsp.php)数据库和文献[15-20]中收集鸡血藤14个有效成分的化学结构信息,包括黄酮类和酚酸类(见表1),所有化合物均从NCBI PubChem数据库(http://www.NCBI.nlm.nih.gov/pccompound/)下载并保存为sdf格式文件,提交至PharmMapper数据库,参数和最大生成构象分别设置为ON和300,在高级选项中选择“仅人类蛋白质靶点(v2010,2241)”,其他选项设为默认值[21-24],采用统计方法和反向对接技术来识别化合物的潜在靶点,最后选择z’-score>1[25]的匹配靶点进行综合网络药理学分析。
表 1 鸡血藤的14个有效成分Table 1. 14 active ingredients of Spatholobi Caulis代号 中文名称 英文名称 PubChem CID JXT-01 原儿茶酸 Protocatechuic acid 72 JXT-02 对羟基苯甲酸 P-Hydroxybenzoic acid 135 JXT-03 大黄素 Emodin 3220 JXT-04 儿茶素 Catechin 9064 JXT-05 表儿茶素 Epicatechin 72276 JXT-06 甘草素 Liquiritigenin 114829 JXT-07 异甘草素 Liquiritigenin 114829 JXT-08 芒柄花素 Formononetin 5280378 JXT-09 毛蕊异黄酮 Calycosin 5280448 JXT-10 山奈酚 Kaempferol 5280863 JXT-11 金雀异黄素 Genistein 5280961 JXT-12 黄豆苷元 Daidzein 5281708 JXT-13 樱黄素 Prunetin 5281804 JXT-14 葛根素 Puerarin 5281807 1.2 网络构建和拓扑分析
将PharmMapper数据库筛选出的靶点去重后,通过使用检索/ID映射(http://www.uniprot.org/uploadlists/)将靶点转换为UniProtKB标识符用于以下网络构建和拓扑分析。通过Cytoscape 3.7.2软件[26]构建14个化合物与PharmMapper靶点相互作用网络,可视化分析之间存在的联系,并对成分-靶点网络进行GO生物学注释和KEGG富集分析,以确定鸡血藤抗骨质疏松作用的关键通路。Clue GO插件用于分析生物网络中注释和功能组之间的相互关系,并对关键网络进行深入的探索。在ClueGO操作界面中,删除重复节点,将UniprotKB导入智人列表,Go-tree区间为5~10,kappa评分为0.4,P值为0.01,ClueGO结果仅显示GO生物过程和KEGG信号通路。
为了筛选复杂富集网络中的关键靶点和通路,利用CytoNCA插件计算节点的中心性。CytoNCA提供了8种中心性(介数、接近中心性、自由度、特征向量中心性、平均最短路径长度、网络中心性、子网络中心性和信息中心性),本研究分别选取介数、接近中心性和子网络中心性的前10%的节点,通过三个中心性的重叠,生成具有关键靶点的子网络。
1.3 分子对接
虽然通过各种生物过程和信号通路中的蛋白质能够筛选出一些药物,但是化合物和蛋白质的结合可能较弱。同样,鸡血藤中的一些化合物可能与关键蛋白质结合较弱,为了剔除这些蛋白质和化合物,故进行了基于分子对接的虚拟筛选。
利用AutoDock 4.2软件进行分子对接,研究潜在靶点与化合物的结合能力。将表1中14个化合物的配体分别导入软件中,与从RCSB蛋白质数据库(http://www.RCSB.org/pdb/home/home.do)下载KEGG通路中的靶蛋白进行对接,根据相关文献报道[27-28],参数设置为:Grid Box坐标(4DMX:−6.875,2.256,10.836),盒子大小为40×40×40个网格点;(4MXO:11.896,−36.649,−6.446),盒子大小为60×40×40个网格点,运行次数为100,其他参数采用软件的默认设置,采用拉马克遗传(Lamarckian genetic algorithm)算法评价配体与受体的结合能。采用Pymol、Ligplus软件对分子对接结果进行分析与展示。
2. 结果与分析
2.1 网络构建
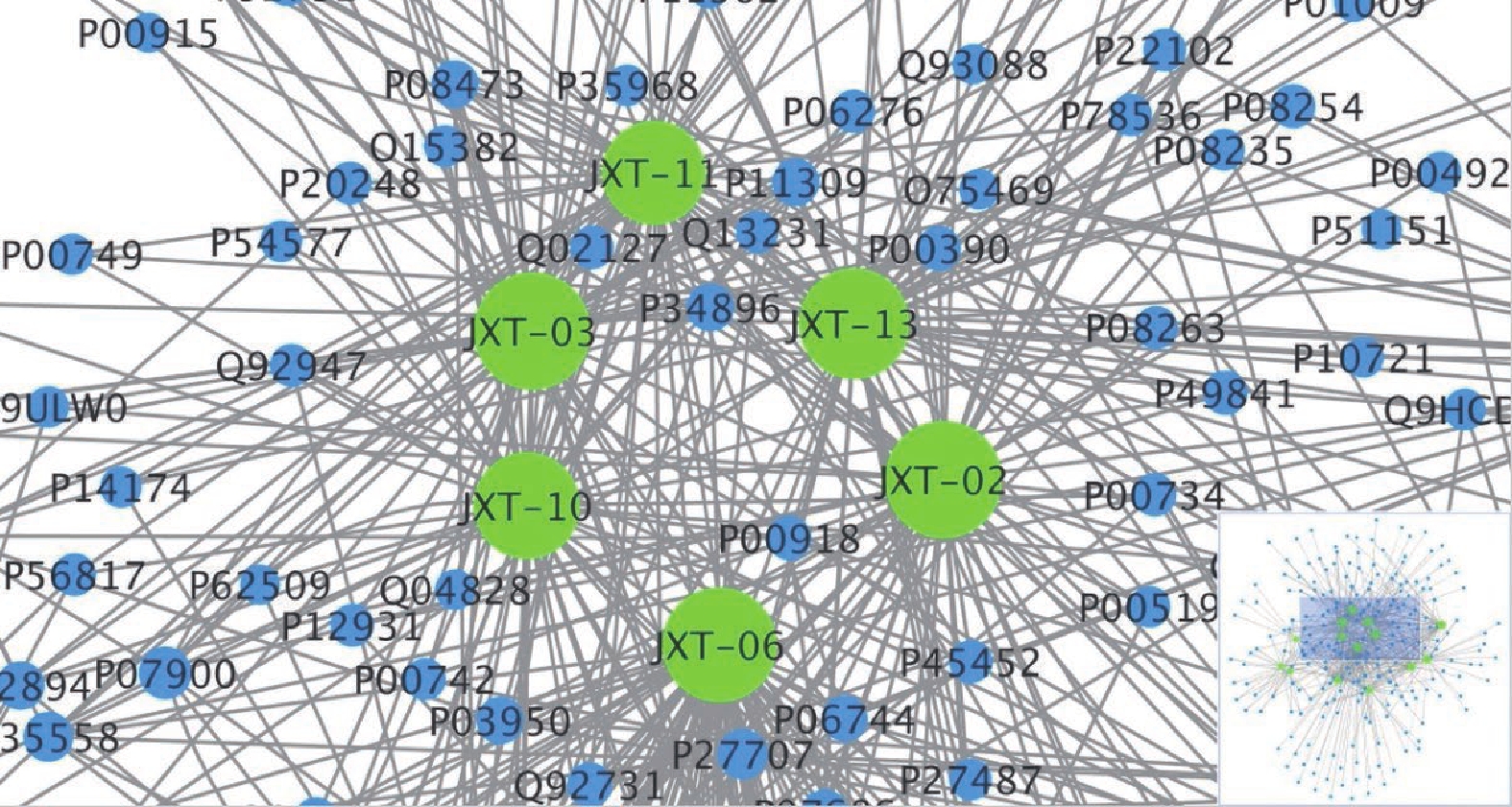
文章整体架构见图1。鸡血藤14个化合物从PharmMapper数据库获得601个靶点,筛重后通过检索/ID映射(http://www.uniprot.org/uploadlists/)转换为221个UniProt KB标识符用于以下富集分析。应用Cytoscape 3.7.2软件构建化合物-靶点网络,生成的网络包含235个节点和601条边,如图2所示,化合物越大,表明结合的靶点越多,化合JXT-02、JXT-03、JXT-06、JXT-10、JXT-11和JXT-13在网络中的degree值大于其他化合物,显示出了更强的多重交互结合靶点作用,主要包括原癌基因酪氨酸蛋白激酶(SRC,UniProtKB:P12931)、组织蛋白酶K(CTSK,UniProtKB:P43235),中性粒细胞胶原酶(MMP8,UniProt KB:P22894)和雌激素受体(分别为ESR1、ESR2、NCOA5,UniProt KB:P03372、Q92731、Q9HCD5),这些蛋白质都参与骨质疏松和代谢反应,该网络揭示了鸡血藤的14个成分对骨质疏松的蛋白质靶点或生物途径有联合作用。
2.2 富集分析
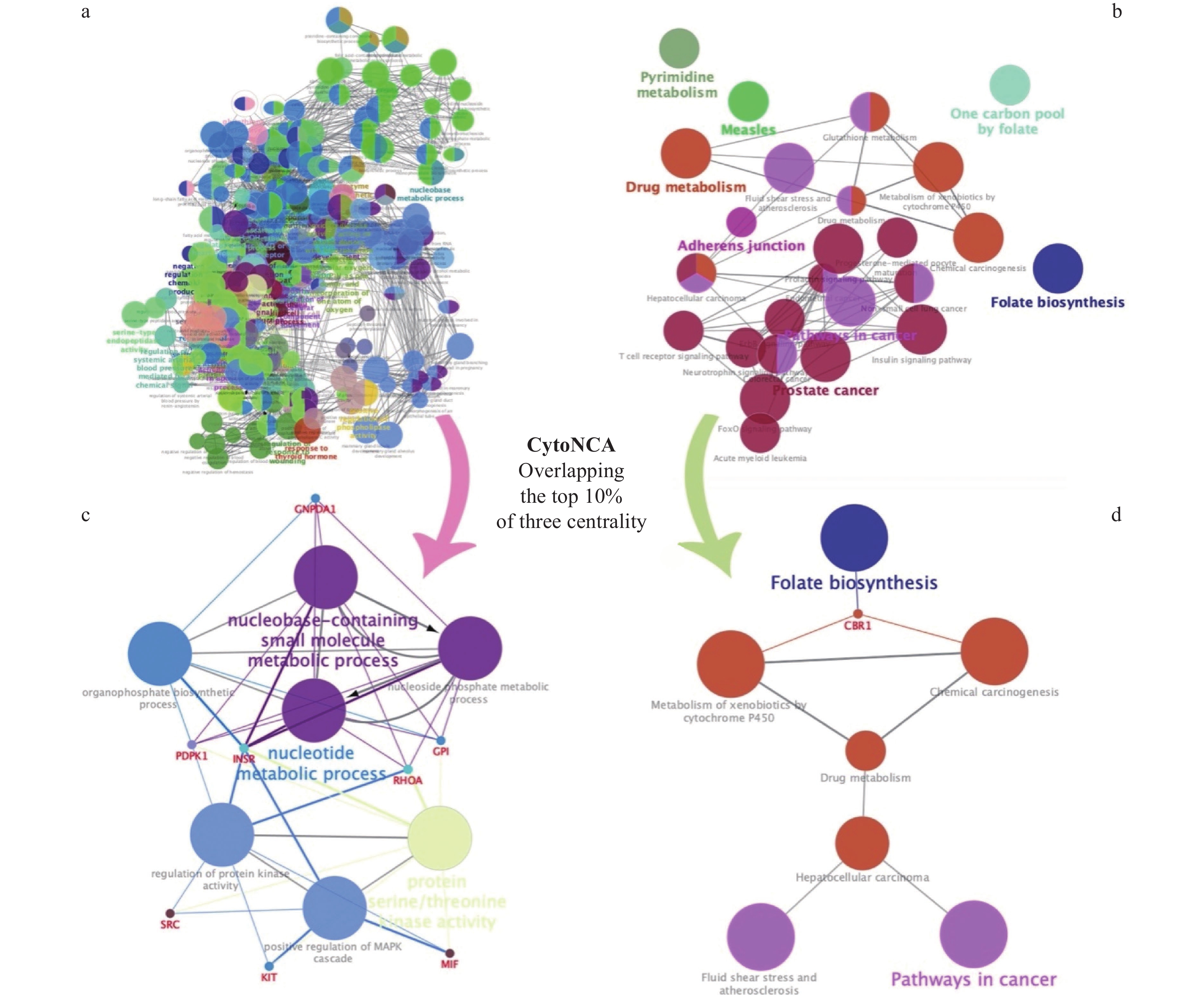
将221个靶点导入ClueGo插件得到靶点生物过程网络(456个节点和5723条边)和KEGG信号通路网络(124个节点和365条边)(图3a~3b),选用3个中心性度值筛选核心子网络(图3c~3d),在同一颜色组中包含了密切相关的靶点。
中草药治疗疾病的特点具有多成分相互配合、协同增效的作用。研究表明鸡血藤不同成分以相互连接的生物网络中不同节点为目标,这些节点具有相似的功能,而针对这一个相互关联的生物网络为目标的治疗方式有利于避免旁路激活引起的耐药性。
在GO生物过程子网络(包含15个节点和47条边)中,15个靶点注释均与大量生物过程显着相关,包括蛋白质丝氨酸/苏氨酸激酶活性、核苷磷酸代谢过程、核苷酸代谢过程、MAPK级联反应的正调控、调节蛋白激酶活性、含核碱基的小分子代谢过程和有机磷酸酯的生物合成过程(表2,图3c);KEGG信号通路子网络(包含10个节点和9条边)包含流体剪切应力和动脉粥样硬化、细胞色素P450对异生物的代谢、嘧啶代谢和药物代谢等信号通路(表3,图3d),此外,KEGG信号通路子网络还揭示了与癌症的关系。我们发现,由于骨质疏松反应不可避免地伴随着代谢反应,因此绝大多数靶点本体注释和KEGG信号通路都与机体代谢系统有关,因此,利用该子网络来分析鸡血藤抗骨质疏松作用的机制是可行的。
表 2 生物过程子网络Table 2. Biological process sub-network生物过程注释 图3c中颜色 P-value GO:0004674:蛋白质丝氨酸/苏氨酸激酶活性 黄浅色 2.21E-13 GO:0006753:核苷磷酸代谢过程 紫色 3.78E-16 GO:0009117:核苷酸代谢过程 紫色 2.94E-16 GO:0043410:MAPK级联反应的正调控 浅蓝色 1.56E-10 GO:0045859:调节蛋白激酶活性 浅蓝色 1.66E-12 GO:0055086:含核碱基的小分子代谢过程 紫色 4.90E-17 GO:0090407:有机磷酸酯的生物合成过程 浅蓝色 2.71E-15 表 3 KEGG信号通路子网络Table 3. KEGG signal path sub-networkKEGG信号通路 图3d中颜色 P-value hsa:05200:癌症信号通路 浅紫色 3.13E-08 hsa:00980:细胞色素P450对异生物的代谢 橙色 3.19E-05 hsa:05225:肝细胞癌 橙色 1.56E-03 hsa:00790:叶酸生物合成 蓝色 2.68E-04 hsa:05418:流体剪切应力和动脉粥样硬化 浅紫色 4.77E-06 hsa:00982:药物代谢 橙色 6.62E-03 hsa:05204:化学致癌作用 橙色 7.45E-05 在靶点生物过程和KEGG信号通路富集分析的结果中,大量的必需靶点与代谢信号通路或生物过程相关(图3c~3d),表明鸡血藤抗骨质疏松可能与代谢异常有关。
骨质疏松代谢相关的生物过程包含多条信号通路[29],而流体剪切应力和动脉粥样硬化、细胞色素P450对异生物的代谢等信号通路中的SRC、CTSK等靶点在调控骨质疏松中发挥了至关重要的作用[30-31]。关于骨代谢,SRC在破骨细胞中表达的水平比其他细胞高5~200倍[32],SRC激酶已被证明可以通过细胞信号传导和生化调节促进破骨细胞的分化和激活,从而导致骨吸收增加[33],因此SRC蛋白激酶抑制剂是治疗骨质疏松症的药物靶点。另外,与破骨细胞相关的CTSK表达上调引起关节周围骨量下降,尤其是股骨末梢干骺端的骨质流失[34],因此,抑制组织蛋白酶K表达可以降低骨质流失。以上研究与本网络药理学预测的KEGG信号通路富集网络的结果一致(图3d中橙色和紫色)。
图3d中的蓝色是叶酸生物合成代谢通路,叶酸在体内存于肠壁、肝、骨髓等组织中,被叶酸还原酶还原成具有生理活性的四氢叶酸并参与嘧啶的合成,对正常红细胞的形成有促进作用。这与中医对鸡血藤活血作用的描述一致。
在KEGG子网络中,流体剪切应力和动脉粥样硬化、细胞色素P450对异生物的代谢信号通路进一步划分并置于同一组中(图3d)。在KEGG信号通路分析的结果中,关键靶点SRC是通过流体剪切应力和动脉粥样硬化信号通路直接参与骨代谢发挥的作用(条目:hsa:05418,图3d中浅紫色),同时,调节蛋白激酶活性生物过程(条目:GO:0045859,图3c中浅蓝色)也出现在靶点富集分析中协同发挥作用。此外,在KEGG富集分析中,细胞色素P450对异生物的代谢信号通路(条目:hsa:00980,图3d中橙色)也被认为是必不可少的通路,因为该通路中的CTSK对于调节骨吸收至关重要。可以推测鸡血藤通过影响上述信号通路调节了骨代谢反应并治疗骨质疏松。
综上所述,抑制破骨细胞的生物过程在骨质疏松和代谢调节中起着至关重要的作用,而流体剪切应力和动脉粥样硬化、细胞色素P450对异生物的代谢信号通路是生物过程的关键。将KEGG子网络靶点筛重后,选择PharmMapper数据库筛选出的、并富集在上述信号通路中的2个蛋白作为进一步对接研究的靶点:SRC(PDBID:4MXO)和CTSK(PDBID:4DMX)。故提示鸡血藤14个化合物通过靶向影响破骨细胞分化成熟的关键靶点调控流体剪切应力和动脉粥样硬化、细胞色素P450对异生物的代谢信号通路,进而表现出抗骨质疏松作用。
2.3 分子对接
鸡血藤14个化合物的对接结果见表4,两个关键靶点(4MXO和4DMX)的平均对接得分为−6.32和−5.47,提示与原配体具有相似的结合能力(−7.67和−6.87)。结果表明,鸡血藤14个化合物通过2条KEGG信号通路(流体剪切应力和动脉粥样硬化、细胞色素P450对异生物的代谢信号通路)中的2个关键靶点协同发挥抗骨质疏松的作用。
表 4 鸡血藤14个成分与SRC和CTSK靶点结合打分排序表Table 4. Molecular docking results of 14 compounds from Spatholobi Caulis with SRC and CTSK序号 成分 结合自由能(kcal/mol) SRC(4MXO) CTSK(4DMX) JXT-01 原儿茶酸 −3.97 −3.79 JXT-02 对羟基苯甲酸 −3.04 −3.89 JXT-03 大黄素 −6.69 −5.94 JXT-04 儿茶素 −7.03 −5.7 JXT-05 表儿茶素 −6.61 −5.96 JXT-06 甘草素 −6.53 −6.31 JXT-07 异甘草素 −6.3 −6.16 JXT-08 芒柄花素 −6.67 −5.61 JXT-09 毛蕊异黄酮 −6.35 −5.47 JXT-10 山奈酚 −6.37 −5.46 JXT-11 金雀异黄素 −6.84 −5.17 JXT-12 黄豆苷元 −6.85 −5.8 JXT-13 樱黄素 −7.63 −5.37 JXT-14 葛根素 −7.56 −5.96 平均结合自由能 −6.32 −5.47 原配体 −7.67 −6.87 采用AutoDock 4.2进行分子对接,根据蛋白质与配体之间相互作用的结合能选择评分函数,分别得到每个化合物和受体的对接得分,得分越低,配体与受体结合越稳定[35],结果见表4。为了筛选出能够与关键靶点具有较好结合能力的化合物,对14个化合物与2个靶点的结合能进行了研究。在抗骨质疏松级联反应中,按照对接分数降序排列,筛选出化合物-靶点复合物。最后,从表4中挑选出与初始配体结合能相近的前2名对接结果,其中樱黄素(JXT-13)和甘草素(JXT-06)与靶位点SRC和CTSK的结合能力强。研究表明,樱黄素(JXT-13)可以通过抑制破骨细胞增殖来对骨质疏松小鼠起保护作用[36];甘草素(JXT-06)能抑制破骨细胞形成和骨吸收活性缓解类风湿性关节炎的骨破坏[37],说明上述化合物对抗骨质疏松有效。SRC作为流体剪切应力和动脉粥样硬化信号通路中的下游成员,SRC激酶刺激破骨细胞生成并激活,从而导致骨吸收增加,引发骨质疏松形成。因此,选择复合物JXT-13/4MXO和JXT-06/4DMX(分别为−7.63和−6.31)进行进一步的对接分析研究,以分析抑制剂的结合能力。
复合物JXT-13/4MXO和JXT-06/4DMX的配体相互作用分别见图4b、4d,图5b、5d。在图4a、4c中,内置配体是SRC的抑制剂,通过3个氢键与处于活化状态的Abl蛋白的活化环结合,其中两个氢键位于ATP结合位点的铰链区,另一个将内置配体氨基的氮原子与蛋白的Met341氨基酸上羟基的氧原子相连接,从而抑制酪氨酸激酶的活性[27]。在图4b中可以看到化合物JXT-13的酚基和Glu310、Thr338、Phe405、Glu339和Met341之间存在相互作用的氢键。Met341与作为主链受体的内置配体嘧啶形成氢原子,与复合物JXT-13/4MXO中的羟基具有相似的相互作用。此外,两个配体周围的氨基酸(Met341、Thr338、Tyr340、Ala293、Leu393、Leu273、Clu310和Clu339)几乎相同,表明化合物JXT-13和内置配体对SRC具有相似的抑制作用。在图5中,组织蛋白酶K抑制剂和化合物JXT-06在活性口袋中与周围的氨基酸形成了相似的相互作用,这些抑制剂对酶活性抑制的作用机制都是利用抑制剂小分子的突触基团直接与酶分子中Cys25位的巯基形成共价健,并依靠其它位点所形成的多个氢键和疏水键相互作用进一步稳固它们之间的这种结合,从而使酶失去活性。同时,两个配体周围的氨基酸(Asn161、Cly66、Leu209、Leu60、Cly64、Trp26和Gly65)几乎相同,化合物JXT-06可能通过这些周围氨基酸与组织蛋白酶K抑制剂表现出相同的作用。化合物JXT-13的结果与化合物JXT-06相似,其酚羟基与4MXO、4DMX形成新的相互作用氢键,表明这两个化合物对靶点SRC和CTSK具有较强的结合能力。
3. 结论
综上所述,SRC和CTSK可能为鸡血藤治疗骨质疏松症的核心靶点,分别与樱黄素、甘草素等有效成分以氢键、疏水作用力等连接发挥治疗作用。本研究基于网络药理学构建“成分-靶点-通路”网络模型,并应用分子对接验证分析,具有快速、高效筛选成分、靶点的作用。同时,该方法对鸡血藤治疗骨质疏松症的作用机制进行了多维度、多层次分析,并对鸡血藤的临床应用具有积极意义,可为揭示中医思维的科学价值提供理论支撑。此外,本实验室将依据实验结果开展体内、外生物学实验,进一步为鸡血藤治疗骨质疏松症提供实验依据。
-
表 1 鸡血藤的14个有效成分
Table 1 14 active ingredients of Spatholobi Caulis
代号 中文名称 英文名称 PubChem CID JXT-01 原儿茶酸 Protocatechuic acid 72 JXT-02 对羟基苯甲酸 P-Hydroxybenzoic acid 135 JXT-03 大黄素 Emodin 3220 JXT-04 儿茶素 Catechin 9064 JXT-05 表儿茶素 Epicatechin 72276 JXT-06 甘草素 Liquiritigenin 114829 JXT-07 异甘草素 Liquiritigenin 114829 JXT-08 芒柄花素 Formononetin 5280378 JXT-09 毛蕊异黄酮 Calycosin 5280448 JXT-10 山奈酚 Kaempferol 5280863 JXT-11 金雀异黄素 Genistein 5280961 JXT-12 黄豆苷元 Daidzein 5281708 JXT-13 樱黄素 Prunetin 5281804 JXT-14 葛根素 Puerarin 5281807 表 2 生物过程子网络
Table 2 Biological process sub-network
生物过程注释 图3c中颜色 P-value GO:0004674:蛋白质丝氨酸/苏氨酸激酶活性 黄浅色 2.21E-13 GO:0006753:核苷磷酸代谢过程 紫色 3.78E-16 GO:0009117:核苷酸代谢过程 紫色 2.94E-16 GO:0043410:MAPK级联反应的正调控 浅蓝色 1.56E-10 GO:0045859:调节蛋白激酶活性 浅蓝色 1.66E-12 GO:0055086:含核碱基的小分子代谢过程 紫色 4.90E-17 GO:0090407:有机磷酸酯的生物合成过程 浅蓝色 2.71E-15 表 3 KEGG信号通路子网络
Table 3 KEGG signal path sub-network
KEGG信号通路 图3d中颜色 P-value hsa:05200:癌症信号通路 浅紫色 3.13E-08 hsa:00980:细胞色素P450对异生物的代谢 橙色 3.19E-05 hsa:05225:肝细胞癌 橙色 1.56E-03 hsa:00790:叶酸生物合成 蓝色 2.68E-04 hsa:05418:流体剪切应力和动脉粥样硬化 浅紫色 4.77E-06 hsa:00982:药物代谢 橙色 6.62E-03 hsa:05204:化学致癌作用 橙色 7.45E-05 表 4 鸡血藤14个成分与SRC和CTSK靶点结合打分排序表
Table 4 Molecular docking results of 14 compounds from Spatholobi Caulis with SRC and CTSK
序号 成分 结合自由能(kcal/mol) SRC(4MXO) CTSK(4DMX) JXT-01 原儿茶酸 −3.97 −3.79 JXT-02 对羟基苯甲酸 −3.04 −3.89 JXT-03 大黄素 −6.69 −5.94 JXT-04 儿茶素 −7.03 −5.7 JXT-05 表儿茶素 −6.61 −5.96 JXT-06 甘草素 −6.53 −6.31 JXT-07 异甘草素 −6.3 −6.16 JXT-08 芒柄花素 −6.67 −5.61 JXT-09 毛蕊异黄酮 −6.35 −5.47 JXT-10 山奈酚 −6.37 −5.46 JXT-11 金雀异黄素 −6.84 −5.17 JXT-12 黄豆苷元 −6.85 −5.8 JXT-13 樱黄素 −7.63 −5.37 JXT-14 葛根素 −7.56 −5.96 平均结合自由能 −6.32 −5.47 原配体 −7.67 −6.87 -
[1] LONG Z, WU J, XIANG W, et al. Exploring the mechanism of icariin in osteoporosis based on a network pharmacology strategy[J]. Med Sci Monit,2020,26:e924699.
[2] TANG X, BAI Y, ZHANG Z, et al. A validated miRNA signature for the diagnosis of osteoporosis related fractures using SVM algorithm classification[J]. Exp Ther Med,2020,20(3):2209−2217.
[3] TANG G. Bioconversion of dietary provitamin A carotenoids to vitamin A in humans[J]. Am J Clin Nutr,2010,91(5):1468s−1473s. doi: 10.3945/ajcn.2010.28674G
[4] LEE J C, LIN C K, TSENG C K, et al. Discovery of 3-amino-2-hydroxypropoxyisoflavone derivatives as potential anti-HCV agents[J]. Molecules,2018,23(11):2863. doi: 10.3390/molecules23112863
[5] TSENG C H, CHEN Y L, LU C M, et al. Synthesis and anti-osteoporotic evaluation of certain 3-amino-2-hydroxypropoxyisoflavone derivatives[J]. Eur J Med Chem,2009,44(9):3621−3626. doi: 10.1016/j.ejmech.2009.02.025
[6] 张广文, 陈青海, 宁学乾, 等. 大豆异黄酮对骨质疏松大鼠模型的作用探讨[J]. 中国微生态学杂志,2020,32(12):1397−1403. [ZHANG G W, CHEN Q H, NING X Q, et al. Effect of soybean isoflavones on osteoporosis rat model[J]. Chin J Microecol,2020,32(12):1397−1403. [7] HANAKA A, DRESLER S, WÓJCIAK-KOSIOR M, et al. The impact of long-and short-term strontium treatment on metabolites and minerals in glycine max[J]. Molecules,2019,24(21):3825. doi: 10.3390/molecules24213825
[8] QIN S, WU L, WEI K, et al. A draft genome for Spatholobus suberectus[J]. Sci Data,2019,6(1):113. doi: 10.1038/s41597-019-0110-x
[9] LEE M H, LIN Y P, HSU F L, et al. Bioactive constituents of Spatholobus suberectus in regulating tyrosinase-related proteins and mRNA in HEMn cells[J]. Phytochemistry,2006,67(12):1262−1270. doi: 10.1016/j.phytochem.2006.05.008
[10] 张庆熙, 金晨, 陈康, 等. 我国鸡血藤属和崖豆藤属药用植物的研究现状及比较[J]. 中国实验方剂学杂志,2021,27(16):198−208. [ZHANG Q X, JIN C, CHEN K, et al. Research status and comparison on medicinal plants of Callerya and Millettia in China[J]. Chinese Journal of Experimental Traditional Medical Formulae,2021,27(16):198−208. [11] 余弯弯, 金晨, 双鹏程, 等. 丰城鸡血藤异黄酮及黄烷类化学成分的研究[J]. 中国中药杂志,2015,40(12):2363−2366. [YU W W, JIN C, SHUANG P C, et al. Isoflavones and flavans from Millettia nitida var. hirsutissima[J]. China Journal of Chinese Materia Medica,2015,40(12):2363−2366. [12] 冯淑华, 陈虹, 刘薇. 8味中药提取物对MC3T3-E1细胞增殖及碱性磷酸酶活性的影响[J]. 中成药,2010,32(4):661−663. [FENG S F, CHEN H, LIU W. Effects of 8 Chinese herbal extracts on the proliferation and alkaline phosphatase activity of MC3T3-E1 cells[J]. Chinese Traditional Patent Medicine,2010,32(4):661−663. doi: 10.3969/j.issn.1001-1528.2010.04.041 [13] 冯淑华, 李可意, 李灵芝. 6种中药粗提物对胎鼠体外骨生长的影响[J]. 北京联合大学学报(自然科学版),2009,23(1):11−13,17. [FENG S H, LI K Y, LI L Z. Effect of 6 Chinese medicines' extraction on bone growth for embryo rat in vitro[J]. Journal of Beijing Union University,2009,23(1):11−13,17. [14] 曹辉, 周霖, 孙志, 等. 基于UHPLC-Q-Orbitrap HRMS结合整合网络药理学的藤黄健骨胶囊化学成分识别及作用机制初步研究[J]. 中草药,2020,51(9):2408−2417. [CAO H, ZHOU L, SUN Z, et al. Chemical composition identification and mechanism study of Tenghuang Jiangu capsule based on UHPLC-Q-Orbitrap HRMS and network pharmacology[J]. Chinese Traditional and Herbal Drugs,2020,51(9):2408−2417. [15] 丁平, 仰铁锤, 林振坤, 等. 鸡血藤化学成分的指纹图谱研究[J]. 华西药学杂志,2010,25(4):461−463. [DING P, YANG T C, LIN Z L K, et al. Study on HPLC chromatographic fingerprint of Spatholobi Caulis[J]. West China Journal of Pharmaceutical Sciences,2010,25(4):461−463. [16] 严启新, 李萍. 鸡血藤高效液相色谱指纹图谱研究[J]. 中草药,2004(5):80−83. [YAN Q X, LI P. Study on HPLC f ingerprint of Spatholobi Caulis[J]. Chinese Traditional and Herbal Drugs,2004(5):80−83. [17] 刘静, 苏建春, 甘林建, 等. 鸡血藤UPLC指纹图谱及模式识别研究[J]. 中国实验方剂学杂志,2014,20(4):87−90. [LIU J, SU J C, GAN L J, et al. UPLC fingerprint analysis and pattern recognition of Spatholobus suberectus[J]. Chinese Journal of Experimental Traditional Medical Formulae,2014,20(4):87−90. [18] 杨冉冉, 姬蕾, 李二文, 等. 鸡血藤的HPLC指纹图谱及模式识别研究[J]. 中草药,2017,48(21):4530−4536. [YANG R R, JI L, LI E W, et al. HPLC fingerprint analysis and pattern recognition of Spatholobus suberectus[J]. Chinese Traditional and Herbal Drugs,2017,48(21):4530−4536. doi: 10.7501/j.issn.0253-2670.2017.21.026 [19] 王宏, 刘艺娜, 曾祖平, 等. 鸡血藤抗肿瘤活性部位SSCE指纹图谱的研究[J]. 中国中药杂志,2011,36(18):2525−2529. [WANG H, LIU Y, ZENG Z P, et al. Study on HPLC chromatographic fingerprint of anti-tumor active site SSCE of Spatholobi Caulis[J]. China Journal of Chinese Materia Medica,2011,36(18):2525−2529. [20] 郭希庆. 鸡血藤糖浆中芒柄花素含量的高效液相色谱法测定[J]. 时珍国医国药,2013,24(11):2657−2658. [GUO X Q. Determination of mangostemonin in chicken blood vine syrup by high performance liquid chromatography[J]. Lishizhen Medicine and Materia Medica Research,2013,24(11):2657−2658. [21] 沈红波, 周一农, 郑杰, 等. 基于网络药理学葵花护肝片“多成分-多靶点-多通路”的作用机制研究[J]. 中国中药杂志,2019,44(7):1464−1474. [SHEN H B, ZHOU Y N, ZHENG J, et al. “Multi-component-multi-target-multi-pathway” mechanism of Kuihua Hugan Tablets based on network pharmacology[J]. China Journal of Chinese Materia Medica,2019,44(7):1464−1474. [22] 徐建亚, 顾勤, 夏卫军. 鸡血藤对黑色素瘤细胞黏附、侵袭、运动和转移能力的影响[J]. 中药材,2010,33(10):1595−1599. [XU J Y, GU Q, XIA W J, et al. Effect of Spatholobus suberctus on adhesion, invasion, migration and metastasis of melanoma cells[J]. Journal of Chinese Medicinal Materials,2010,33(10):1595−1599. [23] 孙凯, 朱立国, 魏戌, 等. 基于网络药理学的“淫羊藿-白芍”配伍治疗腰椎间盘突出症作用机制研究[J]. 中国中药杂志,2020,45(3):609−616. [SUN K, ZHU L G, WEI X, et al. Study on mechanism of “Epimedii Folium-Paeoniae Radix Alba” in treatment of lumbar disc herniation based on network pharmacology[J]. China Journal of Chinese Materia Medica,2020,45(3):609−616. [24] 孙鹏辉, 袁普卫, 李堪印. 名老中医李堪印运用藤类药物治疗痹症的经验[J]. 中国中医骨伤科杂志,2020,28(3):75−78. [SUN P H, YUAN P W, LI K Y. Experience of famous veteran Chinese medicine practitioner Li Kanyin in the treatment of paralysis using rattan drugs[J]. Chinese Journal of Traditional Medical Traumatology & Orthopedics,2020,28(3):75−78. [25] WANG X, SHEN Y, WANG S, et al. PharmMapper 2017 update: A web server for potential drug target identification with a comprehensive target pharmacophore database[J]. Nucleic Acids Res,2017,45(W1):w356−w360. doi: 10.1093/nar/gkx374
[26] OTASEK D, MORRIS J H, BOUCAS J, et al. Cytoscape automation: Empowering workflow-based network analysis[J]. Genome Biol,2019,20(1):185. doi: 10.1186/s13059-019-1758-4
[27] LEVINSON N M, BOXER S G. A conserved water-mediated hydrogen bond network defines bosutinib's kinase selectivity[J]. Nat Chem Biol,2014,10(2):127−132. doi: 10.1038/nchembio.1404
[28] DOSSETTER A G, BEELEY H, BOWYER J, et al. (1R, 2R)-N-(1-cyanocyclopropyl)-2-(6-methoxy-1, 3, 4, 5-tetrahydropyrido [4,3-b] indole-2-carbonyl) cyclohexanecarboxamide (AZD4996): A potent and highly selective cathepsin K inhibitor for the treatment of osteoarthritis[J]. J Med Chem,2012,55(14):6363−6374. doi: 10.1021/jm3007257
[29] UEHARA S, UDAGAWA N, KOBAYASHI Y. Non-canonical Wnt signals regulate cytoskeletal remodeling in osteoclasts[J]. Cellular and Molecular Life Sciences,2018,75(20):3683−3692. doi: 10.1007/s00018-018-2881-1
[30] ALEMAN J O, FAROOKI A, GIROTRA M. Effects of tyrosine kinase inhibition on bone metabolism: Untargeted consequences of targeted therapies[J]. Endocr Relat Cancer,2014,21(3):R247−259. doi: 10.1530/ERC-12-0400
[31] XIE Y, ZHANG L, XIONG Q, et al. Bench-to-bedside strategies for osteoporotic fracture: From osteoimmunology to mechanosensation[J]. Bone Res,2019,7:25. doi: 10.1038/s41413-019-0066-7
[32] BROWN M T, COOPER J A. Regulation, substrates and functions of src[J]. Biochim Biophys Acta,1996,1287(2-3):121−149.
[33] SORIANO P, MONTGOMERY C, GESKE R, et al. Targeted disruption of the c-src proto-oncogene leads to osteopetrosis in mice[J]. Cell,1991,64(4):693−702. doi: 10.1016/0092-8674(91)90499-O
[34] LOREDO-PEREZ A A, MONTALVO-BLANCO C E, HERNANDEZ GONZALEZ L I, et al. High-fat diet exacerbates pain-like behaviors and periarticular bone loss in mice with CFA-induced knee arthritis[J]. Obesity(Silver Spring),2016,24(5):1106−1115.
[35] 王馨苑, 黄夏冰, 邓鑫. 基于网络药理学和分子对接探讨黄连素治疗2型糖尿病机制研究[J]. 中国新药杂志,2020,29(24):2820−2831. [WANG X Y, HUANG X B, DENG X. Exploring the mechanism of safranin for the treatment of type 2 diabetes based on network pharmacology and molecular docking[J]. Chinese Journal of New Drugs,2020,29(24):2820−2831. [36] 曾荣, 徐家科, 赵劲民, 等. 芦荟大黄素对小鼠破骨细胞增殖的抑制作用研究[J]. 广西医科大学学报,2016,33(2):240−242. [ZENG R, XU J K, ZHAO J M, et al. Study on the inhibitory effect of aloe vera rhodopsin on the proliferation of mouse osteoblasts[J]. Journal of Guangxi Medical University,2016,33(2):240−242. [37] 雷丽娟. 大血藤总酚及其抗类风湿性关节炎骨破坏作用研究[D]. 贵阳: 贵州大学, 2019 LEI L J. Study on the total phenol of Da Blood Vine and its anti-rheumatoid arthritis bone destruction effect[D]. Guiyang: Guizhou University, 2019.





 下载:
下载:



 下载:
下载:
