Comparison of Physicochemical Properties of Pepsin-Soluble Collagens from Swim Bladders of Sturgeon(Acipenser schrenckii) and Grass Carp(Ctenopharyngodon idella)
-
摘要: 以鲟鱼鱼鳔和草鱼鱼鳔为原料,比较分析两种鱼鳔酶溶性胶原蛋白(PSC)的理化性质。通过胶原蛋白得率、氨基酸组成、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳、紫外光谱、傅里叶红外光谱、圆二光谱、微量热仪分析两种鱼鳔PSC的组成及理化性质的差异。结果表明,鲟鱼鱼鳔基本营养成分中的粗脂肪和羟脯氨酸含量均显著高于草鱼鱼鳔(P<0.05);鲟鱼鱼鳔PSC得率80.63%显著高于草鱼鱼鳔PSC得率49.85%(P<0.05);两种鱼鳔PSC都属于I型胶原蛋白;鲟鱼鱼鳔PSC的α链相对分子质量和二聚体β链的含量低于草鱼鱼鳔PSC;氨基酸组成中鲟鱼鱼鳔PSC中的丝氨酸、蛋氨酸、异亮氨酸、亮氨酸、组氨酸和精氨酸的含量显著高于草鱼鱼鳔PSC(P<0.05),草鱼鱼鳔PSC中的丙氨酸、苯丙氨酸、赖氨酸、脯氨酸和羟脯氨酸的含量显著高于鲟鱼鱼鳔PSC(P<0.05);两种鱼鳔PSC具有相似的二级结构;鲟鱼鱼鳔PSC的变性温度29.26 ℃显著低于草鱼鱼鳔PSC变性温度36.01 ℃(P<0.05)。在两种鱼鳔PSC之间,草鱼鱼鳔PSC比鲟鱼鱼鳔PSC有更好的热稳定性,但是鲟鱼鱼鳔PSC比草鱼鱼鳔PSC有更高的得率。Abstract: Using sturgeon and grass carp swim bladder as raw materials, compared and analyzed the physicochemical properties of two kinds of fish swim bladder pepsin-soluble collagen (PSC). Calculation of collagen yield, amino acid composition, SDS-PAGE, ultraviolet spectroscopy, Fourier infrared spectroscopy, circular dichroism, microdifferential scanning calorimeter to study the differences of the composition and physic-chemical properties of the two types of swim bladder PSC. The results showed that the content of crude fat and hydroxyproline in the basic nutrients of sturgeon swim bladder were significantly higher than that of grass carp swim bladder (P<0.05). The yield of sturgeon swim bladder was 80.63%, which was significantly higher than the PSC yield of grass carp swim bladder 49.85% (P<0.05).Two kinds of swim bladder PSC were consistent with type I collagen. The relative molecular weight of α chain and the content of dimer β chain of sturgeon swim bladder PSC were lower than those of grass carp swim bladder PSC. In the amino acid composition, the content of Ser, Met, Ile, Leu, His and Arg of sturgeon swim bladder PSC was significantly higher than that of grass carp swim bladder PSC (P<0.05), the content of Ala, Phe, Lys, Pro and Hyp of grass carp swim bladder PSC was significantly higher than that of sturgeon swim bladder PSC (P<0.05). They had similar secondary structures. The PSC denaturation temperature of sturgeon swim bladder was 29.26 ℃, which was significantly lower than that of the PSC of grass carp swim bladder, which was 36.01 ℃ (P<0.05). Among the two kinds of fish bladder PSC, grass carp swim bladder PSC had better thermal stability than sturgeon swim bladder PSC, but sturgeon swim bladder PSC had a higher yield than grass carp swim bladder PSC.
-
胶原蛋白是动物体内含量最丰富、分布最广泛的结构蛋白,也是细胞外基质中主要组成成分之一。胶原蛋白广泛存在于哺乳和水产动物的皮、骨等器官组织,由于胶原蛋白具有低免疫原性且生物相容性良好,被广泛用于化妆品、食品和医药等领域[1]。目前胶原蛋白主要来源于哺乳动物的皮和跟腱组织,受人畜共患病以及宗教问题的影响,人们开始从鱼类中提取胶原蛋白进行研究。近年来,鱼类胶原蛋白理化性质和生物活性的相关研究日益增加,为鱼类胶原蛋白的发展提供了科学依据[2]。
鲟鱼是世界现有淡水鱼中体型较大,寿命较长的鱼类,随着我国鲟鱼养殖技术的成熟,鲟鱼养殖的总量每年呈增长趋势[3]。鲟鱼加工过程中会产生大量副产物鱼鳔,其胶原蛋白含量丰富,可以作为鱼类胶原蛋白的来源。目前对鲟鱼鱼鳔胶原蛋白的研究中:蒋玉[4]从鲟鱼鱼鳔中提取胶原蛋白,通过大鼠饲喂实验发现可以延缓大鼠皮肤自然衰老,具有良好的生物安全性;张曦[5]从鲟鱼软骨、皮、和鱼鳔中得到胶原蛋白,发现鱼鳔胶原蛋白有更好的原纤维形成能力。草鱼鱼鳔胶原蛋白是淡水鱼鳔中研究较多且来源广的蛋白[6-7] ,而鲟鱼鱼鳔与常见淡水鱼的鱼鳔不同,为了探究鲟鱼鱼鳔胶原蛋白与常见淡水鱼鱼鳔胶原蛋白理化性质的差异,选取草鱼鱼鳔作为对比进行研究。胶原蛋白提取的方法有盐法、酸法、酶法和热水法,其中酶法提取胶原蛋白对胶原蛋白天然三螺旋结构影响最小且生物安全性高[8]。
故本研究以人工养殖的鲟鱼鱼鳔和草鱼鱼鳔为原料,测定两种鱼鳔的基本营养成分,通过酶法制备两种鱼鳔酶溶性胶原蛋白(PSC),对两种鱼鳔PSC理化性质比较分析,探究鲟鱼鱼鳔PSC与普通淡水鱼草鱼鱼鳔PSC的差异性,为鲟鱼鱼鳔在食品和生物材料领域发展应用提供依据。
1. 材料与方法
1.1 材料与仪器
鲟鱼鱼鳔 嫦娥创新(武汉)生物科技有限公司;草鱼鱼鳔 华中农业大学中百超市;异丙醇、氢氧化钠、氯化钠、冰乙酸、盐酸 国药集团化学试剂有限公司(分析纯);胃蛋白酶(1:3000)、L-羟脯氨酸 索莱宝科技有限公司。
LGJ-10真空冷冻干燥机 北京松源华兴科技发展有限公司;DYY-8C型电泳仪 北京六一仪器厂;MicroDSCIII微量热仪 法国SETARAM公司;UV-1800紫外可见分光光度计 日本岛津公司;NEXUS-470傅里叶红外光谱仪 美国Nicolet公司;J-1500圆二色谱仪、L-8900氨基酸自动分析仪 日本日立公司。
1.2 实验方法
1.2.1 两种鱼鳔基本营养成分的测定
水分含量根据GB 5009.3-2016中的直接干燥法测定;灰分根据GB 5009.4-2016测定;蛋白质含量的测定根据GB 5009.5-2016中的凯氏定氮法测定;脂肪含量的测定根据GB 5009.6-2016中的索氏抽提法测定;总糖含量根据GB/T 9695.31-2008中的分光光度法测定;羟脯氨酸(Hyp)含量根据氯胺T比色法测定[9]。
1.2.2 两种鱼鳔酶溶性胶原蛋白的制备
以下操作均在4 ℃下进行,因为原材料差异,采用不同的方法对两种鱼鳔进行胶原蛋白提取前的预处理。
1.2.2.1 鲟鱼鱼鳔的预处理
将从鲟鱼鱼鳔内膜剥下来的内层浸泡于4 mol/L的NaCl溶液中24 h(料液比为1:20)[4]。用匀浆机以5000 r/min匀浆5 min。将其置于磁力搅拌器上轻微搅拌24 h,以脱除杂蛋白,每8 h换一次液。然后用蒸馏水漂洗3次,将其浸泡于10%的异丙醇中脱脂24 h(料液比为1:20),用蒸馏水漂洗3次。下一步进行酶溶性胶原蛋白提取。
1.2.2.2 草鱼鱼鳔的预处理
先将草鱼鱼鳔剪成大小为0.5 cm×0.5 cm的片段,将剪好的草鱼鱼鳔在0.1 mol/L 的NaOH中轻微搅拌24 h(料液比为1:20),以脱除杂蛋白[5-6]。然后用蒸馏水将鱼鳔漂洗至中性,将其浸泡于10%的异丙醇中脱脂24 h(料液比为1:20),用蒸馏水漂洗3次。下一步进行酶溶性胶原蛋白的提取。
1.2.2.3 两种鱼鳔酶溶性胶原蛋白(PSC)的提取、纯化及胶原蛋白得率计算
将预处理好的鲟鱼鱼鳔和草鱼鱼鳔用含有胃蛋白酶(1:3000)的乙酸溶液(0.5 mol/L)缓慢搅拌48 h,胃蛋白酶的添加量为各鱼鳔干重的2%,料液比为1:100,于10000 r/min离心10 min后收集上清液,用2 mol/L的NaOH调节上清液的pH至7.5[4-7]。向上清液中多次缓慢搅拌加入提前碾磨好的NaCl粉末直至NaCl浓度达到2.5 mol/L为止,搅拌2 h,静置12 h,于10000 r/min离心10 min后,收集沉淀,用0.5 mol/L乙酸(料液比1:30)缓慢搅拌至沉淀溶解。将其装入截留分子量为14 kDa的透析袋中[10](尽量避免带入气泡),分别用0.1 mol/L乙酸、0.05 mol/L乙酸与蒸馏水各透析2天,最后用真空冷冻干燥机干燥得到两种鱼鳔PSC,按照下式计算胶原蛋白得率。
1.2.3 SDS-PAGE分析
参考LaemmLi[11]对两种鱼鳔PSC进行电泳分析。浓缩胶浓度为5%,分离胶浓度为8%。用预冷的蒸馏水在4 ℃下搅拌溶解,使其浓度达到2.5 mg/mL,与上样缓冲液混合(胶原蛋白溶液:上样缓冲液=4:1),煮沸3 min,10000 r/min离心5 min,取10 μL上清液上样,Marker上样量为5 μL。跑浓缩胶电压为80 V,时间约为0.5 h。待条带进入分离胶后,电压调至120 V,时间约为1.5 h。采用考马斯亮蓝R250溶液进行染色,用50%甲醇与6.8%醋酸溶解R250,振荡染色4 h。用5%甲醇与7.5%醋酸脱色至无背景色,然后用凝胶成像系统拍摄并分析各条带的分子质量,商业明胶作为对照组。
1.2.4 氨基酸组成分析
取冻干后的两种鱼鳔PSC各100 mg,取5 mL的6 mol/L HCl,110 ℃下水解24 h[10]。将溶液注入氨基酸自动分析仪,与标准氨基酸对比,氨基酸含量记为每1000个残基对应的氨基酸残基个数。
1.2.5 紫外光谱分析
称取适量的两种鱼鳔PSC,用预冷的蒸馏水在4 ℃下搅拌溶解,使胶原蛋白浓度达到1 mg/mL。用紫外分光光度计对胶原蛋白溶液进行190~400 nm波长扫描[12]。
1.2.6 红外光谱分析
参考Pal等[13]方法,称取1~2 mg的两种鱼鳔PSC样品加入200 mg左右干燥后的KBr中,在玛瑙研钵中按一个方向碾细,取适量放入擦拭干净的模具,置于真空压片机中关闭放气阀并加压至20 MPa持续1~2 min,将制备好样品的压片放入样品室中,用傅里叶红外分析仪进行400~4000 cm−1扫描,并以单纯的KBr压片扫描作为背景。
1.2.7 圆二光谱分析
称取适量的两种鱼鳔PSC样品,用预冷的蒸馏水在4 ℃下搅拌溶解,使胶原蛋白浓度达到0.5 mg/mL。常温下在190~260 nm波长范围内扫描,扫描速率为20 nm/min,间隔0.1 nm[14]。
1.2.8 热变性温度测定
将两种鱼鳔PSC与蒸馏水按1:40混合,充分溶胀24 h(4 ℃)。于8000 r/min离心3 min以脱除气泡,取适量胶原蛋白溶液加入微量热仪测定其热变性温度(Td)[15]。升温速率为0.5 ℃/min,温度范围在10~60 ℃。
1.3 数据处理
采用SPSS软件进行统计学分析,每个指标测三次平行,统计结果以
2. 结果与分析
2.1 两种鱼鳔基本营养成分比较和胶原蛋白得率分析
表1为两种鱼鳔的基本营养成分和胶原蛋白得率的结果。从表1可见鲟鱼鱼鳔的水分含量显著低于草鱼鱼鳔(P<0.05);为了减少误差,除了水分,其它成分以干基计,两种鱼鳔蛋白质含量都较高;鲟鱼鱼鳔粗脂肪的含量为5.31%,显著高于草鱼鱼鳔3.51%(P<0.05);两种鱼鳔灰分、总糖的含量差异不显著(P>0.05)。两种鱼鳔在干基下蛋白质含量没有显著性差异(P>0.05),但是鲟鱼鱼鳔中羟脯氨酸的含量显著高于草鱼鱼鳔(P<0.05);同时鲟鱼鱼鳔PSC得率80.63%显著高于草鱼鱼鳔PSC得率49.85%(P<0.05)。在动物体内羟脯氨酸是胶原蛋白的特征氨基酸,可以测定羟脯氨酸,乘以转换系数11.1来估算两种鱼鳔胶原蛋白的含量[16]。汪安利等[17]研究发现鱼鳔的基本营养成分因种属的不同而有所差异,不同种属的干鱼鳔营养成分中蛋白质含量最高,脂肪含量偏低。这两种鱼鳔的营养成分组成符合这一结论。
表 1 鲟鱼、草鱼鱼鳔基本营养成分及胶原蛋白得率(除水分均以干基计)Table 1. The basic nutrients of sturgeon and grass carp swim bladder and the yield of collagen (except for water, all on dry basis)种类 粗脂肪(%) 灰分(%) 总糖(%) 蛋白质(%) 水分(%) 羟脯氨酸(%) 胶原蛋白得率(%) 鲟鱼鱼鳔 5.31±0.10a 0.65±0.11a 1.24±0.97a 92.80±0.95a 57.83±0.56b 8.01±0.18a 80.63±0.75a 草鱼鱼鳔 3.51±0.08b 0.81±0.13a 1.77±0.73a 93.97±1.01a 78.34±1.10a 6.18±0.21b 49.85±0.86b 注:同列上标字母不同代表数据间具有显著差异(P<0.05)。 2.2 SDS-PAGE分析结果
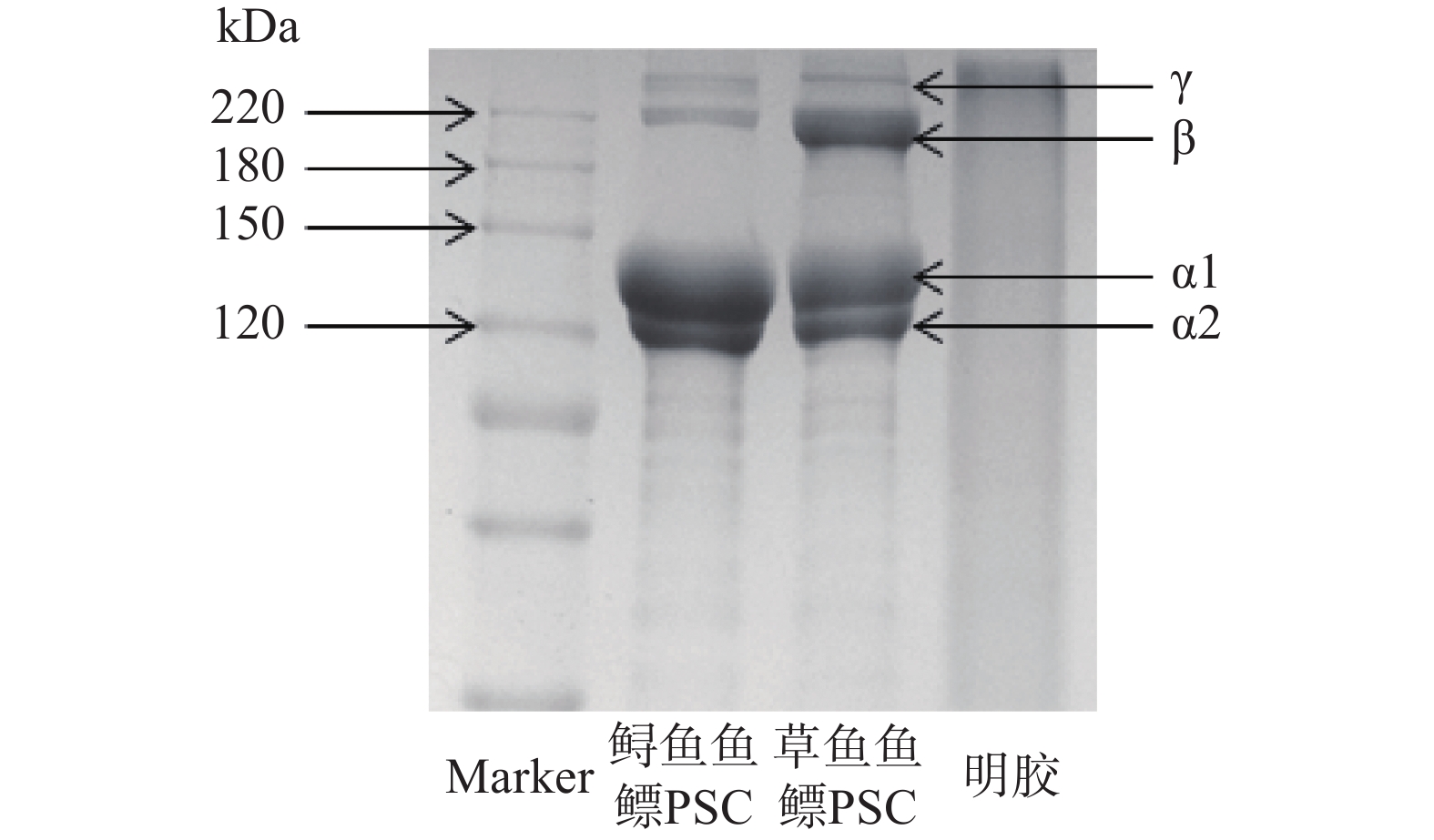
图1为两种鱼鳔PSC和明胶的电泳条带,可见两种鱼鳔PSC的电泳条带与明胶的电泳条带差别非常大,两种鱼鳔PSC都含有两条迁移率不同的α链(α1和α2)及它们的二聚体β链和三聚体γ链,两种鱼鳔PSC的α1链含量均比α2含量高,且α链的相对分子质量都在120~150 kDa之间,β链和γ链的相对分子质量也在200 kDa以上。这些特征与报道的I型胶原蛋白电泳条带一致[18]。从电泳图中也可以看出两种PSC的差异,草鱼鱼鳔PSC的α链的相对分子质量要高于鲟鱼鱼鳔PSC,同时草鱼鱼鳔PSC的二聚体β链含量也比鲟鱼鱼鳔PSC的含量要高。
2.3 氨基酸组成分析结果
表2为两种鱼鳔PSC氨基酸组成。从表2可见,两种鱼鳔PSC的氨基酸组成中的天冬氨酸、苏氨酸、谷氨酸、甘氨酸、缬氨酸含量没有显著性差异(P>0.05),鲟鱼鱼鳔PSC中的丝氨酸、蛋氨酸、异亮氨酸、亮氨酸、组氨酸和精氨酸的含量显著高于草鱼鱼鳔PSC(P<0.05),草鱼鱼鳔PSC中的丙氨酸、苯丙氨酸、赖氨酸、脯氨酸和羟脯氨酸的含量显著高于鲟鱼鱼鳔PSC(P<0.05)。
表 2 两种鱼鳔PSC的氨基酸组成(残基个数/1000个残基)Table 2. Amino acid composition of two kinds of swim bladder PSC(AA/1000 AA)氨基酸 鲟鱼鱼鳔PSC 草鱼鱼鳔PSC 天冬氨酸 53.01±0.15a 52.34±1.04a 苏氨酸 26.12±1.01a 27.56±0.89a 丝氨酸 46.14±2.14a 28.27±1.97b 谷氨酸 87.13±1.61a 84.36±1.01a 甘氨酸 349.14±2.14a 353.27±1.67a 丙氨酸 86.01±1.16b 100.26±1.24a 缬氨酸 20.14±0.17a 19.65±0.87a 蛋氨酸 9.25±0.24a 8.67±0.14b 异亮氨酸 11.25±0.25a 6.16±0.31b 亮氨酸 22.23±0.17a 20.60±0.14b 酪氨酸 0 0 苯丙氨酸 12.37±0.45b 14.34±0.78a 赖氨酸 24.56±1.01b 28.27±1.17a 组氨酸 7.61±0.13a 4.46±0.12b 精氨酸 65.13±1.53a 56.65±1.21b 脯氨酸 89.67±0.76b 98.34±1.15a 羟脯氨酸 90.14±0.53b 96.75±0.78a 注:同行上标字母不同代表数据间具有显著差异(P<0.05)。 李国英等[19]报道I型胶原蛋白氨基酸组成特点:甘氨酸的含量占30%左右,亚氨基酸(脯氨酸和羟脯氨酸)含量占20%左右,哺乳动物胶原蛋白中亚氨基酸含量较高,通常高于鱼类胶原蛋白,猪皮和牛皮胶原蛋白中亚氨基酸含量分别是22%和21.5%。鲟鱼和草鱼鱼鳔PSC的甘氨酸的含量分别是34.9%和35.3%,亚氨基酸的含量分别是17.9%和19.5%。猪皮和牛皮胶原蛋白中亚氨基酸含量都高于两种鱼鳔PSC,与报道相符。可能是因为种属和生长环境的差异导致两种鱼鳔中提取的PSC的氨基酸组成中大部分氨基酸含量存在明显差异,但两种鱼鳔PSC的氨基酸组成都符合I型胶原蛋白的特征。
2.4 紫外光谱分析结果
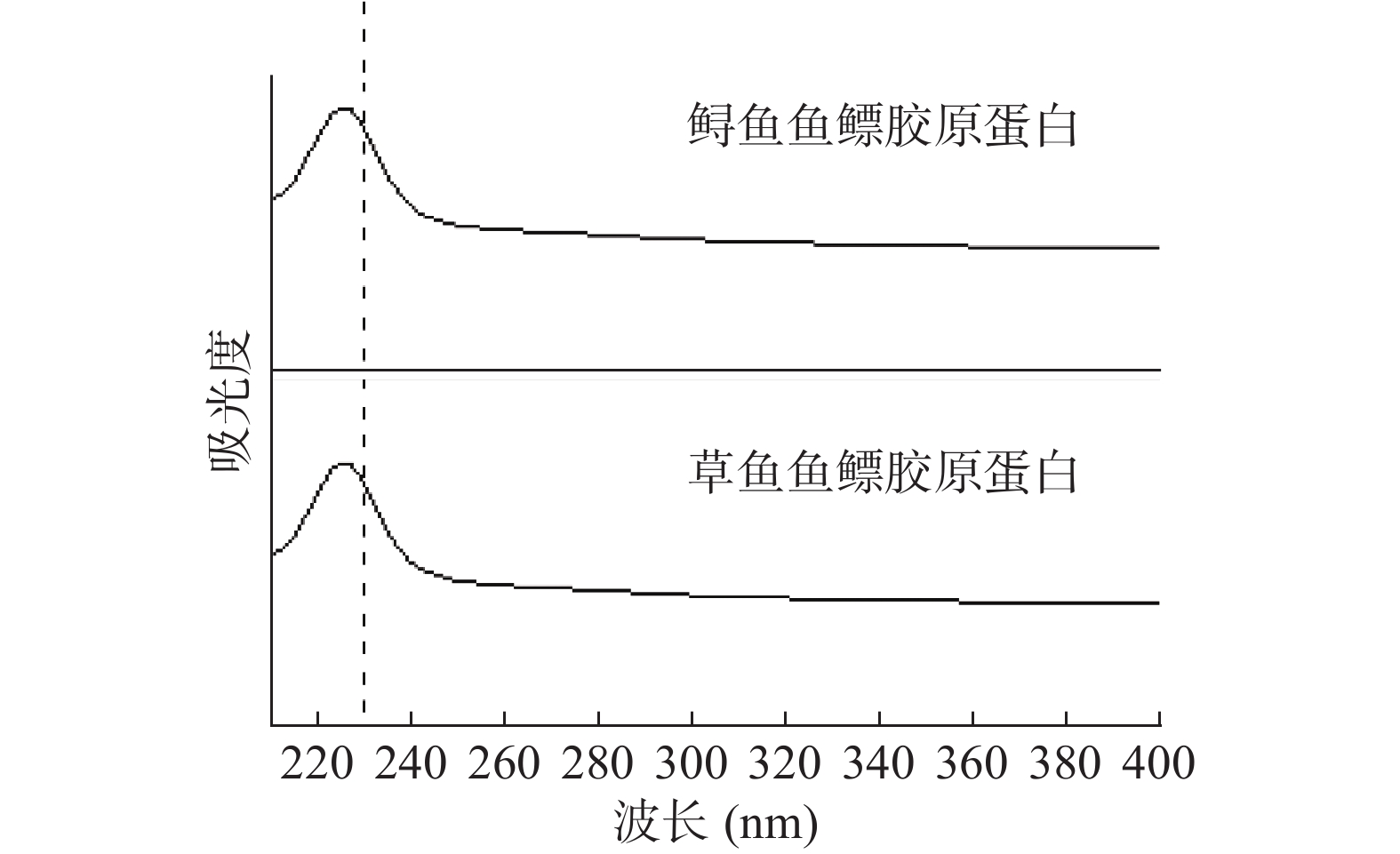
图2为两种鱼鳔PSC紫外光谱。其中鲟鱼鱼鳔PSC最大吸收峰为227 nm,草鱼鱼鳔PSC最大吸收峰为228 nm。据报道[20],大多数蛋白质在波长280 nm附近有最大吸收峰,这主要是色氨酸残基的吲哚环和酪氨酸残基的酚基引起的,而I型胶原蛋白紫外最大吸收峰在230 nm左右。尽管两种鱼鳔PSC紫外最大吸收峰的位置不同,但都在230 nm附近,符合I型胶原蛋白紫外光谱特征。
2.5 红外光谱分析结果
图3为两种鱼鳔PSC红外光谱,可见两种鱼鳔PSC红外光谱都具有I型胶原蛋白典型的五条红外吸收酰胺带,但每个酰胺带的峰位不同。其中酰胺A带归属于N-H伸缩振动,酰胺B归属于-CH2不对称伸缩振动,酰胺I带归属于C=O伸缩振动,酰胺II带归属于N-H弯曲振动和C-N伸缩振动,酰胺III带归属于N-H弯曲振动[21]。
根据Doyle理论[22],酰胺A带中当N-H的氢键键合程度比较高时,吸收波数就会蓝移,振动频率就会降低。草鱼鱼鳔PSC的酰胺A带位置的波数要比鲟鱼鱼鳔PSC大,表明鲟鱼鱼鳔PSC分子间可能形成较广泛的氢键键合。
Payne等[23]报道酰胺I带和酰胺II带两个峰的振动频率与胶原蛋白分子的有序度和交联度呈正相关。图中草鱼鱼鳔PSC两个酰胺带峰的振动频率都稍高于鲟鱼鱼鳔PSC,表明草鱼鱼鳔PSC具有比鲟鱼鱼鳔PSC较高的有序度和交联度。
总的来讲,从红外光谱中可以看出两种鱼鳔胶原蛋白二级结构相似但也存在一定差异,草鱼鱼鳔PSC中有较高的分子有序度和分子间交联度,而鲟鱼鱼鳔PSC中拥有较多的氢键。
2.6 圆二光谱分析结果
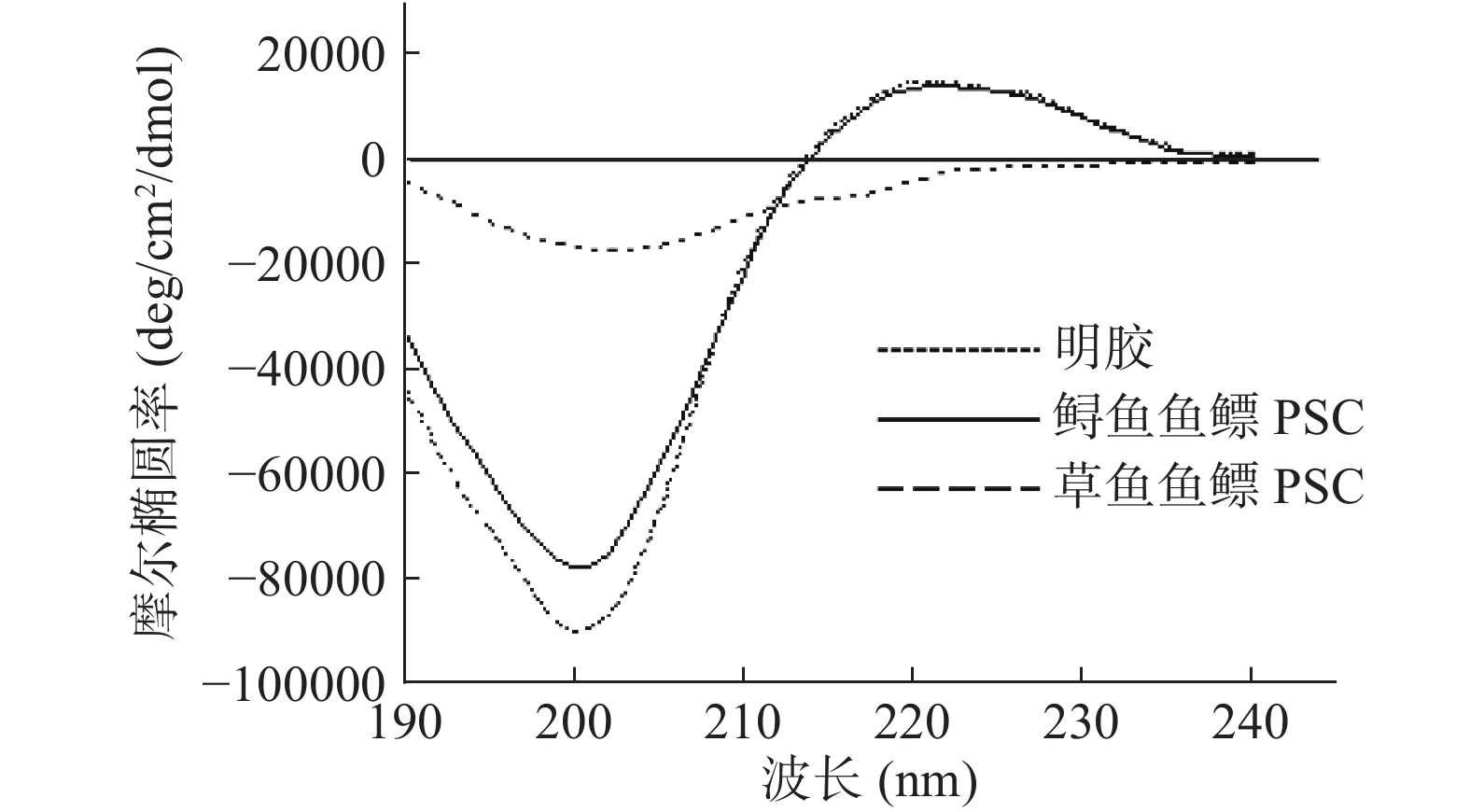
图4为两种鱼鳔PSC和明胶的圆二光谱,两种鱼鳔PSC圆二光谱中负峰的吸收波长为200 nm,正峰的吸收波长为220 nm,而明胶没有正峰。Sreerama等[24]报道胶原蛋白溶液的圆二光谱特征:在200 nm左右存在一强负吸收峰,在220 nm左右存在一弱正吸收峰。Feng等[25]报道,若胶原蛋白的圆二光谱中的正负吸收峰的强度比值的绝对值Rpn值小于1,即可判断其存在三螺旋结构。两种鱼鳔PSC圆二光谱的正负吸收峰的位置与报道的胶原蛋白圆二光谱相符,其中鲟鱼鱼鳔PSC的Rpn=0.17,草鱼鱼鳔PSC的Rpn=0.16,两者都小于1,圆二光谱特征说明这两种不同来源的鱼鳔PSC二级结构相似且都保持了较为完整的三螺旋结构。
2.7 热变性温度测定结果
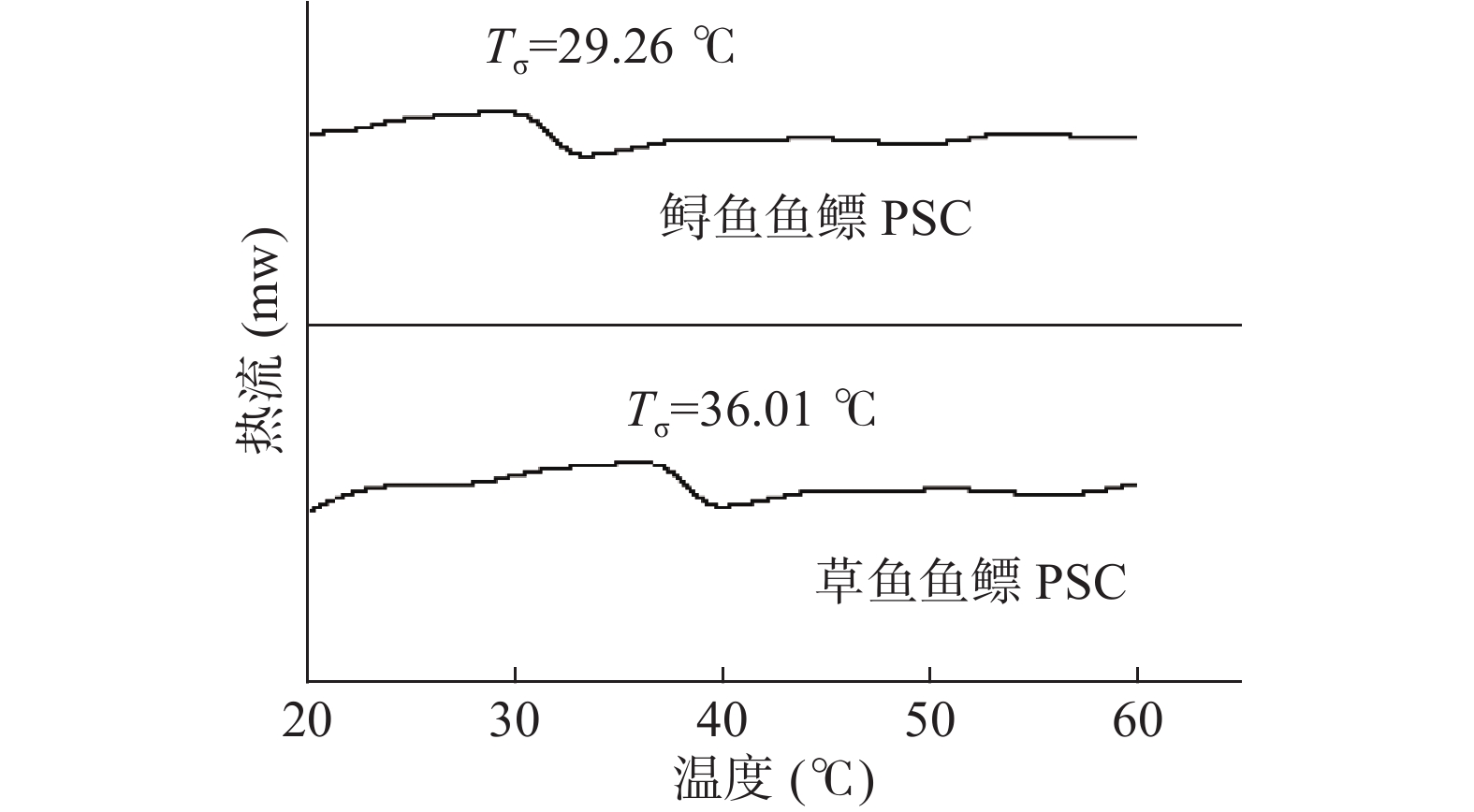
图5是两种鱼鳔PSC的DSC结果,可见草鱼鱼鳔PSC的变性温度为36.01 ℃,高于鲟鱼鱼鳔PSC的热变性温度为29.26 ℃(P<0.05)。
胶原蛋白的热稳定性是重要的理化性质指标[26]。研究报道鱼类胶原蛋白的热稳定性与鱼类的生活环境和温度有关,通常冷水鱼低于温水鱼[27-28]。Kimura等[29]研究阿拉斯加狭鳕鱼鱼鳔胶原蛋白的变性温度为18.4 ℃,因为属于冷水鱼,所以它的热稳定性较差。其中鲟鱼的生长适宜温度在20~25 ℃,草鱼的生长适宜温度在27~32 ℃[30],可判断其热稳定性可能与其生存环境温度相关。同时胶原蛋白的热稳定性和氨基酸组成有一定的联系,但不同的学者有不同的结论。Ikoma等[31]研究表明亚氨基酸中存在着吡啶环状结构,这一结构对胶原蛋白三螺旋结构的稳定性起重要作用,所以胶原蛋白的热变性温度与亚氨基酸的含量存在正相关性。而Nagai等[32]研究表明羟脯氨酸中的羟基结构有助于形成内的氢键键合,可以提高三螺旋结构的稳定性,故脯氨酸的羟基化程度与胶原蛋白的热变性温度存在正相关性。氨基酸组成分析中鲟鱼鱼鳔PSC的亚氨基酸含量是17.9%,脯氨酸的羟基化程度是57.5%,草鱼鱼鳔PSC中亚氨基酸含量是19.5%,脯氨酸的羟基化程度是49.6%。造成鲟鱼鱼鳔PSC和草鱼鱼鳔PSC热稳定差异的原因更接近Ikoma的理论,即亚氨基酸的含量偏低导致鲟鱼鱼鳔PSC的变性温度低于草鱼鱼鳔PSC的变性温度。
综合分析,两种鱼生长的环境温度以及两种鱼鳔PSC中亚氨基酸含量可能是造成两种鱼鳔PSC热稳定性具有显著性差异的原因。
3. 结论
鲟鱼鱼鳔基本营养成分中的粗脂肪和羟脯氨酸含量均显著高于草鱼鱼鳔(P<0.05);鲟鱼鱼鳔PSC得率80.63%显著高于草鱼鱼鳔PSC得率49.85%(P<0.05);两种鱼鳔PSC都属于I型胶原蛋白;两种鱼鳔PSC具有相似的二级结构;鲟鱼鱼鳔PSC的α链相对分子质量和二聚体β链的含量都低于草鱼鱼鳔PSC;氨基酸组成中鲟鱼鱼鳔PSC中的丝氨酸、蛋氨酸、异亮氨酸、亮氨酸、组氨酸和精氨酸的含量显著高于草鱼鱼鳔PSC(P<0.05),草鱼鱼鳔PSC中的丙氨酸、苯丙氨酸、赖氨酸、脯氨酸和羟脯氨酸的含量显著高于鲟鱼鱼鳔PSC(P<0.05);鲟鱼鱼鳔PSC的变性温度29.26 ℃显著低于草鱼鱼鳔PSC变性温度36.01 ℃(P<0.05)。从鲟鱼鱼鳔和草鱼鱼鳔中所得到的PSC虽都属于I型胶原蛋白,但草鱼鱼鳔PSC有更好的热稳定性,鲟鱼鱼鳔PSC有更高的得率。
-
表 1 鲟鱼、草鱼鱼鳔基本营养成分及胶原蛋白得率(除水分均以干基计)
Table 1 The basic nutrients of sturgeon and grass carp swim bladder and the yield of collagen (except for water, all on dry basis)
种类 粗脂肪(%) 灰分(%) 总糖(%) 蛋白质(%) 水分(%) 羟脯氨酸(%) 胶原蛋白得率(%) 鲟鱼鱼鳔 5.31±0.10a 0.65±0.11a 1.24±0.97a 92.80±0.95a 57.83±0.56b 8.01±0.18a 80.63±0.75a 草鱼鱼鳔 3.51±0.08b 0.81±0.13a 1.77±0.73a 93.97±1.01a 78.34±1.10a 6.18±0.21b 49.85±0.86b 注:同列上标字母不同代表数据间具有显著差异(P<0.05)。 表 2 两种鱼鳔PSC的氨基酸组成(残基个数/1000个残基)
Table 2 Amino acid composition of two kinds of swim bladder PSC(AA/1000 AA)
氨基酸 鲟鱼鱼鳔PSC 草鱼鱼鳔PSC 天冬氨酸 53.01±0.15a 52.34±1.04a 苏氨酸 26.12±1.01a 27.56±0.89a 丝氨酸 46.14±2.14a 28.27±1.97b 谷氨酸 87.13±1.61a 84.36±1.01a 甘氨酸 349.14±2.14a 353.27±1.67a 丙氨酸 86.01±1.16b 100.26±1.24a 缬氨酸 20.14±0.17a 19.65±0.87a 蛋氨酸 9.25±0.24a 8.67±0.14b 异亮氨酸 11.25±0.25a 6.16±0.31b 亮氨酸 22.23±0.17a 20.60±0.14b 酪氨酸 0 0 苯丙氨酸 12.37±0.45b 14.34±0.78a 赖氨酸 24.56±1.01b 28.27±1.17a 组氨酸 7.61±0.13a 4.46±0.12b 精氨酸 65.13±1.53a 56.65±1.21b 脯氨酸 89.67±0.76b 98.34±1.15a 羟脯氨酸 90.14±0.53b 96.75±0.78a 注:同行上标字母不同代表数据间具有显著差异(P<0.05)。 -
[1] 赵然, 曹敏杰, 王晶, 等. 水产动物源胶原蛋白蛋白的提取及应用研究进展[J]. 食品安全质量检测学报,2020,11(22):8157−8165. [2] 邓浩, 党政, 尹青春, 等. 胶原蛋白蛋白的研究进展[J]. 广州化工,2019,47(18):27−30. doi: 10.3969/j.issn.1001-9677.2019.18.014 [3] 王保友, 王斌, 陈玮, 等. 我国鲟鱼养殖产业现状及发展趋势[J]. 水产研究,2020,7(2):107−114. [4] 蒋玉. 鲟鱼鳔胶原蛋白蛋白延缓皮肤自然衰老作用及分子机制研究[D]. 镇江: 江苏大学, 2019. [5] Zhang X, Ookawa M, Tan Y, et al. Biochemical characterisation and assessment of fibril-forming ability of collagens extracted from Bester sturgeon Huso huso×Acipenser ruthenus[J]. Food Chemistry,2014,160:305−312. doi: 10.1016/j.foodchem.2014.03.075
[6] 张宝, 陈运中, 徐颖, 等. 草鱼鱼鳔胶原蛋白性质的研究[J]. 食品科学,2010,31(1):58−62. [7] 詹永献. 草鱼鱼鳔胶原蛋白蛋白理化性质及结构特点的研究[D]. 洛阳: 河南科技大学, 2012. [8] 王金梅, 包建强. 超声波辅助酶法提取草鱼皮胶原蛋白蛋白及其纯化[J]. 食品工业科技,2016,37(18):236−240. [9] 李娜. 鳕鱼鳔胶原蛋白蛋白和胶原蛋白肽特性及对细胞衰老进程干预作用与机制[D]. 上海: 上海海洋大学, 2019. [10] Tanaka T, Takahashi K, Tsubaki K, et al. Isolation and characterization of acid-soluble bluefin tuna (Thunnus orientalis) skin collagen[J]. Fisheries and Aquatic Scienences,2018,21(1):7−14. doi: 10.1186/s41240-018-0084-1
[11] Laemmli U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature,1970,227(5259):680−685. doi: 10.1038/227680a0
[12] Cao W, Shi L, Weng W. Histological distribution and characterization of collagen in European eel(Anguilla anguilla) Muscle[J]. Journal of Aquatic Food Product Technology,2019,29(1):1−11.
[13] Pal G K, Suresh P V. Physico-chemical characteristics and fibril-forming capacity of carp swim bladder collagens and exploration of their potential bioactive peptides by in silico approaches[J]. International Journal of Biological Macromolecules,2017,101:304−313. doi: 10.1016/j.ijbiomac.2017.03.061
[14] Tang L, Chen S, Su W, et al. Physicochemical properties and film-forming ability of fish skin collagen extracted from different freshwater species[J]. Process Biochemistry,2015,50:148−155. doi: 10.1016/j.procbio.2014.10.015
[15] Rochdi A, Foucat L, Renou J P. NMR and DSC studies during thermal denaturation of collagen[J]. Food Chemistry,2000,69(3):295−299. doi: 10.1016/S0308-8146(99)00267-8
[16] 文卓琼, 黄爱妮. 鱼类胶原蛋白蛋白的研究进展[J]. 黑龙江科技信息,2016(14):95−96. [17] 汪安利, 祖晋锋, 时文强, 等. 白鲢鱼鳔营养成分分析与评价[J]. 食品安全质量检测学报,2019,10(8):143−148. [18] Sionkowska A, KozLowska J, Skorupska M, et al. Isolation and characterization of collagen from the skin of Brama australis[J]. International Journal of Biological Macromolecules,2015,80:605−609. doi: 10.1016/j.ijbiomac.2015.07.032
[19] 李国英, 刘文涛. 胶原蛋白化学[M]. 北京: 中国轻工业出版社, 2013: 5-8. [20] Sun L, Li B, Song W, et al. Characterization of Pacific cod ( Gadus macrocephalus) skin collagen and fabrication of collagen sponge as a good biocompatible biomedical material[J]. Process Biochemistry,2017,63:229−235. doi: 10.1016/j.procbio.2017.08.003
[21] Zhang Q, Wang Q, Lv S, et al. Comparison of collagen and gelatin extracted from the skins of Nile tilapia(Oreochromis niloticus) and channel catfish (Ictalurus punctatus)[J]. Food Bioscience,2016,13:41−48. doi: 10.1016/j.fbio.2015.12.005
[22] Doyle B B, Bendit E G, Blout E R. Infrared spectroscopy of collagen and collagen like peptides[J]. Biopolymers,2010,14(5):937−957.
[23] Payne K J, Veis A. Fourier transform ir spectroscopy of collagen and gelatin solutions: Deconvolution of the amide I band for conformational studies[J]. Biopolymers,1988,27(11):1749. doi: 10.1002/bip.360271105
[24] Sreerama N, Woody R W. Poly(pro)II helices in globular proteins: Identification and circular dichroic analysis[J]. Biochemistry,1994,33(33):10022−10025. doi: 10.1021/bi00199a028
[25] Feng Y B, Melacini G, Taulane J P, et al. Acetyl-terminated and template-assembled collagen-based polypeptides composed of Gly-Pro-Hyp Sequences. 2. Synthesis and conformational analysis by circular dichroism, ultraviolet absorbance, and optical rotation[J]. Journal of the American Chemical Society,1996,118(43):10351−10358. doi: 10.1021/ja961260c
[26] 王园园, 张靓, 周鹏, 等. 太湖白鱼中胶原蛋白蛋白的提取及其理化性质分析[J]. 食品工业科技,2017,38(18):45−49. [27] 邓明霞, 汪海波, 杨玲, 等. 氨基酸组成及溶剂环境对淡水鱼胶原蛋白蛋白热稳定性能的影响[J]. 现代食品科技,2015,31(12):111−120. [28] Bhuimbar M V, Bhagwat P K, Dandge P B. Extraction and characterization of acid soluble collagen from fish waste: Development of collagen-chitosan blend as food packaging film[J]. Journal of Environmental Chemical Engineering,2019,7(2):102−108.
[29] Kimura S, Ohno Y. Fish type I collagen: tissue-specific existence of two molecular forms, (α1) 2α2 and α1α2α3, in Alaska pollack[J]. Comparative Biochemistry and Physiology Part B: Comparative Biochemistry,1987,88(2):409−413. doi: 10.1016/0305-0491(87)90320-8
[30] 李林春. 中国鱼类图鉴[M]. 山西: 山西科学技术出版社, 2015: 20−30. [31] Ikoma T, Kobayashi H, Tanaka J, et al. Physical properties of type I collagen extracted from fish scales of Pagrus major and Oreochromis niloticas[J]. International Journal of Biological Macromolecules,2003,32(3−5):199−204. doi: 10.1016/S0141-8130(03)00054-0
[32] Nagai T, Suzuki N, Nagashima T. Collagen from common minke whale (Balaenoptera acutorostrata) unesu[J]. Food Chemistry,2008,111(2):296−301. doi: 10.1016/j.foodchem.2008.03.087





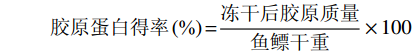
 下载:
下载:

 下载:
下载:
