Effect of Different Solvent Extracts of Amygdalus mongolica on Liver Fibrosis Rat Models Induced by Carbon Tetrachloride and Its Mechanisms
-
摘要: 探讨蒙古扁桃不同极性部位对四氯化碳致肝纤维化大鼠的作用及可能机制。雄性SD大鼠分为7组,每组10只。以四氯化碳建立肝纤维化大鼠模型,将成模大鼠分为模型组、水飞蓟素组(0.05 g/kg)阳性药组和蒙古扁桃石油醚、乙酸乙酯、正丁醇、水部位提取物组,同批未给四氯化碳的大鼠为正常对照组。给药8周后,测血清中的丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)、碱性磷酸酶(alkaline phosphatase,ALP)活性及丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)、透明质酸(hyaluronic acid, HA)、层粘连蛋白(laminin,LN)、Ⅲ型前胶原(type Ⅲ collagen,PC-Ⅲ)和Ⅳ型胶原(type Ⅳ collagen ,Col-Ⅳ)含量并计算肝指数和脾指数;同时测肝组织中MDA、SOD、羟脯氨酸(hydroxyproline,HYP)含量及转化生成因子β1(Transforming growth factor β1 protein,TGF-β1)、Smad3(mothers against decapentaplegic homolog)和Smad7的表达。与模型组比较,蒙古扁桃药材各极性部位大鼠的体质量显著增加(P<0.05),血清和组织中MDA显著降低(P<0.05),血清中SOD显著升高(P<0.05),石油醚、水部位大鼠肝指数显著降低(P<0.05);病理学检查结果显示,蒙古扁桃药材各部位给药组大鼠肝纤维化有明显改善;蒙古扁桃石油醚部位和正丁醇部位可显著降低血清中AST、ALP、HA、PC-Ⅲ含量(P<0.05)及下调组织中HYP、TGF-β1和Smad3的水平(P<0.05);蒙古扁桃正丁醇部位可显著降低血清中ALT含量(P<0.05)。蒙古扁桃药材石油醚、正丁醇提取物对肝纤维化有显著改善作用,是保护肝纤维化的优选活性部位,其机制可能是通过调节胶原合成异常及TGF-β1/Smad 信号通路来发挥作用。
-
关键词:
- 蒙古扁桃 /
- 四氯化碳 /
- 肝纤维化 /
- 病理检查 /
- TGF-β1/Smad信号通路
Abstract: To investigate the effects and possible mechanisms of different polarity positions of Amygdalus mongolica on carbon tetrachloride to hepatic fibrosis rats. Male SD rats were divided into 7 groups with 10 in each group. The rats were divided into model group, silymarin group (0.05 g/kg), positive drug group and Amygdalus mongolica petroleum ether, ethyl acetate, n-butanol and aqueous extract group. The rats in the same group were not given carbon tetrachloride as normal control group. After 8 weeks of treatment, serum alanine aminotransferase (ALT), aspartate aminotransferase (AST), alkaline phosphatase (ALP) activity and malondialdehyde (MDA), superoxide dismutase (SOD), hyaluronic acid (HA), laminin (LN), type Ⅲ collagen (PC-Ⅲ) and type Ⅳ collagen (Col-Ⅳ) content were measureed, and the liver index and spleen index were calculated; The contents of MDA, SOD and Hydroxyproline(HYP) and the expressions of transforming growth factor β1 protein (TGF-β1), mothers against decapentaplegic homolog 3 (Smad3) and Smad7 mRNA in liver tissues were also measured. Compared with the model group, the body mass of the rats in various polar parts of Amygdalus mongolica significantly increased (P<0.05), MDA in serum and tissues significantly decreased (P<0.05), SOD in serum significantly increased (P<0.05), and liver index of the rats in petroleum ether and water parts significantly decreased (P<0.05). The results of pathological examination showed that the liver fibrosis of the rats in each part of the drug group was significantly improved. Amygdalus mongolica petroleum ether part and n-butanol part could significantly decrease in the serum AST, ALP, HA, PC-Ⅲ content (P<0.05), HYP, TGF-β1 and Smad3 levels in the organization (P<0.05). The n-butanol position of Amygdalus mongolica could significantly reduce the serum ALT level (P<0.05). Amygdalus mongolica herbs petroleum ether, n-butanol extract has improved markedly effect to liver fibrosis, which is the preferred active site for protection of liver fibrosis and its mechanism may be through adjusting abnormal collagen synthesis and TGF-β1 / Smad signaling pathways to work. -
肝纤维化(hepatic fibrosis,HF)是肝脏对慢性损伤的一种修复反应,是慢性肝病共有的病理改变[1]。它是肝硬化及各种终末期肝病复杂病症如肝门静脉高压、肝腹水、合成功能紊乱、代谢能力受损等发生的基础,严重威胁人类健康,但也是其早期可逆阶段[2]。目前针对肝纤维化的治疗如秋水仙碱、皮质类固醇等经典药物存在较高的副反应发生率,制约了肝纤维化的治疗[3]。近年来,研究发现中药在治疗肝纤维化方面有独特的优势[4-6],中药治疗肝纤维化已成为人们研究的热点[7]。
蒙古扁桃(Amygdalus mongolica)蒙名乌兰-布衣勒斯属蔷薇科扁桃属旱生落叶灌木,为蒙古高原特有的阿拉善荒漠种[8-10],其分布区阿拉善荒漠区是我国八大生物多样性中心之一,特殊的环境胁迫造成了次生代谢产物结构多样性和生物活性多样性,也为获得高效低毒的药用生物活性成分提供了新的来源[11]。蒙古扁桃富含总黄酮、蛋白质、脂肪酸、有机酸、多糖、维生素E等营养和药用成分[12]。蒙古扁桃作为一味传统的中药材以种仁入药,可代“郁李仁”[13],性苦,味平,主治咽喉干燥、干咳及支气管炎、阴虚便秘,能润燥滑肠、利尿,主治大便燥结、水肿、脚气等症[14]。课题组前期研究表明,蒙古扁桃油具有调血脂、提高肝脏抗氧化功能和保护肝脏的作用[15-17],已证实蒙古扁桃具有较好防治肝、肺、肾纤维化的作用,并已明确蒙古扁桃石油醚提取物和正丁醇提取物为抗肾纤维化和抗肺纤维化作用有效部位[18-19],但其抗肝纤维化作用的有效部位有待进一步明确。本实验在前期研究基础上,通过建立稳定的大鼠肝纤维化模型,灌胃蒙古扁桃石油醚、乙酸乙酯、正丁醇、水部位提取物,通过对大鼠生理指标、肝脏组织的形态学、纤维化指标、血清生化指标、组织生化指标及分子生物学等方面的分析,筛选出蒙古扁桃对大鼠肝纤维化保护作用的有效部位,为进一步挖掘蒙古扁桃药材新的药理作用及开发治疗抗纤维化药物提供科学依据和理论基础。
1. 材料与方法
1.1 材料与仪器
蒙古扁桃药材 蒙古扁桃种子采自阿拉善雅布来戈壁,经包头医学院药学院石松利教授鉴定为蒙古扁桃(Amygdalus mongolica);水飞蓟素胶囊(批号131102819) 德服博士大药厂;CCl4(批号:20091217) 天津市北方天医化学试剂厂;ALT、AST和ALP试剂盒 美国贝克曼公司;MDA试剂盒(批号:20150421)、SOD试剂盒(批号:20150505)、HYP试剂盒(批号:20150527)、总蛋白定量测定试剂盒(批号:20150519) 南京建成生物工程研究所;HA试剂盒、LN试剂盒、PC-Ⅲ试剂盒、Col-Ⅳ试剂盒(批号:20151020) 北京北方生物技术研究所有限公司;mRNA提取试剂TRIzol Thermo Fisher Scientific公司;逆转录试剂盒RevertAid First Strand cDNA Synthesis Kit Thermo Fisher Scientific公司;qPCR试剂RealSYBR Mixture 康为世纪公司;PCR引物 宁夏科诺嘉华生物工程有限公司。SPF级SD雄性大鼠,体质量170~200 g(许可证号SCXK(京)2011-0012) 北京大学医学部(实验动物科学部)。
TGL-16M型高速台式冷冻离心机 湖南湘仪实验室仪器开发有限公司;RE-52A型旋转蒸发仪 上海亚荣生化仪器厂;GENIUS 5K-D全自动脱帽离心机 长沙鑫奥仪器;AU640全自动生化分析仪 日本奥林巴斯公司;CX31显微镜 日本奥林巴斯公司;Vlultifuge X1R高速冷冻离心机 美国赛默飞公司;7500型qPCR仪 美国AB公司;NanoDrop 2000微量分光光度计 美国赛默飞公司;7500型qPCR仪 美国AB公司。
1.2 实验方法
1.2.1 蒙古扁桃不同极性部位提取物的制备
取蒙古扁桃生药研碎,置于索氏提取器中,用10倍体积的95%乙醇(v/v)水浴提取3次,每次2 h;再用10倍体积的50%乙醇(v/v)提取3次,每次2 h,得粗提液[20]。分别使用旋转蒸发仪和水浴锅浓缩粗提液至膏状。将粗膏依次分别以石油醚、乙酸乙酯、正丁醇和水萃取得到各部位提取物,得率分别为石油醚部位56.68%、乙酸乙酯部位8.38%、正丁醇部位23.35%、水部位11.59%。
1.2.2 建立动物模型、分组及给药
将70只SD大鼠随机分为正常对照组、纤维化模型组、水飞蓟素阳性对照组及蒙古扁桃石油醚部位、乙酸乙酯部位、正丁醇部位和水部位提取物7组,每组10只。大鼠肝纤维化造模方法参照文献[21-23],用橄榄油将CCl4配制成40%橄榄油液,除对照组之外,其余各组大鼠按体重腹部皮下注射40% CCl4橄榄油液3 mL/kg(首次5 mL/kg),每周2次,持续8周。造模同时给药,蒙古扁桃石油醚部位、乙酸乙酯部位、正丁醇部位和水部位提取物组给药剂量均为1.5 g/kg(生药剂量),以0.01 g/mL的水飞蓟素溶液按大鼠体重5 mL/kg灌胃给药,模型组和正常对照组按大鼠体重5 mL/kg灌胃给蒸馏水,每天灌胃1次。实验过程中每天注意观察大鼠的反应、饮水饮食、粪尿排泄、毛发光泽等基本情况。
1.2.3 血清及肝脏的采集
末次给药禁食不禁水24 h后,称量各组大鼠体质量,用10%水合氯醛腹腔注射麻醉后,腹主动脉取血,血液以4 ℃下,以6000 r/min冷冻离心,分离血清,置于−80 ℃冰箱保存,用以检测各项血清生化指标。各组大鼠处死后取其肝脏、脾,观察肝脾色、质、形态等情况,称质量用于计算肝脾指数和脾指数(肝指数=肝质量/体质量×100%,脾指数=脾质量/体质量×100%),从肝右叶中相同部位切取肝组织一块做苏木精-伊红染色(hematoxylin-eosin staining,HE染色)、马松染色(Masson染色)。
1.2.4 观察各项指标及检测方法
1.2.4.1 HE及Masson胶原染色观察肝脏病理学形态
将经福尔马林溶液固定后的肝脏组织常规脱水,石蜡包埋,切片进行HE及Masson胶原染色,于光镜下观察(×100)各组大鼠肝脏的肝纤维化程度[24-25]。
1.2.4.2 生化指标测定
血清ALT、AST、ALP、SOD、MDA含量组织中的SOD和MDA均采用全自动生化检测仪测量。
1.2.4.3 肝纤维化指标测定
血清中HA、LN、PC-Ⅲ、Col-Ⅳ采用夹心酶联免疫吸附试验法(ELISA法),严格按照试剂盒说明书进行操作;肝组织中HYP的测定,按照试剂盒方法测定。
1.2.4.4 荧光定量PCR扩增实验
引物序列如表1:
表 1 PCR引物序列Table 1. PCR primer sequence基因名称 上游引物(5′-3′) 下游引物(5′-3′) RAT Actin CCCATCTATGAGGGTTACGC TTTAATGTCACGCACGATTTC TGF-β1 CGCAACAACGCAATCTATG ACCAAGGTAACGCCAGGA Smad3 CCAGTGCTACCTCCAGTGTT CTGGTGGTCGCTAGTTTCTC Smad7 GGCTTTCAGATTCCCAACTTC CGCCATCCACTTCCCTTGT PCR扩增反应体系:
50 μL反应体系:2×RealSYBR Mixture 25 μL,Forward Primer 10 µmol/L 1 μL,Reverse Primer 10 µmol/L 1 μL,Template DNA 2 μL,ddH2O Up to 50 μL。
qPCR实验参数:
扩增条件:95 ℃ 10 min;95 ℃ 15 s,60 ℃ 40 s,72 ℃ 20 s,40个循环;72 ℃ 2 min。
1.3 数据处理
实验数据处理采用SPSS17.0软件进行分析,实验结果以平均值±标准差表示(
2. 结果与分析
2.1 各组大鼠一般情况
结果见表2,与正常对照组比较,模型组大鼠的体质量显著降低(P<0.05);与模型组比较,蒙古扁桃各极性部位组大鼠的体质量升高,差异有显著性(P<0.05)。实验中,正常对照组大鼠情况良好。各造模组大鼠第2周开始出现精神萎靡,食量减少,背毛脱落,皮肤溃烂等情况。给药期间,水飞蓟素组、蒙古扁桃药材各部位提取物治疗组大鼠进食、皮毛、活动等情况有所改观。第8周,处死大鼠时观察到正常对照组大鼠肝脏颜色鲜红,质嫩;模型组大鼠肝脏表面颜色褐色,质硬,有花斑样改变,个别大鼠肝脏颗粒样变严重;各给药组较模型组变化轻。
表 2 蒙古扁桃药材不同极性部位对大鼠体质量的影响Table 2. Effects of different polar parts of Amygdalus mongolica on rat body quality2.2 蒙古扁桃药材不同极性部位对肝指数和脾指数的影响
结果见表3,与正常对照组比较,模型组大鼠的肝、脾指数均明显升高,差异有显著性(P<0.05)。与模型组比较,蒙古扁桃石油醚、水部位均能明显降低大鼠的肝指数,降幅分别为11.11%和14.49%,差异有显著性(P<0.05)。水飞蓟素及蒙古扁桃各部位给药组均有降低大鼠的脾指数趋势,但无显著性差异(P>0.05)。郭羽轩[26]研究结果表明睡莲花总黄酮高剂量组能极显著降低大鼠肝脏指数(P<0.01);睡莲花总黄酮低、中和高剂量组均能显著降低肝纤维化大鼠的脾脏指数(P<0.05);睡莲花总黄酮低、中剂量组均能显著增加大鼠体质量(P<0.05),睡莲花高剂量组能极显著增加大鼠体质量(P<0.01)。本实验结果表明,蒙古扁桃石油醚和水部位具有明显下调肝指数的作用。
表 3 蒙古扁桃药材不同极性部位对大鼠肝指数、脾指数的影响Table 3. Effects of different polar parts of Amygdalus mongolica on rat liver index and spleen index组别 脏器指数(%) 肝指数 脾指数 对照 2.46±0.08 0.16±0.01 模型 4.14±0.55** 0.19±0.03* 石油醚部位 3.68±0.49**# 0.18±0.02 乙酸乙酯部位 3.83±0.16** 0.17±0.02 正丁醇部位 3.95±0.43** 0.18±0.02 水部位 3.54±0.27**## 0.17±0.01 水飞蓟素 4.07±0.30** 0.17±0.01 2.3 蒙古扁桃药材不同极性部位对肝功能 ALT、AST、ALP的影响
由表4可知,与正常对照组比较,模型组血清 ALT, AST 和ALP活力明显升高,差异有显著性(P<0.05),表明采用四氯化碳造模能使大鼠的肝功能受损。与模型组比较,蒙古扁桃正丁醇部位能显著降低血清 ALT活力(P<0.05);蒙古扁桃石油醚、乙酸乙酯、正丁醇部位能显著降低血清AST活力(P<0.05),降幅分别为26.99%、55.54%和55.91%;蒙古扁桃石油醚、正丁醇、水部位及水飞蓟素能降低血清ALP活力(P<0.05),降幅分别为32.75%、36.61%、27.66%和42.09%。陈淳[27]研究结果表明,红背叶根乙醇、正丁醇提取物能极显著降低肝纤维化大鼠血清ALT和AST水平(P<0.01)。本结果提示蒙古扁桃石油醚部位和正丁醇部位有明显改善AST和ALP活力作用,对肝纤维化大鼠肝功能起到保护作用,且蒙古扁桃正丁醇部位效果更佳。
表 4 蒙古扁桃药材不同极性部位对大鼠血清ALT,AST,ALP的影响Table 4. Effects of different polar parts of Amygdalus mongolica on ALT, AST and ALP in rat serum组别 ALT(U/L) AST(U/L) ALP(U/L) 对照 51.42±9.07 174.28±32.63 90.62±42.25 模型 260.98±80.10** 427.16±104.50** 309.16±62.10** 石油醚部位 186.88±64.24** 311.88±80.14*# 207.9±58.74**## 乙酸乙酯部位 210.98±53.32** 189.92±49.06## 256.40±39.57** 正丁醇部位 101.38±32.66## 188.35±62.19## 195.98±26.42**## 水部位 303.00±72.66** 393.90±66.98** 223.65±28.02**## 水飞蓟素 293.18±78.66** 328.45±120.22** 179.02±39.13**## 2.4 蒙古扁桃药材不同极性部位对肝纤维化大鼠肝组织中HYP的影响
结果见表5,与正常对照组比较,模型组大鼠肝组织中的HYP含量明显升高,差异有显著性(P<0.05),表明采用四氯化碳造模能使大鼠的肝功能受损。与模型组比较,蒙古扁桃石油醚部位、正丁醇部位和水飞蓟素组大鼠肝组织中的HYP含量降低,差异有显著性(P<0.05),降幅分别为36.42%、38.85%和38.17%;蒙古扁桃乙酸乙酯和水部位组大鼠肝组织中的 HYP含量有降低趋势,但无显著性差异(P>0.05)。结果提示蒙古扁桃石油醚和正丁醇部位有明显改善HYP的作用,在实验剂量和时间内恢复HYP含量接近正常对照组水平,且蒙古扁桃正丁醇部位效果更佳。
表 5 蒙古扁桃药材不同极性部位对大鼠肝组织 HYP 的影响Table 5. Effects of different polar parts of Amygdalus mongolica on HYP of liver tissue in rats组别 HYP(ug/g肝湿重) 对照 210.06±16.47 模型 344.41±94.91** 石油醚部位 218.98±31.50## 乙酸乙酯部位 326.94±56.12* 正丁醇部位 210.62±39.34## 水部位 289.37±48.79 水飞蓟素 212.95±22.88*## 2.5 蒙古扁桃药材不同极性部位对肝纤维化大鼠肝脏病理组织学的影响
HE 染色结果如图1所示,正常对照组大鼠的肝组织结构完整清晰,肝细胞大小均匀,未见炎症细胞变性及坏死现象。模型组的大鼠多数小叶结构遭到破坏,结构紊乱,干细胞出现气球样变,肝脏汇管区和小叶间有胶原纤维沉积,说明本实验成功建立了大鼠肝纤维化模型。与模型组比较,蒙古扁桃各部位给药组和水飞蓟素组的大鼠肝组织损伤明显减轻,肝细胞脂肪变性及坏死显著减少,细胞炎症明显减轻。
Masson染色结果如图2所示:正常对照组的大鼠肝小叶结构正常,肝细胞形态规则,仅在汇管区有少量胶原纤维存在。模型组的大鼠肝脏汇管区周围及肝小叶之间有大量粗大的胶原纤维增生,呈宽带状增生的胶原纤维形成条索状纤维分隔,导致正常的肝小叶结构遭到破坏,形成了假小叶。蒙古扁桃各给药组的大鼠肝组织中胶原纤维明显减少,病变减轻,肝小叶结构有不同程度的恢复正常,且以蒙古扁桃石油醚部位和正丁醇部位组恢复较为显著。
2.6 蒙古扁桃药材不同极性部位对血清及肝脏组织 MDA、SOD的影响
结果见表6,与正常对照组比较,模型组的大鼠血清中SOD含量明显下降,血清及组织中MDA含量明显升高,差异有显著性(P<0.05),表明采用四氯化碳造模能使大鼠过氧化,引起肝功能受损。与模型组比较,蒙古扁桃各部位给药组和水飞蓟素组血清SOD含量明显升高,差异有显著性(P<0.05),其中蒙古扁桃石油醚部位增幅为最高33.14%;蒙古扁桃各部位给药组和水飞蓟素组血清及组织中 MDA含量明显降低,差异有显著性(P<0.05),其中蒙古扁桃石油醚部位组血清和组织中MDA的降幅分别高于其他组,降幅分别46.01%和73.23%。蒙明瑜[28]研究结果表明,剑叶耳草乙酸乙酯、正丁醇和水部位能降低肝纤维化小鼠织中MDA活性(P<0.05)和升高SOD活性(P<0.05)。本实验结果提示蒙古扁桃各给药组均有明显抗氧化功能,能改善SOD和MDA的水平,且以蒙古扁桃石油醚部位效果更佳。
表 6 蒙古扁桃药材不同极性部位对大鼠血清及肝组织中 SOD、MDA的影响Table 6. Effects of different polar parts of Amygdalus mongolica on SOD and MDA in serum and liver tissues of rats组别 血清SOD 组织SOD 血清MDA 组织MDA 对照 185.49±13.79 317.36±42.26 5.49±1.69 4.93±1.12 模型 145.05±14.21* 328.89±31.23 8.65±2.94** 8.03±1.19** 石油醚部位 193.12±15.31# 633.96±33.75**## 4.67±1.46## 2.15±0.49**## 乙酸乙酯部位 179.36±15.16# 477.40±83.50**## 5.40±1.47## 2.26±0.32**## 正丁醇部位 182.74±17.68# 448.31±22.88**## 4.69±0.67## 3.60±1.43**## 水部位 187.47±13.74# 403.65±58.51**# 5.68±0.35## 5.77±1.01## 水飞蓟素 185.43±16.70# 346.16±42.90 5.53±0.65## 3.75±1.50*## 2.7 蒙古扁桃不同极性部位对肝纤维化大鼠血清中纤维化指标的影响
结果见表7,与正常对照组比较,模型组血清 HA、PC-Ⅲ和Col-Ⅳ水平升高,差异有显著性(P<0.05),表明采用四氯化碳造模能使大鼠的肝功能受损。与模型组比较,蒙古扁桃各部位提取物组和水飞蓟素组血清中的HA明显降低,差异有显著性(P<0.05),其中水飞蓟素组降幅为最高54.88%;蒙古扁桃石油醚部位、正丁醇部位和水飞蓟素组PC-Ⅲ明显降低,差异有显著性(P<0.05),降幅分别为49.54%、66.67%和11.52%;蒙古扁桃各部位和水飞蓟素组血清中的Col-Ⅳ有降低趋势,但差异无显著性(P>0.05);结果提示蒙古扁桃石油醚部位和正丁醇部位具有明显改善肝纤维化大鼠HA和PC-Ⅲ的作用。
表 7 蒙古扁桃药材不同极性部位对大鼠血清肝纤维化指标 HA、LN、PC-Ⅲ及 Col-Ⅳ的影响Table 7. Effects of different polar parts of Amygdalus mongolica on serum liver fibrosis indexes HA, LN, PC-Ⅲ and Col-Ⅳ in rats组别 HA(ng/mL) LN(ng/mL) PC-Ⅲ(ng/mL) Col-Ⅳ(ng/mL) 对照 170.52±26.52 42.70±4.07 18.31±1.31 18.56±2.28 模型 253.68±78.00** 48.78±3.65 22.83±1.20* 24.84±1.80** 石油醚部位 156.08±49.62## 44.06±2.88 11.52±4.72## 22.84±2.62 乙酸乙酯部位 141.38±14.71## 49.57±10.26 21.31±3.05 22.80±2.91 正丁醇部位 133.45±19.65## 46.45±3.59 7.61±1.06**## 21.11±3.90 水部位 120.63±11.30## 44.94±7.62 20.20±3.94 20.79±1.16 水飞蓟素 114.47±18.79## 44.96±1.62 7.91±1.32**## 22.08±4.31 2.8 蒙古扁桃药材不同极性部位对肝纤维化大鼠TGF-β1/Smad信号传导通路的影响
结果见表8,与正常对照组相比,模型组的肝组织TGF-β1、Smad3 mRNA表达水平显著上调,差异有显著性(P<0.05)。与模型组比较,蒙古扁桃各部位和水飞蓟素组均可抑制肝纤维化大鼠组织中TGF-β1表达水平,差异有显著性(P<0.05),其中蒙古扁桃水部位降幅为最高64.50%;蒙古扁桃石油醚部位、乙酸乙酯、正丁醇部位和水飞蓟素组可抑制肝纤维化大鼠组织中的Smad3 mRNA表达水平,差异有显著性(P<0.05),其中蒙古扁桃石油醚部位降幅为最高41.30%。实验结果表明,蒙古扁桃石油醚部位、乙酸乙酯和正丁醇部位均可以调节TGF-β1和Smad3 mRNA的表达水平,其抗肝纤维化机制可能是通过对TGF-β纤维化通路的调节来起作用的。
表 8 蒙古扁桃不同极性部位对肝纤维化大鼠TGF-β1/Smad信号传导通路的影响Table 8. Effects of different polarity of Amygdalus mongolica on TGF-β1/Smad signaling pathway in hepatic fibrosis rats组别 TGF-β1 Smad3 Smad7 对照 1.00±0.14 1.04±0.38 1.03±0.33 模型 3.48±0.34** 9.25±1.29** 0.96±0.10** 石油醚部位 1.92±0.14**# 5.43±1.26**## 0.32±0.03**## 乙酸乙酯部位 2.13±0.38**## 6.32±1.14**## 0.28±0.02**## 正丁醇部位 2.24±0.32**## 7.12±1.23**## 0.24±0.03**## 水部位 1.20±0.15## 7.68±1.98** 0.26±0.02**## 水飞蓟素 2.43±1.39**## 6.32±1.04**## 0.30±0.05**## 3. 讨论与结论
本论文采用CC14诱导大鼠建立肝纤维化模型,通过组织病理学(HE染色、Mission染色)、HA、HYP、AST等生化指标及TGF-β1、Smad3、Smad7表达水平的变化,综合分析该药材不同极性部位对肝纤维化大鼠干预作用,探讨蒙古扁桃药材抗肝纤维化有效部位并对其作用机制进行了深入研究。四氯化碳是经典的肝毒性试剂,是最早和目前使用最广泛的诱发肝纤维化的毒剂[29],因此本文采用了CC14造模方法。实验结果表明,CCl4致大鼠纤维化模型组血清中ALT、AST、ALP活性显著升高,血清中SOD含量显著下降,血清及组织中MDA含量显著升高,致大鼠过氧化,引起肝功能受损。给予蒙古扁桃不同极性部位干预后,蒙古扁桃正丁醇部位显著降低ALT、AST、和ALP活性,蒙古扁桃石油醚部位显著降低AST和ALP活性,说明蒙古扁桃石油醚部位和正丁醇部位有明显改善AST和ALP的作用,对肝纤维化大鼠肝功能起到保护作用;蒙古扁桃各极性部位均能显著提高肝纤维化大鼠血清中的SOD含量,并显著降低血清和组织中的MDA含量,提示蒙古扁桃各极性部位有清除活性氧及抗脂质过氧化作用,能够拮抗CCl4的毒性。据文献报道,CC14可直接溶解肝细胞膜,引起脂质过氧化反应,导致肝细胞损伤[30]。当肝细胞受损时,主要存在于肝细胞中的ALT、AST、ALP会被释放进入血液,表现为血清ALT、AST、ALP水平升高[31],因此血清中ALT、AST、ALP水平可反映肝脏受损的程度[32]。本实验结果也证明了大鼠模型组血清中的ALT、AST、ALP水平显著升高,而蒙古扁桃石油醚部位和正丁醇部位有明显调节AST和ALP的水平,对肝纤维化大鼠肝功能起到了保护作用。
肝纤维化患者的细胞外基质大量生成并沉积于肝脏,HA、LN、PC-Ⅲ、Col-Ⅳ是肝脏纤维组织主要基质成分,其血清水平可反映肝纤维化严重程度[33],是反映肝纤维化的灵敏指标[31],羟脯氨酸(HYP)是胶原蛋白中特征性的氨基酸成分,肝组织HYP含量也可反映纤维化的程度[34]。因此,本实验着重测定上述肝纤维化四项指标和肝组织中的HYP含量,研究发现,模型组大鼠血清中的HA、PC-Ⅲ、Col-Ⅳ含量和肝组织HYP含量显著升高,表明引起大鼠肝组织损伤及肝纤维化。给予蒙古扁桃不同极性部位干预后,蒙古扁桃各部位提取物血清中的HA含量显著降低,蒙古扁桃石油醚部位和正丁醇部位PC-Ⅲ含量显著降低,起到减轻大鼠肝细胞坏死和纤维组织沉积程度作用,说明蒙古扁桃药材石油醚和正丁醇部位是抑制 CCl4诱导大鼠肝纤维化的优选有效部位。
为了进一步深入探索蒙古扁桃药材抗纤维化的作用机制,本实验通过研究实验样品中TGF-β1、Smad3、Smad7等蛋白的表达水平,从调节TGF-β1/Smad信号通路的角度来研究其抗纤维化机制。目前公认的肝纤维化信号转导通路中TGF-β1/Smad信号传导通路是研究比较多、是比较深入的一条经典肝纤维化通路[29]。TGF-β共有3种:TGF-β1、TGF-β2、TGF-β3,其中肝脏中含量最高且具有生物活性的是TGF-β1,与受体结合后活化并将信号向细胞内转导[35-36]。而TGF-β1作为目前已发现的最强促肝纤维化因子,可通过Smad蛋白转导信号进而活化肝星状细胞(HSC,Hepatic stellate cell),并促使其大量分泌胞外基质,该过程是肝纤维化发生、进展,甚至肝硬化形成的核心,故抑制TGF-β1/Smad 信号通路是缓解肝纤维化的关键[37]。由此可知,TGF-β1是HSC活化的重要中间体,是最重要的前体。据文献报道,Schnabl等向敲除Smad3基因的鼠胃内注射CCl4,发现该敲除鼠的α1胶原蛋白增加,但是HSC内不能形成TGF-β诱导的Smad与DNA结合形成复合物,可见Smad3在HSC的活化和胶原蛋白合成中起到关键作用[35]。文献报道,通过抑制TGF-β/Smad信号通路可以明显减轻肝纤维化的症状[38-40]。本实验研究发现,在CCl4诱导的大鼠肝纤维化体内,TGF-β1和Smad3的表达明显上调,表明肝细胞中TGF-β1/Smad信号通路被激活,从而促进肝纤维化进程,而给予蒙古扁桃药材干预后,蒙古扁桃石油醚和正丁醇部位组TGF-β1、Smad3的表达明显下调,说明蒙古扁桃可以通过抑制Smad3的磷酸化水平和TGF-β1的活性,从而调控肝星状细胞的活性,起到抑制肝纤维化作用,其机制可能是通过对TGF-β纤维化通路的调节来起到抗纤维化作用。
综上所述,蒙古扁桃药材石油醚、正丁醇提取物可以明显改善肝纤维化大鼠的组织病理学变化,对AST、ALP、SOD、MDA等指标和纤维化四项指标HA、PC-Ⅲ的水平及HYP水平有明显改善作用,并对TGF-β1、Smad3水平有显著改善作用,说明该药材具有明确地抗肝纤维化作用。蒙古扁桃药材石油醚、正丁醇提取物是保护肝纤维化的优选活性部位,其抗纤维化作用机制可能与调节胶原合成异常及抑制TGF-β1/Smad信号通路作用有关。
-
表 1 PCR引物序列
Table 1 PCR primer sequence
基因名称 上游引物(5′-3′) 下游引物(5′-3′) RAT Actin CCCATCTATGAGGGTTACGC TTTAATGTCACGCACGATTTC TGF-β1 CGCAACAACGCAATCTATG ACCAAGGTAACGCCAGGA Smad3 CCAGTGCTACCTCCAGTGTT CTGGTGGTCGCTAGTTTCTC Smad7 GGCTTTCAGATTCCCAACTTC CGCCATCCACTTCCCTTGT 表 2 蒙古扁桃药材不同极性部位对大鼠体质量的影响
Table 2 Effects of different polar parts of Amygdalus mongolica on rat body quality
表 3 蒙古扁桃药材不同极性部位对大鼠肝指数、脾指数的影响
Table 3 Effects of different polar parts of Amygdalus mongolica on rat liver index and spleen index
组别 脏器指数(%) 肝指数 脾指数 对照 2.46±0.08 0.16±0.01 模型 4.14±0.55** 0.19±0.03* 石油醚部位 3.68±0.49**# 0.18±0.02 乙酸乙酯部位 3.83±0.16** 0.17±0.02 正丁醇部位 3.95±0.43** 0.18±0.02 水部位 3.54±0.27**## 0.17±0.01 水飞蓟素 4.07±0.30** 0.17±0.01 表 4 蒙古扁桃药材不同极性部位对大鼠血清ALT,AST,ALP的影响
Table 4 Effects of different polar parts of Amygdalus mongolica on ALT, AST and ALP in rat serum
组别 ALT(U/L) AST(U/L) ALP(U/L) 对照 51.42±9.07 174.28±32.63 90.62±42.25 模型 260.98±80.10** 427.16±104.50** 309.16±62.10** 石油醚部位 186.88±64.24** 311.88±80.14*# 207.9±58.74**## 乙酸乙酯部位 210.98±53.32** 189.92±49.06## 256.40±39.57** 正丁醇部位 101.38±32.66## 188.35±62.19## 195.98±26.42**## 水部位 303.00±72.66** 393.90±66.98** 223.65±28.02**## 水飞蓟素 293.18±78.66** 328.45±120.22** 179.02±39.13**## 表 5 蒙古扁桃药材不同极性部位对大鼠肝组织 HYP 的影响
Table 5 Effects of different polar parts of Amygdalus mongolica on HYP of liver tissue in rats
组别 HYP(ug/g肝湿重) 对照 210.06±16.47 模型 344.41±94.91** 石油醚部位 218.98±31.50## 乙酸乙酯部位 326.94±56.12* 正丁醇部位 210.62±39.34## 水部位 289.37±48.79 水飞蓟素 212.95±22.88*## 表 6 蒙古扁桃药材不同极性部位对大鼠血清及肝组织中 SOD、MDA的影响
Table 6 Effects of different polar parts of Amygdalus mongolica on SOD and MDA in serum and liver tissues of rats
组别 血清SOD 组织SOD 血清MDA 组织MDA 对照 185.49±13.79 317.36±42.26 5.49±1.69 4.93±1.12 模型 145.05±14.21* 328.89±31.23 8.65±2.94** 8.03±1.19** 石油醚部位 193.12±15.31# 633.96±33.75**## 4.67±1.46## 2.15±0.49**## 乙酸乙酯部位 179.36±15.16# 477.40±83.50**## 5.40±1.47## 2.26±0.32**## 正丁醇部位 182.74±17.68# 448.31±22.88**## 4.69±0.67## 3.60±1.43**## 水部位 187.47±13.74# 403.65±58.51**# 5.68±0.35## 5.77±1.01## 水飞蓟素 185.43±16.70# 346.16±42.90 5.53±0.65## 3.75±1.50*## 表 7 蒙古扁桃药材不同极性部位对大鼠血清肝纤维化指标 HA、LN、PC-Ⅲ及 Col-Ⅳ的影响
Table 7 Effects of different polar parts of Amygdalus mongolica on serum liver fibrosis indexes HA, LN, PC-Ⅲ and Col-Ⅳ in rats
组别 HA(ng/mL) LN(ng/mL) PC-Ⅲ(ng/mL) Col-Ⅳ(ng/mL) 对照 170.52±26.52 42.70±4.07 18.31±1.31 18.56±2.28 模型 253.68±78.00** 48.78±3.65 22.83±1.20* 24.84±1.80** 石油醚部位 156.08±49.62## 44.06±2.88 11.52±4.72## 22.84±2.62 乙酸乙酯部位 141.38±14.71## 49.57±10.26 21.31±3.05 22.80±2.91 正丁醇部位 133.45±19.65## 46.45±3.59 7.61±1.06**## 21.11±3.90 水部位 120.63±11.30## 44.94±7.62 20.20±3.94 20.79±1.16 水飞蓟素 114.47±18.79## 44.96±1.62 7.91±1.32**## 22.08±4.31 表 8 蒙古扁桃不同极性部位对肝纤维化大鼠TGF-β1/Smad信号传导通路的影响
Table 8 Effects of different polarity of Amygdalus mongolica on TGF-β1/Smad signaling pathway in hepatic fibrosis rats
组别 TGF-β1 Smad3 Smad7 对照 1.00±0.14 1.04±0.38 1.03±0.33 模型 3.48±0.34** 9.25±1.29** 0.96±0.10** 石油醚部位 1.92±0.14**# 5.43±1.26**## 0.32±0.03**## 乙酸乙酯部位 2.13±0.38**## 6.32±1.14**## 0.28±0.02**## 正丁醇部位 2.24±0.32**## 7.12±1.23**## 0.24±0.03**## 水部位 1.20±0.15## 7.68±1.98** 0.26±0.02**## 水飞蓟素 2.43±1.39**## 6.32±1.04**## 0.30±0.05**## -
[1] 夏海珊, 陈少茹, 钟月春, 等. 肝纤维化的发病机制和药物治疗现况[J]. 中国医药导报,2014,11(18):162−165, 168. [2] 江远, 熊丽. 莪术治疗肝病的研究进展[J]. 中西医结合肝病杂志,2005(2):127−129. doi: 10.3969/j.issn.1005-0264.2005.02.032 [3] Strader D B, Wright T, Thomas D L, et al. Diagnosis, management, and treatment of hepatitis C[J]. Hepatology,2004,39(4):1147−1171. doi: 10.1002/hep.20119
[4] 张可锋, 黄思茂, 陈毅飞, 等. 七味净肝灵对二甲基亚硝胺诱导肝纤维化大鼠的保护作用及其作用机制[J]. 中药材,2018,41(2):464−467. [5] Zhang Y, Miao H, Yan H, et al. Hepatoprotective effect of forsythiae fructus water extract against carbon tetrachloride-induced liver fibrosis in mice[J]. Journal of Ethnopharmacology,2018,23(218):27−34.
[6] 蒋征奎, 王学方. 茯苓皮水提物对四氯化碳诱导大鼠肝纤维化的改善作用[J]. 中国药房,2017,28(22):3065−3068. doi: 10.6039/j.issn.1001-0408.2017.22.11 [7] 吴鹏, 王亚东, 方颖, 等. 肝豆灵抑制Notch信号通路干预铜负荷致肝纤维化大鼠肝脏上皮-间质转化[J]. 安徽中医药大学学报,2018,37(6):79−84. doi: 10.3969/j.issn.2095-7246.2018.06.023 [8] 赵一之. 蒙古扁桃的植物区系地理分布研究[J]. 内蒙古大学学报(自然科学版),1995,26(6):713−715. [9] 马毓泉. 内蒙古植物志(第三卷)[M]. 呼和浩特: 内蒙古人民出版社, 1989, 4(2): 519−522. [10] 斯琴巴特尔. 蒙古扁桃[J]. 生物学通报,2003,38(8):23−24. doi: 10.3969/j.issn.0006-3193.2003.08.009 [11] 王斌. 黄河三角洲滨海湿地药用耐盐植物蒙古鸦葱和柽柳化学成分及生物活性研究[D]. 青岛: 中国海洋大学, 2007. [12] 郝海梅, 石松利, 周红兵, 等. 蒙古扁桃油对肾纤维化大鼠的保护作用研究[J]. 中药药理与临床,2020,36(5):105−109. [13] 尚立芝, 王付, 苗小玲, 等. 四逆散加味抗肝纤维化的作用及机制研究[J]. 中国实验方剂学杂志,2013,19(5):207−211. [14] 方海涛, 李俊兰, 王黎元. 珍稀濒危植物蒙古扁桃研究进展[J]. 阴山学刊(自然科学版),2004,18(2):16−18. [15] Zheng Q N, Wang J, Zhou H B, et al. Effectiveness of Amygdalus mongolica oil in hyperlipidemic rats and underlying antioxidant processes[J]. Journal of Toxicology and Environmental Health A,2017,80(22):1193− 1198. doi: 10.1080/15287394.2017.1367124
[16] 郑倩男, 冯长梅, 吴桐, 等. 蒙古扁桃油对高脂血症大鼠肝脏保护作用[J]. 食品工业科技,2018,39(20):286−292. [17] 郑倩男, 石松利, 周红兵, 等. 蒙古扁桃石油醚提取物对高脂血症大鼠血脂水平、肝功能及脂质过氧化的影响[J]. 中药药理与临床,2016,32(4):67−70. [18] 贾小叶, 高晨, 刘庆, 等. 蒙古扁桃药材抗大鼠肾纤维化有效提取物部位的筛选[J]. 食品工业科技,2020,41(9):297−302, 308. [19] 权博文, 吴桐, 刘庆, 等. 蒙古扁桃种仁不同极性部位对博来霉素致大鼠肺纤维化的保护作用[J]. 食品工业科技,2020,41(22):305−309. [20] 吴培赛, 石松利, 周红兵, 等. 蒙古扁桃药材不同提取物对高脂血症大鼠血脂和肝功能的影响[J]. 中国实验方剂学志,2015,21(21):113−117. [21] 金俊杰, 钟鸣, 余胜民, 等. 穿破石水提取物对四氯化碳致大鼠肝纤维化的治疗作用[J]. 中国实验方剂学杂志,2012,18(22):258−262. [22] 任美萍, 刘艳, 李华, 等. 楤木皂苷抗四氯化碳致大鼠肝纤维化作用[J]. 沈阳药科大学学报,2013,30(12):958−960, 966. [23] 赵松峰, 阚全程. 六味五灵片对四氯化碳致大鼠肝纤维化的保护作用[J]. 中国药理学通报,2011,27(6):872−875. doi: 10.3969/j.issn.1001-1978.2011.06.031 [24] 刘鸣昊. 芪珠方对肝纤维化大鼠TGF-β1/Smad信号传导通路的影响[D]. 南京: 南京中医药大学, 2013. [25] 张继红, 邓为, 石孟琼, 等. 珠子参皂苷对四氯化碳致大鼠肝纤维化的保护作用[J]. 中药药理与临床,2014,30(5):73−78. [26] 郭羽轩, 董惠娟, 刘涛, 等. 睡莲花总黄酮对四氯化碳诱导大鼠肝纤维化的防治作用[J]. 中草药,2020,51(19):4983−4990. doi: 10.7501/j.issn.0253-2670.2020.19.017 [27] 陈淳. 红背叶根醇提物的药效学及化学成分的初步研究[D]. 广州: 南方医科大学, 2015. [28] 蒙明瑜. 剑叶耳草活性成分的筛选及其抗肝炎作用的实验研究[D]. 南宁: 广西医科大学, 2012. [29] 冯欣. 藏药波棱瓜子抗肝纤维化作用及机理研究[D]. 北京: 北京中医药大学, 2018. [30] Doustimotlagh A H, Dehpour A R, Nourbakhsh M, et al. Alteration inmembrane protein, antioxidant status and hexokinase activity inerythrocytes of CCl4-induced cirrhotic rats[J]. Acta Med Iran,2014,52(11):795−803.
[31] 吴晓东, 张峰, 梁瑞峰. 大黄素与丹参素合用对四氯化碳诱导大鼠肝纤维化的保护作用[J]. 天津中医药,2018,35(2):143−146. [32] 董红筠, 王敬, 李萍, 等. 软肝化纤丸抗慢性乙型肝炎肝纤维化60例临床观察[J]. 天津中医药,2013,30(5):266−268. [33] Wu J, Pan L, Jin X, et al. The role of oxymatrine in regulating TGF-β1 in rats with hepatic fibrosis[J]. Acta Cir Bras,2018,33(3):207−215. doi: 10.1590/s0102-865020180030000002
[34] 聂珍贵, 王姝, 王世全, 等. 和肝汤对四氯化碳致小鼠肝纤维化的防治作用[J]. 时珍国医国药,2018,29(8):1828−1830. [35] 樊晓明, 俞富军. 肝纤维化前沿[M]. 上海: 复旦大学出版社, 2015. [36] Nakamura T, Sakata R, Ueno T, et al. Inhibition of transforming growth factor β prevents progression of liver fibrosis and enhances hepatocyte regeneration in dimethyl nitrosamine-treated rats[J]. Hepatology,2000,32(2):247−255. doi: 10.1053/jhep.2000.9109
[37] 李书香, 王爱民. 肝纤维化与转化生长因子-β1关系的研究进展[J]. 中华实验外科杂志,2017,34(6):1079−1080. doi: 10.3760/cma.j.issn.1001-9030.2017.06.063 [38] Inagaki Y, Okazaki I. Emerging insights into transforming growth factor beta smad signal in hepatic fibrogenesis[J]. Gut,2007,56(2):284−292. doi: 10.1136/gut.2005.088690
[39] Moustakas A, Souchelnytskyi S, Heldin C H. Smad regulation in TGF-beta signal transduction[J]. Journal of Cell Science,2001,114(24):4359−4369. doi: 10.1242/jcs.114.24.4359
[40] Derynck R, Zhang Y E. Smad-department and Smad-independent pathway in TGF-beta family signaling[J]. Nature,2003,425(6958):577−584. doi: 10.1038/nature02006





 下载:
下载:
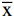


 下载:
下载:
