Relationship Among Changes of μ-calpain, pH and Skeleton Protein and Water Holding Capacity of Post-mortem Pork
-
摘要: 为研究宰后猪肉中pH、μ-calpain、肌间线蛋白(desmin)和整联蛋白(integrin)变化与持水性的关系,将20条不同汁液流失的猪背最长肌样品按汁液流失率的高低,分成高汁液流失组(High drip loss;H组,drip loss≥5.01%,n=10)和低汁液流失组(Low drip loss;L组,drip loss≤4.00%,n=10)。分别于宰后45 min,3、9、12和24 h测定所选背最长肌pH、μ-calpain活性和desmin、integrin的表达量。结果表明:H组的汁液流失率极显著高于L组(P < 0.01),3~24 h的desmin表达量均高于L组(P < 0.05),45 min、12 h和24 h的μ-calpain活性低于L组(P < 0.05),integrin(45 min、3 h和12 h)的表达量和pH(45 min~12 h)均低于L组(P < 0.05)。desmin的表达量与汁液流失率呈正相关,而pH、μ-calpain活性和integrin的表达量与汁液流失率均呈负相关。pH、μ-calpain活性、desmin和integrin的表达量分别解释了汁液流失变异的78.1%、42.4%、70.3%和71.7%。上述结果表明:pH、μ-calpain、desmin和integrin都会对汁液流失产生影响;pH是对汁液流失率的影响最大的单变量。Abstract: To investigate the relationship between pH, μ-calpain, desmin and integrin changes and water holding capacity in postmortem pork, 20 samples of longissimus dorsi with different drip loss were divided into High drip loss group(H-group drip loss≥5.01%, n = 10) and Low drip loss group (L-group drip loss≤4.00%, n = 10). pH, μ-calpain activity and expression levels of desmin and integrin were determined in 45 min, 3, 9, 12 and 24 h after slaughter. The results showed that the drip loss of H-group was significantly higher than L-group (P<0.01), desmin expression level (3~24 h) was higher than that of L group (P<0.05), the activity of μ-calpain (12 h and 24 h) was lower than that of L group (P<0.05), integrin expression level (45 min, 3 h and 12 h) and pH (45 min~12 h) was lower than that of L group. The expression of desmin was positively correlated with the drip loss, while the expression of integrin, the activity of μ-calpain and pH were negatively correlated with the driploss.pH, the express level of μ-calpain autolysis, desmin and integrin explained 78.1%, 42.4%, 70.3% and 71.7% of the variation in drip loss, respectively .The results showed that pH, μ-calpain, desmin and integrin all had an effect on drip loss, pH is the single variable that has the greatest influence on drip loss.
-
持水性(water-holding capacity,WHC)是肉类生产行业和消费者共同关注的问题,常用汁液流失率高低(drip loss)衡量持水性[1-2]。汁液流失率的大小不仅受pH影响,也受钙激活酶(calpains)活性[3]和关键细胞骨架蛋白降解程度的影响[4]。
研究表明,宰后猪肉的pH下降会抑制μ-calpain的自溶和骨架蛋白降解[5],从而导致较高的汁液流失[3]。μ-calpain是肌肉向食用肉转化过程中重要的钙激活酶,宰后μ-calpain被激活,其80 kDa亚基经78 kDa亚基形式降解为76 kDa的亚基[6]。常用76 kDa亚基表达量来衡量μ-calpain的活性,76 kDa亚基的表达量越高,酶的自溶程度和活性越高[7],降解关键骨架蛋白——肌间线蛋白(desmin)的能力就越强。desmin缠绕在肌原纤维的Z盘上并与肌细胞膜直接相连,是维持肌纤维网状结构有序性和肌细胞稳定性的重要骨架蛋白[8]。整联蛋白(integrin)是横贯于细胞膜内外的粘附性蛋白[9],在维持细胞形态、细胞膜与细胞体彼此附着中起关键作用[10-11]。有报道显示,宰后肌肉中μ-calpain活性[6]、desmin和integrin的表达量均会影响持水性[12]。Bee等[5]观察到μ-calpain 80、78 kDa的亚基表达量均与汁液流失率呈显著正相关,76 kDa与汁液流失呈显著负相关,而张冬怡[13]等报道78 kDa亚基的表达量与汁液流失率呈显著负相关,80、76 kDa亚基表达量与汁液流失无显著性相关。Zuo等[14]发现牦牛宰后高汁液流失组中desmin表达量显著高于低汁液流失组,Zhang等[15]在鹅肉中也发现desmin降解有利于提高持水性,但Schafer等[16]认为desmin的降解与汁液流失率无关。Qian等[17]在观察猪肉持水能力实验中发现integrin降解量大持水能力高。但Lawson[12]认为高汁液流失组中,integrin降解量大。可见,μ-calpain、desmin和integrin与持水性的关系还存在争议。目前,国内外学者[18-19]主要通过相关性分析来解释pH、μ-calpain及骨架蛋白等自变量与持水性的关系,并不能完全反映出各变量对持水性的相对重要性。
偏最小二乘回归分析(Partial least squares regression analysis,PLSR)可排除不显著变量,筛选出对因变量解释能力强的自变量[20]。因此,本研究运用PLSR和相关性分析对μ-calpain、desmin、integrin和pH变化与持水性之间的关系进行分析,为宰后肉类汁液流失率变化提供一定的理论依据。
1. 材料与方法
1.1 材料与仪器
猪肉样品 在曲靖市东恒经贸集团食品有限公司屠宰场选取同一批次平均体重在105 kg左右的三元杂交商品肉猪(大河乌猪×夏约克×长白猪),依照生猪屠宰规范(GB/T17236-2008)进行宰杀。取右侧第七腰椎段至最后腰椎段背最长肌用塑封袋包裹。依据背最长肌45 min时的pH和肉色,分别选取疑似苍白发软表面有汁液渗出的肉(Pale,soft exudative,PSE)样品和正常肉的样品各10条,依次编号,放置于4 ℃恒温冷库内,分别于各时间点(45 min,3、9、12、24 h)测定pH和温度。将各时间点样品存于−30 ℃冷冻库保存,后转移置实验室−80 ℃冰箱中冻藏保存,用于Western blotting蛋白定量分析;脱脂奶粉 武汉博士德生物;牛血清蛋白 分析纯,北京索莱宝科技术公司;十二烷基磺酸钠(Sodium Dodecylsulfonate,SDS)(分析纯)、甘油(分析纯)、吐温-20(分析纯)、N',N',N',N'-四甲基乙二胺(N',N',N',N'-tetramethylethylenediamine,TEMED)(分析纯)、β-巯基乙醇(分析纯)、N',N'-双-亚甲叉双丙烯酰胺(超级纯)、乙二胺四乙酸(分析纯)、丙烯酰胺(超级纯) Amresco公司;超特敏发光试剂盒碧云天生物有限公司;0.45 μm疏水性转印膜(poly vinylidene fluoride,PVDF)、desmin一抗(Anti-desmin,No.MAB3430)、integrin一抗(Anti-integrin β1D, No.MAB1900)、二抗(Goat anti-Mouse IgG (H+L) Antibody, No.AP181P) Millpore公司;μ-calpain一抗(Anti-μ-calpain,No.MA3940) Thermo Scientific公司。
CR-10Plus便携式色差仪 美能达;Bio Rad Power通用垂直电泳仪电源、转印槽、ChemiDoc化学成像仪系统 伯乐生命医学有限公司;HI9025C便携式pH计 意大利哈他;HBMB-96PLUS紫外光酶标仪 北京北方浩博科学仪器有限公司。
1.2 实验方法
1.2.1 pH、肉色及汁液流率的测定
在4 ℃的冷藏环境中,将矫正好的便携式pH计探头插入待检测样品的内部,测定宰后45 min,3、9、12和24 h的背最长肌的pH。将肉片平摊于干净的桌面,用色差仪测定宰后45 min和24 h亮度值L*、红度值a*和黄度值b*。
参照Honikel等[21]的方法测定汁液流失,具体操作如下:将准备好的样品切成2.5 cm厚的肉片,用精度为万分之一的天平称重,记做W1,称重后用细铁丝穿过肉片进行固定,使肌纤维始终保持垂直向下,放置在清洁干燥的聚乙烯薄膜袋中(肉片与袋壁要保持距离,不能接触袋壁),扎紧袋口后吊挂于4 ℃冷库中,24 h后取出肉片再次称重,记做W2,依据公式计算汁液流失率。
汁液流失率(%)=W1−W2W1×100 1.2.2 肌肉中μ-calpain、desmin和integrin表达量测定
全肌肉蛋白提取:参照Lonergan等[22]的方法,称取切成碎末状的样品0.8 g,将其置于装有10 mL磷酸钠全肌肉蛋白提取液(2% (w/v) SDS;pH7.0)的离心管内进行15 s的低温匀浆(6500 r/min)后室温离心20 min取上清液并用酶标仪测定浓度。使用双蒸水将所有样品测得蛋白浓度,统一调至6.4 mg/mL。将调整好浓度的样品、上样缓冲液(25 mmol/L Tris-HC1,3 mmol/L 乙二胺四乙酸,3% (w/v) SDS,30% (v/v) 甘油,0.001% (w/v) 溴酚蓝,pH8.0)和β-巯基乙醇按体积比10:5:1混合得到全肌肉蛋白溶液。用50 ℃水浴锅将全肌肉蛋白溶液加热20 min至变性,待冷却至室温将其分装冻存于−80 ℃冰箱中备用。
SDS-PAGE凝胶制备:参照Zhao[3]等的方法并做修改。μ-calpain使用8%的分离胶(丙烯酰胺:N',N'-双交叉甲基丙烯酰胺=1:100, 1% (w/v) SDS,0.1% (v/v) TEMED,0.05% (w/v) APS) 和125 mmol/L Tris·HCl,pH8.8。desmin和integrin均使用10%的分离胶(丙烯酰胺:N,N'-双交叉甲基丙烯酰胺=1:100,1% (w/v) SDS,0.1% (v/v) TEMED,0.05% (w/v) APS和500 mmol/L Tris· HCl pH8.8)。μ-calpain、desmin和integrin浓缩胶统一使用5%的浓缩凝胶(丙烯酰胺:N',N'-双-亚甲基丙烯酰胺=100:1,1% (w/v) SDS,0.1% (v/v) TEMED,0.1% (w/v) APS和 0.125 mmol/L Tris·HCl pH6.8)。凝胶完成后,用保鲜膜包裹存放于4 ℃冰箱备用。
电泳及转膜:将固定好凝胶板放入电泳缓冲液,从左至右依次向泳道加入预染蛋白Marker 7.5 μL、内部标准蛋白(选取本次实验宰后45 min,L组汁液流失率最低的样品制备)和不同样品在各时间点(依次为宰后45 min,3、9、12、24 h)的全肌肉蛋白样品。μ-calpain和desmin的上样量均为80 μg,integrin为120 μg。设定浓缩电压60 V,50 min,分离电压100 V,1.5 h,进行电泳。电泳结束后采用湿转法在200 mA下进行为时1.5 h的转膜操作,全程在冰浴中进行。
Western blotting:转印完成后,将转印膜放置在用TBST溶液(25 mmol / L Tris pH7.0,0.1%(w/v)吐温−20,80 mmol / L NaCl)配制的5%的脱脂奶粉封闭液中,室温封闭2 h。将封闭好的蛋白膜分别置于对应的一抗(用含3%牛血清白蛋白的TBST稀释)中4 ℃孵育过夜。一抗孵育过夜后,将蛋白膜置于TBST冲洗3×10 min,洗去未结合的抗体,后转至二抗(用含3%牛血清白蛋白的TBST稀释)中室温孵育2 h。二抗孵育完成,后用TBST冲洗3×10 min,洗去未结合的抗体,完成后将膜放置在ECL化学发光试剂下显影并在凝胶成像系统扫描(BIO RAD Chemical XRS++)中曝光,得到蛋白灰度值图片。用Image J图像分析软件测定样品各个时间点目标蛋白的灰度值,按照Bee等[5]的方法用各个时间的相对灰度值比上标准蛋白样品的灰度值,得到目标蛋白的相对灰度值,用目标蛋白的相对灰度值来表示肌肉中目标蛋白表达量。其中,μ-calpain的一抗释比例为1:2000;desmin的一抗释比例为1:1000;integrin的一抗释比例为1:800。μ-calpain和desmin的二抗释比例均为1:5000,integrin的二抗释比例为1:8000。
1.3 数据分析
采用SPSS 23.0进行系统聚类分析、平均值和标准误计算、独立样本t检验、单因素ANOVA分析和多重比较。由于宰后各时间点的pH不成正态分布,因此与pH有关的相关性分析均采用Spearman相关系分析[23]。鉴于PLSR适用于样本量小且变量可以不符合正太分布的数据[24-25],故使用Unscrambler 10.4软件进行PLS1回归分析。使用Microsoft office 2019和Origin 2018进行图片及表格绘制。
2. 结果与分析
2.1 汁液流失率及肉色
依据宰后24 h的汁液流失率高低,对样品进行聚类,当欧氏距离增至10时,可以将样品分为高汁液流失组(High drip loss;H组,drip loss ≥ 5.01%,n=10)和低汁液流失组(Low drip loss;L组,drip loss ≤ 4.00%,n=10)(图1)。H组平均汁液流失率是L组的2.625倍(表1),极显著高于L组(P<0.01)。H组宰后45 min的L*极显著高于L组(P<0.01),但两组间的L*、a*、b*值在宰后24 h时均无显著差异(P>0.05)。
表 1 高低汁液流失率组肉样的肉质指标Table 1. Meat quality index of L-group and H-group指标 H组 L组 L*45 min 52.42 ± 1.71 41.27 ± 2.66** a*45 min 8.03 ± 0.41 7.27 ± 0.84 b*45 min 7.17 ± 0.34 6.43 ± 0.56 L*24 h 45.97 ± 2.57 40.07 ± 2.62 a*24 h 8.02 ± 0.77 6.81 ± 0.87 b*24 h 5.25 ± 0.57 4.18 ± 0.36 汁液流失率(%) 5.46 ± 0.13 2.08 ± 0.39** 注:表中数值为平均值 ± SEM,**表示在同一时间点内组间差异极显著(P<0.01)。 2.2 pH和μ-calpain、desmin、integrin的变化
图2为宰后μ-calpain、desmin和integrin的Western blot的条带图。由图2A可以看出宰后各时间点H组的desmin蛋白条带均比L组粗、颜色深;在45 min~12 h时,H组的desmin蛋白条带随着宰后时间的增加几乎没有变化,在24 h时出现明显降解,而L组的desmin条带随着宰后时间的延长而逐渐变浅变细。如图2B所示,在宰后各时间点,L组的integrin蛋白条带明显比H组粗、颜色深,且H组和L组的integrin条带均会随着宰后时间的延长逐渐变浅、变小。μ-calpain的Western blot蛋白条带如图2C所示,宰后各时间点H组的80 kDa和78 kDa亚基比L组条带颜色深,76 kDa条带比L组颜色浅。
如图3A所示,宰后45 min~12 h, 两组的pH均呈直线下降,12~24 h有所回升。宰后45 min~12 h时H组的pH都显著低于L组(P<0.05),表明汁液流失率高的样品pH低。随时间延长,desmin和integrin出现不同程度的降解。由图3B所示,相对于宰后9 h,H组desmin在宰后24 h出现显著降解(P < 0.05)但L组在12 h就出现显著降解(P < 0.05)。3~24 h时H组desmin的表达量显著高于L组(P<0.05),说明在desmin表达量大的组内汁液流失率高,持水性差;45 min、3 h和24 h时H组integrin的表达量显著低于L组(P<0.05)(图3C),表明L组细胞内integrin表达量大,肌肉汁液流失率低,持水能力强。宰后μ-calpain发生自溶,其80 kDa的亚基经78 kDa亚基形式降解为76 kDa,76 kDa亚基表达量越高,μ-calpain的活性就越高。如图3的D、E、F所示,宰后各时间点,两组的80 kDa亚基表达量差异不显著(P > 0.05);45 min时H组78 kDa亚基表达量显著大于L组(P < 0.05);12~24 h时,L组的76 kDa亚基表达量极显著大于H组(P < 0.01);由此可知宰后12 h和24 h时H组的μ-calpain活性低于L组。
![]() 图 3 宰后不同汁液流失组pH(A)、desmin(B)、integrin(C)、μ-calpain 80 kDa(D)、78 kDa(E)、76kDa(F)的表达量变化注:**表示同一时间点内组间差异极显著(P < 0.01);*表示同一时间点内组间差异显著(P<0.05);同组内不同时间点小写字母不同代表差异显著(P<0.05)。Figure 3. Changes in pH (A),desmin (B),integrin (C) and μ-calpain 80 kDa (D), 78 kDa (E), 76 kDa (F) expression levels in different drip loss groups post-mortem
图 3 宰后不同汁液流失组pH(A)、desmin(B)、integrin(C)、μ-calpain 80 kDa(D)、78 kDa(E)、76kDa(F)的表达量变化注:**表示同一时间点内组间差异极显著(P < 0.01);*表示同一时间点内组间差异显著(P<0.05);同组内不同时间点小写字母不同代表差异显著(P<0.05)。Figure 3. Changes in pH (A),desmin (B),integrin (C) and μ-calpain 80 kDa (D), 78 kDa (E), 76 kDa (F) expression levels in different drip loss groups post-mortem2.3 相关性分析
如表2所示,在各个时间点,desmin的表达量与pH呈负相关但不显著(P>0.05)。integrin与pH整体呈正相关,其中在45 min时integrin的表达量与宰后9 h和12 h的pH呈极显著正相关(P < 0.01);在12 h时,与宰后9 h和24 h的pH呈显著正相关(P < 0.05);在24 h时,与宰后9 h和12 h的pH呈显著正相关(P < 0.05)。μ-calpain80、78 kDa亚基的表达量与pH整体呈负相关,而76 kDa与之相反。在45 min时μ-calpain 76 kDa亚基的表达量与宰后9 h的pH呈显著正相关(P < 0.05);在3 h时,与宰后12 h的pH呈显著正相关(P < 0.05);在9 h时,与宰后12 h的pH呈显著正相关(P < 0.05)。μ-calpain 76 kDa亚基表达量越高,μ-calpain的活性就越高。因μ-calpain76 kDa表达量整体与pH呈正相关,故μ-calpain活性整体与pH呈正相关。
表 2 μ-calpain、desmin和integrin与pH和汁液流失率的相关性分析Table 2. Correlation analysis of μ-calpain, desmin and integrin with pH and drip loss指标 时间点 pH45 min pH3 h pH9 h pH12 h pH24 h 汁液流失率 desmin 45 min −0.144 −0.062 −0.281 −0.061 0.143 0.221 3 h −0.087 −0.155 0.072 −0.257 −0.399 0.342 9 h −0.347 −0.123 −0.088 −0.012 −0.238 0.298 12 h 0.009 0.084 −0.033 0.049 0.072 0.200 24 h −0.294 −0.338 −0.206 −0.219 −0.050 0.690** integrin 45 min 0.420 0.357 0.634** 0.603** 0.398 −0.590** 3 h 0.109 0.107 0.205 0.197 0.009 −0.404 9 h 0.112 0.073 0.359 0.363 0.289 −0.224 12 h 0.346 0.314 0.556* −0.378 0.499* −0.480* 24 h 0.452 0.303 0.571* 0.499* 0.369 −0.499* μ-calpain 80 kDa 45 min −0.258 −0.261 −0.561** −0.528* −0.463* 0.406 3 h −0.152 −0.136 −0.250 −0.261 −0.144 0.352 9 h −0.494* −0.519* −0.624** −0.581* −0.495* 0.550* 12 h −0.364 −0.329 −0.520* −0.568** −0.528* 0.405 24 h −0.129 −0.166 −0.200 −0.148 −0.046 0.371 μ-calpain 78 kDa 45 min −0.518* −0.459* −0.426 −0.448* −0.241 0.702** 3 h 0.270 0.299 0.145 0.068 0.053 −0.072 9 h −0.497* −0.461* −0.447* −0.485* −0.251 0.417 12 h −0.425 −0.393 −0.451* −0.470* −0.258 0.495* 24 h −0.422 −0.342 −0.498* −0.335 −0.250 0.277 μ-calpain 76 kDa 45 min 0.423 0.513* 0.472* 0.308 0.275 −0.603** 3 h 0.242 0.242 0.458* 0.399 0.259 −0.436 9 h 0.230 0.331 0.418 0.542* 0.389 −0.490* 12 h 0.124 0.149 0.189 0.177 0.264 −0.400 24 h 0.131 0.154 0.204 0.117 0.211 −0.444 汁液流失率 −0.688** −0.649** −0.588** −0.626** −0.402 1 注:*在0.05水平上显著相关;**在0.01水平上显著相关。 宰后汁液流失率与24 h时desmin的表达量呈极显著正相关(P < 0.01),与45 min、12 h和24 h时的integrin表达量呈显著负相关(P < 0.05),与9 h时μ-calpain 80 kDa亚基表达量、45 min和12 h时μ-calpain 78 kDa亚基表达量呈显著正相关(P < 0.05),与45 min和9 h时μ-calpain 76 kDa亚基表达量呈显著负相关(P < 0.05)。表明宰后肌肉内desmin表达量越多,汁液流失率越高;integrin的表达量越高,汁液流失率越低;μ-calpain76 kDa亚基表达量越高,μ-calpain活性越高,汁液流失率越低。
2.4 最小偏二乘回归分析模型构建
通过建立PLS1回归模型,分析μ-calpain、desmin、integrin和pH变化对汁液流失率的影响。如图4所示,汁液流失率与宰后各时间点的pH呈现显著负相关(P < 0.05);与45 min、3 h和12 h的integrin表达量呈显著负相关(P < 0.05);与24 h的desmin表达量呈显著正相关(P < 0.05);与45 min~12 h的μ-calpain 80 kDa、45 min的μ-calpain 78 kDa亚基的表达量呈显著负相关(P < 0.05);与45 min的76 kDa亚基呈显著正相关(P< 0.05)。说明宰后低pH会导致较高的汁液流失率;肌肉中desmin表达量越多,汁液流失率越高,与之相反的是与肌肉中integrin和μ-calpain 76 kDa亚基(μ-calpain活性)的表达量越高,汁液流失率越低。
表3为宰后μ-calpain、demsin、integrin和pH的变化对汁液流失率解释能力的PLS1模型。结果显示:pH作为单变量时对汁液流失的解释能力最强,主要受宰后3 h的pH控制,解释了78.1%的汁液流失变异;μ-calpain、desmin和integrin的表达量分别解释了42.4%、70.3%和71.7%的汁液流失变异。为明确宰后μ-calpain、desmin和integrin三者共同对汁液流失率的影响,将这三个自变量与汁液流失率构建PLS1回归模型(见表3中模型5),该模型主要由宰后9 h和24 h时的desmin和45 min、12 h和24 h 时integrin的表达量控制,解释了88.1%的汁液流失变异率。随后排除不显著变量得到模型6,该模型主要受宰后45 min的desmin和integrin的表达量控制。与模型5相比,模型6的解释能力下降了7.2%说明宰后12 h的μ-calpain76 kDa表达量对汁液流失的影响也十分重要。
表 3 测量参数(μ-calpain76 kDa、pH、desmin、integrin)(X-变量)对汁液流失率(Y-变量)解释能力的PLS1模型Table 3. PLS1 models of explained variance for drip loss (Y-variable) by the measurement traits (μ-calpain76 kDa, pH, desmin, integrin) (X-variable)模型 变量 显著贡献的时间点 X-var (%) Y-var (%) R2 RMSEP PC 1 μ-calpain μ-calpain76 kDa12 h+24 h 65.2 42.4 0.36 1.22 2 2 desmin desmin24 h 83.5 70.3 0.63 1.56 3 3 integrin integrin45 min+9 h+12 h 87.2 71.7 0.65 1.46 3 4 pH pH3 h 79.9 78.1 0.74 1.12 3 5 μ-calpaindesmin、integrin μ-calpain76 kDa 12 h、desmin9 h+24 h、integrin 45 min+12 h+24 h 42.1 88.1 0.80 1.17 1 6 模型5中显著贡献时间点的参数 desmin 24 hintegrin 45 min 54.6 80.9 0.79 1.10 2 注:R2为调整后R2;RMSEP为预测均方误差根;PC为主成分个数。 3. 讨论
宰后45 min~12 h,H组样品的pH显著低于L组(P < 0.05)(图3A)且与汁液流失呈现极显著负相关(P < 0.01)(表2),说明pH越低,汁液流失越高,持水性越差,这与Bowker[26]等的报道一致。同时PLS1模型显示pH的变化解释了汁液流失变异的78.1%,进一步证实pH是影响猪肉汁液流失率的关键因素。
宰后H组的desmin(3~24 h)表达量高于低L组(P < 0.05),μ-calpain的活性(12 h和24 h)和pH(45 min~12 h)显著低于L组(P < 0.05),且desmin的表达量与汁液流失呈正相关(P < 0.05),pH与μ-calpain活性呈正相关(P < 0.05)。这表明宰后H组的低pH抑制了μ-calpain活性,使μ-calpain对desmin的降解能力减弱[27]。僵直期,大量的desmin可以使肌原纤维横向收缩的力传递至整个肌细胞,导致肌细胞横向收缩,使肌细胞间间隙增加,导致高汁液流失[28]。H组的integrin(45 min、3 h和24 h)表达量低于L组(P<0.05),且integrin的表达量与pH呈正相关,与汁液流失率呈负相关。这可能是因为宰后较低的pH会促使integrin发生降解,从而导致高汁液流失[6]。如果细胞内integrin大量降解则会导致细胞膜的黏附结构被破坏[29],细胞膜剥离细胞体,在细胞膜与细胞体之间形成间隙,造成汁液流失[12]。从μ-calpain、desmin和integrin与汁液流失的PLS1模型(表3模型5)中发现,宰后汁液流失率主要受到宰后μ-calpain76 kDa12 h、desmin9 h+24 h和integrin45 min+12 h+24 h的表达量控制,这可能是因为宰后μ-calpain活性低,降解desmin的能力低,细胞内desmin表达量高可能在细胞间形成较大的间隙,促使汁液流失形成;完整的integrin在维持细胞膜黏附结构完整性上起重要作用,如果integrin的表达量低,细胞膜与细胞体之间就形成间隙且汁液流失增加。
4. 结论
宰后pH变化可能通过影响μ-calpain活性、desmin和integrin的表达量,从而对汁液流失产生影响。宰后肌细胞内的demsin表达量高可能在细胞间形成较大的间隙,促使高汁液流失形成;integrin表达量低可能在细胞膜与细胞体之间形成较大的间隙,造成更高的汁液流失。鉴于本次实验只观测到宰后24 h内的变化,24 h后的变化需要进一步研究。
-
图 3 宰后不同汁液流失组pH(A)、desmin(B)、integrin(C)、μ-calpain 80 kDa(D)、78 kDa(E)、76kDa(F)的表达量变化
注:**表示同一时间点内组间差异极显著(P < 0.01);*表示同一时间点内组间差异显著(P<0.05);同组内不同时间点小写字母不同代表差异显著(P<0.05)。
Figure 3. Changes in pH (A),desmin (B),integrin (C) and μ-calpain 80 kDa (D), 78 kDa (E), 76 kDa (F) expression levels in different drip loss groups post-mortem
表 1 高低汁液流失率组肉样的肉质指标
Table 1 Meat quality index of L-group and H-group
指标 H组 L组 L*45 min 52.42 ± 1.71 41.27 ± 2.66** a*45 min 8.03 ± 0.41 7.27 ± 0.84 b*45 min 7.17 ± 0.34 6.43 ± 0.56 L*24 h 45.97 ± 2.57 40.07 ± 2.62 a*24 h 8.02 ± 0.77 6.81 ± 0.87 b*24 h 5.25 ± 0.57 4.18 ± 0.36 汁液流失率(%) 5.46 ± 0.13 2.08 ± 0.39** 注:表中数值为平均值 ± SEM,**表示在同一时间点内组间差异极显著(P<0.01)。 表 2 μ-calpain、desmin和integrin与pH和汁液流失率的相关性分析
Table 2 Correlation analysis of μ-calpain, desmin and integrin with pH and drip loss
指标 时间点 pH45 min pH3 h pH9 h pH12 h pH24 h 汁液流失率 desmin 45 min −0.144 −0.062 −0.281 −0.061 0.143 0.221 3 h −0.087 −0.155 0.072 −0.257 −0.399 0.342 9 h −0.347 −0.123 −0.088 −0.012 −0.238 0.298 12 h 0.009 0.084 −0.033 0.049 0.072 0.200 24 h −0.294 −0.338 −0.206 −0.219 −0.050 0.690** integrin 45 min 0.420 0.357 0.634** 0.603** 0.398 −0.590** 3 h 0.109 0.107 0.205 0.197 0.009 −0.404 9 h 0.112 0.073 0.359 0.363 0.289 −0.224 12 h 0.346 0.314 0.556* −0.378 0.499* −0.480* 24 h 0.452 0.303 0.571* 0.499* 0.369 −0.499* μ-calpain 80 kDa 45 min −0.258 −0.261 −0.561** −0.528* −0.463* 0.406 3 h −0.152 −0.136 −0.250 −0.261 −0.144 0.352 9 h −0.494* −0.519* −0.624** −0.581* −0.495* 0.550* 12 h −0.364 −0.329 −0.520* −0.568** −0.528* 0.405 24 h −0.129 −0.166 −0.200 −0.148 −0.046 0.371 μ-calpain 78 kDa 45 min −0.518* −0.459* −0.426 −0.448* −0.241 0.702** 3 h 0.270 0.299 0.145 0.068 0.053 −0.072 9 h −0.497* −0.461* −0.447* −0.485* −0.251 0.417 12 h −0.425 −0.393 −0.451* −0.470* −0.258 0.495* 24 h −0.422 −0.342 −0.498* −0.335 −0.250 0.277 μ-calpain 76 kDa 45 min 0.423 0.513* 0.472* 0.308 0.275 −0.603** 3 h 0.242 0.242 0.458* 0.399 0.259 −0.436 9 h 0.230 0.331 0.418 0.542* 0.389 −0.490* 12 h 0.124 0.149 0.189 0.177 0.264 −0.400 24 h 0.131 0.154 0.204 0.117 0.211 −0.444 汁液流失率 −0.688** −0.649** −0.588** −0.626** −0.402 1 注:*在0.05水平上显著相关;**在0.01水平上显著相关。 表 3 测量参数(μ-calpain76 kDa、pH、desmin、integrin)(X-变量)对汁液流失率(Y-变量)解释能力的PLS1模型
Table 3 PLS1 models of explained variance for drip loss (Y-variable) by the measurement traits (μ-calpain76 kDa, pH, desmin, integrin) (X-variable)
模型 变量 显著贡献的时间点 X-var (%) Y-var (%) R2 RMSEP PC 1 μ-calpain μ-calpain76 kDa12 h+24 h 65.2 42.4 0.36 1.22 2 2 desmin desmin24 h 83.5 70.3 0.63 1.56 3 3 integrin integrin45 min+9 h+12 h 87.2 71.7 0.65 1.46 3 4 pH pH3 h 79.9 78.1 0.74 1.12 3 5 μ-calpaindesmin、integrin μ-calpain76 kDa 12 h、desmin9 h+24 h、integrin 45 min+12 h+24 h 42.1 88.1 0.80 1.17 1 6 模型5中显著贡献时间点的参数 desmin 24 hintegrin 45 min 54.6 80.9 0.79 1.10 2 注:R2为调整后R2;RMSEP为预测均方误差根;PC为主成分个数。 -
[1] Zhao X, Wang C, Wang Y, et al. Comparative gene expression profiling of muscle reveals potential candidate genes affecting drip loss in pork[J]. BMC Genetics,2019,20(1):1−9. doi: 10.1186/s12863-018-0706-8
[2] 杨汝男, 李燕清, 陈韬. 宰后猪背最长肌踝蛋白降解与汁液流失率的关系[J]. 食品工业科技,2018,39(20):12−17. [3] Zhao L, Xing T, Huang J, et al. Involvement of μ/m-calpain in the proteolysis and meat quality changes during postmortem storage of chicken breast muscle[J]. Animal Science Journal,2018,89(2):423−431. doi: 10.1111/asj.12921
[4] 冯晓琴, 韩玲, 余群力. 电刺激结合冷却排酸对牦牛细胞骨架蛋白(desmin、troponin-C、integrin)降解影响的研究进展[J]. 食品工业科技,2014(3):369−375. [5] Bee G, Anderson A L, Lonergan S M, et al. Rate and extent of pH decline affect proteolysis of cytoskeletal proteins and water-holding capacity in pork[J]. Meat Science,2007,76(2):359−365. doi: 10.1016/j.meatsci.2006.12.004
[6] Yin Y, Zhang W, Zhou G H, et al. Comparison of protein degradation, protein oxidation, and μ-calpain activation between pale, soft, and exudative and red, firm, and nonexudative pork during postmortem aging[J]. Journal of Animal Science,2014,92(8):3745−3752. doi: 10.2527/jas.2014-7850
[7] 孙隽, 李臻佳, 类春燕, 等. 钙蛋白酶系统对肉的嫩化作用研究进展[J]. 食品科技,2008,33(8):70−72. doi: 10.3969/j.issn.1005-9989.2008.08.021 [8] Rodriguez M A, Liu J, Parkkonen K, et al. The cytoskeleton in the extraocular muscles of desmin knockout mice[J]. Investigative Ophthalmology & Visual Science,2018,59(12):4847−4855.
[9] Sun Z, Costell M, Fassler R, et al. Integrin activation by talin, kindlin and mechanical forces[J]. Nature Cell Biology,2019,21(1):25−31. doi: 10.1038/s41556-018-0234-9
[10] Henderson C A, Gomez C G, Novak S M, et al. Overview of the muscle cytoskeleton[J]. Comprehensive Physiology,2017,7(3):891−944.
[11] Hytonen V P, Bachmann M, Kukkurainen S, et al. Cell adhesion by integrins[J]. Physiological Reviews,2019,99(4):1655−1699. doi: 10.1152/physrev.00036.2018
[12] Lawson M A. The role of integrin degradation in post-mortem drip loss in pork[J]. Meat Science,2004,68(4):559−566. doi: 10.1016/j.meatsci.2004.05.019
[13] 张冬怡, 陈韬, 吴霜, 等. 猪宰后正常肉与PSE肉中肌间线蛋白和钙激活酶的变化与持水性的关系[J]. 食品科技,2015(6):130−135. [14] Zuo H, Han L, Yu Q, et al. Proteome changes on water-holding capacity of yak longissimus lumborum during postmortem aging[J]. Meat Science,2016:409−419.
[15] Zhang M, Wang D, Xu X, et al. Comparative proteomic analysis of proteins associated with water holding capacity in goose muscles[J]. Food Research International,2019:354−361.
[16] Schafer A, Rosenvold K, Purslow P P, et al. Physiological and structural events post mortem of importance for drip loss in pork[J]. Meat Science,2002,61(4):355−366. doi: 10.1016/S0309-1740(01)00205-4
[17] Qian Shuyi, LiXia, Wang Hang, et al. Contribution of calpain to protein degradation, variation in myowater properties and the water-holding capacity of pork during postmortem ageing[J]. Food Chemistry,2020,61(2):352−358.
[18] 吴霜, 陈韬, 张冬怡, 等. 猪屠宰后正常肉与PSE肉中整联蛋白变化与持水性的相关性[J]. 食品工业科技,2015,36(21):64−67, 72. [19] Li Z, Li X, Gao X, et al. Effect of inhibition of μ-calpain on the myofibril structure and myofibrillar protein degradation in postmortem ovine muscle[J]. Journal of the Science of Food and Agriculture,2017,97(7):2122−2131. doi: 10.1002/jsfa.8018
[20] 齐海军, 李绍稳, Arnon K, 等. 基于PLS-BPNN算法的土壤速效磷高光谱回归预测方法[J]. 农业机械学报,2018,49(2):166−172. doi: 10.6041/j.issn.1000-1298.2018.02.022 [21] Honikel K O. Reference methods for the assessment of physical characteristics of meat[J]. Meat Science,1998,49(4):447−457. doi: 10.1016/S0309-1740(98)00034-5
[22] Lonergan S M, Hufflonergan E J, Rowe L J, et al. Selection for lean growth efficiency in Duroc pigs influences pork quality[J]. Journal of Animal Science,2001,79(8):2075−2085. doi: 10.2527/2001.7982075x
[23] Li D, Phoon K, Wu S, et al. Impact of translation approach for modelling correlated non-normal variables on parallel system reliability[J]. Structure and Infrastructure Engineering,2013,9(10):969−982. doi: 10.1080/15732479.2011.652968
[24] 肖作兵, 王红玲, 牛云蔚, 等. 基于OAV和AEDA对工夫红茶的PLSR分析[J]. 食品科学,2018,39(10):242−249. doi: 10.7506/spkx1002-6630-201810037 [25] 林盛, 刘金兰, 韩文秀. 基于PLS-结构方程的顾客满意度评价方法[J]. 系统工程学报,2005,20(6):653−656. doi: 10.3969/j.issn.1000-5781.2005.06.017 [26] Bowker B C, Zhuang H. Relationship between water-holding capacity and protein denaturation in broiler breast meat[J]. Poultry Science,2015,94(7):1657−1664. doi: 10.3382/ps/pev120
[27] Huang J C, Yang J, Huang F, et al. Effect of fast pH decline during the early postmortem period on calpain activity and cytoskeletal protein degradation of broiler M. pectoralis major[J]. Poultry Science,2016,95(10):2455−2463. doi: 10.3382/ps/pew206
[28] Huff-lonergan E, Lonergan S M. New frontiers in understanding drip loss in pork: Recent insights on the role of postmortem muscle biochemistry[J]. Journal of Animal Breeding and Genetics,2007,66(2):19−26.
[29] Michael M, Parsons M. New perspectives on integrin-dependent adhesions[J]. Current Opinion in Cell Biology,2020,63:31−37. doi: 10.1016/j.ceb.2019.12.008





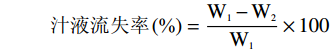

 下载:
下载:



 下载:
下载:
