Extraction of Total Flavonoids in Vegetable Soybean Fermented by Bacillus natto and Evaluation of Its Effect on Hypolipidemic Effect
-
摘要: 本研究以菜用大豆等外品为原料,通过纳豆枯草芽孢杆菌发酵来提高其总黄酮含量,为提高菜用大豆产品的附加值提供理论支持。实验利用纳豆芽孢杆菌对菜用大豆等外品进行发酵,以发酵产品中总黄酮含量为评价指标确定纳豆发酵的最优条件,通过D101型大孔树脂对提取的总黄酮进行纯化,采用芦丁比色法测定总黄酮含量。体内实验分为肥胖预防实验和缓解实验:以C57BJ/6L小鼠为模型,预防实验在饲喂高脂饲料的同时,灌胃总黄酮提取物溶液(50 mg/kg·d);缓解实验是利用高脂饲料建立起肥胖小鼠模型后,灌胃低、中、高剂量的总黄酮提取物溶液(分别为20、50和100 mg/kg·d)。通过小鼠体重、血脂以及促炎因子等指标评价总黄酮溶液的降脂效果。结果表明,菜用大豆发酵生产黄酮的最佳条件为:枯草芽孢杆菌接菌量为1.15 × 1011 CFU/100 g菜用大豆,发酵温度37 ℃,发酵时间24 h,后熟时间12 h,此时纳豆总黄酮得率为4.30 mg/g菜用大豆;测得该粗提物中黄酮含量为22.1%;预防实验组给予黄酮处理后,小鼠体重和Lee's指数与正常对照组相比均无显著差异(P >0.05)。缓解实验中高、中、低剂量黄酮提取物处理组小鼠血清中甘油三酯(TG)含量分别为313.10 ± 10.12、310.39 ± 31.76和310.1 ± 10.20 nmol/L,与正常对照组(330.80 ± 34.36 nmol/L)无显著差异(P>0.05);黄酮各组灌胃干预后,小鼠血清总胆固醇(TC)、白介素-6(IL-6)和肿瘤坏死因子-α(TNF-α)含量均较高脂模型组显著下降(P<0.05)。结论:利用纳豆芽孢杆菌发酵菜用大豆提高了其总黄酮含量,该黄酮提取物具有预防和缓解高脂饮食小鼠血脂升高的效果。Abstract: This paper used vegetable soybeans which were not qualified for export as raw materials to increase total flavonoid yield through Bacillus natto fermentation, thus providing theoretical support for increasing the added value of vegetable soybeans. Bacillus natto was used to ferment vegetable soybeans, and the total flavonoid content in the fermented product was used as criteria to determine the optimal fermentation conditions. The extracted total flavonoids were purified using D101 macroporous resin. The content of total flavonoids was determined by rutin colorimetric method. The in vivo experiments were divided into obesity preventive and alleviating tests using C57BJ/6L mice. Mice from the preventive experiment were fed high-fat diet while administered flavonoid extracts (50 mg/kg·d) through gavage; in alleviating groups, mice were administered total flavonoid extracts at low, medium and high doses (20, 50, and 100 mg/kg·d, respectively) through gavage after establishing obese mouse model with high-fat diet. The hypolipidemic effect of total flavonoids was evaluated through parameters such as mouse body weight, blood lipids and pro-inflammatory factors. Results showed that the optimal conditions for production of total flavonoids via fermentation were as follows: Bacillus natto was inoculated at 1.15 × 1011 CFU/100 g vegetable soybeans, which was subjected to fermentation at 37 ℃ for 24 h and post ripeness for another 12 h. The yield of total flavonoids was 4.30 mg/g vegetable soybean, with the content of flavonoids in the crude extract at 22.1%. In the prevention experiment, there were no significant differences in both the weight and Lee's index of the high-fat diet mice after gavage with total flavonoids compared with those of the normal control group (P >0.05). In the alleviating experiment, the serum triglyceride (TG) content of the mice treated with high, medium, and low-dose flavonoid extracts were 313.10 ± 10.12, 310.39 ± 31.76 and 310.10 ± 10.20 nmol/L, respectively, with no significant difference compared with that of the normal control group (330.80 ± 34.36 nmol/L) (P>0.05). After intragastric intervention with flavonoids, serum total cholesterol (TC), interleukin-6 (IL-6) and tumor necrosis factor-α (TNF-α) levels in mice showed a significant decrease compared with those of the higher fat control group (P<0.05). In summary, fermentation using Bacillus natto helped to increase the total flavonoid content in vegetable soybeans. The flavonoid extract showed the effect of both preventing and alleviating mouse hyperlipidemia.
-
调查显示,我国15~69岁的人群当中约有40%是高血脂症患者,病症主要是由长期高脂饮食导致对脂质的过度吸收或者是体内脂质代谢及转运异常引起[1]。目前,市面上治疗高脂血症的药物主要包括他汀类及树脂类药物、烟酸和依折麦布等[2],这些药物大多具有副作用,所以寻找天然的降血脂物质显得尤其重要。
大量流行病学调查发现,长期食用富含总黄酮的食品能够有效降低心血管疾病的发病率[3]。陈会良等[4]研究发现,总黄酮类物质在降脂方面主要是通过对抗低密度脂蛋白的氧化、清除体内自由基及抑制脂质过氧化物的产生而发挥作用。
纳豆主要是以大豆为原料,蒸煮后接入纳豆芽孢杆菌发酵而成。纳豆营养价值高,具有多种医疗保健功能。纳豆含有总黄酮、卵磷脂、皂苷、生物碱等多种生理活性物质,长期食用可提升机体的免疫力[5]。纳豆中的总黄酮更是具有抗氧化[6- 7]、抗癌[8-11]、降血压和降血脂[12-15]等功效。因此,选择特定的豆制品原料,再通过一定的生物技术手段提高其中的总黄酮类物质的含量具有重要的研究价值和应用前景。
菜用大豆是一种含有丰富植物蛋白、多种有益矿物质、维生素及膳食纤维等成分的豆类植物。目前,我国对于菜用大豆深加工产品的研究和开发还比较落后。本课题研究目的是以菜用大豆等外品为原料,经实验室前期分析显示,通过芦丁比色法未能测到总黄酮类物质,因此,本文拟利用纳豆芽孢杆菌对其进行发酵处理,以期提高总黄酮含量,为企业提高菜用大豆的附加值、增加收入提供重要的解决方案。
1. 材料和方法
1.1 材料与仪器
纳豆枯草芽孢杆菌(Bacillus subtilis)菌粉 日本有限会社高桥祐藏研究所;菜用大豆 山东阳光农业生物科技有限公司;SPF级雄性C57BL/6J小鼠 90只 6~8周龄,18~22 g,长春长生生物有限公司,实验动物合格证号NO.SCXK(辽)2020-0001;高脂饲料 北京泰博宏达生物有限公司;普通饲料 哈尔滨医科大学;奥利司他 中山万汉制药;小鼠高密度脂蛋白(High density lipoprotein, HDL)、总胆固醇(total cholesterol, TC)、甘油三酯(triglycerides, TG)、白细胞介素-6(interleukin-6, IL-6)、白细胞介素-10(interleukin-10, IL-10)、肿瘤坏死因子- α(tumor necrosis factor-α, TNF- α)ELISA试剂盒 上海酶联生物科技有限公司;其他试剂 市售分析纯。
1.2 实验方法
1.2.1 纳豆发酵
按照传统的方法[15]制作纳豆,具体过程如下:挑选无发霉、虫害的菜用大豆,清洗后浸泡过夜,在121 ℃条件下蒸煮20 min,自然冷却至50~60 ℃后,按5.75×1010~2.3×1011 CFU/100 g接入纳豆菌菌液,接种完成后置于恒温培养箱中,于35~41 ℃发酵12~48 h,发酵完成后,将纳豆放入4 ℃冰箱中后熟6~24 h后取出,即得到发酵好的纳豆。
1.2.2 总黄酮提取及含量测定
参考文献[16-18]的方法提取总黄酮。将发酵好的纳豆置于−20 ℃预冻12 h后,进行冷冻干燥,然后将冷冻干燥完成的纳豆置于粉碎机中粉碎,过80目筛后,称量所得纳豆粉质量。向纳豆粉中加入10倍体积石油醚,在超声功率为300 W的条件下间歇处理10次,每次3 min,萃取脂肪,弃去石油醚层后,加入30倍体积60%乙醇,80 ℃热回流3 h,收集提取液,即得总黄酮粗提液。
采用亚硝酸钠-硝酸铝-氢氧化钠法测定总黄酮含量[16-19]。具体操作如下:准确吸取芦丁标准溶液0、0.50、1.00、2.00、3.00、4.00 mL(相当于0、75、150、300、450、600 μg芦丁),移入10 mL刻度比色管中,加入30%乙醇溶液至5 mL,各加5%亚硝酸钠溶液0.3 mL,振摇后放置5 min,加入10%硝酸铝溶液0.3 mL摇匀后放置6 min,加1.0 mol/L氢氧化钠溶液2 mL,用30%乙醇定容至刻度,摇匀,放置15 min,于510 nm波长处测定吸光度,以零管为空白,以芦丁含量(μg)为横坐标,以吸光度为纵坐标绘制标准曲线方程如下:
y=5.02x+0.0007,R2=0.9996。
取适量的黄酮粗提物粉末,配制成合适浓度的溶液,按照对芦丁标准品的处理过程获得黄酮粗提物待测液,测得的OD510吸光值,代入上述标准曲线回归方程计算样品中总黄酮含量。
1.2.3 纳豆发酵工艺单因素实验
将菜用大豆清洗后倒入250 mL锥形瓶中,121 ℃、0.1 MPa下高温蒸煮20 min后,以纳豆中总黄酮的含量为评价指标,分别进行以下单因素实验处理:
1.2.3.1 发酵时间
按1.150×1011 CFU /100 g添加纳豆芽孢杆菌,于37 ℃条件下分别静置发酵12、24、36和48 h,发酵完成后转入4 ℃冰箱后熟12 h,测定不同发酵时间下得到的纳豆中总黄酮的含量,确定最适合的发酵时间。
1.2.3.2 发酵温度
按1.150×1011 CFU /100 g添加纳豆芽孢杆菌,分别于35、37、39和41 ℃静置发酵24 h,发酵完成后转入4 ℃冰箱后熟12 h,测定不同发酵温度下得到的纳豆中总黄酮的含量,以确定最适合的发酵温度。
1.2.3.3 接菌量
分别按5.750×1010、1.150×1011、1.725×1011和2.300×1011 CFU /100 g添加菌液,37 ℃静置发酵24 h,发酵完成后转入4 ℃冰箱后熟12 h,测定不同接菌量下发酵制得的纳豆中总黄酮的含量,得到最适合的接菌量。
1.2.3.4 后熟时间
按1.150×1011 CFU /100 g添加菌液,37 ℃分别静置发酵24 h,发酵完成后转入4 ℃冰箱分别后熟6、12、18和24 h,测定不同后熟时间下发酵制得的纳豆中总黄酮的含量,得到最适合的后熟时间。
1.2.4 正交试验设计
在单因素实验的基础上,选择对纳豆黄酮产量影响显著的三个因素,即发酵时间(A)、接菌量(B)和后熟时间(C)为变量,纳豆中总黄酮含量为评价指标,选用正交表L9 (34)进行3因素3水平正交实验,确定纳豆发酵条件最佳组合(如表1所示)。
表 1 纳豆发酵工艺优化正交试验因素与水平Table 1. Factors and levels of orthogonal experiment for optimization of natto fermentation process水平 A发酵时间(h) B接菌量(CFU /100 g) C后熟时间(h) 1 24 5.75 × 1010 6 2 36 1.15 × 1011 12 3 48 1.73 × 1011 18 1.2.5 总黄酮粗提液的纯化
参考文献[16-18]的方法纯化黄酮粗提液。将D101型大孔树脂倒入95%乙醇中预处理12 h,然后填入层析柱中,用蒸馏水洗至无味,然后以1.5 mL/min的流速加入250 mL总黄酮粗提液,静置平衡30 min;平衡完成后使用70%乙醇溶液以1.5 mL/min的流速洗涤直至大孔树脂无色,收集洗脱液。通过旋转蒸发浓缩洗脱液,浓缩完成后置于−20 ℃预冷冻后进行冷冻干燥,获得纯化的总黄酮粉末。将纯化的总黄酮粉末配制成一定浓度的总黄酮水溶液,并根据1.2.2的方法确定总黄酮的含量。
1.2.6 动物实验分组及剂量
实验选择80只雄性SPF级C57BL/6J小鼠,体重18~22 g。将实验小鼠放置在动物饲养室中适应性饲养1周,适应性饲养期间12 h光照和12 h黑暗,动物自由饮食摄水。适应性饲养完成后,进行以下分组实验。
1.2.6.1 缓解实验
随机选取48只小鼠,分为6组,每组8只,除空白对照组(A组)以外,其余各组连续喂养8周的高脂饮食以建立高脂动物模型。建模成功后,A组继续饲喂普通饲料,每天灌胃0.2 mL/d的无菌水;阳性对照组(B组)每天饲喂高脂饲料,同时灌胃1.8 mg/d的奥利司他1次;模型组(C组)每天饲喂高脂饲料并灌胃与阳性对照组等量的生理盐水1次;总黄酮高、中、低剂量组(D~F组)每天饲喂高脂饲料并分别按照100、50和20 mg/kg·d灌胃总黄酮水溶液1次。每只小鼠的灌胃量为0.2 mL/d,连续灌胃处理4周。
1.2.6.2 预防实验
32只小鼠适应性饲养完成后,随机分为4组,即空白对照组(A组):饲喂普通饲料,灌胃0.2 mL/d的无菌水;阳性对照组(B组):饲喂高脂饲料,灌胃1.8 mg/d的奥利司他;模型组(C组):饲喂高脂饲料,灌胃与阳性对照组等量的生理盐水;总黄酮提取物处理组(D组):饲喂高脂饲料,灌胃50 mg/(kg·d)的纳豆总黄酮提取物。每组8只,连续灌胃处理喂养8周,每只小鼠的灌胃量为0.2 mL/d,每日灌胃1次。
1.2.7 总黄酮对小鼠体重及Lee’s指数影响
实验过程中每周测定小鼠的体重和体长(从鼻子到肛门),按照如下公式计算Lee’s指数:
Lee's指数 = 体重(g)1/3 × 1000/体长(cm)
1.2.8 总黄酮对小鼠肝脾指数影响
在眼球取血结束后,断颈处死小鼠,迅速收集小鼠的肝脏和脾脏,并用滤纸吸去血渍,除去周围的组织和脂肪后称量其湿重。根据以下公式计算免疫器官的指数:
肝脏指数(g/100 g) = 肝脏重量(g)/体重(g) × 100
脾脏指数(g/100 g) = 脾脏重量(g)/体重(g) × 100
1.2.9 总黄酮对小鼠血清中血脂及炎症因子影响
实验结束时,小鼠禁食12 h,期间自由饮水,采用摘眼球法取血,用不含内毒素的1.5 mL离心管收集血液,1652 g离心10 min,取上清到新离心管中,−20 ℃的冰箱保存,待检测时,提前将血清放入冰浴环境中解冻,使用ELISA试剂盒检测小鼠血清中TNF-α、HDL、IL-6、IL-10、TG和TC的含量,具体操作方法参照试剂盒说明书。
1.3 数据分析
所有数据均进行三次重复实验,用Origin 2018软件对结果进行分析和作图。通过ANOVA对数据进行统计学分析,结果表示为平均值±标准差的形式。标记小写字母不同者表示差异显著(P<0.05),字母相同或部分相同或未标记者表示差异不显著(P
>0.05)。 2. 结果与讨论
2.1 纳豆发酵产黄酮工艺的确定
2.1.1 单因素实验
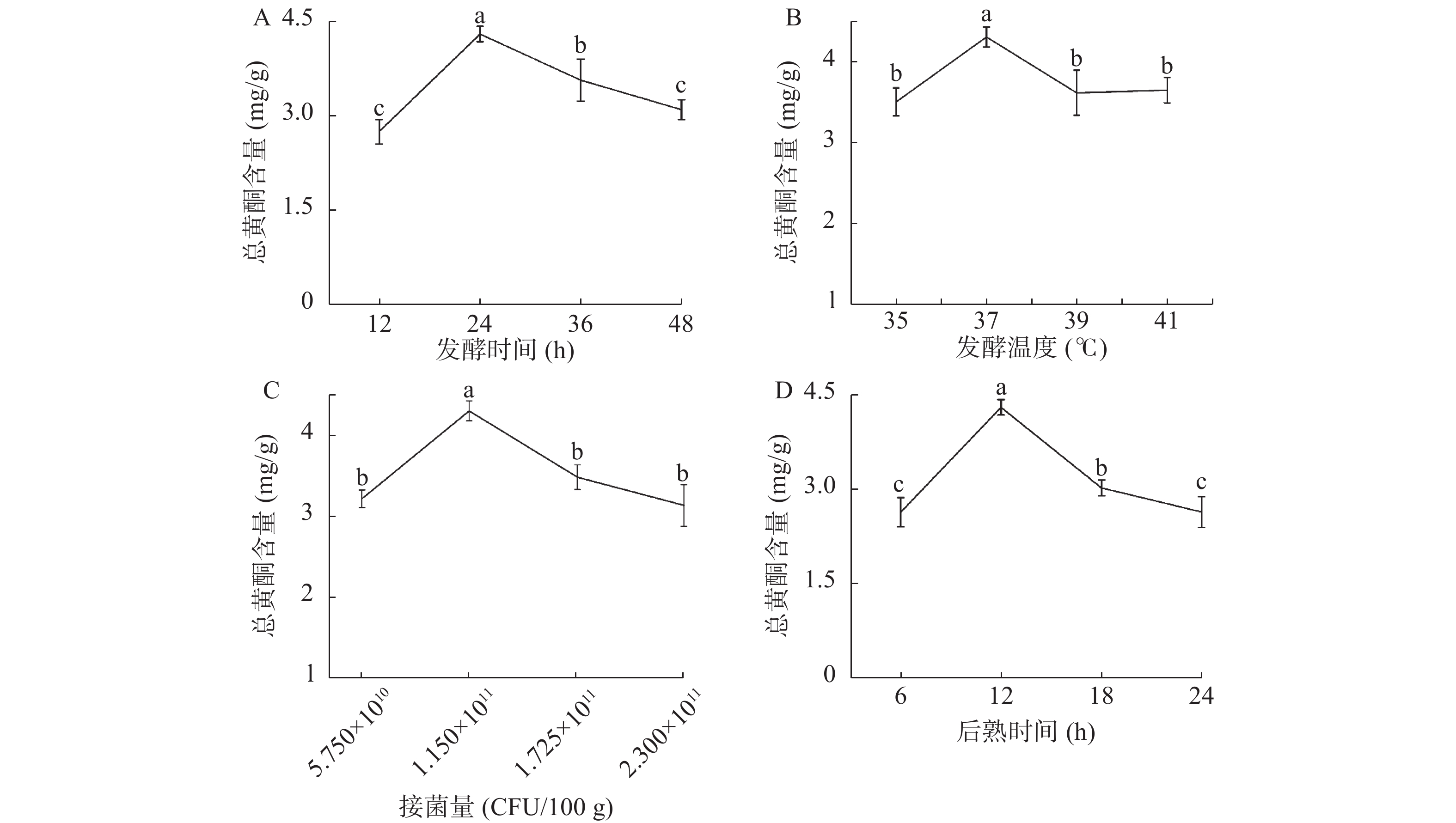
如图1A所示,纳豆中总黄酮含量随着发酵时间的延长呈现先升高后降低的趋势。在12~24 h这个阶段,纳豆中总黄酮含量逐渐升高,发酵时间为24 h时,纳豆中总黄酮含量达到最高;而当发酵时间超过24 h时,发酵底物的营养物质可能不足以维持纳豆菌的代谢,同时次级代谢产物过多,对初级代谢产物产生抑制[16-18],使得纳豆中总黄酮含量逐渐降低。为此,选择发酵时间为24、36和48 h进行后续实验。
本实验中发酵温度对纳豆中总黄酮含量的影响如图1B所示。随着发酵温度的升高,纳豆中的总黄酮含量不断变化。而当发酵温度为37 ℃时,纳豆中总黄酮含量最高。因此,发酵温度选择为37 ℃。
如图1C所示,接菌量对纳豆发酵过程中总黄酮的产生具有一定影响。当接菌量为5.75×1010 CFU/100 g时,纳豆的总黄酮含量较低,造成这种结果的原因可能是因为接菌量太少,细菌生长速度缓慢,发酵过程不完全;当接菌量为1.15×1011 CFU/100 g时,纳豆中总黄酮含量达到最大;接菌量大于1.15×1011 CFU/100 g时,纳豆中总黄酮含量随接菌量增大而降低,此时细菌繁殖速度过快导致菜用大豆中营养成分迅速耗竭,从而导致纳豆中总黄酮含量减少[16-18]。因此,接菌量选择为5.75×1010 、1.15×1011、1.73×1011 CFU/100 g进行后续实验。
从图1D可以看出,当后熟时间为12 h时,纳豆的总黄酮含量最高,纳豆的独特氨味较少、黏度较低;当后熟时间大于12 h时,纳豆的氨臭味过大,纳豆中总黄酮含量逐渐降低。因此,后熟时间选择为6、12和18 h进行后续实验。
有研究表明,大豆产品经微生物发酵后,可以实现一些次级代谢物的转化,如大豆经黑曲霉(A. niger M46)发酵,其异黄酮化合物的组成发生了改变,提高了发酵产物的抗氧化活性[20]。Moktan等[21]研究也显示,大豆经枯草芽孢杆菌发酵以后,其总酚含量明显增加,导致其抗氧化能力得到显著提高。因此,本研究以纳豆芽孢杆菌作为发酵剂,经发酵后提高菜用大豆黄酮含量具有可行性。
2.1.2 正交试验
由表2、表3可知,3个因素对菜用大豆发酵纳豆中总黄酮类物质含量影响顺序为A>B>C,即发酵时间>接菌量>后熟时间。A1B2C3是正交试验得出的纳豆中总黄酮类物质含量最高的发酵方案,即菜用大豆发酵时间24 h,接菌量1.15×1011 CFU /100 g,后熟时间18 h,此发酵方案下纳豆中的总黄酮类含量为4.35 mg/g(以菜用大豆计);经验证试验,该条件下纳豆黄酮产量与A1B2C2(4.30 mg/g)条件下差异不显著(P>0.05),考虑到后熟时间18 h时间过长,选择A1B2C2作为最优发酵方案。
表 2 纳豆发酵工艺优化正交试验结果Table 2. Orthogonal experiment result for optimization of natto fermentation process实验号 A B C Y:总黄酮含量(mg/g) 1 1 1 1 3.34 ± 0.17 2 1 2 2 4.30 ± 0.12 3 1 3 3 3.70 ± 0.24 4 2 1 2 3.66 ± 0.27 5 2 2 3 3.79 ± 0.21 6 2 3 1 2.99 ± 0.21 7 3 1 3 3.30 ± 0.26 8 3 2 1 3.23 ± 0.28 9 3 3 2 2.40 ± 0.26 k1 3.78 3.43 3.19 k2 3.48 3.77 3.45 k3 2.98 3.03 3.59 R 0.80 0.74 0.41 表 3 正交试验方差分析Table 3. Analysis of orthogonal experimental variance因素 SS 自由度 F值 Fa A 0.9893 2 3.874 F0.05(2,4) = 6.944 B 0.8294 2 3.248 C 0.2604 2 误差e 0.2503 2 总变异 2.329 F检验结果表明,各因素F值远小于F0.05(2,4),这说明三个因素的交互作用对总黄酮含量的影响均不显著,可以选择上述实验方案作为最优组合。
2.2 总黄酮对小鼠体重及Lee’s指数的影响
图2A为缓解实验中第0、8、12周小鼠体重变化情况。第8周末时,饲喂高脂饲料的小鼠体重显著高于正常对照组(A)的体重(P<0.05),表明高脂动物模型建立成功。建模成功后再连续灌胃总黄酮4周,各组小鼠体重变化差异明显,第12周末时,总黄酮各剂量处理组的小鼠体重显著低于模型组(C)(P<0.05)。
图2B为预防实验中第0周、第4周、第8周小鼠体重变化情况。第4周末时,模型组(C)和正常对照组(A)小鼠的体重显著高于灌胃奥利司他干预的阳性对照组(B)和总黄酮组(D)小鼠的体重(P<0.05);在第8周末时,模型组(C)小鼠体重显著高于其他三组小鼠体重(P<0.05),其中总黄酮组(D)小鼠的体重略低于正常对照组(A)。
如表4所示,缓解实验中各组小鼠在第12周末体长无显著性差异(P>0.05),C组小鼠Lee’s指数显著高于其他五组(P<0.05)。总黄酮各剂量处理组小鼠的Lee’s指数与正常对照组(A)、阳性对照组(B)无显著性差异(P>0.05)。
表 4 各组小鼠体长及Lee’s指数Table 4. Body length and Lee’s index of mice in different groups组别 缓解实验 组别 预防实验 体长(cm) Lee’s指数 体长(cm) Lee’s指数 正常对照组(A) 8.98 ± 0.33a 344.94 ± 5.82b 正常对照组 8.63 ± 0.24a 356.58 ± 3.79b 阳性对照组(B) 8.90 ± 0.23a 349.73 ± 10.19b 阳性对照组 8.31 ± 0.39a 363.58 ± 11.18b 模型组(C) 8.98 ± 0.36a 363.56 ± 18.18a 模型组 8.57 ± 0.62a 382.03 ± 11.15a 总黄酮高剂量组(D) 8.73 ± 0.15a 350.20 ± 7.17b 总黄酮组 8.34 ± 0.38a 362.54 ± 6.76b 总黄酮中剂量组 8.81 ± 0.08a 351.15 ± 4.96b 总黄酮低剂量组(F) 8.84 ± 0.28a 348.65 ± 12.22b 注:表中同一列标记小写字母不同者表示差异显著(P<0.05),表5同。 预防实验中第8周末各组小鼠体长无显著性差异(P>0.05),C组小鼠Lee's指数显著高于另外三组(P<0.05),正常对照组(A)、阳性对照组(B)和总黄酮组(D)Lee's指数无显著差异(P>0.05)。
2.3 总黄酮对小鼠肝脾指数的影响
高脂饮食会损害肥胖动物的肝脏,这主要是由于空泡样变性、肝脂肪变性和肝纤维化所致[22]。脾脏是人体中最大的淋巴器官,能够合成某些具有生物活性的物质,同时也是发生免疫应答反应的场所[23]。由表5可以看出,在缓解实验中,总黄酮处理的各组小鼠肝脾指数均显著高于模型组(C)(P<0.05)。在预防实验中,模型组(C)小鼠肝脏指数最低,各组小鼠脾脏指数差异不显著(P>0.05)。
表 5 缓解实验及预防实验各组小鼠肝脏及脾脏系数Table 5. Liver and spleen coefficients of mice in alleviating experiment and prevention experiment组别 缓解试验 组别 预防实验 肝脏指数 脾脏指数 肝脏指数 脾脏指数 正常对照组 3.55 ± 0.13a 0.24 ± 0.03a 正常对照组 3.57 ± 0.39a 2.57 ± 0.25a 阳性对照组 3.73 ± 0.33a 0.27 ± 0.04a 阳性对照组 3.65 ± 0.20a 2.58 ± 0.43a 模型组 3.25 ± 0.37b 0.23 ± 0.05b 模型组 3.38 ± 0.33b 2.46 ± 0.42a 总黄酮高剂量 3.53 ± 0.20a 0.26 ± 0.05a 异黄酮组 3.62 ± 0.11a 2.63 ± 0.19a 总黄酮中剂量组 3.51 ± 0.63a 0.27 ± 0.04a 总黄酮低剂量组 3.58 ± 0.33a 0.26 ± 0.05a 2.4 总黄酮对小鼠血清中血脂的影响
由图3可知,在缓解实验中模型组(C)小鼠的血清中TG水平最高,显著高于其他5组(P<0.05),总黄酮处理的各组小鼠血清中TG水平与正常对照组(A)和阳性对照组(B)无显著差异(P>0.05)。预防实验结果与缓解实验类似,模型组(C)小鼠血清中的TG水平显著高于其他三组(P<0.05),灌胃奥利司他和黄酮粗提物都显著地降低了小鼠TG含量(P<0.05)。
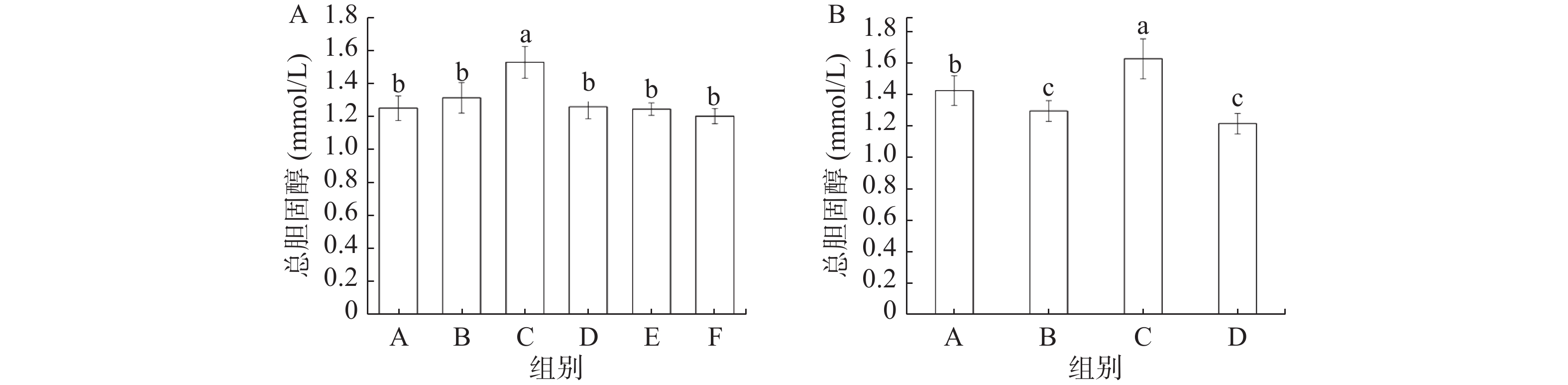
由图4A可知,缓解实验中模型组(C)小鼠血清中TC含量显著高于其他五组(P<0.05);灌胃奥利司他处理的阳性对照组(B)小鼠血清中TC含量与总黄酮各剂量处理组没有显著性差异。如图4B所示,预防实验中模型组(C)小鼠血清TC含量显著高于其他三组(P<0.05),正常对照组(A)的TC含量也显著高于阳性对照组(B)和总黄酮组(D)(P<0.05)。
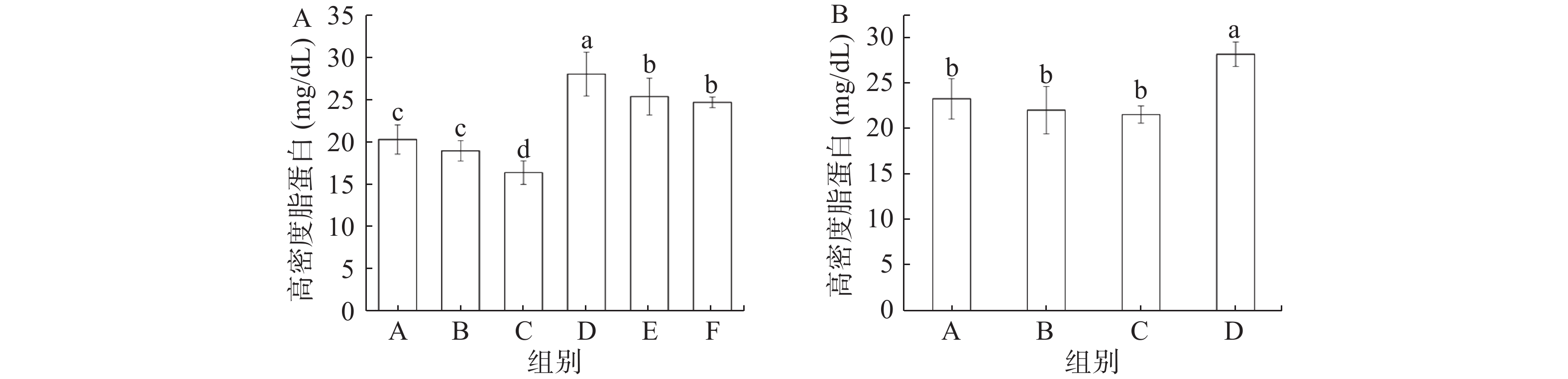
由图5可知,缓解实验中,灌胃总黄酮的三组小鼠血清中的HDL水平显著高于其他三组(P<0.05),其中总黄酮处理组小鼠血清中的HDL水平呈现出明显的剂量依赖性。预防实验与缓解实验结果一致,同样是模型组(C)小鼠血清中HDL水平最低,总黄酮组(D)HDL水平最高。Aloud等[24]研究显示,高良姜黄素(一种天然黄酮类化合物)可以降低糖尿病大鼠血清中低密度脂蛋白(LDL)水平,并升高HDL含量,使得糖尿病大鼠的血脂水平恢复到正常水平,这与本研究所得到的结果一致。
2.5 总黄酮对小鼠炎症因子的影响
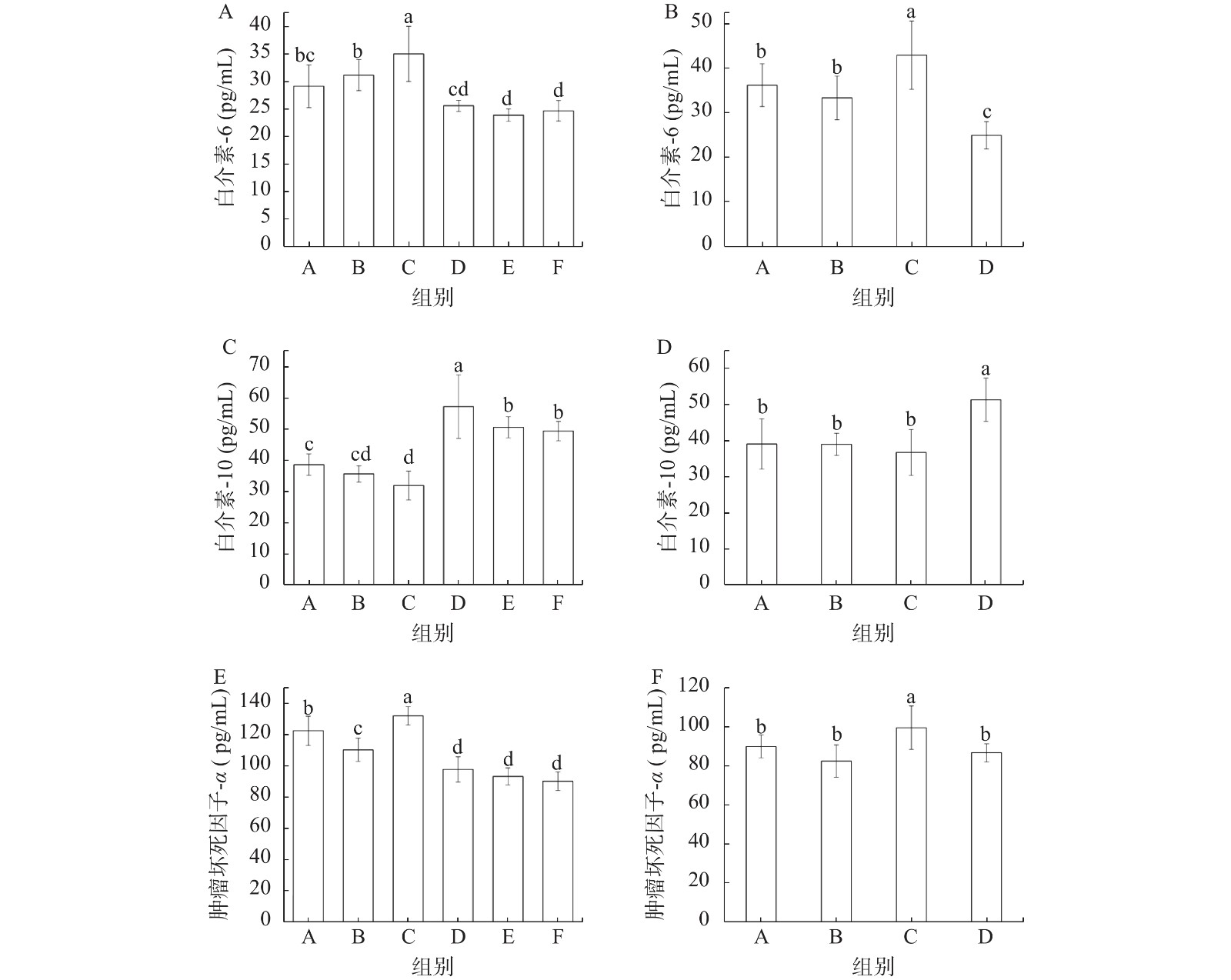
总黄酮提取物对高脂饮食小鼠炎症因子产生的影响如图6所示。高脂饮食会引起血清促炎因子IL-6、TNF-α含量提高(图6A, B, E, F),而抗炎因子IL-10含量下降(图6C, D)。缓解实验中总黄酮各剂量处理组促炎因子IL-6、TNF-α含量都明显降低,没有明显的剂量依赖效应。缓解实验中给予总黄酮处理的三组小鼠血清中IL-10含量显著高于其他各组(P<0.05)(图6C),预防实验中总黄酮组(D)小鼠血清中IL-10含量显著高于其他三组(P<0.05)(图6D)。IL-10具有抑制IL-1β、IL-6和TNF-α的作用[25]。本研究结果显示,发酵菜用大豆产生的总黄酮提取物具有降血脂、抗炎的功效,这与文献报道的一致[26]。
本研究中,从纳豆菌发酵菜用大豆中提取了总黄酮,其中含有多种成分,有研究显示,总黄酮中的不同成分在降脂方面具有协同效应[27],本研究中也显示出总黄酮的优异效果。
3. 结论
本研究利用纳豆芽孢杆菌发酵菜用大豆,优化了总黄酮的发酵工艺,通过大孔树脂纯化,得到黄酮粗提物,其含量为4.30 mg/g菜用大豆。该黄酮粗提物可预防和缓解高脂饮食引起小鼠的血脂升高,降低血清中炎症因子水平。本研究进一步证实了利用纳豆芽孢杆菌发酵可以提高菜用大豆中黄酮类物质的含量,这为通过生物发酵法提高菜用大豆的产品附加值提供了新思路。
-
表 1 纳豆发酵工艺优化正交试验因素与水平
Table 1 Factors and levels of orthogonal experiment for optimization of natto fermentation process
水平 A发酵时间(h) B接菌量(CFU /100 g) C后熟时间(h) 1 24 5.75 × 1010 6 2 36 1.15 × 1011 12 3 48 1.73 × 1011 18 表 2 纳豆发酵工艺优化正交试验结果
Table 2 Orthogonal experiment result for optimization of natto fermentation process
实验号 A B C Y:总黄酮含量(mg/g) 1 1 1 1 3.34 ± 0.17 2 1 2 2 4.30 ± 0.12 3 1 3 3 3.70 ± 0.24 4 2 1 2 3.66 ± 0.27 5 2 2 3 3.79 ± 0.21 6 2 3 1 2.99 ± 0.21 7 3 1 3 3.30 ± 0.26 8 3 2 1 3.23 ± 0.28 9 3 3 2 2.40 ± 0.26 k1 3.78 3.43 3.19 k2 3.48 3.77 3.45 k3 2.98 3.03 3.59 R 0.80 0.74 0.41 表 3 正交试验方差分析
Table 3 Analysis of orthogonal experimental variance
因素 SS 自由度 F值 Fa A 0.9893 2 3.874 F0.05(2,4) = 6.944 B 0.8294 2 3.248 C 0.2604 2 误差e 0.2503 2 总变异 2.329 表 4 各组小鼠体长及Lee’s指数
Table 4 Body length and Lee’s index of mice in different groups
组别 缓解实验 组别 预防实验 体长(cm) Lee’s指数 体长(cm) Lee’s指数 正常对照组(A) 8.98 ± 0.33a 344.94 ± 5.82b 正常对照组 8.63 ± 0.24a 356.58 ± 3.79b 阳性对照组(B) 8.90 ± 0.23a 349.73 ± 10.19b 阳性对照组 8.31 ± 0.39a 363.58 ± 11.18b 模型组(C) 8.98 ± 0.36a 363.56 ± 18.18a 模型组 8.57 ± 0.62a 382.03 ± 11.15a 总黄酮高剂量组(D) 8.73 ± 0.15a 350.20 ± 7.17b 总黄酮组 8.34 ± 0.38a 362.54 ± 6.76b 总黄酮中剂量组 8.81 ± 0.08a 351.15 ± 4.96b 总黄酮低剂量组(F) 8.84 ± 0.28a 348.65 ± 12.22b 注:表中同一列标记小写字母不同者表示差异显著(P<0.05),表5同。 表 5 缓解实验及预防实验各组小鼠肝脏及脾脏系数
Table 5 Liver and spleen coefficients of mice in alleviating experiment and prevention experiment
组别 缓解试验 组别 预防实验 肝脏指数 脾脏指数 肝脏指数 脾脏指数 正常对照组 3.55 ± 0.13a 0.24 ± 0.03a 正常对照组 3.57 ± 0.39a 2.57 ± 0.25a 阳性对照组 3.73 ± 0.33a 0.27 ± 0.04a 阳性对照组 3.65 ± 0.20a 2.58 ± 0.43a 模型组 3.25 ± 0.37b 0.23 ± 0.05b 模型组 3.38 ± 0.33b 2.46 ± 0.42a 总黄酮高剂量 3.53 ± 0.20a 0.26 ± 0.05a 异黄酮组 3.62 ± 0.11a 2.63 ± 0.19a 总黄酮中剂量组 3.51 ± 0.63a 0.27 ± 0.04a 总黄酮低剂量组 3.58 ± 0.33a 0.26 ± 0.05a -
[1] Gao S, Hu G, Li D, et al. Anti-hyperlipidemia effect of sea buckthorn fruit oil extract through the AMPK and Akt signaling pathway in hamsters[J]. Journal of Functional Foods,2020,66:1736803. doi: 10.1155/2020/1736803
[2] 侯晅, 戴学文, 房志仲. 抗高血脂药物的研究进展[J]. 天津药学,2016,28(4):59−64. doi: 10.3969/j.issn.1006-5687.2016.04.021 [3] Szliszka E, Bronikowska J, Czuba Z P, et al. Isoflavones augment the effect of tumor necrosis factor-related apoptosis-inducing ligand (TRAIL) on prostate cancer cells[J]. Urologia Polska,2010,63:182−186.
[4] 陈会良, 顾有方. 中草药化学成分与降血脂功能的研究进展[J]. 中国中医药科技,2006(4):287−288. doi: 10.3969/j.issn.1005-7072.2006.04.066 [5] Taniguchi-Fukatsu A, Yamanaka-Okumura H, Naniwa-Kuroki Y, et al. Natto and viscous vegetables in a Japanese-style breakfast improved insulin sensitivity, lipid metabolism and oxidative stress in overweight subjects with impaired glucose tolerance[J]. British Journal of Nutrition,2012,107:1184−1191. doi: 10.1017/S0007114511004156
[6] 王正, 杨青松, 刘露. 大豆黄酮抗氧化及抗癌作用[J]. 生命的化学,2010,30(6):198−201. [7] 黄琼, 杨杏芬, 李文立, 等. 大豆异黄酮抗大鼠T细胞衰老及抗氧化作用研究[J]. 中国食品卫生杂志,2005,17(5):407−411. doi: 10.3969/j.issn.1004-8456.2005.05.007 [8] 彭亮, 覃光球. 纳豆的特异性保健功效因子研究进展[J]. 中国食物与营养,2013,19(10):65−69. doi: 10.3969/j.issn.1006-9577.2013.06.016 [9] Hyun J, Shin S Y, So K M, et al. Isoflavones inhibit the clonogenicity of human colon cancer cells[J]. Bioorganic & Medicinal Chemistry Letters,2012,22:2664−2669.
[10] Mishra P, Kar A, Kale R K. Prevention of chemically induced mammary tumorigenesis by daidzein in pre-pubertal rats: The role of peroxidative damage and antioxidative enzymes[J]. Molecular & Cellular Biochemistry,2009,325:149−157.
[11] Wu A H, Yu M C, Tseng C-C, et al. Epidemiology of soy exposures and breast cancer risk[J]. British Journal of Cancer,2008,98:9−14.
[12] Liu X X, Li S H, Chen J Z, et al. Effect of soy isoflavones on blood pressure: A meta-analysis of randomized controlled trials[J]. Nutrition Metabolism & Cardiovascular Diseases,2011,22:463−470.
[13] 刘璐璐, 王洲婷, 丁传波, 等. 加工方法对毛豆中大豆异黄酮苷元含量的影响及其对糖尿病小鼠的降血糖降血脂活性研究[J]. 天然产物研究与开发,2014,26(10):1659−1663. [14] 孙瑞红, 李琨, 滕文丽, 等. 大豆异黄酮对高脂大鼠血脂的影响[J]. 中医药学报,2012,40(6):50−53. doi: 10.3969/j.issn.1002-2392.2012.04.019 [15] 元振华. 纳豆的制作及营养价值[J]. 农业技术与装备,2017(9):8,10. [16] Pekal A, Pyrzynska K. Evaluation of aluminium complexation reaction for flavonoid content assay[J]. Food Analytical Methods,2014,7:1776−1782. doi: 10.1007/s12161-014-9814-x
[17] Zhu H B, Wang Y Z, Liu Y X, et al. Analysis of flavonoids in Portulaca oleracea L. by UV-Vis spectrophotometry with comparative study on different extraction technologies[J]. Food Analytical Methods,2010,3:90−97. doi: 10.1007/s12161-009-9091-2
[18] Granato D, Santos J S, Maciel L G, et al. Chemical perspective and criticism on selected analytical methods used to estimate the total content of phenolic compounds in food matrices[J]. Trends in Analytical Chemistry,2016,80:266−279. doi: 10.1016/j.trac.2016.03.010
[19] Kishawy A T Y, Amer S A, Abd El-Hack M E, et al. The impact of dietary linseed oil and pomegranate peel extract on broiler growth, carcass traits, serum lipid profile, and meat fatty acid, phenol, and flavonoid contents[J]. Asian-Australas Journal of Animal Science,2019,32:1161−1171. doi: 10.5713/ajas.18.0522
[20] Sheih I C, Fang T J, Wu T K, et al. Effects of fermentation on antioxidant properties and phytochemical composition of soy germ[J]. Journal of the Science of Food and Agriculture,2014,94:3163−3170. doi: 10.1002/jsfa.6666
[21] Moktan B, Saha J, Sarkar P K. Antioxidant activities of soybean as affected by Bacillus-fermentation to kinema[J]. Food Research International,2008,41:586−593. doi: 10.1016/j.foodres.2008.04.003
[22] 杜娟, 朱安峰, 宋东明, 等. 高脂饮食诱导的肥胖大鼠肝脏形态学改变及意义[J]. 中华内分泌外科杂志,2019,13(6):463−465. doi: 10.3760/cma.j.issn.1674-6090.2019.06.005 [23] 吕乃达, 贾晓梅. 脾脏生理功能的中西医比较及认识[J]. 中国中医药现代远程教育,2009,7(3):5. doi: 10.3969/j.issn.1672-2779.2009.10.004 [24] Aloud A A, Chinnadurai V, Govindasamy C, et al. Galangin, a dietary flavonoid, ameliorates hyperglycaemia and lipid abnormalities in rats with streptozotocin-induced hyperglycaemia[J]. Pharmaceutical Biology,2018,56:302−308. doi: 10.1080/13880209.2018.1474931
[25] 王斯阳. 肺炎克雷伯杆菌感染小鼠白细胞IL-10及其mRNA的变化[D]. 沈阳:中国医科大学, 2012. [26] Prahalathan P, Saravanakumar M, Raja B. The flavonoid morin restores blood pressure and lipid metabolism in DOCA-salt hypertensive rats[J]. Redox Report,2012,17:167−175. doi: 10.1179/1351000212Y.0000000015
[27] Ma Q Q, Cui Y L, Xu S Y, et al. Synergistic inhibitory effects of acacetin and 11 other flavonoids isolated from Artemisia sacrorum on lipid accumulation in 3T3-L1 cells[J]. Journal of Agricultural and Food Chemistry,2018,66:12931−12940. doi: 10.1021/acs.jafc.8b04683





 下载:
下载:


 下载:
下载:
