Optimization of Extraction Process of Flavonoids from Fagopyrum esculentum Moench Leaves and Its Antioxidant Properties
-
摘要: 为了对荞麦叶黄酮的提取和抗氧化性进行研究,采用响应面法对超声波法辅助提取荞麦叶黄酮的工艺进行了优化,高效液相色谱(HPLC)法分析了荞麦叶黄酮成分,并对荞麦叶黄酮的抗氧化性进行了测定。结果表明:当超声频率45 kHz、超声功率100 W、液料比30:1 mL:g、超声时间22 min,超声温度为28 ℃,乙醇体积分数为51%时,荞麦叶黄酮的提取量为80.311 mg/g,与预测值81.414 mg/g相对误差为1.35%,表明该模型预测值与实际值拟合效果良好。HPLC检测表明,荞麦叶黄酮的主要成分为芦丁和槲皮素,其含量分别为66.5%和13.9%。抗氧化试验表明,荞麦叶黄酮对DPPH自由基(DPPH·)、ABTS自由基(ABTS+·)和羟基自由基(·OH)的半清除浓度(IC50)分别为0.012、0.044、0.344 mg/mL,表明其具有较强的抗氧化能力。本试验为荞麦叶的综合利用提供了理论依据。Abstract: In order to study the extraction process and antioxidant properties of flavonoid in Fagopyrum esculentum Moench leaves. The ultrasonic-assisted extraction process of flavonoids from Fagopyrum esculentum Moench leaves was optimized by response surface method, the contents of flavonoids was analyzed by high performance liquid chromatography (HPLC), and the antioxidant activity was explored.The results showed that when the ultrasonic frequency was 45 kHz, the ultrasonic power was 100 W, the liquid -solid ratio was 30:1(mL:g), the ultrasonic time was 22 min, the ultrasonic temperature was 28 ℃, and the volume fraction of ethanol was 51%, the yield of flavonoids in Fagopyrum esculentum Moench leaves was 80.311mg/g. The relative error was 1.35% compared with the predicted value of 81.414 mg/g, which proved that the theoretical predicted value of the model well fitted with the actual value. The result of HPLC showed that rutin and quercetin were the main components of flavonoid in Fagopyrum esculentum Moench leaves, and their contents were 66.5% and 13.9%, respectively. The antioxidant activity test showed that the half maximal inhibitory concentration (IC50) of the flavonoids to DPPH·, ABTS+· and ·OH was 0.012, 0.044, 0.344 mg/mL, respectively, indicated that the flavonoids had strong antioxidant capacity. This experiment provided a theoretical basis for the comprehensive utilization of Fagopyrum esculentum Moench leaves.
-
荞麦(Fagopyrum esculentum Moench
)又名乌麦、三角麦,即通俗意义上的甜荞麦,属廖科廖属双子叶一年生草本植物[1],性喜冷凉,耐贫瘠,我国是荞麦的原产地之一,种植面积达到70万公顷,产量多年位居世界第二位[2]。因荞麦籽粒含有黄酮、维生素、甾醇等[3-5]活性物质而具有抗菌消炎、降血糖、预防心脑血管疾病等功效[6-8]。但是荞麦低产,广种薄收,籽粒亩产不到100 kg,精耕细作产量也仅为200 kg,种植收益较低,影响了农民的种植积极性。而据报道,荞麦叶片含有诸如黄酮类等的生物活性物质,并且荞麦叶中的黄酮含量远高于荞麦籽粒[9-10],然而目前荞麦叶却没有得到充分的利用,除少量用作饲料外,其余的大多丢弃,造成资源浪费。 目前,从植物中提取黄酮的研究报道较多,孙艳等[11]对从酸枣叶中提取的黄酮进行了研究,王树宁等[12]优化了从侧柏叶提取黄酮的工艺,Wang等[13]对不同干燥方式下洋葱黄酮的提取量和性质做了研究,Wang等[14]对桑叶黄酮提取及抗氧化性进行了系统研究,Li等[15]则对番石榴叶黄酮水提法进行了优化,徐树来等[16]则用超声波法和微波法对蒲公英黄酮的提取工艺进行了优化;自诸多文献可以看出,不同植物黄酮的性质和提取方式都有不同,甚至同一种植物的产地、采收期以及取样部位都会影响到黄酮的提取量和性质,然而目前从荞麦叶提取黄酮报道却较少,荞麦叶黄酮的抗氧化性尚未有报道,为了充分利用荞麦叶这一资源,有必要对从其中提取黄酮进行研究,并对其抗氧化性能做分析,从而为更好地利用这一资源提供理论依据。
本研究以分枝期的荞麦叶为研究对象,用超声波乙醇提取法提取黄酮,以黄酮得率为目标,在单因素实验基础上,对影响黄酮提取效果较大的因素超声时间、超声温度以及提取溶剂乙醇体积分数进行响应面优化,建立二项式回归模型,并对试验数据进行拟合分析,得到最佳提取条件,利用HPLC法检测荞麦叶黄酮的组分,并对荞麦叶黄酮清除DPPH·、ABTS+·和·OH的能力进行测定,以期为荞麦叶的综合利用提供必要的理论支持。
1. 材料和方法
1.1 材料与仪器
供试的荞麦叶片 采自山东省淄博市本地农户,种植的土地为沙壤土,种植土地没有施用化肥与农家肥,属于接近野生状态的广种薄收种植类型,采样时期为分枝期的成熟叶片;芦丁标准品、槲皮素标准品(生物制品,BR,纯度≥98%)、1,1-二苯基-2-苦基肼(DPPH,BR,纯度≥96%)、2,2-连氮基-双-(3-乙基苯并二氢噻唑啉-6-磺酸)二铵盐(ABTS,BR,纯度≥98%)、D101大孔吸附树脂(BR,30~60目) 上海源叶生物制品有限公司;乙腈、甲酸(色谱纯) 北京迪科马科有限公司;其它试剂 均为分析纯。
KQVDE-100型三频数控超声波仪 昆山市超声有限公司;V-2550型双光束紫外分光光度计 日本岛津;FD-1A-50型真空冷冻干燥机 北京博医康实验仪器有限公司;Waters 2695高效液相色谱仪,配有Waters 2489UV/vis 紫外检测器 美国Waters公司;TGL-20M型高速冷冻离心机 湖南湘仪离心机有限公司;RE-52C型旋转蒸发器 上海青浦沪西仪器厂;FW80型高速万能粉碎机 天津泰斯特仪器有限公司;THE-98A 型恒温振荡培养箱、HWS-26型电热恒温水浴锅 上海一恒科技有限公司。
1.2 实验方法
1.2.1 荞麦叶粉的制备
荞麦叶采收后,−40 ℃冷冻3 d,然后放置于−40 ℃低温冷冻干燥机干燥24 h,干燥完全后样品用高速万能粉碎机(10000 r/min)瞬时粉碎成粉末,干燥器内保存备用。
1.2.2 荞麦叶黄酮的提取
准确称取一定量的荞麦叶粉,加入一定量的乙醇提取液,4 ℃浸提20 min后,在超声频率45 kHz、功率100 W条件下,超声20 min,然后10000 r/min冷冻离心10 min(4 ℃),上清液用70%乙醇溶液定容到50 mL,棕色细口瓶4 ℃保存备用。
1.2.3 单因素实验
在液料比60:1、乙醇体积分数70%、超声功率100 W、室温(25 ℃)、超声时间20 min条件下,设定超声频率分别45、80、100 kHz,按照1.2.5方法测定不同超声频率下荞麦叶黄酮的提取量;在超声频率45 kHz、功率100 W、乙醇体积分数70%、室温(25 ℃)、超声时间20 min条件下,加入料液比分别为10:1、20:1、30:1、40:1、50:1、60:1、70:1(mL:g)的乙醇水溶液,按照1.2.5方法测定不同液料比下样品黄酮的提取量;在超声频率45 kHz、功率100 W、液料比60:1、室温(25 ℃)、超声时间20 min条件下,加入体积分数分别为0、20%、30%、40%、50%、60%、70%、95%的乙醇提取液,按照1.2.5方法测定不同乙醇体积分数下样品黄酮的提取量;在超声频率45 kHz、功率100 W、液料比60:1、乙醇体积分数70%、超声时间20 min条件下,超声温度分别设定为20、30、40、50、60、70 ℃,按照1.2.5 方法测定不同超声温度下样品黄酮的提取量;在超声频率45 kHz、功率100 W、液料比60:1、乙醇体积分数70%、室温(25 ℃)条件下,设定超声时间分别为5、10、20、30、40、50、60 min,按照1.2.5方法测定不同超声时间下样品黄酮的提取量。
1.2.4 响应面法试验
根据单因素实验结果,选取对荞麦叶黄酮提取影响较大的三个因素:超声温度、超声时间、提取液乙醇体积分数为Box -Behnken设计的自变量,以黄酮提取量为响应值,通过响应面分析对提取条件进行优化。试验因素及水平设计如表1所示。
表 1 响应面试验因素水平表Table 1. Factors and levels table of response surface experiment水平 因素 A超声时间(min) B乙醇体积分数(%) C超声温度(℃) −1 15 45 25 0 20 50 30 1 25 55 35 1.2.5 荞麦叶总黄酮提取量的测定
总黄酮的测定采用魏永生的硝酸铝-亚硝酸钠法[17]测定。准确称取0.0185 g芦丁标准品,用70%的乙醇溶液溶解并定容到100 mL,得浓度为0.185 mg/mL芦丁标准溶液,在510 nm下按照文献方法[17]测定各处理的吸光度值。以芦丁浓度(mg/mL)为横坐标,以吸光度为纵坐标,做标准曲线,得到回归方程为:y=9.4969x+0.0002(R2=0.999),在浓度0.0037~0.0555 mg/mL范围内线性关系良好。
取0.5 mL荞麦叶提取液按照同样方法测定样品总黄酮浓度。荞麦叶黄酮提取量(以芦丁计)按照以下公式计算:
式中:C为测试液黄酮浓度,mg/mL;V为测试液总体积,mL;V0 为提取液总体积,mL;m为样品质量,g;V1为提取液取样体积,mL。
1.2.6 液相色谱法分析荞麦叶黄酮组分
荞麦叶黄酮提取物在进行液相色谱分析之前要进行大孔树脂纯化,方法为:将活化并纯化好的D101大孔树脂放置到干净的锥形瓶中,加入荞麦叶黄酮提取液并置于恒温振荡培养箱中振荡吸附24 h,频率为80 r/min,温度为25 ℃,结束后用50%的乙醇溶液进行解析12 h,之后将解析液置于旋转蒸发器中浓缩,并将浓缩液置于−40 ℃冷冻干燥机干燥24 h,得到干燥的荞麦叶黄酮样品[14]。在进行液相色谱测定之前,样品用50%的乙醇溶解并通过0.22 μm的微孔过滤膜过滤。色谱条件参考文献[15]的方法并稍作调整,具体为:Waters 2489UV/Vis 检测器,Kromasil 100-5 C18(250 mm×4.6 mm, 5 μm)色谱柱,温度30 ℃,波长254 nm,流动相:0.3 %的甲酸水溶液(A),乙腈(B),洗脱梯度为:0~5 min,10%~25%B,5~10 min ,25%~30%B,10~15 min, 30%~20%B,流速为1 mL/min,进样量为10 μL,保留时间为15 min。
1.2.7 荞麦叶黄酮抗氧化能力
清除DPPH·测定采用文献[18]方法,清除ABTS+·的测定采用Re 等[19]的方法,清除·OH方法采用邻二氮菲法[20-21]。实验时配制抗坏血酸溶液用做对照,并计算半抑制浓度(IC50)。
1.3 数据处理
所有实验重复三次,实验数据取均值;采用SPASS 19.0进行差异性分析,Origin 8.5作图,Design Expert 8.0.6 做响应面设计并进行相关分析。
2. 结果与分析
2.1 单因素实验结果
2.1.1 超声频率对荞麦叶黄酮提取的影响
超声频率对荞麦叶黄酮的提取有影响。由于实验室条件限制,本次实验只设定了45、80和100 kHz三个频率,结果显示三个频率对应的荞麦叶黄酮提取量分别为74.19、60.96、和47.41 mg/g;此结果说明超声频率越高,黄酮提取量越低。在超声波法提取银杏黄酮研究中发现,低频超声波较高频超声波更有利于有效成分的析出,20 kHz比40 kHz的黄酮提取量要高[22],这跟本研究结论相似,这是因为高频情况下,不利于液体的空化效应,所以不利于黄酮的析出[22]。然而徐艳丽等[23]报道,超声频率为70 kHz时的苦参种子黄酮的提取量要远高于50、60 kHz的提取量,产生这种差异或许是因为样品本身性质不同造成。鉴于实验室的超声波仪仅具有三个频率波段,所以在后期的优化实验中未能将此因素作为优化因素,后续实验都采用45 kHz。
2.1.2 超声时间对荞麦叶黄酮提取的影响
从(图1A)中可以看出,随着超声时间的增长,黄酮提取量增加,在超声20 min时黄酮提取量较高,此后即使继续增大提取时间,提取量变化不大,说明物料中的黄酮基本已经溶解出来,再增加时间作用不大,所以提取时间设定为20 min较好。
2.1.3 液料比对荞麦叶黄酮提取的影响
不同液料比对荞麦叶粉黄酮提取影响如图1B所示,随着液料比的增加,黄酮提取量增加,当液料比超30:1之后,提取量虽有增大,但是增加量无显著性差异( P>0.05);而在料液比增大到50:1后,黄酮提取量出现降低趋势,这是因为随着料液比的增加,样品中的一些其它醇溶性物质的溶解速度增大,从而抑制了黄酮的溶出[24]。因此选定液料比为30:1。
2.1.4 乙醇体积分数对荞麦叶黄酮提取的影响
提取液乙醇体积分数对荞麦叶黄酮提取有一定作用(图1C)。在乙醇体积分数较低时,随着乙醇体积分数的增加,黄酮提取量增大,当乙醇体积分数增大到60%时,黄酮提取量达到最大,其后随着乙醇体积分数的增加,黄酮提取量逐渐降低,95%时的黄酮提取量比60%降低近一半,这是因为在乙醇体积分数增大后,叶绿素、脂类等非极性物质溶出的比率增大,降低了黄酮的溶解所致[25]。虽然在乙醇体积分数为60%时的提取量最高,但是跟50%时没有显著性差异(P>0.05),从能耗和成本方面考虑,选择乙醇体积分数为50%。
2.1.5 超声温度对荞麦叶黄酮提取的影响
温度对荞麦叶黄酮提取有影响(图1D)。低温有抑制黄酮溶出的作用,当温度升到30 ℃时,提取量显著增加(P<0.05),但此后随着温度升高,提取量逐渐降低,温度达到70 ℃时,提取量比30 ℃时降低近一半,这是因为黄酮含有羟基,温度过高会影响其稳定性,黄酮被氧化破坏[26]。因此选定超声温度为30 ℃。
2.2 响应面试验
2.2.1 模型拟合分析
通过三因素三水平的响应面设计方法设计,试验结果如表2所示,对所得试验数据进行方差分析,结果如表3所示,用Design Expert 8.0.6软件对试验结果回归拟合,得到荞麦叶总黄酮提取量对超声时间(A)、乙醇体积分数(B)以及超声温度(C)的二次多项回归方程为:
表 2 响应面试验设计及结果Table 2. Design and results of response surface experiment试验号 A超声时间
(min)B提取剂乙醇
体积分数(%)C超声温度
(℃)黄酮提取量
(mg/g)1 0 0 0 80.79 2 0 0 0 80.68 3 1 1 0 79.15 4 −1 −1 0 72.54 5 −1 0 −1 72.01 6 −1 0 1 71.67 7 −1 1 0 74.92 8 0 0 0 80.12 9 1 0 −1 78.85 10 0 −1 −1 76.97 11 1 −1 0 76.27 12 0 1 1 74.71 13 1 0 1 72.67 14 0 −1 1 74.23 15 0 1 −1 77.99 16 0 0 0 80.84 17 0 0 0 80.96 表 3 二次响应面回归模型方差分析及显著性检验结果Table 3. ANOVA for quadratic response surface model and significance of difference差异来源 平方和 自由度 均方 F值 P值 显著性 模型 183.81 9 20.42 64.11 <0.0001 ** A 31.21 1 31.21 97.96 <0.0001 ** B 5.71 1 5.71 17.93 0.0039 ** C 19.66 1 19.66 61.70 0.0001 ** AB 0.063 1 0.063 0.20 0.6712 AC 8.53 1 8.53 26.77 0.0013 ** BC 0.073 1 0.073 0.23 0.6470 A2 53.56 1 53.56 168.12 <0.0001 ** B2 8.15 1 8.15 25.59 0.0015 ** C2 46.17 1 46.17 144.94 <0.0001 ** 残差 2.23 7 0.32 失拟项 1.80 3 0.60 5.59 0.0650 误差项 0.43 4 0.11 总离差 186.04 16 R2=0.988 R2Adj=0.9726 R2Pred=0.8416 精密度=20.7 CV(%)=0.74 注:**:差异极显著(P<0.01);*:差异显著(P<0.05)。 Y=80.68+1.98A+0.85B−1.57C+0.12AB−1.46AC−0.14BC−3.57A2−1.39B2−3.31C2
由表3可以得知,模型的F值为64.11,P<0.0001,说明模型极显著;失拟项P=0.065,影响不显著,说明非试验因素对试验结果影响不大;回归模型的决定系数R2=0.988,说明试验中98.8%的数据是合理的;预测系数R2Pred=0.8416 和调整决定系数R2Adj=0.9726的差值小于0.2,说明模型其具有合理的一致性;变异系数0.74%小于1%,说明模型外因素对试验结果影响较小,该模型可以用于拟合分析;精密度值20.7大于4,说明此模型具有合理性,可以用于荞麦叶黄酮提取产量的预测[27]。
从表3可以看出,提取时间、乙醇体积分数和提取温度都对荞麦叶黄酮提取量的影响具有极显著性(P<0.01),其影响的主次顺序为A(超声时间)>C(超声温度)>B(乙醇体积分数)。
2.2.2 交互作用分析
由表3可以看出,A(超声时间)和C(超声温度)交互作用有极显著性影响(P<0.01),而 A(超声时间)和 B(乙醇体积分数)、B(乙醇体积分数)和 C(超声温度)交互作用无显著性影响(P>0.05)。利用回归模型作各因素之间的响应面图和等高线如图2所示。
不同因素之间交互作用对模型影响从等高线的形状上能得到直观反映,等高线呈现椭圆形显示出两因素交互作用显著,反之形状为圆形则说明交互作用不显著。由图2可以看出,超声时间和超声温度交互作用呈现显著性,而超声温度和乙醇体积分数、超声时间和乙醇体积分数交互作用无显著差异性,这与表3的结论相一致。
2.2.3 试验验证
根据响应面模型和结果分析,得到荞麦叶黄酮最佳提取条件为:超声时间21.743 min,提取液乙醇体积分数为51.673%,超声温度为28.40 ℃,此条件下荞麦叶粉黄酮提取量为81.414 mg/g,根据实验室实际情况,对验证试验条件调整为:超声时间22 min,提取液乙醇体积分数为51%,超声温度为28 ℃。进行三次验证试验,黄酮的提取量均值为80.311 mg/g,与预测值81.414 mg/g接近,相对误差为1.35%,说明该模型可以用于拟合分析。据孙艳华等[28]报道,其在用乙醇预处理常规方法提取荞麦茎叶黄酮时候,需要先将粉碎后的样品用15倍的30%乙醇浸泡6 h,之后再用15倍的95%的乙醇70 ℃下恒温浸提1 h,得出荞麦叶中约含有黄酮5.1%的黄酮,而本实验的提取时间要比已有的报道更短,乙醇浓度低,提取温度低;且荞麦叶黄酮提取量为81.414 mg/g,明显高于已有的报道,这表明响应面法优化可以用于荞麦叶黄酮提取实验。
2.3 HPLC 图谱分析
荞麦叶黄酮HPLC分析图谱如图3所示,从图3中可以看出,荞麦叶黄酮的主要成分是芦丁和槲皮素,根据峰面积积分得到其相对含量分别为66.5%和13.9%,出峰时间分别为6.13和8.05 min,跟标准样品出样时间基本吻合,还有3个含量很少的组分,分别为图3样品图中的3、4、5号峰,出峰时间分别为4.73、7.18和11.2 min,因含量太低,未做具体组分和含量分析。
2.4 荞麦叶黄酮体外抗氧化能力
2.4.1 荞麦叶黄酮清除DPPH·能力
由图4A可知,荞麦叶黄酮具有清除DPPH·的能力。在浓度为0~0.020 mg/mL之间,荞麦叶黄酮和VC对DPPH·清除率呈线性增加,在浓度为0.025 mg/mL时,清除率已达98.29%,而VC在浓度为0.020 mg/mL时清除率已达100%,说明荞麦叶黄酮的的清除能力弱于VC;在浓度0~0.016 mg/mL之间,荞麦叶黄酮浓度(X)与清除率(Y)的回归方程为y=3486x+7.383,R2=0.9984,VC浓度(X)与清除率(Y)的回归方程为y=5647x+2.806,R2=0.9972。荞麦叶黄酮和VC对DPPH·清除作用的IC50分别为0.012 和0.008 mg/mL。
2.4.2 荞麦叶黄酮清除ABTS+·能力
荞麦叶黄酮对ABTS+·自由基清除有明显作用(图4B)。在浓度0~0.080 mg/mL之间,荞麦叶黄酮和VC对ABTS+·的清除能力都呈线性增加,当浓度为0.080 mg/mL时,二者的清除率都达到了96%之上,说明反应体系中的自由基已经基本被清除。在浓度0~0.080 mg/mL之间,荞麦叶黄酮浓度(X)和清除率(Y)的回归方程为y=1306.5x−8.0193,R2=0.9949,VC浓度(X)与清除率(Y)回归方程为Y=1200.4x+3.7953,R2=0.9909;荞麦叶黄酮和VC对ABTS+·清除作用的IC50分别为0.044和0.039 mg/mL。
2.4.3 荞麦叶黄酮清除·OH的能力
由图4C可知,荞麦叶黄酮对·OH清除作用明显高于VC。荞麦叶黄酮浓度在0~0.8 mg/mL范围内,对·OH的清除能力呈线性增加趋势,而VC在浓度低于0.5 mg/mL时,其清除率无法检测到;在荞麦叶黄酮浓度0~0.8 mg/mL之间,黄酮浓度(X)和清除率(Y)回归方程为y=119.37x+8.9517,R2=0.9727;在VC浓度为0.5~4 mg/mL 之间时,VC浓度(X)和清除率(Y)回归方程为y=25.142x−11.113,R2=0.9835;荞麦叶黄酮和VC对·OH清除能力IC50分别为0.344 和2.431 mg/mL。荞麦叶黄酮清除·OH高于VC的能力,这跟单科开等[29]对苦菜黄酮的研究结论相似。
3. 结论
在单因素实验基础上,通过响应面试验得到荞麦叶黄酮的最佳提取工艺条件为:超声时间22 min,提取液乙醇体积分数51%,超声温度28 ℃,在此条件下荞麦叶黄酮的提取量为80.311 mg/g,与预测值理论值接近;HPLC检测显示荞麦叶黄酮以芦丁为主,其次是槲皮素;荞麦叶黄酮抗氧化性实验显示,荞麦叶黄酮对DPPH·、ABTS+·和·OH都有清除作用,显示其具有较好的抗氧化性。本实验显示荞麦叶可以作为黄酮提取的原料来源,从而为荞麦叶的综合利用提供了必要的理论依据。
-
表 1 响应面试验因素水平表
Table 1 Factors and levels table of response surface experiment
水平 因素 A超声时间(min) B乙醇体积分数(%) C超声温度(℃) −1 15 45 25 0 20 50 30 1 25 55 35 表 2 响应面试验设计及结果
Table 2 Design and results of response surface experiment
试验号 A超声时间
(min)B提取剂乙醇
体积分数(%)C超声温度
(℃)黄酮提取量
(mg/g)1 0 0 0 80.79 2 0 0 0 80.68 3 1 1 0 79.15 4 −1 −1 0 72.54 5 −1 0 −1 72.01 6 −1 0 1 71.67 7 −1 1 0 74.92 8 0 0 0 80.12 9 1 0 −1 78.85 10 0 −1 −1 76.97 11 1 −1 0 76.27 12 0 1 1 74.71 13 1 0 1 72.67 14 0 −1 1 74.23 15 0 1 −1 77.99 16 0 0 0 80.84 17 0 0 0 80.96 表 3 二次响应面回归模型方差分析及显著性检验结果
Table 3 ANOVA for quadratic response surface model and significance of difference
差异来源 平方和 自由度 均方 F值 P值 显著性 模型 183.81 9 20.42 64.11 <0.0001 ** A 31.21 1 31.21 97.96 <0.0001 ** B 5.71 1 5.71 17.93 0.0039 ** C 19.66 1 19.66 61.70 0.0001 ** AB 0.063 1 0.063 0.20 0.6712 AC 8.53 1 8.53 26.77 0.0013 ** BC 0.073 1 0.073 0.23 0.6470 A2 53.56 1 53.56 168.12 <0.0001 ** B2 8.15 1 8.15 25.59 0.0015 ** C2 46.17 1 46.17 144.94 <0.0001 ** 残差 2.23 7 0.32 失拟项 1.80 3 0.60 5.59 0.0650 误差项 0.43 4 0.11 总离差 186.04 16 R2=0.988 R2Adj=0.9726 R2Pred=0.8416 精密度=20.7 CV(%)=0.74 注:**:差异极显著(P<0.01);*:差异显著(P<0.05)。 -
[1] 唐宇, 邵继荣, 周美亮. 中国荞麦属植物分类学的修订[J]. 植物遗传资源学报,2019,20(3):646−653. [2] 宋越冬, 王明超, 韩晓静, 等. 超声辅助提取荞麦叶绿原酸及体外降糖活性研究[J]. 食品科技,2020,45(7):242−249. [3] Lan-Sook Lee, Eun-Ji Choi, Chang-Hee, et al. Contribution of flavonoids to the antioxidant properties of common and tartary buckwheat[J]. Journal of Cereal Science,2016,68(3):181−186.
[4] 章洁琼, 邹军, 卢扬, 等. 不同荞麦品种主要功能成分分析及评价[J]. 种子,2020,39(2):107−112, 117. [5] Zhang W N, Zhu Y Y, Liu Q Q, et al. Identification and quantification of polyphenols in hull, bran and endosperm of common buckwheat (Fagopyrum esculentum) seeds[J]. Journal of Functional Foods,2017,38(11):363−369.
[6] Tomotake H, Kayashita J, Kato N. Hypolipidemic activity of common (Fagopyum esculentum Moench) and tartary (Fagopyum esculentum Gaertn.) buckwheat[J]. Jonrnal of the Science of Food & Agriculture,2015,95(10):1963−1967.
[7] 林红梅, 韩淑英, 栾新段, 等. 甜荞麦种子提取物镇痛抗炎作用的实验研究[J]. 华北煤炭医学院学报,2003(3):290−291. [8] Nguyen Ngoc Thanh Tien, Le Ngoc Dang Trinh, Naoto Inoue, et al. Nutritional composition, bioactive compounds, and diabetic enzyme inhibition capacity of three varieties of buckwheat in Japan[J]. Cereal Chemistry,2018,95(5):615−624. doi: 10.1002/cche.10069
[9] Mariotti M, Andreuccetti V, Nuvoloni R, et al. Rutin and quercetin content in the forage of common buckwheat as affected by maturity and conservation method[J]. Grassland Science,2017,63(3):169−176. doi: 10.1111/grs.12160
[10] 符献琼, 张慧, 李承业, 等. 荞麦叶的营养成分及其营养特性[J]. 新疆农业科学,1994(3):105−108. [11] 孙艳, 崔旭盛, 刘静, 等. 酸枣叶黄酮的提取工艺优化及其抗秀丽隐杆线虫氧化损伤活性[J]. 食品工业科技,2020,41(8):143−150. [12] 王树宁, 宋照军, 黄滢洁, 等. 响应面法优化超声波辅助提取侧柏叶总黄酮工艺[J]. 食品研究与开发,2020,41(9):88−93. doi: 10.12161/j.issn.1005-6521.2020.09.014 [13] Wang Y Y, Duan X, Ren G Y, et al. Comparative study on the flavonoids extraction rate and antioxidant activity of onions treated by three different drying methods[J]. Drying Technology,2018,24(11):245−252.
[14] Wang Y Q, Gao Y J, Ding H, et al. Subcritical ethanol extraction of flavonoids from Moringa oleifera leaf and evaluation of antioxidant activity[J]. Food Chemistry,2017,218:152−158. doi: 10.1016/j.foodchem.2016.09.058
[15] Li J K, Wu C C, Li F, et al. Optimization of ultrasound-assisted water extraction of flavonoids from Psidium guajava leaves by response surface analysis[J]. Preparative Biochemistry and Biotechnology,2019,49(1):21−29. doi: 10.1080/10826068.2018.1466158
[16] 徐树来, 王丽, 任红波, 等. 蒲公英黄酮的提取工艺优化及主要成分浅析[J]. 食品工业科技,2020,41(19):172−178. [17] 魏永生, 王永宁, 石玉平, 等. 分光光度法测定总黄酮含量的实验条件研究[J]. 青海大学学报(自然科学版),2003,21(3):61−63. doi: 10.3969/j.issn.1006-8996.2003.03.019 [18] Song H F,Zhang Q B, Zhang A S, et al. In vitro antioxidant activity of polysaccharides extracted from Bryopsis plumosa[J]. Carbohydrate Polymers,2010,80(4):1057−1061. doi: 10.1016/j.carbpol.2010.01.024
[19] ] Re R, Pellegrini N, Proteggente A, et al. Antioxidant activity applying an improved ABTS radical cation decolorization assay[J]. Free Radical Biology and Medicine,1999,26(9):1231−1237.
[20] 董迪迪, 王鸿飞, 周增群, 等. 杨梅籽油抗氧化活性及其调节血脂作用的研究[J]. 中国粮油学报,2014,29(5):53−57. [21] Mukhopadhyay D, Dasgupta P, Roy D S, et al. A sensitive in vitro spectrophotometric hydrogen peroxide scavenging assay using 1, 10-phenanthroline[J]. Free Radicals and Antioxidants,2016,6(1):124−132. doi: 10.5530/fra.2016.1.15
[22] 宋伟. 银杏叶超声萃取机制及提取条件的研究[D]. 哈尔滨: 哈尔滨工业大学, 2009. [23] 徐艳丽, 赵文英, 孙彦妮, 等. 响应面优化苦参种子黄酮超声提取工艺[J]. 粮食与油脂,2019,32(2):87−90. doi: 10.3969/j.issn.1008-9578.2019.02.025 [24] 陈建福. 响应面优化黄槿叶总黄酮提取工艺及其抗氧化活性[J]. 食品研究与开发,2019,40(14):85−91. [25] 禄璐, 米佳, 罗青, 等. 枸杞总黄酮提取工艺优化及其体外抗氧化活性分析[J]. 食品工业科技,2019,40(24):165−171. [26] 秦晶晶, 钱慧琴, 赵媛, 等. 柿叶总黄酮提取工艺优化及其抗氧化活性[J]. 食品工业科技,2020,41(13):32−38, 45. [27] 田明杰, 谭宏渊, 叶帆宇, 等. 福白菊总黄酮的微波辅助提取工艺优化及其抗氧化活性研究[J]. 中国酿造,2020,39(1):170−174. doi: 10.11882/j.issn.0254-5071.2020.01.033 [28] 孙艳华, 刘永彬. 乙醇预处理法提取荞麦茎叶中黄酮类化合物的研究[J]. 天津医科大学学报,2006(3):375−377, 387. doi: 10.3969/j.issn.1006-8147.2006.03.005 [29] 单科开, 王鸿飞, 许凤, 等. 苦菜总黄酮超声波辅助提取及抗氧化能力研究[J]. 核农学报,2019,33(9):1755−1764. doi: 10.11869/j.issn.100-8551.2019.09.1755





 下载:
下载:
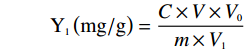




 下载:
下载:
